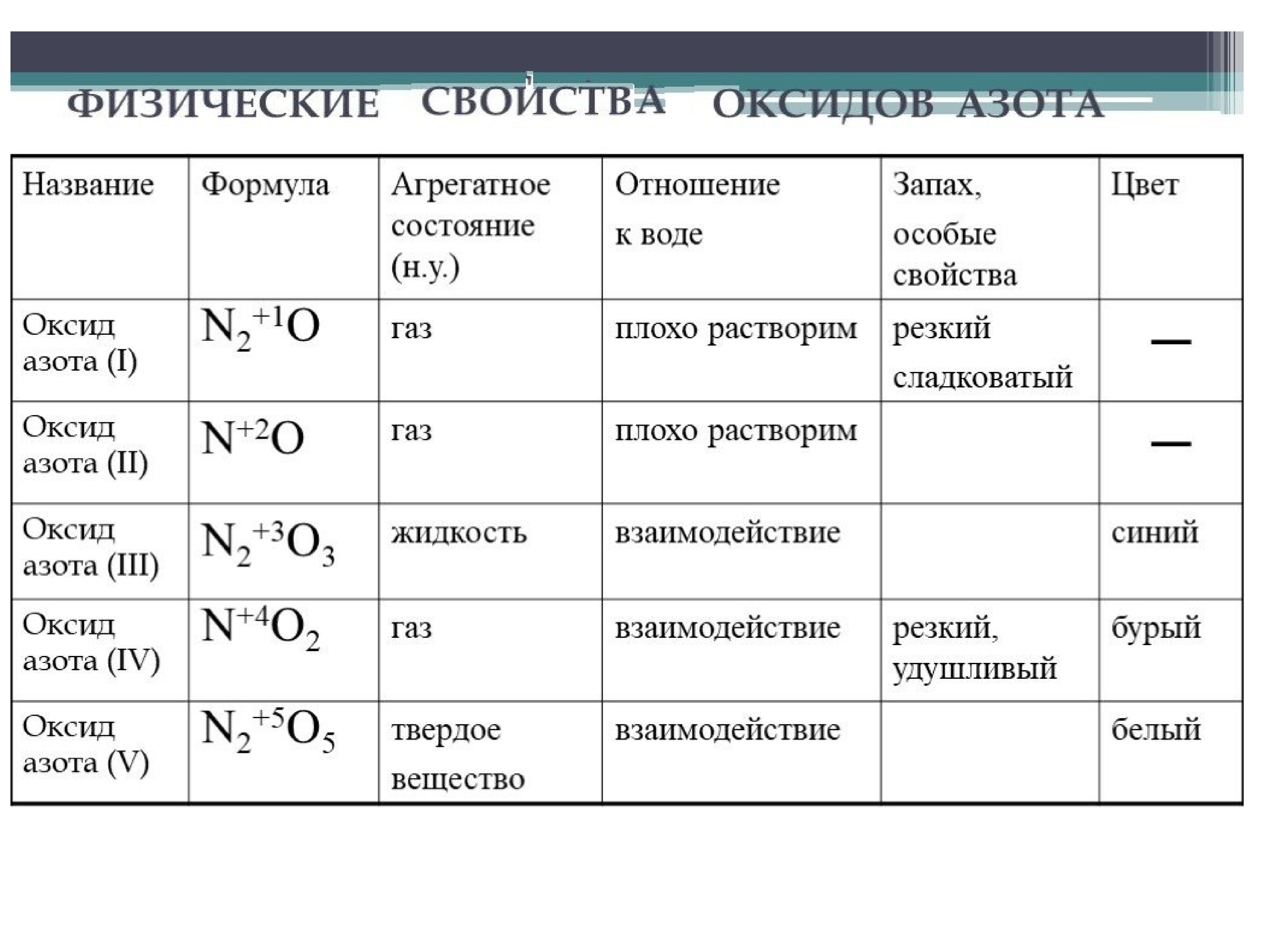
- В кислородных соединениях азот проявляет степень окисления от +1 до +5.
- N2O ; NO ; N2O3 ; NO2 ; N2O4 ; N2O5
- Оксиды N2O и NO – несолеобразующие, остальные солеобразующие.
- Оксид азота (I) и оксид азота (II) – бесцветные газы, оксид азота (III) – синяя жидкость, (IV) – бурый газ, (V) – прозрачные бесцветные кристаллы.
Кроме N2O, все они чрезвычайно ядовиты.
Закись азота N2O обладает весьма своеобразным физиологическим действием, за которые ее часто называют веселящим газом.
Вот как описывают действия закиси азота английский химик Хэмфри Дэви, который с помощью этого газа устраивал специальные сеансы: «Одни джентльмены прыгали по столам и стульям, у других развязывались языки, третьи обнаружили чрезвычайную склонность к потасовке». Вдыхание N2O вызывает потерю болевых ощущений и поэтому применяется в медицине как анестезирующее средство.

- Метод валентных связей (МВС) предполагает в молекулеN2O наличие ионов N+ и N–
- sp-гибридизация
- +N
- –N
- O
За счет sp-гибридизации ион N+ дает 2σ связи: одну с N– и другую с атомом кислорода. Эти связи направлены под углом 180º друг к другу и молекула N2O линейна. Структуру молекулы определяет направленность σ связей. Оставшиеся у N+ два p-электрона образуют еще по одной π-связи: одну с ионом N– и другую с атомом кислорода. Отсюда N2O имеет строение
- σ σ
- : N– = N+ = O :
- · · · ·
Склонность NO2 к димеризации – следствие нечетного числа электронов в молекуле (парамагнитна).
С оксидами азота связаны серьезные экологические проблемы. Увеличение их концентрации в атмосфере приводит к образованию азотной кислоты и соответсвенно кислотных дождей.
- N2O3 взаимодействует с водой, образует неустойчивую азотистую кислоту HNO2, которая существует только в разбавленных растворах, так как легко разлагается
- 2HNO2 = N2O3 + H2O.
- HNO2 может быть более сильным восстановителем, чем HNO3, о чём свидетельствуют значения стандартных электродных потенциалов.
- HNO3 + 2 Н+ + 2е = HNO2 + Н2О Е0 = + 0,93 В
- HNO2 + Н+ + 1е = NO + H2O Е0 = + 1,10 В
- HNO2 + 1e = NO + H+ Е0 = + 1,085 В
Ее соли нитриты – устойчивы. HNO2 – кислота средней силы (К ≈ 5 · 10–4). Наряду с кислотной диссоциацией в незначительной степени идет диссоциация с образованием NO+ и OH–.
Степень окисления азота в нитритах промежуточная (+3), поэтому в реакциях он может вести себя и как окислитель, и как восстановитель, т.е. обладает окислительно-восстановительной двойственностью.
- Сильные окислители переводят NO2– в NO3–.
- 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
- Сильные восстановители обычно восстанавливают HNO2 до NO.
- 2NaNO2 + 2KI + 2H2SO4 = Na2SO4 +2NO + I2 + K2SO4 +2H2O
- Может происходить также процесс диспропорционирования, одновременного увеличения и уменьшения степени окисления атомов одного и того же элемента.
- 3HNO2 = HNO3 + 2NO + H2O
- Нитриты обладают токсичностью: переводят гемоглобин в метгемоглобин, не способный переносить кислород и они служат причиной образования в продуктах питания нитрозааминов R2N–NO – канцерогенных веществ.
Важнейшее соединение азота – HNO3
Азотная кислота – важнейший продукт основной химической промышленности. Идет на приготовление взрывчатых веществ, лекарственных веществ, красителей, пластических масс, искусственных волокон и др. материалов.
HNO3 – бесцветная жидкость с резким удушливым запахом, дымящая на воздухе. В небольших количествах образуется при грозовых разрядах и присутствует в дождевой воде.
- N2 + O2 → 2NO
- 2NO + O2 → 2NO2
- 4NO2 + O2 + 2H2O → 4HNO3
- Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету или при нагревании процесса разложения
- 4HNO3 = 4NO2 + 2H2O + O2
- HNO3 – очень опасное вещество.
- Важнейшее химическое свойство HNO3 состоит в том, что она является сильным окислителем и поэтому взаимодействует почти со всеми металлами кроме Au, Pt, Rh, Ir, Ti, Ta, металлы Al, Fe, Co, Ni и Cr она «пассивирует». Кислота же в зависимости от концентрации и активности металла может восстанавливаться до соединений:
- +4 +3 +2 +1 0 -3 -3
- NO2 → HNO2 → NO → N2O → N2 → NH3 (NH4NO3)
- и также образуется соль азотной кислоты.
Как правило, при взаимодействии азотной кислоты с металлами не происходит выделения водорода. При действии HNO3 на активные металлы может получаться водород. Однако атомарный водород в момент выделения обладает сильными восстановительными свойствами, а азотная кислота – сильный окислитель. Поэтому водород окисляется до воды.
- Свойства концентрированной и разбавленной HNO3
- 1) Действие концентрированной HNO3 на малоактивные металлы (Cu, Hg, Ag)
- Cu + 4 HNO3 = Cu(NO3)2 + 2NO2 ↑ + 2H2O
- 2) Действие разбавленной HNO3 на малоактивные металлы
- 3Cu + 8 HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
- 3) Действие концентрированной кислоты на активные металлы
- 4Ca + 10HNO3 = 4Ca(NO3)2 + N2O↑ + 5H2O
- 4) Действие разбавленной HNO3 на активные металлы
- 4Ca + 10 HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O
Одна из наиболее сильных кислот, характерны все реакции кислот: реагирует с основными оксидами, основаниями, амфотерными оксидами, амфотерными гидроксидами. Специфичное свойство – ярко выраженная окислительная. В зависимости от условий (концентрации, природы восстановителя, температуры)HNO3 может принимать от 1 до 8 электронов.
- Ряд соединений N с различными степенями окисления восстанавливаются до различных продуктов:
- NH3 ; N2H4 ; NH2OH ; N2O ; NO ; N2O3 ; NO2 ; N2O5
- NO3– + 2H+ + 1e = NO2 + H2O
- NO3– + 4H+ + 3e = NO + 2H2O
- 2NO3– +10H+ + 8e = N2O + 5H2O
- 2NO3– +12H+ + 10e = N2 + 6H2O
- NO3– + 10H+ + 8e = NH4– + 3H2O
Образование продуктов зависит от концентрации азотной кислоты. Чем выше концентрация, тем менее глубоко она восстанавливается. Реагирует со всеми металлами, кроме Au, Pt, W. Концентрированная HNO3 не взаимодействует при обычных условиях с Fe, Cr, Al, которых она пассивирует, но при очень сильном нагревании реагирует с этими металлами.
- Большинство неметаллов и сложных веществ восстанавливается HNO3 до NO (реже NO2).
- 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
- S + 2HNO3 = H2SO4 + 2NO
- 3C + 4HNO3 = 3CO2 + 4NO + 2H2O
- ZnS + 8HNO3 k = ZnSO4 + 8NO2 + 4H2O
- 6HCl + 2HNO3 k =3Cl2 + 2NO + 4H2O
Запись окислительно-восстановительной реакции с участием HNO3 обычно условна, т.к. образуется смесь азотсодержащих соединений, а указывают тот продукт восстановления, который образовался в большем количестве.
Золото и платиновые металлы растворяются в «царской водке» – смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты, которая обладает сильнейшим окислительным свойством, растворяет «царя металлов» – золото.
Au + HNO3 +4HCl = H[AuCl4] + NO↑ + 2H2O
HNO3 – сильная одноосновная кислота, образует только средние соли -нитраты, которые получают действием ее на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Их растворы обладают незначительными окислительными свойствами.
- При нагревании нитраты разлагаются; нитраты щелочных металлов превращаются в нитриты и выделяется кислород.
- 2KNO3 = 2KNO2 + O2
- Состав других продуктов зависит от положения металла в ряду стандартных электродых потенциалов (РСЭП).
- Левее Mg = MeNO2 + O2до магния
- Me = Mg – Cu = MeO + NO2 + O2 правее магния.
- правее Cu = Me + NO2 + O2 менее активных металлов
- Нитраты аммония разлагаются
- NH4NO3 → N2O + 2H2O
- NH4NO3 → N2 + NO + 2H2O
- Нитриты не разлагаются, кроме NH4NO2
- NH4NO2 → N2 + 2H2O
- Получение азотной кислоты
- t
- В лабораторных условиях – KNO3тв + H2SO4 k = KHSO4 + HNO3 ↑
- В промышленности: аммиачный или контактный способ.
- Каталитическое окисление в контактном аппарате (катализатор – платинородиевые сетки)
- t,k
- 1) 4NH3 + 5O2 → 4NO + 6H2O
- 2) 2NO + O2 → 2NO2при обычной t и повышенном P ≈ 600 – 1100 кПа
- 3)4NO2 + O2 + 2H2O → 4HNO3 ω (50 – 60%)
- Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Источник: https://zdamsam.ru/a71288.html
Урок 15. свойства оксидов неметаллов. свойства серной и азотной кислот. водородные соединения неметаллов — Химия — 11 класс — Российская электронная школа
Химия, 11 класс
Урок № 15. Свойства оксидов неметаллов. Свойства серной и азотной кислот. Водородные соединения неметаллов
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению соединений неметаллов: оксидам неметаллов, кислородсодержащим кислотам и водородным соединениям неметаллов.
Глоссарий
Азотная кислота – HNO3 — представляет собой бесцветную «дымящуюся» на воздухе жидкость. Приобретает на воздухе желтоватый цвет из-за разложения на двуокись азота.
Аммиак – NH3 – бинарное химическое соединение азота с водородом, бесцветный токсичный газ с резким характерным запахом, 10%-ный раствор аммиака используют в медицине, называют нашатырным спиртом.
Высшие оксиды – оксиды, в которых элементы проявляют свою наибольшую валентность
Метан – CH4 — бинарное химическое соединение водорода и углерода. Бесцветный газ без запаха, основной компонент природного газа.
Серная кислота – H2SO4 – сильная двухосновная кислота. При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3.
Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум). Мировое производство серной кислоты около 200 млн тонн в год.
Самый крупный потребитель серной кислоты — производство минеральных удобрений.
Сернистый газ – SO2 – оксид серы IV. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Токсичен. Один из основных компонентов вулканических газов.
Серный газ – SO3 – оксид серы VI. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. Весьма токсичен. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Сероводород – SH2 – бинарное химическое соединение водорода и серы. Бесцветный газ со сладковатым вкусом, обеспечивающий запах протухших куриных яиц.
Силан – SiH4 — бинарное химическое соединение водорода и кремния. Бесцветный газ с неприятным запахом.
Угарный газ – CO – монооксид углерода, оксид углерода II, бесцветный чрезвычайно токсичный газ без вкуса и запаха. Горюч.
Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Токсическое действие оксида углерода(II) обусловлено образованием карбоксигемоглобина — значительно более прочного карбонильного комплекса с гемоглобином, по сравнению с комплексом гемоглобина с кислородом.
Углекислый газ – CO2 – диоксид углерода, оксид углерода IV, бесцветный газ, почти без запаха, но в больших концентрациях приобретает кисловатый запах, знакомый нам по газировке. Является одним из парниковых газов.
Фосфин – PH3 — бинарное химическое соединение водорода и фосфора. Бесцветный ядовитый газ без запаха, однако примеси могут дать ему запах тухлой рыбы.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Соединения неметаллов с кислородом и водородом
Неметаллы (углерод, кислород, азот, сера, галогены) могут образовывать соединения как с кислородом (оксиды), так и с водородом. Водородные соединения являются газами или жидкостями, например, вода, аммиак, сероводород, соляная кислота. Оксиды могут быть газами (углекислый или сернистый газ), жидкостями (оксид хлора(VI) и (VIII)) или твёрдыми телами (оксид фосфора(V)).
- Оксиды неметаллов
- Типичными примерами оксидов неметаллов являются:
- Сернистый газ (SO2), серный газ (SO3), угарный газ (CO), углекислый газ (CO2), оксид фосфора V (P2O5), оксид азота I (NO), оксид азота II (NO2).
- Оксиды неметаллов подразделяют на две группы – несолеобразующие (SiO, N2O, NO, CO, S2O, H2O) и солеобразующие (остальные).
- Несолеобразующих оксидов немного, их обыкновенно образуют одновалентные и двухвалентные неметаллы.
Солеобразующие оксиды неметаллов при взаимодействии с водой дают соответствующую им кислоту. Исключение составляет оксид кремния IV, который нерастворим в воде. Соответствующую ему кремниевую кислоту получают косвенным путём — взаимодействием растворимых силикатов щелочных металлов с кислотами.
Высшие оксиды – это оксиды, в которых неметалл проявляет степень окисления, равную номеру группы.
Кислотные свойства оксидов. В пределах одного периода с увеличением номера группы наблюдается увеличение кислотных свойств высших оксидов и соответствующих им кислот. Например, для неметаллов третьего периода, кремниевая кислота является слабой, а хлорная кислота является одной из самых сильных.
Такая закономерность вытекает из периодического закона Менделеева. В периоде радиус атома неметалла уменьшается с увеличением номера группы, а заряд неметалла при этом увеличивается. Поэтому при движении по периоду слева направо связь между неметаллом и кислородом упрочняется, а связь неметалл-водород ослабевает, что даёт увеличение диссоциации кислоты.
В пределах одной главной подгруппы происходит ослабление кислотных свойств оксидов и кислот с увеличением номера периода.
Соединения неметаллов с водородом
Кроме соединений с кислородом, неметаллы образуют соединения с водородом. Например, метан (CH4), аммиак (NH3), вода (H2O), плавиковая кислота (HF), соляная кислота (HCl). Эти соединения представляют собой газы или жидкости.
В периодах слева направо кислотные свойства водородных соединений неметаллов в водных растворах усиливаются. Это связано с тем, что в этом направлении у атомов элементов увеличивается заряд ядра и уменьшается радиус.
В группах сверху вниз, по мере увеличения атомного радиуса, отрицательно заряженные анионы неметаллов всё слабее притягивают положительно заряженные ионы водорода. Таким образом, отщепление ионов водорода происходит проще и кислотность увеличивается.
Кислородосодержащие кислоты
Некоторые из рассматриваемых соединений при взаимодействии с водой образуют кислородосодержащие кислоты, такие как серная, азотная, фосфорная кислоты.
Азотная кислота также относится к кислородосодержащим кислотам, но не образуется при растворении соответствующих оксидов в воде. Для синтеза этой кислоты требуется более сложный процесс: смесь оксидов азота реагируют с водой с поглощением кислорода.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на определение участников реакции.
- Условие задания:
- Оксид с формулой XO2 прореагировал с 14 г CaO (оксид неметалла был взят в избытке), при этом образовалось 30 г соли CaXO3.
- 1) Укажите порядковый номер элемента X.
- 2) Какая масса (в граммах) оксида неметалла прореагировала?
- 3) Укажите степень окисления неметалла в оксиде XO2 (без знака)
- 4) Укажите максимальную степень окисления элемента X (без знака)
- Шаг первый:
- Составим уравнение реакции оксида неметалла с основным оксидом:
- XO2 + CaO → CaXO3
- Стехиометрическое соотношение CaO к CaXO3 – 1:1
- Шаг второй:
Определим количество вещества CaO: M(CaO) = 56 г/моль. Количество вещества n = m/M. n(CaO) = 14/56 = 0,25 моль.
Шаг третий
Определим молярную массу элемента X. Поскольку стехиометрическое соотношение CaO к CaXO3 – 1:1, то n(CaXO3) = 0,25 моль. Определим молярную массу соединения CaXO3. M = m/n. M(CaXO3) = 30/0,25 = 120 г/моль. Молярная масса CaXO3 слладывается из атомарных масс образующих соединение элементов. Получаем уравнение:
- M(Ca) + M(X) + 3*M(O) = 120
- 40 + M(X) + 48 = 120
- M(X) = 32 г/моль
- Шаг четвёртый
Определяем элемент X. Находим в таблице Менделеева элемент с молярной массой 32 г/моль. Это сера, элемент с порядковым номером 16.
- Шаг пятый
- Определяем массу прореагировавшего XO2. Исходя из материального баланса:
- m(XO2) + m(CaO) = m(CaXO3)
m(CaO) и m(CaXO3) известны из условия задачи. Определяем m(XO2).
m(XO2) = 30 – 14 = 16 г.
Шаг шестой
Определеяем степень окисления неметалла в оксиде XO2 (без знака). Степень окисления кислорода в оксидах = -2. Значит, степень окисления X = +4. Без знака: 4.
Шаг седьмой
Определяем максимальную степень окисления элемента X (без знака). Мы определили, что элемент X – это сера. Максимальную степень окисления элементы проявляют в высших оксидах. Высший оксид для серы это SO3. Степень окисления серы в нём = +6. Без знака: 6.
Ответ:
Порядковый номер элемента X – 16. Это сера.
m(XO2) = 16 г. Степень окисления неметалла в оксиде XO2 (без знака): 4. Максимальную степень окисления элемента X (без знака): 6.
- Решение задачи на установление соответствия между оксидами неметаллов и соответствующим им кислотам.
Условие задания:
Соедините между собой оксиды неметаллов и кислородсодержащие кислоты, соответствующие им.

Шаг первый:
Определим среди предложенных соединений оксиды неметаллов. Это Cl2O, SO2, SO3, CO2. Остальные соединения не являются оксидами.
- Шаг второй:
- Определим соответствующие им кислоты. Такие кислоты получаются при взаимодействии оксидов с водой:
- Cl2O + H2O → 2 HClO
- SO2 + H2O → H2SO3
- SO3 + H2O → H2SO3
- CO2 + H2O → H2CO3
- Шаг четвёртый:
- Соединяем между собой оксиды неметаллов и кислородсодержащие кислоты, соответствующие им.
- Ответ:

Источник: https://resh.edu.ru/subject/lesson/5913/conspect/
Кислородсодержащие соединения азота
Азот непосредственно не соединяется с кислородом. В кислородных соединениях азот проявляет различные степени окисления и образует пять оксидов: N2O, NO, N2O4, NO2 и N2O5. Оксиды N2O и NO – бесцветные газы, оксид азота (IV) NO2 – бурый газ. Оксид азота (III) N2O3 – синяя жидкость, оксид азота (V) N2O5 – бесцветные кристаллы.
Оксид азота (II) NO – бесцветный газ, не обладающий ни кислотными, ни основными свойствами.
Молекула NO не совсем обычная: между азотом и кислородом образуется двойная связь и один электрон у азота в молекуле NO остается неспаренным, т. е.
NO – свободный радикал и для него характерна очень высокая химическая активность. Поэтому NO на воздухе легко окисляется до NO2.
- В лаборатории NO получают взаимодействием меди с разбавленной азотной кислотой:
- 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O,
- в промышленности – каталитическим окислением аммиака:
- 4NH3 + 5O2 = 4NO + 6H2O.
Оксид азота (IV) NO2 – бурый газ с характерным запахом. Атом азота образует две связи с атомами кислорода, одну донорно-акцепторную связь и имеет один неспаренный электрон.
Пары NO2 ядовиты. При растворении в воде NO2 реагирует с ней, образуя азотную кислоту и NO. В присутствии кислорода NO2 растворяется в воде, при этом образуется только азотная кислота:
4NO2 + O2 + 2H2O = 4HNO3.
Оксид азота (I), или закись азота, N2O – бесцветный газ без запаха. Его называют веселящим газом, так как он притупляет чувствительность и вызывает своеобразное чувство эйфории. При растворении с водой не взаимодействует, а при нагревании разлагается на азот и кислород.
Получают N2O термическим разложением нитрата аммония:
NH4NO3 = N2O + 2H2O.
Оксид азота (III), или азотистый ангидрид, N2O3 – практического применения не имеет. Это темно-синяя жидкость. Легко разлагается по уравнению:
- N2O3 « NO + NO2.
- Азотистый ангидрид при растворении в воде образует азотистую кислоту HNO2:
- N2O3 + H2O = HNO2.
- Это слабое и неустойчивое соединение. При нагревании раствор азотистой кислоты разлагается:
- 2HNO2 = NO + NO2 + H2O.
- Соли азотистой кислоты называются нитритами.
- Оксид азота (V), или азотный ангидрид, N2O5 – практического применения не имеет. Это твердое кристаллическое вещество, хорошо растворимое в воде, при этом образуется азотная кислота:
- N2O5 + H2O = 2HNO3.

Источник: http://www.yoursystemeducation.com/kislorodsoderzhashhie-soedineniya-azota/
Кислородные соединения азота
Кислородные соединения азота
Оксиды. Азот образует пять оксидов со степенями окисления +1, +2, +3, +4, +5.Оксиды N20 и N0 несолеобразующие (что это означает?), а остальные оксиды — кислотные: N2O3 соответствует азотистая кислота НN02, а N205 — азотная кислота НNO3. Оксид азота(IV) N02, при растворении в воде образует одновременно две кислоты — HNO2 и НNO3.Если же он растворяется в воде в присутствии избытка кислорода, получается только азотная кислота4N02 + 02 + 2Н20 = 4НNO3Оксид азота(IV) NO2 — бурый, очень ядовитый газ. Он легко получается при окислении кислородом воздуха бесцветного несолеобразующего оксида азота(П):2NO + 02 = 2NO2
Азотная кислота НN03 — бесцветная жидкость, которая «дымится» на воздухе. При хранении на свету концентрированная азотная кислота желтеет, так как частично разлагается с образованием бурого газа N02.
Азотная кислота проявляет все типичные свойства сильных кислот: взаимодействует с оксидами и гидроксидами металлов, с солями. Но вот с металлами она ведет себя по-особому — ни один из металлов не вытесняет из азотной кислоты водород, независимо от ее концентрации (для серной кислоты такое поведение характерно только в ее концентрированном состоянии).
Это объясняется тем, что НNO3 является сильным окислителем, в ней азот имеет максимальную степень окисления +5. Именно он и будет восстанавливаться при взаимодействии с металлами.
Продукт восстановления зависит от положения металла в ряду напряжений, от концентрации кислоты и условий проведения реакции.
Например, при взаимодействии с медью концентрированная азотная кислота восстанавливается до оксида азота(IV):
Сu + 4НN03(конц) = Сu(NO3)2 + 2NO2 + 2Н20а разбавленная — до оксида азота(ПII):ЗСu + 8HN03(разб) = ЗСu(HNО3)2 + 2NO + 4Н20
Железо и алюминий при действии концентрированной HN03 покрывается прочной оксидной пленкой, предохраняющей металл от дальнейшего окисления, т. е. кислота пассивирует их. Поэтому азотную кислоту, как и серную, можно перевозить в стальных и алюминиевых цистернах.
Азотная кислота окисляет многие органические вещества, обесцвечивает красители. При этом обычно выделяется много теплоты и вещество воспламеняется. Так, если к азотной кислоте прилить каплю скипидара, то происходит яркая вспышка, а тлеющая лучинка в ней загорается (рис. 33).
Азотная кислота широко применяется в химической промышленности для производства азотных удобрений, пластмасс, искусственных волокон, органических красителей и лаков, лекарств и взрывчатых веществ.Соли азотной кислоты — нитраты получают при действии кислоты на металлы, их оксиды и гидроксиды.
Нитраты натрия, калия, кальция и аммония называются селитрами: NaNO3 — натриевая селитра, КN03 — калийная селитра, Са(NO3)2 — кальциевая селитра, NН4О3 — аммиачная селитра. Все они применяются как азотные удобрения.

Калийная селитра используется также при изготовлении черного пороха, а из аммиачной селитры готовят взрывчатое вещество аммонал. Нитрат серебра, или ляпис, AgNOз применяется в медицине для прижигания ран, язв и др.
Почти все нитраты хорошо растворимы в воде. При нагревании они разлагаются с выделением кислорода.
Поэтому если в расплавленную в пробирке калийную селитру бросить кусочек раскаленного древесного угля, то он энергично сгорит, взаимодействуя с выделяющимся из селитры кислородом (рис. 34).
Источник: http://chemistrykz.blogspot.com/p/blog-page_6204.html
Презентация к уроку по химии (9 класс) на тему: Кислородные соединения азота | Социальная сеть работников образования
Слайд 1
Кислородные соединения азота. Автор : Гвоздева Е. А., учитель химии МБОУ ООШ Г. Кирсанова 2014
Слайд 2
Оксиды азота . Азот образует шесть кислородных соединений. степени окисления + 1 N 2 O + 2 NO + 3 N 2 O 3 + 4 NO 2 , N 2 O 4 + 5 N 2 O 5
Слайд 3
Получение : NH 4 NO = N 2 O +2H 2 O Химические свойства: 1. разложение при нагревании 2 N 2 +1 O = 2 N 2 0 + O 2 2.
с водородом N 2 +1 O + H 2 = N 2 0 + H 2 O несолеобразующий +1 N 2 O оксид азота (I), закись азота или «веселящий газ», возбуждающе действует на нервную систему человека, используют в медицине как анестезирующее средство.
Физические свойства: газ, без цвета и запаха. Проявляет окислительные свойства, легко разлагается.
Слайд 4
NO +2 Получение: 1. В природе: N 2 + O 2 = 2NO 2. В промышленности: 4 NH 3 + 5O 2 = 4NO +6H 2 O Химические свойства: 1. легко окисляется: 2 N +2 O + O 2 = 2N +4 O 2 2. окислитель: 2 N +2 O + 2SO 2 = 2SO 3 +N 2 0 несолеобразующий бесцветный газ, термически устойчивый, плохо растворим в воде, практически мгновенно взаимодействует с кислородом (при комнатной температуре).
Слайд 5
N 2 O 3 +3 Химические свойства: NO 2 + NO N 2 O 3 Получение: ВСЕ свойства кислотных оксидов. кислотный оксид жидкость темно-синего цвета, термически неустойчивая, t кип.= 3,5 0С, т. е. существует в жидком состоянии только при охлаждении, в обычных условиях переходит в газообразное состояние. При взаимодействии с водой образуется азотистая кислота.
Слайд 6
NO 2 + 4 Получение: 1. 2 NO + O 2 = 2NO 2 2. Cu + 4HNO 3( к ) = Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O Химические свойства: 1. с водой 2 NO 2 + H 2 O = HNO 3 + HNO 2 2. с щелочами 2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O 3. димеризация 2NO 2 N 2 O 4 токсичен оксид азота (IV) или диоксид азота , бурый газ, хорошо растворим в воде, полностью реагирует с ней. Является сильным окислителем.
Слайд 7
N 2 O 5 + 5 Получение: 1. 2NO 2 + O 3 = N 2 O 5 + O 2 2. 2HNO 3 + P 2 O 5 = 2HPO 3 + N 2 O 5 Химические свойства: 1. легко разлагается 2N 2 O 5 = 4NO 2 + O 2 2 . сильный окислитель кислотный оксид оксид азота (V), азотный ангидрид, белое твердое вещество ( tпл.= 41 0 С). Проявляет кислотные свойства, является очень сильным окислителем.
Слайд 8
HNO 3 Состав. Строение. Свойства.
H O N O O — — степень окисления азота валентность азота +5 IV химическая связь ковалентная полярная Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде.
Т емпература плавления −41,59 °C, кипения +82,6 °C с частичным разложением. При хранении на свету разлагается на оксид азота ( IV ), кислород и воду, приобретая желтоватый цвет: 4HNO 3 = 4NO 2 + O 2 + 2H 2 O Азотная кислота ядовита.
- Слайд 9
- Азотная кислота ( HNO 3 ) Классификация по: наличию кислорода: основности : растворимости в воде: летучести: степени электролитической диссоциации: кислородсодержащая одноосновная растворимая летучая сильная
- Слайд 10
Получение азотной кислоты в промышленности NH 3 NO NO 2 HNO 3 4NH 3 + 5O 2 = 4NO + 6H 2 O 2NO+O 2 = 2NO 2 4 NO 2 + 2 H 2 O + O 2 = 4 HNO 3 Контактное окисление аммиака до оксида азота ( II ): 2 . Окисление оксида азота ( II ) в оксид азота ( IV ): 3 . Адсорбция (поглощение) оксида азота ( IV ) водой при избытке кислорода
- Слайд 11
- В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитраты при слабом нагревании. NaNO 3 + H 2 SO 4 = NaHSO 4 + HNO 3
- Слайд 12
Химические свойства азотной кислоты Азотная кислота проявляет все типичные свойства кислот. 1 .
Свойства HNO 3 как электролита: 1 3 2 3 2) с основными и амфотерными оксидами 3) с основаниями 1) Диссоциация: HNO 3 = H + + NO 3 – 2HNO 3 + CuO = Cu(NO 3 ) 2 + H 2 O 6HNO 3 + Al 2 O 3 = 2Al(NO 3 ) 3 + 3H 2 O HNO 3 + NaOH = NaNO 3 + H 2 O 2HNO 3 + Zn(OH) 2 = Zn(NO 3 ) 2 + 2H 2 O 4) с солями 2HNO 3 + Na 2 SiO 3 = H 2 SiO 3 ↓ + 2NaNO 3
Слайд 13
2 . Окислительные свойства: особенности взаимодействия с металлами: (азотная кислота никогда не выделяет водород!) Me + HNO 3 = Me(NO 3 ) 2 + H 2 ↑ Металл Концентри — рованная (> 60%) Разбавлен- ная (5-60%) Очень разбавлен- ная (
- Слайд 14
- С металлами, стоящими в ряду напряжений левее водорода: С металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO 3 Разбавленная HNO 3 Химические свойства азотной кислоты
- Слайд 15
- 2 . Окислительные свойства 2) Особенности взаимодействия с неметаллами (S , P, C ) : 3) Взаимодействует с органическими веществами (скипидар вспыхивает): Химические свойства азотной кислоты 3P + 5HNO 3 + H 2 O = 3H 3 PO 4 + 5NO C + 4HNO 3 = CO 2 + H 2 O + 4NO 2 5 HNO 3 + 3 P + 2 H 2 O → 3 H 3 PO 4 + 5 NO
- Слайд 16
- Применение азотной кислоты 1 5 4 6 2 3 Производство азотных и комплексных удобрений. Производство взрывчатых веществ Производство красителей Производство лекарств Производство пленок, нитролаков, нитроэмалей Производство искусственных волокон 7 Как компонент нитрующей смеси, для траления металлов в металлургии
- Слайд 17
Нитраты – соли азотной кислоты, получают при действии кислоты на металлы, их оксиды и гидроксиды . Селитры – соли азотной кислоты и щелочных металлов. NaNO 3 – натриевая селитра KNO 3 – калийная селитра NH 4 NO 3 – аммиачная селитра Ca ( NO 3 ) 2 – кальциевая селитра Свойства : ВСЕ растворимы в воде.
- Слайд 18
- При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом ряду напряжений стоит металл, образующий соль. Li K Ba Ca Na Mg Al Mn Zn Cr Fe Co Sn Pb Cu Ag Hg Au нитрит + О 2 оксид металла + NO 2 + O 2 Ме + NO 2 + O 2 2NaNO 3 = 2NaNO 2 + O 2 2Pb(NO 3 ) 2 = 2PbO + 4NO 2 + O 2 2AgNO 3 = 2Ag + 2NO 2 + O 2
- Слайд 19
Селитры используются как удобрения. KNO 3 применяется для приготовления черного пороха.
Слайд 20
Домашнее задание: § 26, упр. 2,4 стр. 121.
Источник: https://nsportal.ru/shkola/khimiya/library/2015/02/03/kislorodnye-soedineniya-azota
Кислородосодержащие соединения азота
Кислородосодержащие
соединения азота
План
-
Оксиды азота
-
Азотистая кислота, ее соли
-
Азотная кислота и ее соли
- 1.
Оксиды
азота - кислотный
оксид азот соль - Всего имеется пять
оксидов азота: N2O,
NO
– несолеобразующие оксиды; N2O3,
NO2,
N2O5
– кислотные оксиды. - а) N2O
– закись азота. - Получают разложением
нитрата аммония при 250оС. - NH4NO3
→ N2O↑
+ 2H2O
Это — газ с приятным
слабым запахом. Вдыхание малых количеств
этого газа оказывает опьяняющее действие,
поэтому называется «веселящий газ». В
больших дозах вызывает потерю болевой
чувствительности. Молекула N2O
имеет линейное строение
N
≡ N
→ O
N2O
хорошо растворяется в Н2О, но устойчивых
соединений не образует. Ни с водой, ни
с кислотами, ни со щелочами не реагирует.
Уже при слабом нагревании N2O
распадается, выделяя О2.
- 2N2O
→ 2N2
+ O2 - Поэтому N2O
является окислителем по отношению ко
всем веществам, которые непосредственно
реагируют с кислородом. - N2O
+ Н2 = N2
+ Н2О.
б)NO
– оксид азота
(П). Тоже — несолеобразующий оксид. В
обычных условиях NO
– бесцветный газ. В промышленности
получают при окислении H3N
на платиновом катализаторе при нагревании:
4NH3
+ 5O2
= 4NO
+ 6H2O
В лаборатории NO
получают действием разбавленной HNO3
на Cu:
3Cu +
8HNO3разб.
= 3Cu(NO3)2 + 2NO + 4H2O.
В отличие от всех
остальных оксидов азота NO
образуется также прямым взаимодействием
простых веществ:
N2
+ O2
= 2NO.
- 2NO + O2 =
2NO2; 2NO + Cl2 = 2NOCl - Как окислитель NO
легко окисляет SO2
до SO3; - 2SO2
+ 2NO
= 2SO3
+ N2 - С водородом
(особенно когда равные объемы) при
нагревании NO
взрывается: - 2NO
+ 2H2
= N2
+ 2H2O - В воде NO
мало растворяется и с водой не реагирует. - в) NO2
– оксид азота (IV)
— красно —
бурый ядовитый газ с характерным запахом.
Его молекула имеет
угловую форму, порядок связи между N
и О равен 1,5. Молекула NO2
даже в парах частично димеризована:
2NO2
↔ N2O4
+ Q
Эти два соединения
находятся в равновесии между собой при
температурах от –11о до 140оС. Молекула
NO2
характеризуется высокой химической
активностью. При повышении температуры
NO2
– один из наиболее энергичных окислителей
(в нем горят С, S,
P).
При температуре более 500оС NO2
разлагается на NO
и О2. При растворении в воде образуются
две кислоты:
- 2N+4O2
+ H2O
→ HN+5O3
+ HN+3O2, - то есть NO2
– смешанный ангидрид азотной и азотистой
кислот. - Аналогично
со
щелочью: - 2NO2 +
2NaOH = NaNO3 + NaNO2 + H2O - 4NO2
+ O2
+ 2H2O
= 4HNO3 - (эта реакция
используется в промышленности для
получения HNO3). - В лабораторных
условиях NO2
получают: - Cu
+ 4HNO3
(конц.) = Cu(NO3)2
+ 2NO2↑
+ 2H2O - или термическим
разложением нитратов: - 2Рв(NO3)2
= 2РвО
+ 4NO2 + O2
г).
N2O5
– оксид азота (V)
– азотный ангидрид получают дегидратацией
азотной кислоты фосфорным ангидридом
(осторожным обезвоживанием) или окислением
NO2
озоном.
- 2HNO3 +
P2O5 = 2HPO3 + N2O52NO2 + O3 → N2O5 + O2. - N2O5
– это белое кристаллическое вещество.
При комнатной температуре N2O5
постепенно разлагается на NO2
и О2, при нагревании взрывается: - 2N2O5
= 4NO2
+ O2 - При взаимодействии
с Н2О образует азотную кислоту: - N2O5
+ Н2О → 2HNO3
N2O5
– очень сильный окислитель. Многие
органические вещества при соприкосновении
с ним воспламеняются.
д). N2O3
– оксид азота (Ш)
– азотистый ангидрид, образуется по
реакции:
NO2
+ NO
↔ N2O3.
Равновесие этой
реакции даже при 25оС сдвинуто влево, то
есть N2O3
– малоустойчивое соединение. Существует
только при низких температурах в твердом
состоянии (светло-синие кристаллы). В
виде жидкости и пара сильно диссоциирует:
- N2O3
↔ NO2
+ NO - N2O3
может быть также получен при разложении
HNO2,
которая очень неустойчива: - 2HNO2
↔ H2O
+ N2O3 - N2O3
– кислотный оксид, поэтому легко
реагирует со щелочами: - N2O3
+ 2NaOH
= 2NaNO2
+ H2O - При растворении
в воде получается HNO2: - N2O3 + HOH
↔ 2HNO2 - Строение
N2O3:
2.
Азотистая
кислота,
её соли
Азотистая кислота
HNO2
известна лишь в разбавленных водных
растворах. В чистом виде не существует.
При нагревании разлагается: 2HNO2
= NO
+ NO2↑
+ H2O.
HNO2
— кислота средней силы (К ≈ 5∙10-4).
Молекула HNO2
существует в двух таутомерных формах:
Нитриты металлических
элементов достаточно устойчивы, а
нитриты щелочных металлов даже возгоняются
без разложения.
Азот в HNO2
имеет С.О. = +3, то есть промежуточная
степень окисления, поэтому и кислота,
и соли обладают окислительно-восстановительной
двойственностью. Сильные окислители
переводят NO2-
в NO3-:
- 5NaNO2
+ 2KMnO4
+ 3H2SO4
→ 5NaNO3
+ 2MnSO4
+ K2SO4
+ 3H2O - Сильные восстановители
обычно восстанавливают NO2-
до NO: - 2NaNO2 +
2KI + 2H2SO4 → Na2SO4 + 2NO + K2SO4 + I2 + 2H2O - Кроме того,
соединения азота (Ш) склонны к реакциям
диспропорционирования: - 3HNO2 =
HNO3 + 2NO + H2O - 2HNO2 = NO
+ NO2 + H2O - 3. Азотная кислота
и её соли - Азотную кислоту
HNO3
получают в промышленности каталитическим
окислением NH3
до NO,
затем NO
окисляют кислородом воздуха до NO2,
а затем смесь NO2
с избытком воздуха поглощают водой (или
разбавленной HNO3). - 4NH3 + 5O2
→ 4NO + 6H2O - 2NO + O2 →
2NO2 - 4NO2 + O2 +
2H2O → 4HNO3 - В лаборатории HNO3
получают действием концентрированной.
H2SO4
на
нитрат
натрия: - NaNO3 +
H2SO4 = NaHSO4 + HNO3
При обычных условиях
HNO3
– бесцветная жидкость (ρ = 1,52г/см3),
кипящая при 84,1оС. С водой HNO3
смешивается в любых соотношениях. В
водном растворе HNO3
— сильная кислота, которая практически
полностью диссоциирована. При хранении
HNO3
(особенно при нагревании и освещении)
разлагается: 4HNO3
= 4NO2
+ O2
+ 2H2O.
На воздухе она
«дымит», так как её пары с влагой воздуха
образуют мелкие капельки тумана.
HNO3
имеет плоское строение:
Ковалентность
азота в HNO3
равна 4.
HNO3
относится к сильным окислителям. Она
разрушает животные и растительные
ткани, пары её ядовиты. Окисляет многие
металлы и неметаллы:
- Cu
+ 4HNO3
(конц.) = Cu(NO3)2
+ 2NO2
+ 2H2O - 3Cu + 8HNO3
(разб.)
= 3Cu(NO3)2 + 2NO + 4H2O - 4Zn +
10HNO3 (очень
разб.)
= 4Zn(NO3)2 + NH4NO3 + 3H2O - S + 6HNO3
(конц.)
= H2SO4 + 6NO2 + 2H2O - 3P + 5HNO3
(разб.)
+ 2H2O = 3H3PO4 + 5NO - Смесь из одного
объёма HNO3
и трёх объёмов концентрированной HCl,
называется «царской водкой». Это более
сильный окислитель, чем HNO3
и реагирует с такими благородными
металлами, как золото и платина, переводя
их в комплексные хлориды: - Au + HNO3 +
4HCl = NO + 2H2O + H[AuCl4].
Источник: https://studfile.net/preview/8173861/
ПОИСК
Синтез кислородсодержащих соединений азота [c.
176]
Каталитическое превращение МНз в N0 лежит в основе промышленного способа получения кислородсодержащих соединений азота и является одной из стадий так называемого процесса Оствальда.
Подобно процессу Габера, этот процесс был разработан в Германии накануне первой мировой войны. Он позволил превращать МНз в азотную кислоту для производства взрывчатых веществ. [c.318]
Кислородсодержащие соединения азота. А.30Т с кислородом образует пять оксидов, в которых он проявляет степень окисления от 1-f- до 5+ [c.252]
Таким образом, имеющиеся в настоящее время экспериментальные данные по окислению циклогексана различными кислородсодержащими соединениями азота достаточно убедительно говорят о радикальном механизме этих реакций. При этом наряду с окислительным действием окислы азота оказывают на циклогексан нитрующее действие. Изменяя условия реакции (концентрацию окислов азота, температу- [c.271]
Катализатор (типа Гудри ЗВ), содержащий платину, нанесенную на окись алюминия, изготовлялся на заводе Гудри в Пол-сборо, Нью-Джерси. Металлы, например свинец, медь, никель и мышьяк, снижают активность катализатора [26]. При работе с этим катализатором необходимо обеспечить удаление избыточных количеств воды, кпслсрода, кислородсодержащих соединений, азота и серы.
Указанный катализатор обладает исключительно высокими качествами в процессах обессеривания. При исследованиях, проведенных с индивидуальными соединениями, не наблюдалось снижение дегидрогенизационной активности катализатора при содержании серы в исходном сырье до 0,2%. Сырье однократно пропускали над свежим катализатором при коротких периодах пробега установки [98].
Однако в промышленной практике (при содержании в сырье более 0,2% вес. серы) может потребоваться предварительная обработка исходного сырья или промывка рециркулирующего газа. Несмотря на непрерывность процесса, имеется возможность регенерации катализатора. Первоначальная активность и избирательность катализатора при регенерации почти полностью восстанавливаются. [c.
622]
КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ АЗОТА [c.168]
Азотная кислота HNO3-важнейшее кислородсодержащее соединение азота. При обычных условиях HNO3-бесцветная жидкость, неограниченно смешивающаяся с водой. Концентрированная (дымящая) азотная кислота при хранении на свету окрашивается в бурый цвет из-за разлЬжения до NO2 (а также Oj и HjO). [c.137]
Кислородсодержащие соединения азотя [c.317]
Поверхностно-активные вещества этого югасса отличаются большим разнообразием химического строения анилин, алкилфениламины, алкилфеноламины, алифатические амины, в частности полиэтиленполи-амин. Очень разнообразны кислородсодержащие соединения азота. Важнейшим из них являются ПАВ с [c.798]
Кислородсодержащие соединения азота Азот с кислородом образует пять оксидов, в которых он проявляет степень окисления от 1+ до 5-f- N2O, N0, N2O3, NO2 и N2O5. При обычных условиях все оксиды азота, кроме оксида азота(У), — газообразны N2O5 — твердое вещество. [c.300]
В последние годы разработаны методы определения некоторых кислородсодержащих соединений азота по их светопогло-щению в ультрафиолетовой области спектра N0(1], Ы0г [2], N03- [3,4], Н2Ы20г[5], НЫ202 [5], Ы20г [5]. На этом основаны методы дифференциальной фотометрии двуокиси азота (до 7 г/л) и нитрат-иона (до 36 г/л).
Азотноватистую кислоту, гипонитриты и окись азота определяют в количествах до 10 М. Из органических реактивов для определения больших количеств нитрат-иона пригодна фенолдисульфокислота (до 70 мг/л, =500 нм), 2,6-ксиленол позволяет определять до 40 мг/л нитрат-иона. В обоих случаях мешают галоиды и нитрит-ионы. [c.
69]
Распространение в природе. Большая часть азота на Земле находится в свободном состоянии в виде двухатомных молекул N2 в атмосфере. Массовая доля азота в воздухе составляет 75,6%, а объемная доля равна 78,09%.
Б воздухе содержатся также небольшие количества аммиака NHg, образуюш егося при гниении органических веш еств, и кислородсодержащих соединений азота (оксидов и кислот), источниками которых служат грозы, извержения вулканов, деятельность почвенных микроорганизмов и человека.
Промышленное значение имеют биогенные месторождения натриевой (чилийской) селитры NaNOg и калиевой (индийской) селитры KNOg, которые образовались в местностях с устойчивым сухим и жарким климатом. Азот содержится также в каменном угле (1,0—2,5%) и нефти (0,2—1,7%).
Суммарное содержание всех химических форм азота в гидросфере составляет 5 10 моль/л. Массовая доля азота в живом веществе биосферы намного выше, чем в литосфере. Общее содержание азота в биомассе составляет примерно 10 млрд т. [c.382]
Источник: https://www.chem21.info/info/1500869/
Кислородные соединения азота. Оксиды азота.. Что относится к кислородным соединениям? ОксидыКислоты(кислородсодержащие) Оксиды азота и кислоты, содержащие. — презентация
1 Кислородные соединения азота. Оксиды азота.
- 2 Что относится к кислородным соединениям? ОксидыКислоты(кислородсодержащие) Оксиды азота и кислоты, содержащие азот
- 3 Оксиды азота Степени окисления азота Степени окисления азота Оксиды азота Оксиды азота N 2 O N 2 O N 2 O N 2 O NO NO NO N 2 O 3 N 2 O 3 N 2 O 3 N 2 O 3 NO 2 NO 2 NO 2 NO 2 N 2 O 5 N 2 O 5 N 2 O 5 N 2 O 5
- 4 Формуланазвание Физические свойства ПрименениеХарактер Взаимодействие с водой и щелочью
5 Оксид азота (I) оксид диазота закись азота веселящий газ N +1 2 O -2 Группа 1 Школьникова Д. Осипов В.
6 Физические свойства При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом.
Растворим в воде Растворим в воде Из 1 кг жидкой закиси азота образуется 500 л газа. Из 1 кг жидкой закиси азота образуется 500 л газа. Не воспламеняется, но поддерживает горение. Не воспламеняется, но поддерживает горение.
7 Характер Относится к несолеобразующим оксидам, с водой, с растворами щелочей и кислот не взаимодействует. Относится к несолеобразующим оксидам, с водой, с растворами щелочей и кислот не взаимодействует.
8 Применение Средство для ингаляционного наркоза Средство для ингаляционного наркоза Малые концентрации закиси азота вызывают чувство опьянения (отсюда название «веселящий газ») и лёгкую сонливость. При вдыхании чистого газа быстро развиваются состояние наркотического опьянения, а затем асфиксия.
В смеси с кислородом при правильном дозировании вызывает наркоз без предварительного возбуждения и побочных явлений.
В двигателях внутреннего сгорания В двигателях внутреннего сгорания В пищевой промышленности В пищевой промышленности соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ.
9 Оксид азота (II) монооксид азота окись азота N +2 O -2 Группа 2 Акименко С. Светловская Д.
10 Физические свойства При нормальных условиях бесцветный газ, При нормальных условиях бесцветный газ, плохо растворимый в воде, плохо растворимый в воде, сжижается с трудом, сжижается с трудом, в жидком и твёрдом виде имеет голубой цвет. в жидком и твёрдом виде имеет голубой цвет.
11 Характер Не реагирует с водой, кислотами и щелочами Несолеобразующий
12 Применение Получение NO является одной из стадий получения азотной кислоты.
13 Оксид азота(III) азотистый ангидрид N 2 O 3 Группа 3 Сидров И. Федотов Н.
14 Физические свойства Жидкость синего цвета (при н. у.), в твёрдом виде синеватого цвета. Жидкость синего цвета (при н. у.), в твёрдом виде синеватого цвета. Устойчив только при температурах ниже 4 °C.
Устойчив только при температурах ниже 4 °C. Без примесей NO 2 и NO существует только в твёрдом виде. Без примесей NO 2 и NO существует только в твёрдом виде. Высоко токсичен. Вызывает тяжёлые ожоги кожи. Высоко токсичен.
Вызывает тяжёлые ожоги кожи.
15 Характер При взаимодействии с водой даёт азотистую кислоту, При взаимодействии с водой даёт азотистую кислоту, При взаимодействии с растворами щелочей образуются соответствующие нитриты, При взаимодействии с растворами щелочей образуются соответствующие нитриты, Солеобразующий кислотный оксид.
16 Применение Применяется в лаборатории для получения азотистой кислоты и её солей. Применяется в лаборатории для получения азотистой кислоты и её солей.
17 Оксид азота (IV) диоксид азота, бурый газ N +4 O 2 -2 Группа 4: Иванова А. Ершова Н.
18 Физические свойства газ, газ, красно-бурого цвета, красно-бурого цвета, с характерным острым запахом с характерным острым запахом высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких. высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
19 Характер Реагирует с водой, кислотами и щелочами Солеобразующий, кислотный
20 Применение В производстве серной и азотной кислот, В производстве серной и азотной кислот, в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах. в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
21 «Лисий хвост» «Лисий хвост» жаргонное название выбросов в атмосферу оксидов азота на химических предприятиях (иногда из выхлопных труб автомобилей). Название происходит от оранжево- бурого цвета диоксида азота. «Лисий хвост» на Нижнетагильском металлургическом комбинате
22 Оксид азота(V) пентаоксид диазота, нитрат нитроила, азотный ангидрид N2O5N2O5N2O5N2O5
23 Физические свойства Бесцветные, очень летучие кристаллы. Бесцветные, очень летучие кристаллы. Крайне неустойчив. Крайне неустойчив.
24 Характер Солеобразующий кислотный оксид. Солеобразующий кислотный оксид. Соответствует азотная кислота HNO 3 Соответствует азотная кислота HNO 3
25 Применение Применяется в лаборатории для получения азотной кислоты и её солей. Применяется в лаборатории для получения азотной кислоты и её солей.
26 Спасибо за работу!
Источник: http://www.myshared.ru/slide/603001/




