Алкадиены (диены, диеновые углеводороды) – соединения, в молекулах которых присутствуют две двойные связи. Общая формула CnH2n-2.
Сопряженные диены – соединения, в молекулах которых две двойные связи разделены одной простой связью: СН2=СН–СН=СН–СН3 (пентадиен-1,3)
Изолированные диены – соединения, в молекулах которых две двойные связи разделены более чем одной простой связью. СН2=СН–СН2–СН=СН2 (пентадиен-1,4)

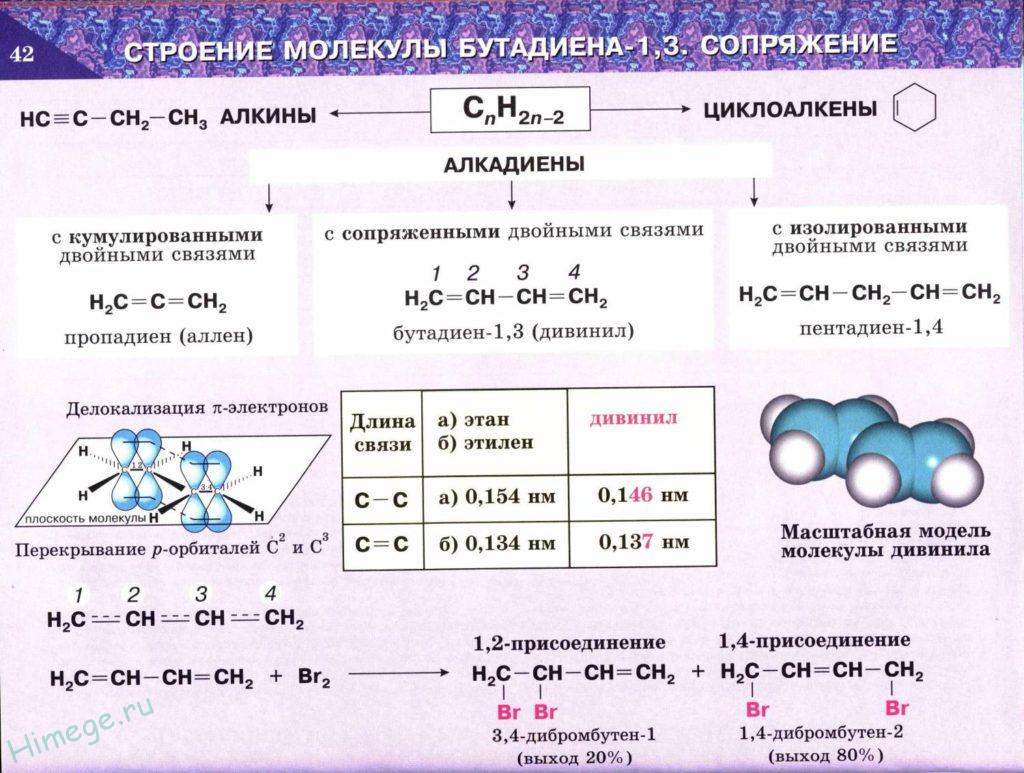
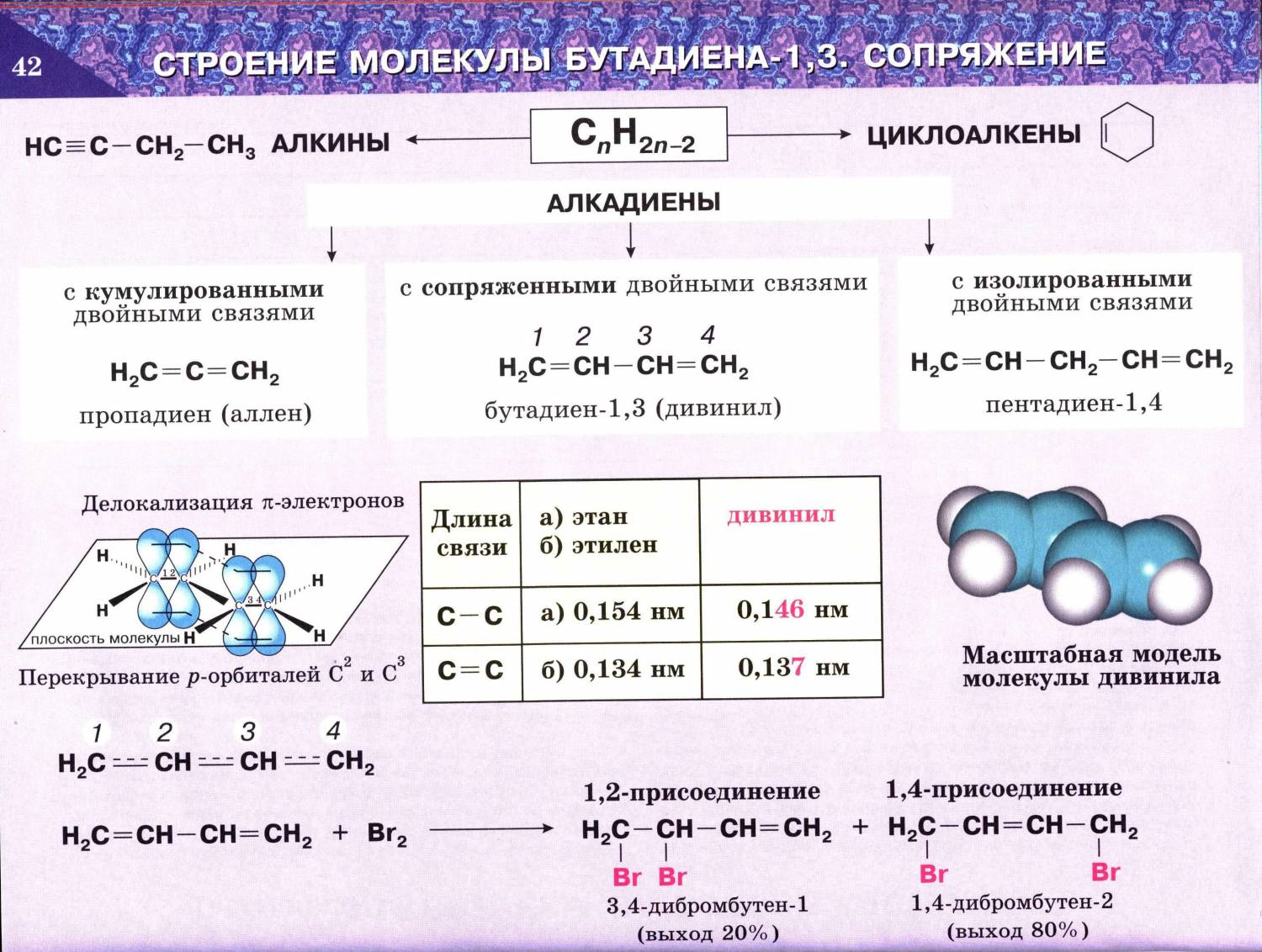
Рассмотрим строение сопряженного алкадиена бутадиена-1,3. Молекула имеет плоское строение. Рис. 1. Все 4 атома С в sp2-гибридизации, 2 двойных связи. Однако длина этих двойных связей (0,135 нм) больше, чем у алкена (0,133 нм), а простая связь между атомами углерода (0,146 нм) короче, чем связь С-С в алканах (0,154 нм).
Две сопряженных двойных связи в химических реакциях часто ведут себя, как единое целое. Почему?
Происходит частичное перекрывание π-электронных облаков между 2-м и 3-м атомами углерода, и четыре р-орбитали образуют единое π-электронное облако. Такой тип перекрывания орбиталей называют сопряжением. Четыре электрона не локализованы попарно на двойных связях, а распределены вдоль всей цепи – делокализованы. Рис. 2.

- Типичные реакции – электрофильное присоединение.
- Реакция с избытком брома:
- СН2=CН–СH=СН2 + 2Вr2 ——® СН2Вr–CHВr–СHBr-СН2Br
- При взаимодействии 1:1 образуется смесь.
- Обычное присоединение:
- СН2=CН–СH=СН2 + Вr2 ——® СН2Вr–CHВr–СH=СН2
- Сопряженное присоединение:
- СН2=CН–СH=СН2 + Вr2 ——® СН2Вr–СН=CH–СН2Вr
- При сопряженном присоединении π-электронное облако диена участвует в реакции присоединения как единое целое.
- 1. В промышленности бутадиен-1,3 и изопрен получают каталитическим дегидрированием бутана и 2-метилбутана, выделенных из фракций нефтеперегонки:

2. Бутадиен-1,3 в промышленности получают из этилового спирта по методу С.В.Лебедева:

3. Лабораторный способ – реакции отщепления, например:
СН2Br-СН2-СН2-СН2Br + 2КОН ® СН2=СН-СН=СН2 + 2KBr + 2H2O
В промышленности диены используют для получения синтетического каучука.
Углеводороды, содержащие две и более двойные связи в молекуле – терпены – широко распространены в растительных организмах, часто обладают приятным запахом. Смеси терпенов используют в производстве духов и ароматических отдушек, а также в медицине.
Жизненно важен для человека b-каротин, который превращается в организме в витамин А, он содержится в красных и желтых плодах. Рис. 3. Красный цвет b-каротина обусловлен длинной цепочкой сопряженных двойных связей.
Реакции полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой получения синтетических каучуков:

Полимеризация сопряжённых алкадиенов протекает как 1,4-присоединение. В этом случае двойная связь оказывается центральной в элементарном звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию:

Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью алкадиенов с сопряжёнными двойными связями является способность присоединять молекулы как в положения 1 и 2 (1,2-присоединение), так и в положения 1 и 4 (1,4-присоединение):

Рассмотрим причины, по которым в случае алкадиенов с сопряжёнными двойными связями возможно 1,4-присоединение на примере реакции гидробромирования (присоединения НВr). Реакция протекает по механизму электрофильного присоединения и начинаетс я с присоединения электрофильной частицы, катиона водорода, к молекуле алкадиена:
![]()
Присоединение к этому карбокатиону иона Вr- приведёт к продукту 1,2-присоединения:
![]()
Положительный заряд на атоме углерода означает наличие незаполненной р-орбитали, которая может перекрываться с π-связью, перетягивая к себе электронную плотность. В результате этого происходит перемещение двойной связи в центр молекулы, а положительный заряд оказывается на крайнем атоме углерода. Присоединение к нему аниона брома приведёт к продукту 1,4-присоединения:

Источник: https://infopedia.su/1x21d3.html
Алкадиены
Алкадиены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С. Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда — пропадиен — CH2=C=CH2. Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкадиенов
Названия алкенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.

Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В зависимости от того, как чередуются двойные связи в молекуле алкадиена, они подразделяются на следующие типы:
- Кумулированные двойные связи
- В случае, если две двойные связи прилежат к одному и тому же атому углерода.
- Пример — пропадиен-1,2 (аллен) — CH2=C=CH2
- В молекуле аллена все атомы углерода находятся в состоянии sp2гибридизации.
- Сопряженные двойные связи
- Изолированные двойные связи
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).

Пример — бутадиен-1,3 — CH2=CH-CH=CH2
В случае, если две двойные связи разделены двумя и более одинарными связями.
Пример — пентадиен-1,4 — CH2=CH-CH2-CH=CH2
Получение алкадиенов
Алкадиены получают несколькими способами:
- Дегидрогалогенирование дигалогеналканов
- Синтез С.В. Лебедева
- Дегидрирование алканов
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты. Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода. 
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта. 2CH3-CH2-OH → (450 °C, кат. ZnO) CH2=CH-CH=CH2 + 2H2O + H2 Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно. 
В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора. 
Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны. Наличие сопряженных двойных связей увеличивает реакционную способность молекулы и обуславливает необычный механизм некоторых реакций.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь). 
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу. В случае, если двойные связи находятся в сопряжении, выход продуктов во многом зависит от температуры. Например, в ходе галогенирования бутадиена-1,3 при -80°C преимущественно получается продукт 1,2-присоединения, а при +60°C — продукт 1,4-присоединения. 
Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения. Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода. 
При горении алкадиены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. 2CH2=CH-CH=CH2 + 11O2 → 8CO2 + 6H2O
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров. Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера. 
Источник: https://studarium.ru/article/184
Алкины и алкадиены
Алкины также называют ненасыщенными углеводородами, так как присутствует одна тройная связь и характерны реакции присоединения.
Общая формула: CnH2n-2.
Гибридизация
Атомы углерода, участвующие в образовании тройной связи находятся в состоянии sp-гибридизации, остальные атомы углерода находятся в состоянии sp3-гибридизации.
Виды изомерии: изомерия цепи, изомерия положения тройной связи, межклассовая изомерия с алкадиенами.
Номенклатура
Название алкинов образуется из названия алкильного радикала с суффиксом -ин с указанием положения тройной связи.
Физические свойства
Физические свойства алкинов практически не отличаются от свойств соответствующих алканов и алкенов (С2–С4 – газы, С4–С16 – жидкости при нормальных условиях, далее – твердые вещества).
Температуры кипения алкинов несколько выше, чем у соответствующих алкенов (несмотря на несколько меньшую молекулярную массу).
Это также связано с большей полярностью связей, образованных sp-гибридизованными атомами углерода.
Химические свойства
По своим химическим свойствам алкины похожи на алкены. Для них также наиболее характерными являются реакции электрофильного присоединения. Для несимметричных алкинов, как и для алкенов, действует правило Марковникова.
Существенным отличием является меньшая реакционная способность тройных связей по сравнению с двойными.
Поскольку в результате присоединения обаразуется замещенный алкен (с более реакционно-способной связью), то при избытке присоединяющегося реагента реакция, как правило, идет дальше и образуется замещенный алкан:
 |
или |  |
| Алкин | Замещеный алкен | Замещеный алкан |
Гидрирование
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая p-связь), а затем алканов (разрывается вторая p-связь):
При использовании менее активного катализатора гидрирование останавливается на стадии образования алкенов.
Галогенирование
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая p-связь разрывается труднее, чем вторая). Алкины обесцвечивают бромную воду:
 |
| Ацетилен | 1,2-Дибромэтилен | 1,1,2,2-Тетробромэтилен |
Гидрогалогенирование
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова [7]:
 |
| Пропин | 2-Бромпропен | 2,2-Дибромпропан |
Гидрохлорирование
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида. Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
Гидратация (реакция Кучерова)
Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена) или в кетон (в случае других алкинов).
Полимеризация
1.Димеризация под действием водно-аммиачного раствора CuCl.
2.Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского).
- Возможно образование молекул, содержащих большее число звеньев ацетилена как циклического, так и линейного строения
- … –СН=СН–СН=СН–СН=СН–…
- (такие полимеры обладают полупроводниковыми свойствами).
- Следует также отметить, что высокомолекулярное вещество – карбин (третья аллотропная модификация углерода) – образуется не в результате полимеризации ацетилена, а при окислительной поликонденсации ацетилена в присутствии CuCl.
Получение
Получение алкинов чаще всего производится по следующим реакциям:
Алкины могут быть получены из соответствующих галогензамещенных алканов и алкенов.
 |
| 2,2-Дибромбутан | 2-Бромбутен-2 | Бутин-2 |
 |
| Бутен-1 | 1,2-Дибромбутан | Бутин-1 |
Применение
Ранее (а иногда и сейчас) ацетилен широко применялся для создания высокотемпературного пламени при газовой сварке. Сейчас на первый план вышло его применение для целей органического синтеза. Получение растворителей. При присоединении хлора к ацетилену получается тетрахлорэтан:
- СН≡СН+2Сl2 = СНСl2–СНСl2,
- а отщеплением от последнего молекулы хлороводорода – 1,1,2-трихлорэтен:
- СНСl2–СНСl2 = СНСl=ССl2+НСl.
Алкадиены
Алкадиены также называют ненасыщенными углеводородами, так как присутствуют две двойных связи.
Общая формула:CnH2n-2.
Гибридизация
Атомы углерода, участвующие в образовании двойных связей находятся в состоянии sp2-гибридизации, остальные атомы углерода находятся в состоянии sp3-гибридизации.
Виды изомерии: изомерия цепи, изомерия положения двойных связей, межклассовая изомерия с циклоалкенами и алкинами. В зависимости от взаимного расположения двойных связей выделяют следующие алкадиены:
1.С изолированными двойными связями. Разделены в цепи двумя или более s-связями: СН2=СН–СН2–СН=СН2.
Такие двойные связи не оказывают друг на друга взаимного влияния, так как разделенны sp3-атомами углерода, и вступают в те же реакции, что и двойная связь в алкенах. Таким образом, алкадиены этого типа проявляют химические свойства, характерные для алкенов.
2.С кумулированными двойными связями, которые расположены у одного атома углерода: СН2=С=СН2 (аллен).
Подобные диены (аллены) относятся к довольно редкому типу соединений.
3.С сопряженными двойными связями, которые разделены одной s-связью: СН2=СН–СН=СН2.
Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью 4-х sp2-атомов углерода.
Номенклатура
Название алкдиенов образуется из названия алкильного радикала с суффиксом -диен. После суффикса через запятую указывают наименьшие номера атомов углерода, участвующие в образовании двойных связей.
Физические свойства
Бутадиен – газообразное вещество (температура кипения – 4,5 °С), изопрен является жидкостью, кипящей при 34 °С, диметилбутадиен – также жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды полимеризуются в каучук. Натуральный каучук в очищенном состоянии – это полимер с общей формулой (С5Н8)n и получается из млечного сока некоторых тропических растений.
Химические свойства
Для алкадиенов, как и для других ненасыщенных углеводородов, наиболее характерны реакции присоединения с разрывом π-связи.

Так же как и для других углеводородов характерны реакции окисления.
Алкадиены хорошо подвергаются реакциям полимеризации. Важнейшими представителями для промышленно получаемых каучуков являются изопрен и бутадиен-1,3.
Применение
Широко используются в производстве синтетических каучуков и различных органических веществ отдельные представители этих диенов.
Источник: http://mmlab5.uginfo.sfedu.ru/tutorial/chapters/chapter4_1.html
Методическая разработка урока на тему "Алкадиены"
- Дата проведения_____________
- Урок № _______
- Тема: Алкадиены. Каучуки
- Цель урока:
- Формирование теоретического и практического обучения учащихся основам исследовательской деятельности по данной теме.
Задачи урока:
- Знать строение, виды изомерии, химические свойства применение алкадиенов.
- Уметь делать теоретический анализ, сравнивать, прогнозировать, обобщать, делать выводы.
Ход урока
- Организационный момент урока.
- Актуализация ранее полученных знаний
Вопросы:
1. С какими классами углеводородов вы познакомились к настоящему времени?
2. Какие вещества называются алканами, алкенами, алкинами?
3. Общая химическая формула алканов, алкенов, алкинов?
4. Какие виды изомерии характерны для этих классов углеводородов?
- Изученте нового материала
- Алкадиены – алифатически (ациклические), непредельные (ненасыщенные) углеводороды, с двумя двойными связями в цепи.
- Общая формула – CnH2n-2
- Строение:
- Атомы углерода в молекуле бутадиена-1,3 находятся в sp2 — гибридном состоянии, что означает расположение этих атомов в одной плоскости и наличие у каждого из них одной p — орбитали, занятой одним электроном и расположенной перпендикулярно к упомянутой плоскости.
p — Орбитали всех атомов углерода перекрываются друг с другом, т.е. не только между первым и вторым, третьим и четвертым атомами, но и также между вторым и третьим. Отсюда видно, что связь между вторым и третьим атомами углерода не является простой σ — связью, а обладает некоторой плотностью p — электронов, т.е.
слабым характером двойной связи. В молекуле отсутствуют в классическом понимании одинарные и двойные связи, а наблюдается делокализация p — электронов, т.е. равномерное распределение p — электронной плотности по всей молекуле с образованием единого p — электронного облака.
Взаимодействие двух или нескольких соседних p — связей с образованием единого p — электронного облака, в результате чего происходит передача взаимовлияния атомов в этой системе, называется эффектом сопряжения.
Таким образом, молекула бутадиена -1,3 характеризуется системой сопряженных двойных связей.
Такая особенность в строении диеновых углеводородов делает их способными присоединять различные реагенты не только к соседним углеродным атомам (1,2- присоединение), но и к двум концам сопряженной системы (1,4- присоединение) с образованием двойной связи между вторым и третьим углеродными атомами. Отметим, что очень часто продукт 1,4- присоединения является основным.
|
Классификация алкадиенов:
В зависимости от взаимного расположения двойных связей диены подразделяются на три типа:
1) углеводороды с кумулированными двойными связями, т.е. примыкающими к одному атому углерода.
Например, пропадиен или аллен CH2=C=CH2
2) углеводороды с изолированными двойными связями, т.е разделенными двумя и более простыми связями.
Например, пентадиен -1,4 CH2=CH–CH2–CH=CH2
3) углеводороды с сопряженными двойными связями, т.е. разделенными одной простой связью.
Например, бутадиен -1,3 или дивинил CH2=CH–CH=CH2Наибольший интерес представляют углеводороды с сопряженными двойными связями.
Физические свойства:
Бутадиен -1,3 – легко сжижающийся газ с неприятным запахом, t°пл.= -108,9°C, t°кип.= -4,5°C; растворяется в эфире, бензоле, не растворяется в воде.2- Метилбутадиен -1,3 (изопрен) – летучая жидкость, t°пл.= -146°C, t°кип.= 34,1°C; растворяется в большинстве углеводородных растворителях, эфире, спирте, не растворяется в воде.
- Изомерия сопряженных диенов
- Структурная изомерия
- 1. Изомерия положения сопряженных двойных связей:
![]()
2. Изомерия углеродного скелета:

3. Межклассовая изомерия с алкинами и циклоалкенами.
Например, формуле С4Н6 соответствуют следующие соединения:

- Пространственная изомерия
- Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис—транс-изомерию.
- Получение диеновых углеводородов CnH2n-2
| В промышленности |
|
|
Дегидратация и дегидрирование этанола: (р. Лебедева) Каталитический способ получения бутадиена-1,3 из этанола был открыт в 1932 г. Сергеем Васильевичем Лебедевым. По способу Лебедева бутадиен-1,3 получается в результате одновременного дегидрирования и дегидратации этанола в присутствии катализаторов на основе ZnO и Al2O3: 2CH3-CH2-OH t=425,ZnO,Al2O3→ CH2=CH-CH=CH2 + H2 + 2H2O 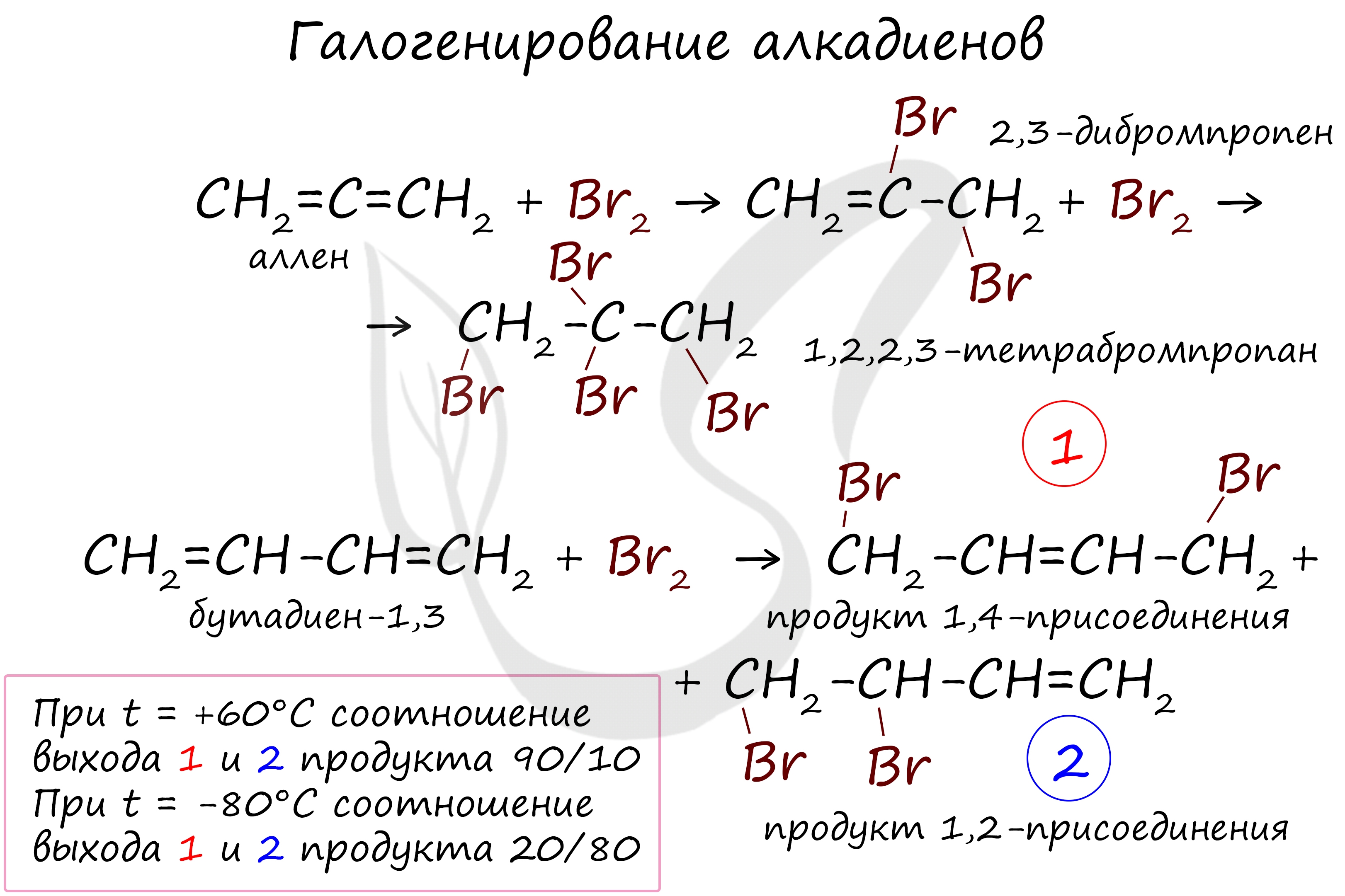 |
Химические свойства диеновых углеводородов CnH2n-2
(характерны реакции горения, присоединения, обесцвечивают водный раствор перманганата калия и бромную воду)
| Реакции присоединения (+Г2; +НГ; +Н2; +НОН) |
Галогенирование: (образуется смесь продуктов) а) 1,2-присоединение  б) 1,4-присоединение (преимущественно) б) 1,4-присоединение (преимущественно)  в) Галогенирование достаточным количеством галогена: в) Галогенирование достаточным количеством галогена:  |
|
- Применение
- Диеновые углеводороды в основном применяются для синтеза каучуков:
- Натуральный и синтетический каучуки
- Натуральный каучук получают из млечного сока (латекса) каучуконосного дерева гевеи, растущего в тропических лесах Бразилии.
- При нагревании без доступа воздуха каучук распадается с образованием диенового углеводорода – 2- метилбутадиена-1,3 или изопрена. Каучук – это стереорегулярный полимер, в котором молекулы изопрена соединены друг с другом по схеме 1,4- присоединения с цис- конфигурацией полимерной цепи:
- Стереорегулярное строение каучука
Молекулярная масса натурального каучука колеблется в пределах от 7.104 до 2,5.106.
транс — Полимер изопрена также встречается в природе в виде гуттаперчи.
Натуральный каучук обладает уникальным комплексом свойств: высокой текучестью, устойчивостью к износу, клейкостью, водо- и газонепроницаемостью.
Для придания каучуку необходимых физико-механических свойств: прочности, эластичности, стойкости к действию растворителей и агрессивных химических сред – каучук подвергают вулканизации нагреванием до 130-140°С с серой.
В упрощенном виде процесс вулканизации каучука можно представить следующим образом:
Атомы серы присоединяются по месту разрыва некоторых двойных связей и линейные молекулы каучука «сшиваются» в более крупные трехмерные молекулы – получаетсярезина, которая по прочности значительно превосходит невулканизированный каучук. Наполненные активной сажей каучуки в виде резин используют для изготовления автомобильных шин и других резиновых изделий. Строение резины.
В 1932 году С.В.Лебедев разработал способ синтеза синтетического каучука на основе бутадиена, получаемого из спирта.
И лишь в пятидесятые годы отечественные ученые осуществили каталитическую стереополимеризацию диеновых углеводородов и получили стереорегулярный каучук, близкий по свойствам к натуральному каучуку.
В настоящее время в промышленности выпускают каучук, в котором содержание звеньев изопрена, соединенных в положении 1,4, достигает 99%, тогда как в натуральном каучуке они составляют 98%.
Кроме того, в промышленности получают синтетические каучуки на основе других мономеров – например, изобутилена, хлоропрена, и натуральный каучук утратил свое монопольное положение.Для вулканизации каучука берётся немного серы 2 – 3 % от общей массы. Если добавить к каучуку более 30 % серы, то она присоединится по линии разрыва почти всех π – связей и образуется жёсткий материал – эбонит.
- 1. Диеновые углеводороды имеют формулу:
- а) СnН2n + 2; б) СnС2n; в) СnНn; г) СnН2n – 2
- 2. Кратные связи в углеводороде:
- СН2 = СН – СН = СН – СН3 называются
- а) кумулированные.
- б) сопряженные.
- в) изолированные.
- 3. Укажите тип гибридизации атомов углерода в веществе:
- СН2 = С = СН – СН3
- Домашнее задание: записи в тетради по данной теме.
Источник: https://multiurok.ru/files/mietodichieskaia-razrabotka-uroka-60.html
Строение алкадиенов
Алкадиены – это ненасыщенные органические соединения, в углеродной цепи которых содержатся две двойные связи. Рассмотрим строение алкадиенов, способы расположения двойных связей.
Общая молекулярная формула нециклических алкадиенов — CnH2n-2, циклических алкенов — CnH2n-4 где n равняется любому целому числу, больше трех.
Расположение двойных связей
Двойные связи в алкадиенах могут располагаться несколькими способами:
- Двойные связи примыкают к одному атому углерода – кумулированные связи:
- между двумя двойными связями расположена одна одинарная связь —сопряженные связи:

- двойные связи разделены двумя или более одинарными связями —изолированные связи:

Электронное строение алкадиенов
- А алкадиенах одна s- и 2 р-орбитали атомов углерода при двойной связи находятся в состоянии sp2-гибридизации. Еще одна р-орбиталь – негибридизованная:

- Рассмотрим в качестве примера строение 1,3-бутадиена (дивинила):

Гибридизованные орбитали соединяясь образуют сигма связи (σ), которые располагаются с одной плоскости. Негибридизованные орбитали лежат за пределами этой плоскости, перпендикулярно к ней. При этом происходит перекрывание всех соседних негибридных орбиталей и образование общего π-электронного облака. Длина связи между атомами углерода С1-С2 и С3-С4 составляет 1,37 Å, С2-С3 – 1,46 Å. Для сравнения длина одинарной связи С-С в алканах составляет 1,54 Å, двойной С=С в алкенах – 1,32 Å.

Изомерия и номенклатура алкадиенов
Для алкадиенов также как и для алкенов характерна изомерия структурная (изомерия углеродного скелета, положения кратных связей и заместителей, межклассовая) и геометрическая (цис-, транс-, Z-, E-).
Согласно правилам номенклатуры ИЮПАК названия алкадиенов строятся следующим образом:
- выбирают самую длинную углеродную цепь, включающую обе двойные связи
- нумерацию цепи начинают с ближнего к двойной связи конца
- называют аналогично алканам, заменяя окончание -ан на -диен
- вначале указывают положение заместителей, а в конце – положение двойных связей
Также для некоторых алкадиенов приняты тривиальные названия:

Источник: http://zadachi-po-khimii.ru/organic-chemistry/stroenie-alkadienov.html
Диены — номенклатура, получение, характерные химические свойства
Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnH2n-2.
- Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах:
- 1) изолированные двойные связи разделены в цепи двумя или более s-связями:
- СН2=СН–СН2–СН=СН2 (разделенные sp3-атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах);
- 2) кумулированные двойные связи расположены у одного атома углерода:
- СН2=С=СН2 (подобные диены (аллены) менее стабильны, чем другие диены и при нагревании в щелочной среде перегруппировываются в алкины);
- 3) сопряженные двойные связи разделены одной s-связью:
- СН2=СН–СН=СН2.
Сопряженные диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех sp2-атомов углерода.
Все атомы углерода лежат в одной плоскости, образуя s-скелет. Негибридизованные р-орбитали каждого атома углерода перпендикулярны плоскости s-скелета и параллельны друг другу, взаимно перекрываются, образуя единое p-электронное облако.
Такой особый вид взаимного влияния атомов называется сопряжением.

Перекрывание р-орбиталей молекулы бутадиена имеет место не только между С1 – С2, С3 – С4, но и между С2 – С3. В связи с этим применяют термин: «сопряженная система».
Следствием делокализации электронной плотности является то, что длины связей С1 – С2 (С3 – С4) увеличены, по сравнению с длиной двойной связи в этилене (0,132 нм) и составляют 0,137 нм; в свою очередь, длина связи С3 – С4 меньше, чем в этане С – С (0,154 нм) и составляет 0,146 нм. Диены с сопряженной системой двойных связей более энергетически выгодны.
Номенклатура алкадиенов
По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода) с добавлением окончания –диен.
- Виды изомерии алкадиенов:
- Структурная изомерия:
- 1) изомерия положения сопряженных двойных связей;
- 2) изомерия углеродного скелета;
- 3) межклассовая (изомерны алкинам)
- Пространственная изомерия — диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию.
Способы получения алкадиенов

Химические свойства алкадиенов

Для сопряженных диенов характерны реакции присоединения (реакции 1, 2). Наличие сопряженной системы p-электронов приводит к особенностям реакций присоединения.
Сопряженные диены способны присоединять не только по двойным связям (С1 и С2, С3 и С4), но и к концевым (С1 и С4) атомам углерода сообразованием двойной связи между С2 и С3.
Соотношение продуктов 1,2- и 1,4-присоединения зависит от температуры, при которой проводился эксперимент и от полярности применяемого растворителя.
Восстановление (реакция 3) с помощью [Na + C2H5OH] называется восстановлением водородом в момент выделения (при взаимодействии натрия и спирта выделяется водород). Алкены в таких условиях не восстанавливаются, это отличительное свойство сопряженных диенов.
Полимеризация (реакция 4) важнейшее свойство сопряженных диенов, которая происходит под действием различных катализаторов (AlCl3, TiCl4+(C2H5)3Al) или света. В случае применения определенных катализаторов можно получить продукт полимеризации с определенной конфигурацией цепей.
Цис-конфигурацию имеет натуральный каучук. Макромолекулы натурального каучука имеют спиралевидную структуру цепи из-за того, что изопреновые звенья изогнуты, что создает пространственные препятствия упорядоченному расположению цепей.
В каучуке длинные молекулы скручены в спутаны друг с другом в спирали. При растяжении каучука спирали растягиваются, а при снятии напряжения они снова скручиваются. В природе существует еще другой полимер изопрена гуттаперча (транс-конфигурация).
Гуттаперча обладает стержнеобразной структурой цепи из-за выпрямленности изопреновых звеньев (цепи с транс-конфигурацией двойных связей могут располагаться одна вдоль другой), поэтому гуттаперча твердый, но хрупкий полимер.
Натуральный каучук имеют немногие страны и поэтому его заменяют синтетическими каучуками из дивинила, а также из изопрена.


- Для практического использования каучуки превращают в резину.
Резина – это вулканизованный каучук с наполнителем (сажа). Суть процесса вулканизации заключается в том, что нагревание смеси каучука и серы приводит к образованию трехмерной сетчатой структуры из линейных макромолекул каучука, придавая ему повышенную прочность. Атомы серы присоединяются по двойным связям макромолекул и образуют между ними сшивающие дисульфидные мостики.
Сетчатый полимер более прочен и проявляет повышенную упругость – высокоэластичность (способность к высоким обратимым деформациям).
В зависимости от количества сшивающего агента (серы) можно получать сетки с различной частотой сшивки. Предельно сшитый натуральный каучук – эбонит – не обладает эластичностью и представляет собой твердый материал.
Источник: http://himege.ru/dieny-nomenklatura-poluchenie-xarakternye-ximicheskie-svojstva/
Строение, номенклатура и изомерия алкадиенов
- Алкадиены – алифатически (ациклические), непредельные (ненасыщенные) углеводороды, с двумя двойными связями в цепи.
- Общая формула – CnH2n-2
- Строение:
- Атомы углерода в молекуле бутадиена-1,3 находятся в sp2 — гибридном состоянии, что означает расположение этих атомов в одной плоскости и наличие у каждого из них одной p — орбитали, занятой одним электроном и расположенной перпендикулярно к упомянутой плоскости.
 a) |
б)  |
| Схематическое изображение строения молекул бутадиена -1,3 (а) и вид модели сверху (б). Перекрывание электронных облаков между С1–С2 и С3–С4 больше, чем между С2–С3. |
p — Орбитали всех атомов углерода перекрываются друг с другом, т.е. не только между первым и вторым, третьим и четвертым атомами, но и также между вторым и третьим. Отсюда видно, что связь между вторым и третьим атомами углерода не является простой σ — связью, а обладает некоторой плотностью p — электронов, т.е.
слабым характером двойной связи. В молекуле отсутствуют в классическом понимании одинарные и двойные связи, а наблюдается делокализация p — электронов, т.е. равномерное распределение p — электронной плотности по всей молекуле с образованием единого p — электронного облака.
Взаимодействие двух или нескольких соседних p — связей с образованием единого p — электронного облака, в результате чего происходит передача взаимовлияния атомов в этой системе, называется эффектом сопряжения. Таким образом, молекула бутадиена -1,3 характеризуется системой сопряженных двойных связей.
Такая особенность в строении диеновых углеводородов делает их способными присоединять различные реагенты не только к соседним углеродным атомам (1,2- присоединение), но и к двум концам сопряженной системы (1,4- присоединение) с образованием двойной связи между вторым и третьим углеродными атомами.
Отметим, что очень часто продукт 1,4- присоединения является основным.


Источник: http://www.yoursystemeducation.com/stroenie-nomenklatura-i-izomeriya-alkadienov/
Алкадиены
Ненасыщенные углеводороды, содержащие две двойные связи, называются алкадиенами или диеновыми углеводородами («ди» означает «два»). Общая формула алкадиенов – CnH2n-2.

Диены образуют гомологический ряд пропандиена. Это простейший представитель алкадиенов. Названия гомологов согласно номенклатуре ИЮПАК составляются из греческого числительного и суффикса «диен». Например, пентадиен, бутадиен, гексадиен.
Ряд гомологов С3-С10:
- пропадиен (С3Н4);
- бутадиен (С4Н6);
- пентадиен (С5Н8);
- гексадиен (С6Н10);
- гептадиен (С7Н12);
- октадиен (С8Н14);
- нонадиен (С9Н16);
- декадиен (С10Н18).
Для диенов, начиная с пентадиена, характерна пространственная и структурная изомерия. Например, пентадиен-1,3 с переносом метильной группы ко второму атому углерода превращается в 2-метилбутадиен-1,3 или изопрен.
Рис. 1. Изомеры диенов.
В зависимости от расположения двойных связей друг к другу в углеродном скелете выделяют три вида диеновых углеводородов.
| Вид | Описание | Пример |
| Кумулированные | Двойные связи располагаются у одного атома углерода. Такие соединения называются алленами. Простейший аллен – пропадиен, содержащий три атома углерода | СН2=С=СН2 |
| Сопряжённые | Двойные связи разделены одной одинарной связью. Простейший представитель – бутадиен | CH2=CH-CH=CH2 |
| Изолированные | Двойные связи разделены несколькими простыми связями. Простейший представитель – пентадиен | CH2=CH-CH2-CH=CH2 |
Сопряжённые диены отличаются электронным строением. Атомы углерода в таких соединениях находятся в состоянии sp2-гибридизации и образуют единое р-облако за счёт сопряжения двух двойных связей. Такой тип сопряжения называется π,π-сопряжение.
Рис. 2. Электронное строение бутадиена.
Диеновые углеводороды получают несколькими способами:
- методом Лебедева из этанола (получение бутадиена):
2СН3-СН2-ОН → СН2=СН-СН=СН2 + 2H2O + Н2; - дегидрированием из нефтепродуктов:
СН3-СН2-СН2-СН3 → CH2=CH-СН=СН2 + 2Н2; - дегидрогалогенированием галогеналканов:
CH2Br-CH2-CH2-CH2Br + 2KOH → CH2=CH-CH=CH2 + 2KBr + 2H2O.
При обычных условиях алкадиены имеют аналогичные с алкенами физические свойства. Простейшие представители ряда алкадиенов – пропадиен и бутадиен – бесцветные легко сжижаемые газы с неприятным запахом. Алкадиены, содержащие от пяти до 17 атомов углерода, а также их изомеры, являются жидкостями. Высшие диены с 18 и более атомами углерода – твёрдые вещества.
Температуры плавления и кипения, а также плотность увеличиваются с увеличением молекулярной массы. При этом разветвлённые изомеры плавятся и кипят при более низких температурах, чем линейные аналоги.
Диены распространены в природе в виде растительных пигментов, гуттаперчи, каучука, холестерина.
Реакционная способность обусловлена определением положения двойной связи в молекуле диена. Атомы присоединяются в местах разрыва двойных связей, образуя 1,4-, 1,2-, 1,3-присоединение и т.д. В результате одних и тех же реакций образуются разные структурные соединения. Основные свойства диеновых углеводородов представлены в таблице.
| Реакция | Описание | Уравнение |
| Гидрирование | Реакция протекает в присутствии катализатора – никеля | CH2=CH-CH=CH2 + 2H2 → CH3-CH2-CH2-CH3 |
| Галогенирование | Присоединение галогенов с образованием тетрагалогеноалканов | CH2=CH-CH=CH2 + Br2 → CH2(Br)-CH(Br)-CH=CH2 или CH2(Br)-CH=CH-CH2-Br |
| Гидрогалогенирование | Присоединение галогеноводородов аналогично реакции с алканами. Реакция протекает в водной или спиртовой среде в присутствии хлорида лития | CH2=CH-CH=CH2 +HBr → CH3-CH(Br)-CH=CH2 или CH3-CH=CH-CH2-Br |
| Полимеризация | Реакция используется для получения искусственного каучука | nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n |
Рис. 3. Искусственный каучук.
Из урока химии 10 класса узнали, что такое алкадиены или диеновые углеводороды. Диены отличаются от других классов ненасыщенных углеводородов наличием двух двойных связей, которые могут располагаться у одного атома углерода, через одинарную связь или через несколько простых связей.
Гомологический ряд образует пропадиен. Простейшие диены – пропадиен и бутадиен – газы, диены С5-С17 – жидкости, высшие диены – твёрдые соединения. Начиная с пентадиена, диеновые углеводороды имеют изомеры.
Соединения реагируют с галогенами, водородом, галогеноводородами, а также образуют полимеры.
Средняя оценка: 3.9. Всего получено оценок: 205.
Источник: https://obrazovaka.ru/himiya/alkadieny-obschaya-formula-10-klass.html





