Углекислый газ, или диоксид углерода, или CO2 — одно из самых распространенных на Земле газообразных веществ. Он окружает нас в течение всей нашей жизни. Углекислый газ не имеет цвета, вкуса и запаха и никак не ощущается человеком.

Углекислый газ
Он является важным участником обмена веществ живых организмов. Газ сам по себе не ядовит, но не поддерживает дыхание, поэтому превышение его концентрации ведет к ухудшению снабжения тканей организма кислородом и к удушью. Углекислый газ широко применяется в быту и в промышленности.
Что такое диоксид углерода
При атмосферном давлении и комнатной температуре диоксид углерода находится в газообразном состоянии. Это наиболее часто встречающаяся его форма, в ней он участвует в процессах дыхания, фотосинтеза и обмена веществ живых организмов.

Диоксид углерода
При охлаждении до -78 °С он, минуя жидкую фазу, кристаллизуется и образует так называемый «сухой лед», широко применяемый как безопасный хладагент в пищевой и химической промышленности и в уличной торговле и рефрижераторных перевозках.
При особых условиях — давлении в десятки атмосфер — углекислота переходит в жидкое агрегатное состояние. Это происходит на морском дне, на глубине свыше 600 м.
Свойства углекислого газа
В 17 веке Жан-Батист Ван Гельмонт из Фландрии открыл углекислый газ и определил его формулу. Подробное исследование и описание было сделано столетие спустя шотландцем Джозефом Блэком. Он исследовал свойства углекислого газа и провел серию опытов, в которых доказал, что он выделяется при дыхании животных.
В состав молекулы вещества входит один атом углерода и два атома кислорода. Химическая формула углекислого газа записывается как CO2
В нормальных условиях не обладает вкусом, цветом и запахом. Только вдыхая большое его количество, человек ощущает кислый привкус. Его дает угольная кислота, образующаяся в малых дозах при растворении углекислого газа в слюне.
Эта особенность применяется для приготовления газированных напитков.
Пузырьки в шампанском, просекко, пиве и лимонаде — это и есть углекислый газ, образовавшийся в результате естественных процессов брожения или добавленный в напиток искусственно.

Физические свойства углекислого газа
Плотность углекислого газа больше плотности воздуха, поэтому при отсутствии вентиляции он скапливается внизу. Он не поддерживает окислительные процессы, такие, как дыхание и горение.
Поэтому углекислоту применяют в огнетушителях. Это свойство углекислого газа иллюстрируют с помощью фокуса — горящую свечу опускают в «пустой» стакан, где она и гаснет. В действительности стакан заполнен CO2.
К таким источникам относятся окислительные процессы разной интенсивности:
- Дыхание живых организмов. Из школьного курса химии и ботаники все помнят, что в ходе фотосинтеза растения поглощают углекислый газ и выделяют кислород. Но не все помнят, что это происходит только днем, при достаточном уровне освещения. В темное время суток растения наоборот, поглощают кислород и выделяют углекислый газ. Так что попытка улучшить качество воздуха в комнате, превращая ее в заросли фикусов и герани может сыграть злую шутку.
- Извержения и другая вулканическая активность. CO2 выбрасывается из глубин мантии Земли вместе с вулканическими газами. В долинах рядом с источниками извержений газа настолько много, что, скапливаясь в низинах, он вызывает удушье животных и даже людей. Известны несколько случаев в Африке, когда задыхались целые деревни.
- Горение и гниение органики. Горение и гниение — это одна и та же реакция окисления, но протекающая с разной скоростью. Богатые углеродом разлагающиеся органические остатки растений и животных, лесные пожары и тлеющие торфяники — все это источники диоксида углерода.
- Самым же большим природным хранилищем CO2 являются воды мирового океана, в которых он растворен.

Углекислый газ в природе
За миллионы лет эволюции основанной на углеродных соединениях жизни на Земле в различных источниках накопились многие миллиарды тонн углекислого газа. Его одномоментный выброс в атмосферу приведет к гибели всего живого на планете из-за невозможности дыхания. Хорошо, что вероятность такого одномоментного выброса стремится к нулю.
Углекислый газ попадает в атмосферу и в результате человеческой жизнедеятельности. Самыми активными источниками в наше время считаются:
- Индустриальные выбросы, происходящие в ходе сгорания топлива на электростанциях и в технологических установках
- Выхлопные газы двигателей внутреннего сгорания транспортных средств: автомобилей, поездов, самолетов и судов.
- Сельскохозяйственные отходы — гниение навоза в больших животноводческих комплексах
Кроме прямых выбросов, существует и косвенное воздействие человека на содержание CO2 в атмосфере. Это массовая вырубка лесов в тропической и субтропической зоне, прежде всего в бассейне Амазонки.

Искусственный источник углекислого газа
Несмотря на то, что в атмосфере Земли содержится менее процента диоксида углерода, он оказывает все возрастающее действие на климат и природные явления.
Углекислый газ участвует в создании так называемого парникового эффекта путем поглощения теплового излучения планеты и удерживания этого тепла в атмосфере.
Это ведет к постепенному, но весьма угрожающему повышению среднегодовой температуры планеты, таянию горных ледников и полярных ледяных шапок, росту уровня мирового океана, затоплению прибрежных регионов и ухудшению климата в далеких от моря странах.
- Знаменательно, что на фоне общего потепления на планете происходит значительное перераспределение воздушных масс и морских течений, и в отдельных регионах среднегодовая температура не повышается, а понижается. Это дает козыри в руки критикам теории глобального потепления, обвиняющим ее сторонников в подтасовке фактов и манипуляции общественным мнением в угоду определенным политическим центрам влияния и финансово-экономическим интересам
Человечество пытается взять под контроль содержание углекислого газа в воздухе, были подписаны Киотский и Парижский протоколы, накладывающие на национальные экономики определенные обязательства.
Кроме того, многие ведущие автопроизводители автомобилей объявили о сворачивании к 2020-25 годам выпуска моделей с двигателями внутреннего сгорания и переходе на гибриды и электромобили.
Однако некоторые ведущие экономики мира, такие, как Китай и США, не торопятся выполнять старые и брать на себя новые обязательства, мотивируя это угрозой уровню жизни в своих странах.
Углекислый газ и мы: чем опасен CO2
Углекислый газ — один из продуктов обмена веществ в организме человека. Он играет большую роль в управлении дыханием и снабжением кровью органов.
Рост содержания CO2 в крови вызывает расширение сосудов, способных таким образом транспортировать больше кислорода к тканям и органам. Аналогично и система дыхания понуждается к большей активности, если концентрация углекислоты в организме растет.
Это свойство используют в аппаратах искусственной вентиляции легких, чтобы подстегнуть собственные органы дыхания пациента к большей активности.
Кроме упомянутой пользы, превышение концентрации СO2 может принести организму и вред. Повышенное содержание во вдыхаемом воздухе приводит к тошноте, головной боли, удушью и даже к потере сознания. Организм протестует против углекислого газа и подает человеку сигналы.
При дальнейшем увеличении концентрации развивается кислородное голодание, или гипоксия. Co2 мешает кислороду присоединяться к молекулам гемоглобина, которые и осуществляют перемещение связанных газов по кровеносной системе.
Кислородное голодание ведет к снижению работоспособности, ослаблению реакции и способностей к анализу ситуации и принятию решений, апатии и может привести к смерти.

Общие симптомы отравления углекислым газом
Такие концентрации углекислого газа, к сожалению, достижимы не только в тесных шахтах, но и в плохо проветриваемых школьных классах, концертных залах, офисных помещениях и транспортных средствах — везде, где в замкнутом пространстве без достаточного воздухообмена с окружающей средой скапливается большое количество людей.
Основное применение
CO2 широко применяется в промышленности и в быту – в огнетушителях и для изготовления газировки, для охлаждения продуктов и для создания инертной среды при сварке.
Основное применение углекислого газа
Применение углекислого газа отмечено в таких отраслях, как:
- для чистки поверхностей сухим льдом.
Фармацевтика
- для химического синтеза компонентов лекарственных средств;
- создания инертной атмосферы;
- нормализация индекса pH отходов производства.

Углекислый газ в фармацевтике
Пищевая отрасль
- производство газированных напитков;
- упаковка продуктов питания в инертной атмосфере для продления срока годности;
- декаффеинизация кофейных зерен;
- замораживание или охлаждение продуктов.

Углекислый газ в пищевой отрасли
Медицина, анализы и экология
- Создание защитной атмосферы при полостных операциях.
- Включение в дыхательные смеси в качестве стимулятора дыхания.
- В хроматографических анализах.
- Поддержание уровня pH в жидких отходах производства.

Углекислый газ и экология
Электроника
- Охлаждение электронных компонентов и устройств при тестировании на температурную стойкость.
- Абразивная очистка в микроэлектронике (в твердой фазе).
- Очищающее средство в производстве кремниевых кристаллов.
Химическая отрасль
Широко применяется в химическом синтезе в качестве реагента и в качестве регулятора температур в реакторе. CO2 отлично подходит для обеззараживания жидких отходов с низким индексом pH.
Использование углекислого газа
Применяется также для осушения полимерных веществ, растительных или животных фиброматериалов, в целлюлозном производстве для нормализации уровня pH как компонентов основного процесса, так и его отходов.
Металлургическая отрасль
В металлургии CO2 в основном служит делу экологии, защиты природы от вредных выбросов путем их нейтрализации:
Применение углекислого газа в металлургии
- В черной металлургии — для нейтрализации плавильных газов и для донного перемешивания расплава.
- В цветной металлургии при производстве свинца, меди, никеля и цинка — для нейтрализации газов при транспортировке ковша с расплавом или горячих слитков.
- В качестве восстановительного агента при организации оборота кислотных шахтных вод.
Сварка в углекислой среде
Процесс сварки с применением углекислого газа
Разновидность сварки под флюсом является сварка в углекислой среде. Операции сварочных работ с углекислым газом осуществляется плавящимся электродом и распространен в процессе монтажных работ, устранении дефектов и исправления деталей с тонкими стенками.
Источник: https://stankiexpert.ru/spravochnik/svarka/uglekislyjj-gaz.html
Химические свойства углекислого газа, реакции с другими веществами
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + H2O ↔ CO2 × H2O (растворение) ↔ Н2СО3
Диоксид углерода + вода ↔ угольная кислота
 Молекула угольной кислоты
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2NH3 + CO2 + H2O = NH4HCO3
Аммиак + углекислота = гидрокарбонат аммония

Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2NH3 + СО2 → (NH2)2СО + H2O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Zn + CO2 → ZnO + CO

Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + H2O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
CH4 + 2O2 → CO2 + 2H2O + 891кДж

Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6H2O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
C2H5OH + 3O2 = 3H2O + 2CO2 + Q

Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + H2O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Ca(OH)2 + CO2 → CaCO3 + H2O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
8) В зелёных растениях играет важную роль в процессе фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2

Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + H2O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород
 Колба с пероксидом натрия
Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + H2O → CO2 + H2O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + H2O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Источник: https://UglekislyGaz.ru/dioksid-ugleroda/himicheskie-svojstva-co2/
Углекислый газ: применение, технические характеристики и способы промышленного производства
Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения. Кроме этого, различные газы используются для получения определённых физических явлений и свойств. Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Что такое углекислый газ
Оксид углерода (IV) представляет собой тяжёлый газ. Плотность углекислоты примерно в полтора раза больше чем у атмосферного воздуха.
Несмотря на то, что этот газ уже при температуре минус 78,3 градуса Цельсия превращается в снегообразную массу, получить жидкую углекислоту при нормальном давлении не представляется возможным. Так называемый сухой лёд при малейшем повышении температуры сразу переходит из твёрдой, в газообразную форму.
Получить жидкую углекислоту можно только при давлении более 60 атмосфер. В таких условиях газ конденсируется даже при комнатной температуре с образованием бесцветной жидкости.
Углекислый газ не окисляется, но может поддерживать горение некоторых металлов. В среде углекислоты, при определённых условиях, могут возгораться такие активные элементы как магний, кальций и барий.
Этот газ хорошо растворим в воде, а в воздухе его содержится большое количество благодаря дыханию живых организмов и растений, наличию вулканической активности на земле, а также в результате сгорания органических веществ.
В результате растворения СО2 в воде в большой концентрации образуется угольная кислота. Это вещество может вступать в реакцию с фенолом и магнийорганическими соединениями. Углекислый газ также реагирует с щелочами. В результате такой реакции образуются соли и эфиры угольной кислоты.
Свойства углекислого газа
При большой концентрации углекислоты во вдыхаемом воздухе может наступить отравление. Признаками негативного воздействия СО2 на организм человека являются:
- Шум и гул в ушах.
- Обильный холодный пот.
- Потеря сознания.
Учитывая тот факт, что углекислый газ тяжелее воздуха, его концентрация в нижней части помещения будет более значительной.
По этой причине, первую очередь симптомы отравления могут наблюдаться у животных и детей, а также у взрослых очень маленького роста. Большая концентрация СО2 может привести к гибели людей.
При потере сознания человек может оказаться на полу, где количество кислорода будет недостаточным для поддержания нормального процесса дыхания.
Углекислый газ: получение в промышленности

Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.
- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.
- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Применение углекислого газа
Благодаря наличию определённых физических и химических свойств углекислый газ может использоваться в различных сферах. В химической промышленности углекислота используется для:
- Синтеза искусственных химических соединений.
- Для очистки животной и растительной ткани.
- Регулирования температуры реакций.
- Нейтрализации щёлочи.
В металлургии CO2 применяется с целью:
- Регулирования отвода воды в шахтах.
- Создания лазерного луча для резки металлов.
- Осаждения вредных газообразных веществ.
Кроме перечисленных областей углекислый газ активно используется при производстве бумаги. Оксид углерода применяется регулирования водородного показателя древесной массы, а также усиления мощности производственных машин.
Углекислый газ используется в пищевой промышленности в качестве добавки, которая оказывает консервирующее действие. При изготовлении выпечки СО2 применяется в качестве разрыхлителя. Газированные напитки также изготавливаются с применением углекислоты, а для хранения быстро портящихся продуктов используется «сухой лёд».
Незаменим углекислый газ и при выращивании овощей и фруктов в зимних теплицах. В таких помещения в воздухе недостаточное количество СО2, который необходим для «дыхания» растений, поэтому приходится искусственно насыщать атмосферу этим газом.
В медицине углекислота применяется во время проведения сложных операций на внутренних органах. Наиболее ценным качеством этого газа, является использование его для реанимационных мероприятий, ведь благодаря возможности повысить его концентрацию можно эффективно стимулировать процесс дыхания пациента.
При сварке металлов углекислота применяется в качестве инертного облака, которое служит защитой расплавленного участка от попадания в него активного кислорода. В результате такой обработки сварочный шов получается идеально ровным и не подверженным окислению.
Благодаря способности охлаждаться при испарении, СО2 используется для тушения пожаров. Заправленные этим веществом огнетушители являются эффективным средством борьбы с возгораниями на объектах, где применение порошковых или пенных средств тушения невозможно.
В быту углекислота используется в качестве напорного газа в пневматическом оружии, а также для отпугивания комаров и борьбы с грызунами.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.
- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов.
При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом.
Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
Источник: https://ballonis.ru/stati/uglekislyy-gaz-harakteristiki-i-primenenie
Cвойства углекислого газа
Применение углекислого газа в сварочной области является очень распространенной. Это один из основных вариантов, которые применяются для различных видов соединения металла.
Физические свойства углекислого газа определяют его как универсальную субстанцию для газовой сварки, соединения газовой и электродуговой и так далее. Это относительно недорогое сырье, которое используется здесь на протяжении многих лет.
Есть более эффективные варианты, но именно углекислота применяется чаще всего. Она находит применение как для обучения, так и для выполнения самых простых процедур.
Углекислота еще носит название диоксид углерода. Вещество не обладает запахом и бесцветно в обыкновенном состоянии. При нормальном атмосферном давлении, углекислота не состоит в жидком состоянии и из твердого сразу переходит в газообразное.
Область применения углекислого газа
Химическое вещество используется не только для сварки. Физические свойства углекислого газа позволяют применять его как разрыхлитель или консервант в пищевой промышленности. Во многих системах пожаротушения, в частности в ручных огнетушителях. Его применяют для обеспечения питания аквариумных растений. Практически все газированные напитки содержат углекислый газ.
В сварочной сфере применение чистой углекислоты является не совсем безопасным для металла. Дело в том, что при воздействии высокой температуры он распадается и из него выделяется кислород. В свою очередь, кислород является опасным для сварочной ванны и чтобы ликвидировать его негативное воздействие, применяют разнообразные раскислители, такие как кремний и марганец.
Применение углекислоты встречается еще и в баллонах для пневматических пистолетов и винтовок. Как и в сварочных баллонах, углекислота здесь хранится в сжиженном состоянии под давлением.

Баллон с углекислотой для сварки
Химическая формула
Химические свойства углекислого газа, а также его другие характеристики, напрямую зависят от элементов, которые входят в состав формулы. Формула углекислого газа в химии имеет вид CO2. Это означает, что углекислота содержит в себе один атом углерода и два атома кислорода.
Химические и физические свойства
Рассмотрев, как обозначается химических газ в химии, стоит более внимательно рассмотреть его свойства. Физические свойства углекислого газа проявляются в различных параметрах.
Плотность углекислого газа при стандартных атмосферных условиях составляет 1,98 кг/м3. Это делает его в 1,5 раза тяжелее, чем воздух в атмосфере. Диоксид углерода не имеет запаха и цвета.
Если его подвергнуть сильному охлаждению, то он начинает кристаллизоваться в так называемый «сухой лед». Температура сублимации достигает -78 градусов Цельсия.
Заправка баллонов аргоном
Химические свойства углекислого газа определяют его к кислотным оксидам, так как он может образовывать угольную кислоту, когда его растворяют в воде. При взаимодействии с щелочами, вещество начинает образовывать гидрокарбонаты и карбонаты.
С некоторыми веществами, такими как фенол, диоксид углерода вступает в реакцию электрофильного замещения. С магнийорганическими вещество вступает в реакцию нуклеофильного присоединения. Использование углекислоты в огнетушителях обусловлено тем, что она не поддерживает процесс горения.
Использование в сварке обусловлено тем, что в веществе горят некоторые активные металлы.
Преимущества
- Использование углекислого газа является относительно недорогим, так как цена на данное вещество достаточно низкая, если сравнивать с другими газами;
- Это очень распространенное вещество, найти которое можно во многих местах;
- Углекислый газ удобен в хранении и не требует сверхсложных мер безопасности;
- Газ хорошо справляется с теми обязанностями, для которых он предназначается.
Недостатки
- Во время использования на металле могут образовываться оксиды, которые выделяет вещество во время нагревания;
- Для нормальной работы нужно использовать дополнительные расходные материалы, которые бы помогли ликвидировать негативное воздействие оксидов;
- Существуют более эффективные газы, применяемые в сварочной сфере.
Применение углекислого газа при сварке
Данное вещество применяется в области сваривания металлических изделий в качестве защитного газа. Он применяется как для автоматических, так и для полуавтоматических сварочных аппаратов.
Зачастую его используют не в чистом виде а вместе с аргоном или кислородом в газовой смеси. В производственной сфере существует несколько вариантов снабжения постов.
Среди них выделяют следующие методы:
- Поставка из баллона. Это очень удобно, когда речь идет об относительно небольших объемах вещества. Это обеспечивает мобильность, так как не всегда имеется возможность создать трубопровод к посту.
- Транспортная емкость для углекислоты. Это также отличный вариант для потребления вещества в небольших баллонах. Она обеспечивает поставку большего количества газа, чем в баллонах, но менее удобна в транспортировке.
- Стационарный сосуд накопитель. Он применяется для тех, кто использует углекислоту в больших объемах. Их используют при отсутствии на предприятии автономной станции.
- Автономная станция. Это наиболее широкий по объему метод поставки, так как может обслуживать пост практически для любых процедур, вне зависимости от объемов. Таким образом, пост получает вещество непосредственно с места его производства.
Особенности процесса ионизации газа при сварочных работах
Автономная станция представляет собой специальный цех на предприятии, где получают диоксид углерода.
Он может работать как исключительно для собственных нужд, так и на поставку другим цехам и организациям. Для обеспечения рабочих точек предприятия, газ поставляет по трубопроводам.
В то время, когда на предприятии имеется необходимость в запасании углекислоты, ее перемещают в специальные накопители.
Меры безопасности
Хранение и использование вещества является относительно безопасным. Но для того, чтобы исключить вероятности несчастных случаев, следует придерживаться основных правил:
- Несмотря на то, что углекислота не отличается взрывоопасностью и токсичностью, если ее концентрация будет выше 5%, то человек будет чувствовать удушье и кислородную недостаточность. Не следует допускать утечки и хранения всего в закрытом не проветриваемом помещении.
- Если понизить давление, то жидкая углекислота превращается в газообразное состояние. В это время ее температура может составлять -78 градусов Цельсия. Это вредно для слизистых оболочек организма. Также это приводит к обморожению кожи
- Осмотр больших емкостей для хранения углекислоты следует проводить с использованием шлангового противогаза. Цистерна должна быть отогрета до температуры окружающей среды и быть хорошо проветренной.
Заключение
Физические свойства являются не единственным показателем, по которому подбирается газ для сварки. Совокупность всех параметров обеспечивает данному веществу уверенные позиции на современном рынке расходных материалов. Среди самых простых процедур это незаменимый газ, с которым сталкивался практически каждый профессиональный и начинающий сварщик.
Источник: https://svarkaipayka.ru/material/zashhitnyie-gazyi/fizicheskie-svoystva-uglekislogo-gaza.html
Углекислый газ
Диоксид углерода, оксид углерода, углекислота – все эти названия одного вещества, известного нам, как углекислый газ. Так какими же свойствами обладает этот газ, и каковы области его применения?
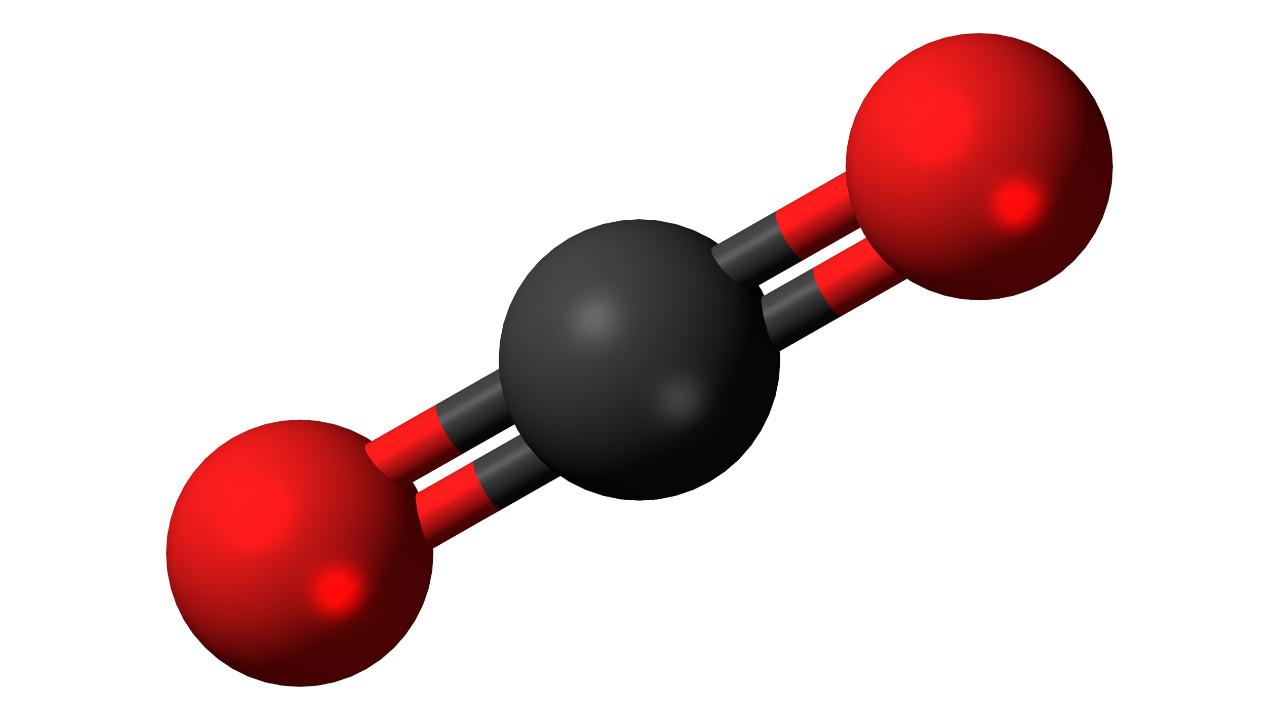
Углекислый газ состоит из углерода и кислорода. Формула углекислого газа выглядит так – CO₂. В природе он образуется при сжигании или гниении органических веществ. В воздухе и минеральных источниках содержание газа также достаточно велико. кроме того люди и животные также выделяют диоксид углерода при выдыхании.
Рис. 1. Молекула углекислого газа.
Диоксид углерода является абсолютно бесцветным газом, его невозможно увидеть. Также он не имеет и запаха. Однако при его большой концентрации у человека может развиться гиперкапния, то есть удушье. Недостаток углекислого газа также может причинить проблемы со здоровьем. В результате недостатка это газа может развиться обратное состояние к удушью – гипокапния.
Если поместить углекислый газ в условия низкой температуры, то при -72 градусах он кристаллизуется и становится похож на снег. Поэтому углекислый газ в твердом состоянии называют «сухой снег».
Рис. 2. Сухой снег – углекислый газ.
Углекислый газ плотнее воздуха в 1,5 раза. Его плотность составляет 1,98 кг/м³ Химическая связь в молекуле углекислого газа ковалентная полярная. Полярной она является из-за того, что у кислорода больше значение электроотрицательности.
Важным понятием при изучении веществ является молекулярная и молярная масса. Молярная масса углекислого газа равна 44. Это число формируется из суммы относительных атомных масс атомов, входящих в состав молекулы.
Значения относительных атомных масс берутся из таблицы Д.И. Менделеева и округляются до целых чисел. Соответственно, молярная масса CO₂ = 12+2*16.
Чтобы вычислить массовые доли элементов в углекислом газе необходимо следовать формулерасчета массовых долей каждого химического элемента в веществе.
n – число атомов или молекул.
Ar – относительная атомная масса химического элемента.
Mr – относительная молекулярная масса вещества.
Рассчитаем относительную молекулярную массу углекислого газа.
Mr(CO₂) = 14 + 16 * 2 = 44 w(C) = 1 * 12 / 44 = 0,27 или 27 % Так как в формулу углекислого газа входит два атома кислорода, то n = 2 w(O) = 2 * 16 / 44 = 0,73 или 73 %
Ответ: w(C) = 0,27 или 27 %; w(O) = 0,73 или 73 %
Углекислый газ обладает кислотными свойствами, так как является кислотным оксидом, и при растворении в воде образует угольную кислоту:
Вступает в реакцию со щелочами, в результате чего образуются карбонаты и гидрокарбонаты. Этот газ не подвержен горению. В нем горят только некоторые активные металлы, например, магний.
При нагревании углекислый газ распадается на угарный газ и кислород:
Как и другие кислотные оксиды, данный газ легко вступает в реакцию с другими оксидами:
Углекислый газ входит в состав всех органических веществ. Круговорот этого газа в природе осуществляется с помощью продуцентов, консументов и редуцентов.
В процессе жизнедеятельности человек вырабатывает примерно 1 кг углекислого газа в сутки. При вдохе мы получаем кислород, однако в этот момент в альвеолах образуется углекислый газ.
В этот момент происходит обмен: кислород попадает в кровь, а углекислый газ выходит наружу.
Получение углекислого газа происходит при производстве алкоголя. Также этот газ является побочным продуктом при получении азота, кислорода и аргона. Применение углекислого газа необходимо в пищевой промышленности, где углекислый газ выступает в качестве консерванта, а также углекислый газ в виде жидкости содержится в огнетушителях.
Рис. 3. Огнетушитель.
Углекислый газ – вещество, которое в нормальных условиях не имеет цвета и запаха. помимо своего обычного названия – углекислый газ, его также называют оксидом углерода или диоксидом углерода.
Средняя оценка: 4.3. Всего получено оценок: 161.
Источник: https://obrazovaka.ru/himiya/uglekislyy-gaz-formula-8-klass.html
Физические и химические свойства углекислого газа
- Физические и химические свойства углекислого газа
- ОПРЕДЕЛЕНИЕ
- Углекислый газ (двуокись углерода, угольный ангидрид, диоксид углерода) – оксид углерода (IV).
Формула – ( mathrm{CO}_{2} ). Молярная масса – 44 г/моль.
Химические свойства углекислого газа
Углекислый газ относится к классу кислотных оксидов, т.е. при взаимодействии с водой он образует кислоту, которая называется угольная. Угольная кислота химически неустойчива и в момент образования сразу же распадается на составляющие, т.е. реакция взаимодействия углекислого газа с водой носит обратимый характер:
- ( mathrm{CO}_{2}+mathrm{H}_{2} mathrm{O} leftrightarrow mathrm{CO}_{2} imes mathrm{H}_{2} mathrm{O}( ext { solution }) leftrightarrow mathrm{H}_{2} mathrm{CO}_{3} ).
- При нагревании углекислый газ распадается на угарный газ и кислород:
- ( 2 mathrm{CO}_{2}=2 mathrm{CO}+mathrm{O}_{2} )
- Как и для всех кислотных оксидов, для углекислого газа характерны реакции взаимодействия с основными оксидами (образованными только активными металлами) и основаниями:
- ( mathrm{CaO}+mathrm{CO}_{2}=mathrm{CaCO}_{3} );
- ( mathrm{Al}_{2} mathrm{O}_{3}+3 mathrm{CO}_{2}=mathrm{Al}_{2}left(mathrm{CO}_{3}
ight)_{3} ); - ( mathrm{CO}_{2}+mathrm{NaOH}_{( ext { dilute })}=mathrm{NaHCO}_{3} );
- ( mathrm{CO}_{2}+2 mathrm{NaOH}_{(mathrm{conc})}=mathrm{Na}_{2} mathrm{CO}_{3}+mathrm{H}_{2} mathrm{O} ).
- Углекислый газ не поддерживает горения, в нем горят только активные металлы:
- ( mathrm{CO}_{2}+2 mathrm{Mg}=mathrm{C}+2 mathrm{MgO}left(mathrm{t}^{circ}
ight) ); - ( mathrm{CO}_{2}+2 mathrm{Ca}=mathrm{C}+2 mathrm{CaO}left(mathrm{t}^{circ}
ight) ). - Углекислый газ вступает в реакции взаимодействия с простыми веществами, такими как водород и углерод:
- ( mathrm{CO}_{2}+4 mathrm{H}_{2}=mathrm{CH}_{4}+2 mathrm{H}_{2} mathrm{O}left(mathrm{t}^{circ}, mathrm{kat}=mathrm{Cu}_{2} mathrm{O}
ight) ); - ( mathrm{CO}_{2}+mathrm{C}=2 mathrm{CO}left(mathrm{t}^{circ}
ight) ). - При взаимодействии углекислого газа с пероксидами активных металлов образуются карбонаты и выделяется кислород:
- ( 2 mathrm{CO}_{2}+2 mathrm{Na}_{2} mathrm{O}_{2}=2 mathrm{Na}_{2} mathrm{CO}_{3}+mathrm{O}_{2} uparrow ).
Качественной реакцией на углекислый газ является реакция его взаимодействия с известковой водой (молоком), т.е. с гидроксидом кальция, в которой образуется осадок белого цвета – карбонат кальция:
( mathrm{CO}_{2}+mathrm{Ca}(mathrm{OH})_{2}=mathrm{CaCO}_{3 downarrow}+mathrm{H}_{2} mathrm{O} ).
Физические свойства углекислого газа
Углекислый газ – газообразное вещество без цвета и запаха. Тяжелее воздуха. Термически устойчив. При сжатии и охлаждении легко переходит в жидкое и твердое состояния.
Углекислый газ в твердом агрегатном состоянии носит название «сухой лед» и легко возгоняется при комнатной температуре. Углекислый газ плохо растворим в воде, частично реагирует с ней. Плотность – 1,977 г/л.
- Получение и применение углекислого газа
Выделяют промышленные и лабораторные способы получения углекислого газа. Так, в промышленности его получают обжигом известняка (1), а в лаборатории – действием сильных кислот на соли угольной кислоты (2): - ( mathrm{CaCO}_{3}=mathrm{CaO}+mathrm{CO}_{2}left(mathrm{t}^{circ}
ight)(1) ); - ( mathrm{CaCO}_{3}+2 mathrm{HCl}=mathrm{CaCl}_{2}+mathrm{CO}_{2} uparrow+mathrm{H}_{2} mathrm{O}(2) ).
- Углекислый газ используется в пищевой (газирование лимонада), химической (регулировка температур при производстве синтетических волокон), металлургической (защита окружающей среды, например, осаждение бурого газа) и других отраслях промышленности.
- Примеры решения задач
- ПРИМЕР 1
Задание Какой объем углекислого газа выделится при действии 200 г 10%-го раствора азотной кислоты на 90 г карбоната кальция, содержащего 8% примесей, нерастворимых в кислоте?
Решение Молярные массы азотной кислоты и карбоната кальция, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 63 и 100 г/моль, соответственно.
Запишем уравнение растворения известняка в азотной кислоте:
- ( mathrm{CaCO}_{3}+2 mathrm{HNO}_{3}
ightarrow mathrm{Ca}left(mathrm{NO}_{3}
ight)_{2}+mathrm{CO}_{2} uparrow+mathrm{H}_{2} mathrm{O} ). - Содержание чистого (без примесей) карбоната кальция в известняке:
- ( omegaleft(mathrm{CaCO}_{3}
ight)_{mathrm{cl}}=100 \%-omega_{ ext { admixture }}=100 \%-8 \%=92 \%=0,92 ). - Тогда, масса чистого карбоната кальция:
- ( mleft(mathrm{CaCO}_{3}
ight)_{mathrm{cl}}=mathrm{m}_{ ext { limestone }} imes omegaleft(mathrm{CaCO}_{3}
ight)_{mathrm{cl}} / 100 \% ); - ( mathrm{m}left(mathrm{CaCO}_{3}
ight)_{mathrm{cl}}=90 imes 92 / 100 \%=82,8 mathrm{г} ). - Количество вещества карбоната кальция равно:
- ( nleft(C a C O_{3}
ight)=mleft(C a C O_{3}
ight)_{C l} / Mleft(C a C O_{3}
ight) ); - ( nleft(mathrm{CaCO}_{3}
ight)=82,8 / 100=0,83 mathrm{моль} ) - Масса азотной кислоты в растворе будет равна:
- ( mathrm{m}left(mathrm{HNO}_{3}
ight)=mathrm{m}left(mathrm{HNO}_{3}
ight)_{ ext { solution }} imes omegaleft(mathrm{HNO}_{3}
ight) / 100 \% ); - ( mathrm{m}left(mathrm{HNO}_{3}
ight)=200 imes 10 / 100 \%=20 mathrm{г} ) - Количество вещества азотной кислоты кальция равно:
- ( mathrm{n}left(mathrm{HNO}_{3}
ight)=mathrm{m}left(mathrm{HNO}_{3}
ight) / mathrm{M}left(mathrm{HNO}_{3}
ight) ) - ( nleft(H N O_{3}
ight)=20 / 63=0,32 ) моль
Сравнивая количества веществ, вступивших в реакцию, определяем, что азотная кислота находится в недостатке, следовательно дальнейшие расчеты производим по азотной кислоте. Согласно уравнению реакции ( n(H N O 3) : n(C O 2)=2 : 1 ), следовательно n(CO2) = 1/2×n(HNO3) = 0,16 моль. Тогда, объем углекислого газа будет равен:
- V(CO2) = n(CO2)×Vm ;
- V(CO2) = 0,16×22,4 = 3,58 г.
- Ответ Объем углекислого газа — 3,58 г.
- ПРИМЕР 2
- Задание Найдите объем углекислого газа массой 35 г.
- Решение Масса вещества и его объем связаны между собой через количество вещества. Запишем формулы для вычисления количества вещества с помощью его массы и объема:
- ( mathrm{n}=mathrm{m} / mathrm{M} );
- ( mathrm{n}=mathrm{V} / mathrm{V}_{mathrm{m}} ).
- Приравняет выражения, записанные справа и выразим объем:
- ( mathrm{m} / mathrm{M}=mathrm{V} / mathrm{V}_{mathrm{m}} );
- ( mathrm{V}=mathrm{m} imes mathrm{V}_{mathrm{m}} / mathrm{M} ).
Вычислим по выведенной формуле объем углекислого газа. Молярная масса углекислого газа, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 44 г/моль.
( Vleft(C O_{2}
ight)=35 imes 22,4 / 44=17,82 ) л.
Ответ Объем углекислого газа — 17,82 л.
Источник: https://sciterm.ru/spravochnik/fizicheskie-i-himicheskie-svojstva-uglekislogo-gaza/




