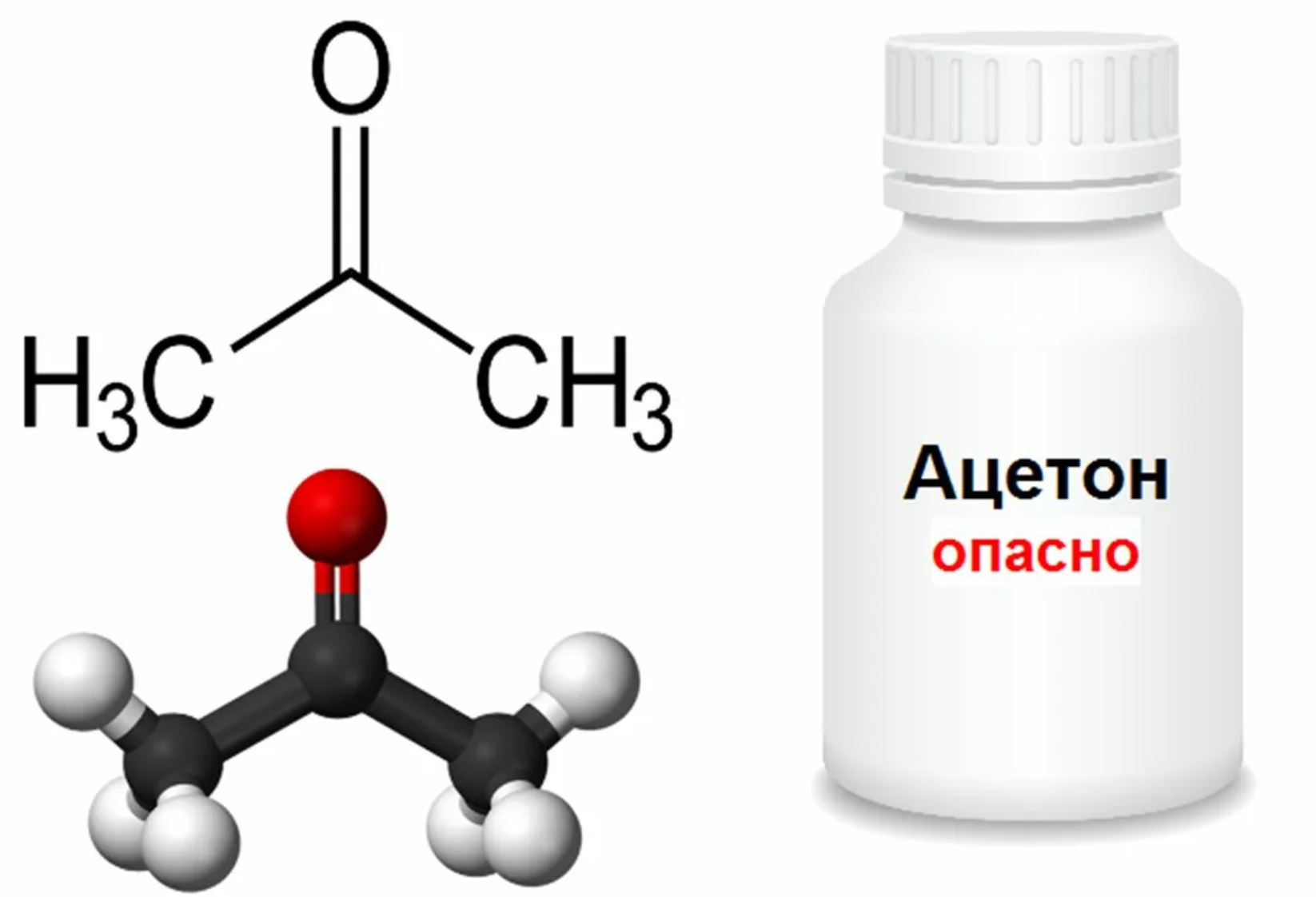
Ацетон — простейший представитель насыщенных кетонов.
Ацетон (пропанон-2, диметилкетон) СН3-СО-СН3 — летучая бесцветная жидкость с характерным запахом и температурой кипения 560С.
Ацетон легче воды, смешивается с ней в любых соотношениях, хорошо растворяется спирте и эфире.
Он хорошо растворяет многие органические вещества (жиры, смолы, ацетилцеллюлозу, воск, резину и др.), поэтому является незаменимым растворителем в быту и в лакокрасочной промышленности.


Ацетон встречается в организме человека. Он является промежуточным продуктом обмена веществ. Незначительное количество ацетона, образующееся в организме человека в результате метаболических реакций, выводится вместе с мочой. У больных диабетом следы ацетона можно обнаружить в выдыхаемом воздухе.
А знаете ли вы?
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины.
Токсичность ацетона
Ацетон обладает возбуждающим и наркотическим действием, поражает центральную нервную систему. Ацетон способен накапливаться в организме, т.к. медленно выводится из организма. Он может поступать в организм с вдыхаемым воздухом, а также через пищевой канал и кожу.
После поступления ацетона в кровь часть его переходит в головной мозг, селезенку, печень, поджелудочную железу, почки, легкие и сердце. Содержание ацетона в указанных органах несколько меньшее, чем в крови.
При вдыхании паров ацетона происходит кислородное голодание мозга. Поэтому, в помещениях, в которых происходит испарение ацетона, создается опасность отравления при вдыхании его паров.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов.
Ацетон, как и все кетоны, не дает реакции «серебряного зеркала», не полимеризуется. В этом его отличие от альдегидов.
- 1. Гидрирование (восстановление)
- При тех же условиях, что и формальдегид, ацетон присоединят водород:

- Водород присоединяется вследствие разрыва двойной связи карбонильной группы.
- 2. Взаимодействие с гидросульфитом натрия
- Ацетон один из немногих кетонов образует бисульфитное соединение:
 3. Альдольная конденсация
3. Альдольная конденсация- Под действием щелочей ацетон вступает в альдольную самоконденсацию, с образованием «ацетонового» (диацетонового) спирта:

- 4. Взаимодействие с синильной кислотой
- Одной из наиболее важных реакций ацетона является присоединение к нему синильной кислоты с образованием ацетонциангидрина:
- 5. Пиролиз ацетона
- При нагревании выше 5000C ацетон распадается на кетен и метан:

- 6. Галоформная реакция (иодоформная реакция, или проба Люголя)
- Качественная реакция на ацетон!
- При взаимодействии ацетона с избытком йода в щелочной среде образуется йодоформ – желтое вещество с характерным запахом:

- Аналогичные реакции идут с хлором и бромом, но только реакция с йодом приводит к нерастворимому йодоформу.
- 7. Взаимодействие с нитропруссидом натрия
- Качественная реакция на ацетон!
- Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой CH3COOH окраска переходит в красно-фиолетовую:

- Йодоформная реакция и реакция с нитропруссидом натрия используются для обнаружения ацетона в моче при сахарном диабете.
Получение
Ацетон получают в больших количествах различными методами: при сухой перегонке дерева, разложением ацетата кальция, окислением пропена, «кумольным» способом, окислением изопропилового спирта, гидратацией ацетилена водяным паром.
1.Кумольный способ
Данный способ получения фенола основан на окислении кумола (изопропилбензола). В качестве исходных продуктов используют бензол и пропилен.
Процесс протекает в три стадии. На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса-Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:

Окисление кумола — экономически выгодный метод, так как позволяет получить наряду с фенолом другой важный продукт — ацетон (на 1 кг фенола приходится 0,6 кг ацетона). В настоящее время этот метод наиболее широко используется в промышленности и позволяет производить более 80% синтетического фенола.
- 2. Окисление изопропилового спирта
- Ацетон получают в больших количествах при окислении изопропилового спирта:
В качестве катализатора применяется медь, серебро, никель, платина и др. Воздух, насыщенный парами изопропилового спирта, пропускают над тонким слоем катализатора при температуре 400-6500С.
- Если процесс окисления протекает в жидкой фазе, то, как побочный продукт образуется пероксид водорода:
- 3. Каталитическое окисление пропена кислородом воздуха
- В промышленности ацетон получают прямым окислением пропена в жидкой фазе в присутствии катализатора — смеси PdCl2 и CuCl2 при температуре 1000C:
- 4. Брожение крахмала
Незначительное значение имеет метод брожения крахмала под действием бактерий с образованием ацетона и бутанола. Метод характеризуется малыми выходами.
- 5. Пиролиз ацетата кальция
- Ацетон можно получить пиролизом ацетата кальция:
- 6. Гидратация ацетилена водяным паром
- Реакция протекает при 400-4600С над катализатором, содержащим оксиды железа и марганца:
Применение
- В качестве растворителя ацетон используется в производстве красок, лаков и олифы, резины, пластмасс, красителей, взрывчатых веществ, а также в фотографии.
- Ацетон применяется в производство искусственного шелка и синтетической кожи, в производстве смазочных масел, бездымного пороха, кинопленки.
- В химической промышленности ацетон является промежуточным химическим соединением при производстве многих химикатов, таких как кетен, уксусный ангидрид, бисфенол А, метилметакрилат, хлороформ, изофорон, йодоформ, витамин С.
- Метилметакрилат применяется, главным образом, в виде листов пластика, порошков для литья и формовки, поверхностных покрытий, эмульсионных полимеров, волокон, чернил и пленок.
Метилметакрилат также применяется в производстве материалов, известных под названием плексигласа или люцита. Они используются в зубных протезах, твердых контактных линзах, и клеях.
Метилметакрилат – мономер для синтеза полиметилметакрилата («органическое сырье»).
Альдегиды и кетоны
Источник: https://himija-online.ru/organicheskaya-ximiya/aldegidy-i-ketony/aceton-predstavitel-ketonov.html
Ацетон: формула, структура, свойства и применение
Возьмите в руки средство для снятия лака (кажется, это вещество есть у каждого в доме или, как минимум, хоть раз попадалось на глаза). На большинстве из них в настоящее время виднеется яркая надпись: без ацетона. Но далеко не всем известно хоть что-нибудь, кроме названия, о химическом веществе под названием ацетон.
Что же такое ацетон?
Химическая формула ацетона предельно проста: C3H6O. Если человек был внимателен на уроках химии, то, возможно, он даже помнит класс химических соединений, к которому относится данное вещество, а именно — кетон. Или же внимательный в прошлом ученик школы может помнить не только хим. формулу ацетона и класс соединения, а еще и структурную формулу, которая представлена на рисунке ниже.
Помимо структуры, формула ацетона отражает и его общепринятое по номенклатуре ИЮПАК название: пропанон-2. Хотя вновь стоит отметить, что некоторые читатели, возможно, даже помнят правила названия химических веществ со школьной скамьи.
А если говорить о том, что кроется под формулой ацетона в реальной жизни, а не на картинке с формулой или структурой? Ацетон при нормальных условиях представляет собой летучую жидкость без цвета, но с характерным резким запахом. Можно быть точно уверенным в том, что с запахом ацетона знаком почти каждый человек.
История открытия
Как и любое химическое вещество, ацетон имеет своего «родителя», то есть человека, который впервые обнаружил данное вещество и написал первую страницу в истории химического соединения.
«Родителем» ацетона является Андреас Либавий (фото представлено ниже), который впервые выявил его во время сухой перегонки ацетата свинца.
Произошло это ни много ни мало чуть больше, чем 400 лет назад: в 1595 году!

Однако это не могло являться полноценным открытием, ведь химический состав, природу, формулу ацетона смогли установить лишь 300 лет спустя: только в 1832 году ответы на данные вопросы смогли найти Жан-Батист Дюма и Юстус фон Либих.
Методом получения ацетона вплоть до 1914 года служил процесс коксования древесины. Но в период Первой мировой войны на ацетон очень повысился спрос, так как он стал выступать в роли важнейшего компонента производства бездымного пороха.
Именно данный факт послужил толчком для создания более изящных способов производства данного соединения.
Сложно поверить, но начали получать ацетон из кукурузы, а открытие данного способа в поддержку военных нужд принадлежит Хаиму Вейцману, ученому-химику из Израиля.
Применение ацетона
Мы установили «официальное» название, некоторые физические свойства и формулу ацетона, производство которого в мире составляет около 7 миллионов тонн в год (и это данные за 2013 год, а объемы производства только растут). Но что можно сказать о его роли в жизнедеятельности человечества?
Как уже было сказано выше, данное вещество является летучей жидкостью, что значительно затрудняет его использование в производстве. О каком использовании идет речь? Дело в том, что ацетон применяется в качестве растворителя многих веществ. Однако его повышенная испаряемость зачастую мешает пользоваться им в чистом виде, для чего состав данного растворителя на производстве намеренно меняют.
В пищевой промышленности ацетон играет важную роль, так как не отличается столь сильной токсичностью (в отличие от большинства других растворителей).
Все хоть раз сталкивались с банальной жидкостью для снятия лака на основе ацетона (хоть современное общество старается и искоренить его из состава). Также ацетон нередко используют для обезжиривания различного рода поверхностей.
Важно отметить и то, что широко распространено данное вещество в фармацевтических синтезах, в синтезах эпоксидных смол, поликарбонатов и даже взрывчатых веществ!
Насколько опасен ацетон для человека?
Не раз звучали слова о слабой токсичности интересующего нас вещества. Стоит же сказать более конкретно об опасности, которую представляет столь безобидная, на первый взгляд, формула ацетона для человека.
Данное вещество относится к легковоспламеняющимся и веществам 4-го класса опасности, то есть малотоксичным.

Последствия попадания ацетона в глаза крайне серьезны — это либо сильное снижение зрения, либо его полная утрата, так как ацетон вызывает сильный химический ожог слизистой, а заживление оставляет рубец на сетчатке. Немедленное промывание глаз большим количеством чистой воды поможет частично снизить вред зрению.
Попадание ацетона в организм пероральным путем вызывает следующие последствия: потеря сознания через несколько минут, периодичные остановки дыхания, возможно снижение артериального давления, тошнота и рвота, боли в животе, отек слизистых рта, пищевода и желудка, одышка, учащенное сердцебиение, а также галлюцинации.
Ингаляционное отравление газообразным ацетоном проявляется почти аналогично вышеописанному. Очевидным различием выступает отек дыхательных путей, а не пищеварительного тракта. Отеку могут быть подвержены также глаза при контакте с окружающей средой с распространенным газом.
Ожогов кожи при попадании ацетона чаще всего не наблюдается, что обусловлено высокой летучестью вещества. Однако все же известны случаи получения ожогов 1-ой и 2-ой степени.
Интересное производное ацетона: знакомьтесь, ацетоксим
Помимо свойств и формулы ацетона как такового, стоит поближе узнать и его ближайших «родственников». Например, познакомимся с таким веществом, как ацетоксим.
Ацетоксим — это производное ацетона. Формула оксима ацетона ненамного сложнее формулы так хорошо знакомого нам пропанона-2: C3H7NO. Пространственная структура представлена на рисунке ниже.

Один из возможных способов получения ацетоксима — это взаимодействие ацетона с гидроксиламином.
Применение оксимов
Говоря о таком классе органических соединений, как оксимы, необходимо отметить сферу их использования в современном мире. Сами по себе оксимы являются твердыми веществами, но легкоплавкими, то есть с низкими температурами плавления.
Различные оксимы имеют, соответственно, различное применение. Так, некоторые из них необходимы в производстве капролактама, другие используются в аналитической химии, где помогает в обнаружении и количественном определении никеля (так как результатом взаимодействия является вещество красного цвета).
Отдельный класс оксимов используется как лекарственное средство при отравлениях фосорорганическими соединениями.
Источник: https://News4Auto.ru/aceton-formyla-stryktyra-svoistva-i-primenenie/
Ацетон
Ацетон (диметилкетон, пропанон-2) — органическое вещество, имеющее формулу CH3—C(O)—CH3 (C3H6O), простейший представитель насыщенных кетонов.
Своё название ацетон получил от лат. acetum — уксус. Это связано с тем, что ранее ацетон получали из ацетатов, а из самого ацетона получали синтетическую ледяную уксусную кислоту.
В 1848 году немецкий профессор медицины и химии Леопольд Гмелин ввёл термин в официальное употребление, использовав старое немецкое слово Aketon (кетон, ацетон), которое также берёт корни от латинского acetum.
Открытие
 — первым открыл ацетон
— первым открыл ацетон
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины, однако повышенный спрос на него в годы Первой мировой войны очень быстро стимулировал создание новых методов производства.
Физические свойства
Ацетон — бесцветная подвижная летучая жидкость (при н.у.) с характерным резким запахом. Во всех соотношениях смешивается с водой, диэтиловым эфиром, бензолом, метанолом, этанолом, многими сложными эфирами и так далее.
Основные термодинамические свойства ацетона:
- Поверхностное натяжение (20 °C): 23,7 мН/м
- Стандартная энтальпия образования ΔH (298 К): −247,7 кДж/моль (ж)
- Стандартная энтропия образования S (298 К): 200 Дж/моль·K (ж)
- Стандартная мольная теплоемкость Cp (298 К): 125 Дж/моль·K (ж)
- Энтальпия плавления ΔHпл: 5,69 кДж/моль
- Энтальпия кипения ΔHкип: 29,1 кДж/моль
- Теплота сгорания Qp: 1829,4 кДж/моль
- Критическое давление: 4,7 МПа
- Критическая плотность: 0,273 г/см3
- Динамическая вязкость жидкостей и газов:
- 0,36 мПа·с (10 °C)
- 0,295 мПа·с (25 °C)
- 0,28 мПа·с (41 °C)
Термохимические свойства:
- Температура вспышки в воздухе: (-20 °C)
- Температура самовоспламенения на воздухе: 465 °C
- Пределы взрывоопасных концентраций: 2,6-12,8 %
Оптические свойства:
- Показатель преломления (для D-линии натрия):
- 1,3591 (20 °C)
- 1,3588 (25 °C)
- Показатель диссоциации: pKa = 20 (20 °C, вода)
- Диэлектрическая проницаемость (20 °C): 20,9
- Дипольный момент молекулы (20 °C): 2,84 Дебай
Ацетон хорошо растворяет многие органические вещества, в частности, ацетил- и нитроцеллюлозы, воски, алкалоиды и так далее, а также ряд солей.
Ацетон образуется при ацетоновом (ацетон-бутиловом) брожении углеводов, вызываемом Clostridium acetobutylicus. В результате образуется ацетон и бутанол-1, а также ряд побочных примесей. В качестве промышленного такой метод получения ацетона был популярен в XIX — начале XX вв., но был вытеснен технологиями химического синтеза.

Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение:
(CH3)2CO + NaHSO3 ⟶ (CH3)2C(OH)SO3Na
Под действием щелочей вступает в альдольную самоконденсацию, с образованием диацетонового спирта:
2(CH3)2CO →OH− (CH3)2C(OH)CH2C(O)CH3
Восстанавливается цинком до пинакона:
2(CH3)2CO →Zn (CH3)2C(OH)C(OH)(CH3)2
При пиролизе (700 °C) образует кетен:
(CH3)2CO ⟶ CH2=C=O + CH4
Легко присоединяет циановодород с образованием ацетонциангидрина:
(CH3)2CO + HCN ⟶ (CH3)2C(OH)CN
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
- Hal2 + 2NaOH ⟶ NaHal + NaOHal + H2O
- (CH3)2CO + 3NaOHal ⟶ CH3−CO−CHal3 + 3NaOH
- CH3−CO−CHal3+NaOH ⟶ CHHal3↓ + CH3COONa
Качественной реакцией на диметилкетон есть наличие интенсивно-красной окраски с нитропруссидом натрия в щелочной среде. При добавлении CH3COOH окраска переходит в красно-фиолетовую.
(CH3)2CO + Na2[Fe(CN)5NO] + 2NaOH ⟶ Na4[Fe(CN)5ON=CHCOCH3] + 2H2O
Получение
Мировое производство ацетона составляет более 6,9 миллионов тонн в год (по данным на 2012 г.) и устойчиво растёт.
В промышленности получается напрямую или косвенно из пропена.
Кумольный способ
Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Процесс протекает в 3 стадии.
На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса — Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
C6H6 + CH3CH=CH2 ⟶ C6H5CH(CH3)2C6H5CH(CH3)2 + O2 ⟶ C6H5C(OOH)(CH3)2C6H5C(OOH)(CH3)2 ⟶ C6H5OH + (CH3)2COИз изопропанола
По данному методу изопропанол окисляют в паровой фазе при температурах 450—650 °C на катализаторе (металлические медь, серебро, никель, платина). Ацетон с высоким выходом (до 90 %) получают на катализаторе «серебро на пемзе» или на серебряной сетке:
(CH3)2CH-OH + O2 ⟶ (CH3)2CO + H2O2Метод окисления пропена
Ацетон получают также прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при температуре 50-120 °C и давлении 50-100 атм:
CH3CH=CH2 + PdCl2 + H2O ⟶ (CH3)2CO + Pd + 2HCl2Pd + 4HCl + O2 ⟶ 2PdCl2 + 2H2O
Некоторое значение имеет метод брожения крахмала под действием бактерий Clostridium acetobutylicum с образованием ацетона и бутанола. Метод характеризуется малыми выходами. Используются также методы получения из изопропилового спирта и ацетилена.

Применение
Ацетон применяется как сырьё для синтеза многих важных химических продуктов, таких как уксусный ангидрид, кетен, диацетоновый спирт, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан, изофорон, бисфенол А и так далее; пример:
(CH3)2CO + 2C6H5OH ⟶ (CH3)2C(C6H4OH)2
Последний широко применяется при синтезе поликарбонатов, полиуретанов и эпоксидных смол.
Ацетон также является популярным растворителем. В частности он используется как растворитель
- в производстве лаков;
- в производстве взрывчатых веществ;
- в производстве лекарственных препаратов;
- в составе клея для киноплёнок как растворитель ацетата целлюлозы и целлулоида;
- компонент для очистки поверхностей в различных производственных процессах;
- как очиститель инструмента и поверхностей от монтажной пены — в аэрозольных баллонах.
Без ацетона невозможно хранить в компактном (сжиженном и в баллоне) состоянии ацетилен, который под давлением в чистом виде крайне взрывоопасен. Для этого используют ёмкости с пористым материалом, пропитанным ацетоном. 1 литр ацетона растворяет до 250 литров ацетилена.
Ацетон используется также при экстракции многих растительных веществ.
Ацетон служит также сырьём для синтеза уксусного ангидрида, кетена, диацетонового спирта и многих других соединений.
Лабораторное применение
В органической химии ацетон применяется в качестве полярного апротонного растворителя, в частности, в реакции алкилирования
ArOH + RCl + K2CO3 ⟶ ArOR + KCl + KHCO3
для окисления спиртов в присутствии алкоголятов алюминия по Оппенауэру
RR′CH-OH + (CH3)2CO ⟶ RR′CO + (CH3)2CH-OH
- Ацетон применяется для приготовления охлаждающих бань в смеси с «сухим льдом» и жидким аммиаком (охлаждает до температуры −78 °C).
- В лабораториях используется для мытья химической посуды благодаря низкой цене, малой токсичности, высокой летучести и лёгкой растворимости в воде, а также для быстрой сушки посуды и неорганических веществ.
- Для очистки в лабораторных условиях ацетон перегоняют в присутствии небольшого количества перманганата калия (до слабо-розовой окраски раствора).
Обнаружение
- В химико-токсикологическом анализе для обнаружения ацетона применяют реакции с растворами йода, нитропруссида натрия, фурфурола, ο-нитробензальдегида и метод микродиффузии.
- Реакция на образование йодоформа.
- При взаимодействии ацетона с раствором йода в щелочной среде образуется трииодметан (йодоформ):
I2 + 2OH− ⟶ IO− + I− + H2O3IO− + CH3COCH3 ⟶ I3C-CO-CH3 + 3OH−I3C-CO-CH3 + OH− ⟶ CHI3 + CH3COO−
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора аммиака и несколько капель раствора йода в йодиде калия (йодной настойки).
В присутствии йода образуется желтый осадок трииодметана с характерным запахом, а его кристаллы имеют характерную гексалучевую форму. Предел обнаружения — 0,1 мг ацетона в пробе.
Реакция с нитропруссидом натрия (проба Легаля).
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой окраска переходит в красно-фиолетовую.
Кетоны, в молекулах которых отсутствуют метильные группы, непосредственно связанные с кетоновыми (СО—) группами, не дают такой реакции.
Соответственно такие кетоны как метилэтилкетон, метилпропилкетон и другие — также дадут красную окраску с нитропруссидом.
CH3COCH3 + Na2[Fe(CN)5NO] + 2NaOH ⟶ Na4[Fe(CN)5ON=CHCOCH3] + 2H2O
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора гидроксида натрия и 5 капель 1%-го свежеприготовленного раствора нитропруссида натрия. При наличии ацетона в пробе появляется красная или оранжево-красная окраска.
При прибавлении 10%-го раствора уксусной кислоты до кислой реакции через несколько минут окраска переходит в красно-фиолетовую или вишнёво-красную. Следует заметить, что бутанон дает аналогичную окраску с нитропруссидом натрия.

Пожароопасность
Одна из основных опасностей при работе с ацетоном — его легковоспламеняемость. Температура самовоспламенения +465 °C, температура вспышки −20 °C.
Воздушные смеси, содержащие от 2,5 % до 12,8 % (по объёму), взрывоопасны.
С этим необходимо считаться, так как ацетон быстро испаряется, и образующееся облако может распространиться до места воспламенения (нагрев или искра) вдали от места работы с ним.
Метаболизм и токсикология
Ацетон является естественным метаболитом, производимым организмами млекопитающих, в том числе и человеческим организмом.
Некоторое количество вещества выводится с выдыхаемым воздухом и выделениями кожи, некоторое — с мочой. В медицине ацетон относят к кетоновым телам.
Нарушение нормального метаболизма, например, при сахарном диабете, приводит к так называемой ацетонурии — избыточному образованию и выведению ацетона.
В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи — 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона.
Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом.
Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое — с мочой.
Ацетон ядовит, но относится к малоопасным веществам (класс опасности IV, категория безопасности для здоровья по NFPA — 1). Сильно раздражает слизистые оболочки: длительное вдыхание больших концентраций паров приводит к возникновению воспаления слизистых оболочек, отёку лёгких и токсической пневмонии.
Пары оказывают слабое наркотическое действие, сопровождаемое, чаще всего, дисфорией.
При попадании внутрь вызывает состояние опьянения, сопровождаемое слабостью и головокружением, нередко — болями в животе; в существенных количествах возникает выраженная интоксикация, хотя, как правило, отравления ацетоном не смертельны.
Возможно поражение печени (токсический гепатит), почек (уменьшение диуреза, появление крови и белка в моче) и коматозное состояние. При ингаляционном воздействии ацетон выводится гораздо медленнее (в течение нескольких часов), чем поступает, и поэтому может накапливаться в организме.
Источник: https://chem.ru/aceton.html
ацетон
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
диметилкетон пропанон бесцветн. жидкость 56,05 °C (температура кипения азеотропа, давление 1 атм) аллилбромид 8% ацетон 92% ацетон: смешивается бензол: смешивается вода: смешивается диэтиловый эфир: смешивается метанол: смешивается хлороформ: растворим этанол: смешивается Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. «Практикум по органической химии: Органический синтез» М.: Высшая школа, 1991 стр. 49
Для высушивания ацетон помещают в колбу с обратным холодильником, закрытым хлоркальциевой трубкой, добавляют безводный хлорид кальция (120 г на 1 л) и кипятят, дважды заменяя осушитель через каждые 5-6 часов. Переливать ацетон на свежий осушитель следует как можно быстрее, так как ацетон очень жадно поглощает влагу. Окончательно ацетон перегоняют над хлоридом кальция.
Плотность:
0,7908 (20°C, г/см3) 0,7899 (25°C, г/см3)
Показатель преломления (для D-линии натрия):
1,3591 (20°C) 1,3588 (25°C) pKa (1) = 20 (20 C, вода) 20,9 (20°C) 2,84 (20°C) 0,295 (25°C) 0,28 (41°C) 0,36 (10°C) 23,7 (20°C) -247,7 (ж) 200 (ж) 125 (ж) 5,69 29,1 -18 465 1829,4 -216,5 (г)
Клиническая картина отравления: При попадании внутрь и вдыхании паров — состояние опьянения, головокружение, слабость, шаткая походка, тошнота, боли в животе, коллапс, коматозное состояние. Возможны поражения печени (токсический гепатит) и почек (снижение диуреза, появление белка и эритроцитов в моче). При выходе из коматозного состояния часто развивается пневмония.
Лечение: При пероральном приеме — промывание желудка, при ингаляционном — промывание глаз водой, ингаляция кислорода. Ощелачивание мочи. Форсированный диурез. Лечение острой сердечно-сосудистой недостаточности, нефропатии, пневмонии.
Аналитические

Критическая температура (в °C):
235,5
Критическое давление (в МПа):
4,7
Критическая плотность (в г/см3):
0,273
Применение:
Широко применяемый растворитель органических веществ, в первую очередь нитратов и ацетатов целлюлозы. Сырье для синтеза уксусного ангидрида, кетена, диацетонового спирта, окиси мезитила, метилизобутилкетона, метилметакрилата, дифенилолпропана, изофорона и многих других соединений.
Мировое производство около 3 000 000 т/год (1980).
История:
Название от латинского acetum — уксус.
Дополнительная информация:
Входит в список IV (прекурсоры) наркотических и психотропных веществ.
Образует кристаллические соединения с гидросульфитами щелочных металлов. Сильными окислителями (щелочной раствор перманганата калия или хромовая кислота) окисляется до муравьиной и уксусной кислот и далее до углекислого газа и воды.
Каталитически восстанавливается до изопропанола; амальгамами магния и цинка, а также цинком в уксусной кислоте — до пинакона. Атомы водорода легко замещаются при галогенировании, нитрозировании. Действием хлора в щелочи превращается в хлороформ, который взаимодействует с избытком ацетона с образованием хлорэтона.
Окисляет вторичные спирты в присутствии алкоголятов алюминия до кетонов (реакция Оппенгауэра). Вступает в альдольную конденсацию с образованием диацетонового спирта, а также в кротоновую конденсацию с образованием окиси мезитила, форона и мезитилена.
В присутствии сильной минеральной кислоты алкилирует фенол с образованием дифенилолпропана. Присоединяет цианид-ион с образованием ацетонциангидрина. При пиролизе (700 С) дает кетен и метан.
- «Неотложная помощь при острых отравлениях: Справочник по токсикологии» под ред. Голикова С.Н. М.:Медицина, 1977 стр. 261
- «Химическая энциклопедия» т.1 М.: Советская энциклопедия, 1988 стр. 230-231
- Бабаян Э.А., Гаевский А.В., Бардин Е.В. «Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров» М.: МЦФЭР, 2000 стр. 147
- Гордон А., Форд Р. «Спутник химика» М.: Мир, 1976 стр. 186
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 127
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Еще по теме:
- АЦЕТОН — химическая энциклопедия
- Ацетон — Токсикологическая химия

Источник: http://www.xumuk.ru/spravochnik/27.html
Чем ацетон отличается от… другого ацетона, или Не все ацетоны одинаково полезны
3D Today Личные дневники Чем ацетон отличается от… другого ацетона, или Не все ацетоны одинаково полезны
10.04.2019
2855
Подпишитесь на автора, если вам нравятся его публикации. Тогда вы будете получать уведомления о его новых постах.
Отписаться от уведомлений вы всегда сможете в профиле автора.
Подписаться
2
Когда я год назад впервые начал работать с 3D-принтером, то на этом сайте узнал, что такое 'ABS-сок', и как его правильно пить использовать.В кладовке у меня на тот момент стояло две литровые бутыли с этой волшебной жидкостью — одна матовая полиэтиленовая неизвестного уже теперь производителя (потому что наклейка оторвалась и потерялась), и вторая — из прозрачного PET производства ООО 'Экспохимтрейд' (г.Королев Московской области). В то время (до 3D-эры) потребление ацетона в моей семье было минимальным, и обе бутыли стояли чуть початые уже несколько лет. Почему их было две — сам не помню. Возможно, когда-то срочно понадобился ацетон, и проще было сбегать в хозмаг за новой порцией, чем искать в заваленной кладовке старую. В-общем, это неважно.Ну да ладно. Для первого приготовления ABS-сока была открыта первая бутыль — та, что из матового полиэтилена. Был произведен 'отлив' в малую посуду, и в нем был успешно растворен ABS. Растворение происходило почти моментально — кусочки прутка не успевали коснуться дна и расползались в стороны густым туманом. Был получен раствор нужной консистенции, который затем успешно использовался по назначению.Всему хорошему приходит конец. Прошел почти год, и первая бутыль закончилась. Я открыл вторую (Экспохимтрейдовскую) бутыль, сделал привычный 'отлив в мелкую тару', накидал туда отрезков ABS-ного прутка, но… пластик растворяться не захотел. Прутки блестели глянцем, будучи погруженными в кристально прозрачную жидкость. Ни о каком растворении речи не шло. Оставил на сутки. Через сутки все же стало заметно, что прутки немного разбухли и осели на дно, потеряв упругость. Еще через день они слились в единую 'блямбу', покрывшую дно сосуда. И на этом всё — 'ацетон' (специально пишу в кавычках) даже не помутнел.Если у кого-то прямо сейчас напросился ответ типа 'разный ABS себя по-разному ведет', то отвечаю со всей ответственностью — в течение всего года использовался не просто одинаковый пластик, а пластик с одной и той же катушки (ну, купил я когда-то килограмм серого ABS и печатаю из него очень мало и очень редко).
И вот теперь я не пойму, где настоящий ацетон, а где не настоящий. И чем они друг от друга отличаются? Я знаю, что химическая формула ацетона такая:
 Но у меня нет знакомой химической лаборатории, чтобы это проверить.Единственное, что я могу — это громогласно заявить: люди, не покупайте ацетон завода 'Экспохимтрейд'. Это неправильный ацетон.
Но у меня нет знакомой химической лаборатории, чтобы это проверить.Единственное, что я могу — это громогласно заявить: люди, не покупайте ацетон завода 'Экспохимтрейд'. Это неправильный ацетон.
Вот он:
 Не берите его — покупайте другой.
Не берите его — покупайте другой.
Подпишитесь на автора, если вам нравятся его публикации. Тогда вы будете получать уведомления о его новых постах.
Отписаться от уведомлений вы всегда сможете в профиле автора.
Подписаться
2
Источник: https://3dtoday.ru/blogs/booroondook/than-acetone-acetone-in-another-or-not-all-equally-useful-atsetony/
Ацетон технический
для применения в качестве растворителя в различных областях промышленности
Ацетон технический ГОСТ 2768-84 изготовлен окислением изопропилового спирта.
Ацетон (диметилкетон, систематическое наименование: пропанон-2) — простейший представитель кетонов. Формула: CH3-C(O)-CH3. Бесцветная легкоподвижная летучая жидкость с характерным запахом. Полностью смешивается с водой и большинством органических растворителей. Отличается высокой летучестью.
Назначение
Ацетон применяется в качестве растворителя в различных областях промышленности.
Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, жиры, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия). Используется для синтеза уксусного ангидрида, ацетонциангидрина, дифенилолпропана и других органических продуктов.
Область применения
- Область применения ацетона: синтез уксусного ангидрида, ацетонциангидрина, дифенилпропана и других органических продуктов.
- Применяется для растворения природных смол, масел, диацетата целлюлозы, полистирола, эпоксидных смол, сополимеров винилхлорида, пошакрилатов, хлоркаучука.
- Входит в состав смесевых растворителей: Р-4 (Р-4А), Р-5 (Р-5А), Р-646, Р-647, Р-648 и др.
Используется для обезжиривания поверхности. В чистом виде можно использовать для разбавления грунтовок ЭП-0199 и ЭП-0263, эмалей Эвинал-21, Эвинал-28, ХС-436, Винэп, ХС-510, ЭП-437, ЭП-438.
Ацетон также может применяться для разбавления быстросохнущих лакокрасочных материалов (лаков, красок, эмалей, грунтов, шпаклевок), а также для растворения природных смол, диацетата целлюлозы, полистирола, эпоксидных смол, сополимеров винилхлорида, полиакрилатов, хлоркаучука и проч.
Производится по ГОСТ 2768-84.
Технические характеристики
| Наименование показателя | Норма по ГОСТ (ТУ) |
| Внешний вид и цвет | Бесцветная прозрачная жидкость |
| Массовая доля ацетона, %, не менее | 99,5 |
| Плотность, г/см3/см | 0,789-0,791 |
| Массовая доля воды, %, не более | 0,5 |
| Массовая доля метилового спирта, %, не более | 0,15 |
| Массовая доля кислот в пересчете на уксусную кислоту, %, не более | 0,002 |
| Устойчивость к окислению марганцево-кислым калием, ч, не менее | 2 |
Рис. 1. Малекула ацетона

Стандарт
ГОСТ 2768-84
Характеристики товара
По типу материала
Растворитель / Разбавитель, Прочее
По области применения
Полуфабрикатные материалы, Химическая промышленность
Купить Ацетон технический
Источник: https://www.infrahim.ru/products/2276/
Ацетон, основные особенности и сферы применения
Компания «Химсервис» предлагает купить ацетон по доступным ценам
Из школьного учебника химии известно, что самым простейшим органическим соединением, относящимся к группе кетонов, является диметилкетон. Это вещество, единственное из всей группы данных карбонилсодержащих соединений, имеет свое собственное нарицательное название – ацетон.
Причем, само слово «кетон» как раз и произошло от немецкого «aketon».
Дело в том, что ацетон был получен немецким химиком Андреасом Либавиусом в процессе сухой перегонки ацетата свинца еще в XVI веке, когда не существовало ни единой химической терминологии, ни даже периодической системы элементов.
Характеристики ацетона
Ацетон представляет собой бесцветное летучее вещество, обладающее характерным, довольно приятным запахом. Он отличается высокой гигроскопичностью, легко смешивается с водой, метанолом, этанолом, диэтиловым спиртом и другими растворителями в самых произвольных пропорциях.
Основные физические свойства
- Плотность – 0,7899 г/см3;
- Температура кипения – 56,1°С;
- Температура плавления – -95°С;
- Показатель оптического преломления – 1,3591 (при 20°С);
Основные химические свойства
- Молекулярная формула СН3-СО-СН3;
- Относительная молекулярная масса 58,08 г/моль;
Главной химической особенностью ацетона является его высокая реакционная способность. В частности, он является одним из немногих кетонов, способных образовывать бисульфидные соединения. Кроме того, атомы водорода в ацетоне легко замещаются галогенами.
Основные биологические свойства
Ацетон естественным способом вырабатывается в организме всех млекопитающих, включая человека. Он является продуктом метаболических реакций. У здорового человека в крови содержится 1-2 грамма ацетона на 100 мл, кроме того, 0,01-0,03 грамма выделяется в суточном объеме мочи.
Повышение содержания ацетона в организме может свидетельствовать о серьезных заболеваниях, в частности, сахарном диабете. Следует упомянуть, что из-за приятного запаха и специфического влияния на нервную систему ацетон можно причислить к наркотическим веществам.
Токсикоманы используют его для достижения состояния эйфории.
Однако ацетон в дозах свыше 60 мл смертельно опасен и приводит к существенным негативным изменениям в организме, вплоть до отека легких, пневмонии, гепатита, поражения почек и так далее.
Получение ацетона
Во всем мире производится около 7 миллионов тонн ацетона в год, и этот показатель непрерывно растет.
Вплоть до 1914 года данное вещество получали исключительно путем коксования древесины, однако повышенной спрос на ацетон в первой половине XX века привел к появлению более прогрессивных методов.
Сегодня основная часть ацетона в мире получается из пропена, например, кумольным методом в три стадии:
- получение кумола путем алкилирования пропеном бензола С6Н6+С3Н6=С6Н5СН(СН3)2;
- окисление кумола до гидропероксида С6Н5СН(СН3)2+О2= С6Н5С(ООН)(СН3)2;
- разложение гидропероксида на фенол и ацетон под действием серной кислоты С6Н5С(ООН)(СН3)2→С6Н5ОН+(СН3)2(СО).
- В небольших количествах ацетон также получается при брожении крахмала.
- Применение ацетона
- Ацетон является важнейшим представителем кетонов и применяется в самых различных областях человеческой жизнедеятельности.
- Применение ацетона в промышленности
- Ацетон – это самый востребованный в мире растворитель органических веществ, поэтому он в данном качестве широко применяется при производстве различных лаков, клеев, взрывчатых веществ, лекарственных препаратов, строительных очистительных жидкостей и так далее.
Важным преимуществом ацетона является его высокая безопасность по сравнению с альтернативными веществами – скипидаром, керосином или уайт-спиритом. В лабораторных условиях ацетон широко используется для мытья и быстрой сушки химической посуды, окисления различных спиртов, приготовления охлаждающих бань, а также в качестве полярного апротонного растворителя.
Бытовое применение ацетона
Ацетон наверняка имеется практически в каждом доме. Дело в том, что он, обладая весьма доступной стоимостью, является верным помощником в домашнем хозяйстве. В частности, ацетон можно использовать в следующих целях:
- Очистка сложных загрязнений. Ацетон успешно используется для выведения пятен краски с одежды и других объектов. С помощью него можно удалить даже суперклей с тканевой поверхности или остатки застывшего силикона без повреждения базовой структуры материала.
- Обезжиривание различных поверхностей перед покраской или другими работами. Например, металлические изделия перед нанесением слоя лака необходимо тщательно протереть тканью, смоченной в ацетоне.
- Улучшение характеристик бензиновых двигателей. Опытные автолюбители добавляют немного ацетона в бензобак, используя его некоторые важные достоинства. Высокая гигроскопичность позволяет ацетону хорошо перемешиваться с бензином, а качества растворителя помогают удалить накопившийся в форсунках и свечах нагар, а также весь конденсат без вреда для самой системы. Кроме того, из-за высокой концентрации кислорода в ацетоне улучшается воспламенение и сгорание топливной смеси, что снижает расход бензина и увеличивает динамические качества автомобиля.
Меры предосторожности при работе с ацетоном
Несмотря на низкую степень токсичности (в малых объемах), ацетон способен при высоких концентрациях вызывать раздражение кожных покровов и жжение в глазах.
Поэтому желательно при длительной работе с веществом использовать средства защиты (респиратор, перчатки и т. д.).
Также существенная опасность ацетона заключается в его высокой воспламеняемости (при температуре от +465°С) и взрывоопасности (при концентрации в воздухе от 2,5 до 12%).
Где приобрести?
Купить ацетон по наиболее доступным ценам вы сможете прямо на нашем сайте – www.chemservice.ru/materials/aceton/
Источник: http://www.reakor.ru/aceton-osnovnye-osobennosti-i-sfery-primeneniya.html
Применение ацетона технические характеристики
Ацетон – это органическое вещество, которое относится к классу насыщенных кетонов. Сам по себе ацетон представляет бесцветную жидкость с характерным, резким запахом уксуса. Он можно смешивать с органическими растворителями или водой, из-за чего вещество широко используется не только в промышленности, но и в быту.
Ацетон получил распространение в быту благодаря возможности растворять нитролаки, нитрокраски и органические вещества, из-за чего с его помощью можно обезжирить как керамические поверхности, так и любые другие (металл, древесины, бетон). Большое количество вещества может разрушить волокна антицелюллозы и резины, а также помочь с устранением солевого налета.
Производство ацетона завод Ясхим
Наибольшее применение ацетон получил в лакокрасочной промышленности из-за возможности растворять нитрокраску, а также обезжиривать поверхность машин смесью из грунтовки и ацетона. Практически ни одна серьезная работа по осуществлению покраски автомобиля не обходится без применения ацетона. В быстросохнущие краски также добавляют ацетон, чтобы улучшить долговечность лакокрасочного материала.
Он имеет малую токсичность, и может использоваться для выделения веществ из раствора (экстракции), что позволило его применять при производстве лекарственных препаратов, а также в пищевой и металлургической промышленности.
Химические свойства ацетона позволили использовать его для производства лака, пороха, стекла, кинопленок и много другого. Помимо того, он используется в качестве заполнителя ацетиленовых баллонов из-за возможности расщеплять ацетилен. Незаменим он так же и для строителей, т.к. с его помощью можно очистить поверхность инструмента и обрабатываемого материла от остатков монтажной пены.
Технические характеристики вещества согласно ГОСТу:
- Внешний вид – бесцветная жидкость
- Количество ацетона в веществе – не менее 99,5 %
- Количество воды – 0,5 %
- Количество кислот – 0,002 %
- Количество метилового спирта – 0,15 %
Ацетон относится к классу пожароопасных веществ, поэтому при работе следует избегать попадания на него прямых солнечных лучей и держать вдали от тепла. Он тяжелее воздуха и может накапливаться в невентилируемом помещении, что может быть причиной химического отравления или взрыва, если облако паров ацетона соприкоснётся с искрой или источником тепла.
Работать с ацетоном следует в перчатках и не допускать попадания вещества в слизистую оболочку глаза.
Источник: http://yashim.ru/stati/primenenie-aczetona-texnicheskie-xarakteristiki




