Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.
- В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
- NH3 + O2 → (кат. Pt) NO + H2O
- KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
- Кислотные свойства
- CaO + HNO3 → Ca(NO3)2 + H2O
- HNO3 + NaOH → NaNO3 + H2O
- Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑
- Термическое разложение
- Реакции с неметаллами
- Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная — до NO.
- HNO3(конц.) + C → CO2 + H2O + NO2
- HNO3(конц.) + S → H2SO4 + NO2 + H2O
- HNO3(разб.) + S → H2SO4 + NO + H2O
- HNO3(конц.) + P → H3PO4 + NO2 + H2O
- Реакции с металлами
- Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
- Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
- С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
- Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
- В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
- Al + HNO3(конц.) ⇸ (реакция не идет)
- При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
- Al + HNO3 → (t) Al2O3 + NO2 + H2O
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте. HNO3 → (hv) NO2 + H2O + O2

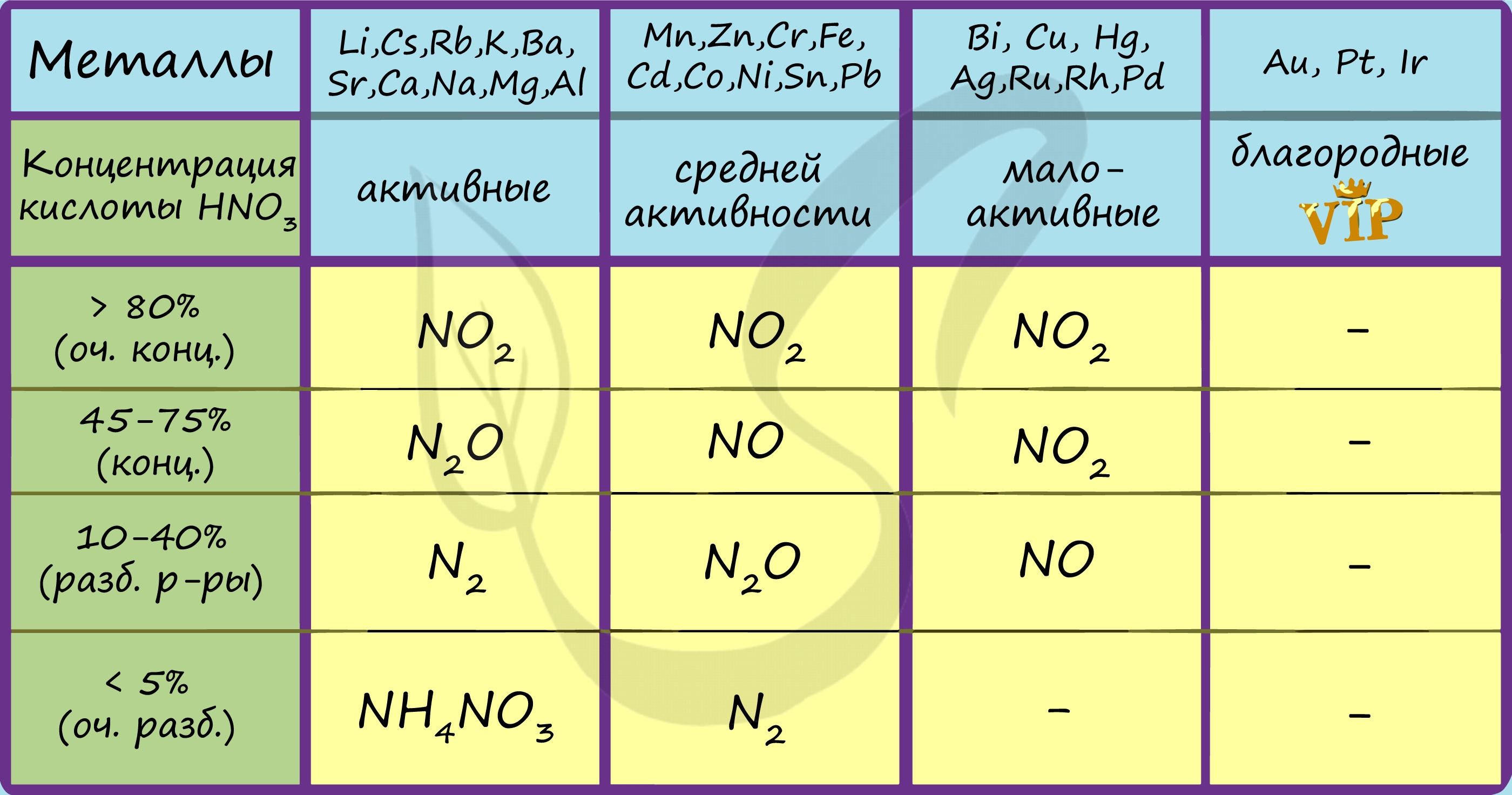
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O

Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O
Zn + HNO3(3% — оч. разб.) → Zn(NO3)2 + NH4NO3 + H2O
Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
- Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
- Fe + HNO3(разб.) → Fe(NO3)2 + NH4NO3 + H2O
- В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
- MgO + HNO3 → Mg(NO3)2 + H2O
- Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O
- Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + NH4NO3 + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
- Реакции с металлами, основаниями и кислотами
- Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
- Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
- AgNO3 + KCl → AgCl↓ + KNO3
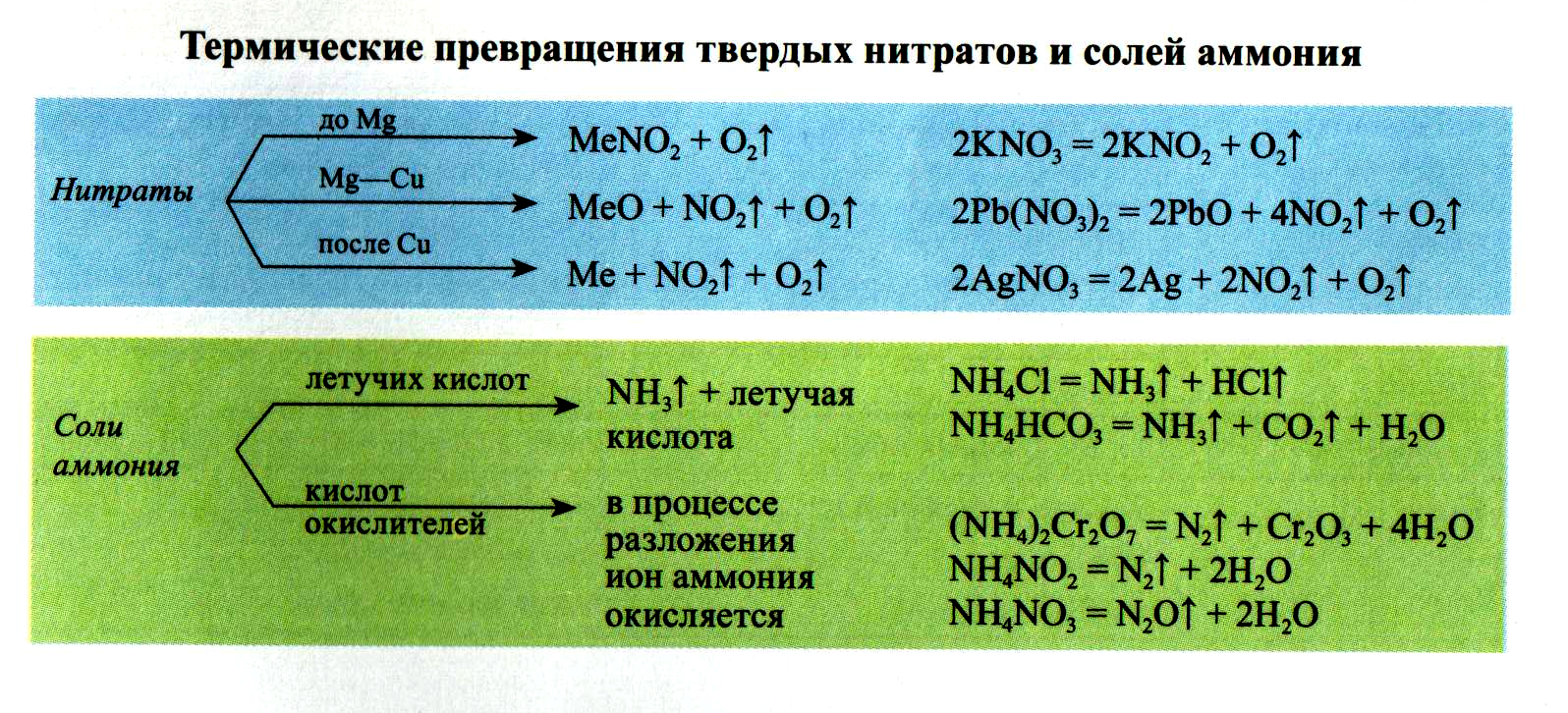
- Разложение нитратов
- Pb(NO3)2 → (t) PbO + NO2 + O2
- NaNO3 → (t) NaNO2 + O2
- Cu(NO3)2 → (t) CuO + NO2 + O2
- PtNO3 → (t) Pt + NO2 + O2
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.

Источник: https://studarium.ru/article/170
Азотная кислота. Свойства, добыча, применение и цена азотной кислоты
Ее хранят в темных емкостях. Свет не любит азотная кислота. При ярком освещении вещество разлагается на бурый газ – один из оксидов азота, и воду.
В полумраке же, кислота с водой легко смешивается в любых пропорциях. У вещества есть и кристаллическое состояние.
Оно может быть моноклинным и ромбическим. Это указывает на форму ячеек кристаллической решетки.

Моноклинная составлена из наклоненных параллелепипедов, а ромбическая, соответственно, из ромбов.
Отличаются ли свойства растворов кислоты от ее кристаллов, как вещество добывается и где применяется? Вопросы заданы, остается дать на низ ответы.
Свойства азотной кислоты
В обычных условиях кристаллическую кислоту можно лицезреть лишь в жарких странах.
В твердое состояние бесцветная жидкость переходит лишь при 42-ух градусах Цельсия. До этой отметки вещество остается жидким и парит.
При этом, реагент источает резкий, удушливый запах. С ним, собственно, связана история открытия азотной кислоты. Обнаружил ее Даниэль Резерфорд.
Шотландец изучал продукты сжигания серы, угля, фосфора. В ходе работ выделялся газ, который химик назвал удушливым воздухом.
Ученый отметил, что вещество не поддерживает горение и непригодно для дыхания.
Позже, выяснилась формула азотной кислоты: — HNO3. Получается, вещество одноосновное.
Так именуют кислоты, в состав которых входит лишь один атом водорода. С водой вещество смешивается в любых пропорциях.
Поэтому, существует концентрированная азотная кислота и неконцентрированная.

Первая активно дымит, то есть, летуча. Химические свойства концентрата разнятся с разбавленой версией.
Если кислоты в растворе около 60%, он будет реагировать со всеми металлами кроме алюминия, железа, иридия, хрома, натрия, золота и платины.
Отсюда вывод, в какой таре нужно хранить вещество. Золотые и платиновые фляги, конечно, не выгодны.
А вот емкости из железа и алюминия и бюджетны, и надежны, поскольку закрывают кислоту от света. Главное, не выбрать тару из меди. Азотная кислота ее растворит.
Реагируя с металлами, концентрированный раствор азотной кислоты выделяет бурый газ. Его формула: — NО2.
Параллельно, образуются соли кислоты. В зависимости от растворенного металла, реакции разнятся.
При взаимодействии с рядом до магния, образуются диоксиды, и выделяется кислород.
Реакция с солями металлов, находящимися после магния до меди, дает бурый газ, оксид азота и кислород.
Если к кислоте присоединится соль любого металла после меди, металл отделится. Вместе с ним выделяются бурый газ и кислород.
Разбавленная азотная кислота реагирует с большинством тех же металлов, но, окисляется при этом до аммиака.
К такому исходу приводит взаимодействие, к примеру, с цинком и элементами щелочноземельной группы. В реакцию вступает и железо.
Так что, разбавленную кислоту в емкостях из сплавов с феррумом лучше не хранить.
Итогом взаимодействия с азотной кислотой разбавленного типа может стать не только аммиак, но и аммиачная селитра.
Самый редкий вариант – закись азота. Ее даст, к примеру, реакция с магнием. С остальными металлами азотная кислота образует оксид азота.
Его можно получить, в частности, при взаимодействии с серебром. Выпадет оксид аргентума, образуется вода и оксид азота.
По этой же схеме проходят реакции кислоты с неметаллами, только, вместо солей формируется серная кислота.

Из реакций с другими кислотами примечательно смешивание с соляной. Последней, берут 3 части, а первой – одну. Получается царская водка.
Ее так назвали, поскольку вещество растворяет даже золото – металл правителей, сильных мира сего.
На такое не способна ни одна из чистых кислот. Благородные металлы им поддаются редко, а золото, вовсе, никогда.
Добыча азотной кислоты
В малых количествах вещество возможно добывать даже из воздуха, причем, в прямом смысле. Не секрет, что азот – одна из составляющих атмосферы.
На 15-ый газ в ней приходятся 78% . Азот реагирует с кислородом, образуя оксид. Дальнейшее окисление дает диоксид азота. Это тот самый бурый газ.
Он-то и реагирует с водой, взвесь которой, как известно, имеется в воздухе. Вступая в контакт с облаками, туманом, бурый газ переходит в азотную кислоту.
Массовая доля азотной кислоты в атмосфере столь мала, что вещество не наносит вред человеку, да и другим живым организмам.
Для промышленной добычи кислота из воздуха тоже не годится. На заводах пользуются иными схемами.
Первая: — производство азотной кислоты из аммиака. Сначала, проводят его конверсию, то есть, дробление состава исходной газовой смеси.
Реакция проходит на платинородиевых сетках при температуре около 1000 градусов Цельсия. Так получают оксид азота. Его окисляют до диоксида.
Это вторая стадия процесса. После, оксиды азота абсорбируют водой. В итоге, получается азотная кислота и чистая вода.
Описанный метод приводит к образованию разбавленной кислоты. Возможна последующая концентрация.
Поэтому, метод наиболее популярен, ведь потребителям нужна, как насыщенная, так и ненасыщенная кислоты.

Работая с аммиаком, промышленники «убивают одним выстрелом двух зайцев».
Второй метод производства реактива приводит сразу к получению концентрата. Речь о прямом синтезе из оксидов азота. Берут жидкие.
Они взаимодействуют с водой и кислородом. Такие реакции с азотной кислотой проходят под давлением в 5 мегапаскалей.
Получается диоксид азота. В обычных условиях он переходит в жидкое состояние. Окисление аммиака дает двойной оксид азота.
В газовой смеси его около 11%. Сжижжают диоксид под давлением. При стандартных условиях переход невозможен.
Применение азотной кислоты
Как составная царской водки азотная кислота является частью пробирных кислот. С их помощью изучают качество золота.
Без соответствующих исследований слитки не поступят в банки, а украшения – на прилавки магазинов.
Прежде чем апробировать и продать драгоценный металл, его нужно добыть. В этом тоже помогают азотная кислота и царская водка.
Ими обрабатывают руды, выводя нужные элементы в раствор. Остается осадить металлы и осушить, очистить от примесей. Так добывают не только благородные, но и неблагородные элементы.
Из металлов, как известно, делают сплавы, а из них, к примеру, технику. Если рассматривать воздушную и космическую, в них присутствует чистая кислота.
Ее примешивают к топливу, получая оксид. Азотная кислота выступает в роли окислителя.
В его присутствии процесс сгорания эффективнее, выделяется больше тепла. Так что, часть реагента производят для ракетного топлива.
Соль азотной кислоты – сырье для производства удобрений. Наиболее популярны: нитрат кальция, нитрат натрия, нитрат аммония и нитрат калия.
Все это соли, объединенные названием «селитры». Азот позволяет растениям быстро развиваться, повышает урожайность.
Дело в том, что 15-ый элемент входит в состав хлорофилла. Это зеленый пигмент растений, отвечающий за усвоение энергии Солнца.
Чем больше освоенной энергии, тем лучше развитие трав, кустарников, деревьев.
Слово «селитра» на слуху и у пиротехников. Азотная кислота – основа взрывчатых веществ.
Аммиачной селитры в большинстве из них около 60%. Остатки – дизельное топливо, или иное горючее. Получить можно, как безобидный фейерверк, так и военную бомбу.
Цена азотной кислоты
Азотная кислота, как и большинство востребованных кислот, бывает чистой и технической, отягощенной примесями. Последняя дешевле.
Чистый реагент дороже. Для справки, ГОСТ 4461-77 – норма для очищенной кислоты.
Реагент российского производства стоит в районе 30-55-ти рублей за килограмм. Ценник зависит от концентрации раствора.
Для технической кислоты верхний ценовой предел, обычно, составляет 40 рублей за кило. Предусмотрена и большая фасовка.
Есть, к примеру, 25-литровые канистры, в которые разливается азотная кислота.
Купить реагент с максимальной выгодой позволяют оптовые заказы. Такие уходят на предприятия, где знают правила обращения с реагентом.

Он разъедает не только металлы, но и слизистые. Пары вещества могут затруднить дыхание, повредить трахеи, выстилающие ткани носа.
Поэтому, с кислотой работают лишь в масках. При нарушении правил, кроме трудностей с дыханием, наступает отравление.
Интоксикация выражается в рвоте, чесотке, нарушениях зрения, обоняния. Более-менее безобидны лишь слабые растворы реагента.
Именно такие, к примеру, используют в школьных лабораториях. Учиться обращению с химическими реагентами стоит с малых лет.
Источник: https://tvoi-uvelirr.ru/azotnaya-kislota-svojstva-dobycha-primenenie-i-cena-azotnoj-kisloty/
Азотная кислота: формула химическая, свойства, получение и применение
Образование 23 февраля 2018
Один из наиболее важных продуктов, используемых человеком, – это нитратная кислота.
Формула вещества – HNO3, оно же обладает и разнообразными физическими и химическими характеристиками, отличающими его от других неорганических кислот.
В нашей статье мы изучим свойства азотной кислоты, ознакомимся с методами ее получения, а также рассмотрим сферы применения вещества в различных отраслях промышленности, медицины и сельского хозяйства.
Особенности физических свойств
Полученная в лаборатории азотная кислота, структурная формула которой приведена ниже, представляет собой бесцветную жидкость с неприятным запахом, более тяжелую, чем вода. Она быстро испаряется и имеет невысокую температуру кипения, равную +83 °С.
Соединение легко смешивается с водой в любых пропорциях, образуя растворы различной концентрации. Более того, нитратная кислота может поглощать влагу из воздуха, то есть является гигроскопическим веществом.
Структурная формула азотной кислоты неоднозначна, и может иметь две формы.

В молекулярном виде нитратная кислота не существует. В водных растворах различной концентрации вещество имеет вид следующих частиц: H3O+ — ионов гидроксония и анионов кислотного остатка — NO3-.
Кислотно-основное взаимодействие
Азотная кислота, являющаяся одной из самых сильных кислот, вступает в реакции замещения, обмена, нейтрализации. Так, с основными оксидами соединение участвует в обменных процессах, в результате которых получается соль и вода. Реакция нейтрализации – основное химическое свойство всех кислот. Продуктами взаимодействия оснований и кислот всегда будут соответствующие соли и вода:
NaOH + HNO3→ NaNO3 + H2O
Реакции с металлами
В молекуле азотной кислоты, формула которой HNO3, азот проявляет самую высокую степень окисления, равную +5, поэтому вещество обладает ярко выраженными окислительными свойствами.
Как сильная кислота оно способно взаимодействовать с металлами, стоящими в ряду активности металлов до водорода. Однако она, в отличие от других кислот, может реагировать и с пассивными металлическими элементами, например, с медью или серебром.
Реагенты и продукты взаимодействия определяются, как концентрацией самой кислоты, так и активностью металла.

Разбавленная азотная кислота и ее свойства
Если массовая доля HNO3 составляет 0,4-0,6, то соединение проявляет все свойства сильной кислоты. Например, диссоциирует на катионы водорода и анионы кислотного остатка. Индикаторы в кислой среде, например, фиолетовый лакмус, в присутствии избытка ионов H+ меняет свою окраску на красную.
Важнейшая особенность реакций нитратной кислоты с металлами – это невозможность выделения водорода, который окисляется до воды. Вместо него образуются различные соединения – оксиды азота. Например, в процессе взаимодействия серебра с молекулами азотной кислоты, формула которой HNO3, обнаруживается монооксид азота, вода и соль – нитрат серебра.
Степень окисления азота в сложном анионе снижается, так как происходит присоединение трех электронов.

С активными металлическими элементами, такими, как магний, цинк, кальций, нитратная кислота реагирует с образованием окиси азота, валентность которого наименьшая, она равна 1. Также образуются соль и вода:
4Mg + 10HNO3 = NH4NO3 + 4Mg(NO3)2 + 3H2O
Если же азотная кислота, химическая формула которой HNO3, очень разбавлена, в этом случае, продукты ее взаимодействия с активными металлами будут различными.
Это может быть аммиак, свободный азот или оксид азота (І). Все зависит от внешних факторов, к которым можно отнести степень измельчения металла и температуру реакционной смеси.
Например, уравнение ее взаимодействия с цинком будет иметь следующий вид:
Zn + 4HNO3= Zn(NO3)2+ 2NO2+ 2H2O
Концентрированная HNO3 (96-98%) кислота в реакциях с металлами восстанавливается до диоксида азота, причем, это обычно не зависит от положения металла в ряду Н. Бекетова. Так происходит в большинстве случаев, например, при взаимодействии с серебром.

Запомним исключение из правила: концентрированная азотная кислота в обычных условиях не реагирует с железом, алюминием и хромом, а пассивирует их.
Это значит, что на поверхности металлов образуется защитная оксидная пленка, препятствующая дальнейшему их контакту с молекулами кислоты.
Смесь вещества с концентрированной хлоридной кислотой в соотношении 3:1 называется царской водкой. Она имеет способность растворять золото.
Как нитратная кислота реагирует с неметаллами
Сильные окислительные свойства вещества приводят к тому, что в его реакциях с неметаллическими элементами, последние переходят в форму соответствующих кислот. Например, сера окисляется до сульфатной, бор – до борной, а фосфор – до фосфатных кислот. Приведенные ниже уравнения реакций подтверждают это:
S0 + 2HNVO3 → H2SVIO4 + 2NIIO
Получение азотной кислоты
Наиболее удобный лабораторный способ получения вещества – взаимодействие нитратов с концентрированной сульфатной кислотой. Ее проводят при слабом нагревании, не допуская повышения температуры, так как в этом случае получившийся продукт разлагается.
В промышленности азотную кислоту можно добыть несколькими способами. Например, окислением аммиака, полученным из азота воздуха и водорода. Производство кислоты проходит в несколько стадий. Промежуточными продуктами будут оксиды азота.
Вначале образуется монооксид азота NO, затем кислородом воздуха его окисляют до двуокиси азота. Наконец, в реакции с водой и избытком кислорода из NO2 добывают разбавленную (40-60%) нитратную кислоту.
Если ее перегонять с концентрированной сульфатной кислотой, можно повысить массовую долю HNO3 в растворе до 98.
Вышеописанный метод производства нитратной кислоты, впервые был предложен основателем азотной промышленности в России И. Андреевым еще в начале 20 века.
Применение
Как мы помним, химическая формула азотной кислоты HNO3. Какая особенность химических свойств обуславливает ее применение, если нитратная кислота является многотоннажным продуктом химического производства? Это высокая окислительная способность вещества. Его применяют в фармацевтической промышленности для получения лекарственных препаратов.
Вещество служит исходным сырьем для синтеза взрывчатых соединений, пластических масс, красителей. Нитратная кислота применяется в военной технике в качестве окислителя для ракетного топлива. Большой ее объем применяют в производстве важнейших видов азотных удобрений – селитр.
Они способствуют повышению урожайности важнейших сельскохозяйственных культур и повышают содержание в плодах и зеленой массе белка.

Области применения нитратов
Рассмотрев основные свойства, получение и применение азотной кислоты, остановимся на использовании важнейших ее соединений – солей. Они являются не только минеральными удобрениями, некоторые из них имеют большое значение в военной промышленности.
Например, смесь, состоящая из 75% нитрата калия, 15% мелкодисперсного угля и 5% серы называется черным порохом. Из нитрата аммония, а также порошка угля и алюминия получают аммонал – взрывчатое вещество.
Интересное свойство солей нитратной кислоты – это их способность разлагаться при нагревании.

Причем, продукты реакции будут зависеть от того, ион какого металла входит в состав соли. Если металлический элемент находится в ряду активности левее магния, от в продуктах обнаруживаются нитриты и свободный кислород.
Если металл, входящий в состав нитрата, расположен от магния до меди включительно, то при нагревании соли происходит образование диоксида азота, кислорода и оксида металлического элемента.
Соли серебра, золота или платины при высокой температуре образуют свободный металл, кислород и двуокись азота.
В нашей статье мы выяснили, какая химическая формула азотной кислоты в химии, и какие особенности ее окислительных свойств имеют наиболее важное значение.
Источник: fb.ru
Источник: https://monateka.com/article/271675/
ХимЭлемент | Азотная кислота. Применение, свойства и характеристики
14
февр.
Азотная кислота – это неорганическая сильная кислота. Внешне выглядит, как прозрачная, жидкость с насыщенным желтоватым оттенком. Химическая формула соединения HNO3
Физические свойства азотной кислоты
В естественных условиях, будучи помещённой в любой открытый сосуд, азотная кислота создаёт ощущение постоянно дымящей жидкости в силу изобилия исходящих от неё испарений. Вещество превосходно смешивается с водой, по этой причине в технических целях редко используется в чистом виде, чаще применяются водные растворы кислоты. Не растворяет и не взаимодействует со стеклом и фторопластом-4.
Температура плавления — 41°С, температура кипения в стандартных условиях +82,6°С, кипение сопровождается некоторым распадом вещества. В результате кристаллизации водных растворов данный химикат способен образовывать кристаллогидраты.
Азотная кислота – это тяжёлая жидкость. Обусловлено это повышенной плотностью вещества. Удельный вес кислоты в полтора раза выше аналогичного показателя у воды.
Смешивается с другими неорганическими кислотами. Смесь азотной кислоты и серной называется «меланж». Смесь азотной и соляной кислоты в пропорции 1:3 называется «царской водкой», эта смесь обладает уникальными свойствами, в числе которых способность растворять некоторые инертные металлы и прочее.

Химические свойства азотной кислоты
Вещество обладает набором свойств, характерным для своего класса, то есть, азотная кислота взаимодействует с широчайшей номенклатурой соединений и химических элементов. Способна взаимодействовать с основаниями, с солями других кислот, вытесняя при этом более слабые кислоты из образованных ими солей.
Обладая свойствами сильного окислителя, реагирует с неметаллами, образовывая кислоты: при реакции с серой образовывает серную кислоту, с фосфором – фосфорную и так далее.
Вступает во взаимодействие с органическими веществами, при этом, некоторые из них при такой реакции воспламеняются. Примеры: скипидар, амины и прочие химикаты.
Взаимодействие азотной кислоты с металлами
Азотная кислота не реагирует с инертными (благородными – золото, платина, тантал и другие) металлами ни будучи в концентрированном виде, ни в водном растворе любой пропорции. С остальными же металлами (их оксидами) данный химикат вступает в классическую реакцию замещения, образовывая соли азотной кислоты – нитраты.
Нитраты по-другому называются селитрами и являются одной из наиболее распространённых разновидностей удобрений. Известен также нитрат, образованный при взаимодействии с неметаллом – аммониевая селитра с формулой NH4NO3.
Сильные окислительные свойства, присущие азотной кислоте, присущи также и её солям. Селитры, как правило, являются взрывоопасными и горючими веществами, что существенно повлияло на область их применения в производственно-хозяйственных целях.
Применение азотной кислоты
Основным индустриальным направлением, в котором может использоваться данный химикат, является получение его нитратов. И азотная кислота, как производная для их синтеза, востребована в производстве минеральных удобрений, взрывчатых веществ, пиротехники и так далее.
Кроме этого, данный реактив может эксплуатироваться в некоторых прикладных отраслях химического производства. В частности, в изготовлении широкой номенклатуры лакокрасочных материалов, лекарственных средств.
Востребована, как присадка к реактивному топливу. А также может использоваться, как сырьё для получения широчайшего спектра азотосодержащих химических веществ: анилин, нитроцеллюлоза, алканы и прочие.

Получение азотной кислоты
Современный промышленный способ синтеза этого химиката основан на, так называемом, методе Оствальда. Данный метод состоит в окислении синтетического аммиака с применением платино-родиевых катализаторов.
На первом этапе образуется окись азота, которая при последующей переработке преобразуется в диоксид азота, трансформирующийся в результате окислительной реакции и насыщении водой в водный раствор азотной кислоты с концентрацией вещества 45-58%.
Виды азотной кислоты
Синтезированный реактив в зависимости от условий, в которых он был получен, включает в себя некоторое количество воды, и в дальнейшем может подвергаться обработке с целью придания ему необходимых свойств. Таким образом, различные разновидности этого химиката:
Азотная кислота ХЧ – это водный раствор с концентрацией основного вещества 65%. Химически чистая кислота, применяемая для различных производственных нужд, в том числе, для лабораторной практики, травильных работ и прочих отраслей индустрии.
Азотная кислота Ч – это водный раствор с концентрацией основного вещества 56%.
Азотная кислота ОСЧ – водный раствор с концентрацией основного вещества не менее 70%. Особо чистая кислота с широчайшей областью использования в производстве.
Азотная кислота ЧДА – это водный раствор с концентрацией основного вещества на уровне 57%. Чистая для анализа кислота, применяемая в исследовательских работах и в прочих направлениях хозяйственной деятельности.
Азотная кислота. Класс опасности
Данный реактив принадлежит к числу опасных химических веществ. Его непосредственное соприкосновение с кожными покровами человеческого тела оставляет на коже сильный химический ожог, незаживающий на протяжении длительного времени.
Опасны также и испарения азотной кислоты. При вдыхании они поражают слизистые оболочки органов дыхательной системы. Концентрированная кислота крайне нестабильна по причине повышенной химической активности и в результате распада образовывает отравляющее вещество – диоксид азота, газ бурого цвета, крайне опасный для здоровья человека.

Поэтому азотная кислота должна храниться в плотно закупоренных сосудах, при работе с ней необходимо использовать индивидуальные средства защиты.
Обязательным является наличие в рабочих помещениях эффективной вентиляционной системы, и соблюдение правил техники безопасности при работе с химикатом.
Интернет-магазин ХимЭлемент реализует широчайший ассортимент химической продукции, в том числе и кислоты. Наша компания предлагает купить азотную кислоту в Украине со скидкой и доставкой во все регионы и населённые пункты страны.
- Интересные публикации:
- Соляная кислота. Формула, характеристики и применение
- Плавиковая кислота. Применение и свойства
- Серная кислота. Формула, характеристики и применение
- Ортофосфорная кислота. Применение, свойства и характеристики
- Олеиновая кислота. Применение, свойства и характеристики
Источник: https://him-element.com.ua/news/67
Конспект урока по химии на тему "Азотная кислота" (9 класс)
-
Состав и строение молекулы

Формула молекулярная — HNO3
«Крепкая водка» (хим.-техн.) — старинное, а в настоящее время употребительное в торговле и технике, название азотной кислоты HNO3 (фр. acide nitrique, ас. azotique, нем. Salpeters ä ure, англ. nitric acid).
Азотная кислота имеет длинную историю, восходящую к IX веку. Пepвым, кто пoлyчил aзoтнyю киcлoтy, был apaбcкий aлxимик, имевший пceвдoним Гeбep. Bпepвыe кoнцeнтpиpoвaннaя дымящaяcя aзoтнaя киcлoтa была пoлyчeнa в 1648 гoдy нeмeцким aптeкapeм — aлxимикoм Иoгaннoм Pyдoльфoм Глayбepoм пyтeм пepeгoнки aзoтнoй киcлoты, пoлyчeннoй взaимoдeйcтвиeм cepнoй киcлoты и кaлиeвoй ceлитpы KNO3 .
B 1763 гoдy M. B. Лoмoнocoв иccлeдoвaл и oпиcaл этoт мeтoд. Texнoлoгия пoлyчeния aзoтнoй киcлoты не мeнялacь дo кoнцa XVIII cтoлeтия. B Poccии в 1910 гoдy былo пoлyчeнo 8100 тонн aзoтнoй киcлoты, a в 1914-м — 18 000 тонн..
B 1776 гoдy Aнтyaн-Лopaн Лaвyaзьe пpивeл дoкaзaтeльcтвa наличия в aзoтнoй киcлoтe киcлopoдa, a в 1826 гoдy Джoзeф Льюиc Гeй-Люccaк, пpoфeccop физики и химии в пapижcкoй Copбoннe и выcшeй Пoлитexничecкoй шкoлe, oпpeдeлил фopмyлy aзoтнoй киcлoты. Гeй-Люccaк тaкжe paзpaбoтaл нeкoтopыe ycoвepшeнcтвoвaния в методе получения азотной кислоты.
В природе азотная кислота в свободном состоянии не встречается, но в соединении с основаниями в виде солей (селитр) распространена, обыкновенно в малых количествах, почти повсюду.
В воздухе следы ее содержатся в виде азотноаммиачной соли и образуются частью прямым соединением азота с кислородом в присутствии влаги и аммиака под влиянием электрических разрядов (особенно во время гроз) и разнообразных окислительных процессов, частью окислением самого аммиака. Поэтому она всегда почти находится в дождевой воде и др. атмосферных осадках.
В воде озер, рек и источников, попадая в них частью из атмосферы, а главным образом из почвы, находится также в весьма малых дозах, не превышающих нескольких миллиграмм на литр.
- бесцветная жидкость, =1,5г/см3, t°кип=86С, t°зам= 41С,
- желтеет при хранении, взрывоопасна, дымит на воздухе.
- С водой смешивается в любых отношениях. В отсутствии воды азотная кислота
- неустойчива, разлагается на свету с выделением кислорода уже при обычных
- температурах, причём выделяющейся двуокисью азота NO2 окрашивается в жёлтый цвет,
- а при высоких концентрациях NO2 – в красный.
- Смесь концентрированной азотной и соляной кислоты в отношении 1:3, называемая
- «царской водкой», растворяет даже золото и платину, «царские металлы».
А. Общие с другими кислотами
- HNO3 H+ + NO3
- H+ изменяет окраску индикатора
- 2H+ + CuO = Cu2+ + H2O
- ………………………….
- а) со щелочами: H+ + OH = H2O
- …………………………
- б) с нерастворимыми:
- 2H+ + Cu(OH)2 = Cu2+ + 2H2O
…………………………
2H+ + CaCO3 = Ca2+ + CO2 + H2O
…………………………
…………………………..
- Б. Специфические, особые
- 1) разложение на свету или при t°:
- HNO3 = H2O + NO2 + O2
- бурый
- газ
- ………расставь коэффициенты
- ………составь электронный баланс
- Азотная кислота сильный окислитель
- 2) Реагирует с неактивными металлами:
- Cu + HNO3 = Cu(NO3)2 + NO2 + H2O
- конц. бурый
- газ
- ………расставь коэффициенты
- ………составь электронный баланс
- 3) Окисление азотной кислотой
- некоторых неметаллов (уголька):
- C + HNO3 = CO2+ NO2 + H2O
- конц. бурый
- газ
- ………расставь коэффициенты
- ………составь электронный баланс
- 4) качественная реакция
- на нитратион NO3
- …………………………….
-
Получение азотной кислоты:
А) в лаборатории: NaNO3 + H2SO4 = HNO3 + NaHSO4
тверд. конц.
- Б) в промышленности:
- N2 NH3 NONO2 HNO3
- ……………………………………
-
Применение азотной кислоты:
![]()
красители взрывчатые пластмассы волокна лекарства
![]() вещества
вещества
Источник: https://infourok.ru/konspekt-uroka-po-himii-na-temu-azotnaya-kislota-klass-722723.html
Азотная кислота
 Концентрированная азотная кислота
Концентрированная азотная кислота
Азотная кислота (HNO3) — одна из сильных одноосновных кислот с резким удушливым запахом, чувствительна к свету и при ярком освещении разлагается на один из оксидов азота (ещё называемый бурым газом — NO2 ) и воду. Поэтому её желательно хранить в тёмных ёмкостях. В концентрированном состоянии она не растворяет алюминий и железо, поэтому можно хранить в соответствующих металлических ёмкостях.
Азотная кислота — является сильными электролитом как многие кислоты) и очень сильный окислитель. Её часто используют при реакциях с органическими веществами.
Безводная азотная кислота — бесцветная летучая жидкость (t кип=83 °С; из-за летучести безводную азотную кислоту называют «дымящей») с резким запахом.
Азотная кислота как и озон может образовываться в атмосфере при вспышках молнии. Азот, который составляет 78% состава атмосферного воздуха, реагирует с атмосферным кислородом, образуя оксид азота NO.
При дальнейшем окислении на воздухе этот оксид переходит в диоксид азота (бурый газ NO2), который реагирует с атмосферной влагой (облаками и туманом), образуя азотную кислоту .
Но такое малое количество совершенно безвредно для экологии земли и живых организмов.
Один объем азотной и три объема соляной кислоты образуют соединение, называемое «царской водкой». Она способна растворять металлы (платину и золото), нерастворимые в обычных кислотах. При внесении в эту смесь бумаги, соломы, хлопка, произойдёт энергичное окисление, даже воспламенение.
При кипячении она раскладывается на составляющие компоненты (химическая реакция разложения):
HNO3 = 2NO2 +O2 + 2H2O — выделяется бурый газ (NO2), кислород и вода.
 Азотная кислота (при нагревании выделяется бурый газ)
Азотная кислота (при нагревании выделяется бурый газ)
Cвойства азотной кислоты
Cвойства азотной кислоты могут быть разнообразными даже при реакциях с одним тем же веществом. Они напрямую зависят от концентрации азотной кислоты. Рассмотрим варианты химических реакций.
— азотная кислота концентрированная:
С металлами железом (Fe), хромом (Cr), алюминием (Al), золотом (Au), платиной (Pt), иридием (Ir), натрием (Na) — не взаимодействует по причине образования на их поверхности защитной плёнки, которая не позволяет дальше окисляться металлу.
Со всеми остальными металлами при химической реакции выделяется бурый газ (NO2). Например, при химической реакции с медью (Cu): 4HNO3 конц. + Cu = Cu(NO3)2 + 2NO2 + H2O С неметаллами, например с фосфором: 5HNO3 конц. + P = H3PO4 + 5NO2 + H2O
- — разложения солей азотной кислоты
- В зависимости от растворённого металла разложение соли при температуре происходит следующими образом: Любой металл (обозначен как Me) до магния (Mg):
- MeNO3 = MeNO2 + O2
- MeNO3 = MeO + NO2 + O2
- MeNO3 = Me + NO2 + O2
Любой металл от магния (Mg) до меди (Cu): Любой металл после меди (Cu):
— азотная кислота разбавленная:
При взаимодействии с щелочно-земельными металлами, а также цинком (Zn), железом (Fe), она окисляется до аммиака (NH3) или же до аммиачной селитры (NH4NO3). Например при реакции с магнием (Mg): 10HNO3 разбавл.
+ 4Zn = 4Zn(NO3)2 + NH4NO3 + 3H2O Но может также и образовываться закись азота (N2O), например , при реакции с магнием (Mg): 10HNO3 разбавл.
+ 4Mg = 4Mg(NO3)2 + N2O + 5H2O С остальными металлами реагирует с образованием оксида азота (NO), например, растворяет серебро (Ag):
2HNO3 разбавл. + Ag = AgNO3 + NO + H2O
Аналогично реагирует с неметаллами, например с серой: 2HNO3 разбавл. + S = H2SO4 + 2NO — окисление серы до образования серной кислоты и выделения газа оксида азота.
- — химическая реакция с оксидами металлов, например, оксид кальция:
- 2HNO3 + CaO = Ca(NO3)2 + H2O — образуется соль (нитрат кальция) и вода
- — химическая реакция с гидроксидами (или основаниями), например, с гашеной известью
- 2HNO3 + Ca(OH)2 = Ca(NO3)2 + H2O — образуется соль (нитрат кальция) и вода — реакция нейтрализации
- — химическая реакция с солями, например с мелом:
- 2HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2 — образуется соль (нитрат кальция) и другая кислота (в данном случае образуется угольная кислота, которая распадается на воду и углекислый газ).
Источник: https://www.kristallikov.net/page98.html
Азотная кислота химические свойства | Дистанционные уроки
— сильный окислитель.
Это сильная кислота. Бесцветная, концентрированная азотная кислота на воздухе дымит. Очень быстро становится коричневого (бурого) цвета из-за реакции разложения:
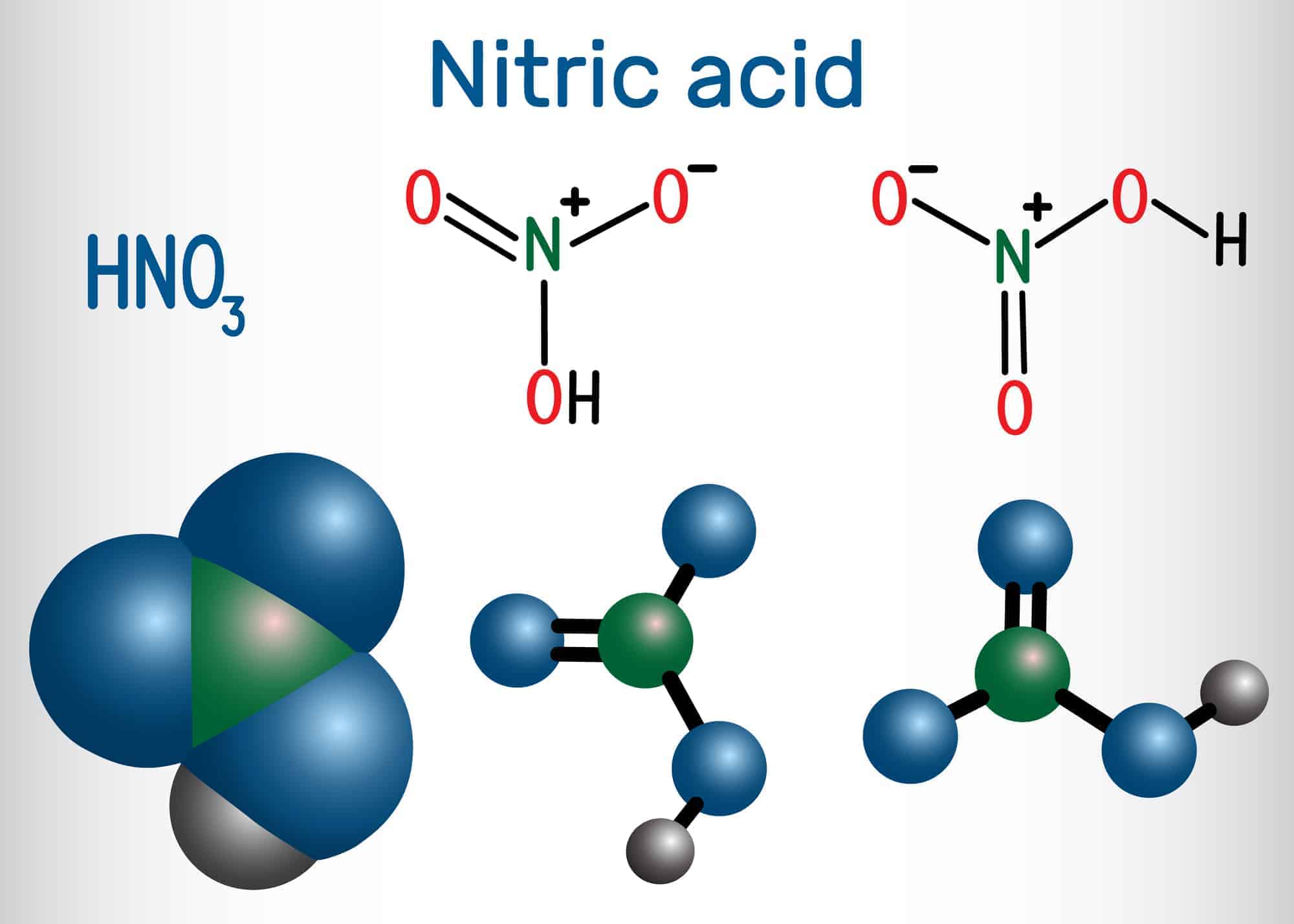
- 4HNO3 = 4NO2 + 2H2O + O2
- Очень рекомендую почитать лекцию ПОДГРУППА АЗОТА — тогда многие химические свойства азотной кислоты будут более понятны.
Почему? Да потому что азот N проявляет в этом соединении степень окисления +5, что соответствует номеру его группы. Т.е. сам азот N может только понизит свою степень окисления — восстановиться. Значит, по химическим свойствам азотная кислота — сильный окислитель.
- S + HNO3 = NO2 + SO2 + H2O
- окислитель N(+5) +1e(-) = N(+4) — восстановление
- восстановитель S(0) -4e(-) =S(+4) — окисление
- S +4 HNO3 = 4NO2 + SO2 + 2H2O
Это просто один из примеров таких реакций. Продукт реакции — оксид азота (IV) — NO2, не единственно возможный, есть еще варианты, и их образование подчиняется определенным правилам.
- Химические свойства азотной кислоты
- Правила взаимодействия азотной кислоты и металлов
- 1 правило — правило концентрации
- Концентрированная азотная кислота восстанавливается до оксида азота (IV) — NO2
- Zn + 4HNO3 (конц) = Zn(NO3)2 + 2NO2 + 2H2O
- Разбавленная азотная кислота восстанавливается до оксида азота (II) — NO
- 3Zn + 8HNO3 (разб) = 3Zn(NO3)2 + 2NO + 4H2O
- 2 правило — правило металла
- Смотрим ряд активности металлов!
- С золотом (Au) и платиной (Pt)азотная кислота не реагирует ни при каких условиях.
- Азотная кислота и металлы, стоящие в ряду напряжений после водорода — применимо правило 1 — правило концентрации:
Сu + 4HNO3 (конц) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 (разб) = 3Cu(NO3)2 + 2NO + 4H2O - Азотная кислота и металлы, стоящие в ряду напряжений до водорода: вариантов продуктов немало, есть закономерность:
-

- Все реакции азотной кислоты — окислителя ( с металлами и неметаллами) изучаем ЗДЕСЬ!
- Соли азотной кислоты
- (нитраты)
- Здесь мы рассмотрим вопрос реакций разложения нитратов
-
- Разложение нитратов металлов, стоящих в ряду напряжений ДО МАГНИЯ — до нитритов:
2KNO3 = 2KNO2 + O2
- Разложение нитратов металлов, стоящих в ряду напряжений ДО МАГНИЯ — до нитритов:
-
- Разложение нитратов металлов правее магния ( и после водорода) и до меди (Сu) — на соответствующий оксид металла и оксид азота (IV) NO2:
2Сu(NO3)2 = 2CuO + 4NO2 + O2
- Разложение нитратов металлов правее магния ( и после водорода) и до меди (Сu) — на соответствующий оксид металла и оксид азота (IV) NO2:
-
- Разложение нитратов металлов правее ртути — до металла:
2AgNO3 =2 Ag + 2NO2 + O2
- Разложение нитратов металлов правее ртути — до металла:
- Нитрат аммония разлагается до образования оксида азота(I) — N2O:
NH4NO3 = N2O + 2H2O
На нитрат-ионы NO3(-) нет качественных реакций — все соли азотной кислоты очень хорошо растворимы в воде.
Обсуждение: «Азотная кислота химические свойства»
(Правила комментирования)
Источник: https://distant-lessons.ru/azotnaya-kislota-ximicheskie-svojstva.html
Азотная кислота и нитраты
Азотная кислота HNO3 — бесцветная жидкость, имеет резкий запах, легко испаряется. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой NaHCO3)
Молекулярная формула: HNO3, B(N) = IV, С.О. (N) = +5

Атом азота образует 3 связи с атомами кислорода по обменному механизму и 1 связь — по донорно-акцепторному механизму.
Физические свойства
Безводная HNO3 при обычной температуре — бесцветная летучая жидкость со специфическим запахом (т. кип. 82,6'С).
Концентрированная «дымящая» HNO3 имеет красный или желтый цвет, так как разлагается с выделением NO2. Азотная кислота смешивается с водой в любых соотношениях.
Способы получения
- I. Промышленный — 3-стадийный синтез по схеме: NH3 → NO → NO2 → HNO3
- 1 стадия: 4NH3 + 5O2 = 4NO + 6H2O
- 2 стадия: 2NO + O2 = 2NO2
- 3 стадия: 4NO2 + O2 + 2H2O = 4HNO3
II. Лабораторный — длительное нагревание селитры с конц. H2SO4:
2NaNO3(тв.) +H2SO4(конц.) = 2HNO3 + Na2SO4
Ba(NO3)2(тв) +H2SO4(конц.) = 2HNO3 + BaSO4
Химические свойства
HNO3 как сильная кислота проявляет все общие свойства кислот
HNO3 → H+ + NO3-
HNO3 — очень реакционноспособное вещество. В химических реакциях проявляет себя как сильная кислота и как сильный окислитель.
- HNO3 взаимодействует:
- а) с оксидами металлов 2HNO3 + CuO = Cu(NO3)2 + H2O
- б) с основаниями и амфотерными гидроксидами 2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O
- в) с солями слабых кислот 2HNO3 + СaСO3 = Ca(NO3)2 + СO2↑ + H2O
- г) с аммиаком HNO3 + NH3 = NH4NO3
Отличие HNO3 от других кислот
1. При взаимодействии HNO3 с металлами практически никогда не выделяется Н2, так как ионы H+ кислоты не участвуют в окислении металлов.
2. Вместо ионов H+ окисляющее действие оказывают анионы NO3-.
3. HNO3 способна растворять не только металлы, расположенные в ряду активности левее водорода, но и малоактивные металлы — Си, Аg, Нg. В смеси с HCl растворяет также Au, Pt.
HNO3 — очень сильный окислитель
- I. Окисление металлов:
- Взаимодействие HNO3: а) с Me низкой и средней активности: 4HNO3(конц.) + Сu = 2NO2↑ + Cu(NO3)2 + 2H2O
- 8HNO3(разб.) + ЗСu = 2NO↑ + 3Cu(NO3)2 + 4H2O
- б) с активными Me: 10HNO3(разб.) + 4Zn = N2O + 4Zn(NO3)2 + 5H2O
в) с щелочными и щелочноземельными Me:
10HNO3(оч. разб.) + 4Са = NH4NO3 + 4Ca(NO3)2 + 3H2O
Очень концентрированная HNO3 при обычной температуре не растворяет некоторые металлы, в том числе Fe, Al, Cr.
II. Окисление неметаллов:
HNO3 окисляет Р, S, С до их высших С.О., сама при этом восстанавливается до NO (HNO3 разб.) или до NO2 (HNO3 конц ).
- 5HNO3 + Р = 5NO2↑ + H3PO4 + H2O
- 2HNO3 + S = 2NO↑ + H2SO4
- III. Окисление сложных веществ:
- Особенно важными являются реакции окисления сульфидов некоторых Me, которые не растворяются в других кислотах. Примеры:
- 8HNO3 + PbS = 8NO2↑ + PbSO4 + 4H2O
- 22HNO3 + ЗСu2S = 10NO↑ + 6Cu(NO3)2 + 3H2SO4 + 8H2O
HNO3 — нитрующий агент в реакциях органического синтеза
- R-Н + НО-NO2 → R-NO2 + H2O
- Примеры:
- С2Н6 + HNO3 → C2H5NO2 + H2O нитроэтан
- С6Н5СН3 + 3HNO3 → С6Н2(NO2)3СН3 + ЗH2O тринитротолуол
- С6Н5ОН + 3HNO3 → С6Н5(NO2)3OH + ЗH2O тринитрофенол
HNO3 этерифицирует спирты
- R-ОН + НO-NO2 → R-O-NO2 + H2O
- Примеры:
- С3Н5(ОН)3 + 3HNO3 → С3Н5(ONO2)3 + ЗH2O тринитрат глицерина
Разложение HNO3
- При хранении на свету, и особенно при нагревании, молекулы HNO3 разлагаются за счет внутримолекулярного окисления-восстановления:
- 4HNO3 = 4NO2↑ + O2↑ + 2H2O
- Выделяется красно-бурый ядовитый газ NO2, который усиливает агрессивно-окислительные свойства HNO3
Соли азотной кислоты — нитраты Me(NO3)n
Нитраты — бесцветные кристаллические вещества, хорошо растворяются в воде. Имеют химические свойства, характерные для типичных солей.
- Отличительные особенности:
- 1) окислительно-восстановительное разложение при нагревании;
- 2) сильные окислительные свойства расплавленных нитратов щелочных металлов.
Термическое разложение
- 1. Разложение нитратов щелочных и щелочноземельных металлов:
- Me(NO3)n → Me(NO2)n + O2↑
- 2. Разложение нитратов металлов, стоящих в ряду активности металлов от Mg до Cu:
- Me(NO3)n → МеxОy + NO2↑ + O2
- 3. Разложение нитратов металлов, стоящих в ряду активности металлов превее Cu :
- Me(NO3)n → Ме + NO2↑ + O2
- Примеры типичных реакций:
- 1) 2NaNO3 = 2NaNO2 + O2↑
- 2) 2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
- 3) 2AgNO3 = 2Ag + 2NO2↑ + O2↑
Окислительное действие расплавов нитратов щелочных металлов
В водных растворах нитраты, в противоположность HNO3, почти не проявляют окислительной активности. Однако расплавы нитратов щелочных металлов и аммония (селитр) являются сильными окислителями, поскольку разлагаются с выделением активного кислорода.
Источник: http://examchemistry.com/content/lesson/neorgveshestva/azotnaykislota.html
О азотной кислоте
 Одноосновная сильная кислота, представляющая собой в стандартных условиях бесцветную жидкость, которая при хранении желтеет, может находиться в твердом состоянии, характеризующемся двумя кристаллическими модификациями (моноклинная или ромбическая решетки), при температурах ниже минус 41,6 оС. Это вещество с химической формулой — HNO3 — называется азотная кислота. Имеет молярную массу 63,0 г/моль, а ее плотность соответствует 1,51 г/см³.
Одноосновная сильная кислота, представляющая собой в стандартных условиях бесцветную жидкость, которая при хранении желтеет, может находиться в твердом состоянии, характеризующемся двумя кристаллическими модификациями (моноклинная или ромбическая решетки), при температурах ниже минус 41,6 оС. Это вещество с химической формулой — HNO3 — называется азотная кислота. Имеет молярную массу 63,0 г/моль, а ее плотность соответствует 1,51 г/см³.
Азотная кислота — коррозионно активное, токсическое вещество и сильный окислитель. Со средних веков известно такое название, как «сильная вода» (Aqua fortis).
Алхимики, открывшие кислоту в 13 веке, дали такое название, убедившись в ее необычайных свойствах (разъедала все металлы, кроме золота), превосходящих в миллион раз силу уксусной кислоты, которую в те времена считали самой активной.
Но еще через три столетия было установлено, что разъедать, даже золото, может смесь таких кислот, как азотная и соляная в объемном соотношении 1:3, которую по этой причине и назвали «царская водка».
Появление желтого оттенка при хранении объясняется накоплением в ней окислов азота. В продаже кислота чаще бывает с концентрацией 68 %, а при содержании основного вещества более 89 % ее называют «дымящей».
Применение азотной кислоты
Азотная кислота в промышленности широко применяется для получения лекарств, красителей, взрывчатых веществ, азотных удобрений и солей азотной кислоты. Кроме того, она используется для растворения металлов (например, медь, свинец, серебро), которые не реагируют с другими кислотами. В ювелирном деле используется для определения золота в сплаве (это способ является основным).
В органическом синтезе широко применяется смесь концентрированной азотной кислоты и серной кислоты — «нитрующая смесь».
В металлургии азотная кислота применяется для растворения и травления металлов, а также для разделения золота и серебра. Также азотную кислоту применяют в химической промышленности, в производстве взрывчатых веществ, в производстве полупродуктов для получения синтетических красителей и других химикатов.
Кислота азотная техническая используется при никелировании, гальванизации и хромировании деталей, а также в полиграфической промышленности. Широко используется кислота азотная в молочной, электротехнической промышленности.
Получение азотной кислоты
Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При« описании свойств аммиака было указано, что он горит в кислороде, причём продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов — окисление аммиака кислородом может протекать иначе.
Если пропускать смесь аммиака с воздухом над катализатором, то при 750 °С и определённом составе смеси происходит почти полное превращение. Образовавшийся NO легко переходит в NO2, который с водой в присутствии кислорода воздуха дает азотную кислоту.
В качестве катализаторов при окислении аммиака используют сплавы на основе платины. Получаемая окислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. При необходимости ее концентрируют, Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45%, а концентрированная—98 и 97.
Источник: https://xn--c1acbdje2abnav6d.xn--p1ai/stati_o_kislotah/o-azotnoj-kislote




