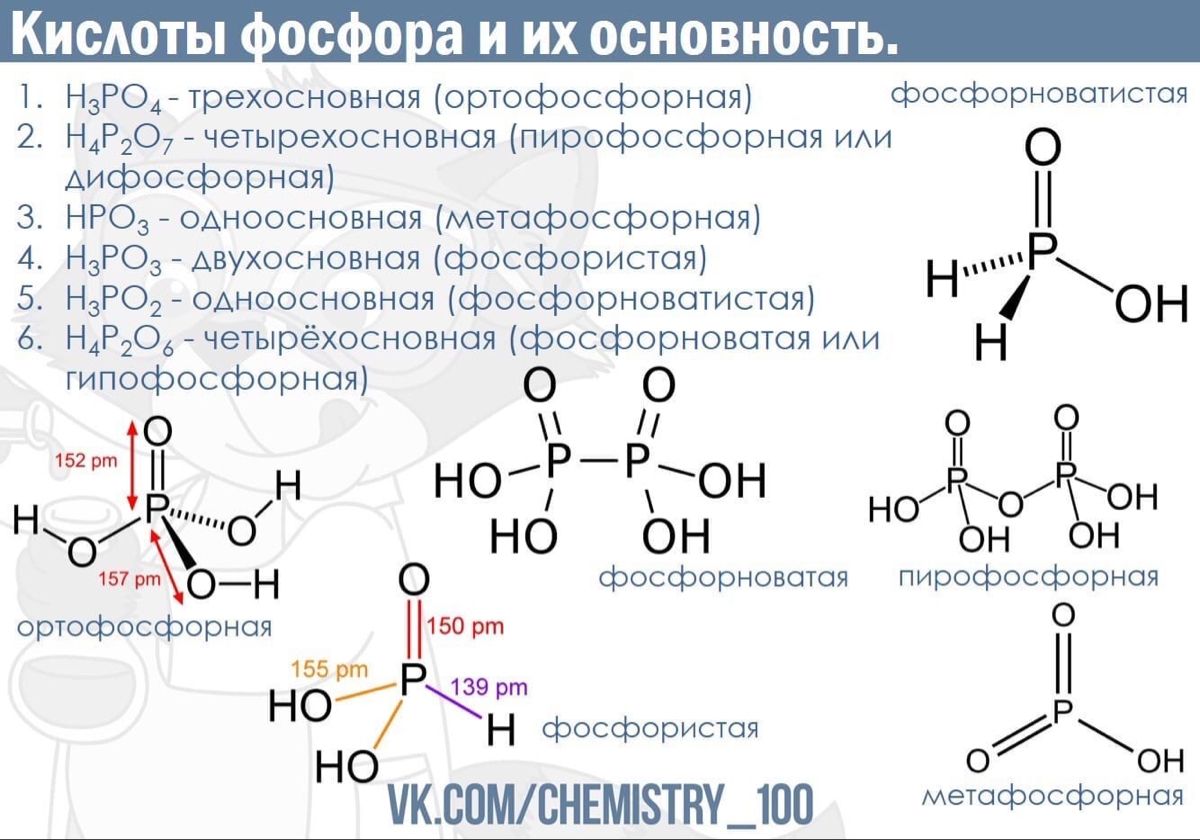
Фосфор — элемент 3-го периода и VA-группы Периодической системы, порядковый номер 15. Электронная формула атома [10Ne]3s23p3, устойчивая степень окисления в соединениях +V.
Электроотрицательность фосфора (2,32) значительно ниже, чем у типичных неметаллов, и немного выше, чем у водорода. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, проявляет неметаллические (кислотные) свойства. Большинство фосфатов нерастворимы в воде.
В природе — тринадцатый по химической распространенности элемент (шестой среди неметаллов), встречается только в химически связанном виде. Жизненно важный элемент.
Недостаток фосфора в почве восполняется введением фосфорных удобрений — главным образом суперфосфатов.
Аллотропные модификации фосфора

 Красный и белый фосфор Р. Известно несколько аллотропных форм фосфора в свободном виде, главные — это белый фосфор Р4 и красный фосфор Pn. В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.).
Красный и белый фосфор Р. Известно несколько аллотропных форм фосфора в свободном виде, главные — это белый фосфор Р4 и красный фосфор Pn. В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.).
Красный фосфор состоит из полимерных молекул Pn разной длины. Аморфный, при комнатной температуре медленно переходит в белый фосфор. При нагревании до 416 °С возгоняется (при охлаждении пара конденсируется белый фосфор). Нерастворим в органических растворителях. Химическая активность ниже, чем у белого фосфора. На воздухе загорается только при нагревании.
Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек. Не ядовит.
Белый фосфор состоит из молекул Р4. Мягкий как воск (режется ножом). Плавится и кипит без разложения (tпл 44,14 °С, tкип 287,3 °С, р 1,82 г/см3). Окисляется на воздухе (зеленое свечение в темноте), при большой массе возможно самовоспламенение.
В особых условиях переводится в красный фосфор. Хорошо растворим в бензоле, эфирах, сероуглероде. Не реагирует с водой, хранится под слоем воды. Чрезвычайно химически активен. Проявляет окислительно-восстановительные свойства.
Восстанавливает благородные металлы из растворов их солей.
Применяется в производстве Н3Р04 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит.
Уравнения важнейших реакций фосфора:
Получение в промышленности фосфора
- — восстановление фосфорита раскаленным коксом (песок добавляют для связывания кальция):
- Ca3(PО4)2 + 5С + 3SiО2 = 3CaSiO3 + 2Р + 5СО (1000 °С)
- Пар фосфора охлаждают и получают твердый белый фосфор.
Красный фосфор готовят из белого фосфора (см. выше), в зависимости от условий степень полимеризации n (Pn) может быть различной.
Соединения фосфора
Фосфин РН3. Бинарное соединение, степень окисления фосфора равна — III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3-гибридизация).
Мало растворим в воде, не реагирует с ней (в отличие от NH3). Сильный восстановитель, сгорает на воздухе, окисляется в HNО3 (конц.). Присоединяет HI. Применяется для синтеза фосфорорганических соединений.
Сильно ядовит.
- Уравнения важнейших реакций фосфина:

- Получение фосфина в лаборатории:
- СазP2 + 6НСl (разб.) = ЗСаСl + 2РНз
Оксид фосфора (V) P2O5. Кислотный оксид. Белый, термически устойчивый. В твердом и газообразном состояниях димер Р4О10 со строением из четырех тетраэдров [O=Р(O)3], связанных по трем вершинам (Р — О-P).
При очень высоких температурах мономеризуется до P2O5. Существует также стеклообразный полимер (Р205)п. Чрезвычайно гигроскопичен, энергично реагирует с водой, щелочами. Восстанавливается белым фосфором.
Отнимает воду у кислородсодержащих кислот.
Применяется как весьма эффективный дегидратирующий агент для осушения твердых веществ, жидкостей и газовых смесей, реагент в производстве фосфатных стекол, катализатор полимеризации алкенов. Ядовит.
- Уравнения важнейших реакций оксида фосфора +5:

- Получение: сжигание фосфора в избытке сухого воздуха.
Ортофосфорная кислота Н3Р04. Оксокислота. Белое вещество, гигроскопичное, конечный продукт взаимодействия P2O5 с водой.
Молекула имеет строение искаженного тетраэдра [Р(O)(OН)3] (sр3-гибридизадия), содержит ковалентные σ-связи Р — ОН и σ, π-связь Р=O. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворяется в воде (548 г/100 г Н20).
Слабая кислота в растворе, нейтрализуется щелочами, не полностью — гидратом аммиака. Реагирует с типичными металлами. Вступает в реакции ионного обмена.
Качественная реакция — выпадение желтого осадка ортофосфата серебра (I). Применяется в производстве минеральных удобрений, для осветления сахарозы, как катализатор в органическом синтезе, компонент антикоррозионных покрытий на чугуне и стали.
- Уравнения важнейших реакций ортофосфорной кислоты:

- Получение фосфорной кислоты в промышленности:
- кипячение фосфоритной руды в серной кислоте:
- Ca3(PO4)2 + 3H2SO4 (конц.) = 2Н3РО4 + 3CaSO4
Ортофосфат натрия Na3PO4. Оксосоль. Белый, гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Реагируется в растворе с цинком и алюминием.
Вступает в реакции ионного обмена.
Качественная реакция на ион РО43-
- — образование желтого осадка ортофосфата серебра(I).
- Применяется для устранения «постоянной» жесткости пресной воды, как компонент моющих средств и фотопроявителей, реагент в синтезе каучука. Уравнения важнейших реакций:

- Получение: полная нейтрализация Н3Р04 гидроксидом натрия или по реакции:

Гидроортофосфат натрия Na2HPO4. Кислая оксосоль. Белый, при умеренном нагревании разлагается без плавления. Хорошо растворим в воде, гидролизуется по аниону. Реагирует с Н3Р04 (конц.), нейтрализуется щелочами. Вступает в реакции ионного обмена.
- Качественная реакция на ион НРО42- — образование желтого осадка ортофосфата серебра (I).
- Применяется как эмульгатор при сгущении коровьего молока, компонент пищевых пастеризаторов и фотоотбеливателей.
- Уравнения важнейших реакций:

- Получение: неполная нейтрализация Н3Р04 гидроксидом натрия в разбавленном растворе:
- 2NaOH + Н3РО4 = Na2HPO4 + 2H2O
Дигидроортофосфат натрия NaH2PO4. Кислая оксосоль. Белый, гигроскопичный. При умеренном нагревании разлагается без плавления. Хорошо растворим в воде, анион Н2Р04 подвергается обратимой диссоциации. Нейтрализуется щелочами. Вступает в реакции ионного обмена.
- Качественная реакция на ион Н2Р04 — образование желтого осадка ортофосфата серебра(1).
- Применяется в производстве стекла, для защиты стали и чугуна от коррозии, как умягчитель воды.
- Уравнения важнейших реакций:

- Получение: неполная нейтрализация H3PО4 едким натром:
Н3РО4 (конц.) + NaOH (разб.) = NaH2PO4 + H2O
Ортофосфат кальция Са3(PO4)2— Оксосоль. Белый, тугоплавкий, термически устойчивый. Нерастворим в воде. Разлагается концентрированными кислотами. Восстанавливается коксом при сплавлении. Основной компонент фосфоритных руд (апатиты и др.).
- Применяется для получения фосфора, в производстве фосфорных удобрений (суперфосфаты), керамики и стекла, осажденный порошок — как компонент зубных паст и стабилизатор полимеров.
- Уравнения важнейших реакций:
Фосфорные удобрения
Смесь Са(Н2Р04)2 и CaS04 называется простым суперфосфатом, Са(Н2Р04)2 с примесью СаНР04 — двойным суперфосфатом, они легко усваиваются растениями при подкормке.
Наиболее ценные удобрения — аммофосы (содержат азот и фосфор), представляют собой смесь аммонийных кислых солей NH4H2PO4 и (NH4)2HPO4.
Хлорид фосфора (V) PCI5. Бинарное соединение. Белый, летучий, термически неустойчивый. Молекула имеет строение тригональной бипирамиды (sp3 d-гибридизация).
В твердом состоянии димер P2Cl10 с ионным строением РСl4+[РСl6]—. «Дымит» во влажном воздухе. Весьма реакционноспособный, полностью гидролизуется водой, реагирует со щелочами. Восстанавливается белым фосфором.
Применяется как хлорагент в органическом синтезе. Ядовит.
- Уравнения важнейших реакций:
- Получение: хлорирование фосфора.
Источник: http://himege.ru/fosfor/
Фосфат натрия, характеристика, свойства и получение, химические реакции
![]()
![]()
![]()
![]()
- Фосфат натрия – неорганическое вещество, имеет химическую формулу Na3PO4.
- Краткая характеристика фосфата натрия
- Физические свойства фосфата натрия
- Получение фосфата натрия
- Химические свойства фосфата натрия
- Химические реакции фосфата натрия
- Применение и использование фосфата натрия
Краткая характеристика фосфата натрия:
- Фосфат натрия – неорганическое вещество бесцветного либо белого цвета, соль щелочного металла натрия и ортофосфорной кислоты.
- Фосфат натрия представляет собой бесцветные кристаллы.
- Химическая формула фосфата натрия Na3PO4.
Хорошо растворяется в воде, с которой образует кристаллогидраты Na3PO4·0,5H2O, Na3PO4·H2O и Na3PO4·12H2O.
Водный раствор имеет сильнощелочную реакцию из-за гидролиза по аниону.
- Не растворим в этаноле.
- Обладает гигроскопичностью.
- В пищевой промышленности используется 3 типа фосфатов натрия, согласно степени замещения атомов водорода:
- – добавка Е339(i) – ортофосфат натрия 1-замещенный с химической формулой NaH2PO4;
- – добавка Е339(ii) – ортофосфат натрия 2-замещенный с химической формулой Na2HPO4;
- – добавка Е339(iii) – ортофосфат натрия 3-замещенный с химической формулой Na3PO4.
Физические свойства фосфата натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na3PO4 |
| Синонимы и названия иностранном языке | sodium phosphate (англ.) натрий фосфорнокислый трёхзамещенный (устар. рус.) натрия ортофосфат (рус.) тринатрий фосфат (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные тетрагональные кристаллы |
| Цвет | бесцветный, белый |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2536 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,536 |
| Температура кипения, °C | — |
| Температура плавления, °C | 1340 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 163,94067 |
| Растворимость в воде при 25 °C, г/100 мл | 14,5 |
* Примечание:
— нет данных.
Получение фосфата натрия:
Фосфат натрия получается в результате следующих химических реакций:
- 1. взаимодействием карбоната натрия и ортофосфорной кислоты:
2H3PO4 + 3NaCO3 → 2Na3PO4 + 3CO2 + 3H2O.
- 2. взаимодействием гидроксида натрия и ортофосфорной кислоты:
H3PO4 + 3NaOH → Na3PO4 + 3H2O.
Химические свойства фосфата натрия. Химические реакции фосфата натрия:
- Химические свойства фосфата натрия аналогичны свойствам фосфатов других металлов. Поэтому для него характерны следующие химические реакции:
- 1. реакция фосфата натрия с нитратом серебра:
- 3AgNO3 + Na3PO4 → Ag3PO4 + 3NaNO3.
- В результате реакции образуются ортофосфат серебра и нитрат натрия.
- 2.
реакция фосфата натрия и нитрата хрома:
- Cr(NO3)3 + Na3PO4 → CrPO4 + 2NaNO3.
- В результате реакции образуются ортофосфат хрома и нитрат натрия.
- 3. реакция фосфата натрия и нитрата галлия:
- Ga(NO3)3 + Na3PO4 → GaPO4 + 3NaNO3.
- В результате реакции образуются ортофосфат галлия и нитрат натрия.
- 4.
реакция фосфата натрия и хлорида алюминия:
- AlCl3 + Na3PO4 → AlPO4 + 3NaCl.
- В результате реакции образуются ортофосфат алюминия и хлорид натрия.
- 5. реакция фосфата натрия и хлорида кальция:
- 2Na3PO4 + 3CaCl2 → Ca3(PO4)2 + 6NaCl.
- В результате реакции образуются ортофосфат кальция и хлорид натрия.
- 6.
реакция фосфата натрия и хлорида бария:
- 2Na3PO4 + 3BaCl2 → Ba3(PO4)2 + 6NaCl.
- В результате реакции образуются ортофосфат бария и хлорид натрия.
- 7. реакция фосфата натрия и сульфата железа:
- 3FeSO4 + 2Na3PO4 → Fe3(PO4)2 + 3Na2SO4 (t = 60-80 oС).
В результате реакции образуются ортофосфат железа и сульфат натрия. Фосфат натрия используется в виде разбавленного раствора.
- 8. реакция фосфата натрия и сульфата лития:
- 2Na3PO4 + 3Li2SO4 → 2Li3PO4 + 3Na2SO4.
- В результате реакции образуются ортофосфат лития и сульфат натрия.
- 9. реакция фосфата натрия и сульфата магния:
- 2Na3PO4 + 3MgSO4 → Mg3(PO4)2 + 3Na2SO4.
В результате реакции образуются ортофосфат магния (который выпадает в осадок) и сульфат натрия. Реакция уменьшения жесткости воды.
10. реакция фосфата натрия и гидрокарбоната кальция:
2Na3PO4 + 3Ca(HCO3)2 → Ca3(PO4)2 + 6NaHCO3.
В результате реакции образуются ортофосфат кальция (который выпадает в осадок) и гидрокарбонат натрия. Реакция уменьшения жесткости воды.
11. реакция фосфата натрия, алюминия и воды:
2Al + 2Na3PO4 + 8H2O → 2Na[Al(OH)4] + 2Na2HPO4 + 3H2 (to).
В результате реакции образуются тетрагидроксоалюминат (III) натрия, гидроортофосфат натрия и водород. Фосфат натрия используется в виде концентрированного раствора. Реакция протекает при кипении.
12. реакция фосфата натрия, цинка и воды:
Zn + 2Na3PO4 + 4H2O → Na2[Zn(OH)4] + 2Na2HPO4 + H2 (to).
В результате реакции образуются тетрагидроксоцинкат (III) натрия, гидроортофосфат натрия и водород. Фосфат натрия используется в виде концентрированного раствора. Реакция протекает при кипении.
13. реакция термического разложения кристаллогидрата фосфата натрия:
Na3PO4•12H2O → Na3PO4 + 12H2O (t = 200 оС).
В результате реакции термического разложения додекагидрата фосфата натрия образуются фосфат натрия и вода. Реакция протекает в вакууме.
14. реакция фосфата натрия с азотной кислотой:
Na3PO4 + 3HNO3 ⇄ 3NaNO3 + H3PO4.
В результате химической реакции образуются нитрат натрия и ортофосфорная кислота. Реакция носит обратимый характер.
- Аналогично проходят реакции фосфата натрия и с другими сильными минеральными кислотами.
- 15. реакция термического разложения фосфата натрия:
- 2Na3PO4 → 3Na2O + P2O5 (tо).
- В результате реакции термического разложения фосфата натрия образуются оксид натрия и оксид фосфора.
Применение и использование фосфата натрия:
- Фосфат натрия используется во множестве отраслей промышленности и для бытовых нужд:
- – для уменьшения жесткости воды,
- – в пищевой промышленности как разрыхлитель для теста (при взаимодействии с пищевой содой) и эмульгатор для плавленого сыра, колбасы, сгущённого молока,
- – как пищевая добавка Е339,
- – в стекольной промышленности для обесцвечивания стекла при его плавке,
- – как составной компонент зубных паст и некоторых косметических препаратов.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
-



- карта сайта
- фосфат натрия реагирует кислота 1 2 3 4 5 вода соль гидролиз цинка
уравнение реакций соединения масса взаимодействие масса фосфата натрия
реакции
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/fosfat-natriya-harakteristika-svoystva-i-poluchenie-himicheskie-reaktsii/
Фосфаты натрия — важные неорганические соединения
- Фосфаты натрия — группа неорганических соединений, солей фосфорных кислот
 (ортофосфорной, пирофосфорной, полифосфорных, метафосфорной, ультрафосфорных), включающая:— соли (ортофосфат Na3PO4, пирофосфат Na4P2O7, дигидрофосфат NaH2PO4, гидрофосфат Na2HPO4 и др.);— их кристаллогидраты (NaH2PO4∙H2O, Na2HPO4∙12H2O, Na3PO4∙12H2O, …); — конденсированные фосфаты (содержат группу (РО3)-;— циклические полифосфаты (NaPO3)n.
(ортофосфорной, пирофосфорной, полифосфорных, метафосфорной, ультрафосфорных), включающая:— соли (ортофосфат Na3PO4, пирофосфат Na4P2O7, дигидрофосфат NaH2PO4, гидрофосфат Na2HPO4 и др.);— их кристаллогидраты (NaH2PO4∙H2O, Na2HPO4∙12H2O, Na3PO4∙12H2O, …); — конденсированные фосфаты (содержат группу (РО3)-;— циклические полифосфаты (NaPO3)n.
Свойства
Фосфаты натрия представляют собой белый или стекловидный кристаллический порошок, хорошо растворяющийся в воде, гигроскопичный на воздухе. Раствор соли в воде имеет ярко выраженную сильнощелочную реакцию. Соли хорошо выдерживают нагревание до высоких температур: начиная с +250 °С кристаллическое вещество плавится, но не разлагается.
Получение
В индустриальных масштабах фосфаты натрия получают методом химической реакции ортофосфорной кислоты с кальцинированной содой или гидроксидом натрия. Потом вещества выкристаллизуются и высушиваются до солей или их кристаллогидратов.
Применение
 — В аналитической химии фосфаты натрия востребованы в качестве буферных растворов.— Как чистящие средства для металлов в металлургии.— В пищепроме в качестве добавки Е339 используются как разрыхлитель для различной выпечки; эмульгатор при изготовлении колбасных изделий, паштетов, паст, сгущенного молока; солей плавления в производстве плавленых сыров. Кроме того эта разрешенная в России и Евросоюзе добавка применяется в качестве регулятора рН, антиоксиданта, стабилизатора и усилителя окраски пищевых продуктов (бульонные концентраты, сухое молоко и сливки, соки и газировки, полуфабрикаты быстрого приготовления). — Для смягчения воды используют безводные фосфаты, образующие комплексные соединения с элементами, отвечающими за жесткость воды: с кальцием, магнием, барием, металлами.— Как антислеживающая добавка.— В фотоделе в качестве проявителя.— Фосфаты натрия применяются в горнодобыче для обогащения руд; в составе ПАВ при изготовлении цемента, в буровых растворах в нефтедобыче.— При производстве красок, фосфатных стекол.— На производстве стекол с помощью ортофосфата натрия обесцвечивают стекольную массу.— В различных электролитических процессах, например, в электрофорезе. — В медицине и фармакологии входят в состав лекарств, оказывающих слабительное, антацидное действие; для поддержания кислотно-щелочного и минерального баланса крови; как вспомогательные вещества.
— В аналитической химии фосфаты натрия востребованы в качестве буферных растворов.— Как чистящие средства для металлов в металлургии.— В пищепроме в качестве добавки Е339 используются как разрыхлитель для различной выпечки; эмульгатор при изготовлении колбасных изделий, паштетов, паст, сгущенного молока; солей плавления в производстве плавленых сыров. Кроме того эта разрешенная в России и Евросоюзе добавка применяется в качестве регулятора рН, антиоксиданта, стабилизатора и усилителя окраски пищевых продуктов (бульонные концентраты, сухое молоко и сливки, соки и газировки, полуфабрикаты быстрого приготовления). — Для смягчения воды используют безводные фосфаты, образующие комплексные соединения с элементами, отвечающими за жесткость воды: с кальцием, магнием, барием, металлами.— Как антислеживающая добавка.— В фотоделе в качестве проявителя.— Фосфаты натрия применяются в горнодобыче для обогащения руд; в составе ПАВ при изготовлении цемента, в буровых растворах в нефтедобыче.— При производстве красок, фосфатных стекол.— На производстве стекол с помощью ортофосфата натрия обесцвечивают стекольную массу.— В различных электролитических процессах, например, в электрофорезе. — В медицине и фармакологии входят в состав лекарств, оказывающих слабительное, антацидное действие; для поддержания кислотно-щелочного и минерального баланса крови; как вспомогательные вещества.
— Используются в моющих средствах для смягчения воды и лучшей отстирываемости. Наиболее часто для этих целей применяется тринатрий фосфат,  доля которого в моющем средстве может достигать от 10 до 50%. В последнее время производители пытаются уменьшить его содержание в стиральных порошках, так как фосфаты вызывают «цветение» водоемов и развитие цианобактерий, негативно влияющих на жизнедеятельность рыб, животных, человека.
доля которого в моющем средстве может достигать от 10 до 50%. В последнее время производители пытаются уменьшить его содержание в стиральных порошках, так как фосфаты вызывают «цветение» водоемов и развитие цианобактерий, негативно влияющих на жизнедеятельность рыб, животных, человека.
— Кристаллогидрат тринатрия фосфата применяется в цветной и черной металлургии, в целлулозно-бумажной индустрии, в газо- и нефтедобывающей промышленности, в производстве смазочных масел и охлаждающих жидкостей, в энергетике.
В химическом магазине Prime Chemicals Group вы можете купить как непосредственно один из фосфатов натрия — тринатрий фосфат, так и сырье для производства фосфатов натрия: ортофосфорную кислоту и кальцинированную соду. Реактивы продаются в розницу и оптом, по выгодным ценам и с доставкой.
Источник: https://pcgroup.ru/blog/fosfaty-natriya-vazhnye-neorganicheskie-soedineniya/
Фосфат натрия, что это. Трифосфат натрия
Фосфат натрия вред

Характеристика вещества
Фосфат натрия относится к ряду солей натрия фосфорных кислот.
Его физические свойства будут следующими:
- данное вещество являет собою белые гранулы либо кристаллы;
- в воде растворимо хорошо;
- термически устойчиво.
Технологические функции
В промышленном производстве добавка Е339 выполняет такие функции:
- регулятор кислотности, который способствует поддержанию необходимого рН уровня;
- стабилизатор – придает продукту определенную текстуру, форму, принимает непосредственное участие в формировании и сохранности консистенции;
- эмульгатор – помогает соединить вещества, которые при обычных условиях не смешиваются.
Виды фосфатов
Существует три вида фосфатов натрия, которые будут отличаться химической формулой и номенклатурным значением, при помощи которого их можно распознать на этикетках продуктов:
- однозамещенный фосфат, или добавка Е339 (I) — NaH2PO4 ;
- двузамещенный фосфат, или добавка Е339 (II) — Na2HPO4 ;
- трехзамещенный фосфат, или добавка Е339 (III) — Na3PO4 .
Вредное воздействие
Вред фосфата натрия проявляется в зависимости от вида продукта, в который он входит. Например, синтетические моющие средства с его содержанием оказывают неблагоприятное воздействие на кожные покровы, а проявляется это в виде аллергии – сыпи, а в особо тяжелых ситуациях развивается экзема.
Рекомендация! Чтобы защитить свою кожу, при использовании фосфатосодержащих средств желательно надевать резиновые перчатки!
Продукты питания, содержащие в своем составе добавку с индексом Е339, обладают более широким спектром вредных свойств, которые проявляются, как:
- диарея;
- гастриты;
- язва желудка;
- нарушение обмена кальция;
- злокачественные новообразования в желудочно-кишечном тракте.
Что такое фосфат натрия для ребенка?
Детский организм более восприимчив к влиянию подобных веществ и его реакция проявляется в виде нервных и психических расстройств.У ребенка может наблюдаться:
- моторное беспокойство;
- гиперактивность;
- импульсивность;
- агрессия;
- беспокойство;
- снижение концентрации внимания.
На заметку! Что характерно, если из меню убрать продукты, содержащие добавку Е339, то все симптомы постепенно будут сходить на нет и в скором времени полностью исчезнут без применения медикаментозного лечения!
Применение
В непищевой промышленности фосфат кальция входит в состав стиральных и чистящих порошков. А список продуктов питания, содержащих эту вредную добавку, выглядит следующим образом:
- хлебобулочные и кондитерские изделия, где он исполняет функцию разрыхлителя;
- молочная продукция – молоко, сухие сливки, сгущенное молоко, где он применяется как антикристаллизатор и вещество, которое помогает увеличить сроки хранения готовых продуктов;
- сыры, в основном, плавленые – колбасные, ломтевые, пастообразные, где его используют в качестве сольплавителя.
На заметку! При изготовлении всех вышеописанных продуктов питания используется фосфат натрия двухзамещенный!
Кроме того, добавку Е339 можно встретить на упаковках мясных продуктов, сухих бульонов и супов, соусов, чая в пакетиках.
Фосфат натрия гидролиз. Na3PO4 + H2O = ? уравнение реакции
Что происходит при растворении фосфата натрия в воде (Na3PO4 + H2O = ?)? Подвергается ли данная соль гидролизу? Дайте определение понятию «гидролиз». Расскажите о том, какие соли подвергаются гидролизу, а какие – не подвергаются.
1 ответ
Фосфат натрия – средняя соль, образованная слабой кислотой – фосфорной () и сильным основанием – гидроксидом натрия (), это означает, что она подвергается гидролизу по аниону (Na3PO4 + H2O = ?). Теоретически возможно записать гидролиз в три ступени, но в реальности он протекает только по первой:
Наличие гидроксид-ионов в реакционной смеси свидетельствует о щелочном характере среды.Гидролизом называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды. Примером гидролиза может служить взаимодействие хлорида фосфора (III)с водой. В результате этой реакции образуются фосфористая кислотаи соляная кислота:
Гидролизу подвержены соединения различных классов.В реакции гидролиза вступают соли, образованные слабой кислотой и слабым основанием, или слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой. Соли. Образованные сильной кислотой и сильным основанием, гидролизу не подвергаются; нейтрализация в этом случае сводится к процессу:
а обратная реакция – диссоциация молекулы воды на ионы – протекает в ничтожно малой степени.
Источник: https://zdorovecheloveka.com/stati/fosfat-natriya-chto-eto-trifosfat-natriya




