







Написать уравнения реакций, которые надо провести для осуществления следующих превращений: а)Сr → Сr Cl 2 → Сr(OH)2→ Сr 2(SO 4)3→Cr б) Na 2 Cr. O 4→Na 2 Cr 2 O 7→Cr 2(SO 4)3→Cr(OH)3→ K[Cr(OH)4(H 2 O)2] в) Cr 2 O 3→K 2 Cr. O 4→K 2 Cr 2 O 7→Cr 2(SO 4)3→K 3[Cr(OH)6] г)Cr(NO 3)3→K 2 Cr 2 O 7→K 2 Cr. O 4→Ba. Cr. O 4
При сплавлении 22, 8 г технического хром (III) оксида в щёлочной среде с калий хлоратом получено 52, 5 г калий хромата. Определить массовую долю чистого Сr 2 O 3(в %). Ответ: 90, 2% Сr 2 O 3. Сколько литров хлора (н. у.
) выделиться при взаимнодействии 11, 76 г калий дихромата с избытком концентрированной серной кислоты? Ответ: 2, 688 л Сr 2.
Сколько граммов хром (III) оксида образуется при нагревании 50, 4 г аммоний дихромата? Ответ: 30, 4 г Сr 2 O 3.
Соль натрия желтого цвета массой 6, 48 г растворили в воде, подкислили серной кислотой, получив оранжевый раствор. При добавлении избытка раствора калий сульфита образовался раствор зеленовато-фиолетового цвета.
Какая масса хрома может быть выделена при электролизе полученного раствора? Ответ: 2, 08 г Сr 2. К водному раствору, содержащему хром (III) хлорид массой 3, 17 г, прилили раствор, содержащий калия сульфид массой 3, 85 г.
Какое вещество выпадает в осадок? Определить массу осадка. Ответ: 2, 06 г Сr(ОН)3.
Хром (VI) оксид массой 3 г растворили в воде объемом 120 мл (плотность воды 1 г/мл). определить массовую долю хромовой кислоты Н 2 Cr. O 4 в полученном растворе. Ответ: 2, 88% Н 2 Cr. O 4.
Хром (VI) оксид массой 5 г вступил в реакцию с аммиаком объемом 2, 24 л (н. у. ). Полученный твердый продукт сплавили с избытком натрий гидроксида, а затем подействовали избытком раствора серной кислоты.
Какую массу кристаллогидрата Cr 2(SO 4)3 ∙ 18 Н 2 О можно выделить из полученного раствора?
Решение: Уравнения реакций, лежащие в основе химических процессов: 2 Сr. O 3 + 2 NH 3 = Cr 2 O 3 + N 2 +3 H 2 O (1) Cr 2 O 3 + 2 Na. OH = 2 Na. Cr. O 2 + H 2 O (2) 2 Na. Cr. O 2 + 4 H 2 SO 4 = Cr 2(SO 4)3 + Na 2 SO 4 + 4 H 2 O (3) Находим количество вещества. Cr. O 3 и NH 3 n(Cr. O 3)=5(г)/100(г/моль) =0, 025(моль); n(NH 3)=2. 24(л)/22, 4(л/моль)= 0, 1 моль.
Из уравнения (1) следует: n(NH 3): n(Cr. O 3)= 1: 1, отсюда видно, что NH 3 взят в избытке, расчет ведем по недостатку — Cr. O 3. На основании уравнений (1) – (3) следует, что n(Cr. O 3) = ½ n(Cr 2 O 3) = ½ ∙ 0, 05 = 0, 025 моль; масса кристаллогидрата будет равна: m(Cr 2(SO 4)3∙ 18 H 2 O) = 0. 025 моль∙ 716 г/моль = 17, 9 г. Ответ: 17, 9 г Cr 2(SO 4)3∙ 18 H 2 O.
К раствору натрий дихромата массой 250 г прилили серную кислоту и избыток раствора натрий йодида, в результате выделился йод массой 15, 24 г. Вычислить массовую долю (%) натрий дихромата в исходном растворе. Ответ: 2, 1% Na 2 Cr 2 O 7.
На реакцию с натрий сульфидом в присутствии серной кислоты затрачен раствор калий дихромата массой 98 г с массовой долей (%)К 2 Cr 2 O 7, равной 5%. Вычислить массу серы, образовавшейся в результате этой реакции. Ответ: 1, 6 г серы.
Источник: https://present5.com/xrom-polozhenie-v-periodicheskoj-sisteme-mendeleeva-i-stroenie/
Хром

Кристаллы (99,999%) хрома различной формы, полученные разложением йодида хрома.
Хром — твёрдый металл голубовато-белого цвета. Хром иногда относят к чёрным металлам. Этот металл способен окрашивать соединения в разные цвета, потому и был назван «хром», что означает «краска».
Хром – микроэлемент, необходимый для нормального развития и функционирования человеческого организма. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови.
СТРУКТУРА

Кристаллическая структура хрома
В зависимости от типов химической связи — как и все металлы хром имеет металлический тип кристаллической решетки, то есть в узлах решетки находятся атому металла.
В зависимости от пространственной симметрии — кубическая, объемно-центрированная а = 0,28839 нм.
Особенностью хрома является резкое изменение его физических свойств при температуре около 37°С. Кристаллическая решетка металла состоит из его ионов и подвижных электронов. Аналогично атом хрома в основном состоянии имеет электронную конфигурацию.
При 1830 °С возможно превращение в модификацию с гранецентрированной решеткой, а = 3,69Å.
СВОЙСТВА

Хром
Хром имеет твердость по шкале Мооса 9, один из самых твердых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке. Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами.
При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами. При нагревании реагирует со многими неметаллами, часто образуя соединения нестехиометрического состава карбиды, бориды, силициды, нитриды и др.
Хром образует многочисленные соединения в различных степенях окисления, в основном +2, +3, +6. Хром обладает всеми характерными для металлов свойствами — хорошо проводит тепло, электрический ток, имеет присущий большинству металлов блеск.
Является антиферромагнетиком и парамагнетиком, то есть, при температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
Запасы и добыча

Чистый хром
Самые большие месторождения хрома находятся в ЮАР (1 место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении, Бразилии, на Филиппинах.nГлавные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2 место в мире)Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом).
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе;
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём;
5) с помощью алюминотермии получают металлический хром;
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты.
Источник: http://mineralpro.ru/minerals/chromium/
Элемент хром | Дистанционные уроки
- За счет большого количества валентных электронов образует большое количество окрашенных соединений.
- Электронное строение атома

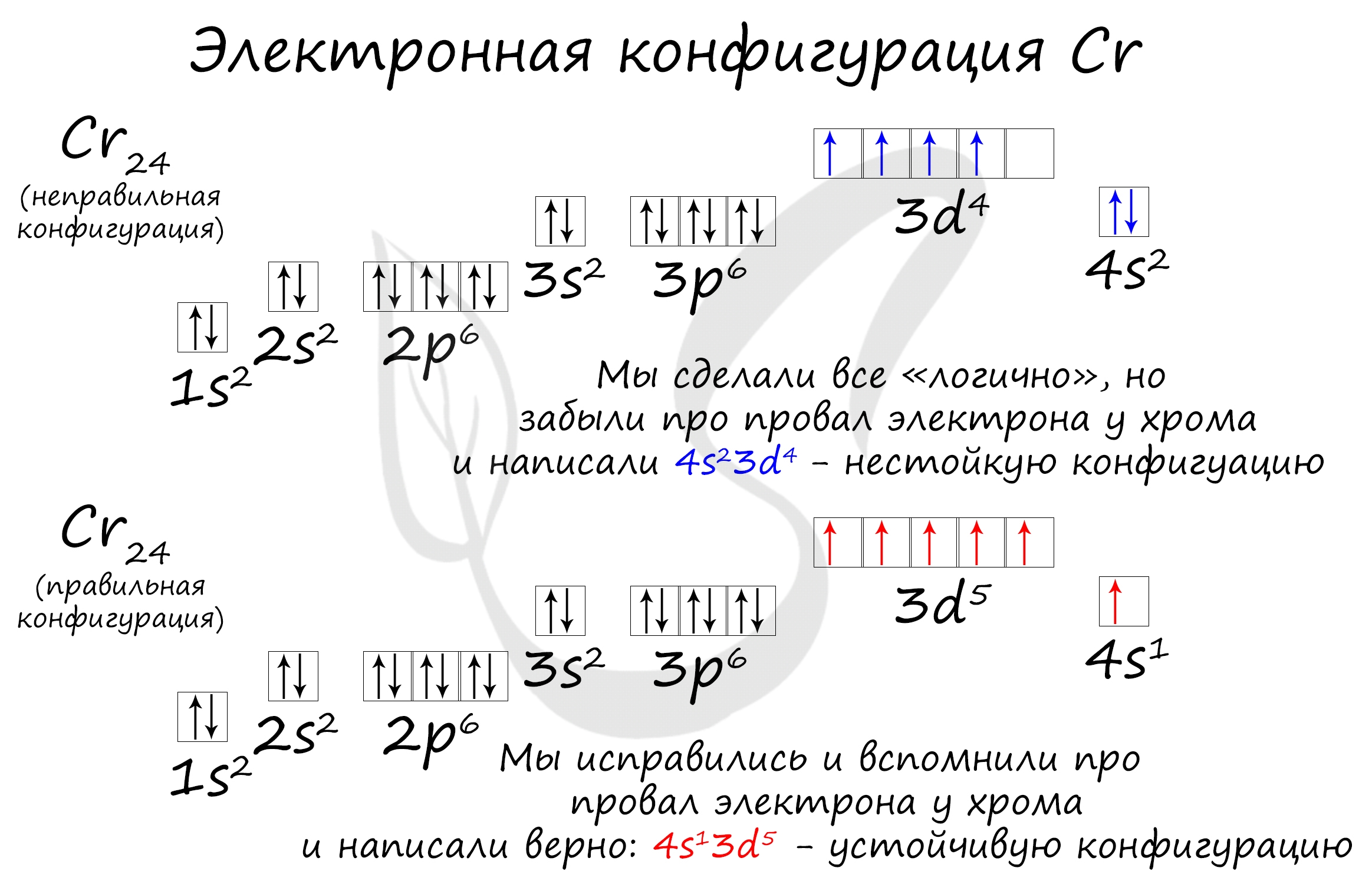
- Как видно из схемы, у d-элемента хрома наблюдается такое явление как «провал электрона» — один электрон с s-орбитали перескакивает на d-орбиталь.
«Провал» электрона — переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций.
Соответственно, возможные степени окисления хрома:
+6, +4, +3 и +2.
Свойства простого вещества
Хром — типичный металл — блестящий, бело-голубого цвета. Довольно часто встречающийся элемент в минералах земли.
Это малоактивный металл, т.к. на воздухе он покрывается оксидной пленкой
- Взаимодействие с неметаллами:
2Сr + 3F2 = 2CrF3
4Cr + 3O2 = 2Cr2O3 - Взаимодействие с водой (при нагревании):
2Cr + 3H2O = Cr2O3 + 3H2 - Взаимодействие с кислотами
— при н.у. это пассивный металл, ни с серной, ни с азотной кислотой не взаимодействует
— с разбавленной соляной и серной кислотами образует соли хрома (II): Сr + 2HCl = CrCl2 + H2
- Оксиды хрома
- СrO — оксид хрома (II), (черного цвета) — основной оксид.
- Сr(OH)2 — желто-коричневого цвета, быстро окисляется до Cr2O3 или Сr(OH3).
- СrO + 2HCl = CrCl2 + H2O (cоли — голубого цвета)
- Cr2O3 — оксид хрома (III), (зеленого цвета) — амфотерный оксид.
- Сr2O3 + 2NaOH = 2NaCrO2 + H2O
- Cr2O3 + 6HCl = 2CrCl3 + 3H2OСr(OH)3 — амфотерный гидроксид, серо-зеленого цвета.
- Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
- Соли Cr(3+) — зеленого цвета
- СrO3 — оксид хрома (VI), кислотный оксид, красного цвета.
Образует кислоты: HCrO4 — хромовая кислота и H2Cr2O7 — дихромовая кислота. Это сильные кислоты-окислители.
- CrO4(2-) — хроматы — желтого цвета
- Сr2O7(2-) — бихроматы — оранжевого цвета
- В зависимости от среды (кислой или щелочной) — хроматы и бихроматы переходят друг в друга:

- Итого соединения d- элемента хрома, их свойств и цветов можно выразить схемой:
- Отсюда, кстати, и название элемента: «хром» — это «цвет»!
- У d- элемента — хрома свойства веществ меняются следующим образом:
- вещества, в которых хром в низшей степени окисления, проявляют металлические (основные) свойства;
- в средней степени окисления (+3) — амфотерные;
- вещества с хромом в высшей степени окисления проявляют кислотные свойства.
Обсуждение: «Элемент Хром»
(Правила комментирования)
Источник: https://distant-lessons.ru/ximiya/xrom
Хром Cr
Хром в таблице менделеева занимает 24 место, в 4 периоде.
| Символ | Cr |
| Номер | 24 |
| Атомный вес | 51.9961000 |
| Латинское название | Chromium |
| Русское название | Хром |
Как самостоятельно построить электронную конфигурацию? Ответ здесь Cr: 1s2 2s2 2p6 3s2 3p6 4s1 3d5 Короткая запись:
Cr: [Ar] 4s1 3d5
- Порядок заполнения оболочек атома хрома (Cr) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
- На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
- Хром имеет 24 электрона, заполним электронные оболочки в описанном выше порядке:
- Элемент Cr является исключением!
- 2 электрона на 1s-подуровне
- 2 электрона на 2s-подуровне
- 6 электронов на 2p-подуровне
- 2 электрона на 3s-подуровне
- 6 электронов на 3p-подуровне
- 1 электрон на 4s-подуровне
- 5 электронов на 3d-подуровне
Степень окисления хрома
Атомы хрома в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2, -3, -4.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы хрома
Cr 0
Валентность Cr
Атомы хрома в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность хрома характеризует способность атома Cr к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cr
Квантовые числа определяются последним электроном в конфигурации, для атома Cr эти числа имеют значение N = 3, L = 2, Ml = 2, Ms = ½
Видео заполнения электронной конфигурации (gif): 

Источник: https://k-tree.ru/tools/chemistry/periodic.php?element=Cr&oxidation=3
Хром
Хром (Cr), химический элемент VI группы периодической системы Менделеева. Относится к переходным металлом с атомным номером 24 и атомной массой 51,996. В переводе с греческого, название металла означает «цвет». Такому названию металл обязан разнообразной цветовой гамме, которая присуща его различным соединениям.

Физические характеристики хрома
Металл обладает достаточной твердостью и хрупкостью одновременно. По шкале Мооса твердость хрома оценивается в 5,5. Этот показатель означает, что хром имеет максимальную твердость из всех известных на сегодня металлов, после урана, иридия, вольфрама и бериллия. Для простого вещества хрома характерен голубовато-белый окрас.
| Атомный номер | 24 |
| Атомная масса | 51,996 |
| Плотность, кг/м³ | 7190 |
| Температура плавления, °С | 1856 |
| Теплоемкость, кДж/(кг·°С) | 0,46 |
| Электроотрицательность | 1,6 |
| Ковалентный радиус, Å | 1,18 |
| 1-й ионизац. потенциал, эв | 6,76 |
Металл не относится к редким элементам. Его концентрация в земной коре достигает 0,02% масс. долей. В чистом виде хром не встречается никогда.
Он содержится в минералах и рудах, которые являются главным источником добычи металла. Хромит (хромистый железняк, FeO*Cr2O3) считается основным соединением хрома.
Еще одним достаточно распространенным, однако менее важным минералом, является крокоит PbCrO4.
Металл легко поддается плавке при температуре 19070С (21800К или 34650F). При температуре в 26720С – закипает. Атомная масса металла составляет 51,996 г/моль.
Хром является уникальным металлом благодаря своим магнитным свойствам. В условиях комнатной температуры ему присуще антиферромагнитное упорядочение, в то время, как другие металлы обладают им в условиях исключительно пониженных температур. Однако, если хром нагреть выше 370С, физические свойства хрома изменяются.
Так, существенно меняется электросопротивление и коэффициент линейного расширения, модуль упругости достигает минимального значения, а внутреннее трение значительно увеличивается. Такое явление связано с прохождением точки Нееля, при которой антиферромагнитные свойства материала способны изменяться на парамагнитные.
Это означает, что первый уровень пройден, и вещество резко увеличилось в объеме.
Строение хрома представляет собой объемно-центрированную решетку, благодаря которой металл характеризуется температурой хрупко-вязкого периода.
Однако, в случае с данным металлом, огромное значение имеет степень чистоты, поэтому, величина находится в пределах -500С — +3500С.
Как показывает практика, раскристаллизированный металл не имеет никакой пластичности, но мягкий отжиг и формовка делают его ковким.
Химические свойства хрома
Атом имеет следующую внешнюю конфигурацию: 3d54s1. Как правило, в соединениях хром имеет следующие степени окисления: +2, +3, +6, среди которых наибольшую устойчивость проявляет Сr3+.Кроме этого существуют и другие соединения, в которых хром проявляет совершенно иную степень окисления, а именно: +1, +4, +5.
Металл не отличается особой химической активностью. Во время нахождения хрома в обычных условиях, металл проявляет устойчивость к влаге и кислороду. Однако, данная характеристика не относится к соединению хрома и фтора – CrF3, которое при воздействии температур, превышающих 6000С, взаимодействует с парами воды, образуя в результате реакции Сr2О3, а также азотом, углеродом и серой.
Во время нагревания металлического хрома, он взаимодействует с галогенами, серой, кремнием, бором, углеродом, а также некоторыми другими элементами, в результате чего получаются следующие химические реакции хрома:
- Cr + 2F2 = CrF4 (с примесью CrF5)
- 2Cr + 3Cl2 = 2CrCl3
- 2Cr + 3S = Cr2S3
Хроматы можно получить, если нагреть хром с расплавленной содой на воздухе, нитратами или хлоратами щелочных металлов:
2Cr + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2.

Хром не обладает токсичностью, чего нельзя сказать о некоторых его соединениях. Как известно, пыль данного металла, при попадании в организм, может раздражать легкие, через кожу она не усваивается. Но, поскольку в чистом виде он не встречается, то его попадание в человеческий организм является невозможным.
Трехвалентный хром попадает в окружающую среду во время добычи и переработки хромовой руды. В человеческий организм попадание хрома вероятно в виде пищевой добавки, используемой в программах по похудению.
Хром с валентностью, равной +3, является активным участником синтеза глюкозы.
Ученые установили, что излишнее употребление хрома особого вреда человеческому организму не наносит, поскольку не происходит его всасывание, однако, он способен накапливаться в организме.
Соединения, в котором участвует шестивалентный металл, являются крайне токсичными. Вероятность их попадания в человеческий организм появляется во время производства хроматов, хромирования предметов, во время проведения некоторых сварочных работ.
Попадание такого хрома в организм чревато серьезными последствиями, так как соединения, в которых присутствует шестивалентный элемент, представляют собой сильные окислители. Поэтому, могут вызвать кровотечение в желудке и кишечнике, иногда с прободением кишечника.
При попадании таких соединений на кожу возникают сильные химические реакции в виде ожогов, воспалений, возникновения язв.
В зависимости от качества хрома, которое необходимо получить на выходе, существует несколько способов производства металла: электролизом концентрированных водных растворов оксида хрома, электролизом сульфатов, а также восстановлением оксидом кремния. Однако, последний способ не очень популярен, так как при нем на выходе получается хром с огромным количеством примесей. Кроме того, он также является экономически невыгодным.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
| +2 | CrO (чёрный) | Cr(OH)2 (желтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зеленый) | Амфотерный | Cr3+ (зеленые или лиловые соли)[Cr(OH)4]- (зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | H2CrO4H2Cr2O7 | Кислотный | CrO42- (хроматы, желтые)Cr2O72- (дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Источник: http://mining-prom.ru/rud/hrom/khrom/
Хром и его соединения
Кларк в земной коре 3,5-1% по массе. Основная хромовая руда — FeO • Cr2O3 (хромистый железняк). Был открыт в составе руды РbСrO4(крокоит). Хром в переводе с греч. означает «цвет, краска» (многие природные и синтетические соединения Сr имеют яркую разнообразную окраску).
Чистый хром — очень твердый тугоплавкий металл голубовато-серебристого цвета. Имеет самую большую твердость из всех применяемых в промышленности металлов. Т. пл. 1890°С, плотность 7,19 г/см.
- 24Cr [Ar]3d54s1
- Изотопы:
- 50Cr (4.35 %)
- 52Cr (83,79 %)
- 53Cr (9.50 %)
- 54Cr (2.36 %)
- ЭО 1,6
- E°Cr0/Cr3+ -0,74 В
При образовании соединений с другими элементами хром может использовать от 1 до 6 валентных электронов. Наибольшую устойчивость и практическую значимость имеют соединения, в которых атомы Сг находятся в степенях окисления +2, +3, +6.
С повышением степени окисления атомов Сг в оксидах и гидроксидах их основный характер ослабевает,а кислотный — усиливается. В этом же направлении происходит замена восстановительной активности на окислительную.
Некоторые важнейшие соединения хрома
| Cr+2 | Cr+3 | Cr+6 | |||
| Оксиды | CrOосновный | Cr2O3амфотерный | CrO3кислотный | ||
| Гидроксиды | Cr(OH)2слабое основание | Cr(OH)3 ↔ HCrO2 + H2Oамфотерный гидроксид | 2H2CrO4 ↔ H2Cr2O7 + H2O сильные кислоты | ||
| Соли | CrCl2,CrSO4,Cr(NO3)2,CrS | Тип ICrCl3,Cr(SO4)3,Cr(NO3)3 | Тип IIKCrO2,Ca(CrO2)2,Fe(CrO2)2хромиты | хроматыK2CrO4,Na2(CrO4)2,BaCrO4,PbCrO4 | дихроматыK2Cr2O7,Na2Cr2O7,(NH4)2Cr2O7 |
| Окислительно-восстановительная функция | Сильные восстановители | Окислители и восстановители | Сильные окислители |
- 1. Алюминотермический: Сr2O3 + 2Al = Аl2O3 + 2Сr
- 2. Силикотермический: 2Сr2O3 + 3Si = 3SiO2 + 4Cr
- 3. Электролитический: 2CrCl3 = 2Сr + 3Cl2
Химические свойства
Поверхностная оксидная пленка является причиной инертности хрома при обычной температуре, благодаря чему этот металл не подвергается атмосферной коррозии (в отличие от железа).
При нагревании хром проявляет свойства довольно активного металла, что соответствует его положению в электрохимическом ряду напряжений.
1. Взаимодействие с O2
Тонкоизмельченный хром интенсивно горит в токе кислорода. На воздухе реакция с O2 происходит лишь на поверхности металла.
4Сr + 3O2 = 2Сr2O3
При осторожном окислении амальгамированного хрома образуется низший оксид CrO.
2. Взаимодействие с другими неметаллами
- (Сr не взаимодействует с Н2, но поглощает его в больших количествах)
- 2Cr + 3Cl2 = 2CrCl3
- Cr + S = CrS
- CrCl3 и CrS — ионные соединения.
- 2Cr + N2 = 2CrN
- Cr + C → CrxCy
- CrN и rxCy — ковалентные тугоплавкие инертные вещества, по твердости сравнимы с алмазом.
3. Взаимодействие с разбавленными растворами HCl и H2SO4
Сr + 2HCl = СrСl2 + Н2↑
Сr + H2SO4 = CrSO4 + Н2↑
4. Действие концентрированных HNO3, H2SO4 и «царской водки» на хром
Эти кислоты не растворяют хром при обычной температуре, они переводят его в «пассивное» состояние.
Пассивацию можно частично снять сильным нагреванием, после чего хром начинает очень медленно растворяться в кипящих конц. HNO3, H2SO4, «царской водке».
- Сr + 6HNO3 = Cr(NO3)3 + 3NO2↑ + 3H2O
- 2Сr + 6H2SO4 = Cr2(SO4)3 + 3SO2↑ + 6H2O
- Царская водка — смесь концентрированных HNO33 и НСl (1:3), растворяет золото и платиновые металлы (Pd,Os,Ru).
5. Вытеснение малоактивных Me из водных р-ров солей
Сr + CuSO4 = CrSO4 + Сu
Сr + Pb(NO3)2 = Cr(NO3)2 + Pb
6. Взаимодействие с солями, разлагающимися с образованием кислорода
2Сr + KIO3 = Сr2O3 + KCl
2Сr + 3NaNO3 = Сr2O3 + 3NaNO2
Соединения Cr (II)
СrO — оксид хрома (II). Твердое черное вещество, н. р. в Н2O.
Способы получения
- 1) медленное окисление хрома, растворенного в ртути
- 2Сr + O2 = 2СrO
- 2) обезвоживание Сr(ОН)2 в восстановительной атмосфере:
- Сr(ОН)2 = СrO + H2O
Химические свойства
СrO — неустойчивое вещество, легко окисляется при небольшом нагревании до Сr2O3; при более высоких Т диспропорционирует:
3СrО = Сr + Сr2O3
СrO — типичный основный оксид, проявляет характерные для этого класса свойства. Реакции необходимо проводить в восстановительной среде.
Сr(OН)2 — гидроксид хрома (II) твердое желтое вещество, н. р. в Н2O.
Получают обменными реакциями из солей Сr2+:
CrCl2 + 2NaOH = Сr(ОН)2 + 2NaCl
Химические свойства
- Неустойчивое вещество, разлагается при нагревании; на воздухе быстро окисляется с образованием зеленого гидроксида хрома (III);
- 4Сr(ОН)2 + O2 + 2Н2O = 4Сr(ОН)3
- желтый → зеленый
Соли Сr2+
Наиболее важные: CrCl2, CrSO4, (СН3СОО)2Сr. Гидратированный ион Сr2+ имеет бледно-голубую окраску.
Способы получения:
- 1. Сr + неметалл (S, Hal2)
- Сr + 2HCl(r) = CrCl2 + Н2
- 2. Восстановление солей Сr3+:
- 2СrСl3 + Н2 = 2CrCl2 + 2HCl
Химические свойства
- 1. Соли Сr2+ — сильные восстановители, так как очень легко окисляются до солей Сr3+
- 4CrCl2 + 4HCl + O2 = 4СrСl3 + 2Н2О
- 2.
Раствор CrSO4 в разбавленной H2SO4 — превосходный поглотитель кислорода:
- 4CrSO4 + O2 + 2H2SO4 = 2Cr2(SO4)3 + 2Н2О
- 3.
С аммиаком соли Сr2+ образуют комплексные соли — аммиакаты:
- CrCl2 + 6NH3 = [Cr(NH3)6]Cl2
- Для Сr2+ характерно образование двойных сульфатов, например: K2Cr(SO4)2• 6Н2O
Соединения Сr(III)
Сr2О3 — оксид хрома (III), важнейшее природное соединение хрома. Сr2О3, полученный химическими методами, представляет собой темно-зеленый порошок.
Способы получения
- 1. Синтез из простых веществ:
- 4Сr + 3O2 = 2Сr2О3
- 2. Термическое разложение гидроксида хрома (III) или дихромата аммония:
- 2Сr(ОН)3 = Сr2O3 + 3Н2O
- (NH4)2Cr2O7 = Сr2O3 + N2 + 4Н2O
- 3. Восстановление дихроматов углеродом или серой:
- К2Сr2O7 + S = Сr2O3 + K2SO4
- Сr2O3 используется для изготовления краски «хромовая зеленая», обладающей термо- и влагоустойчивостью.
Химические свойства
- Сr2O3 — типичный амфотерный оксид
- В порошкообразном виде реагирует с сильными кислотами и сильными щелочами, в кристаллическом виде — химически инертное вещество.
- К наиболее практически важным реакциям относятся следующие:
- 1.
Восстановление с целью получения металлического хрома:
- Сr2O3 + 2Al = 2Сr + Аl2O3
- 2. Сплавление с оксидами и карбонатами активных металлов:
- Сr2O3 + МgО = Мg(СrO2)2
- Сr2O3 + Na2CO3 = 2NaCrO2 + CO2
- Образующиеся метахромиты являются производными метахромистой кислоты НСrO2.
- 3.
Получение хлорида хрома (III):
- Сr2O3 + ЗС + 3Cl2 = 2СrСl3 + ЗСО
- Сr2O3 + ЗССl4 = 2СrСl3 + ЗСОСl2
Сr(ОН)3 — гидроксид хрома (III)
- Образуется в виде синевато-серого осадка при действии щелочей на соли Сr3+:
- СrСl3 + 3NaOH = Сr(ОН)3 + 3NaCl
- Практически нерастворимый в воде гидроксид может существовать в виде коллоидных растворов.
В твердом состоянии гидроксид хрома (III) имеет переменный состав Сr2O3• nН2O. Теряя молекулу воды, Сr(ОН)3 превращается в метагидроксид СrО(ОН).
Химические свойства
- Сr(ОН)3 — амфотерный гидроксид, способный растворяться как в кислотах, так и в щелочах:
- Cr(OH)3 + 3HCl = СrСl3 + ЗН2O
- Сr(ОН)3 + ЗН+ = Сr3+ + ЗН2O
- Сr(ОН)3 + 3NaOH = Na3(Cr(OH)6]
- Сr(ОН)3 + ЗОН- = [Cr(OH)6]3-гексагидроксохромитанион
- При сплавлении с твердыми щелочами образуются метахромиты:
- Сr(ОН)3 + NaOH = NaCrO2 + 2Н2O
Соли Cr3+
Растворением осадка Сr(ОН)3 в кислотах получают нитрат Cr(NO3)3, хлорид СrСl3, сульфат Cr2(SO4)3 и другие соли. В твердом состоянии чаще всего содержат в составе молекул кристаллизационную воду, от количества которой зависит окраска соли.
- Самой распространенной является двойная соль КСr(SO4)2• 12H2O — хромокалиевые квасцы (сине-фиолетовые кристаллы).
- Хромиты, или хроматы (III) — соли, содержащие Сr3+ в составе аниона. Безводные хромиты получают сплавлением Сr2O3 с оксидами двухвалентных металлов:
- Сr2O3 + МеО = Ме(СrO2)2 метахромиты
- В водных растворах хромиты существуют в виде гидроксокомплексов.
Химические свойства
- К наиболее характерным свойствам солей Cr(III) относятся следующие:
- 1. Осаждение катиона Сг3+ под действием щелочей:
- Сr3+ + ЗОН- = Сr(ОН)3
- Характерный цвет осадка и его способность растворяться в избытке щелочи используется для отличия ионов Сг3+ от других катионов.
- 2.
Легкая гидролизуемость в водных растворах, обусловливающая сильнокислый характер среды:
- Сr3+ + Н2O = СrОН2+ + Н+
- Соли Сr (III) с анионами слабых и летучих кислот в водных растворах не существуют; так как подвергаются необратимому гидролизу, например:
- Cr2S3 + 6Н2O = 2Сr(ОН)3 + 3H2S
- 3.
Окислительно-восстановительная активность:
- а) окислитель: соли Cr(III) → соли(VI)
- см. «Получение солей Cr(VI)»
- б) восстановительь: соли Cr(III) → соли(II)
- см. «Получение солей Cr(II)»
- 4.
Способность к образованию комплексных соединений — аммиакатов и аквакомплексов, например:
- СrСl3 + 6NH3 = [Cr(NH3)6]Cl3
Соединения Cr(VI)
CrO3 — оксид хрома (VII) триоксид хрома, хромовый ангидрид
Кристаллическое вещество темно-красного цвета, очень гигроскопичное, легко растворимое в воде. Основной способ получения:
К2Сr2O7(кр.) + H2SO4 = 2CrO3 + K2SO4 + Н2O
Химические свойства
- СrО3 — кислотный оксид, активно взаимодействует с водой и щелочами, образуя хромовые кислоты и хроматы.
- Хромовый ангидрид — чрезвычайно энергичный окислитель. Например, этанол воспламеняется при соприкосновении с СrO3:
- С2Н6ОН + 4СrO3 = 2CO2 + ЗН2O + 2Сr2O3
- Продуктом восстановления хромового ангидрида, как правило, является Сr2O3.
Хромовые кислоты — Н2СrO4, Н2Сr2O7
Химические свойства
- При растворении CrO3 в воде образуются 2 кислоты:
- CrO3 + Н2O = Н2СrO4 хромовая
- 2CrO3 + Н2O = Н2Сr2O7 дихромовая
- Обе кислоты существуют только в водных растворах.
Между ними устанавливается равновесие:
- 2Н2СrO4 = Н2Сr2O7 + Н2O
- Обе кислоты очень сильные, по первой ступени диссоциированы практически полностью:
- Н2СrO4 = Н+ + НCrO4-
- Н2Сr2O7 = Н+ + НСr2O7-
Хроматы (VI) — соли, содержащие анионы хромовой кислоты CrO42-. Почти все имеют желтую окраску (реже — красную).
В воде хорошо растворяются только хроматы щелочных металлов и аммония. Хроматы тяжелых металлов н. р. в Н2O. Наиболее распространены: Na2CrO4, К2CrO4, РЬCrO4 (желтый крон).
Способы получения
- 1. Сплавление CrO3 с основными оксидами, основаниями:
- CrO3 + 2NaOH = Na2CrO4 + Н2O
- 2. Окисление соединений Cr(III) в присутствии щелочей:
- 2К3[Сr(ОН)6]+ ЗВr2+ 4КОН = 2К2СrO4 + 6КВr + 8Н2O
- 3. Сплавление Сr2O3 со щелочами в присутствии окислителя:
- Сr2О3 + 4КOН + КClO3 = 2К2СrO4 + KCl + 2Н2O
Химические свойства
- Хроматы существуют только в разбавленных щелочных растворах, которые имеют желтую окраску, характерную для анионов СrO42-. При подкислении раствора эти анионы превращаются в оранжевые дихромат-анионы:
- 2СrO42- + 2Н+ = Сr2O72- + Н2O Это равновесие мгновенно сдвигается в ту или иную сторону при изменении рН растворов.
- Хроматы — сильные окислители.
- При нагревании хроматы тяжелых металлов разлагаются; например:
- 4Нg2СrO4 = 2Сr2O3 + 8Нg + 5O2
- Дихроматы (VI) — соли, содержащие анионы дихромовой кислоты Сr2O72-
В отличие от монохроматов имеют оранжево-красную окраску и обладают значительно лучшей растворимостью в воде. Наиболее важные дихроматы — К2Сr2O7, Na2Cr2O7, (NH4)2Cr2O7.
Их получают из соответствующих хроматов под действием кислот, даже очень слабых, например:
2Na2CrO4 + 2СO2 + Н2O → Na2Cr2O7 + 2NaHCO3
Химические свойства
Водные растворы дихроматов имеют кислую среду вследствие устанавливаемого равновесия с хроматанионами (см. выше). Окислительные свойства дихроматов наиболее сильно проявляются в подкисленных растворах:
Сr2O72- + 14Н+ + 6e- = 2Сr3+ + 7Н2O
При добавлении восстановителей к кислым растворам дихроматов окраска резко изменяется от оранжевой до зеленой, характерной для соединений Сг3+.
Примеры ОВР с участием дихроматов в качестве окислителей
- K2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2↑ + 2KCl +7Н2О
- K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S↓ + K2SO4
- K2Cr2O7 + 3SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O
- Эта реакция используется для получения хромокалиееых квасцов KCr(SO4)2 • 12H2O
- K2Cr2O7 + 6HI + 4H2SO4 = Cr2(SO4)3 + 3I2↓ + K2SO4 + 7H2O
- K2Cr2O7 + 6FeSO4 +7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
- K2Cr2O7 + H2O2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3O2↑ + 7H2O
- 2K2Cr2O7 + 3CH3OH + 8H2SO4 = Cr2(SO4)3 + 3HCOOH + 2K2SO4 + 11H2O
- 8K2Cr2O7 + 3C12H22O11 + 32H2SO4 = 8Cr2(SO4)3 + 12CO2↑ + 8K2SO4 + 43H2O
- Сплавление:
- Na2Cr2O7 + 2C = Cr2O3 + Na2CO3 + CO↑
- Очень сильным окислителем является «хромовая смесь» — насыщенный раствор K2Cr2O7 или Na2Cr2O7 в концентрированной H2SO4.
Источник: http://examchemistry.com/content/lesson/neorgveshestva/hrom.html
Статья по химии (11 класс): Хром и его соединения. | Социальная сеть работников образования
Хром и его соединения.
Хром – элемент с порядковым номером 24. Электронная формула атома в невозбужденном состоянии Cr 1s22s22p63s23p63d54s1.
Электроны в атоме хрома заселяют четыре энергетических уровня. Это элемент четвертого периода шестой группы главной подгруппы. На внешнем уровне атома один электрон . Это металл. Размеры атома хрома и катиона Cr2+ намного меньше радиусов атома кальция, s-элемента того же четвертого периода и катиона Са2+.
В соединениях хрома (VI) атом хрома связан с соседними атомами ковалентными связями. Оксид хрома (VI) – кислотный оксид, его гидроксид – кислота. Соединения хрома (VI) – сильные окислители.
Соединения хрома (II) – ионные соединения. Оксид хрома (II) – основной оксид. Его гидратная форма – основание. Соединения хрома (II) – сильные восстановители. Соединения хрома (III) наиболее устойчивы и инертны.
Оксид и гидроксид хрома (III) амфотерны.
Физические свойства.
Хром – блестящий металл серовато-белого (серо-стального цвета. Его плотность составляет 7,2 г/см3. Температура плавления хрома 1890 градусов. Это тугоплавкий металл. Технический хром – один из самых твердых, но хрупких металлов. Он лишен пластических свойств. Чистый хром, напротив, очень пластичен, ковок и тягуч.
Химические свойства.
В ряду напряжений хром располагается между цинком и железом. Его поверхность покрыта тончайшим, но очень плотным слоем химически малоактивного оксида хрома (III), препятствующего взаимодействию хрома с окислителями.
При комнатной температуре хром не взаимодействует ни с кислородом, ни с хлором. При нагревании хром медленно окисляется кислородом.
В мелкораздробленном состоянии нагретый хром горит в кислороде с образованием оксида хрома (III) и окисляется хлором, превращаясь в хлорид хрома (III).
4 Cr + 3O2 = 2 Cr2O3
2Cr + 3Cl2 = 2CrCl3
Хром растворяется в разбавленных хлороводородной и серной кислотах. Процесс протекает в две стадии. Первоначально образуются соединения хрома (II). Они взаимодействуют с кислотами, превращаясь в соли хрома (III).
- Cr + 2HCl = CrCl2 + H2 2CrCl2 +2HCl = 2CrCl3 + H2
- Cr + H2SO4 = CrSO4 + H2 2CrSO4 + H2SO4 = Cr2(SO4)3 + H2
- Хром пассивируется холодными концентрированными азотной и серной кислотами. Он медленно восстанавливает нагретую концентрированную серную кислоту, превращая ее в оксид серы (IV):
- 2Cr + 6H2SO4=Cr2(SO4)3 +3SO2 +6H2O
- Взаимодействие хрома со щелочами в присутствии кислорода приводит к образованию соединений хрома (VI) –хроматов:
- 2Cr + 4KOH +3O2 = 2K2CrO4 + 2H2O
- Нахождение в природе, получение, применение
В свободном состоянии хром в природе не встречается. Важнейшими минеральными соединениями, содержащими хром, являются хромистый железняк FeO.Cr2O3 или Fe(CrO2)2 и крокоит PbCrO4.
- Хром получают восстановлением хромистого железняка углеродом в электропечах:
- FeO.Cr2O3+4CO= Fe + 2Cr +4CO2
- Полученный таким образом хром идет на легирование сталей.
- Чистый хром получают методом металлотермии, используя в качестве восстановителей алюминий и кремний:
- Cr2O3 + 2AL = 2Cr + Al2O3 2Cr2O3 + 3Si = 4Cr + 3Si2O3
Хром широко применяется как легирующий компонент в производстве нержавеющих и инструментальных сталей и жаропрочных сплавов. Хром придает им коррозийную стойкость, прочность, твердость, повышенную износоустойчивость.
Декоративные покрытия защищают металлы от коррозии, продлевают срок их службы и придают хромированным изделиям изящный вид.
Сплав с никелем – нихром, обладающий высоким электрическим сопротивлением, идет на производство электронагревательных приборов.
Соединения хрома
Хром образует соединения со степенями окисления +2, +3 и +6. Оксид хрома (II) получают разложением карбонила хрома. Это вещество черного цвета, нерастворимое в воде. Оксид хрома (II) – основной оксид. Он растворим в кислотах:
- CrO + H2SO4 = CrSO4 + H2O
- Его гидратная форма – гидроксид хрома (II) – это нерастворимое в воде основание. Оно растворяется в кислотах:
- Cr(OH)2 +2HCl = CrCl2 + 2 H2O
- Гидроксид хрома (II) легко окисляется растворенным в воде кислородом, превращаясь в гидроксид хрома (III):
- 4Cr(OH)2 + O2 +2H2O = 4Cr(OH)3
Источник: https://nsportal.ru/shkola/khimiya/library/2019/03/28/hrom-i-ego-soedineniya
Хром. Степени окисления хрома
Степень окисления (СО) – это условное обозначение в химии, служащее для того, чтобы определять заряд атома у какого-либо химического элемента (или группы элементов).
Без степеней окисления не решается ни одна задача, не составляется ни одно уравнение, но самое главное – без них мы не можем чётко определить свойства элемента и то, какую роль он будет играть в различных соединениях.
Знаменательно, что периодическая система (ПС) Д.И. Менделеева сгруппирована гениальнейшим образом: все элементы разделены по периодам, группам, подгруппам, их порядковые номера также соответствуют определённым показателям.
Благодаря этому нам не приходится заучивать качества каждого химического элемента (ХЭ) наизусть, потому что легко можно найти его в таблице и определить всё, что требуется.
Однако даже в таком случае некоторые люди, забывая школьные знания по курсу химии (или пренебрегая ими когда-то), вынуждены вернуться к изучению данной темы подробнее.
Итак, для начала необходимо сформировать верные объективные представления о хроме (Cr), разобраться с его положением в ПС, а затем можно будет приступить к наиболее важной части – практике.
Хром – Cr, положение в таблице Менделеева, физические и химические свойстваХром – это твёрдое вещество, металл, блестящий, серебристо-белого (или голубоватого) цвета.
Он достаточно ломкий, но при этом имеет несравненный плюс по сравнению со многими другими металлами – устойчивость к заражению коррозией; именно поэтому он является важным компонентом при производстве нержавеющей стали, а также используется для нанесения на поверхность других металлов, более склонных к коррозии. Хром обладает плохой тепло- и электропроводностью.
ХЭ располагается в VI группе, 4 периоде, носит порядковый номер 24 и обладает атомной массой равной 52 г/моль. Благодаря пассивированию хром не взаимодействует с серной (H2SO4) и азотной (HNO3) кислотами, проявляет устойчивость в воздухе.
Это амфотерный металл – значит, он может растворяться как в кислотах, так и в щелочах. Элемент растворяется в сильных разбавленных кислотах (например, соляная кислота HCl), в нормальных условиях (н.у.
) взаимодействует только с фтором (F). При нагревании хром может осуществлять взаимодействие с элементами VII группы (галогены), кислородом O2, бором B, азотом N2, серой S2, кремнием Si.
Если раскалить Cr, то способен вступить в реакцию с водяными парами.
Теперь поговорим непосредственно о том, какие степени окисления бывают у данного ХЭ: он может приобретать СО +4, +6, а также +2 в безвоздушном пространстве, +3 – в пространстве с воздухом. Хром, как любой другой металл, является сильным восстановителем.
Вещества с различными степенями окисления
- +2. Когда Cr приобретает СО +2, вещество демонстрирует основные и очень сильные восстановительные свойства. К примеру, оксид хрома (II) – CrO, гидроксид хрома – Cr(OH)2, множество солей. Синтезируются соединения этого элемента с фтором(CrF2), хлором(CrCl2) и так далее.
- +3. Эти вещества обладают амфотерными свойствами, могут быть разных цветов (но преимущественно зелёного H2O). Для примера приведём оксид Cr2O3 (это зеленоватый порошок, который не растворяется в ), Cr(OH)3, хромиты NaCrO2.
- +4. Такие соединения встречаются очень редко: они не образуют солей, кислот, с ними почти не производятся какие-либо работы. Но из известных веществ существуют оксид CrO2, тетрагалогенид CrF4, CrCl4.
- +6. Хром с СО +6, образуя соли, имеет кислотный характер, очень ядовитый, гидроскопичный, а также имеющий сильные окислительные свойства. Примеры: CrO3 (имеет вид кристаллов красного цвета), K2CrO4, H2CrO4, H2Cr2O7. Элемент способен образовывать два вида гидроксидов (уже перечислены).
Как определять СО в сложных веществах
С правилом «крест-накрест» вы наверняка уже знакомы. А что, если соединение имеет, например, целых три элемента?
В этом случае мы смотрим на последний элемент вещества, определяем его степень окисления и умножаем на коэффициент, находящийся справа (конечно, если он есть). Мысленно отделяем последний элемент (с уже определённой степенью окисления) от двух других элементов. Нам требуется, чтобы СО двух первых и последнего элементов в сумме была равна нулю.
Рассмотрим пример:
- PbCrO4 – хромат свинца (II), имеющий вид красной соли. На конце формулы находится кислород, степень окисления которого всегда (за исключением некоторых случаев) будет -2. -2*4=-8. Pb (свинец) имеет СО +2. Дальнейшие действия будут похожи на алгебраическое уравнение, но если честно, то когда человек уже неплохо разбирается в определении степеней окислений и умеет пользоваться таблицей растворимости, вполне возможно избежать таких расчётов. Итак, элемент с неизвестной степенью окисления (хром) обозначим за буквенную переменную. 2+x-8=0;x=8-2;x=6. Переменная равна 6, следовательно, степень окисления хрома становится +6.
Степени окисления в следующих формулах попробуйте расставить сами:
- Na2CrO4;
- BaCrO4;
- Fe(CrO2)2;
- Cr2O7;
- H2CrO4.
Хром – один из самых интересных химических элементов, соединения с которым – штука сложная, но необходимая для понимания. Будет замечательно, если данные примеры помогут разобраться со столь кропотливой темой.
Редакция «Учисьучись.рф»
Источник: https://xn--h1aa0abgczd7be.xn--p1ai/blog/ege-2018/hrom-stepeni-okisleniya-hroma/
Характеристика атомарного хрома, оксидов и гидроксидов хрома
Задача 1084. Охарактеризовать свойства хрома, указав: а) его положение в периодической системе и строение атома; б) отношение металлического хрома к воздуху, воде и кислотам; в) состав и характер оксидов и гидроксидов хрома.
Решение:
Строение и свойства металлического хрома
а) Хром (элемент №24) — металл находящейся в шестой группе побочной подгруппы, период 4, ряд 4. Электронное строение атома хрома можно представить формулой +24Cr [Ar] 3d54s1.
Для хрома наблюдается проскок (или провал) электрона на d-уровень (второй s-электрон покидает 4s-подуровень и проскакивает на 3d-подуровень): Cr – 3d54s1. Это объясняется близостью энергий ns— и (n – 1)d-уровней и стабильностью наполовину и полностью заполненных уровней.
У хрома d-уровень заполнен наполовину, что и объясняет стабильность атома +24Cr [Ar] 3d54s1 по сравнению с атомом +24Cr [Ar] 3d44s2. Массовая доля хрома в земной коре – 0,02%.
Для его соединений характерны степени окисления +2, +3, +6, а степени окисления +1,+4,+5 могут проявляются теоретически. Этот металл имеет амфотерные свойства за счёт незавершённой электронной оболочки. Поэтому он реагирует с щелочами и с кислотами.
б) Хром устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами:
4Cr + 3O2 Na2Cr2O7 + 2Cr2O3
Химически хром довольно инертен вследствие образования на его поверхности прочной тонкой пленки оксида. Он не окисляется на воздухе даже в присутствии влаги, а при нагревании окисление проходит только на поверхности. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами:
- 4Cr + 3O2 Na2Cr2O7 + 2Cr2O3
- Хром пассивируется разбавленной и концентрированной азотной кислотой, царской водкой, и даже при кипячении металла с этими реагентами растворяется лишь незначительно. Пассивированный азотной кислотой хром, в отличие от металла без защитного слоя, не растворяется в разбавленных серной и соляной кислотах даже при длительном кипячении в растворах этих кислот, тем не менее, в определенный момент начинается быстрое растворение, сопровождающееся вспениванием от выделяющегося водорода – из пассивной формы хром переходит в активированную, не защищенную пленкой оксида:
- Cr + 2HCl = CrCl2 + H2↑
- Если в процессе растворения добавить азотной кислоты, то реакция сразу прекращается – хром снова пассивируется.
Амфотерные оксиды хрома
в) Оксид хрома II (CrО) – основный оксид – черный порошок. Сильный восстановитель. CrО растворяется в разбавленной соляной кислоте:
CrО + 2НСl = CrСl2 + Н2О.
Гидроксид хрома(II) — неорганическое соединение, гидроокись металла хрома с формулой Сr(OH)2, коричневое (гидрат — жёлтое) аморфное вещество, не растворимое в воде образует кристаллогидрат. Гидроксид хрома (II) имеет основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
Оксид хрома(III) Cr2O3, представляет собой зеленые микрокристаллы с плотностью 5220 кг/м3 и высокой температурой плавления (2437° С). Оксид хрома(III) проявляет амфотерные свойства, но весьма инертен и его трудно растворить в водных кислотах и щелочах. При сплавлении с гидроксидами или карбонатами щелочных металлов переходит в соответствующие хроматы:
- Cr2O3 + 4KOH + KClO3 = 2K2CrO4 + KCl + 2H2O.
- Cr2O3 — амфотерное соединение.
- Гидроксид хрома (III) Cr(OH)3 — нерастворимое в воде вещество зелёного цвета.
- Cr2(SO4)3 + 6NaOH → 2Cr(OH)3↓+ 3Na2SO4
- Гидроксид хрома (III) обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
- 2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O Cr(OH)3 + KOH → K[Cr(OH)4]
Хромовый ангидрид и хромовые кислоты
Оксид хрома(VI) (хромовый ангидрид) CrO3, расплывающиеся на воздухе красные кристаллы, легко растворимые в воде (до 68,2%). Тпл. =197° С (с частичным разложением). Хромовый ангидрид – сильный окислитель.
При растворении в воде, в зависимости от концентрации, образует гидроксиды хрома(VI) — хромовые кислоты различного состава:
CrO3 + H2O = H2CrO4 (желтый р-р) – хромовая кислота; 2CrO3 + H2O = H2Cr2O7 (оранжевый р-р) — двухромовая кислота; 3CrO3 + H2O = H2Cr3O10 (красный р-р) = трихромовая кислота.
Хромовая кислота — электролит средней силы. Изополихромовые кислоты — сильные окислители.
Источник: http://buzani.ru/zadachi/khimiya-glinka/1367-svojstva-khroma-zadacha-1084




