 Алюми́ний — элемент главной подгруппы III группы, третьего периода, с атомным номером 13. Алюминий – р-элемент. На внешнем энергетическом уровне атома алюминия содержится 3 электрона, которые имеют электронную конфигурацию 3s23p1. Алюминий проявляет степень окисления +3.
Алюми́ний — элемент главной подгруппы III группы, третьего периода, с атомным номером 13. Алюминий – р-элемент. На внешнем энергетическом уровне атома алюминия содержится 3 электрона, которые имеют электронную конфигурацию 3s23p1. Алюминий проявляет степень окисления +3.
Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий— лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
 Химические свойства алюминия
Химические свойства алюминия
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. При разрушении оксидной плёнки алюминий выступает как активный металл-восстановитель.
1. Алюминий легко реагирует с простыми веществами-неметаллами:
- 4Al + 3O2 = 2Al2O3
- 2Al + 3Cl2 = 2AlCl3,
- 2Al + 3 Br2 = 2AlBr3
- 2Al + N2 = 2AlN
- 2Al + 3S = Al2S3
- 4Al + 3С = Al4С3
- Сульфид и карбид алюминия полностью гидролизуются:
- Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
- Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
2. Алюминий реагирует с водой
(после удаления защитной оксидной пленки):
2Al + 6H2O = 2Al(OH)3 + 3H2
3. Алюминий вступает в реакцию со щелочами
- 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
- 2(NaOH•H2O) + 2Al = 2NaAlO2 + 3H2
- Сначала растворяется защитная оксидная пленка: Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
- Затем протекают реакции: 2Al + 6H2O = 2Al(OH)3 + 3H2, NaOH + Al(OH)3 = Na[Al(OH)4],
- или суммарно: 2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2,
- и в результате образуются алюминаты: Na[Al(OH)4] — тетрагидроксоалюминат натрия Так как для атома алюминия в этих соединениях характерно координационное число 6, а не 4, то действительная формула тетрагидроксосоединений следующая: Na[Al(OH)4(Н2О)2]
4. Алюминий легко растворяется в соляной и разбавленной серной кислотах:
- 2Al + 6HCl = 2AlCl3 + 3H2
- 2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
- При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
- 8Al + 15H2SO4(конц) = 4Al2(SO4)3 + 3H2S + 12H2O
- Al + 6HNO3(конц) = Al(NO3)3 + 3NO2 + 3H2O
5. Алюминий восстанавливает металлы из их оксидов (алюминотермия):
- 8Al + 3Fe3O4 = 4Al2O3 + 9Fe
- 2Al + Cr2O3 = Al2O3 + 2Cr



Источник: http://himege.ru/alyuminij-xarakteristika-elementa/
Физические и химические свойства алюминия
Алюминий – металл, содержание которого в природе самое большое среди всех известных.
Позднее начало его применения вызвано тем, что, поскольку он обладает высокой химической активностью, то находится в земной коре только в составе различных химических соединений.
Восстановление чистого металла сопряжено с рядом трудностей, преодолеть которые стало возможным только с развитием технологий добычи металлов.
Чистый алюминий – мягкий ковкий металл серебристо-белого цвета. Это один из легчайших металлов, который, к тому же, хорошо поддается разнообразной механической обработке, штамповке, прокатке, литью. На открытом воздухе практически моментально покрывается тонкой и прочной пленкой окисла, которая противодействует дальнейшему окислению.

Внешний вид алюминия
Механические свойства алюминия, такие как мягкость, податливость штамповке, легкость в обработке, послужили широкому распространению во многих отраслях промышленности. Особенно часто алюминия используется в составе сплавов с другими металлами.
Физические и химические свойства сплавов алюминия послужили поводом к широкому использованию их в качестве конструкционных материалов, снижающих общий вес конструкции без ухудшения прочностных качеств.
Физические свойства
Алюминий не имеет каких-либо уникальных физических свойств, но их сочетание делает металл одним из самых широко востребованных.
Твердость чистого алюминия по шкале Мооса равняется трем, что значительно ниже, чем у большинства металлов. Данный факт является практически единственным препятствием для использования чистого металла.
Если внимательно рассмотреть таблицу физических свойств алюминия, то можно выделить такие качества, как:
- Малую плотность (2.7 г/см3);
- Высокую пластичность;
- Низкое удельное электрическое сопротивление (0,027 Ом·мм2/м);
- Высокую теплопроводность (203.5 Вт/(м·К));
- Высокую светоотражательная способность;
- Низкую температуру плавления (660°С).
Такие физические свойства алюминия, как высокая пластичность, низкая температура плавления, отличные литейные качества, позволяют использовать данный металл в чистом виде и в составе сплавов на его основе для производства изделий любой самой сложной конфигурации.
Вместе с этим, это один из немногих металлов, хрупкость которого не возрастает при охлаждении до сверхнизких температур. Данное свойство определило одну из областей применения в конструктивных элементах криогенной техники и аппаратуры.

Детали из алюминия
Существенно более высокую прочность, сравнимую с прочностью некоторых сортов стали, имеют сплавы на основе алюминия. Наибольшее распространение получили сплавы с добавлением магния, меди и марганца – дюралюминиевые сплавы и с добавлением кремния – силумины. Первая группа отличается высокой прочностью, а последняя одними из самых лучших литейных качеств.
- Невысокая температура плавления снижает затраты на производство и себестоимость технологических процессов при производстве конструкционных материалов на основе алюминия и его сплавов.
- Для изготовления зеркал используется такое качество, как высокий коэффициент отражения, сравнимый с показателем серебра, легкость и технологичность вакуумного напыления алюминиевых пленок на различные несущие поверхности (пластики, металл, стекло).
При плавке алюминия и выполнения литья особое внимание обращается на способность расплава поглощать водород. Не оказывая действий на химическом уровне, водород способствует уменьшению плотности и прочности за счет образования микроскопических пор при застывании расплава.
Благодаря низкой плотности и малому электрическому сопротивлению (ненамного выше меди), провода из чистого алюминия находят преимущественное применение при передаче электроэнергии в линиях электропередач, всего диапазона токов и напряжений в электротехнике, как альтернатива медным силовым и обмоточным проводам.
Сопротивление меди несколько меньше, поэтому провода из алюминия необходимо использовать большего сечения, но итоговая масса изделия и его себестоимость оказываются в несколько раз меньше. Ограничением служит только несколько меньшая прочность алюминия и высокая сопротивляемость пайке из-за пленки окислов на поверхности.
Большую роль играет наличие сильного электрохимического потенциала при контакте с таким металлом, как медь. В результате, в месте механического контакта меди и алюминия образуется прочная пленка окисла, имеющего высокое электрическое сопротивление. Это явление приводит к нагреву места соединения вплоть до расплавления проводников.
Существуют жесткие ограничения и рекомендации по применению алюминия в электротехнике.

Алюминий в строительстве
Высокая пластичность позволяет изготавливать тонкую фольгу, которая используется в производстве конденсаторов высокой емкости.
Легкость алюминия и его сплавов стали основополагающими при использовании в авиакосмической отрасли при изготовлении большинства элементов конструкции летательных аппаратов: от несущих конструкций, до элементов обшивки, корпусов приборов и оборудования.
Химические свойства
Являясь довольно химически активным металлом, алюминий активно сопротивляется коррозии. Это происходит благодаря образованию на его внешней поверхности очень прочной оксидной пленки под действием кислорода.
Прочная пленка оксида хорошо защищает поверхность даже от таких сильных кислот, как азотная и серная. Это качество нашло распространение в химии и промышленности для транспортировки концентрированной азотной кислоты.

Химические свойства алюминия
Разрушить пленку можно сильно разбавленной азотной кислотой, щелочами при нагреве или при контакте с ртутью, когда на поверхности образуется амальгама.
В перечисленных случаях оксидная пленка не является защитным фактором и алюминий активно взаимодействует с кислотами, щелочами и окислителями. Оксидная пленка также легко разрушается в присутствии галогенов (хлор, бром).
Таким образом, соляная кислота HCl, хорошо взаимодействует с алюминием при любых условиях.
Химические свойства алюминия зависят от чистоты металла. Использование состава легирующих присадок некоторых металлов, в частности марганца, позволяет увеличить прочность защитной пленки, повысив, таким образом, коррозионную устойчивость алюминия. Некоторые металлы, к примеру, никель и железо, способствуют снижению коррозионную стойкость, но повышают жароустойчивость сплавов.
Оксидная пленка на поверхности алюминиевых изделий играет отрицательную роль при проведении сварочных работ. Мгновенное окисление ванны расплавленного металла при сварке не позволяет сформировать сварочный шов, поскольку окись алюминия имеет очень высокую температуру плавления.
Для сварки алюминия используют специальные сварочные аппараты с неплавящимся электродом (вольфрам). Сам процесс ведется в среде инертного газа – аргона. При отсутствии процесса окисления сварочный шов получается прочным, монолитным.
Некоторые легирующие добавки в сплавы дополнительно улучшают сварочные свойства алюминия.
Чистый алюминий практически не образует ядовитых соединений, поэтому активно используется в пищевой промышленности при производстве кухонной посуды, упаковки пищевых продуктов, тары для напитков.
Оказывать негативное действие могут лишь некоторые неорганические соединения.
Исследованиями также установлено, что алюминий не используется в метаболизме живых существ, его роль в жизнедеятельности ничтожна.
Источник: https://stankiexpert.ru/spravochnik/materialovedenie/svoystva-aluminiia.html
Алюминий
 Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
История открытия
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил «квасцовую землю», которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф.
Оксид алюминия он назвал «alumina», что на латинском языке означает «вяжущий». На тот момент металл не пользовался популярностью, так как не был найден в чистом виде. Долгие годы выделить чистый алюминий пытались английские, датские и немецкие учёные.
В 1855 году в Париже на Всемирной выставке металл алюминий произвёл фурор. Из него делали только предметы роскоши и ювелирные украшения, так как металл был достаточно дорогим. В конце 19 века появился более современный и дешёвый метод получения алюминия.
В 1911 году в Дюрене выпустили первую партию дюралюминия, названного в честь города. В 1919 из этого материала был создан первый самолёт.
Физические свойства
Металл алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью. Он хорошо поддаётся штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки.
Важным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С. Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла.
Основные естественные примеси – это кремний, железо, цинк, титан и медь.
По степени очистки различают алюминий высокой и технической чистоты. Практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. Чем чище металл, тем он дороже. Технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции.
Металл высокой чистоты применяют в специальных целях. По показателю электропроводности алюминий уступает только золоту, серебру и меди. А сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью.
Длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
Теплопроводность алюминия повышается с увеличением чистоты металла. Примеси марганца, магния и меди снижают это свойство. По показателю теплопроводности алюминий проигрывает только меди и серебру.
Благодаря этому свойству металл применяется в теплообменниках и радиаторах охлаждения.Алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. Эти показатели значительно больше, чем у большинства металлов.
Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Металл хорошо полируется и анодируется.
Алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия.
Эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства.
Алюминий обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства
Алюминий — это достаточно активный амфотерный металл. При обычных условиях прочная оксидная плёнка определяет его стойкость. Если разрушить оксидную плёнку, алюминий выступает как активный металл-восстановитель.
В мелкораздробленном состоянии и при высокой температуре металл взаимодействует с кислородом. При нагревании происходят реакции с серой, фосфором, азотом, углеродом, йодом. При обычных условиях металл взаимодействует с хлором и бромом. С водородом реакции не происходит.
С металлами алюминий образует сплавы, содержащие интерметаллические соединения – алюминиды.
При условии очищения от оксидной пленки, происходит энергичное взаимодействие с водой. Легко протекают реакции с разбавленными кислотами. Реакции с концентрированной азотной и серной кислотой происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашло свойство восстанавливать металлы из оксидов и солей – реакции алюминотермии.
Получение
Алюминий находится на первом месте среди металлов и на третьем среди всех элементов по распространённости в земной коре. Приблизительно 8% массы земной коры составляет именно этот металл.
Алюминий содержится в тканях животных и растений в качестве микроэлемента. В природе он встречается в связанном виде в форме горных пород, минералов.
Каменная оболочка земли, находящаяся в основе континентов, формируется именно алюмосиликатами и силикатами.
Алюмосиликаты – это минералы, образовавшиеся в результате вулканических процессов в соответствующих условиях высоких температур.
При разрушении алюмосиликатов первичного происхождения (полевые шпаты) сформировались разнообразные вторичные породы с более высоким содержанием алюминия (алуниты, каолины, бокситы, нефелины). В состав вторичных пород алюминий входит в виде гидроокисей или гидросиликатов.
Однако не каждая алюминийсодержащая порода может быть сырьём для глинозёма – продукта, из которого при помощи метода электролиза получают алюминий.
Наиболее часто алюминий получают из бокситов. Залежи этого минерала распространены в странах тропического и субтропического пояса. В России также применяются нефелиновые руды, месторождения которых располагаются в Кемеровской области и на Кольском полуострове. При добыче алюминия из нефелинов попутно также получают поташ, кальцинированную соду, цемент и удобрения.
В бокситах содержится 40-60% глинозёма. Также в составе имеются оксид железа, диоксид титана, кремнезём. Для выделения чистого глинозёма используют процесс Байера.
В автоклаве руду нагревают с едким натром, охлаждают, отделяют от жидкости «красный шлам» (твёрдый осадок). После осаждают гидроокись алюминия из полученного раствора и прокаливают её для получения чистого глинозёма.
Глинозём должен соответствовать высоким стандартам по чистоте и размеру частиц.
Из добытой и обогащённой руды извлекают глинозём (оксид алюминия). Затем методом электролиза глинозём превращают в алюминий. Заключительным этапом является восстановление процессом Холла-Эру. Процесс заключается в следующем: при электролизе раствора глинозёма в расплавленном криолите происходит выделение алюминия.
Катодом служит дно электролизной ванны, а анодом – угольные бруски, находящиеся в криолите. Расплавленный алюминий осаждается под раствором криолита с 3-5% глинозёма. Температура процесса поднимается до 950°С, что намного превышает температуру плавления самого алюминия (660°С).
Глубокую очистку алюминия проводят зонной плавкой или дистилляцией его через субфторид.
Применение
Алюминий применяется в металлургии в качестве основы для сплавов (дуралюмин, силумин) и легирующего элемента (сплавы на основе меди, железа, магния, никеля).
Сплавы алюминия используются в быту, в архитектуре и строительстве, в судостроении и автомобилестроении, а также в космической и авиационной технике. Алюминий применяется при производстве взрывчатых веществ.
Анодированный алюминий (покрытый окрашенными плёнками из оксида алюминия) применяют для изготовления бижутерии. Также металл используется в электротехнике.
Рассмотрим, как используют различные изделия из алюминия
Алюминиевая лента представляет собой тонкую алюминиевую полосу толщиной 0,3-2 мм, шириной 50-1250 мм, которая поставляется в рулонах. Используется лента в пищевой, лёгкой, холодильной промышленности для изготовления охлаждающих элементов и радиаторов.
Круглая алюминиевая проволока применяется для изготовления кабелей и проводов для электротехнических целей, а прямоугольная для обмоточных проводов.
Алюминиевые трубы отличаются долговечностью и стойкостью в условиях сельских и городских промышленных районов. Применяются они в отделочных работах, дорожном строительстве, конструкции автомобилей, самолётов и судов, производстве радиаторов, трубопроводов и бензобаков, монтаже систем отопления, магистральных трубопроводов, газопроводов, водопроводов.
Алюминиевые втулки характеризуются простотой в обработке, монтаже и эксплуатации. Используются они для концевого соединения металлических тросов.
Алюминиевый круг — это сплошной профиль круглого сечения. Используется это изделие для изготовления различных конструкций.
Алюминиевый пруток применяется для изготовления гаек, болтов, валов, крепежных элементов и шпинделей.Около 3 мг алюминия каждый день поступает в организм человека с продуктами питания.
Больше всего металла в овсянке, горохе, пшенице, рисе.
Учёными установлено, что он способствует процессам регенерации, стимулирует развитие и рост тканей, оказывает влияние на активность пищеварительных желёз и ферментов.
- Алюминиевый лист
- Алюминиевая плита
- Алюминиевые чушки
- Алюминиевые уголки
- Алюминиевая проволока
При использовании алюминиевой посуды в быту необходимо помнить, что хранить и нагревать в ней можно исключительно нейтральные жидкости. Если же в такой посуде готовить, к примеру, кислые щи, то алюминий поступит в еду, и она будет иметь неприятный «металлический» привкус.
Алюминий входит в состав лекарственных препаратов, используемых при заболеваниях почек и желудочно-кишечного тракта.
Источник: https://cu-prum.ru/alyuminij1.html
Алюминий: физические свойства, получение, применение, история
Физические свойства алюминия
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью. Температура плавления 660°C.
По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов.
К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см3), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов.
Алюминий и его сплавы делятся по способу получения на деформируемые, подвергаемые обработке давлением и литейные, используемые в виде фасонного литья; по применению термической обработки — на термически не упрочняемые и термически упрочняемые, а также по системам легирования.
Получение
Впервые алюминий был получен Гансом Эрстедом в 1825 году. Современный метод получения разработали независимо друг от друга американец Чарльз Холл и француз Поль Эру.
Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием графитовых электродов.
Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке.
Применение
Алюминий широко применяется как конструкционный материал.
Основные достоинства алюминия в этом качестве — легкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной пленкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки.
Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий).
Электропроводность алюминия сравнима с медью, при этом алюминий дешевле. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при изготовлении проводников в чипах. Правда, у алюминия как электротехнического материала есть неприятное свойство — из-за прочной оксидной пленки его тяжело паять.
Благодаря комплексу свойств широко распространен в тепловом оборудовании.
Внедрение алюминиевых сплавов в строительстве уменьшает металлоемкость, повышает долговечность и надежность конструкций при эксплуатации их в экстремальных условиях (низкая температура, землетрясение и т.п.).
Алюминий находит широкое применение в различных видах транспорта. На современном этапе развития авиации алюминиевые сплавы являются основными конструкционными материалами в самолетостроении.
Алюминий и сплавы на его основе находят все более широкое применение в судостроении.
Из алюминиевых сплавов изготовляют корпусы судов, палубные надстройки, коммуникацию и различного рода судовое оборудование.
Идут исследования по разработке пенистого алюминия как особо прочного и легкого материала.
Драгоценный алюминий
В настоящее время алюминий является одним из самых популярных и нашедших широкое применение металлов.
С самого момента открытия в середине XIX века его считали одним из ценнейших благодаря удивительным качествам: белый как серебро, легкий по весу и не подверженный воздействию окружающей среды. Стоимость его была выше цен на золото.
Не удивительно, что в первую очередь алюминий нашел свое применение в создании ювелирных изделий и дорогих декоративных элементов.
В 1855 г. на Универсальной выставке в Париже алюминий был самой главной достопримечательностью. Изделия из алюминия располагались в витрине, соседствующей с бриллиантами французской короны. Постепенно зародилась определенная мода на алюминий. Его считали благородным малоизученным металлом, используемым исключительно для создания произведений искусства.
Наиболее часто алюминий использовали ювелиры. При помощи особой обработки поверхности ювелиры добивались наиболее светлого цвета металла, из-за чего его часто приравнивали к серебру. Но в сравнении с серебром, алюминий обладал более мягким блеском, чем обуславливалась еще большая любовь к нему ювелиров.
Так как химические и физические свойства алюминия сначала были слабо изучены, ювелиры сами изобретали новые техники его обработки. Алюминий технически легко обрабатывать, этот мягкий металл позволяет создавать отпечатки любых узоров, наносить рисунки и создавать желаемой формы изделия. Алюминий покрывался золотом, полировался и доводился до матовых оттенков.
Но со временем алюминий стал падать цене. Если в 1854-1856 годах стоимость одного килограмма алюминия составляла 3 тысячи старых франков, то в середине 1860-х годов за килограмм этого металла давали уже около ста старых франков. Впоследствии из-за низкой стоимости алюминий вышел из моды.
В настоящее время самые первые алюминиевые изделия представляют большую редкость. Большинство из них не пережило обесценивания металла и было заменено серебром, золотом и другими драгоценными металлами и сплавами.
В последнее время вновь наблюдается повышенный интерес к алюминию у специалистов. Этот металл стал темой отдельной выставки , организованной в 2000 году Музеем Карнеги в Питсбурге.
Во Франции расположен Институт истории алюминия, который в частности занимается исследованием первых ювелирных изделий из этого металла.
В Советском союзе из алюминия делали общепитовские приборы, чайники и т.д. И не только. Первый советский спутник был выполнен из алюминиевого сплава.
Другой потребитель алюминия — электротехническая промышленность: из него делаются провода высоковольтных линий передач, обмотки моторов и трансформаторов, кабели, цоколи ламп, конденсаторы и многие другие изделия.
Кроме того, порошок алюминия применяют во взрывчатых веществах и твердом топливе для ракет, используя его свойство быстро воспламеняться: если бы алюминий не покрывался тончайшей оксидной пленкой, то мог бы вспыхивать на воздухе.
Последнее изобретение — пеноалюминий, т.н. «металлический поролон», которому предсказывают большое будущее.
Источник: https://TochMeh.ru/info/alum2.php
№13 Алюминий
Около 1807 г. Дэви, пытавшийся осуществить электролиз глинозема, дал название предполагаемому в нем металлу алюмиум (Alumium).
Впервые алюминий был получен Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. В 1827 г.
Велер выделил металлический алюминий более эффективным способом — нагреванием безводного хлористого алюминия с металлическим калием.
Нахождение в природе, получение:
По распространенности в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Содержание алюминия в земной коре по данным различных исследователей составляет от 7,45% до 8,14% от массы земной коры.
В природе алюминий встречается только в соединениях (минералах). Корунд: Al2O3 — относится к классу простых оксидов, и иногда образует прозрачные драгоценные кристаллы — сапфира, и, с добавлением хрома, рубина. Накапливается в россыпях.
Бокситы: Al2O3*nH2O — осадочные алюминиевые руды.
Содержат вредную примесь — SiO2. Бокситы служат важным сырьем для получения алюминия, а также красок, абразивов. Каолинит: Al2O3*2SiO2*2H2O — минерал подкласса слоистых силикатов, главная составная часть белой, огнеупорной, и фарфоровой глины.
Современный метод получения алюминия был разработан независимо американцем Чарльзом Холлом и французом Полем Эру. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF3 с последующим электролизом с использованием графитовых электродов.
Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке. Для производства 1 т алюминия требуется 1,9 т глинозёма и 18 тыс. кВт·ч электроэнергии.
Физические свойства:
Металл серебристо-белого цвета, легкий, плотность 2,7 г/см3, температура плавления 660°C, температура кипения 2500°C. Высокая пластичность, прокатывается в тонкий лист и даже фольгу. Алюминий обладает высокой электропроводностью и теплопроводностью, обладает высокой светоотражательной способностью. Алюминий образует сплавы почти со всеми металлами.
Химические свойства:
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной индустрией.
Однако, при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель.
Легко реагирует с простыми веществами: кислородом, галогенами: 2Al + 3Br2 = 2AlBr3
С другими неметаллами алюминий реагирует при нагревании:
- 2Al + 3S = Al2S3 2Al + N2 = 2AlN
- 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
- 2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2 2Al + 6H2SO4(конц) = Al2(SO4)3 + 3SO2 + 6H2O
Алюминий способен только растворять водород, но не вступает с ним в реакцию.
Со сложными веществами: алюминий реагирует со щелочами (с образованием тетрагидроксоалюминатов):
Легко растворяется в разбавленной и концентрированной серной кислотах:
Алюминий восстанавливает металлы из их оксидов (алюминотермия): 8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Важнейшие соединения:
Оксид алюминия, Al2O3: твердое, тугоплавкое вещество белого цвета. Кристаллический Al2O3 химически пассивен, аморфный — более активен. Медленно реагирует с кислотами и щелочами в растворе, проявляя амфотерные свойства:
Al2O3 + 6НСl(конц.) = 2АlСl3 + ЗН2О
Al2O3 + 2NаОН(конц.
) + 3Н2О = 2Na[Al(OH)4] (в расплаве щелочи образуется NaAlO2). Гидроксид алюминия, Al(OH)3: белый аморфный (гелеобразный) или кристаллический. Практически не растворим в воде. При нагревании ступенчато разлагается. Проявляет амфотерные, равно выраженные кислотные и основные свойства.
При сплавлении с NaOH образуется NaAlO2.
Для получения осадка Аl(ОН)3 щелочь обычно не используют (из-за легкости перехода осадка в раствор), а действуют на соли алюминия раствором аммиака — при комнатной температуре образуется Аl(ОН)3 Соли алюминия.
Соли алюминия и сильных кислот хорошо растворимы в воде и подвергаются в значительной степени гидролизу по катиону, создавая сильнокислотную среду, в которой растворяются такие металлы, как магний и цинк:
Al3+ + H2O =AlOH2+ + H+ Нерастворимы в воде фторид AlF3 и ортофосфат АlРO4, а соли очень слабых кислот, например Н2СО3, вообще не образуются осаждением из водного раствора.
Известны двойные соли алюминия — квасцы состава MAl(SO4)2*12H2O (M=Na+, K+, Rb+, Cs+, ТI+, NH4+), самые распространенные из них алюмокалиевые квасцы KAl(SO4)2*12Н2O.
Растворение амфотерных гидроксидов в щелочных растворах рассматривается как процесс образования гидроксосолей (гидроксокомплексов). Экспериментально доказано существование гидроксомплексов [Аl(ОН)4(Н2О)2] -, [Аl(ОН)6]3-, [Аl(ОН)5(Н2O)]2-; из них первый — наиболее прочный. Координационное число алюминия в этих комплексах равно 6, т.е. алюминий является шестикоординированным. Бинарные соединения алюминия Соединения с преимущественно ковалентными связями, например сульфид Al2S3 и карбид Аl4С3 полностью разлагаются водой:
Al2S3 + 6Н2О = 2Аl(ОН)3 + 3Н2S Аl4С3 + 12H2O = 4Аl(ОН)3 + 3СН4
Применение:
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость, высокая теплопроводность. Алюминий является важным компонентом многих сплавов (медные — алюминиевые бронзы, магниевые и др.) Применяется в электротехнике для изготовления проводов, их экранирования.
Алюминий широко используется и в тепловом оборудовании и в криогенной технике.
Высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления делает алюминий идеальным материалом для изготовления зеркал.
Алюминий и его соединения используются в ракетной технике в качестве ракетного горючего.
В производстве строительных материалов как газообразующий агент.
Аллаяров Дамир
ХФ ТюмГУ, 561 группа.
Источник: http://www.kontren.narod.ru/x_el/info13.htm
Статьи
Свойства алюминия
Алюминий — серебристо-белый легкий металл. Расположен в III группе Периодической системы элементов Д.И.Менделеева под номером 13; атомная масса алюминия — 26,98.
Конфигурация внешней электронной оболочки 3s23р; атомный радиус — 0,143 мм, ионный радиус А1 3+ (в скобках указаны координационные числа) 0,053 нм (4); 0,062 нм (5); 0,067 нм (6); энергия ионизации А1 -» А1 + -> А1 2+ —> А1 3+ — соответственно 5,984; 18,828; 28,44 эВ; сродство к электрону 0,5 эВ; электроотрицательность по Поллингу — 1,5; поперечное сечение захвата тепловых нейтронов — 215*10-25 м2 [3]. Алюминий имеет кубическую гранецентрированную кристаллическую решетку с параметрами: а = 0,40403 нм, z = 4, пространственная группа Fm3m. В природе существует один стабильный изотоп 27А1.
Отличительные особенности алюминия — высокая электропроводимость, теплопроводность, коррозионная стойкость, малая плотность и отличная обрабатываемость давлением в холодном состоянии.
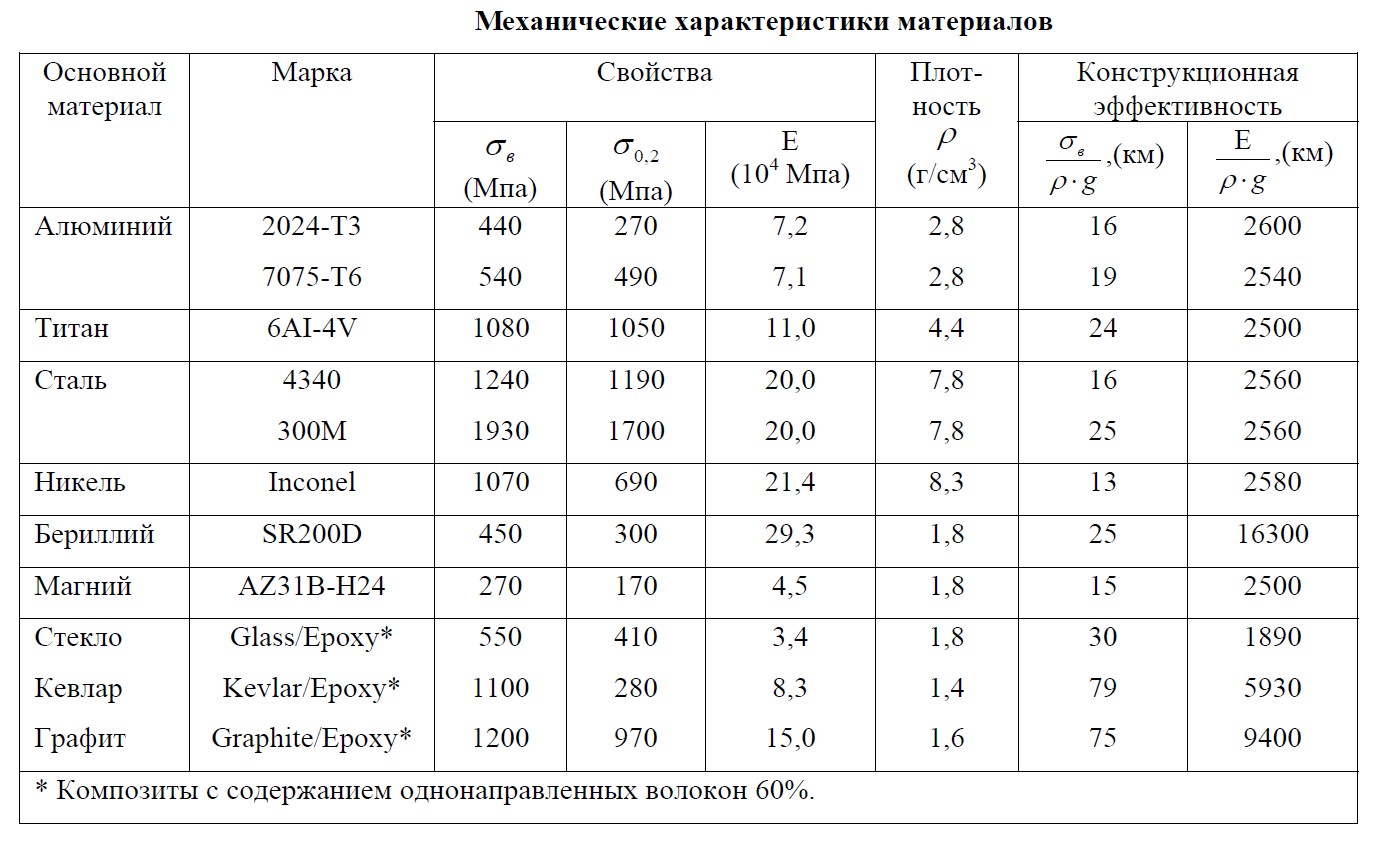
Физические свойства алюминия [2-6]
| Плотность (99,996% А1), г/см3, при температуре: | |
| 20 °С | 2,6989 |
| 1000 °С | 2,289 |
| плавления | 660 |
| кипения | ~2452 |
| плавления | 10,55 |
| испарения | 291,4 |
| Давление пара, Па, при температуре: | |
| 660 °С | 0,266 |
| 1123 °С | 13 3 |
| 1279 °С | 133 |
| Удельная теплоемкость, Дж/(кг*К), при температуре: | |
| 20 °С | 929,46 |
| 100 °С | 931,98 |
| Коэффициент линейного расширения при температуре 20-100 °С, К-1 | 24,58*10-6 |
| Теплопроводность, Вт/( м*К), при температуре: | |
| 20 °С | 217 |
| 190 °С | 343 |
| Электропроводность по отношению к меди при температуре 20 °С | 65,5% |
| Удельное электросопротивление, мк*Ом*м | 0.0265 |
| Температурный коэффициент электросопротивления | 0,042 |
| Динамическая вязкость (99,85% А1), Н*с/м2, при температуре: | |
| 800 °С | 2*10-3 |
| 1123 °С | 1,540-3 |
| 1279 °С | 1,3*10-3 |
| Модуль нормальной упругости Е, МПа, при температуре: | |
| 180 °С | 7,8*104 |
| 20 °С | 7,1*104 |
| 100 °С | 7,0*104 |
| 200 °С | 6,6*104 |
| 400 °С | 5,6*104 |
| 500 °С | 5,0*104 |
| 600 °С | 4,4*104 |
| Модуль сдвига при температуре 20 °С | 2,7*104 МПа |
| Магнитная характеристика алюминия | Слабо парамагнитен |
Механические свойства алюминия [4-6]
| Временное сопротивление разрыву σв,МПА: | |
| в отожженном состоянии | 50 |
| в деформированном (холоднокатаном) состоянии | 115 |
| в отожженном состоянии | 50-80 |
| в деформированном состоянии | 120 |
| Предел усталости (500*10 6 циклов),σ -1: | |
| в отожженном состоянии | 40 |
| в деформированном состоянии | 50 |
| Предел ползучести, при температуре: | |
| 15 °С | 50 |
| 100 °С | 27 |
| 200 °С | 7 |
| Предел прочности при срезе,σ ср: | |
| в отожженном состоянии | 60 |
| в деформированном состоянии | 100 |
| Относительное удлинение,δ: | |
| в отожженном состоянии | 30-40% |
| в деформированном состоянии | 5-10% |
| Относительное сужение, ψ: | |
| в отожженном состоянии | 70-90% |
| в деформированном состоянии | 50-60% |
| Ударная вязкость при температуре 20 °С aм | 140 |
| Твердость по Бринеллю, НВ: | |
| в отожженном состоянии | 25 |
| в литом состоянии | 20 |
| в деформированном состоянии | 30-35 |
При охлаждении алюминия до температуры ниже 120 К его прочностные свойства в отличии от большинства металлов возрастают, а пластичность не изменяется (табл. 1.7).
Таблица 1.7.
Механические свойства алюминия различной чистоты
| Состояние | Содержание Аl, % | Предел прочности при растяжении σв2МПа | Предел текучести при растяжении σ.00,2, МПа | Относительное удлинение δ, % | Твердость по Бринеллю, НВ |
| Литой в землю | 99,996 | 50 | — | 45 | 13-15 |
| Литой в землю | 99,5 | 75 | — | 29 | 20 |
| Литой в землю | 99.0 | 85 | — | 20 | 25 |
| Литой в кокиль | 99,0 | 90 | — | 25 | 25 |
| Деформированный и отожженный | 99.0 | 90 | 30 | 30 | 25 |
| Деформированный | 99,0 | 140 | 100 | 12 | 32 |
| Литой в землю | 98,0 | 90 | 35 | 12,5 | 28 |
Технологические свойства алюминия [6]
| Температура | |
| литья горячей обработки отжига отпуска Линейная усадка, % Допускаемая деформация (холодная и горячая), % Начало рекристаллизации, °СЖидкотекучесть, мм. | 690-710 350-450 370-400 150 2,7 75-90 150 317 |
Коррозионные свойства алюминия [6].
Алюминий и его сплавы характеризуются высокой коррозионной стойкостью в атмосферных условиях как сельской местности, так и городских промышленных районов.
Сернистый газ, сероводород, аммиак и другие газы, находящиеся в воздухе промышленных районов, не оказывают заметного влияния на скорость коррозии алюминия и его сплавов. Алюминий практически не корродирует в дистиллированной и чистой пресной (естественной) воде даже при высоких температурах (до 180 °С). Действие пара на алюминий и его сплавы также незначительно.
Вода, содержащая примеси щелочей, резко повышает скорость коррозии алюминия. При комнатной температуре скорость коррозии алюминия в аэрированной воде содержащей 0,1% едкого натрия — 16 мм/год; 0,1% соляной кислоты — 1 мм/год и 1% соды — 4 мм/год.
Алюминий и его сплавы, не содержащие меди, достаточно стойки в естественной (не загрязненной) морской воде. Сернокислые соли магния, натрия, алюминия, а также гипосульфит практически не действуют на технический алюминий. Скорость коррозии алюминия возрастает в присутствии в воде солей ртути, меди или ионов хлора, разрушающих защитную оксидную пленку на алюминии.
В концентрированной азотной кислоте при комнатной температуре алюминий и его сплавы устойчивы, но быстро разрушаются в разбавленных кислотах.
Слабые растворы серной кислоты, концентрацией до 10%, при комнатной температуре незначительно влияют на технический алюминий, но с повышением концентрации и температуры скорость коррозии резко возрастает. В концентрированной серной кислоте алюминий практически устойчив.
Соляная кислота быстро разрушает алюминий и его сплавы, особенно с повышением температуры. Такое же действие на алюминий оказывают растворы плавиковой и бромистоводородной кислот. Слабые растворы фосфорной (менее 1%), хромовой (до 10%) и борной (при всех концентрациях) кислот на алюминий и его сплавы действуют незначительно.
Органические кислоты — уксусная, масляная, лимонная, винная, а также кислые (незагрязненные) фруктовые соки, вино оказывают слабое действие на алюминий и его сплавы, за исключением щавелевой и муравьиной кислот.
Алюминий и его сплавы быстро разрушаются в растворах едких щелочей, однако в растворах аммиака они довольно стойки, особенно сплавы, содержащие магний. Амины на них действуют также незначительно.
Следует отметить, что алюминий и однофазные сплавы на алюминиевой основе более стойки в коррозионном отношении, чем сплавы двухфазные и многофазные.
Влияние примесей на свойства алюминия. На коррозионные, физические, механические и технологические свойства алюминия оказывают значительное влияние примеси различных элементов. Так, например, большинство примесей снижают электропроводность алюминия (рис. 1.1).
Основные примеси в алюминии — железо и кремний. Железо снижает коррозионную стойкость, электропроводность и пластичность алюминия, но несколько повышает его прочность. Диаграмма состояния системы Al-Fe, приведенная на рис. 1.
2, показывает, что железо незначительно растворяется в алюминии в твердом состоянии. При температуре эвтектики (655°С) растворимость железа достигает 0,052% и с понижением температуры граница твердого раствора а резко сдвигается в сторону алюминия.
Железо в алюминии присутствует в виде самостоятельной фазы Al3Fe.
Железо — вредная примесь не только в алюминии, но и в сплавах алюминия с кремнием и магнием. Однако в жаропрочных алюминиевых сплавах железо (в сочетании с никелм) является полезной примесью.
Обычная примесь в алюминии — кремний. В сплавах на алюминиевой основе кремний наряду с медью, магнием, цинком, а также марганцем, никелем и хромом вводится в качестве основного компонента. Образующиеся при этом соединения CuAl2, Mg2Si, CuMgAl2 и др. являются эффективными упрочнителями алюминиевых сплавов.
Из диаграммы состояния алюминий-кремний (рис. 1.3) видно, что при температуре эвтектики 577°С в алюминии растворяется до 1,65% кремния. С понижением температуры область твердого раствора α резко уменьшается.
Примеси кальция и других элементов, присутствующих в стандартных марках алюминия в незначительном количестве, не имеют практического значения. Небольшие добавки церия, натрия и титана оказывают существенное влияние на структуру и свойства определенных алюминиевых сплавов.
Водород хорошо растворяется в алюминии и оказывает отрицательное влияние на его свойства, вызывая при литье пористость. Азот при высоких температурах вступает в реакцию с алюминием с образованием тугоплавкого соединения.
Токсикологические свойства алюминия [7]. В соответствии с ГОСТом по степени воздействия на организм человека алюминиевую пыль относят к III классу опасности. Предельно-допустимая концентрация (ПДК) в воздухе пыли металлического алюминия и его оксидов составляет 2 мг/м3.
При постоянном вдыхании пыли металлического алюминия и его оксида может возникнуть алюминоз легких. Рабочие, подвергшиеся воздействию пыли, должны проходить периодически флюорографическое обследование. У рабочих, занятых в производстве алюминия, часты катары верхних дыхательных путей (рипиты, фарингиты).
Наибольшую опасность для здоровья представляет процесс электролиза глинозема, протекающий в расплавленном криолите (Na3AlF6) при температуре 950 °С. Электролиз расплавленных солей может сопровождаться выбросами большого количества фторидной пыли, фторсодержащих газов, а также паров и частиц битума-компонента анодной массы.
Рабочим, занятым на этой операции, также грозят ожоги кожи и глаз при попадании на них расплавленного металла. Во избежании несчастных случаев электролизные ванны необходимо надежно изолировать, рабочие должны иметь средства индивидуальной защиты:, противопылевые маски, очки„, перчатки, фартуки, сапоги и т.д.
В электролизных цехах должен регулярно проводиться контроль за содержанием пыли в воздухе.
ПДК алюминия и его оксида по ГОСТу и нормативам США приведены ниже:
| Стандарт | Вещество | Агрегатное состояние | ПДК, мг/м 1 (в пересчете на металл) |
| ГОСТ 12. 1.005 | Алюминий | Пыль | 2 |
| STEL ACGIH* | Алюминий, оксид алюминия | Пыль | 20 |
| TLV ACGIII** | То же | То же | 10 |
| TLV ACGIH | Алюминий | Порошок (от 00,2 до 0,04 мкм) | 5 |
| TLV ACGIH | Алюминий | Пары | 5 |
| * Предел кратковременного влияния, т.е. максимальная концентрация, воздействию которой человек может подвергаться не более 15 минут подряд при условии, что в течении дня допускается не более 4-х таких воздействий с промежутками не менее 60 минут. ** Величина порогового предела концентрации вещества, устанавливаемая американской конференцией государственных гигиенистов и определенная для 8-часового рабочего дня и 40-часовой рабочей недели. |
Источник: https://tdsm.ru/article/view/svojstva-aluminia-2




