Алкадиены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С. Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда — пропадиен — CH2=C=CH2. Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкадиенов
Названия алкенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
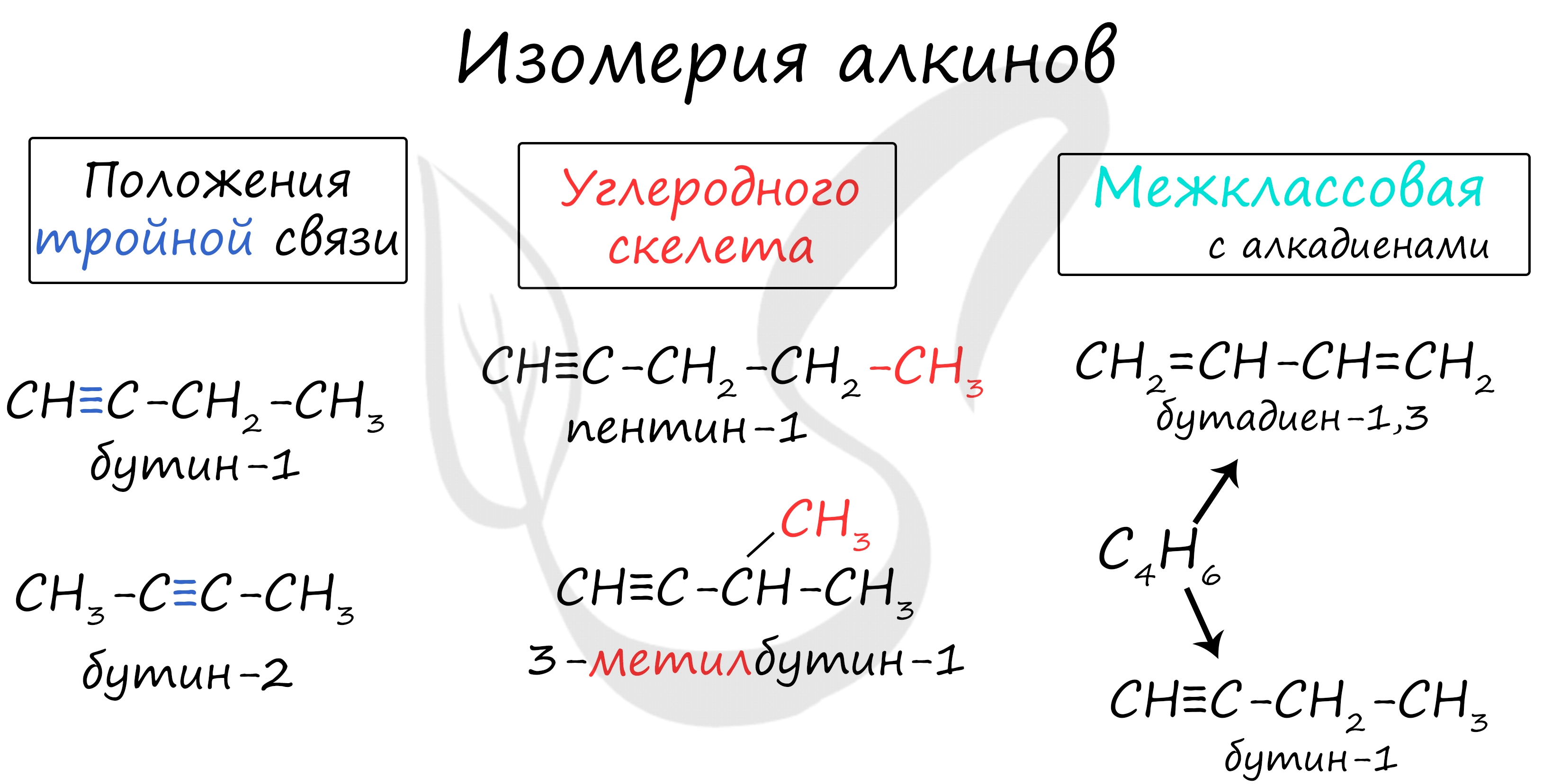
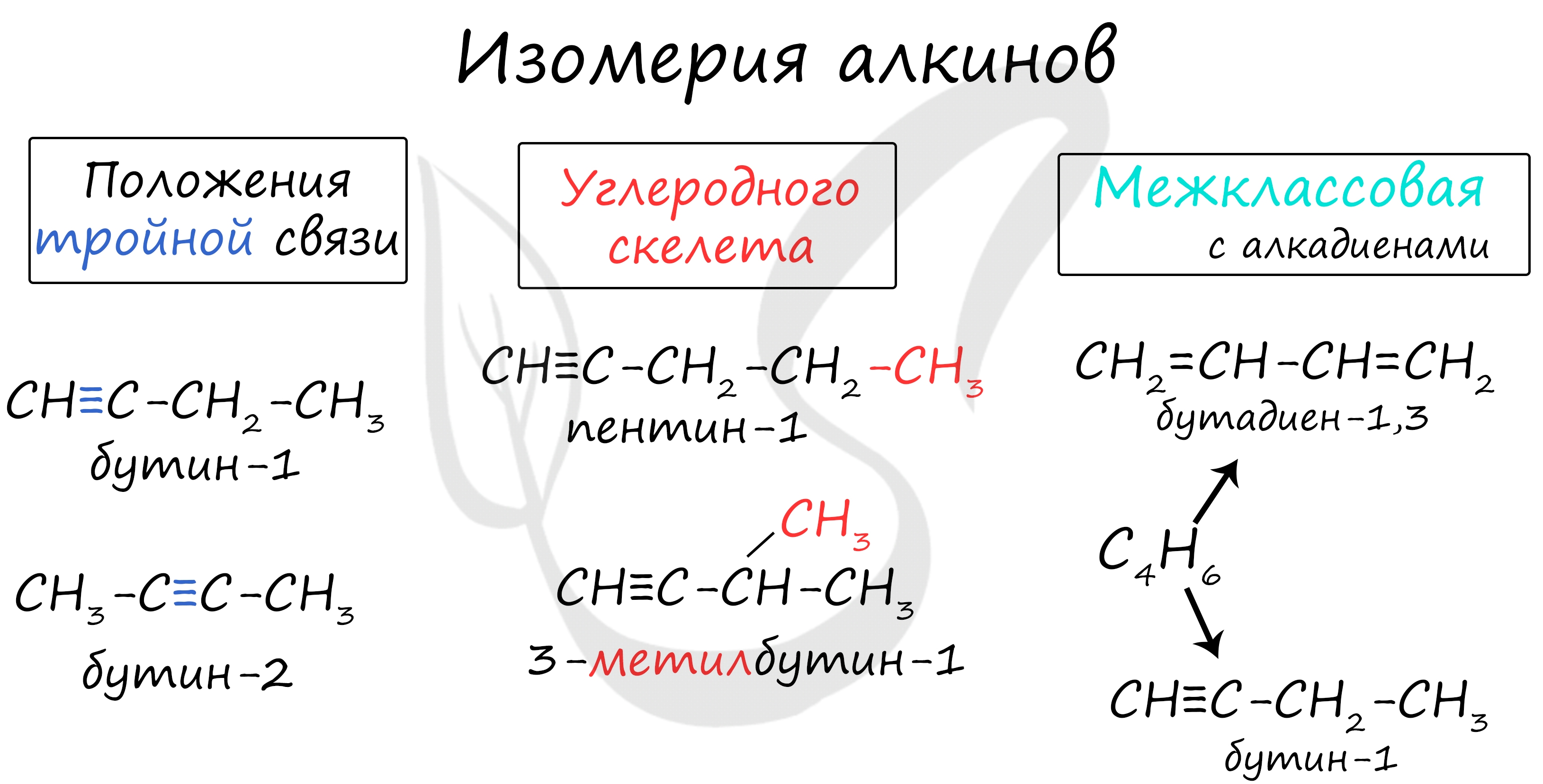
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В зависимости от того, как чередуются двойные связи в молекуле алкадиена, они подразделяются на следующие типы:
- Кумулированные двойные связи
- В случае, если две двойные связи прилежат к одному и тому же атому углерода.
- Пример — пропадиен-1,2 (аллен) — CH2=C=CH2
- В молекуле аллена все атомы углерода находятся в состоянии sp2гибридизации.
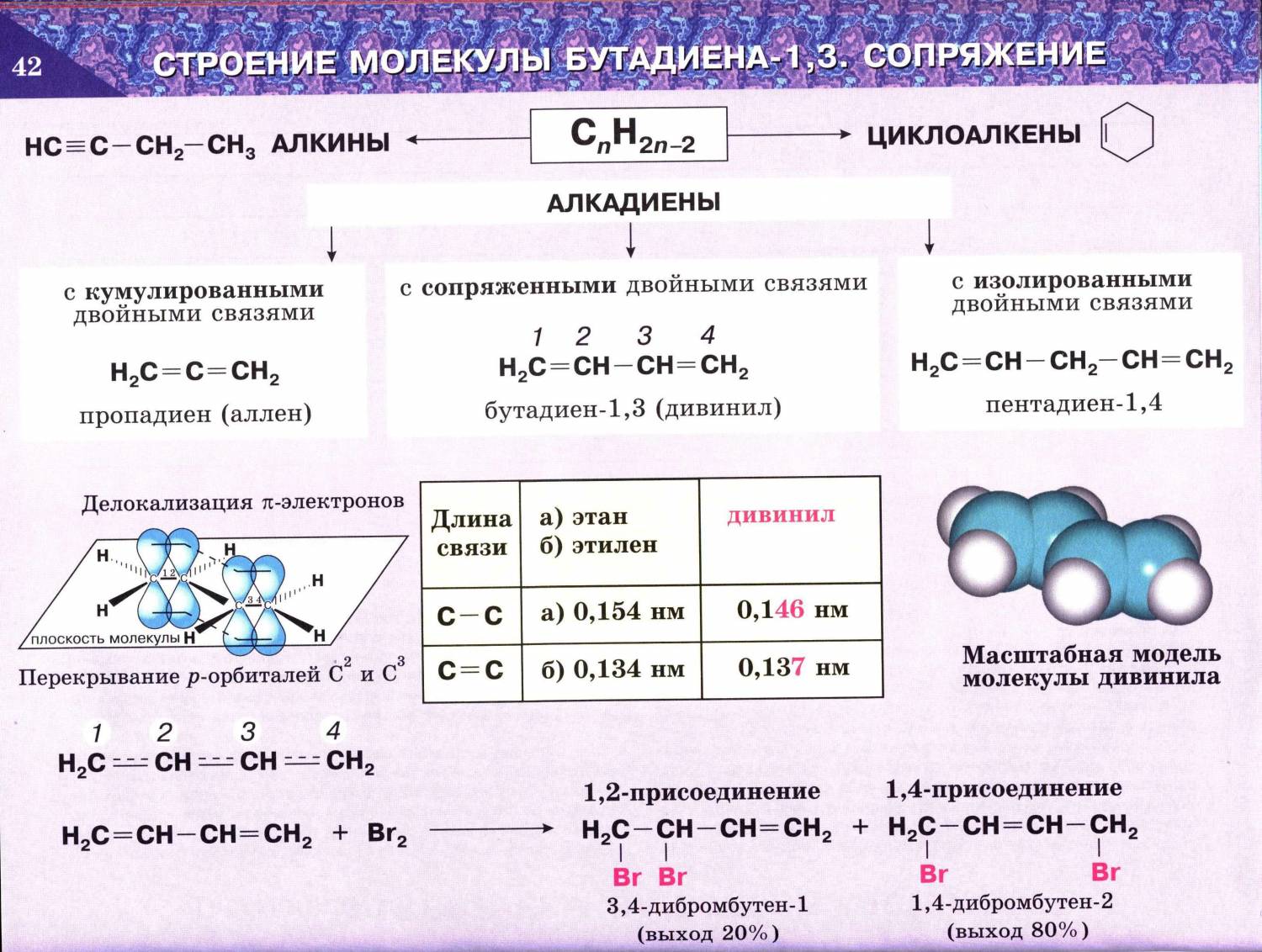
- Сопряженные двойные связи
- Изолированные двойные связи
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).

Пример — бутадиен-1,3 — CH2=CH-CH=CH2
В случае, если две двойные связи разделены двумя и более одинарными связями.
Пример — пентадиен-1,4 — CH2=CH-CH2-CH=CH2
Получение алкадиенов
Алкадиены получают несколькими способами:
- Дегидрогалогенирование дигалогеналканов
- Синтез С.В. Лебедева
- Дегидрирование алканов
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты. Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода. 
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта. 2CH3-CH2-OH → (450 °C, кат. ZnO) CH2=CH-CH=CH2 + 2H2O + H2 Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно. 
В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора. 
Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны. Наличие сопряженных двойных связей увеличивает реакционную способность молекулы и обуславливает необычный механизм некоторых реакций.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь). 
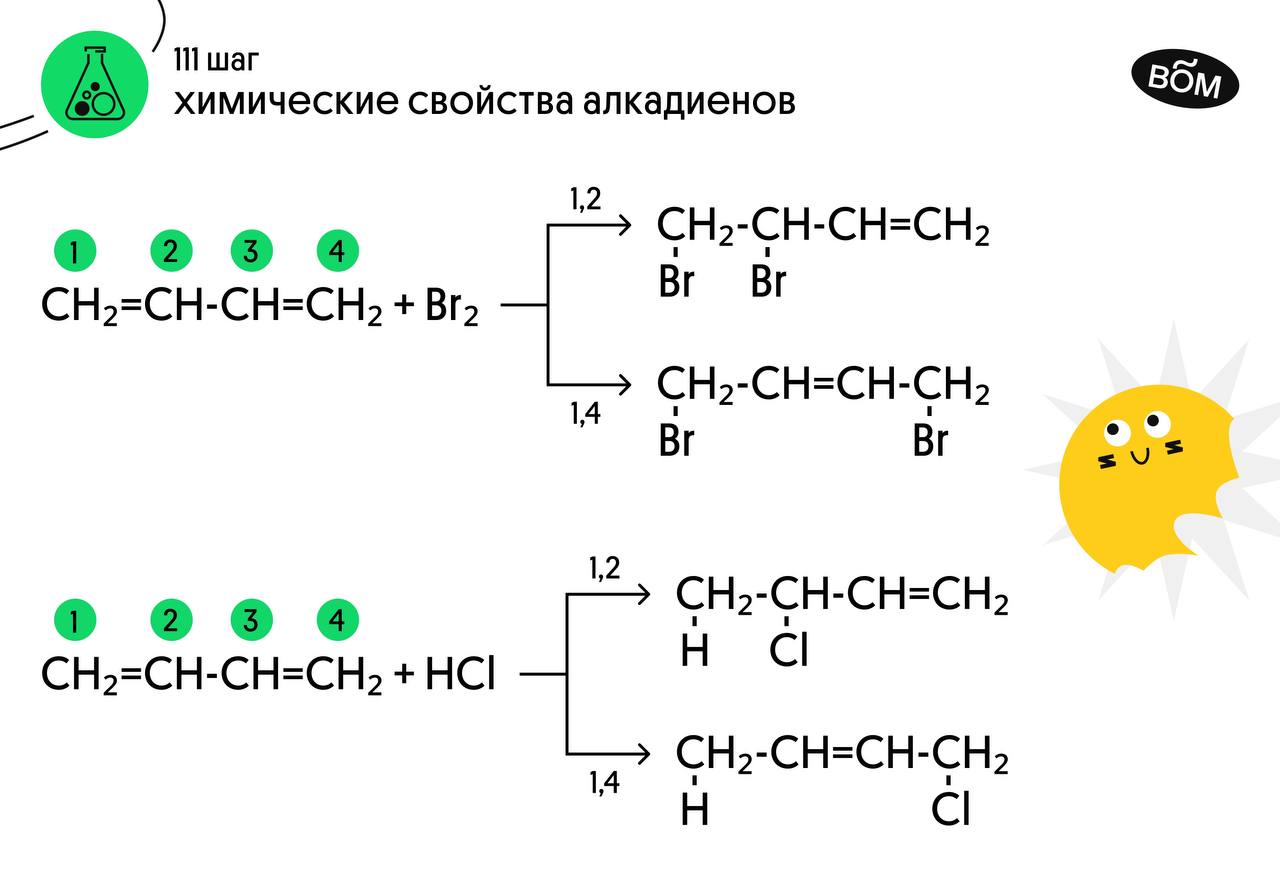
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу. В случае, если двойные связи находятся в сопряжении, выход продуктов во многом зависит от температуры. Например, в ходе галогенирования бутадиена-1,3 при -80°C преимущественно получается продукт 1,2-присоединения, а при +60°C — продукт 1,4-присоединения. 
Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения. Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода. 
При горении алкадиены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. 2CH2=CH-CH=CH2 + 11O2 → 8CO2 + 6H2O
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров. Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера. 
Источник: https://studarium.ru/article/184
Химические свойства алкадиенов | Химия онлайн
Наибольшее значение имеют диены с сопряженными связями, так как они являются сырьем для получения каучуков.
В химическом поведении этих диенов есть особенности, обусловленные наличием в их молекулах сопряжения.
Для них характерны реакции присоединения по концам системы
сопряжённых связей и образование двойной связи между срединными атомами углерода (1,4-присоединение) или к одной из двойных связей (1,2-присоединение).
Реакции присоединения
1. Гидрирование
При гидрировании бутадиена-1,3 получается бутен-2, т.е. происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам углерода С1 и С4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между атомами С2 и С3:

- В присутствии катализатора Ni получается продукт полного гидрирования:

- 2. Галогенирование

- При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана.
- Обесцвечивание бромной воды является качественной реакцией на кратную связь.
- 3. Гидрогалогенирование

- Присоединение галогенов, галогеноводородов, воды и других полярных реагентов происходит по электрофильному механизму (как в алкенах).
- 4. Реакции полимеризации
- Важнейшее свойство диенов — их способность к полимеризации, которая используется для получения синтетических каучуков.
Полимеризация 1,3-диенов может протекать либо по типу 1,4-присоединения, либо по смешанному типу 1,2- и 1,4-присоединения. Направление присоединения зависит от условий проведения реакции.
- При полимеризации бутадиена-1,3, которая протекает как 1,4-присоединение, получают бутадиеновый каучук (полибутадиен).
- Избирательное 1,4-присоединение происходит при использовании металлорганических катализаторов (например, бутиллития C4H9Li, который не только инициирует полимеризацию, но и определенным образом координирует в пространстве присоединяющиеся молекулы диена):

- В упрощенном виде реакцию полимеризации бутадиена-1,3 по схеме 1,4 присоединения можно представить следующим образом:

- Элементная ячейка полибутадиена представляется следующим образом:

Как видно, образующийся полимер характеризуется транс-конфигурацией элементной ячейки полимера. Однако наиболее ценные в практическом отношении продукты получаются при стереорегулярной (иными словами, пространственно упорядоченной) полимеризации диеновых углеводородов по схеме 1,4-присоединения с образованием цис-конфигурации полимерной цепи.
- Например, цис-полибутадиен:
- 5. Горение (полное окисление)
- Как и все углеводороды алкадиены сгорают до углекислого газа и воды.
- 6. Диеновый синтез (реакция Дильса-Альдера)
- В органическом синтезе широко применяется реакция присоединения к сопряженным диенам соединений, содержащих кратные связи (так называемых диенофилов). Реакция идет как 1,4-присоединение и приводит к образованию циклических продуктов:

- Алкадиены
Источник: https://himija-online.ru/organicheskaya-ximiya/alkadieny/ximicheskie-svojstva-alkadienov.html
Получение и свойства алкадиенов
Химические и физические свойства алкадиенов, а также способы их получения аналогичны со свойствами алкенов. Однако для алкадиенов существует ряд отличительных свойств и способов получения.
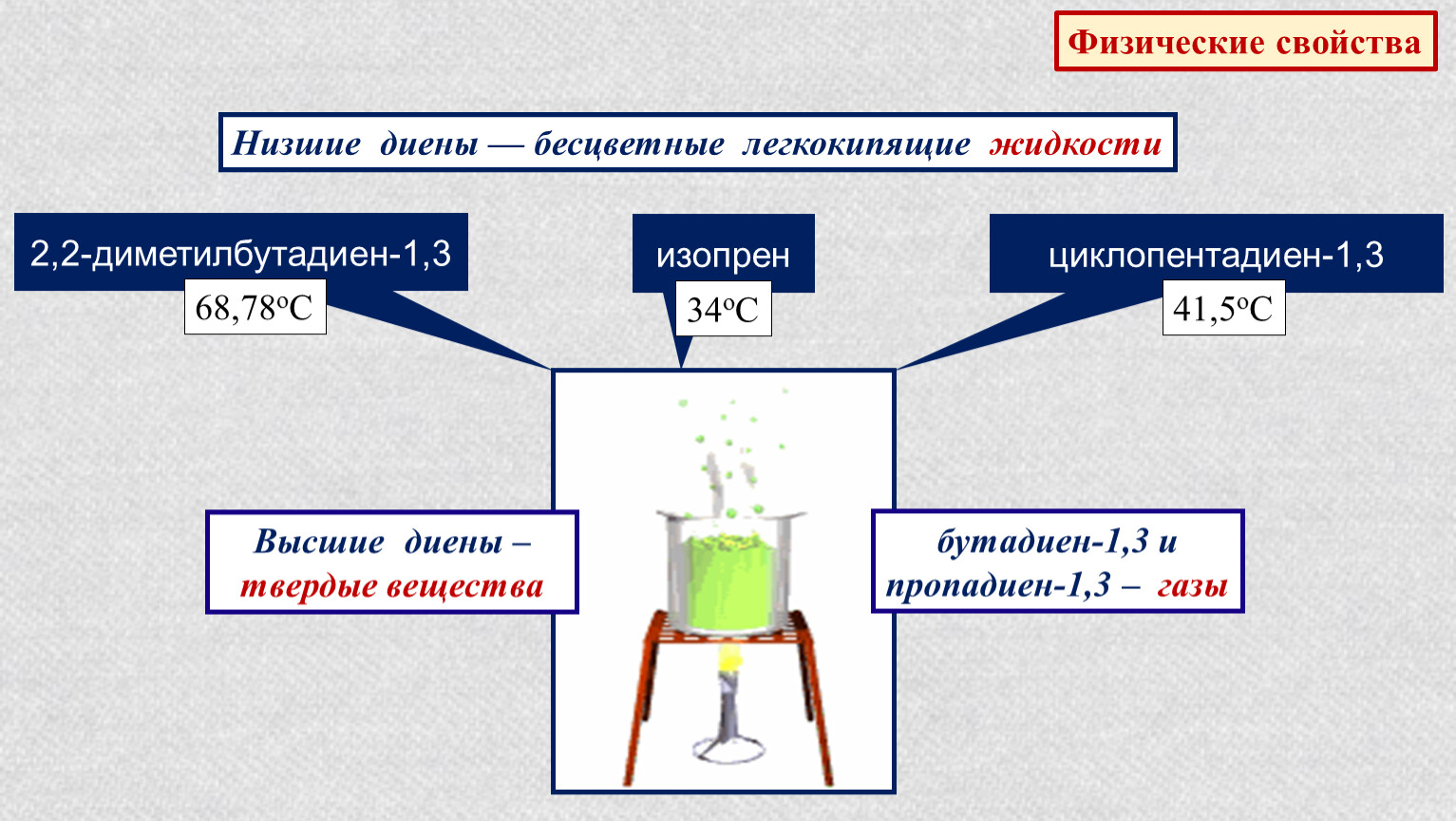
Физические свойства алкадиенов
Низшие члены гомологического ряда представляют собой газообразные вещества с низкими температурами кипения и плавления. С увеличением молекулярной массы наблюдается тенденция к увеличению этих показателей и переход к жидкому состоянию. Алкадиены нерастворимы в воде, хорошо растворимы в большинстве органических растворителях (эфире, бензоле, спирте).

Химические свойства алкадиенов
Алкадиены вступают в химические реакции, характерные для алкенов (реакции присоединения, изормеризации, полимеризации, окисления).
Реакции присоединения
- К алленам и алкадиенам с изолированными двойными связями присоединение молекул происходят по обеим двойным связям:

В алкадиенах с сопряженной двойной связью присоединение молекул происходит как по месту одной двойной связи (1,2-присоединение), так и к крайним атомам сопряженной системы (1,4-присоединение). При этом происходит перемещении двойной связи. В результате образуется смесь продуктов 1,2- и 1,4-присоединения:
 Рассмотрим реакции алкадиенов с сопряженными двойными связями на примере 1,3-бутадиена:
Рассмотрим реакции алкадиенов с сопряженными двойными связями на примере 1,3-бутадиена:
- Гидрирование 1,3-бутадиена в присутствии катализаторов (Ni, Pt):

- Галогенирование. При температуре – 80°С продукты 1,2- и 1,4-присоединения находятся в соотношении 80:20, а при 40°C – 20:80:

- Гидрогалогенирование, гидратация, сульфирование происходит согласно правилу Марковникова:



- Гипогалогенирование происходит в основном по 1,2-положениям:

- Диеновый синтез (реакция Дильса – Альдера). Сопряженные алкадиены присоединяют диенофилы (соединения с ненасыщенными С-С связями) по 1,4-положениям. В результате реакции образуются циклические соединения:
- Следующая реакция является качественной на соединения, имеющие сопряженные двойные связи:
Реакции окисления
- Горение:
- Окисление кислородом воздуха:
- Окисление раствором перманганата калия (KMnO4) является качественной реакцией на непредельные углеводороды. По обесцвечиванию малинового раствора KMnO4 судят о присутствии в исследуемом соединении кратных С-С связей:
- В нейтральной среде (водный раствор KMnO4):
- Озонолиз (окисление озоном) протекает с участием обеих двойных связей:
Реакции полимеризации алкадиенов
На основе реакций полимеризации получают синтетические каучуки. Натуральный каучук –это 1,4-цис-полиизопрен. Такой полимер можно получить, используя катализатор Циглера-Натта (Al(C2H5)3∙TiCl4).
- Транс-изомер изопрена – это гуттаперча:
- При сополимеризации 1,3-бутадиена со стиролом получают бутадиен-стирольный каучук, который широко применяется в производстве шин:
- Бутадиен-нитрильный каучук получают путем сополимеризации 1,3-бутадиена и акрилонитрила :
Получение алкадиенов
- Дегидрирование алканов и алкенов в присутствии катализатора (смесь окиси хрома и алюминия — алюмохромовый катализатор) и температуре 600оС :
Дегидрирование алканов протекает через стадию образования алкенов, которые при последующем отщеплении водорода превращаются в адкадиены.
- Одновременное дегидрирование и дегидратация спиртов в присутствии катализатора (цинкалюминиевый, цинкмарганцевый). Этот способ получения алкадиенов известен как синтез С.В. Лебедева:
- Метод А.Е. Фаворского из ацетона:
- Из смеси изобутилена и формальдегида под давлением около 2 МПа, температуре 100оС:
- Димеризация ацетилена через винилацетилен под действием катализатора (соли закиси меди) с последующим гидрированием винилацетилена:
- Конденсация ацетилена с формальдегидом в присутствии катализатора (ацетиленид меди на силикагеле) при температуре 100оС и давлении 0,5 МПа (Синтез Реппе):
- Дегидратация гликолей в присутствии фосфорной кислоты в качестве катализатора при температуре ~260–275оС и давлении 7,0 МПа, последующая дегидратация при температуре 270–280 оС и давлении 0,1 МПа (катализатор — NaН2РО4, нанесенный на кокс или графит):
- Дегидрогалогенирование дигалогеналканов в присутствии водоотнимающего агента – серной кислоты:
Применение алкадиенов
Основное применение алкадиены нашли в производстве синтетических каучуков, основная часть которых используется для получения резины, материала бензопроводов и др. Подробно о видах каучуков и областях их применения читайте в разделе Каучук — виды, получение и применение.
Источник: http://zadachi-po-khimii.ru/organic-chemistry/poluchenie-i-svojstva-alkadienov.html
Диены — номенклатура, получение, характерные химические свойства
Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnH2n-2.
- Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах:
- 1) изолированные двойные связи разделены в цепи двумя или более s-связями:
- СН2=СН–СН2–СН=СН2 (разделенные sp3-атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах);
- 2) кумулированные двойные связи расположены у одного атома углерода:
- СН2=С=СН2 (подобные диены (аллены) менее стабильны, чем другие диены и при нагревании в щелочной среде перегруппировываются в алкины);
- 3) сопряженные двойные связи разделены одной s-связью:
- СН2=СН–СН=СН2.
Сопряженные диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех sp2-атомов углерода.
Все атомы углерода лежат в одной плоскости, образуя s-скелет. Негибридизованные р-орбитали каждого атома углерода перпендикулярны плоскости s-скелета и параллельны друг другу, взаимно перекрываются, образуя единое p-электронное облако.
Такой особый вид взаимного влияния атомов называется сопряжением.

Перекрывание р-орбиталей молекулы бутадиена имеет место не только между С1 – С2, С3 – С4, но и между С2 – С3. В связи с этим применяют термин: «сопряженная система».
Следствием делокализации электронной плотности является то, что длины связей С1 – С2 (С3 – С4) увеличены, по сравнению с длиной двойной связи в этилене (0,132 нм) и составляют 0,137 нм; в свою очередь, длина связи С3 – С4 меньше, чем в этане С – С (0,154 нм) и составляет 0,146 нм. Диены с сопряженной системой двойных связей более энергетически выгодны.
Номенклатура алкадиенов
По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода) с добавлением окончания –диен.
- Виды изомерии алкадиенов:
- Структурная изомерия:
- 1) изомерия положения сопряженных двойных связей;
- 2) изомерия углеродного скелета;
- 3) межклассовая (изомерны алкинам)
- Пространственная изомерия — диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию.

Способы получения алкадиенов

Химические свойства алкадиенов
Для сопряженных диенов характерны реакции присоединения (реакции 1, 2). Наличие сопряженной системы p-электронов приводит к особенностям реакций присоединения.
Сопряженные диены способны присоединять не только по двойным связям (С1 и С2, С3 и С4), но и к концевым (С1 и С4) атомам углерода сообразованием двойной связи между С2 и С3.
Соотношение продуктов 1,2- и 1,4-присоединения зависит от температуры, при которой проводился эксперимент и от полярности применяемого растворителя.
Восстановление (реакция 3) с помощью [Na + C2H5OH] называется восстановлением водородом в момент выделения (при взаимодействии натрия и спирта выделяется водород). Алкены в таких условиях не восстанавливаются, это отличительное свойство сопряженных диенов.
Полимеризация (реакция 4) важнейшее свойство сопряженных диенов, которая происходит под действием различных катализаторов (AlCl3, TiCl4+(C2H5)3Al) или света. В случае применения определенных катализаторов можно получить продукт полимеризации с определенной конфигурацией цепей.
Цис-конфигурацию имеет натуральный каучук. Макромолекулы натурального каучука имеют спиралевидную структуру цепи из-за того, что изопреновые звенья изогнуты, что создает пространственные препятствия упорядоченному расположению цепей.
В каучуке длинные молекулы скручены в спутаны друг с другом в спирали. При растяжении каучука спирали растягиваются, а при снятии напряжения они снова скручиваются. В природе существует еще другой полимер изопрена гуттаперча (транс-конфигурация).
Гуттаперча обладает стержнеобразной структурой цепи из-за выпрямленности изопреновых звеньев (цепи с транс-конфигурацией двойных связей могут располагаться одна вдоль другой), поэтому гуттаперча твердый, но хрупкий полимер.
Натуральный каучук имеют немногие страны и поэтому его заменяют синтетическими каучуками из дивинила, а также из изопрена.


- Для практического использования каучуки превращают в резину.
Резина – это вулканизованный каучук с наполнителем (сажа). Суть процесса вулканизации заключается в том, что нагревание смеси каучука и серы приводит к образованию трехмерной сетчатой структуры из линейных макромолекул каучука, придавая ему повышенную прочность. Атомы серы присоединяются по двойным связям макромолекул и образуют между ними сшивающие дисульфидные мостики.
Сетчатый полимер более прочен и проявляет повышенную упругость – высокоэластичность (способность к высоким обратимым деформациям).
В зависимости от количества сшивающего агента (серы) можно получать сетки с различной частотой сшивки. Предельно сшитый натуральный каучук – эбонит – не обладает эластичностью и представляет собой твердый материал.
Источник: http://himege.ru/dieny-nomenklatura-poluchenie-xarakternye-ximicheskie-svojstva/
Химические свойства алкадиенов
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n+2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
- Строение, изомерия и гомологический ряд алкадиенов
- Химические свойства алкадиенов
- Получение алкадиенов
- Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
| Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей. |
1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
| Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода. |
1.1. Гидрирование
- Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
- При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
- Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
| При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2). |
При полном гидрировании дивинила образуется бутан:
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2: |
- Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
- При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
1.3. Гидрогалогенирование алкадиенов
- Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
- .
- 3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком. |
- Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
- При полимеризации изопрена образуется природный (натуральный) каучук:
2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
| Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь. |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
2.3. Горение алкадиенов
- Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
- В общем виде уравнение сгорания алкадиенов выглядит так:
- CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
| Например, уравнение сгорания бутадиена: |
2C4H6 + 11O2 → 8CO2 + 6H2O
Источник: https://chemege.ru/ximicheskie-svojstva-alkadieny/
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола)
Алканами (парафинами) называют нециклические углеводороды, в молекулах которых все атомы углерода соединены только одинарными связями. Другими словами в молекулах алканов отсутствуют кратные — двойные или тройные связи. Фактически алканы являются углеводородами, содержащими максимально возможное количество атомов водорода, в связи с чем их называют предельным (насыщенными).
Ввиду насыщенности, алканы не могут вступать в реакции присоединения.
Поскольку атомы углерода и водорода имеют довольно близкие электроотрицательности, это приводит к тому, что связи С-Н в их молекулах крайне малополярны. В связи с этим для алканов более характерны реакции протекающие по механизму радикального замещения, обозначаемого символом SR.
1. Реакции замещения
- В реакциях данного типа происходит разрыв связей углерод-водород
- RH + XY → RX + HY
- или
Галогенирование
Алканы реагируют с галогенами (хлором и бромом) под действием ультрафиолетового света или при сильном нагревании. При этом образуется смесь галогенпроизводных с различной степенью замещения атомов водорода — моно-, ди- три- и т.д. галогенозамещенных алканов.
На примере метана это выглядит следующим образом:
Меняя соотношение галоген/метан в реакционной смеси можно добиться того, что в составе продуктов будет преобладать какое-либо конкретное галогенпроизводное метана.
Механизм реакции
Разберем механизм реакции свободнорадикального замещения на примере взаимодействия метана и хлора. Он состоит из трех стадий:
- инициирование (или зарождение цепи) — процесс образования свободных радикалов под действии энергии извне – облучения УФ-светом или нагревания. На этой стадии молекула хлора претерпевает гомолитический разрыв связи Cl-Cl c образованием свободных радикалов:
Свободными радикалами, как можно видеть из рисунка выше, называют атомы или группы атомов с одним или несколькими неспаренными электронами (Сl•, •Н, •СН3,•СН2• и т.д.);
2. Развитие цепи
Эта стадия заключается во взаимодействии активных свободных радикалов с неактивными молекулами. При этом образуются новые радикалы. В частности, при действии радикалов хлора на молекулы алкана, образуется алкильный радикал и хлороводород. В свою очередь, алкильный радикал, сталкиваясь с молекулами хлора, образует хлорпроизводное и новый радикал хлора:
3) Обрыв (гибель) цепи:
Происходит в результате рекомбинации двух радикалов друг с другом в неактивные молекулы:
2. Реакции окисления
В обычных условиях алканы инертны по отношению к таким сильным окислителям, как концентрированная серная и азотная кислоты, перманганат и дихромат калия (КMnО4, К2Cr2О7).
Горение в кислороде
- А) полное сгорание при избытке кислорода. Приводит к образованию углекислого газа и воды:
- CH4 + 2O2 = CO2 + 2H2O
- Б) неполное сгорание при недостатке кислорода:
- 2CH4 + 3O2 = 2CO + 4H2O
- CH4 + O2 = C + 2H2O
Каталитическое окисление кислородом
В результате нагревания алканов с кислородом (~200 оС) в присутствии катализаторов, из них может быть получено большое разнообразие органических продуктов: альдегиды, кетоны, спирты, карбоновые кислоты.
Например, метан, в зависимости природы катализатора, может быть окислен в метиловый спирт, формальдегид или муравьиную кислоту:
3. Термические превращения алканов
Крекинг
Крекинг (от англ. to crack — рвать) — это химический процесс протекающий при высокой температуре, в результате которого происходит разрыв углеродного скелета молекул алканов с образованием молекул алкенов и алканов с обладающих меньшими молекулярными массами по сравнению с исходными алканами. Например:
CH3-CH2-CH2-CH2-CH2-CH2-CH3 → CH3-CH2-CH2-CH3 + CH3-CH=CH2
Крекинг бывает термический и каталитический. Для осуществления каталитического крекинга, благодаря использованию катализаторов, используют заметно меньшие температуры по сравнению с термическим крекингом.
Дегидрирование
- Отщепление водорода происходит в результате разрыва связей С—Н; осуществляется в присутствии катализаторов при повышенных температурах. При дегидрировании метана образуется ацетилен:
- 2CH4 → C2H2 + 3H2
- Нагревание метана до 1200 °С приводит к его разложению на простые вещества:
- СН4 → С + 2Н2
- При дегидрировании остальных алканов образуются алкены:
- C2H6 → C2H4 + H2
- При дегидрировании н-бутана образуются бутен-1 и бутен-2 (последний в виде цис- и транс-изомеров):
Дегидроциклизация
Изомеризация
Химические свойства циклоалканов
Химические свойства циклоалканов с числом атомов углерода в циклах больше четырех, в целом практически идентичны свойствам алканов.
Для циклопропана и циклобутана, как ни странно, характерны реакции присоединения. Это обусловлено большим напряжением внутри цикла, которое приводит к тому, что данные циклы стремятся разорваться.
Так циклопропан и циклобутан легко присоединяют бром, водород или хлороводород:
Химические свойства алкенов
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
CH3—СН=СН2 + Н2 → CH3—СН2—СН3
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Галогенирование
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
СН2=СН2+ Br2 → CH2Br-CH2Br
Гидрогалогенирование
- Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров.
Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
- Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
- Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
- Поэтому:
Гидратация
- Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
- Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
- CH2=CH2 + H2O → CH3-CH2-OH
- Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
CnH2n + (3/2)nO2 → nCO2 + nH2O
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
- Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
- C2H4 + 2KMnO4 + 2H2O → CH2OH–CH2OH + 2MnO2 + 2KOH (охлаждение)
- В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
- 5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 17H2O (нагревание)
- В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
- 5CH3CH=CH2 + 10KMnO4 + 15H2SO4 → 5CH3COOH + 5CO2 + 10MnSO4 + 5K2SO4 + 20H2O (нагревание)
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.
Химические свойства алкадиенов
Реакции присоединения
- Например, присоединение галогенов:
- Бромная вода обесцвечивается.
В обычных условиях присоединение атомов галогена происходит по концам молекулы бутадиена-1,3, при этом π-связи разрываются, к крайним атомам углерода присоединяются атомы брома, а свободные валентности образуют новую π-связь.
Таким образом, как бы происходит «перемещение» двойной связи. При избытке брома может быть присоединена еще одна его молекула по месту образовавшейся двойной связи.
Реакции полимеризации
Химические свойства алкинов
Алкины являются ненасыщенными (непредельными) углеводородами в связи с чем способны вступать в реакции присоединения. Среди реакци присоединения для алкинов наиболее распространено электрофильное присоединение.
Галогенирование
Поскольку тройная связь молекул алкинов состоит из одной более прочной сигма-связи и двух менее прочных пи-связей они способны присоединять как одну, так и две молекулы галогена. Присоединение одной молекулой алкина двух молекул галогена протекает по электрофильному механизму последовательно в две стадии:
Гидрогалогенирование
- Присоединение молекул галогеноводорода, также протекает по электрофильному механизму и в две стадии. В обоих стадиях присоединение идет в соответствии с правилом Марковникова:
Гидратация
- Присоединение воды к алкинами происходит в присутсвии солей рути в кислой среде и называется реакцией Кучерова.
- В результате гидратации присоединения воды к ацетилену ообразуется ацетальдегид (укусный альдегид):
- Для гомологов ацетилена присоединение воды приводит к образованию кетонов:
Гидрирование алкинов
Алкины реагируют с водородом в две ступени. В качестве катализаторов используют такие металлы как платина, палладий, никель:
Тримеризация алкинов
При пропускании ацетилена над активированным углем при высокой температуре из него образуется смесь различных продуктов, основным из которых является бензол – продукт тримеризации ацетилена:
Димеризация алкинов
Также ацетилен вступать в реакцию димеризации. Процесс протекает в присутствии солей меди как катализаторов:
Окисление алкинов
Алкины сгорают в кислороде:
СnH2n-2 + (3n-1)/2 O2 → nCO2 + (n-1)H2O
Взаимодействие алкинов с основаниями
- Алкины с тройной C≡C на конце молекулы, в отличие от остальных алкинов, способны вступать в реакции, в которых атом водорода при тройной связи замещается металл.
Например, ацетилен реагирует с амидом натрия в жидком аммиаке:
- HC≡CH + 2NaNH2 → NaC≡CNa + 2NH3,
- а также с аммиачным раствором оксида серебра, образуя нерастворимые солеподобные вещества называемые ацетиленидами:
- Благодаря такой реакции можно распознать алкины с концевой тройной связью, а также выделить такой алкин из смеси с другими алкинами.
- Следует отметить, что все ацетилениды серебра и меди являются взрывоопасными веществами.
- Ацетилениды способны реагировать с галогенпроизводными, что используется при синтезе более сложных органических соединений с тройной связью:
- СН3-C≡CН + NaNН2 → СН3-C≡CNa + NН3
- СН3-C≡CNa + CH3Br → СН3-C≡C-СН3 + NaBr
Химические свойства ароматических углеводородов
Ароматический характер связи влияет на химические свойства бензолов и других ароматических углеводородов.
Единая 6пи–электронная система намного более устойчива, чем обычные пи-связи. Поэтому для ароматических углеводородов более характерны реакции замещения, а не присоединения. В реакции замещения арены вступают по электрофильному механизму.
Реакции замещения
Галогенирование
Нитрование
Лучше всего реакция нитрования протекает под действием не чистой азотной кислоты, а ее смеси с концентрированной серной кислотой, так называемой нитрующей смеси:
Алкилирование
Реакция при которой один из атомов водорода при ароматическом ядре замещается на углеводородный радикал:
Также вместо галогенпроизводных алканов можно использовать алкены. В качестве катализаторов можно использовать галогениды алюминия, трехвалентного железа или неорганические кислоты.
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/harakternye-himicheskie-svojstva-uglevodorodov




