В 17-ом веке ее нашли в муравьях и решили назвать муравьиной. Кислоту насекомые выделяют при укусах.
Джон Рейем, открывший соединение, изучал рыжих муравьев. С их помощью и получил реагент.

Позже, выяснилось, что муравьиная кислота вовсе не муравьиная, точнее, не только.
Вещество содержится во фруктах, растениях, человеческом поте, моче. Кроме муравьев кислоту выделяют пчелы, тоже при укусах.
Так что, ощущение от ее попадания в кожу вспомнит каждый. Это жжение. Хоть реагент и не относится к сильным, но все же, является кислотой.

Название класса оправдано. Все его соединения кислые на вкус. Но, сейчас не об общих свойствах, а характеристиках именно муравьиного реагента.
Свойства муравьиной кислоты
HCOOH, – такова формула муравьиной кислоты. COOH химики называют карбоксильной группой.
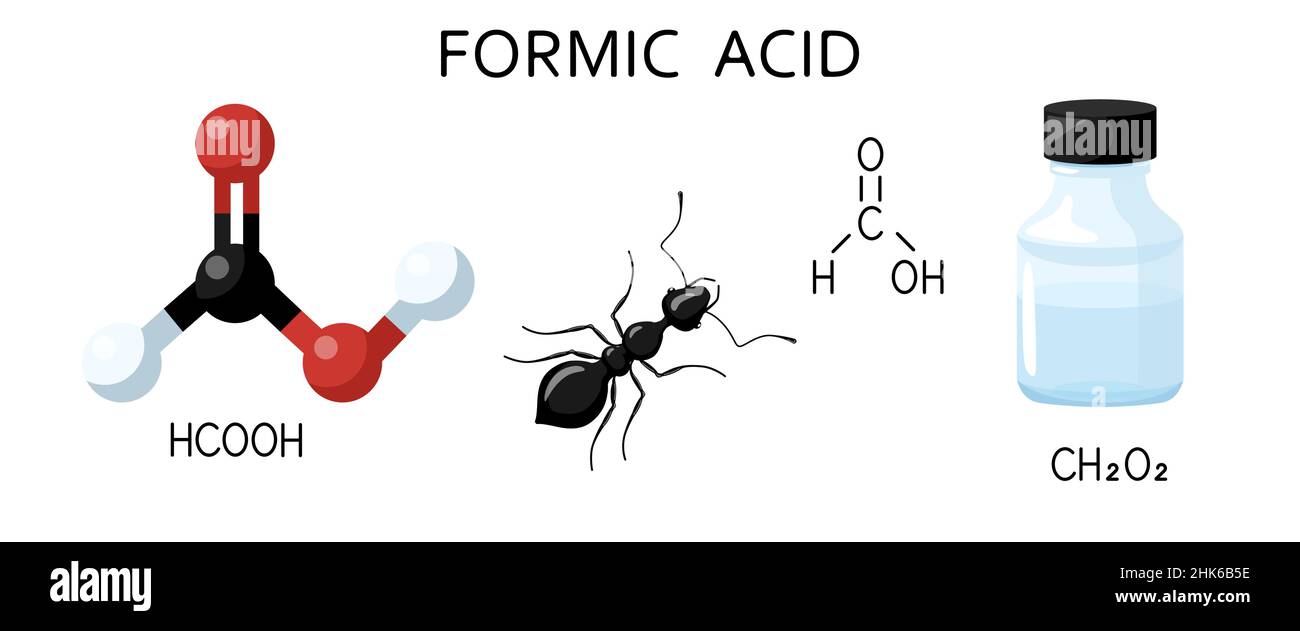
В героини статьи она одна, поэтому, соединение одноосновное. CH4 – метан. Соответственно, кислота метановая.
Собрав данные воедино, получаем одноосновное карбоновое соединение метана. Оно биогенно, поскольку вырабатывается живыми организмами, а не только синтезируется.
Цепь молекул кислоты открыта. Если пройдет взаимодействие со спиртом, получится этерифицированная форма соединения.
Такая характерна для масел, восков, в общем, растительных и животных жиров. Поэтому, метановую кислоту именуют жирной.
Однако, в своем ряду соединение стоит особняком, поскольку углерод карбоксильной группы скреплен с водородом.
Обычно же, он контачит с алкилом, то есть, углеводородным радикалом. В итоге, героиню статьи можно причислить не только к жирным кислотам, но и альдегидам, а попросту, спиртам.
Как и они, муравьиная кислота способна окисляться. Итог реакции – угольная кислота.
От альдегидов соединение взяло и способность восстанавливать соли и окиси ртути. Реакции муравьиной кислоты с ними идут при нагреве.
Получаются закись ртути, а порой, и ее металлическая форма. Подобная реакция проходит с серебром.
Взаимодействие дает соль муравьиной кислоты. Она просто разлагается, вновь давая чистый аргентум.
У муравьиной кислоты нет кристаллического состояния. Соединение изначально жидкое, легко смешивается с ацетоном, глицерином, бензолом.
Последние вещества ароматические. Запах есть и у муравьиной кислоты. Аромат специфический, резкий.
В водных растворах соединения он рассеивается, поскольку уменьшается концентрация кислоты. Резок запах лишь в ее безводной форме.
Хотя, вода может найтись и в ней. Нужно лишь примешать к муравьиной кислоте серную. Итог реакции — окись углерода и вода.
Последняя, используется для хозяйственных нужд. А вот окись углерода – продукт, нужный для создания синтетического жидкого топлива, органических кислот, спиртов.

Получить из муравьиной кислоты можно и двуокись углерода. На нее и водород героиня статьи распадается в присутствии двух металлов, — иридия и родия.
Для реакции достаточно одного из них. Говоря простым языком, двуокись углерода – это угарный газ.
Однако, и он нужен промышленникам. Соединение добавляют в газировки, пиво и сахар.
Остается выяснить, зачем нужна сама муравьиная кислота. Отзывы промышленников, и не только, далее.
Применение муравьиной кислоты
Применение соединение нашло в пищевой промышленности. Увидите на упаковке Е236, знайте, это муравьиная кислота. Купить с ней предлагают напитки, как безалкогольные, так и алкогольные, к примеру, вина.
Е236 добавляется, так же, в корма для животных и консервированные овощи. Соответственно, добавка помогает продуктам дольше сохраняться. Вывод: — у реагента есть антибактериальные свойства.
В организме раствор муравьиной кислоты не задерживается, быстро выводится. Главное, не переборщить.
Если на кожу, или внутрь, нечаянно попадет концентрат соединения, не избежать ожогов, отравления, потери зрения.
Животным тоже предлагают продукты с муравьиной кислотой. Речь уже не о домашних питомцах и их кормах.
В сено и силос для скотины муравьиное соединение, так же, добавляют. Кислота замедляет процессы гниения. Распад сена замедляется, оно остается полезным и вкусным до самой весны.
- Муравьиная кислота в аптеках продается не только в качестве обеззараживающего средства, но и лекарства от варикоза.
- Попадая в кровь в небольших количествах, реагент способствует расширению сосудов, а значит, улучшает кровоток.
- Это служит профилактикой тромбов – смертельно опасного последствия варикоза.

Кровь застаивается в венах, образуются сгустки, крепящиеся к стенкам сосудов. Отрываясь, они устремляются к сердцу.
Если дойдут, последует мгновенная смерть. Проблема, как видно, острая и решить ее помогает не менее «острое» средство – муравьиная кислота.
Медики используют метановую кислоту и в качестве иммуностимулятора. Эту роль соединение играет в лечении туберкулеза.
Бороться реагент способен и с грибковыми заболеваниями. Хотя, часть аптечных средств, больше косметической направленности.
Так, на основе героини статьи делают средства от угревой сыпи. Купить можно и крем с муравьиной кислотой.
Его, как правило, берут для соляриев. Средство слегка раздражает, а значит, и разогревает кожу.
В итоге, обменные процессы протекают быстрее, покровы словно притягивают ультрафиолет.
Так что, муравьиная кислота для загара позволяет сократить время пребывания в солярии, получив, при этом, должный эффект.
В химической промышленности муравьиная кислота служит восстановителем. Помогают свойства, заимствованные от альдегидов.
Реагент, так же, нужен в текстильной отрасли для окрашивания тканей. Муравьиная кислота выступает в роли протравы.
Она нужна для подготовки поверхности материи, иначе, краситель ляжет неравномерно.
Интересно, что муравьиную кислоту используют и за пределами человеческого общества.
Так, медведи после спячки направляются к муравейникам и ложатся на них. Зла на насекомых гиганты не держат.

Косолапые хотят избавиться от паразитов, скопившихся в шерсти за зиму. Они боятся кислот.
Муравьи кусают медведя, но не добираются до кожи, впрыскивая экстракт в густую шерсть. Паразиты бегут «с тонущего в реагенте корабля».
Добыча муравьиной кислоты
Получение муравьиной кислоты – дорога, которая разветвляется. Есть несколько путей добычи реагента.
Первый – производство муравьиной кислоты из соединений углерода, к примеру, хлороформа. На него воздействуют разбавленной щелочью.
Возможно, так же, омылить синильную кислоту, воздействовать двуокисью углерода на гидрит калия, нагреть щавеливую кислоту в присутствии глицерина.
Однако, промышленниками используется лишь один метод. Это пропускание окиси углерода через едкий натр.
Водный раствор реагента можно получить способом перегонки муравьиных солей и серной кислоты.
Если нужно убрать воду, воздействуют концентратом щавелевой кислоты. Привычная дробная перегонка водных растворов не поможет.
При 107-ми градусах смесь метановой кислоты и воды – постоянно кипящий состав. Причем, героини статьи в нем лишь 77%.
Цена муравьиной кислоты
На муравьиную кислоту цена зависит, в основном, от концентрации. Чаще всего, продают растворы, а не обезвоженный реагент.
Для медицинских целей, к примеру, нужна концентрация всего в 1,4%. Препарат именуется муравьиным спиртом и стоит порядка 20-ти рублей за 50-миллилитровый флакон.
Если к соединению примешены дополнительные компоненты, к примеру, по уходу за телом, цена будет иная. Так, 75-миллилитровый бутылек бальзама для кожи может стоит 110, а то и 200 рублей.
Для промышленников реагент отгружают цистернами, или канистрами по 25 и 35 килограммов. За последние, просят в районе 3000-4000 рублей.

Ценник за кило – 50-150 рублей. Это запросы продавцов за 85-процентную кислоту.
Разброс цен связан с чистотой соединения и личными амбициями бизнесменов, а так же, местом производства.
Наиболее выгодны продукция из Китая и отечественные образцы. Частично на цену влияет тара. Она может быть металлической, или пластиковой.
Учитывается наличие удобного слива, как у канистр. В бочках такого, как правило, нет. Есть ряд тар, открыв которые, закрыть уже не получиться.
За такое неудобство стоимость немного снижают. Снижают ее и для оптовиков. При крупных заказах удается сэкономить от 5-ти до 20, а иногда, и все 25%.
Особенно лояльно отношение к постоянным партнерам. Некоторым из них кислоту отгружают даже без предоплаты.
Источник: https://tvoi-uvelirr.ru/muravinaya-kislota-svojstva-primenenie-i-cena-muravinoj-kisloty/
Что такое муравьиный спирт и можно ли его пить?

В данном случае актуально поднять вопрос о том, можно ли пить муравьиный спирт и насколько это опасно для здоровья.
Муравьиный спирт и его состав
Выпускается активное вещество в разных формах. Самым популярным из них является раствор для наружного применения, где содержится на 98,6 мл медицинского спирта и 1,4 мл кислоты муравьиной. Это и есть известный всем муравьиный спирт. На вид он прозрачный и обладает специфическим резким запахом.
Форма выпуска
Препарат продается в аптеке по 100 мл во флаконе из темного стекла, а также по 30 и 50. Емкость находится в картонной упаковке вместе с инструкцией по применению.
Несмотря на разницу объемов, а процентном составе состав муравьиного спирта не меняется. Только при таком разведении он действует на кожу, не вызывая ожогов.
Сама кислота входит в состав других средств (бальзамов, мазей, гелей для растирки).

Форма выпуска
Фармакологическое действие
Данное средство пользуется спросом и помогает при некоторых заболеваниях. Активное вещество его в природе встречается у муравьев, пчел, выделяется из фруктов, крапивы и хвои. Но для химической промышленности и в медицинских целях кислоту обычно синтезируют в лабораториях.
Область применения, для чего нужен муравьиный спирт, исходит из того, что препарат обладает местно-раздражающим действием.
Такая активация рецепторов позволяет осуществлять рефлекторный отвлекающий эффект и снижает болевую чувствительность.
В результате усиления синтеза пептидов и эндорфинов происходит расширение сосудов, улучшается местный кровоток и трофика тканей. Этиловый спирт в препарате одновременно оказывает согревающее и антисептическое действие.
Показания к применению муравьиного спирта
Показанием к его местному использованию является любое состояние, при котором необходимо улучшить ток крови в капиллярной сети, ускорить процессы заживления, убрать острую боль.
Польза муравьиного спирта в быту заключается в устранении плесени. Его антисептические свойства используют в хирургии для обработки рук перед операцией.
Исходя из состава и фармакологического действия препарата, уже становиться понятно, что представляет собой муравьиный спирт и для чего его применяют. В медицине он используется при следующих патологиях:
- ревматические боли в суставах;
- миозиты;
- травмы и повреждения сухожилий;
- невралгии;
- остеохондроз;
- гипертонус мышц;
- варикозное расширение вен;
- судороги;
- воспаление суставной сумки (периартрит).
Раствор помогает быстрее рассасывать гематомы, устранить застой в местах с гнойничковой инфекцией, улучшить трофику периферической ткани за счет притока крови.
Применение
Внимание! Если внимательно изучить инструкцию по применению, то однозначно можно вынести для себя, что муравьиный спирт можно использовать только в качестве наружного средства, пить его нельзя. При этом нужно следить, чтобы он не попадал на слизистые оболочки и открытые раны.

Применение
Его способность очищать кожные покровы и улучшать их состояние известно косметологам и дерматологам. Они проводят лечение муравьиным спиртом угревой сыпи, фурункулеза, а также при выделении избыточного количества кожного сала.
До того как начать терапию, следует провести тест на переносимость средства. Для этого нужно его в небольшом количестве нанести на сгибательную поверхность локтевого сустава и посмотреть на реакцию в течение 12-24 часов. Если в месте соприкосновения кожа станет сухой, покраснеет или начнет шелушиться, то в этом случае препарат заменяется другим, похожим по действию.
Способы использования средства зависят от типа заболевания. Если требуется помощь при артрите или остеохондрозе, то раствор втирают в пораженное место до 4 раз в сутки. Для усиления действия можно приложить теплый сухой компресс.
Когда необходимо избавиться от прыщей и акне, то кожу сначала очищают, а потом прикладывают ватный диск, нанося круговыми движениями муравьиный спирт, разведенный 1 к 1 с чистой водой. Выдерживают 5 минут, а потом смывают его и используют питательный крем.
Использование в народной медицине
Часто встречается применение муравьиного спирта в нетрадиционной и народной медицине. Его рекомендуют в составе с другими природными компонентами для оказания помощи при таких проблемах:
- в виде примочек и компрессов при растяжениях и арталгиях;
- для быстрого восстановления после укусов комаров;
- в качестве защиты от укусов иксодовых клещей (для этого обрабатывают средством одежду и обувь);
- для лечение грибка ногтей с добавлением димексида и березового дегтя;
- для растирки с Меновазином при боли в спине;
- для удаления ненужных волос (применяется в комплексе с другими компонентами).
Противопоказания и побочные явления
Даже при соблюдении всех правил безопасного использования, препарат не рекомендуется применять:
- для маленьких детей;
- при очень сухой или чувствительной коже;
- во время вынашивания плода и грудного вскармливания;
- при непереносимости этилового спирта и муравьиной кислоты.
Имеет противопоказания
Нельзя применять средство для стерилизации места инъекции и на открытые раневые поверхности. Им не следует лечить отит, используя в виде капель, принимать внутрь и капать на слизистые оболочки.Спиртовым раствором не стоит разогревать ноги и руки при переохлаждении. У данного вещества есть также побочные эффекты, при местном применении у человека возникает:
- сыпь;
- зуд;
- жжение;
- краснота.
Внимание! Препарат не рекомендуется наносить на здоровую кожу, а если его необходимо использовать для лечения проблем с гнойничковыми высыпаниями, предварительно нужно посоветоваться с врачом. Противопоказано применять раствор одновременно с отшелушивающими или абразивными средствами.
Опасность муравьиной кислоты
Крайне опасно применять средство как суррогат алкоголя внутрь. Ведь что такое муравьиный спирт? Это сочетание кислоты, которая является токсическим продуктом, и медицинского спирта высокой концентрации (от 70 до 90 градусов). Поэтому, если алкоголики пьют это средство, такое применение не по назначению может быть чревато тяжелым отравлением и даже летальным исходом.
При соприкосновении со слизистой спирта высокой концентрации и муравьиной кислоты получается сильнейший ожог. По этой причине воспаление желудка и других органов пищеварения, которое алкоголик провоцирует, выпивая средство, очень плохо поддается лечению.
При склонности к аллергии внутреннее использование препарата приведет не только к поражению слизистой оболочки, но и вызовет отек Квинке или анафилактический шок.
Как действует муравьиная кислота при приеме внутрь?
Разберем более подробно, что будет, если выпить муравьиный спирт. Даже самой мизерной дозе это приведет к гибели клеток полости рта, пищевода и желудка. В результате развивается гастрит, появляется язва. Раздражение и интоксикация обычно сопровождаются следующими симптомами:
- выступает обильный холодный пот;
- учащается сердцебиение, пульс становится аритмичным;
- появляется тошнота и многократная рвота;
- возникает острая боль в области живота;
- развивается сильное и длительное расстройство кишечника;
- нарушается процесс мочеиспускания, оно становится непроизвольным.

Нельзя употреблять внутрь
Внимание! До того как пить муравьиный спирт, следует уяснить себе, что приятного состояния опьянения не наступит. Возникнут проблемы, которые потребуют врачебного вмешательства. А если доза будет слишком большой, то наступит кома и смерть. Даже если человека удается спасти, его здоровью наносится непоправимый урон.
Как помочь пострадавшему?
Если кто-то из близких или знакомых все-таки случайно принял внутрь муравьиный спирт, то следует немедленно вызвать скорую помощь. Но до приезда врача следует начать оказание первой помощи:
- Промыть желудок. Следует заставить пострадавшего принять большое количество теплой воды, можно подсоленной. А потом вызывать рвотный рефлекс. Это поможет убрать часть ядовитого раствора, который не всосался в кровь.
- Положить человека на ровную плотную поверхность, лучше набок. Это поможет ему предупредить обтурацию рвотными массами дыхательных путей.
- Давать пить много жидкости. Лучше всего чистую воду.
- Предупредить ожог глаз в том случае, если средство попало на роговицу, следует промыванием теплой водой.
Использовать после отравления муравьиным спиртом какие-либо препараты не нужно. Это может дать непредсказуемую реакцию и ухудшить состояние больного. Не поможет в данном случае и прием сорбентов, они обычно бессильны, когда речь идет об использовании любого суррогата спирта.
Заключение
Исходя из всего вышесказанного, становиться понятно, что ни в коем случае не следует использовать муравьиный спирт и любой другой вид спиртовых настоев, не предназначенных для внутреннего применения. В результате таких действий наступают необратимые изменения, которые сделают человека инвалидом, или приведут к гибели.
Источник: https://zdorovnet.ru/preparaty/primenenie-muravinogo-spirta.html
Муравьиная кислота
Муравьиная кислота (систематическое наименование: метановая кислота) HCOOH — органическое соединение, первый представитель в ряду насыщенных одноосновных карбоновых кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236.
Своё название муравьиная кислота получила потому, что впервые она была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв. В природе также обнаружена у пчёл, в крапиве, хвое. Соли и анионы муравьиной кислоты называются формиатами.
Физические и химические свойства
При стандартных условиях муравьиная кислота представляет собой резко пахнущую бесцветную жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
Константа диссоциации: 1,772⋅10−4.
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2 + 8H2O
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается на воду и моноксид углерода:
HCOOH → H2O + CO
Муравьиная кислота реагирует с аммиачным раствором оксида серебра:
HCOOH + 2[Ag(NH3)2]OH → 2Ag + (NH4)2CO3 + 2NH3 + H2O
Взаимодействие муравьиной кислоты с гидроксидом меди:
HCOOH + 2Cu(OH)2 → CO2 + Cu2O + 3H2O
Проявляет все свойства одноосновных карбоновых кислот:
Образует формиаты с металлами:
HCOOH + KOH → HCOOK + H2O 2HCOOH + CaCO3 → (HCOO)2Ca + H2O + CO2
Со спиртами образует сложные эфиры:
HCOOH + CH3OH → HCOOCH3 + H2O
Получение
- Побочный продукт в производстве уксусной кислоты жидкофазным окислением бутана.
- Окисление метанола: CH3OH → HCHO → HCOOH
- Реакцией монооксида углерода с гидроксидом натрия:NaOH + CO → HCOONa → (+H2SO4, −Na2SO4) HCOOHЭто основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6—0,8 МПа пропускают через нагретый до 120—130 °C гидроксид натрия; на второй стадии проводят обработку формиата натрия серной кислотой и вакуумную перегонку продукта.
- Разложением глицериновых эфиров щавелевой кислоты. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя углекислый газ, при этом образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и глицерин.
Безопасность

Опасность муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10 % обладает раздражающим эффектом, больше 10 % — разъедающим.
При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма.
Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Контакт с концентрированными парами муравьиной кислоты может привести к повреждению глаз и дыхательных путей.
Случайное попадание внутрь даже разбавленных растворов вызывает явления тяжёлого некротического гастроэнтерита.
Муравьиная кислота быстро метаболизируется и выводится организмом. Тем не менее, муравьиная кислота и формальдегид, образующиеся при отравлении метанолом, вызывают повреждение зрительного нерва и ведут к слепоте.
По данным ПДК в воздухе рабочей зоны равна 1 мг/м3 (максимально-разовая). Может попадать в организм при вдыхании. Порог восприятия запаха может достигать, например, 453 мг/м3.
можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию муравьиной кислоты на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от неё следует использовать более эффективные изменение технологии и средства коллективной защиты.

В природе муравьиная кислота обнаружена в хвое, крапиве, фруктах, едких выделениях медуз, пчёл и муравьёв. Муравьиная кислота впервые была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв, чем и объясняется её название.
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении бутана и лёгкой бензиновой фракции в производстве уксусной кислоты.
Муравьиную кислоту получают также гидролизом формамида (~35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование метанола, взаимодействие метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида 75%-ной H2SO4. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию СО в присутствии щёлочи (кислоту выделяют из соли действием H2SO4), дегидрогенизацию CH3OH в паровой фазе в присутствии катализаторов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения).
Применение
В основном, муравьиную кислоту используют как консервирующий и антибактериальный агент при заготовке корма.
Муравьиная кислота замедляет процессы гниения и распада, поэтому сено и силос, обработанные муравьиной кислотой, дольше сохраняются.
Муравьиная кислота также используется в протравном крашении шерсти, для борьбы с паразитами в пчеловодстве, как растворитель в некоторых химических реакциях.
В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5, для получения монооксида углерода.
В медицине используется для приготовления растворов пермуравьиной кислоты («первомур», или рецептура «С-4» (смесь перекиси водорода и муравьиной кислоты)). Первомур используют в хирургии в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования.
Производные муравьиной кислоты
Соли и эфиры муравьиной кислоты называют формиатами.
Источник: https://chem.ru/muravinaja-kislota.html
Муравьиная кислота

- Муравьиная (иначе – метановая) кислота представляет собой неокрашенную жидкость, растворимую в бензоле, ацетоне, глицерине и толуоле.
- В качестве пищевой добавки муравьиная кислота зарегистрирована как E236.
- Применение муравьиная кислота получила в:
- Медицине, как наружное обезболивающее средство;
- Сельском хозяйстве, где ее широко используют для заготовки кормов. Она замедляет протекание процессов распада и гниения, что способствует более длительному сохранению сена и силоса;
- Химической промышленности в качестве растворителя;
- Текстильной промышленности для окрашивания шерсти;
- Пищевой промышленности в качестве консерванта;
- Пчеловодстве, как средство для борьбы с паразитами.
Химическая компания «Синтез» является официальным дистрибьютором компании BASF по поставке Муравьиной кислоты в Россию.
Свойства муравьиной кислоты
Свойства муравьиной кислоты зависят от ее концентрации. Так, согласно принятой Европейским союзом классификации, безопасной и оказывающей раздражающий эффект считается муравьиная кислота концентрацией до 10%, большая концентрация обладает уже разъедающим эффектом.
Таким образом, концентрированная муравьиная кислота при попадании на кожу может вызывать сильные ожоги и боль.
Также небезопасен контакт с ее концентрированными парами, поскольку муравьиная кислота при вдыхании может привести к повреждению дыхательных путей, а также глаз. При случайном попадании внутрь она приводит к развитию тяжелого некротического гастроэнтерита.
Еще одним свойством муравьиной кислоты является ее способность быстро выводиться организмом, не накапливаясь в нем.
Получение муравьиной кислоты
Химическая формула муравьиной кислоты – HCOOH.
Впервые выделить ее из рыжих лесных муравьев (брюшных желез) удалось английскому натуралисту Джону Рэйему в 17 веке. Кроме этих насекомых, от которых она и получила свое название, муравьиная кислота в природе находится в некоторых растениях (крапива, хвоя), фруктах, а также в едких выделениях пчел.
- Искусственно синтезирована муравьиная кислота была только в 19 веке французским ученым Джозефом Гей-Люссаком.
- Самым распространенным методом получения муравьиной кислоты является ее выделение в качестве побочного продукта при производстве уксусной кислоты, которое происходит жидкофазным окислением бутана.
- Кроме того, получение муравьиной кислоты возможно:
- В результате химической реакции окисления метанола;
- Методом разложения глицериновых эфиров щавелевой кислоты.
Применение муравьиной кислоты в пищевой промышленности
В пищевой промышленности муравьиная кислота (Е236) в основном используется в качестве добавки при изготовлении консервированных овощей. Она замедляет развитие патогенной среды и плесеней в консервированных и квашеных овощах.
Также ее используют в производстве безалкогольных напитков, в составе рыбных маринадов и других кислых рыбопродуктов.
Кроме того, ее часто применяют для дезинфекции бочек для вина и пива.
Применение муравьиной кислоты в медицине

Современная фармакологическая промышленность выпускает муравьиную кислоту в виде 1,4% спиртового раствора для наружного применения (во флаконах объемом 50 или 100 мл). Этот наружный препарат относится к группе лекарств с раздражающим и анальгезирующим свойствами.
Муравьиная кислота при наружном применении оказывает отвлекающее действие, а также улучшает питание тканей и вызывает расширение сосудов.
Показанием к применению муравьиной кислоты в виде спиртового раствора является:
- Невралгия;
- Миозит;
- Артралгия;
- Миалгия;
- Неспецифические моно- и полиартриты.
Противопоказаниями к применению муравьиной кислоты является гиперчувствительность к соединению и повреждение кожи в месте нанесения.
Помимо спиртового раствора эту кислоту используют для приготовления мазей, например, «Муравьита». Ее применяют при тех же показаниях, что и муравьиный спирт, а также при лечении:
- Различных травм, синяков, переломов, ушибов;
- Варикозного расширения вен;
- Грибковых заболеваний;
- Прыщей, угрей, а также как средство для очистки кожи.
В народной медицине благодаря своим болеутоляющим свойствам муравьиная кислота использовалась издавна для лечения:
- Ревматизма;
- Подагры;
- Радикулита.
Ее использовали в составах, стимулирующих рост волос, и как средство от педикулеза.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Источник: https://www.neboleem.net/muravinaja-kislota.php
Муравьиная кислота: физические и химические свойства, как получается и где применяется

HCOOH – рациональная формула муравьиной кислоты, насыщенной односоставной карбоновой кислоты, входящая в так называемую карбоксильную группу. В настоящее время муравьиная кислота имеет систематическое название метановой, является органическим соединением, зарегистрированным в качестве пищевой добавки Е236.
История появления муравьиной кислоты
Открытие
В 1670 году натуралист, член Лондонского королевского общества Джон Рей провел эксперимент, результатом которого стало появление нового водного раствора химического соединения, проявляющего типичные свойства кислот. Рей путем кипячения воды в сосуде с помещенными в него рыжими лесными муравьями, произвел процесс перегонки паром.
Сейчас процесс заменен синтезом муравьиной кислоты из угарного газа и воды. Позже энтомологи подтвердят, что в теле муравьев в брюшной полости находятся ядовитые железы, которые вырабатывают кислоту как средство защиты от нападения.
Рыжие лесные муравьи оказались не единственными носителями кислоты данного вида. Муравьиная кислота, хоть и в меньших объемах, обнаружена в пчелином яде, гусеницах шелкопряда, сосновой хвое, крапиве, фруктах, а также выделениях животных и даже человека. Соли и эфиры кислоты, формиаты, также получили название от латинского formica — муравей.
Получение
С XIX века муравьиную кислоту получают химическим путем в виде натриевой соли. Большее количество муравьиной кислоты получается как побочный продукт при жидкофазном окислении бутана и бензиновой фракции при производстве другой кислоты – уксусной.
Около 35% мирового производства получают гидролизом формамида. Основным промышленным способом получения муравьиной кислоты является реакция монооксида углерода с гидроксидом натрия: NaOH + CO → HCOONa → (+H2SO4, −Na2SO4) HCOOH. Процесс разделен на две стадии:
- 1 стадия. Монооксид углерода пропускают под давлением 0.6 – 0.8 МПа через 120 – 130 °C гидроксид натрия.
- 2 стадия. Обработка формиата натрия серной кислотой и перегонка продукта вакуумом.
Еще одним способом является разложение глицериновых эфиров щавелевой кислоты. При нагревании щавелевой кислоты и безводного глицерина путем отгона воды образуют щавелевые эфиры. Разлагая щавелевые эфиры методом нагревания, получают углекислый газ и образования муравьиных эфиров. Последние методом разложения водой образуют глицерин и муравьиную кислоту.
Физические и химические свойства муравьиной кислоты
Одна из самых простых карбоновых кислот, муравьиная одновременно является самой сильной. При попадании на кожу вызывает ожог, жжение, растворение. Растворяет капрон, нейлон и прочие полимеры.
Муравьиная кислота представляет собой бесцветную жидкость с едким и резким запахом. Смешивается с водой, этанолом, диэтиловым эфиром. Растворяется в ацетоне, бензоле, глицерине и толуоле.
Обладает свойствами кислот и альдегида, в молекулярной формуле есть кислотная часть (CO-OH) и атом углерода (H-CO).
Такая особенность привела к особенной реакции восстанавливать серебро, что характерно для альдегидов, но не для кислот.
Важная особенность муравьиной кислоты является изготовление «тяжелых» жидкостей. Применяемые геологами, минеролагами, геммологами, помогают при идентификации и разделении минералов по свойствам их плотности.
При растворении металлического таллия в 90% растворе муравьиной кислоты, получают формиат таллия. При растворении таких веществ и их солей получают раствор в котором плавают тяжелый шпат, корунд, малахит.
Муравьиная кислота известна своими бактерицидными свойствами. Используется при дезинфекции продовольственной тары. Кислота используется как пищевой концентрат. Слабые растворы применяют в медицине.
Применение
Основное применение муравьиной кислота – консервант, это обусловлено высоким бактерицидными и антисептическими свойствами. Останавливающая свойства гнилостности муравьиная кислота (пищевой вариант E236) широко применяется во многих областях, среди которых:
- пищевая:
- консервация соков, овощей
- очистка от примесей сахаров при производстве меда, маринадов
- дезинфекция винных и пивных емкостей
- медицинская:
- анальгетическое и противовоспалительное средство
- лечение грибковых заболеваний, ушибов, растяжений, варикозного расширения вен
- противотуберкулерных растворах
- анестетиков
- косметологическая:
- очищающие средства при лечении угревой сыпи
- стимуляция роста волос
- средства для соляриев и загара
- бытовая:
- чистящие средства против ржавчины и известкового налета
- сельское хозяйство:
- заготовка зимних кормов
- борьба с клещами при пчеловодстве
Более подробно о сферах применения муравьиной кислоты можно узнать в публикации «Применение муравьиной кислоты в различных отраслях».
Безопасность и допустимость использования
Следует обратить внимание на то, что применение муравьиной кислоты в продуктах питания разрешено России, Беларуси, а также странах ЕАЭС. В странах Евросоюза разрешено применять Е236 в косметических средствах, а в США в составе синтетических ароматизаторов для продуктов питания.
Неразбавленная муравьиная кислота вызывает сильные химические ожоги, 10% и более обладает разъедающим эффектом, менее 10% — раздражающим.
Основная отличительная особенность метановой кислоты — это отсутствие производств в России. Тем не менее, муравьиную кислоту всегда можно купить в ООО «Эверест». Узнать подробнее можно здесь.
Источник: https://hothim.ru/articles/muravinaya-kislota
Муравьиная Кислота
Метановая к-та.
Химические свойства
Химическая формула муравьиной кислоты: HCOOH. Это один из первых представителей одноосновных карбоновых к-т. Вещество впервые выделили в 1670 году из лесного (рыжего) муравья. В естественной среде содержится в яде пчел, крапивы и иголках хвойных деревьев, выделениях медуз, фруктах.
Физические свойства
Рацемическая формула метановой кислоты: CH2O2.
Вещество при нормальных условиях имеет вид бесцветной жидкости, которая хорошо растворима в глицерине, ацетоне, толуоле и бензоле.
Молярная масса = 46,02 грамм на моль. Эфиры (этиловый эфир и метиловый эфир) и соли метановой к-ты получили название формиаты.
Химические свойства
По структурной формуле Муравьиной кислоты можно сделать выводы и ее химических свойствах. Муравьиная кислота способна проявлять свойства к-т и некоторые из свойств альдегидов (восстановительные реакции).
При окислении Муравьиной кислоты, например, перманганатом калия, активно выделяется углекислый газ. Вещество применяют в качестве консервирующего агента (код Е236).
Муравьиная кислота взаимодействует с уксусной кислотой (концентрированной) и разлагается на моноксид углерода и обычную воду с выделением тепла. Химическое соединение реагирует с гидроксидом натрия.
Вещество не взаимодействует с соляной кислотой, серебром, натрия сульфатом и так далее.
Получение муравьиной кислоты
Вещество образуется в виде побочного продукта при оксислении бутана и производстве уксусной к-ты.
Также ее можно получить путем гидролиза формамида и метилформиата (с избытком воды); при гидратации СО в присутствии какой-либо щелочи.
Качественной реакцией для обнаружения метановой кислоты может служить реакция на альгедигы. В роли окислителя может выступать аммиачный р-р оксида серебра и Си(ОН)2. Используется реакция серебряного зеркала.
Применение муравьиной кислоты
Вещество используют в качестве антибактериального агента и консерванта при заготовке корма на длительное хранение, средство значительно замедляет процессы распада и гниения.
Химическое соединение применяют в процессе покраски шерсти; в качестве инсектицида в пчеловодстве; при проведении некоторых химических реакций (выступает в роли растворителя). В пищевой промышленности средство имеет маркировку E236.
В медицине кислоту применяют в комбинации с перекисью водорода («первомур» или пермуравьиная кислота) в качестве антисептика, для лечения заболеваний суставов.
Фармакологическое действие
Местноанестезирующее, отвлекающее, противовоспалительное, местнораздражающее, улучшающее тканевой метаболизм.
Фармакодинамика и фармакокинетика
Метановая кислота при нанесении на поверхность эпидермиса раздражает нервные окончания кожи, мышечной ткани, активирует специфические рефлекторные реакции, стимулирует выработку нейропептидов и энкефалинов. При этом снижается болевая чувствительность и повышается проницаемость сосудов. Вещество стимулирует процессы либерации кининов и гистамина, расширяет сосуды, стимулирует иммунологические процессы.
Показания к применению
Лекарственное средство применяют для обработки инструментов и оборудования перед операцией. Вещество используют местно в составе растворов для лечения ревматических болей, миозита, радикулита, невралгии, периартритов, поли- и моноартритов.
Противопоказания
Средство нельзя использовать при наличии аллергии, дерматита в месте нанесения, экземы, если есть раны и ссадины на коже.
Побочные действия
Метановая кислота может вызвать местные реакции, зуд, покраснение, раздражение на коже, шелушение кожи, аллергию.
Инструкция по применению (Способ и дозировка)
Лекарственное средство используют местно, в комбинации с другими веществами. Препарат наносят на пораженный участок и осторожно растирают.
Передозировка
Нет данных о передозировке препаратом.
Взаимодействие
Лекарство совместимо с прочими средствами.
Особые указания
Вещество нельзя принимать внутрь или наносить на слизистую оболочку, избегать попадания в глаза.
Препараты, в которых содержится (Аналоги)
Муравьиный спирт, Раствор муравьиной кислоты.
Отзывы
При соблюдении рекомендаций и врача, способа приема лекарства и дозировки, оно дает стойкий положительный эффект при невралгии, артрите и других заболеваниях опорно-двигательной системы. Сообщений о каких-либо побочных реакциях не обнаружено.
Цена, где купить
Купить Муравьиную кислоту в аптеке можно в составе муравьиного спирта, по 15 рублей за 50 мл флакон.
Источник: https://medside.ru/muravinaya-kislota
Химические свойства карбоновых кислот
| Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН. |
- Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
- Строение, изомерия и гомологический ряд карбоновых кислот
- Химические свойства карбоновых кислот
- Способы получения карбоновых кислот
- .
Для карбоновых кислот характерны следующие свойства:
|
1. Кислотные свойства
| Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н. |
| Карбоновые кислоты – кислоты средней силы.В водном растворе карбоновые кислоты частично диссоциируют на ионы: R–COOH ⇆ R-COO– + H+ |
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
| Например, уксусная кислота растворяет осадок гидроксида меди (II) |
Видеоопыт взаимодействия уксусной кислоты с гидроксидом натрия можно посмотреть здесь.
| Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония |
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
| Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода. |
Видеоопыт взаимодействия уксусной кислоты с магнием и цинком можно посмотреть здесь.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
| Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды. |
| Например, уксусная кислота реагирует с оксидом меди (II) |
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Видеоопыт взаимодействия уксусной кислоты с оксидом меди (II) можно посмотреть здесь.
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
| Например, уксусная кислота растворяет карбонат кальция |
| Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа |
2. Реакции замещения группы ОН
| Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов. |
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
| Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты |
2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:
При нагревании карбоновые соли аммония разлагаются на амид и воду:
2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
| Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты |
3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
| Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу. |
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
| Например, уксусная кислота реагирует с бромом в присутствии красного фосфора |
4. Свойства муравьиной кислоты
| Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов. |
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
- При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
- Муравьиная кислота окисляется перманганатом калия до углекислого газа:
- 5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
- Видеоопыт взаимодействия муравьиной кислоты с перманганатом калия можно посмотреть здесь.
4.4. Разложение при нагревании
- При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:
- Видеоопыт разложения муравьиной кислоты можно посмотреть здесь
5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:
4.2. Реакции замещения в бензольном кольце
| Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом. |
6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:
6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:
7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:
- К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:
6.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:
Источник: https://chemege.ru/ximicheskie-svojstva-karb-kisloty/




