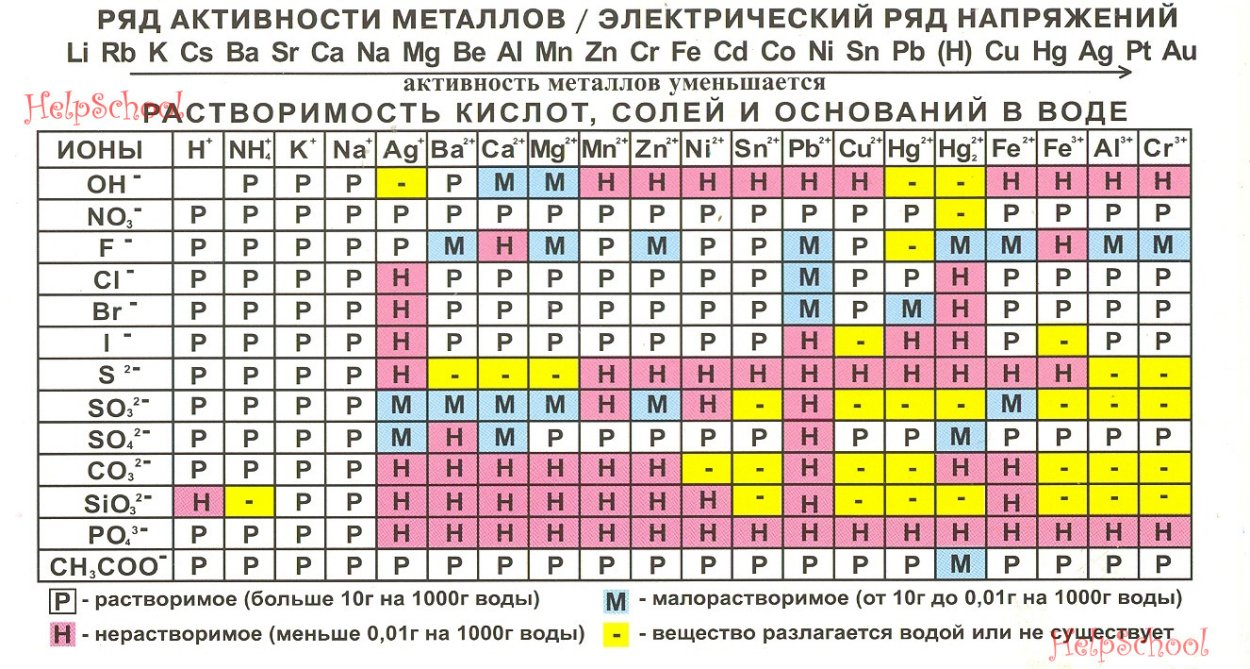
Алмаз — это один из самых прекрасных и дорогих минералов на планете, завоевавший множество поклонников. Приоритетным свойством камня выступает его твердость, которая является самым высоким показателем среди всех минералов.

Состав, формула и свойства алмазов
Поэтому многим интересно, как образуется камень, какая формула алмаза и можно ли его вырастить в лаборатории. Ученые по-прежнему после столетия опытов не могут ответить на все вопросы с точностью, поскольку в некоторых ситуациях камень ведет себя аномально.
Формула вещества

Состоит алмаз полностью из углерода. Этого элемента содержится около 0,15% в Земной коре. Атомный номер вещества — 6, что говорит о количестве протонов в ядре. Соответственно, у алмазов, которые полностью состоят из углерода, то есть являются аллотропной формой этого вещества, атомный номер такой же.

Такое понятие, как форма аллотропной модификации, означает, что из простого вещества, например, углерода, могут формироваться другие простые вещества, которые будут отличаться между собой свойствами и строением атомов.
То есть содержание одно, а форма и вид — абсолютно разные, взять хотя бы противоположности: графит и алмаз. При этом углерод — один из немногих веществ, которое имеет несколько форм модификаций.
Выделяют такие вещества, которые состоят только из углерода:
- алмаз;
- графит;
- карбин;
- лонсдейлит;
- фуллерены;
- углеродные нанотрубки для изготовления микроволокон;
- графен;
- уголь, сажа.
Интересным вопросом для ученых является вопрос, можно ли превратить одну аллотропную модификацию в другую. Как раз этим они и занимаются по отношению к графиту и другим веществам из этой группы.
Поскольку стоимость алмаза — самая высокая, а цена других модификаций ниже. Пока процесс возможен только лишь в обратную сторону: если алмаз нагреть без воздуха до температуры свыше 500 градусов по Цельсию, то камень взорвется и превратится в графит.
При этом дальнейшее плавление камня показывает аномальные результаты, отличные от других веществ. А вот в обратном направлении реакция не происходит.
Разница между модификациями объясняется строением кристаллической решетки вещества. Химическая формула тут не играет никакой роли. Вся суть заключается в пространственной конфигурации атомов углерода и связи между ними. Так, в строении алмаза решетка имеет кубическое строение.
Связь между атомами — самая прочная, с точки зрения химии, ковалентная. При этом кубическая система использует всего 18 атомов и считается самой плотной формой упаковки этих частиц. Поэтому алмаз и является самым твердым веществом планеты.
В центрах граней тетраэдра также располагаются атомы, связанные между собой ковалентно. А вот если рассматривать тот же графит, то в его кристаллической решетке часть связей ковалентная, а часть дисульфидная, которая имеет свойство разрываться. Вследствие этого электроны могут мигрировать, и вещество получает металлические свойства.
Но это разбор атомных форм углерода, поскольку именно атомы и формируют кристаллическую решетку. А вот недавно ученые обнаружили и молекулярные формы вещества в составе фуллеренов, многогранников из углерода. Сейчас обнаружили новые молекулярные соединения с содержанием углерода — от С60 до С540, над которыми проводятся исследования.
На основе формулы, а также конфигурации атомов, ученые пытаются воссоздать картину в лабораторных условиях. В природе алмазы находят в кимберлитовых и лампроитовых трубках, а также на россыпях. Камни формируются миллионы лет в определенных условиях с участием магматических пород, сейсмоактивности, а также под действием высоких температур.
Существует и версия о занесении алмаза вместе с метеоритами, поскольку углерода достаточно много в космическом пространстве. А также одну из его модификаций — лосдейлит — ученые обнаружили в составе метеоритов.
На сегодняшний день алмазы изготавливают такими способами:
- Под давлением и высокой температурой в специальных машинах. Ученые добиваются от графита образования новых ковалентных связей. Такой тип камней называют HPHT.
- Пленочный способ происходит также с участием графита, осаждение которого происходит под действием паров метана.
- Производство камней вследствие взрывного синтеза.
Даже несмотря на то, что все знают формулу бриллианта, ну или его не ограненного вещества (алмаза), никто из ученых не смог с точностью воспроизвести камень с таким же строением кристаллической решетки, как это сделала природа. Поэтому стоимость камня держится на высоком уровне, а добыча из недр Земли не прекращается.
Формула алмаза

- Химическая формула –
- Молярная масса равна г/моль.
Физические свойства – это одно из самых твёрдых веществ с плотностью 3,47—3,55 г/см, обычно бесцветный, но может иметь различные цвета, прозрачный, хрупкий, блестящий.
Плохо проводит электрический ток. Не плавится, сублимируется при 3506,85°С, устойчив при нагревании в отсутствие кислорода.
Кристаллическая решетка алмаза гранецентрированная кубическая (а = 0,357 нм, z = 4). Атомы углерода в алмазе имеют -гибридизацию. Каждый атом С в структуре алмаза находится в центре тетраэдра, вершинами которого служат четыре соседних атома.
На рисунке ниже показана элементарная ячейка алмаза:
Химические свойства алмаза
- Так как алмаз очень твёрдое вещество, то он является достаточно инертным, поэтому его основная реакция – это горение в кислороде при высокой температуре:

- Источники:
https://okaratah.com/dragocennye/almaz/formula-almaza.html
Источник: https://vseprokamni.ru/interesno/formula-almaza-v-ximii.html
Химическая формула и молярная масса алмаза
Невероятно дорогой минерал алмаз, что превращается в удивительно сверкающие бриллианты при огранке, обладает особыми физическими и химическими свойствами. Ученые долго разгадывали его формулу, а затем и вовсе научились получать камни синтетическим путем.
Физико-механические свойства алмаза

Алмаз – не что иное, как одна из разновидностей углерода, только самая красивая и самая дорогая. В естественных условиях он отличается невероятной стабильностью, в нем не происходит никаких изменений столетиями и тысячелетиями. Зато, если поместить алмаз в среду инертных газов, создать условия вакуума, то он превратится в графит – другую форму углерода. Этот бесцветный минерал – эталон твердости по шкале Мооса. Если сравнивать с кварцем, то плотность алмаза выше в тысячу раз и в 150 раз от корунда. Алмаз невозможно поцарапать каким-либо веществом, кроме другого алмаза. Минералу не страшны даже кислоты, способные растворять металлы.
В расплавленных щелочах алмаз начинает постепенно растворяться.
Формула и структура минерала
С точки зрения химии, формула алмаза помещается в одну букву С, обозначающую углерод. Он обладает кристаллической решеткой, причем, гранецентрированной кубической. Атомы молекул углерода связаны между собой очень прочно, поэтому минерал обладает такой твердостью.
Однако при этом он хрупкий, разрушение (раскалывание) будет идти только по определенным плоскостям. Каждый из углеродных атомов занимает ровно середину тетраэдра, в вершинах которого располагается ближайшая четверка атомов. Именно строго упорядоченная структура обеспечивает самоцвету уникальные свойства.
Атомное расстояние имеет одинаковую периодичность, оно равняется 0,15 нм.
В свое время алмаз считали не чем иным, как кварцем. Только в XVIII веке Лавуазье, сжигая камень, обнаружил, что тот выделяет оксид углерода. В начале XIX века ученые окончательно определили, что алмаз, уголь и графит – химически одно и то же. Сажа и графен – также ближайшие родственники алмаза.
Молярная масса алмаза – 12,01. Вместе с графитом алмаз – лидеры по показателю теплопроводности, у алмаза она даже выше – до 2300 Вт/(м⋅К).
За счет того, что на гранях формируются специфические пленки адсорбированных газообразных веществ, у минерала невероятно низкий коэффициент трения по металлу (в условиях воздуха) – только 0,1.
Окраска

Большинство добываемых алмазов – полностью прозрачные и совершенно бесцветные камни. Однако они могут светиться под воздействием рентгеновских, ультрафиолетовых, катодных лучей голубоватым, синим или зеленым цветом. Минерал отличается сильным блеском. Это обеспечивает дисперсия вместе с высоким показателем преломления и прозрачностью минерала.
Также в природе встречаются цветные алмазы, что бывает очень редко. Причем камень не обязательно должен быть окрашен полностью, он может быть пятнистым, иметь цветными отдельные участки.
Наиболее распространенные оттенки – коричневый и желтый, что возникает из-за дефектов в структуре минерала. Цветные камни – редкое явление, особенно если они крупные.
Так, желтый алмаз под названием «Тиффани» имел вес в 57 г (равный 287 каратам), а уникальный бриллиант зеленого цвета «Дрезденский» весил 8,2 г (41 карат).
Такой необычный цвет камня обусловлен его естественной радиоактивностью. Еще реже находят красные, синие или розовые алмазы.
Встречаются даже черные алмазы, именуемые карбонадо. Некоторые ученые считают, что они образовались на Земле, другие считают их пришельцами из Космоса.
Гигантский черный алмаз весом более 3 тысяч карат был обнаружен на территории Бразилии.
Вес и масса алмаза

Стандартная единица для массы – это грамм, но для алмазов, а также полученных из них бриллиантов применяют другую единицу обозначения – карат. Один карат составляет 0,2 г. Такая единица измерения массы камня была окончательно принята в мире в 1907 году.
Чем объемнее минерал, тем в разы возрастает его цена. Большинство добываемых камней довольно мелкие, порядка 0,1 карата. Алмазы крупнее 5 карат встречаются очень редко, а более 15 карат – историческое событие.
Рекордсменом по весу в алмазном мире считается «Звезда Африки» или «Куллинан». Вес минерала составил практически 3107 карат (относительно граммам – это 621 г). Этот рекорд, установленный в 1905 году, побить так и не удалось.
Из-за природных появлений трещин огранить этот гигант в один бриллиант было нельзя, поэтому его раскололи.
Наличие трещин – это знак, который указывает на низкое качество самоцвета.
Синтезированные алмазы
Алмаз представляет большую ценность как режущий и абразивный элемент ввиду своей исключительной твердости. Но для этих целей природные камни слишком дорогие.
Поэтому еще в XVII веке ученые экспериментировали с минералом, пытались сделать из мелких камней один крупный, исследовали химическую формулу алмаза. Первые экземпляры стали получать синтетическим путем в 1953-1954 годах, а массовое производство искусственных камней стартовало с 1963 года.
При помощи специального «алмазного щупа» – прибора, что замеряет теплопроводность камня, искусственный минерал можно однозначно отличить от природного самоцвета.

Чтобы получить алмаз, как сырье обычно используют графит.
Существуют три технологии получения искусственных минералов:
- Методом взрыва. За счет ударной волны, что формируется в замкнутом металлическом контейнере (трубке), получается высокая температура и давление, графит трансформируется в алмаз.
- Химический способ. В этом случае происходит осаждение графита в виде алмазов за счет того, что процесс происходит в среде метана. Этот метод также называют CVD.
- При методе HPTH создают условия, близкие к природным, в которых формируются кристаллы алмаза. Два самых важных фактора для этого – высокое давление и температура. В роли центра кристаллизации используют мельчайшие алмазы, полученные другими технологиями, которые вырастают в более крупные камни.
Искусственные алмазы для изготовления ювелирных украшений не используют, хотя они полностью повторяют химический состав природных камней.
Примеси в составе алмаза
Синтетические минералы находят применение в ядерной промышленности, для изготовления часовых механизмов и компьютерной техники. Для некоторых случаев требуются особые свойства алмаза. Их можно придать камню, если вводить определенные добавки (примеси). Это может быть бор или фосфор.
Алмаз в таблице Менделеева является углеродом.

Даже натуральные алмазы включают микроколичества алюминия, кремния, азота, бора, кальция или магния. Также в роли примесей встречается титан, марганец или железо, которое обеспечивает желтоватый отлив окрашенных алмазов. За счет присутствия примеси бора камень приобретает голубой тон. Основная «добавка» в составе природных камней – это азот.
Для ювелирных целей используют лишь те самоцветы, которые состоят не более чем из 5% примесей, причем, на долю одного вещества не должно выпадать более 2%. Если количество посторонних соединений, кроме углерода, выше, то из драгоценного камня он сразу переходит в технический.
Преобразить промышленный алмаз можно с помощью молекулярного преобразователя.
Драгоценные камни всегда были востребованы. Природные минералы пользуются популярностью среди ювелиров, а искусственно созданные «работают» во многих отраслях промышленности. У алмазов нет конкурентов по твердости и многим другим характеристикам. Это всего лишь углерод, но особой структуры.
Источник: https://velestone.ru/ukrasheniya/formula-almaza/
Относительная молекулярная масса алмаза
Это объясняется тем, что состав камня почти на 100% состоит из углерода. Но остальных элементов настолько мало, что в формуле они не учитываются.
Вообще, в природе углерода не так уж много – всего 0,15% от общего числа элементов. Порядковый номер углерода в таблице 6 (то есть он имеет 6 протонов внутри ядра).
Это означает, что алмаз имеет тот же порядковый номер (если еще раз взглянуть на его формулу).
Ниже приведены краткие характеристики минерала, многие из которых зависят от исходной химической формулы.
- Алмаз имеет наивысочайшую твердость, в среднем оцениваемую как 3,5 г/см.
- Чистый алмаз является прозрачным, но часто имеет цвета и оттенки (редкие цвета ценятся выше).
- Очень блестящий благодаря показателям дисперсии и преломления.
- При всей твердости очень хрупкий.
- Очень плохо проводит электрический ток.
- Пока удается превращать в алмаз только графит, другие аллотропные модификации углерода этому не поддаются. Но обратной реакции добиться проще (превращение минерала обратно в графит), хоть это и происходит при куда более высоких температурах.
- Химическая формула не оказывает влияния на значительную разницу в свойствах разновидностей углеродных модификаций. Это обусловливается только разницей в строении кристаллических решеток веществ.
- «Упакован» минерал очень плотно, имеет всего 18 атомов.
Происхождение
Предполагается, что на создание алмаза уходит огромное количество времени, миллионы лет, также большое давление и температура. Но речь идет о природных условиях.
Ученые не исключают вероятность появления камня из-за пределов земной орбиты. Предположение строится на основании большого количества камня в окружающем нас космическом пространстве. При этом доля самого углерода на Земле не высока.
Эта гипотеза подтверждается еще и обнаруживаемыми разновидностями алмаза в космических метеоритах (например, лонсдейлит).
- Химическая формула –
- Молярная масса равна г/моль.
- Физические свойства – это одно из самых твёрдых веществ с плотностью 3,47—3,55 г/см, обычно бесцветный, но может иметь различные цвета, прозрачный, хрупкий, блестящий.
Плохо проводит электрический ток. Не плавится, сублимируется при , устойчив при нагревании в отсутствие кислорода.

Кристаллическая решетка алмаза гранецентрированная кубическая (а = 0,357 нм, z = 4). Атомы углерода в алмазе имеют -гибридизацию. Каждый атом С в структуре алмаза находится в центре тетраэдра, вершинами которого служат четыре соседних атома.
Химические свойства
- Алмазу присуща инертность в силу своей твердости. В связи с этим реакция горения для камня является основной:
2C O2 = 2CO
C O2 = CO2
- Все атомы камня расположены наикратчайшим друг от друга образом. То есть каждый атом углерода находится в середине тетраэдра, а остальные атомы располагаются по вершинам.
- Молярная масса составляет порядка 12 г/моль.
Предлагаем ознакомиться Почему золото не всегда желтое?
На видео представлена структура алмаза в наиболее удобной модели. Тут же вы можете узнать о некоторых свойствах камня.
Применение камня
Камень широко используется в ювелирном деле. Но помимо этого он находит свое применение в электронике, оптике и даже строительстве. С помощью него создают специализированные шкурки, им покрывают сверла, проверяют металл на прочность в установках с алмазными наконечниками.
Алмаз используется в химических опытах в качестве надежной защиты от очень едких реактивов вроде плавиковой кислоты. В хирургии без минерала также не обойтись, ведь он обеспечивает точность и миниатюрность надрезов. Алмазные скальпели – настоящая находка для врачей.
Получение минерала
Сейчас существует множество способов получения камня, так как для производства это выгоднее, чем использовать природные алмазы. Стоимость таких камней также значительно ниже.
Хотя и свойства природных камней куда выше и лучше, из-за чего их добыча не прекращается несмотря на большое количество добротных аналогов, в том числе имеющих схожий состав, но алмазами не являющихся: фуллерены, лонсдейлит, графит, карбид и некоторые другие.
Также в производство отправляются камни с высоким содержанием примесей, которые в ювелирном деле не пригодятся. Таких включений должно быть более 5% в целом и более 2% одного конкретного вещества (им может оказаться кальций, азот, бор и некоторые другие). В этом случае внешний вид минерала сильно видоизменяется и никаким образом это не исправить.
Исследования алмазов и эксперименты с ними продолжаются, поскольку камень очень перспективен с точки зрения своих свойств. Ученые и исследователи не оставляют попыток найти и более выгодные способы создания искусственных камней.

Таким образом алмаз благодаря своим формуле и строению обладает большим количеством полезных свойств, присущих в таких диапазонах только ему. Заходите на ресурс почаще и узнаете еще много нового о камнях и минералах.
Команда ЛюбиКамни
- Так как алмаз очень твёрдое вещество, то он является достаточно инертным, поэтому его основная реакция – это горение в кислороде при высокой температуре:
Алмаз является природным ископаемым, хотя его можно получить и искусственно. В промышленности алмазы получают из графита при высоких температуре и давлении.
Применение
Алмаз используется для создания ювелирных украшений, для изготовления ножей, свёрл, резцов, применяется как абразив, используется в микроэлектронике.
Примеры решения задач
Аллотропные модификации
Алмаз представляет собой огромную молекулу углерода. Кроме алмаза, из углерода состоят и другие вещества, такие как:
- графит;
- лонсдейлит;
- сажа, уголь;
- углеродные нанотрубки;
- фуллерены.
Но все эти материалы имеют разный внешний вид и разные свойства. Все это объясняется существованием аллотропных модификаций. Это означает, что атомы углерода располагаются в пространстве и связываются между собой по-разному. Конфигурация атомов вместе с их связями называется кристаллической решеткой. Она у всех веществ разная, а у алмаза заслуживает отдельного внимания.
Начать нужно с того, что в алмазе атомы углерода связаны между собой ковалентными сигма-связями. Это самый прочный вид химической связи. Кроме него, есть еще ионная, металлическая, дисульфидная и водородная связь. Они гораздо слабее ковалентной связи и не присутствуют в структуре алмаза.
Элементарная ячейка алмаза, то есть единица структуры, имеет форму куба. По-научному это называется кубической сингонией.
Предлагаем ознакомиться Черный бриллиант: что это такое и сколько стоит?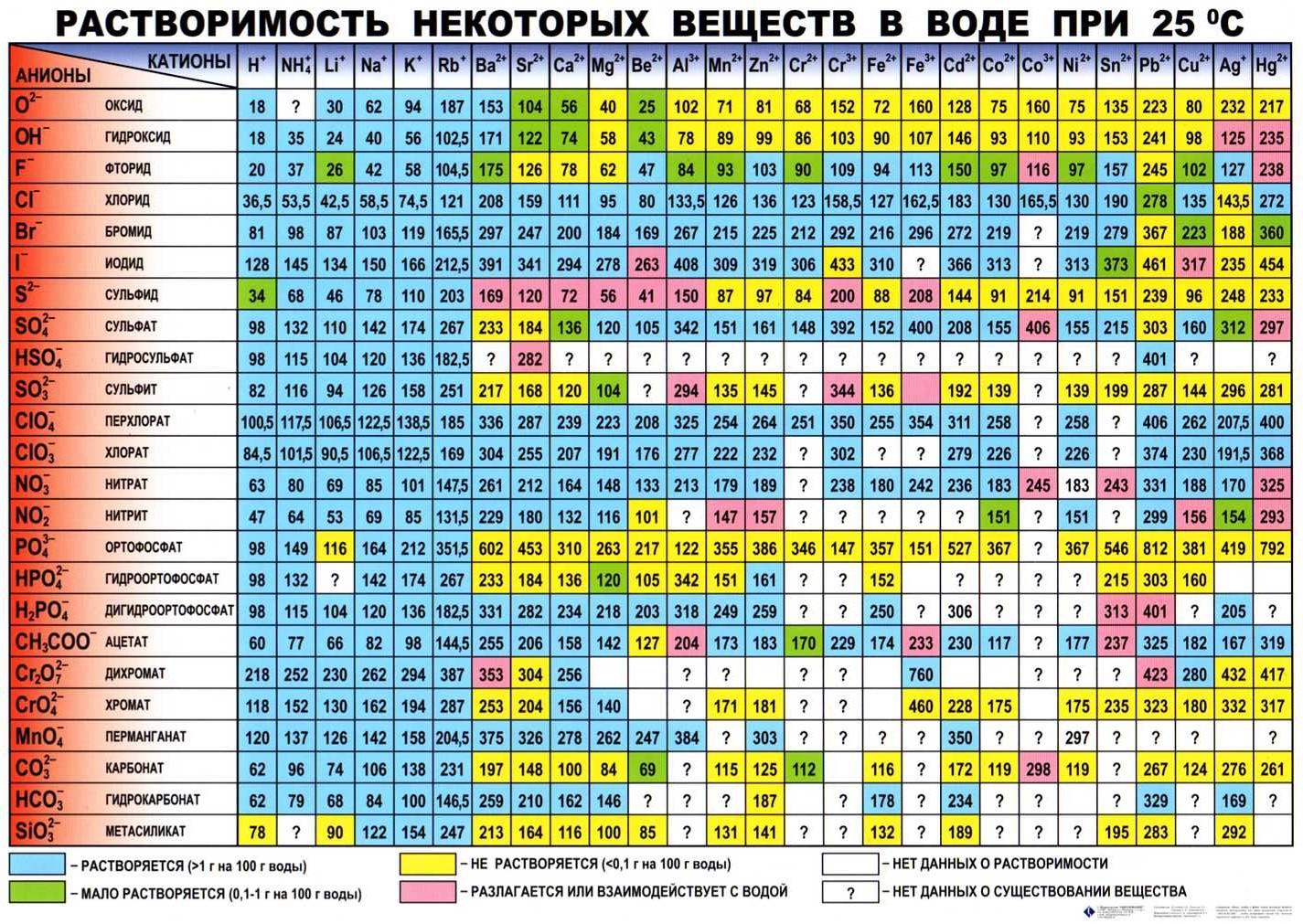
Пространственное расположение атомов и их соединение называются кристаллической решеткой. Именно ее строение и обусловливает такие характеристики, как твердость вещества. Элементарная ячейка структуры алмаза выглядит как куб. То есть алмаз, если пользоваться научной терминологией, кристаллизуется в кубической сингонии.
Вершинами куба выступают атомы углерода. В центре каждой грани также располагается по одному атому, и еще четыре элемента находятся в центре самого куба.
Те атомы углерода, которые находятся в центре грани, являются общими для двух ячеек, а те, что расположены на вершинах куба — общие для восьми ячеек.
Расстояния между атомами симметричные, одинаковые между собой по длине. Связи между элементами — ковалентные-сигма.
Поскольку каждый атом соединен как минимум с четырьмя соседними, то свободных элементов в составе алмаза не остается и камень является отличным диэлектриком.
Твердость алмаза и объясняется такой плотной упаковкой вещества. А вот аллотропные модификации углерода имеют другую пространственную структуру при одинаковом составе.
Кристаллическая решетка алмаза и графита
Например, графит имеет конфигурацию с более слабыми связями в пространстве, ковалентными пи-соединениями. А фуллерены вообще являются молекулами, а не атомами углерода. Их состав и само вещество было открыто относительно недавно — в XIX веке.
Благодаря структуре, алмаз является самым твердым веществом. Это обусловлено именно строением, а не составом камня.
Но не только алмаз имеет такую «упаковку» атомов, хотя только этот минерал обладает большой твердостью. Все вещества из 4 группы имеют похожее с алмазом строение. Но поскольку атомная масса этих элементов больше, чем у алмазов, то расстояние между атомами также больше и связи, соответственно, слабее.
Но не все в природе идеально. Даже алмаз имеет свои изъяны. В составе камня могут встречаться посторонние элементы, которые попали в решетку во время формирования камня. Среди них встречаются такие вещества, как:
- алюминий;
- кальций;
- магний;
- гранит;
- вода;
- газы и углекислота.
Эти вещества нарушают строение алмаза и в идеале их быть в составе не должно. Они встраиваются в кристаллическую решетку и также влияют на твердость камня и его оттенок.
Идеальный по характеристикам камень называется алмазом или бриллиантом чистой воды.
Но если такие примеси есть, они могут повлиять на количество и размер дефектов камня или же образовать самостоятельные включения.
Предлагаем ознакомиться Камень под алмаз
Дефекты структуры могут располагаться как с краю алмаза, так и находиться в центре. Иногда от них можно избавиться с помощью огранки профессионалом-ювелиром. Эта процедура превращает алмаз в бриллиант и раскрывает все его достоинства. В качества дефектов чаще всего выступают микротрещинки, мутные облака или вкрапления других веществ.
Алмазы с большим количеством дефектов отправляются на потребности промышленности, где из них изготавливают алмазную крошку. Идеальная структура и состав могут присутствовать только у искусственных алмазов.
Производство синтетических минералов началось в пятидесятых годах прошлого века. До этого ученые знали о составе бриллианта, но не было необходимой аппаратуры для синтеза минерала. Поскольку условия лабораторного производства алмазов жесткие, требуется не только специальная температура и давление, но еще и затравка в виде камня и графит.

В природе минерал добывают из трубок. Иногда извлекают не весь камень, а только его скол. О том, что в почве осталась еще часть алмаза можно сказать только после изучения структуры под микроскопом. О происхождении алмаза точно неизвестно, существует несколько гипотез о том, почему углерод приобрел такую форму.
Характеристики минерала
Камень имеет такие свойства, которые обусловлены составом минерала:
- Твердость — 10 из 10 по шкале Мооса, и это благодаря кристаллической решетке из углеродов.
- Плотность вещества — 3,5 г/см3. При этом камень очень хрупкий. Он может расколоться при ударе по параллельным граням, что называется спайностью.
- Минерал должен быть прозрачным. Ювелирный камень будет стоить дороже, если в нем меньшее количество примесей. После огранки алмаз играет на свету.
- Если воздействовать на минерал рентген-облучением, то структура алмаза нарушится. Решетка расшатается и станет рыхлой, а сам камень будет излучать свет синего или зеленого оттенка.
- Цвет алмаза может быть от прозрачного до черного оттенка. Дорогими считаются фантазийные камни, имеющие насыщенно-желтый или розоватый окрас.
Алмаз используется не только в ювелирном деле. Камень активно применяется в промышленности из-за своих характеристик. В основном все абразивы и режущие поверхности покрываются твердым веществом — алмазной крошкой. Таким образом качество работ улучшается и затрачивается меньше времени на их выполнение.
Алмазы — минералы, которые имеют простой состав, но сложное строение, поэтому изучение камней и их свойств продолжается по сей день. Алмазы ценятся в ювелирной отрасли, а также в строительстве и медицине.
Источник: https://jewel-spb.ru/otnositelnaya-molekulyarnaya-massa-almaza/
Алмаз

507-каратный алмаз Cullinan Heritage
Алмаз — самый твёрдый минерал, кубическая полиморфная (аллотропная) модификация углерода(C), устойчивая при высоком давлении. При атмосферном давлении и комнатной температуре метастабилен, но может существовать неограниченно долго, не превращаясь в стабильный в этих условиях графит. В вакууме или в инертном газе при повышенных температурах постепенно переходит в графит.
СТРУКТУРА

Кристаллическая структура алмаза
Сингония алмаза кубическая, пространственная группа Fd3m. Элементарная ячейка кристаллической решетки алмаза представляет собой гранецентрированный куб, в котором в четырех секторах расположенных в шахматном порядке, находятся атомы углерода.
Иначе алмазную структуру можно представить как две кубических гранецентрированных решетки, смещенных друг относительно друга по главной диагонали куба на четверть её длины. Структура аналогичная алмазной установлена у кремния, низкотемпературной модификации олова и некоторых других простых веществ.
Кристаллы алмаза всегда содержат различные дефекты кристаллической структуры (точечные, линейные дефекты, включения, границы субзерен и тп.). Такие дефекты в значительной степени определяют физические свойства кристаллов.
СВОЙСТВА

Неограненный алмаз
Алмаз может быть бесцветными водянопрозрачным или окрашенным в различные оттенки желтого, коричневого, красного, голубого, зеленого, черного, серого цветов.Распределение окраски часто неравномерное, пятнистое или зональное. Под действием рентгеновских, катодных и ультрафиолетовых лучей большинство алмазов начинает светиться (люминесцировать) голубым, зелёным, розовым и др.
цветами. Характеризуется исключительно высоким светопреломлением. Показатель преломления (от 2,417 до 2,421) и сильная дисперсия (0,0574 ) обуславливают яркий блеск и разноцветную «игру» огранённых ювелирных алмазов, называемых бриллиантами. Блеск сильный, от алмазного до жирного.Плотность 3,5 г/см3.
По шкале Мооса относительная твердость алмаза равна 10, а абсолютная — в 1000 раз превышает твёрдость кварца и в 150 раз — корунда. Она самая высокая как среди всех природных, так и искусственных материалов. Вместе с тем довольно хрупок, легко раскалывается. Излом раковистый. С кислотами и щелочами в отсутствие окислителей не взаимодействует.
На воздухе алмаз сгорает при 850° С с образованием СО2; в вакууме при температуре свыше 1.500° С переходит в графит.
МОРФОЛОГИЯ
Морфология алмаза очень разнообразна. Он встречается как в виде монокристаллов, так и в виде поликристаллических срастаний («борт», «баллас», «карбонадо»). Алмазы из кимберлитовых месторождений имеют только одну распространенную плоскогранную форму — октаэдр.
При этом во всех месторождениях распространены алмазы с характерными кривогранными формами — ромбододекаэдроиды (кристаллы похожие на ромбододекаэдр, но с округлыми гранями), и кубоиды (кристаллы с криволинейной формой ).
Как показали экспериментальные исследования и изучение природных образцов в большинстве случаев кристаллы в форме додекаэдроида возникают в результате растворения алмазов кимберлитовым расплавом. Кубоиды образуются в результате специфического волокнистого роста алмазов по нормальному механизму роста.
Алмаз Куллинан разбитый на 9 частей
Синтетические кристаллы, выращенные при высоких давлениях и температурах, часто имеют грани куба и это является одни их характерных отличий от природных кристаллов. При выращивании в метастабильных условиях алмаз легко кристаллизуется в виде пленок и шестоватых агрегатов.
Размеры кристаллов варьируют от микроскопических до очень крупных, масса самого крупного алмаза «Куллинан», найденного в 1905г. в Южной Африке 3106 карат (0,621кг).На изучение огромного алмаза было потрачено несколько месяцев и в 1908 году он был расколот на 9 крупных частей.
Алмазы массой более 15 карат — редкость, а массой от сотни карат — уникальны и считаются раритетами. Такие камни очень редки и часто получают собственные имена, мировую известность и своё особое место в истории.
Источник: http://mineralpro.ru/minerals/diamond/
Молярная масса алмаза: примеры с формулой камня
Доброго времени суток, дорогие читатели. Для каждого из нас известно, что рассматриваемый драгоценный камень является углеродом, вернее его аллотропной модификацией. И в сегодняшней статье мы рассмотрим, какой же молярной массой обладает этот ценный природный минерал.
Помимо этого ценного минерала, углерод способен также существовать в виде множества других веществ и состояний.
К этому относится сажа, фуллерен, карбин, кокс, конечно же графит и некоторые другие вещества. К тому же надо отметить, что графит принадлежит к гексагональной системе.
Кристаллизация же алмаза возможна в гексагональной и кубической системах, что обусловлено природой его происхождения.
Строение углеродного атома вы можете наблюдать на изображении ниже:

- 1 Немного теории
- 2 Примеры задач
Немного теории
Удивительным свойством алмаза является то, что у него нет газообразной формы. В газ он может превратиться только под воздействием суровых действий окружающей среды (например, 2000 градусов по Цельсию). При этом образуется углекислый газ, не являющийся формой алмаза.
По этой причине формула Менделеева-Клапейрона (или уравнение состояния идеального газа) в отношении алмаза не действует.
Основные теоретические сведения:
- Молярная масса M – масса, каковую имеет один моль любого природного вещества. Грамм и килограмм на моль (г/моль или кг/моль) – единица измерения этой самой молярной массы.
- Относительная молекулярная масса Mr – молярная масса любого природного соединения, в отнесении к 1/12 массы молярной атома углерода-12 (12 С). Величина эта является безразмерной.
- Относительная атомная масса Ar – молярная масса атома вещества, в отнесении к 1/12 массы молярной атома углерода-12 (12 С).
- Относительная атомная масса алмаза приравнена к 12,0116 а.е.м. А вот его относительная молекулярная масса при этом будет равна 12,0116. Что же с молярной массой? M(С) = Mr (С) × 1 моль = 12,0116 г/моль.
Примеры задач
Для большего понимания данного определения и его использования на практике, мы предлагаем вам посмотреть решения нескольких задач, подробнее о которых вы можете прочитать здесь.
Решение задачи 1. В ней вам предстоит выяснить, какой же молярной массой обладает оставшаяся масса оксида магния?

- Во второй задаче вы узнаете о массе воды, полученной из кислорода.

Источник: https://lubikamni.ru/almaz/molyarnaya-massa.html
Формула алмаза, его особенности с фото, физические и химические свойства
Среди природных минералов наиболее известен и популярен алмаз. Этот камень ассоциируется с достатком и процветанием. Для большинства девушек ювелирное изделие с алмазом – самый желанный подарок. Необычные свойства минерала оценили не только ювелиры. Его широко используют в промышленности, при проведении магических ритуалов и в литотерапии.
Немного истории
Упоминания о необычном камне встречаются в трудах, датируемых третьим тысячелетием до нашей эры. Ученые предполагают, что первые алмазы были найдены в Индии. Долгое время их не умели обрабатывать, поэтому они хранились в сокровищницах богатых людей в чистом необработанном виде.
В Европу камни были завезены после похода Александра Македонского в Индию. Полководец узнал о необычных ископаемых и решил завладеть ими.
Способ, при помощи которого можно изменить форму алмаза, был придуман в средние века в Бельгии. Умельцы смогли отшлифовать камни и придать им блеск.
В России алмаз приобрел популярность во времена Екатерины II. Благодаря ей алмазы и бриллианты стали олицетворением роскоши.
У алмаза существовало несколько названий, которые указывали на необычайную твердость.
Арабы называли его «алмас», что в переводе обозначает «самый твердый», индийцы прозвали его «фарий» или «непревзойденный», греки нарекли его «несокрушимый» или «адамас», римляне – «диамонд».
Наименование «алмаз» закрепилось после того, как русский путешественник Афанасий Никитин описал этот камень в своей книге.
Желтый алмаз
Общая характеристика с фото и состав
Алмаз – это камень, который образован из углерода. Формула алмаза – С. Такое же обозначение имеет, например, графит.
Эта модификация углерода обладает кристаллической решеткой кубической формы, что делает минерал самым твердым среди природных ресурсов. Обработанный камень полностью прозрачен и сияет на солнце.
Однако самородки имеют множество шероховатостей, что создает впечатление матовости. На фото представлен необработанный экземпляр.
Необработанный алмаз
Камень невозможно нагреть теплом своего тела. В горной породе чаще всего находят одиночные, но иногда обнаруживают сросшиеся группы кристаллов. Наиболее распространены бесцветные камни, однако встречаются самородки других оттенков. Разнообразие расцветок можно увидеть на фотографиях ниже.
Физические и химические свойства этого драгоценного камня
Главная характеристика минерала – высокий показатель твердости, он крепче, чем другие углеродистые соединения. Камень невозможно оцарапать каким-либо натуральным материалом, но он режет стекло.
По шкале Мооса алмаз имеет самую высокую оценку – 10 баллов.
При этом из-за свойств кристаллической решетки, называемой совершенной спайностью, алмаз можно легко разбить при сильном ударе молотком, поэтому, наряду с твердостью, он хрупкий. Основные физические свойства:
- Способность светиться различными цветами при воздействии рентгена или ультрафиолета.
- Высокое свотопреломление.
- Выраженный блеск.
- Теплопроводность выше, чем у других минералов.
- Плотность алмаза – 3,5 г/куб.см.
- При изломе образуется поверхность, напоминающая раковину моллюска.
- Плавится при температуре 3700-4000 градусов.
- На воздухе загорается при 800 градусах, при полном сгорании образует углекислый газ. При разогреве плотность алмазов уменьшается.
- Без доступа кислорода при нагревании до 1,5-2 тыс. градусов алмаз превращается в графит без изменения основной формулы и распадается на множество маленьких кусочков. На видео показан опыт по превращению алмаза в графит.
При воздействии на «диамонд» заряженных частиц, в нем образуются электрические импульсы. В химии его называют одним из самых устойчивых элементов. Алмаз не повреждается при соприкосновении с кислотой, но начинает окисляться и гореть при воздействии щелочных веществ (расплавов щелочи, соды и селитры).
Происхождение и месторождения алмаза
Существует 2 основные версии происхождения этих драгоценных камней – магматическая и метеоритная. Согласно первой, они образуются под воздействием высоких температур и давления на углеродные вещества. При извержении вулканов кристаллы алмазов поднимаются на поверхность, формируются кимберлитовые трубки, являющиеся алмазными месторождениями.
Добыча алмазов
Метеоритные «диамонды» появляются при столкновении метеоритов с поверхностью земли. В этот момент температура достигает отметки около 3 тыс. градусов, а давление – 100 ГПа. Камни, образованные таким образом, найдены в США в Большом Каньоне и в Якутии. Однако в таких месторождениях камни небольшого размера, поэтому их добыча нерентабельна.
Залежи алмазов обнаружены на всех континентах, кроме Антарктиды. Наиболее большие месторождения в настоящее время находятся в ЮАР, Анголе, Ботсване, Канаде, Австралии и России. Самый крупный самородок был найден в Южной Африке. Его вес составил более 3 тыс. карат. Последний большой экземпляр обнаружили в 2015 году. Его достоинство – 1111 карат или 222,2 грамм.
Разновидности алмазов
Наиболее распространенный вид алмаза – бесцветный. Однако существует множество алмазов с одинаковыми физическими свойствами, отличающихся по цвету. Расцветка зависит от того, из чего, помимо углерода, состоит уникальный элемент. Выделяют следующие разновидности:
- Желтые. Желтоватый оттенок камни приобретают, когда некоторые атомы в кристаллической решетке замещаются другим веществом — азотом. В зависимости от количества азотистых элементов цвет может быть насыщенным или бледным. В Австралии находят экземпляры коньячного и рыжего оттенка.
- Синие. Камни считаются очень редкими. Оттенок они получают благодаря тому, что в их состав проникают атомы бора.
- Голубые. Также встречаются нечасто. Эта разновидность алмаза высоко ценится и чаще всего оседает в частных коллекциях.
- Розовые и красные. Доказанной теории их происхождения в настоящее время нет. Они очень дорогие из-за того, что редко встречаются в природе. Этот вид драгоценных камней обнаружен в Австралии.
- Зеленые. Получаются при длительном контакте с радиационным излучением.
- Черные. Считаются наиболее прочными среди алмазов. Долгое время считались второсортным материалом, но сейчас высоко ценятся ювелирами. На видео представлены украшения из разноцветных экземпляров.
Также «адамасы» различают по природной форме и строению:
- Монокристаллические и поликристаллические. Вторые считаются особо прочными.
- Октаэдры.
- Плоскогранники.
- Ромбовидные.
- Кубовидные.
- Кристаллографические.
Синий алмаз
Как из алмаза получают бриллиант?
Многие люди полагают, что бриллиант – это одна из разновидностей алмаза. Однако бриллиант является тем же минералом с такой же химической формулой и связями между кристаллами, но получившим огранку. Для придания камням блеска и формы их подвергают обработке.
Алмазы обрабатывают при помощи чугунных дисков с алмазным напылением. Цель огранки – придать камню форму и сделать так, чтобы при свете он переливался и сиял. Наиболее красивы бриллианты круглой формы с 57 гранями.
Создание драгоценного камня может занимать несколько месяцев. Во время огранки он становится меньше, но это не уменьшает стоимость.
Существует 3 способа обработки камня:
- Метод «розетки». Его применяют для создания бриллиантов из небольших экземпляров. Грани располагают по типу «розы».
- Ступенчатая огранка. Используется при работе с образцами в виде прямоугольника. Грани имеют форму треугольника или трапеции и размещаются друг над другом.
- Бриллиантовый. Применяется для круглых и овальных экземпляров. Прямоугольные или ромбовидные грани располагаются в несколько ярусов в шахматном порядке.
Магические и лечебные свойства
Многие люди издавна ценили алмаз не за его красивые блеск, а за необычные свойства. Древние маги и колдуны приписывали минералу магическую силу. Однако и в наши дни есть немало тех, кто верит в магию камня.
Зеленый алмаз
К необычным способностям относят:
- защита от неприятностей и сглаза;
- усиление харизмы хозяина;
- расширение карьерных возможностей;
- налаживание межличностных связей;
- обеспечение удачи в игре;
- помощь в поиске второй половинки;
- ограждение от негативных мыслей и противоправных поступков.
Наибольшее действие камни оказывают, если их носят на левой руке в золотом кольце. Желтые бриллианты считаются самыми сильными, но их влияния слабый человек может не выдержать. Лучше всего в качестве оберега использовать бесцветные экземпляры.
Желтый бриллиант
Литотерапевты применяют алмазы для лечения различных патологий. Минерал способствует устранению следующих проблем:
- сердечно-сосудистых болезней;
- бессонницы;
- депрессии и стресса;
- психических расстройств;
- гинекологических заболеваний;
- ослабленного иммунитета;
- кожных высыпаний.
Для лечения нужно пить воду, в которой на протяжении суток находился алмаз. Усиливает лечебный эффект украшение с бриллиантом. Народные целители утверждают, что постоянный контакт человека с камнем оказывает омолаживающий эффект на организм.
Кому подходит алмаз?
Астрологи уверяют, что алмаз подходит представителям всех знаков зодиака. Энергия камня высокой плотности очень сильная, поэтому он способен усилить энергетические возможности каждого человека.
Особое внимание следует уделить бриллианту Овнам и Львам. Овнов он делает уравновешенными и рассудительными. Львы могут достигнуть больших успехов в профессиональной деятельности, укрепить любовные связи.
Однако «диамонды» требуют уважительного отношения. Если пренебрегать правилами ухода, они перестанут помогать хозяину. Также не следует надевать бриллиантовые украшения людям, которые планируют преступление. Им камень будет препятствовать и приносить неудачи.
При выборе алмазного амулета нужно обратить внимание на цвет минерала:
- знакам стихии Воды лучше всего помогают голубые и синие;
- все огненные представители получат помощь от красного и оранжевого камня;
- знакам Воздуха и Земли подойдут нейтральные бесцветные экземпляры, обрамленные в золото.
Алмаз не относится к чисто мужским или женским камням. Из него делают украшения для мужчин и женщин.
Сколько стоит камень?
Алмаз в настоящее время является самым дорогим драгоценным камнем. Сколько он стоит, зависит от нескольких факторов:
- Чистоты минерала. Наиболее ценятся алмазы, не имеющие видимых дефектов. Определить лучшие экземпляры можно, если их опустить в стакан с чистой водой. Характерная способность бриллианта — исчезать в прозрачной воде.
- Величины. Вес алмазов рассчитывается в каратах. Наибольшей популярностью пользуются камни в 0,1 карат. Самые дорогие бриллианты достоинством более 1 карата.
- Цвета. Высоко оценивают экземпляры необычных оттенков.
- Огранки. Чем больше граней имеет бриллиант, тем эффектнее он смотрится. Для получения переливов у алмаза должно быть не менее 17 граней.
- Форма. Наиболее востребованы круглые бриллианты. Однако экземпляр необычной формы может стоить в несколько раз дороже, чем аналогичный круглый.
- Затраты на добычу и определение подлинности. Самые дешевые — в некоторых странах Африки, Индии и России. Дорого стоят камни из ЮАР, Бразилии и Австралии.
Стоимость 1 карата качественного бриллианта, вставленного в украшение, в рублях составляет около 500 тыс. Один экземпляр со стандартной огранкой стоит от 70 тыс. рублей за карат. Купить камень более 6 карат можно только на специализированном аукционе.
Источник: https://MoyKamen.com/vidy/dragocennye/formula-almaza.html




