1001student.ru > Физика > Определение притяжения и отталкивания молекул в физике в 7 классе
Все материальные объекты состоят из устойчивых, электрически нейтральных частиц — молекул. Они способны притягиваться и отталкиваться, не позволяя физическому телу распасться на отдельные атомы. От межмолекулярного взаимодействия зависят основные свойства материального строения. Тема «Притяжение и отталкивание молекул» изучается в 7 классе на уроках физики.

Зависимость притяжения от расстояния
Для определения сил притяжения важно знать, на каком расстоянии находятся молекулы. Если частицы расположены на большой дистанции, возникают 3 эффекта:

- Дисперсионный. Во время вращения электронов вокруг ядра возникают диполи — идеализированные системы, состоящие из разноименных точечных зарядов. Если эти структуры обращены друг к другу положительными и отрицательными зарядами, между молекулами появляется магнитное поле. В результате образуется сила притяжения, укрепляющая связи между диполями.
- Ориентационный. Если молекулы состоят из ионов с разноименными зарядами, они обращены друг к другу противоположно заряженными частями. В результате возникает диполь-дипольное взаимодействие. Ориентационный эффект притяжения характерен для кислот, состоящих из иона водорода и неметалла с отрицательным зарядом.
- Индукционный. Частица, находящаяся в электромагнитном поле, поляризуется. Изменяется направление колебания излучения, что приводит к сосредоточению электронов на 1 стороне. В результате взаимодействия поляризованных частиц образуется индуцированный диполь. Увеличение энергии дипольного взаимодействия обуславливается зарядом электрически нейтральных частиц.
Если молекулы находятся на близком расстоянии, их электронные облака перекрываются. В результате частицы начинаются отталкиваться друг от друга.
По принципу взаимодействия одноименных зарядов расстояние между молекулами постепенно увеличивается. Примерами отталкивания молекул являются штамповка, ковка, сжатие рессора в машине и натяжения тетивы.
Краткое описание межмолекулярного взаимодействия
Чтобы понять, почему молекулы притягиваются и отталкиваются, нужно знать строение физических тел. Мельчайшие частицы вещества состоят из атомов.
Их количество зависит от вещества, из которого состоит материальный объект. Количество атомов основных химических элементов указано в периодической таблице Д. И. Менделеева. Молекулы вещества постоянно перемещаются.
Скорость движения частиц зависит от температуры физического тела.
В зависимости от характера межмолекулярных связей, выделяют следующие разновидности веществ:

- Твердые: молекулы расположены на близком расстоянии. В результате их взаимодействия могут возникать интенсивные колебания вокруг положения равновесия. Атомы образуют кристаллическую решетку, где частицы расположены в закономерном порядке. По этой причине твердые вещества называются кристаллами. Если молекулы расположены не по порядку, физическое тело будет являться аморфным. В кристаллической решетке между частицами наблюдается сильное притяжение, поэтому твердые вещества способны сохранять свою форму и объем.
- Жидкие: расстояние между мельчайшими частицами выше, чем в телах с кристаллической решеткой. Молекулы жидкостей способны совершать колебательные движения и изменять положение равновесия. В жидких веществах частицы расположены на разных позициях. Между ними возникают промежутки разного размера. Из-за постоянной смены положения равновесия жидкости имеют форму вытянутой капли.
- Газообразные: мельчайшие частицы размещены на дальнем расстоянии. Благодаря наличию большого количества свободного пространства они могут двигаться, сталкиваясь друг с другом. По этой причине газы могут легко сжиматься. Притяжение в газообразных веществах практически отсутствует. По этой причине они не сохраняют свою форму и объем.
Во всех средах может возникать диффузия. Это явление представляет собой смешивание молекул тел, состоящих из различных химических элементов. В результате расстояние между мельчайшими частицами изменяется. Чем меньше дистанция между молекулами, тем сильнее они притягиваются.
Притяжение между мельчайшими частицами проявляется заметно, если выполняется следующее условие: расстояние между молекулами меньше, чем их размеры.
Основные разновидности
Выделяют следующие виды притяжения между частицами веществ:

- Электростатическое: проявляется на большом расстоянии. Является одним из самых слабых разновидностей межмолекулярного взаимодействия. Электростатическое притяжение характеризуется полярностью и поляризуемостью частиц.
- Донорно-акцепторное: проявляется во время химических реакций и при смене агрегатного состояния. Оно лежит в основе каталитических процессов и определяется количеством ионов в веществе. В результате донорно-акцепторного взаимодействия образуются новые растворы.
Для определения разновидности притяжения необходимо знать основные типы межмолекулярного взаимодействия и учитывать заряд поляризованных атомов.
Сильное притяжение возникает при взаимодействии водорода и неметаллов. В этом случае возникает молекулярная водородная связь. Ее энергия составляет 40 кДж/моль.
Этот параметр зависит от содержания водорода в веществе и электроотрицательности неметалла. Водородная связь является одной из основных тем для доклада по химии в 7 классе.
Ученикам необходимо знать ее роль в ассоциации частиц, процессах кристаллизации и растворения, электрической диссоциации и формировании кристаллогидратов.
Явление смачивания
Примером притяжения и отталкивания молекул может служить явления смачивания. Если смочить стеклянные поверхности 2 физических тел и плотно прижать их друг к другу, возникнет сила притяжения.
Для демонстрации явления смачивания можно использовать 2 стеклянных рамы, смоченные несколькими каплями воды. После отсоединения физических тел на обеих поверхностях будет присутствовать жидкость. Это значит, что между частицами стекла и воды возникло взаимное притяжение.
При отсутствии смачивания молекулы жидкостей и твердых тел не могут притягиваться друг к другу. В этом случае стеклянные поверхности останутся сухими.
Практические опыты

Явления взаимного притяжения и отталкивания молекул можно наблюдать при помощи практических опытов. Самым популярным из них является эксперимент с сухой одеждой. Если ткань не наэлектризована, она не будет плотно прилегать к коже человека. Мокрая одежда прилипает к человеческому телу. Аналогичный эффект наблюдается при смачивании листов бумаги и расплавлении листов железа.
Существование взаимного притяжения между частицами можно доказать при помощи сцепления свинцовых цилиндров. Если прижать тела друг другу, они не будут притягиваться.
Чтобы притяжение между молекулами возникло, нужно обработать поверхность свинцовых цилиндров стругом — изогнутым ножом с рукояткой. С помощью этого инструмента нужно заточить торцы физических тел.
После этого процесса необходимо отполировать свинцы и повторно прижать их друг к другу. Возникают силы притяжения.
Источник: https://1001student.ru/fizika/opredelenie-prityazheniya-i-ottalkivaniya-molekul.html
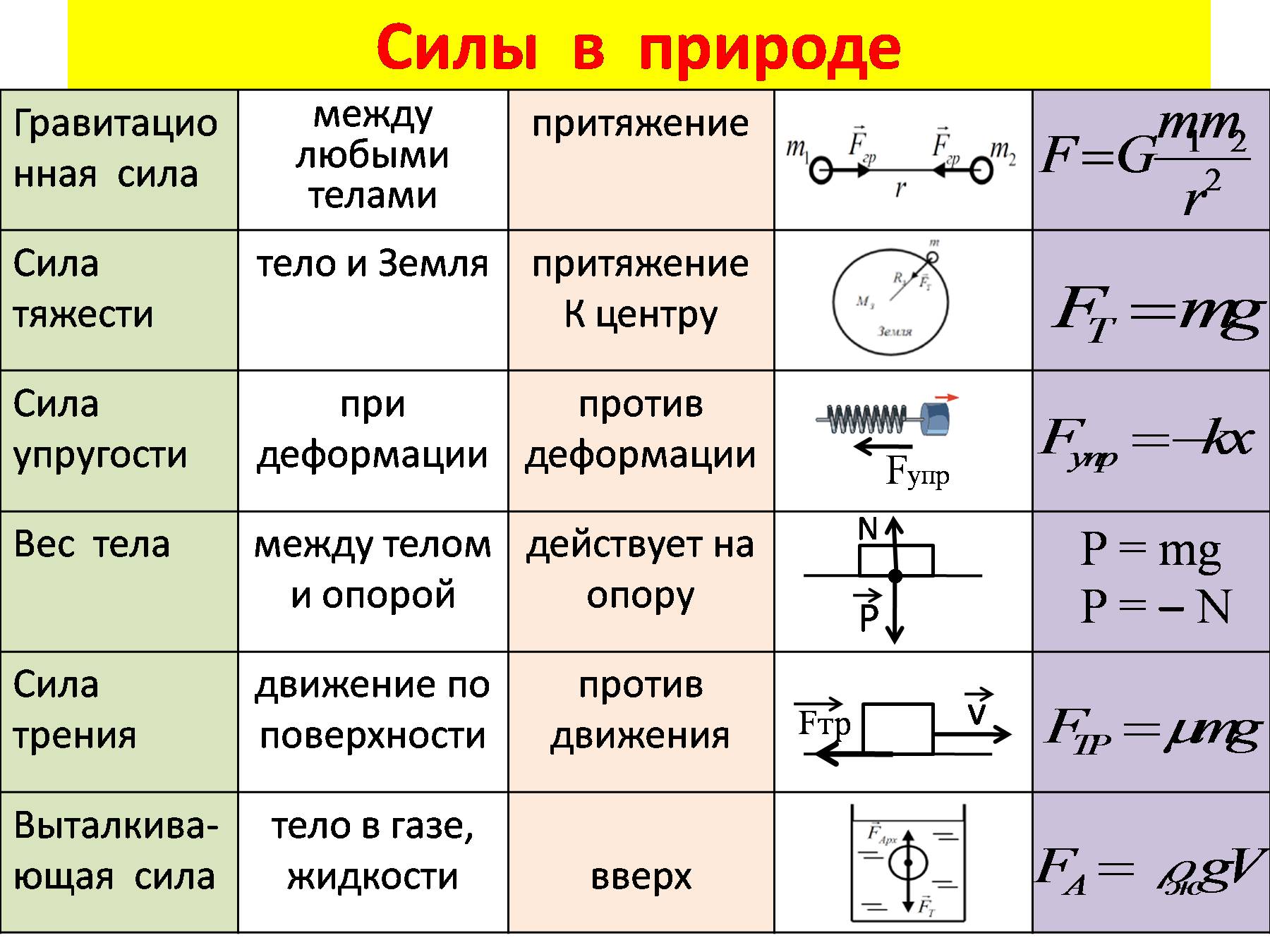
Силы взаимодействия молекул. Строение газообразных, жидких и твёрдых тел — Класс!ная физика
- «Физика — 10 класс»
- Можно ли объяснить свойства вещества во всех его агрегатных состояниях строением вещества, движением и взаимодействием его частиц?
- Силы взаимодействия молекул.
Молекулы взаимодействуют друг с другом. Без этого взаимодействия не было бы ни твёрдых, ни жидких тел.
Доказать существование значительных сил взаимодействия между атомами или молекулами несложно. Попробуйте-ка сломать толстую палку! А ведь она состоит из молекул.
Но одни силы притяжения не могут обеспечить существования устойчивых образований из атомов и молекул. На очень малых расстояниях между молекулами обязательно действуют силы отталкивания.
Благодаря этому молекулы не проникают друг в друга и куски вещества никогда не сжимаются до размеров порядка размеров одной молекулы.
- Молекула — это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер.
- В целом молекулы электрически нейтральны, тем не менее между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул.
- Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия практически не сказываются.
На расстояниях, превышающих 2—3 диаметра молекул, действуют силы притяжения. По мере уменьшения расстояния между молекулами сила их взаимного притяжения сначала увеличивается, но одновременно увеличивается и сила отталкивания. При определённом расстоянии r0 сила притяжения становится равной силе отталкивания. Это расстояние считается равным диаметру молекулы.

При дальнейшем уменьшении расстояния электронные оболочки атомов начинают перекрываться и быстро увеличивается сила отталкивания. На рисунке 8.5 показаны графики зависимости потенциальной энергии взаимодействия молекул (рис. 8.
5, а) и сил притяжения (1) и отталкивания (2) (рис. 8.5, б) от расстояния между молекулами. При r = r0 потенциальная энергия минимальна, сила притяжения равна силе отталкивания.
При r > r0 сила притяжения больше силы отталкивания; при r < r0 сила притяжения меньше силы отталкивания.
Молекулярно-кинетическая теория даёт возможность понять, почему вещество может находиться в газообразном, жидком и твёрдом состояниях.
Итак, между молекулами действуют силы притяжения и они участвуют в тепловом движении. Агрегатное состояние вещества определяется тем, какое из этих двух свойств молекул является главным.
Газы.
В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Например, при атмосферном давлении объём сосуда в десятки тысяч раз превышает объём находящихся в нём молекул.
Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но форма молекулы не изменяется.
Газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объёма. Многочисленные удары молекул о стенки сосуда создают давление газа.
Молекулы газа с огромными скоростями — сотни метров в секунду — движутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга.
- В газах средняя кинетическая энергия теплового движения молекул больше средней потенциальной энергии их взаимодействия, поэтому часто потенциальной энергией взаимодействия молекул мы можем пренебречь.
- Жидкости.
- Молекулы жидкости расположены почти вплотную друг к другу поэтому молекула жидкости ведёт себя иначе, чем молекула газа.
В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам.
Молекула колеблется около своего положения равновесия, сталкиваясь с соседними молекулами. Лишь время от времени она совершает очередной «прыжок», попадая в новое положение равновесия.
В положении равновесия сила отталкивания равна силе притяжения, т. е. суммарная сила взаимодействия молекулы равна нулю.

Характер молекулярного движения в жидкостях, впервые установленный советским физиком Я. И. Френкелем, позволяет понять основные свойства жидкостей. По образному выражению учёного: «…молекулы жидкости ведут кочевой образ жизни…
» При этом время оседлой жизни молекулы воды, т. е. время её колебаний около одного определённого положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время же одного колебания значительно меньше (10-12 — 10-13 с).
С повышением температуры время оседлой жизни молекул уменьшается.
Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объёма силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей.
Жидкости: 1) малосжимаемы; 2) текучи, т. е. не сохраняют своей формы.
Объяснить текучесть жидкостей можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы. Вот почему жидкость течёт и принимает форму сосуда.
В жидкостях средняя кинетическая энергия теплового движения молекул сравнима со средней потенциальной энергией их взаимодействия. Наличие поверхностного натяжения доказывает, что силы взаимодействия молекул жидкостей существенны, и ими пренебрегать нельзя.
Твёрдые тела.
Атомы или молекулы твёрдых тел, в отличие от атомов и молекул жидкостей, колеблются около определённых положений равновесия. По этой причине твёрдые тела сохраняют не только объём, но и форму.
В твёрдых телах средняя потенциальная энергия взаимодействия молекул много больше средней кинетической энергии их теплового движения.
Если соединить центры положений равновесия атомов или ионов твёрдого тела, то получится правильная пространственная решётка, называемая кристаллической.

На рисунках 8.6 и 8.7 изображены кристаллические решётки поваренной соли и алмаза. Внутренний порядок в расположении атомов кристаллов приводит к правильным внешним геометрическим формам.
Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Назад в раздел «Физика — 10 класс, учебник Мякишев, Буховцев, Сотский»
Основные положения МКТ. Тепловые явления — Физика, учебник для 10 класса — Класс!ная физика
Почему тепловые явления изучаются в молекулярной физике — Основные положения молекулярно-кинетической теории. Размеры молекул — Примеры решения задач по теме «Основные положения МКТ» — Броуновское движение — Силы взаимодействия молекул. Строение газообразных, жидких и твёрдых тел — Идеальный газ в МКТ.
Среднее значение квадрата скорости молекул — Основное уравнение молекулярно-кинетической теории газов — Примеры решения задач по теме «Основное уравнение молекулярно-кинетической теории» — Температура и тепловое равновесие — Определение температуры. Энергия теплового движения молекул — Абсолютная температура.
Температура — мера средней кинетической энергии молекул — Измерение скоростей молекул газа — Примеры решения задач по теме «Энергия теплового движения молекул» — Уравнение состояния идеального газа — Примеры решения задач по теме «Уравнение состояния идеального газа» — Газовые законы — Примеры решения задач по теме «Газовые законы» — Примеры решения задач по теме «Определение параметров газа по графикам изопроцессов»
Источник: http://class-fizika.ru/10_a209.html
Полная энергия взаимодействия атомов и молекул
Полная энергия взаимодействия атомов и молекул будет определяться действием сил отталкивания на малых и сил притяжения на больших расстояниях между частицами:
| |
(3.26) |
При этом силы притяжения могут иметь химическую природу (в случае образования химической связи) или являются силами Ван-дер-Ваальса (в случае физического взаимодействия частиц).
Однако и в том, и в другом случае полная энергия взаимодействия частиц на определенном расстоянии R = R0 между частицами (рис.3.
3) достигает своего наименьшего значения –U0, которое соответствует состоянию устойчивого равновесия частиц.
В состоянии устойчивого равновесия действие сил отталкивания компенсируется действием сил притяжения, поэтому частицы, предоставленные самим себе, должны выстраиваться в определенном порядке на расстоянии R0 друг от друга, образуя твердое тело с упорядоченной структурой – кристалл.
 |
| Рис. 3.3. График зависимости полной энергии взаимодействия атомов или молекул от расстояния R между ними. В области малых расстояний между частицами полная энергия определяется главным образом их взаимным отталкиванием. В области больших – притяжением частиц. Глубина U0 потенциальной ямы зависит от природы сил притяжения, которые действуют между частицами. |
Частицы кристалла не могут свободно покидать свои положения равновесия, так как при удалении от этих положений энергия частиц увеличивается, и появляются силы, стремящиеся вернуть их назад. Единственной доступной формой движения для таких частиц являются беспорядочные тепловые колебания около равновесных положений.
Такая структура будет сохраняться до тех пор, пока энергия связи U0 остается выше энергии kT теплового движения частиц:
| . | (3.27) |
При энергиях
| (3.28) |
частицы получают возможность покидать свои положения равновесия, и кристалл превращается в жидкость, то есть плавится.
Наконец, если энергия теплового движения частиц kT становится заметно больше энергии связи U0,
| , | (3.29) |
жидкость превращается в пар.
Таким образом, энергия связиU0 определяет температуру плавления (или кристаллизации) вещества, а также его температуру парообразования (или конденсации).
Величина энергии связи зависит от природы сил притяжения, которые действуют между частицами вещества. Энергия химической связи по порядку величины равна 1 – 10 эВ (200 – 2000 кДж∙моль–1). В случае действия сил Ван-дер-Ваальса энергия связи U0 оказывается порядка 0,01 – 0,1 эВ (2 – 20 кДж∙моль–1).
Несмотря на то, что энергия связи, которая обусловлена действием сил Ван-дер-Ваальса, достаточно мала, эти силы оказываются иногда единственными силами, которые могут обеспечить связь между частицами. Так, силы Ван-дер-Ваальса удерживают атомы в кристаллах инертных газов.
Благодаря действию этих сил притягиваются друг к другу молекулы во многих молекулярных кристаллах органических веществ. Действием сил Ван-дер-Ваальса объясняется и налипание (адсорбция) атомов или молекул из газовой или жидкой фазы на поверхность твердых тел.
К сожалению, область расстояний R между атомами или молекулами, соответствующая минимуму их энергии (3.26) нехимического взаимодействия, относится к области средних расстояний.
Поэтому простые аналитические выражения, полученные нами для энергии отталкивания (раздел 1) и энергии притяжения частиц (раздел 2) оказываются непригодными для расчетов энергии связи U0, обусловленной действием сил Ван-дер-Ваальса. В области средних расстояний между частицами полная энергия (3.
26) нехимического взаимодействия (как, впрочем, и химического) может быть рассчитана только численными методами, путем решения соответствующих уравнений квантовой механики, либо по эмпирическим формулам, полученным на основе экспериментальных данных.
В качестве примера такой формулы можно привести так называемый потенциал Ленарда-Джонса
| |
(3.30) |
который в области средних расстояний между частицами хорошо описывает зависимость от расстояния полной энергии взаимодействия атомов инертных газов. Первое слагаемое в этой формуле соответствует энергии отталкивания атомов, второе – энергии притяжения, обусловленного действием сил Ван-дер-Ваальса.
Постоянные B и C – это эмпирические параметры, определяемые из независимых измерений, сделанных в газовой фазе. Используемые данные включают вязкость, а также вириальные коэффициенты, которые описывают отклонения в поведении реальных инертных газов от поведения идеального газа.
Для описания изменения потенциальной энергии отталкивания с расстоянием широко используются и другие эмпирические формулы, в частности, формула , где эмпирическими параметрами являются постоянные l и a. Формулу, содержащую экспоненту, так же легко обрабатывать аналитически, как и формулу, содержащую обратную степенную функцию.
[1] Данные взяты из книги
П. Эткинс «Физическая химия» (в 2-х томах), — М.: Мир, 1980.
Источник: https://megaobuchalka.ru/1/24.html
Силы взаимодействия молекул
Молекулярные силы. Между молекулами вещества существуют силы взаимодействия, называемые Молекулярными силами. Если бы между молекулами не было сил притяжения, то все вещества при любых условиях находились бы только в газообразном состоянии.
Лишь благодаря силам притяжения молекулы удерживаются друг возле друга и образуют жидкие и твердые тела.
Однако одни только силы притяжения не могут обеспечить существование устойчивых образований из атомов и молекул. На очень малых расстояниях между молекулами действуют силы отталкивания.
- Строение
- атомов и молекул.
Атом, а тем более молекула, — это сложная система, состоящая из отдельных заряженных частиц — электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, между ними на малых расстояниях действуют значительные электрические силы. Происходит взаимодействие между электронами и ядрами соседних молекул.
Описание движения частиц внутри атомов и молекул и сил взаимодействия между молекулами очень сложная задача. Ее рассматривают а атомной физике. Мы приведем только результат: примерную зависимость силы взаимодействия двух молекул от расстояния между ними.
Атомы и молекулы состоят из заряженных частиц противоположных знаков заряда. Между электронами одной молекулы и атомными ядрами другой действуют силы притяжения. Одновременно между электронами обеих молекул и между их ядрами действуют силы отталкивания. Вследствие электрической нейтральности атомов и молекул молекулярные силы являются короткодействующими.
На расстояниях, превышающих размеры молекул в несколько раз, силы взаимодействия между ними практически не сказываются.
Зависимость молекулярных сил от расстояния между молекулами. Рассмотрим, как меняется в зависимости от расстояния между молекулами проекция силы взаимодействия между ними на прямую, соединяющую центры молекул. На расстояниях, превышающих 2-3 диаметра молекул, сила отталкивания практически равна нулю.
Заметна лишь сила притяжения. По мере уменьшения расстояния сила притяжения возрастает и одновременно начинает сказываться сила отталкивания. Эта сила очень быстро возрастает, когда электронные оболочки атомов начинают перекрываться.
В результате на сравнительно больших расстояниях молекулы притягиваются, а на малых отталкиваются.

На расстоянии r0, равном примерно сумме радиусов молекул, проекция результирующей силы Fr = 0, так как сила притяжения равна по модулю силе отталкивания (рис. 9, а). При r > r0 сила притяжения превосходит силу отталкивания и проекция результирующей силы (жирная стрелка) отрицательна (рис 9, б). Если r → ∞, то Fr → 0. На расстояниях r < r0 сила отталкивания превосходит силу притяжения (рис.
9, в).
Происхождение сил упругости. Зависимость сил взаимодействия молекул от расстояния между ними объясняет появление силы упругости при сжатии и растяжении тел.
Если пытаться сблизить молекулы на расстояние, меньшее r0, то начинает действовать сила, препятствующая сближению.
Наоборот, при удалении молекул друг от друга действует сила притяжения, возвращающая молекулы в исходное положение после прекращения внешнего воздействия.
При малом смешении молекул из положений равновесна сила притяжения или отталкивания растут линейно с увеличением смещения. На малом участке кривую можно считать отрезком прямой (утолщенный участок кривой на рис 8). Именно поэтому при малых деформациях оказывается справедливым закон Гука, согласно которому сила упругости пропорциональна деформации.
При больших смещениях молекул закон Гука уже несправедлив.
Так как при деформации тела изменяются расстояния между всеми молекулами, то на долю соседних слоев молекул приходится незначительная часть общей деформации. Поэтому закон Гука выполняется при деформациях в миллионы раз превышающих размеры молекул.
Источник: https://home-task.com/sily-vzaimodejstviya-molekul/
Взаимодействие молекул
Молекулы взаимно притягиваются, в этом невозможно сомневаться. Если бы в какое-то мгновение молекулы перестали притягиваться друг к другу, все жидкие и твердые тела распались бы на молекулы.
Молекулы взаимно отталкиваются, и это несомненно, так как иначе жидкости и твердые тела сжимались бы с необыкновенной легкостью.
Между молекулами действуют силы, во многом похожие на силы между атомами, о которых говорилось выше. Кривая потенциальной энергии, которую мы только что рисовали для атомов, правильно передает основные черты взаимодействия молекул. Однако между этими взаимодействиями имеются и существенные различия.
Сравним, например, равновесное расстояние между атомами кислорода, образующими молекулу, и атомами кислорода двух соседних молекул, притянувшихся в затвердевшем кислороде до равновесного положения. Различие будет очень заметным: атомы кислорода, образующие молекулу, устанавливаются на расстоянии 1,2 ?, атомы кислорода разных молекул подходят друг к другу на 2,9 ?.
Подобные результаты получаются и для других атомов. Атомы чужих молекул устанавливаются дальше один от другого, чем атомы одной молекулы.
Поэтому молекулы легче оторвать одну от другой, чем атомы от молекулы, причем различия в энергиях много больше разницы в расстояниях.
Если энергия, необходимая для разрыва связи между атомами кислорода, образующими молекулу, составляет около 100 ккал/моль, то энергия на растаскивание молекул кислорода меньше 2 ккал/моль.
Значит, на кривой потенциальной энергии молекул «яма» лежит дальше от вертикальной оси и, кроме того, «яма» гораздо менее глубока.
Однако этим не исчерпывается различие взаимодействия атомов, образующих молекулу, и взаимодействия молекул.
Химики показали, что атомы сцепляются в молекулу с вполне определенным числом других атомов. Если два атома водорода образовали молекулу, то третий атом уже не присоединится к ним для этой цели. Атом кислорода в воде соединен с двумя атомами водорода и присоединить к ним еще один невозможно.
Ничего подобного мы не находим в межмолекулярном взаимодействии. Притянув к себе одного соседа, молекула ни в какой степени не теряет своей «притягательной силы». Подход соседей будет происходить до тех пор, пока хватит места.
Что значит «хватит места»? Разве молекулы – это что-то вроде яблок или яиц? Конечно, в некотором смысле такое сравнение оправдано: молекулы – физические тела, обладающие определенными «размерами» и «формой». Равновесное расстояние между молекулами и есть не что иное, как «размеры» молекул.
Следующая глава
Источник: https://fis.wikireading.ru/3969




