Химическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их структурные формулы. Из этих формул видно, что в алканах имеются два типа химических связей:
С–С и С–Н
Связь С–С является ковалентной неполярной. Длина связи C–C в предельных углеводородах равна 0,154 нм. Связь С–Н — ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности (2.5 — для углерода и 2.1 — для водорода). Связи C–Н немного короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода.
Структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое существенно влияет на свойства вещества.
Пространственное расположение атомных орбиталей углерода зависит от типа его гибридизации. Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации.

Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды – тетраэдра. Углы между орбиталями равны 109028ʹ. Атом углерода в молекуле метана расположен в центре тетраэдра, атомы водорода – в его вершинах.
- Строение молекулы метана СН4
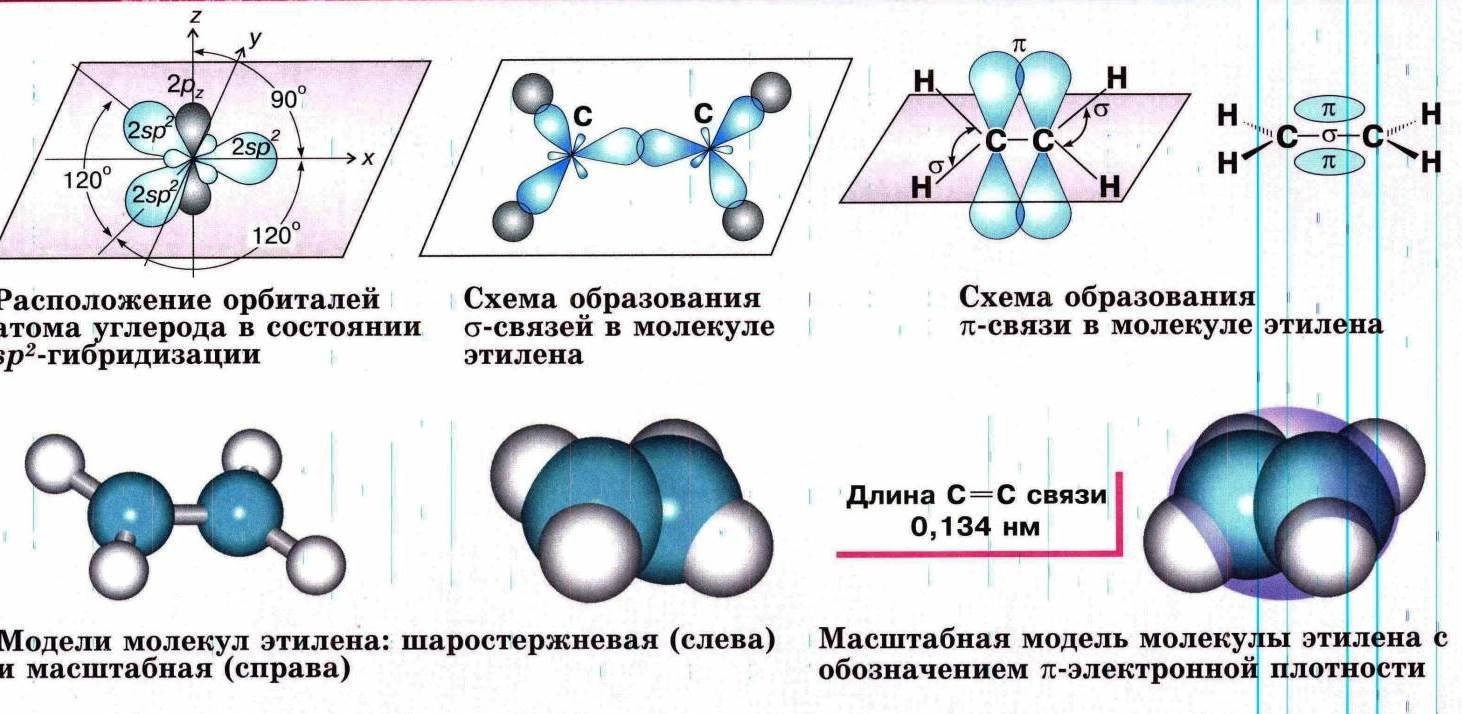
-

Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей.
 Для записи удобно использовать пространственную (стереохимическую) формулу.
Для записи удобно использовать пространственную (стереохимическую) формулу.

- Строение молекулы этана С2Н6
- В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp3— атома углерода образуют более сложную пространственную конструкцию:
-



- Так как гибридизированные электронные облака атомов углерода направлены к вершинам тетраэдра, то при образовании молекулы алканов, с большим числом атомов углерода, имеют зигзагообразное строение.
- Строение молекулы пропана С3Н8 – цепь зигзагообразная

- Молекула н-пентана
Все связи в молекулах предельных углеводородах одинаковые. Атом углерода образует σ–связь за счет перекрывания гибридных орбиталей с гибридными орбиталями другого атома.
Перекрывание осуществляется, таким образом, что область максимальной электронной плотности сосредотачивается в пространстве на прямой, соединяющей ядра атомов.
Такое перекрывание оказывается наиболее эффективным, а возникающие при этом σ–связи – наиболее прочными.
Алканы (предельные углеводороды)
Источник: https://himija-online.ru/organicheskaya-ximiya/alkany/stroenie-alkanov.html
Алканы. Свойства. Строение. Применение
Алканы. Свойства. Строение и применение
Алканы – предельные или насыщенные углеводороды, в их молекулах все атомы углерода соединены одинарной связью.
Состав предельных углеводородов – алканов может быть выражен общей формулой – СnH2n+2, где n – число атомов водорода.
Таким образом, первый представитель алканов, у которого один атом углерода имеет формулу – CH4. Следующий алкан, у которого два атома водорода имеет формулу C2H6, третий – C3H8.
Таким образом, каждый последующий алкан отличается от предыдущего на группу CH2. Эта группа называется гомологической разностью, а ряд алканов – гомологическим рядом.

Гомологический ряд – ряд веществ, расположенных в порядке возрастания относительных молекулярных масс, сходных по строению и свойствам, но отличающихся друг от друга на одну или несколько групп CH2. Вещества такого ряда называют гомологами.
Цепь атомов углерода изображают в виде углеродного скелета, в котором указаны все атомы углерода и водорода, а во втором случае опускают символы атомов углерода и водорода, подразумевая, что стыки двух линий представляют атомы углерода с двумя атомами водорода.

В молекулах алканов возможно свободное вращение групп атомов вокруг одинарных C–C связей.

Так, молекула метана не является плоской, а в пространстве имеет тэтраэдрическое строение, то есть атом углерода находится в центре тэтраэдра, а атомы водорода – в вершинах тэтраэдра.
В молекуле метана все углерод-водородные связи являются равноценными, а углы между ними одинаковы и составляют приблизительно 1900.

В названии алканов используется суффикс – ан. Составим гомологический ряд алканов: CH4 – метан, C2H6 – этан, C3H8 – пропан, C4H10 – бутан, C5H12 – пентан, C6H14 – гексан, C7H16 – гептан, C8H18 – октан, C9H20 – нонан, C10H22– дэкан.

Если от метана отнять один атом водорода, то останется CH3 – углеводородный остаток, или радикал. Он называется метил – суффикс – ил.
Если от этана отнять один атом водорода, то получится радикал C2H5 и он называется этил. Такие радикалы существуют очень короткое время. Они могут соединяться с другими радикалами или друг с другом.
Если соединиться два метильных радикала, то образуется этан, если соединяться два этильных радикала, то образуется бутан.

Кроме углеводородов нормального строения есть ещё углеводороды разветвлённого строения. Допустим, вам нужно составить структурные формулы к бутану. Мы может в первом случае, расположить все атомы углерода по прямой линии, а во втором случае изобразить разветвлённое строение.
Эти вещества будут по отношению к друг другу изомерами. То есть, изомеры – вещества, которые имеют один и тот же количественный и качественный состав, но разное строение и свойства. А само явление существования изомеров называется изомерией.

Посмотрите сами, первое соединение имеет состав C4H10 и второе такое же, но последовательность соединения атомов, то есть химическое строение их различно.

Первое соединение можно назвать нормальным бутаном, а второе изобутаном. Они отличаются строением и температурой кипения.
Рассмотрим таблицу.

Из таблицы видно, что с увеличением числа атомов углерода увеличиваются температуры плавления и кипения. Первые четыре представителя алканов при обычных условиях – газы, начиная с пятого и заканчивая пятнадцатым атомом углерода – жидкости. Те алканы, у которых шестнадцать и больше атомов углерода – твёрдые вещества.
- С1 ― С4 – газы; С5 ― С15 – жидкости; С16 и более – твёрдые вещества.
- Алканы не имеют цвета, жидкие алканы обладают характерным запахом, а твёрдые не имеют запаха.
- Кроме этого, алканы малорастворимы в воде.
- Например, метан, при обычных условиях – газ, не имеющий запаха и цвета, он практически не растворяется в воде.
Алканы содержатся в нефти. Простейший их представитель – метан – образуется в результате разложения без доступа кислорода останков растительных и животных организмов.
Этим объясняется выделение пузырьков газа со дна болот и водоёмов со стоячей водой, поэтому его называют болотным газом.
Метан выделяется также из каменно-угольных пластов и накапливается в шахтах, поэтому его называют ещё и рудничным газом. Он является основной составной частью природного газа.
Твёрдые алканы входят в состав парафина. Наличие углерода и водорода в его составе можно легко доказать опытным путём. Кусочек парафиновой свечи подожжём лучинкой. На стенках стакана появляются капельки воды.
Значит, в состав парафина входит водород. Вынем свечу и нальём в стакан известковой воды. Известковая вода помутнеет, из-за образования карбоната кальция, который образовался в реакции известковой воды с углекислым газом.
Значит, в парафине есть и углерод.
Алканы в химическом отношении малоактивны, потому что атомы углерода связаны друг с другом одинарными связями. Для алканов характерны реакции замещения, которые осуществляются за счёт разрыва C – H связи и замены атома водорода другим атомом.
Например, под действием света или при нагревании алканы реагируют с хлором и бромом. В реакции метана с хлором, на первой стадии образуется хлорметан и хлороводород. Как видите, один атом хлора заместил один атом водорода в молекуле метана и образовался хлороводород.
На второй стадии опять один атом хлора замещает ещё один атом водорода и образуется дихлорметан и хлороводород, на третьей стадии ещё один атом хлора замещает атом водорода и образуется трихлорметан и хлороводород, наконец на последней стадии атом хлора замещает последний атом водорода и образуется тэтрахлорметан и хлороводород.
Таким образом, реакция шла до тех пор, пока все четыре атома водорода в молекуле метана не заместились полностью на атомы хлора. Этот процесс можно записать в виде одного уравнения, поставив перед молекулой хлора коэффициент 4.
- Обратите внимание, что вместо знака равенства в уравнениях реакций стоит стрелка, потому что двумя чёрточками в органической химии обозначается двойная связь.
Предельные углеводороды горят с образованием углекислого газа и воды. Например метан горит бесцветным пламенем с выделением большого количества теплоты.
Смесь метана с воздухом взрывоопасна. Такие смеси могут образоваться в шахтах, заводских котельных, в жилых помещениях.
При высоких температурах молекулы предельных углеводородов расщепляются. Например, метан при температуре 1500 0C распадается на углерод и водород.
Ещё эта реакция называется реакцией дэгидрирования. То есть реакции, в результате которых от молекул органических соединений отщепляются молекулы водорода, называют реакциями дэгидрирования.
Алканы находят широкое применение. Метан используется, как природный газ, в качестве топлива, для синтэза аммиака, для получения метилового спирта, уксусной кислоты, синтетических каучуков, высококачественных сортов бензина, ацэтилена. Галогенпроизводные метана используются в качестве растворителей.
Таким образом, алканы – это углеводороды, содержащие в составе молекул только одинарные углерод-углеродные связи, их общая формула СnH2n+2, молекла метана имеет тэтраэдрическое строение.
Для него характерны реакции замещения и окисления. Ряд углеводородов, соседние члены которого отличаются на группу CH2, называют гомологическим рядом, а члены ряда – гомологами.
Гомологи имеют сходные химические свойства и закономерно изменяющиеся физические свойства.
Источник: https://videouroki.net/video/30-alkany-svoistva-stroieniie-primienieniie.html
Алканы. Строение молекул, номенклатура, физические свойства. Видеоурок. Химия 10 Класс
На уроке будет рассмотрена тема «Алканы. Строение молекул, номенклатура, физические свойства». Вы узнаете о том, что представляют собой алканы (нециклические углеводороды, в которых атомы углерода соединены простыми связями), как их правильно обозначать и какими физическими свойствами обладают эти вещества.
Тема: Предельные углеводороды
Урок: Алканы. Строение молекул, номенклатура, физические свойства
Алканы (предельные или насыщенные углеводороды, парафины) – углеводороды, атомы углерода в которых соединены простыми связями. Общая формула: CnH2n+2.
Соотношение числа атомов водорода и углерода в молекулах алканов максимально по сравнению с молекулами углеводородов других классов.
Поскольку все валентности углерода заняты либо углеродами, либо водородами, как правило, химические свойства алканов не очень ярко выражены, поэтому их еще называют предельными или насыщенными углеводородами. И существует еще более древнее название, лучше отражающее их относительную, конечно, химическую инертность – парафины, что переводится как «лишенные сродства».
Атомы углерода в алканах находятся в состоянии sp3 — гибридизации, и молекулу алканов
можно представить как набор тетраэдрических структур углерода, связанных между собой и с водородом. Рис. 1.

Рис. 1. Тетраэдрическое строение метана
s-связи между атомами Н и С прочные, практически неполярные (очень мало полярные).
Атомы вокруг простых связей постоянно вращаются. Поэтому молекулы алканов могут принимать разные формы. При этом длина связи и угол между связями остаются постоянными. Формы, переходящие друг в друга за счет вращения молекулы вокруг σ-связей, называют конформациями молекулы. Рис. 2.
 |
 |
 |
Рис. 2. Конформация молекулы
Первые четыре члена ряда алканов имеют исторически сложившиеся названия. Рис. 3.
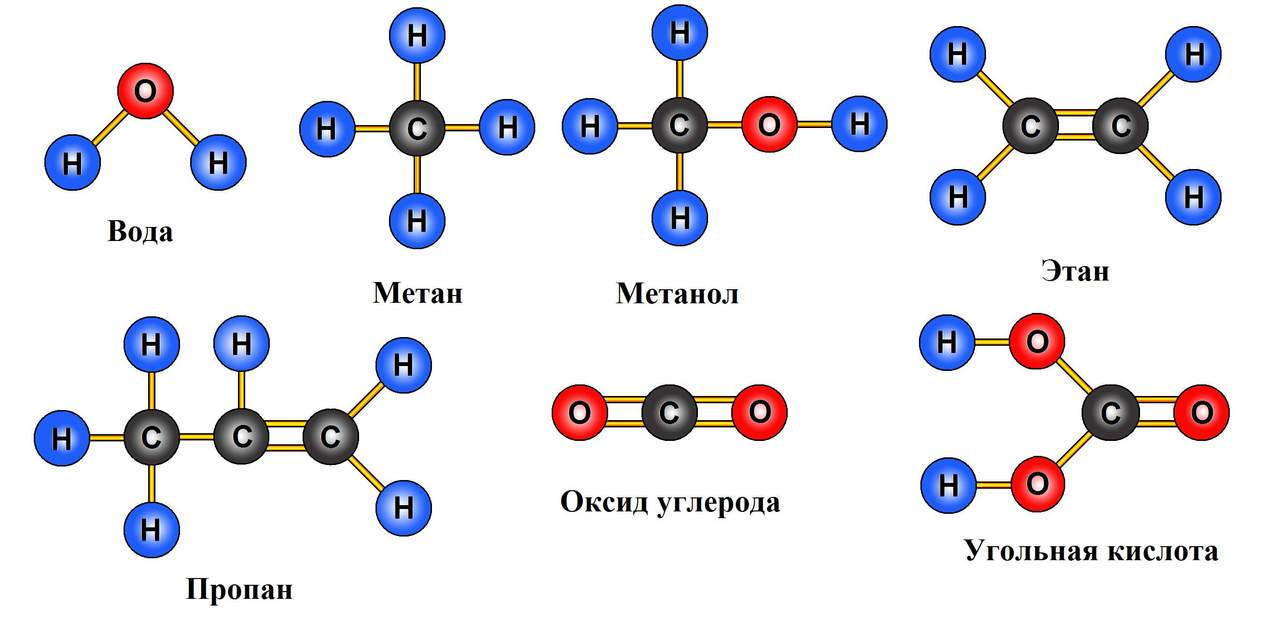
Рис. 3. Названия неразветвленных алканов
Названия неразветвленных алканов с пятью и более атомами углерода в молекуле образованы от греческих числительных, отражающих это число атомов углерода.
Суффикс -ан показывает принадлежность вещества к насыщенным соединениям.
Составляя названия разветвленных алканов по номенклатуре ИЮПАК, в качестве основной цепи выбирают цепь, содержащую максимальное число атомов углерода. Основную цепь нумеруют таким образом, чтобы заместители получили наименьшие номера. Если цепей одинаковой длины несколько, то главной выбирают цепь, содержащую наибольшее число заместителей. См.рис. 4–6.

Рис. 4. 2-метилбутан

Рис. 5. 2,3-диметил-3-этилпентан

Рис. 6. 2,3,4-триметил-3-изопропилгептан
Температуры плавления и кипения в целом увеличиваются с увеличением числа атомов С в молекуле. Первые представители ряда алканов – газы при н.у., алканы, содержащие от 5 до 15 атомов С – обычно жидкости, свыше 15 атомов С – твердые вещества.
Неразветвленные изомеры имеют более высокую температуру кипения, чем разветвленные (причина – разные силы межмолекулярного взаимодействия). Температуры плавления зависят, кроме того, от плотности упаковки молекул в кристалле. Табл. 1.
Табл. 1. Физические свойства алканов.
| Название вещества | Молеку-лярная формула | Структурная формула | Температура плавления, °С |
| Метан | СН4 | СН4 | –182 |
| Этан | С2Н6 | СН3-СН3 | –183 |
| Пропан | С3Н8 | СН3-СН2-СН3 | –188 |
| Бутан | С4Н10 | СН3-(СН2)2-СН3 | –138 |
| Изобутан (2-метилпропан) | С4Н10 | (СН3)2СН-СН3 | –160 |
| Пентан | С5Н12 | СН3-(СН2)3-СН3 | –130 |
| Изопентан (2-метилбутан) | С5Н12 | (СН3)2СН-СН2-СН3 | –160 |
| Неопентан (2,2-диметилпропан) | С5Н12 |
|
–17 |
| Гексан | С6Н14 | СН3-(СН2)4-СН3 | –95 |
| Гептан | С7Н16 | СН3-(СН2)5-СН3 | –91 |
| Октан | С8Н18 | СН3-(СН2)6-СН3 | –57 |
| Нонан | С9Н20 | СН3-(СН2)7-СН3 | –51 |
| Декан | С10Н22 | СН3-(СН2)8-СН3 | –30 |
| Гексадекан | С16Н34 | СН3-(СН2)14-СН3 | 18 |
| Эйкозан | С20Н42 | СН3-(СН2)18-СН3 | 36,7 |
Газообразные и твердые алканы не пахнут, жидкие алканы обладают характерным «бензиновым» запахом.
Все алканы бесцветны, легче воды и нерастворимы в ней. Алканы хорошо растворяются в органических растворителях, жидкие алканы (пентан, гексан) сами широко используются как растворители.
Подведение итога урока
На уроке была рассмотрена тема «Алканы. Строение молекул, номенклатура, физические свойства». Вы узнали о том, что представляют собой алканы (нециклические углеводороды, в которых атомы углерода соединены простыми связями), как их правильно обозначать и какими физическими свойствами обладают эти вещества.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Interneturok.ru (Источник).
2. Органическая химия (Источник).
3. Химик (Источник).
Домашнее задание
1. №№ 8, 9 (с. 22) Рудзитис Г.Е. , Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. М.: Просвещение, 2012.
2. Какой приставкой указывают в названии 4 одинаковых заместителя?
3. Как зависят физические свойства алканов от количества атомов углерода в цепи?
Источник: https://interneturok.ru/lesson/chemistry/10-klass/predelnye-uglevodorody/alkany-stroenie-molekul-nomenklatura-fizicheskie-svoystva
Что такое алканы
Алканами в химии называют предельные углеводороды, у которых углеродная цепь является незамкнутой и состоит из атомов углерода, связанных друг с другом при помощи одинарных связей.
Также характерной особенностью алканов есть то, что они совсем не содержат двойных либо тройных связей.
Порой алканы называют парафинами, дело в том, что парафины собственно и являются смесью предельных углеродов, то есть алканов.
Формула алканов
- Формулу алкана можно записать как:
- СnР2n+2
- При этом n больше или равно 1.
Изомерия алканов
Алканам свойственна изомерия углеродного скелета. При этом соединения могут принимать разные геометрические формы, как например это показано на картинке ниже.
Изомерия углеродного скелета алканов
С увеличением роста углеродной цепи увеличивается и количество изомеров. Так, например, у бутана есть два изомера.
Получение алканов
Алкан как правило получают различными синтетическими методами. Скажем, один из способов получения алкана предполагает реакцию «гидрирования», когда алканы добываются из ненасыщенных углеводов под воздействием катализатора и при температуре.
Физические свойства алканов
Алканы от других веществ отличаются полным отсутствием цвета, также они не растворим в воде. Температура плавления алканов повышается с увеличением их молекулярной массы и длины углеводородной цепи.
То есть чем более разветвленным является алкан, тем у него большая температура горения и плавления. Газообразные алканы и вовсе горят бледно-голубым или бесцветным пламенем, при этом выделяя много тепла.
Химические свойства алканов
Алканы в химическом плане малоактивные вещества, по причине прочности крепких сигма связей С-С и С-Н. При этом связи С-С неполярны, а С-Н малополярны.
А так как все это малополяризируемые виды связей, которые относятся к сигма виду, то разрываться они будут по механизму гомолитическому, в результате чего образуются радикалы.
И как следствия химические свойства алканов представляют собой в основном реакции радикального замещения.

Так выглядит формула химической реакции радикального замещения алканов (галогенирование алканов).
Помимо этого также можно выделить такие химические реакции как нитрирование алканов (реакция Коновалова).

Реакция эта протекает при температуре 140 С, причем лучше всего именно с третичным атомом углерода.
Крекинг алканов – эта реакция протекает при действии высоких температур и катализаторов. Тогда создаются условия, когда высшие алканы могут рвать свои связи образуя алканы более низкого порядка.

Окисление алканов – в различных условиях эта химическая реакция может привести к образованию спирта, альдегида и уксусной кислоты. При полном окислении реакция протекает вплоть до образования воды и углекислого газа.
Применение алканов
Алканы имеют широкое применение в таких промышленных сферах как синтез нефти, топлива и т. д.
Алканы, видео
И в завершение видео урок о сущности алканов.

При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник: https://www.poznavayka.org/himiya/alkanyi-opredelenie-stroenie-fizicheskie-i-himicheskie-svoystva/
Строение алканов и их особенности (CnH2n+2), схема
Алканы образуют гомологический ряд, каждое химическое соединение которого по составу отличается от последующего и предыдущего на одинаковое число атомов углерода и водорода – CH2, а вещества, входящие в гомологический ряд, называются гомологами.
При обычных условиях С1-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле.
Электронное строение алканов и их особенности
В молекулах алканов выделяют первичные (т.е. связанные одной связью), вторичные (т.е. связанные двумя связьями), третичные (т.е. связанные тремя связями) и четвертичные (т.е. связанные четырьмя связями) атомы углерода.
- C1H3 – C2H2 – C1H3 (1 – первичные, 2- вторичные атомы углерода);
- CH3 –C3H(CH3) – CH3 (3- третичный атом углерода);
- CH3 – C4(CH3)3 – CH3 (4- четвертичный атом углерода).
Атомы углерода в предельных углеводородах находятся в sp3 –гибридизации. Рассмотрим это на примере метана – CH4. Молекула метана в общем виде соответствует формуле AB4. Центральный атом – атом углерода, атомы водорода – лиганды. Запишем электронную конфигурацию атома углерода в основном состоянии и зарисуем его электронно-графическую формулу:
6C 1s22s22p2.

Чтобы принять четыре атома водорода, атому углерода необходимо перейти в возбужденное состояние:
Аналогичные операции произведем для атома водорода:
1H 1s1.
В гибридизацию вступают все валентные электроны углерода, следовательно, атом углерода находится в sp3-гибридизации. Углы между связями в молекулах алканов 109,5o (рис. 1).

Рис. 1. Строение молекулы метана.
- Для предельных углеводородов характерны структурная изомерия (изомерия углеродного скелета). Так, у пентана имеются следующие изомеры:
- CH3-CH2-CH2-CH2-CH3 (пентан);
- CH3 –CH(CH3)-CH2-CH3 (2-метилбутан);
- CH3-C(CH3)2-CH3 (2,2 – диметилпропан).
- Для алканов, начиная с гептана, характерна оптическая изомерия.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/ximiya/11-klass/stroenie-atoma/alkany/
Строение алканов
ЗНАНИЯ
- Органические соединения, в состав которых входят углерод и водород называются углеводородами (УВ).
- Алканами называют насыщенные углеводороды, имеющие линейное или разветвленное строение, в молекулах которых атомы углерода связаны одинарной связью.
- CnH2n+2 – общая формула алканов,
n–это число, определяющее количество атомов углерода в УВ. Например, в молекуле гексана содержится 6 атомов углерода. Тогда формула гескана будет выглядеть так: С6Н2·6+2, т.е С6Н14
В природе алканы проявляют химически слабую активность и поэтому их иногда называют парафинами, что означает в переводе с лат. «parrumaffinis» — «малоактивный»
Простейшими представителями этого класса являются: метан (СН4), пропан (С3Н8), бутан (С4Н10). Однако данные УВ не способны к реакциям присоединения, так как в их молекулах полностью использованы валентные возможности углерода и водорода.
- Электронное строение алканов рассмотрим на примере метана и этана.
- Известно, что молекулярная формула метана — СН4:
- С – С и С – Н
Как видно из структурной формулы, в его молекуле имеются два типа связи: ковалентная неполярная С – С и ковалентная слабополярная С – Н.
Ковалентно-слабополярной молекулой является, потому что атом углерода имеет бόльшую электроотрицательность в отличие от атома водорода (2,1), в связи с чем в молекуле метана происходит небольшое смещение электронных пар в сторону атома углерода. Электронное и структурное строение метана имеет следующий вид:
Далее необходимо рассмотреть пространственное строение молекулы, так как электронные и структурные формулы показывают лишь его химическое строение.
Однако, для того чтобы определить пространственное строение метана, необходимо вернуться к расположению его электронов по энергетическим уровням и подуровням и формам его электронных орбиталей.
Например, строение атома углерода имеет следующий вид:
Можно заметить, что на р-подуровне имеется свободная орбиталь, в связи, с чем ее может занять одна из 2s-электронов и тогда расположение электронов будет выглядеть уже так:
Полученное состояние углерода считается возбужденным, так как в его молекуле 4 электрона являются неспаренными, и, следовательно, атом углерода приобретает валентность 4.
На самом деле молекула метана имеет тетраэдрическую форму. Давайте разберемся почему. Пространственное распределение атомных орбиталей углерода зависит от типа его гибридизации. Возбужденное состояние углерода относится к sp3-гибридизации, т.е. в гибридизации участвуют один s-электрон и три p-электрона.
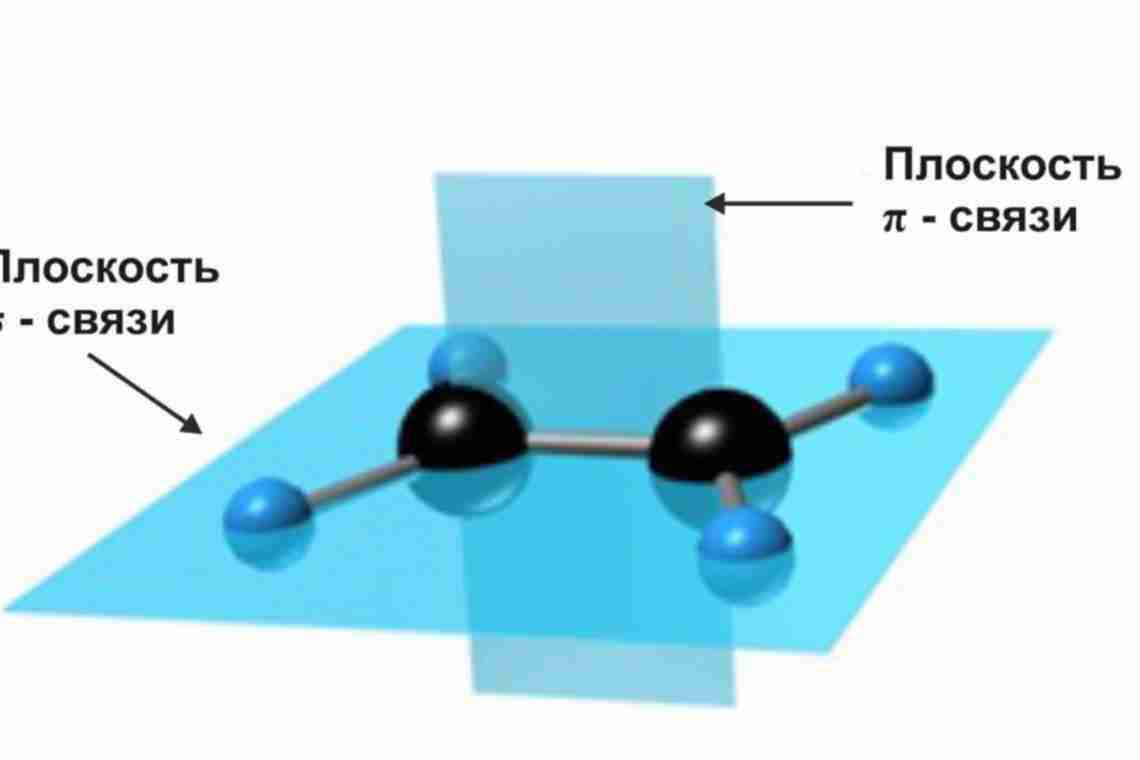
В молекуле метана каждая из четырех sp3-гибридных атомная орбиталь углерода участвует в осевом (s-) перекрывании с s- атомной орбиталью водорода или с sp3 атомной орбиталью другого атома углерода, образуя при этом σ-связи С – Н и С – С (рис. 1).
Рисунок 1 – σ-связи С – Н и С – С
Благодаря электростатическому отталкиванию атомные орбитали в пространстве расположены так, что их оси направлены к вершинам тетраэдра (σ-связи). Более подробно процесс гибридизации рассмотрен на рис. 2.
Рисунок 2 – sp3-гибридизация и молекула метана
Таким образом молекула метана (СН4) имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода. Валентный угол Н–С–Н равен 109о28’.
Аналогично метану рассматривается молекула этана(С2Н6) и другие простейшие представители алканов. В молекуле этана располагаются два тетраэдрических угла, относящиеся к sp3-гибридизации, при этом образуя более сложную пространственную конструкцию (рис. 3).
Рисунок 3 – Пространственное строение этана
Обратите внимание, что в пространственной структуре молекулы этана образовано уже семь σ-связей, одна из которых расположена между двумя атомами углерода перекрыванием двух гибридных атомных орбиталей и шесть σ-связей – между атомами углерода и водорода.
Молекулы, имеющие в себе свыше двух атомов углерода, характеризуются зигзагообразными формами. Рассмотрим такой пример на молекуле пропана (С3Н8).
В этом случае направление химической связи между вторым и третьим атомами углерода не совпадают с направлением связи между первым и вторым атомами углерода. Точно такие же углы образуются и между четвертым, пятым и другими атомами углерода. Валентный угол — 109о28’.
Таким образом получается изогнутая форма в виде зигзага. Однако в структурных формулах таких молекул данные углы не обозначают.
СН3 – СН2 – СН3
Структурная формула пропана
Рисунок 4 – Пространственная структура пропана (зигзагообразная)
Источник: http://uchilegko.info/chemistry/stroenie-alkanov
Алканы: строение и химические свойства, получение насыщенных углеводородов
Углеводороды представляют собой простейшие органические соединения. Их составляют углерод и водород. Соединения этих двух элементов называются предельными углеводородами или алканами. Их состав выражается общей для алканов формулой CnH2n+2, где n — количество атомов углерода.
…
- Вконтакте
- Google+
- Мой мир
Оглавление:
- Гомологический ряд предельных углеводородов
- Номенклатура насыщенных углеводородов, их производные
- Алканы: химические свойства
- Получение метана
Алканы — международное наименование данных соединений. Также эти соединения называют парафинами и насыщенными углеводородами. Связь в молекулах алканов простая (или одинарная). Остальные валентности насыщены атомами водорода. Все алканы насыщены водородом до предела, его атомы находятся в состоянии sp3-гибридизации .
Гомологический ряд предельных углеводородов
Первым в гомологическом ряду насыщенных углеводородов стоит метан. Его формула CH4. Окончание -ан в наименовании предельных углеводородов являет отличительным признаком. Далее в соответствии с приведенной формулой в гомологическом ряду располагаются этан — C2H6, пропан C3H8, бутан — C4H10.
С пятого алкана в гомологическом ряду названия соединений образуются следующим образом: греческое число, указывающее число атомов углеводорода в молекуле + окончание -ан. Так, по-гречески число 5 — пэндэ, соответственно за бутаном идет пентан — C5H12. Далее — гексан C6H14. гептан — C7H16, октан — C8H18, нонан — C9H20, декан — C10H22 и т. д.
Физические свойства алканов заметно изменяются в гомологическом ряду: увеличивается температура плавления, кипения, увеличивается плотность. Метан, этан, пропан, бутан при обычных условиях, т. е.
при температуре равной примерно 22 градуса тепла по Цельсию, являются газами, с пентана по гексадекан включительно — жидкостями, с гептадекана — твердыми веществами.
Начиная с бутана, у алканов есть изомеры.
Это интересно: нуклеотид это что такое? Его строение, масса, длина и последовательность.
Существуют таблицы, отражающие изменения в гомологическом ряду алканов, которые наглядно отражают их физические свойства.
Номенклатура насыщенных углеводородов, их производные
Если происходит отрыв атома водорода от молекулы углеводорода, то образуются одновалентные частицы, которые называют радикалами (R). Название радикалу дает то углеводород, из которого этот радикал произведен, при этом окончание -ан меняется на окончание -ил. Например, из метана при отрыве атома водорода образуется радикал метил, из этана — этил, из пропана — пропил и т. д.
Радикалы также образуются и неорганическими соединениям. Например, отняв у азотной кислоты гидроксильную группу ОН, можно получить одновалентный радикал -NO2, который называется нитрогруппой.
При отрыве от молекулы алкана двух атомов водорода образуется двухвалентные радикалы, названия которых также образуются из названия соответствующих углеводородов, но окончание меняется на:
- илиен, в том случае, если атомы водорода оторваны от одного атома углерода,
- илен, в том случае, если от двух атомы водорода оторваны от двух соседних атомов углерода.
Алканы: химические свойства
Рассмотрим реакции, характерные для алканов. Всем алканам присущи общие химические свойства. Данные вещества являются малоактивными.
Все известные реакции с участием углеводородов подразделяются на два вида:
- разрыв связи С-Н (примером может служить реакция замещения);
- разрыв связи С-С (крекинг, образование отдельных частей).
Очень активны в момент образования радикалы. Сами по себе они существуют доли секунды. Радикалы легко вступают в реакции между собой. Их неспаренные электроны образуют новую ковалентную связь. Пример: CH3 + CH3 → C2H6
Радикалы легко вступают в реакции с молекулами органических веществ.
Они либо присоединяются к ним, либо отрывают от них атом с неспаренным электроном, в результате чего появляются новые радикалы, которые, в свою очередь, могут вступать в реакции с другими молекулами.
При такой цепной реакции получаются макромолекулы, которые перестают расти только тогда, когда оборвется цепь (пример: соединение двух радикалов)
Реакции свободных радикалов объясняют многие важные химические процессы, такие как:
- Взрывы;
- Окисления;
- Крекинг нефти;
- Полимеризацию непредельных соединений.
Подробно можно рассмотреть химические свойства насыщенных углеводородов на примере метана. Выше мы уже рассматривали строение молекулы алкана. Атомы углерода находятся в молекуле метана в состоянии sp3-гибридизации , и образуется достаточно прочная связь. Метан представляет собой газ баз запаха и цвета. Он легче воздуха. В воде малорастворим.
Алканы могут гореть. Горит метан синеватым бледным пламенем. При этом результатом реакции будут оксид углерода и вода.
При смешивании с воздухом, а также в смеси с кислородом, особенно если соотношение объемов будет 1:2, данные углеводород образует взрывчатые смеси, из-за чего он крайне опасен для применения в быту и шахтах.
Если метан сгорает не полностью, то образуется сажа. В промышленности ее таким образом и получают.
Из метана получают формальдегид и метиловый спирт путем его окисления в присутствии катализаторов. Если же метан сильно нагреть, то он распадается по формуле CH4 → C + 2H2
Распад метана можно осуществить до промежуточного продукта в специально оборудованных печах. Промежуточным продуктом будет ацетилен. Формула реакции 2CH4 → C2H2 + 3H2. Выделение ацетилена из метана сокращает расходы производства почти в два раза.
Также из метана получают водород, производя конверсию метана с водяным паром. Характерными для метана являются реакции замещения.
Так, при обычной температуре, на свету галогены (Cl, Br) по стадиям вытесняют водород из молекулы метана. Таким образом образуются вещества, называемые галогенопроизводными.
Атомы хлора, замещая в молекуле углеводорода атомы водорода, образуют смесь разных соединений.
В такой смеси присутствуют хлорметан (CH3 Cl или хлористый метил), дихлорметан (CH2Cl2или хлористый метилен), трихлорметан (CHCl3 или хлороформ), тетрахлорметан (CCl4 или четыреххлористый углерод).
Любое из этих соединений может быть выделено из смеси. В производстве важное значение отводится хлороформу и тетрахлорметану, в силу того, что они являются растворителями органических соединений (жиров, смол, каучука). Галогенопроизводные метана образуются по цепному свободнорадикальному механизму.
Свет воздействует на молекулы хлора, вследствие чего они распадаются на неорганические радикалы, которые отрывают атом водорода с одним электроном от молекулы метана. При этом образуется HCl и метил. Метил реагирует с молекулой хлора, в результате чего получается галогенопроизводное и радикал хлора. Далее радикал хлора продолжает цепную реакцию.
При обычной температуре метан обладает достаточной стойкостью к щелочам, кислотам, многим окислителям. Исключение — азотная кислота. В реакции с ней образуется нитрометан и вода.
Реакции присоединения для метана не характерны, т. к. все валентности в его молекуле насыщены.
Реакции, в которых участвуют углеводороды могут проходить не только с расщеплением связи С-Н , но и с разрывом связи С-С . Такие превращения происходят при наличии высоких температур и катализаторов. К таким реакциям относятся дегидрогенизация и крекинг.
Из насыщенных углеводородов путем окисления получают кислоты — уксусную (из бутана), жирные кислоты (из парафина).
Получение метана
В природе метан распространен достаточно широко. Он — главная составная часть большинства горючих природных и искусственных газов. Он выделяется из каменноугольных пластов в рудниках, со дна болот.
Природные газы (что очень заметно в попутных газах нефтяных месторождений) содержат не только метан, но и другие алканы. Применение этих веществ разнообразно.
Они используются как топливо, на различных производствах, в медицине и технике.
В условиях лаборатории данный газ выделяют при нагревании смеси ацетат натрия + гидроксид натрия, а также реакцией карбида алюминия и воды. Также метан получают из простых веществ. Для этого обязательными условиями являются нагрев и катализатор. Промышленное значение имеет получение метана синтезом на основе водяного пара.
Метан и его гомологи могут быть получены при прокаливании солей соответствующих органических кислот с щелочами. Еще одним способом получения алканов является реакция Вюрца, при которой нагреваются моногалогенопроизводные с металлическим натрием. Онтология читайте у нас на сайте.
Источник: https://obrazovanie.guru/himiya/alkany-predelnye-uglevodorody-ih-himicheskie-svojstva.html
План занятия Лекция. 1. Понятие АЛКАНЫ. Общая формулы. 2. Особенности строения молекул АЛКАНОВ. 3. Гомологический ряд. Номенклатура. 4. Изомерия. 5. Получение. — презентация
1
2 План занятия Лекция. 1. Понятие АЛКАНЫ. Общая формулы. 2. Особенности строения молекул АЛКАНОВ. 3. Гомологический ряд. Номенклатура. 4. Изомерия. 5. Получение в лаборатории и промышленности. 6. Физические свойства. 7. Химические свойства. 8. Применение. 9. Генетическая связь. Выполнение упражнений.
3 Алканы- соединения с открытой цепью, где атомы углерода соединены друг с другом простыми (одинарными) связями, а свободные связи насыщены атомами водорода. Общая формула АЛКАНОВ C n H 2n+2. В обычных условиях алканы мало реакционноспособны, откуда возникло их название «парафины» – от лат. Parrumaffinis – малоактивный.
4 Простейшим представителем насыщенных углеводородов является метан, структурная формула которого H I H – C – H I H H I H – C – H I H Строение молекул алканов
5 Строение молекулы метана sp 3 — гибридизация характерна для атомов sp 3 — гибридизация характерна для атомов углерода в (алканах) – в частности, в метане. Атом углерода в молекуле метана расположен в центре тетраэдра, атомы водорода – в его вершинах, все валентные углы между направлениями связей равны между собой и составляют угол 109°28'. Длинна связи (С-С) = 0,154 нм.
6 Формула Название СН 3 МЕТИЛ С 2 Н 5 ЭТИЛ С 3 Н 7 ПРОПИЛ С 4 Н 9 БУТИЛ С 5 Н 11 ПЕНТИЛ С 6 Н 13 ГЕКСИЛ С 7 Н 15 ГЕПТИЛ С 8 Н 17 ОКТИЛ С 9 Н 19 НОНИЛ С 10 Н 21 ДЕЦИЛ Гомологические ряды Алканы С СС СnН2n+2 Радикалы С СС СnН2n+1 Формула Название СН 4 МЕТАН С 2 Н 6 ЭТАН С 3 Н 8 ПРОПАН С 4 Н 10 БУТАН С 5 Н 12 ПЕНТАН С 6 Н 14 ГЕКСАН С 7 Н 16 ГЕПТАН С 8 Н 18 ОКТАН С 9 Н 20 НОНАН С 10 Н 22 ДЕКАН
7 Изомерия Первые три члена гомологического ряда алканов – метан, этан, пропан – не имеют изомеров. Первые три члена гомологического ряда алканов – метан, этан, пропан – не имеют изомеров. Четвертый член – бутан отличается тем, что имеет два изомера. Четвертый член – бутан отличается тем, что имеет два изомера.
Число изомеров возрастает с увеличением в молекуле углеводорода числа углеродных атомов. Так, у пентана их 3, у гексана — 5, у гептана — 9, у октана — 18, нонана — 35, а у декана – уже 75.
Вид изомерии, при которой вещества отличаются друг от друга порядком связи атомов в молекуле, называется структурной изомерией углеродного скелета. Число изомеров возрастает с увеличением в молекуле углеводорода числа углеродных атомов.
Так, у пентана их 3, у гексана — 5, у гептана — 9, у октана — 18, нонана — 35, а у декана – уже 75.
Вид изомерии, при которой вещества отличаются друг от друга порядком связи атомов в молекуле, называется структурной изомерией углеродного скелета.
8 Получение в промышленности 1) Предельные углеводороды от C 1 до C 11 выделяют фракционной перегонкой нефти, природного газа. 2) Гидрирование угля под давлением, в присутствии катализаторов (железо, кобальт, никель) при повышенной температуре. C + 2 H 2 ––400°С,p CH 4
9 3) Гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля). CH 2 =CH 2 + H 2 ––kat CH 3 –CH 3 + H 2 ––Pd CH 3 –CH 2 –CH 3 + H 2 ––Pd CH 3 –CH 2 –CH 3 Получение в промышленности
10 4) Реакция Вюрца, действие металлического натрия на моногалогенопроизводные углеводороды. 2CH 3 –CH 2 Br + 2Na CH 3 –CH 2 –CH 2 – CH 3 бромэтан — 2NaBr Получение в промышленности
11 Получение в лаборатории 5) Декарбоксилирование солей карбоновых кислот при сплавлении их со щелочами. Так получают метан при нагревании ацетата натрия с гидроксидом натрия. CH 3 COONa + NaOH ––t° CH 4 + Na 2 CO 3
12 Получение в лаборатории 6) Метан также можно получить гидролизом карбида алюминия. Al 4 C H 2 O 3CH 4 + 4Al(OH) 3
13 Физические свойства В обычных условиях C 1 –C 4 – газы, C 5 –C 17 – жидкости, с C 18 – твердые вещества. Температуры плавления и кипения алканов их, Плотности увеличиваются с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями.
14 Физические свойства НазваниеФормула t°пл., °С t°кип., °С МетанCH ,5-161,5 ЭтанC2H6C2H6 -182,8 -88,6 ПропанC3H8C3H8 -187,6 -42,1 БутанC 4 H ,3-0,5 ИзобутанCH 3 –CH(CH 3 )–CH ,4 -11,7 ПентанC 5 H ,7 36,07 Изопентан(CH 3 ) 2 CH–CH 2 –CH ,9 27,9 НеопентанCH 3 –C(CH 3 ) 3 -16,6 9,5
15 Химические свойства Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия.
Для алканов свойственны реакции замещения водородных атомов и расщепления. Эти реакции вследствие прочности связей C–C и C–H протекают или при нагревании, или на свету, или с применением катализаторов.
Рассмотрим некоторые примеры реакций этого типа.
16 Химические свойства 1) Галогенирование. Это одна из характерных реакций предельных углеводородов. Наибольшее практическое значение имеют бромирование и хлорирование алканов. CH 4 +Cl 2 CH 3 Cl + HCl CH 4 +Cl 2 CH 3 Cl + HCl CH 3 Cl +Cl 2 CH 2 Cl 2 + HCl CH 2 Cl 2 +Cl 2 CHCl 3 + HCl CHCl 3 +Cl 2 CCl 4 + HCl свет
17 Химические свойства 2) Нитрование. (реакция М.И.Коновалова). CH 3 –CH 2 –CH 3 (пропан) + HNO 3 CH 3 –CH 2 –CH 3 (пропан) + HNO 3 CH 3 –CH–CH 3 (2-нитропропан) + H 2 O I NO 2 CH 3 –CH–CH 3 (2-нитропропан) + H 2 O I NO 2 t, kt
18 Химические свойства 3) Крекинг – расщепление при высокой температуре в присутствии катализаторов. При крекинге происходит образование насыщенных и ненасыщенных углеводородов с более короткими цепями.
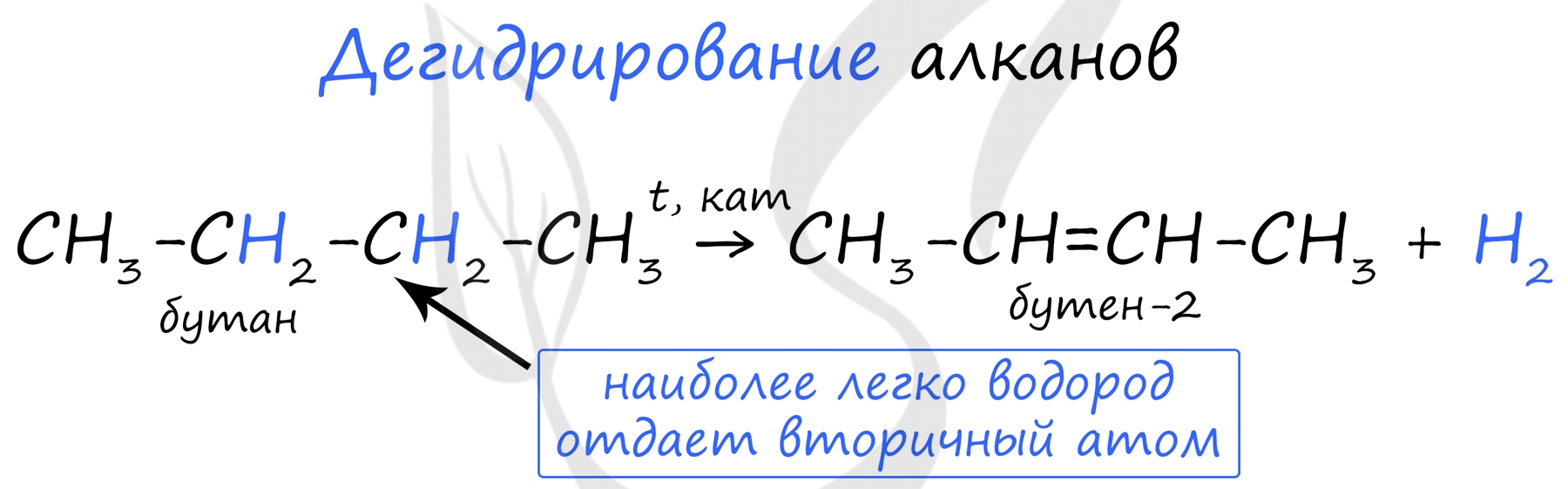
CH 3 –CH 2 –CH 2 –CH 3 (бутан) CH 3 –CH 2 –CH 2 –CH 3 (бутан) CH 3 –CH 3 (этан) + CH 2 =CH 2 (этилен) CH 3 –CH 3 (этан) + CH 2 =CH 2 (этилен) Повышение температуры процесса ведет к более глубоким распадам углеводородов и, в частности, к дегидрированию, т.е. к отщеплению водорода.
Так, метан при 1500ºС приводит к ацетилену. 2CH 4 H–C C–H (ацетилен) + 3H 2 2CH 4 H–C C–H (ацетилен) + 3H 2 t, kt
19 Химические свойства 4) Изомеризация. Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации — перестройке углеродного скелета с образованием алканов разветвленного строения. CH 3 –CH 2 –CH 2 –CH 2 –CH 3 CH 3 –CH 2 –CH 2 –CH 2 –CH 3 CH 3 –CH–CH 2 –CH 3 CH 3 –CH–CH 2 –CH 3 I CH 3 I CH 3 t, kt
20 Химические свойства 5) Окисление. В обычных условиях алканы устойчивы к действию кислорода и окислителей. При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду и выделяя большое количество тепла. CH 4 + 2O 2 CO 2 + 2H 2 O t
21 Применение Алканы – ценное высококалорийное топливо. Сжигание алканов дает тепло, свет, а также приводит в движение многие машины. Первый в ряду алканов – метан – является основным компонентом природных и попутных газов и широко используется в качестве промышленного и бытового газа. Перерабатывается в промышленности в ацетилен, газовую сажу, фторо- и хлоропроизводные.
Низшие члены гомологического ряда используются для получения соответствующих непредельных соединений реакцией дегидрирования. Смесь пропана и бутана используется в качестве бытового топлива. Средние члены гомологического ряда применяются как растворители и моторные топлива. Высшие алканы используются для производства высших жирных кислот, синтетических жиров, смазочных масел и т.д.
22 С2Н6С2Н6 С6Н6С6Н6 С2Н4С2Н4 С2Н2С2Н2 С 6 Н
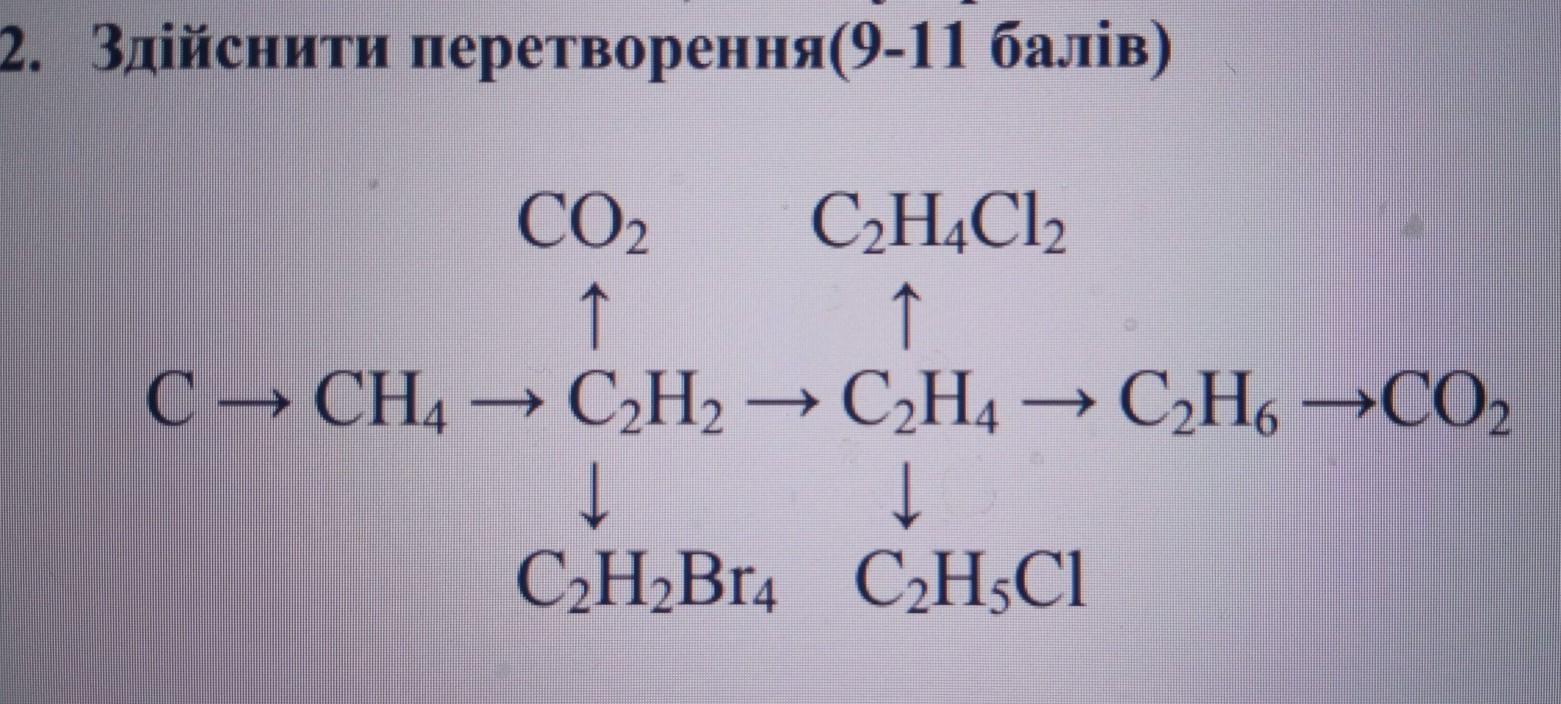
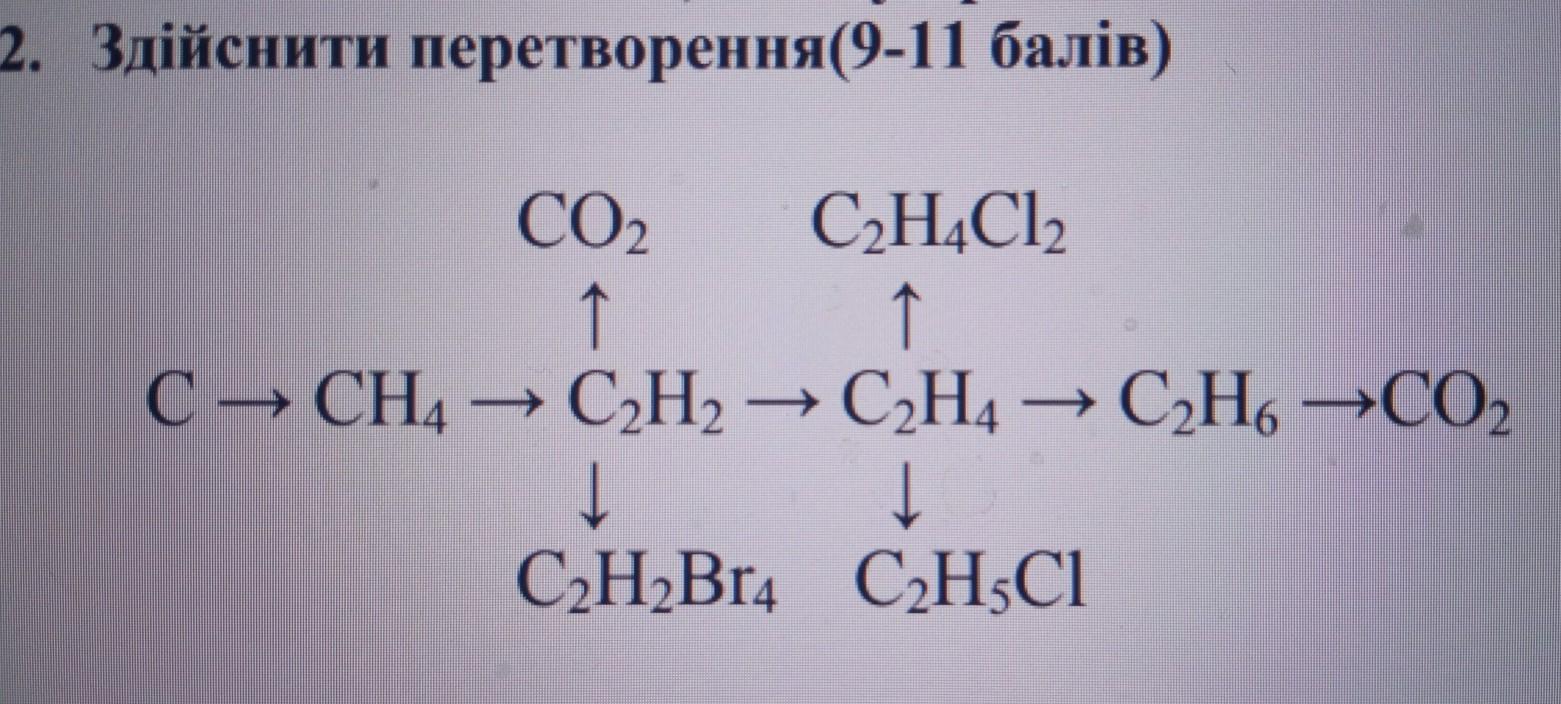
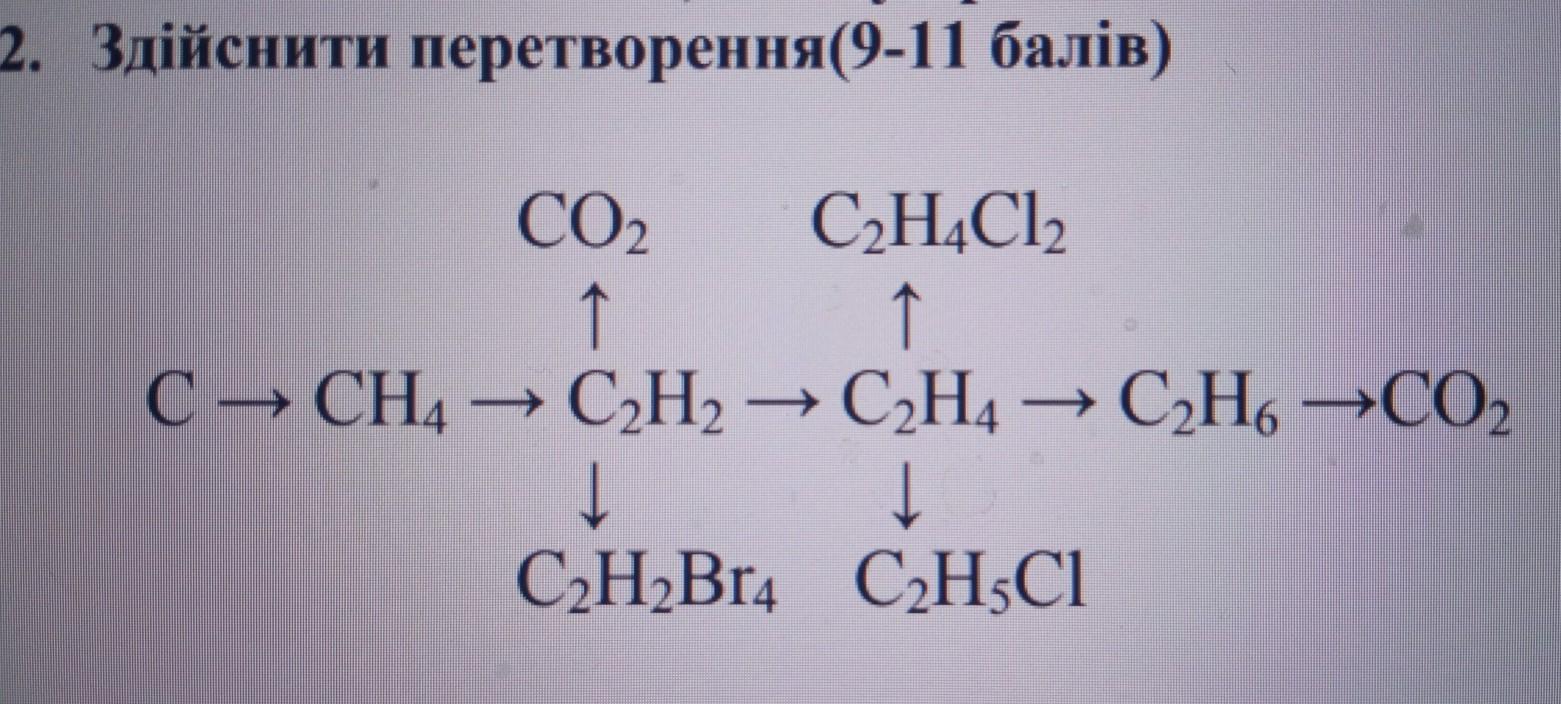
23 Al 4 C 3 Al 4 C 3 C CH 4 C 2 H 2 C 2 H 4 C 2 H 6 C CH 4 C 2 H 2 C 2 H 4 C 2 H 6 C 2 H 5 Cl C 4 H 10 изобутан C 2 H 5 Cl C 4 H 10 изобутан C 2 H 6 C 2 H 6 Осуществить превращения: Задание 1.
24 Выполнение упражнений. 1. Что такое электронные орбитали? Какие они бывают? Поясните примерами. 2. Что такое гибридные орбитали? Разъясните термин «гибридные орбитали» на примере молекулы метана. 3. Составьте уравнения химических реакций хлорирования метана.
Назовите полученные вещества и области их применения. 4. Составьте уравнения реакций, которые характеризуют химические свойства метана. 5. Что означает термин «sp3- гибридизация»? Ответ поясните. 6.
Запишите уравнения химических реакций получения метана: а) в лаборатории, б) в промышленности.
Источник: http://www.myshared.ru/slide/576479/




