



Категория: Тепловой баланс
Задача 1. Сколько нужно килограммов льда, чтобы охладить воду в ванне от до ? Объем воды 100 л. Температура льда .
Тепло от воды передается льду и он тает. Потом получившаяся при таянии льда вода нагревается до . Поэтому ![]() . Запишем количество теплоты, отдаваемой водой:
. Запишем количество теплоты, отдаваемой водой: ![]() . Количество теплоты, требуемое для расплавления льда: . Количество теплоты, требуемое для подогрева воды из растаявшего льда равно
. Количество теплоты, требуемое для расплавления льда: . Количество теплоты, требуемое для подогрева воды из растаявшего льда равно ![]() – масса воды, получившейся изо льда, равна массе льда, а вот объем – нет.
– масса воды, получившейся изо льда, равна массе льда, а вот объем – нет.
![]()
Удельная теплоемкость воды – Дж/(кг К), удельная теплоемкость льда – Дж/(кг К). Вода объемом 100 л имеет массу 100 кг. Удельная теплота плавления льда – Дж/кг.
- Вода изменяет температуру с до : .
- Вода, полученная при таянии льда имеет температуру , и нагревается до – .
- Ответ: 11,68 кг.
Задача 2. Ванну емкостью 100 л необходимо заполнить водой, имеющей температуру . Для этого используют воду температурой и лед, взятый при температуре . Определите массу льда, который необходимо положить в ванну.
Температура теплового равновесия – . Вода в ванне остынет до этой температуры, то есть . При остывании вода отдаст количество теплоты: . Лед, прежде чем начнет таять, должен согреться до . .
На это пойдет количество тепла, равное . Потом лед будет таять: . Затем полученная изо льда вода нагреется от до . .
На это нужно Дж – здесь указана масса льда, так как масса воды будет равна массе льда.
Удельная теплоемкость воды – Дж/(кг К), удельная теплоемкость льда – Дж/(кг К). Удельная теплота плавления льда – Дж/кг.
- Потребуется второе уравнение: .
- Ответ: масса льда – 30 кг.
Задача 3. В теплоизолированный откачанный сосуд объемом 11 л положили рядом кусок льда массой 1 кг и кусок меди массой 3 кг. Температура льда . Определите начальную температуру меди, если в конце процесса в сосуде установилось тепловое равновесие при температуре .
- Медь отдает тепло , которое идет на: а) плавление льда – ; б) нагрев воды – ; в) испарение воды – .
Удельная теплоемкость воды – Дж/(кг К), удельная теплоемкость льда – Дж/(кг К), удельная теплоемкость меди – Дж/(кг К). Удельная теплота плавления льда – Дж/кг. Удельная теплота парообразования – Дж/кг.
Здесь – так как начальную температуру мы не знаем, а конечная – 100. И начальная явно больше, а мы договорились, что будем вычитать из большей – меньшую.
- Здесь – так как вода нагрелась от до .
В последнем равенстве мы не знаем массу пара, но можем ее определить. Пар, очевидно, насыщенный – вода кипит в закрытом сосуде. Плотность такого пара определим по таблице, она составляет г/м. Объем пара – объем сосуда, не занятый медью и водой. Определим объем меди данной массы, если ее плотность равна кг/м:
Мы получили объем в м, в литрах это 0,34. Объем воды массой 1 кг – 1 л. Таким образом, в сосуде будет свободного для пара пространства – л. Масса пара такого объема очень мала: г – определить плотность пара можно по таблице давлений насыщенного пара.
- Ответ:
Задача 4. В калориметр налито 2 кг воды при температуре и положен кусок льда массой 5 кг, имеющий температуру . Определите температуру и объем содержимого калориметра после установления теплового равновесия. Теплоемкостью калориметра и теплообменом с окружающей средой пренебречь.
Очевидно из условия, что вода будет охлаждаться, а лед – наоборот, получать энергию от воды. Возможно, что вода начнет замерзать – это значит, тепло выделяется. Потом проверим, так ли это. Уравнение теплового баланса:
– вода охлаждается. Допустим, до нулевой температуры, тогда .
– лед согревается. Пусть до нулевой температуры, тогда .
Если вода замерзает, то . Определим последнее количество теплоты – ведь мы только предположили, что вода начнет замерзать, но пока в этом не уверены.
Проверим, получится ли такое число джоулей при умножении массы воды на удельную теплоту плавления льда: – очевидно, что равенство не соблюдается. Поэтому делаем вывод: вода начала замерзать, но замерзла не вся, а только часть ее. В процессе кристаллизации температура остается постоянной, поэтому ответ на первый вопрос задачи найден: температура смеси . Определим, какая часть воды замерзла:
Получается, что замерзнет 1,14 кг воды.
Также, раз температура нулевая, то лед не растаял. Тогда в сосуде находится кг воды, а это 0,86 л, и кг льда. Если 1 кг воды – это 1 л, то лед обладает меньшей плотностью, поэтому его объем равен:
м, или 6,82 л. Тогда общий объем смеси равен л.
Ответ: температура смеси , объем 7,68 л.
Задача 5. В куске льда, температура которого , сделано углубление объемом 160 см. В это углубление налили 60 г воды температурой . Какой объем будет иметь свободное от воды углубление, когда вода остынет?
Не сказано, что вода замерзла, поэтому место в лунке займет налитая остывшая вода – а это 60 мл, или 60 см. Теплая вода растопит немного льда в лунке. Так как тепло воды подтопит часть льда и он превратится в воду, объем которой меньше, чем льда, то надо посчитать, какой объем льда растаял и какую часть освободившегося пространства заняла вода, которой стал этот подтаявший лед.
– вода охлаждается. До нулевой температуры, поэтому .
- – лед тает.
- Уравнение теплового баланса:
Льда растает 57 г. То есть талой воды из него образуется 57 мл, или 57 см. Вычислим, какой объем этот лед занимал, когда был льдом:
- м, или 0,0632 л, или 63,2 см. Тогда: 60 см – займет налитая в лунку вода, 63,2 см – освободит пространства растаявший лед, 57 см – займет получившаяся из льда вода:
- Ответ: 106,2 см.
Задача 6. В калориметр, содержащий 100 г льда при температуре , впущено 100 г пара при температуре . Какая температура установится в калориметре? Какова масса полученной воды?
На растапливание льда пойдет Дж тепла. Потом вода, полученная при таянии льда, будет нагреваться. На это понадобится
Дж. Пар будет конденсироваться – именно он отдаст тепло, которое пойдет на растапливание льда и нагрев воды. Он может отдать количество тепла – если весь превратится в воду. Но это не обязательно так, может быть так, что только часть пара сконденсируется, а часть – нет. Определим количества теплоты и :
Сопоставив сумму первых двух с третьим, понимаем, что даже если вода нагреется от до , . То есть лед растает, полученная вода закипит и все равно останется «лишнее» тепло. А это значит, что не весь пар будет конденсироваться, а только часть. Определим, какая это будет часть:
Получаем, что достаточно конденсации только 33 г пара, чтобы и растопить лед, и нагреть воду до . Поскольку во время конденсации температура не меняется, то в калориметре будет температура . А воды получится: 100 г – изо льда и 33 г – из пара, всего 133 г.
Ответ: , 133 г.
Источник: https://easy-physic.ru/teplovoj-balans/
Уравнение теплового баланса
- Нагревание и охлаждение
- Этот процесс характеризуется изменением температуры системы. Количество теплоты определяется по формуле


 Удельная теплоемкость вещества с измеряется количеством теплоты, которое необходимо для нагревания единицы массы данного вещества на 1К=10С. Для нагревания 1кг стекла или 1кг воды требуется различное количество энергии. Удельная теплоемкость — табличная величина.
Удельная теплоемкость вещества с измеряется количеством теплоты, которое необходимо для нагревания единицы массы данного вещества на 1К=10С. Для нагревания 1кг стекла или 1кг воды требуется различное количество энергии. Удельная теплоемкость — табличная величина.
Теплоемкость вещества (тела) С — это количество теплоты, которое необходимо для нагревания тела без учета его массы на 1К.


При вычислении ΔT договоримся из большей температуры вычитать меньшую. Тогда количество теплоты будет всегда положительной величиной. Это уменьшает вероятность ошибки при сложении количества теплоты, выделяющегося при охлаждении с количеством теплоты выделяющимся, например, при кристаллизации.
- Горение
- Количество теплоты, которое выделяется при сгорании вещества


- Удельная теплота сгорания табличная величина.
- Плавление и кристаллизация
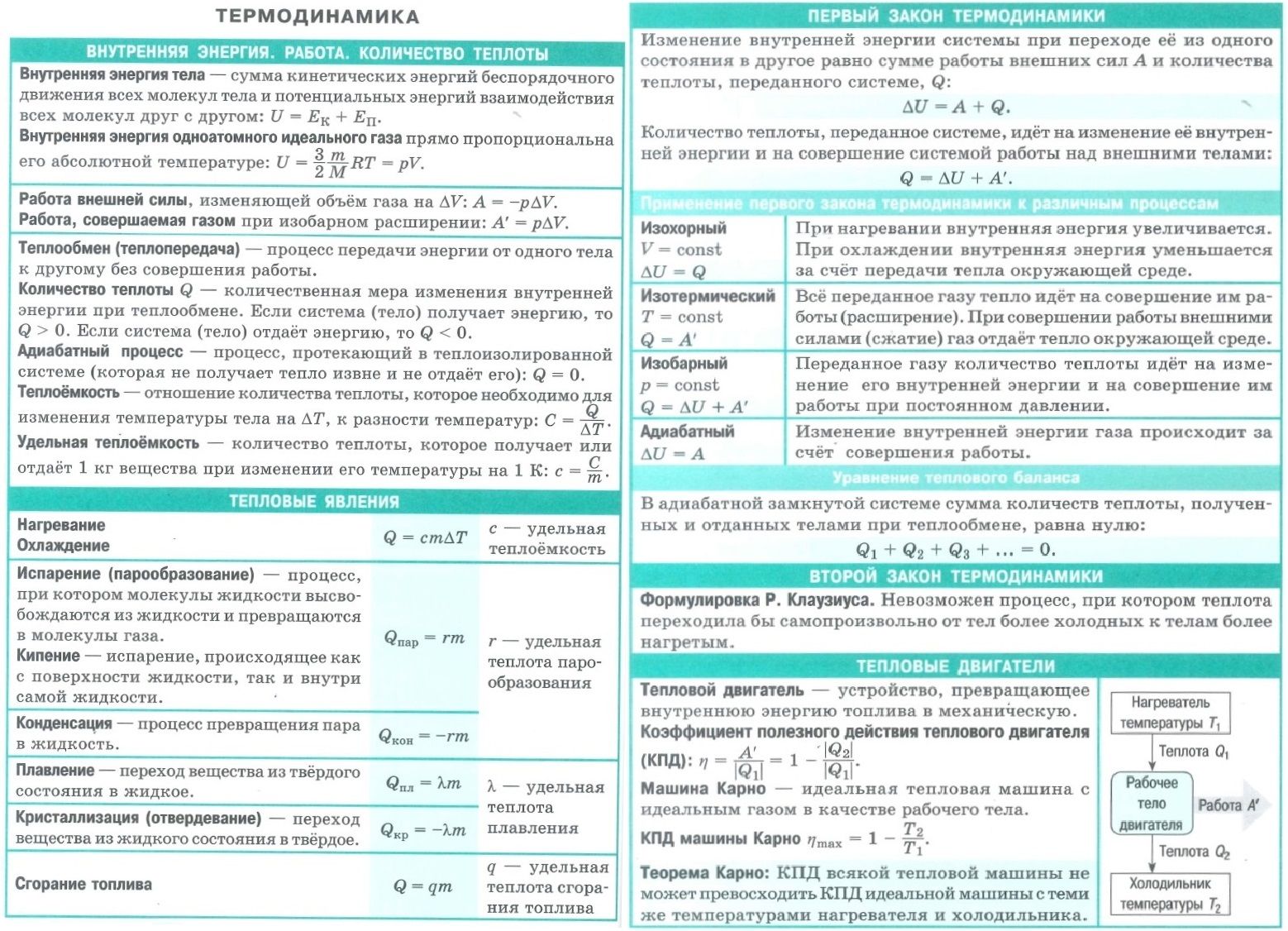
- Энергия, которая тратится на разрушение кристаллической решетки вещества, определяется по формуле


- Значение удельной теплоты плавления можно найти в таблицах.
- Парообразование (испарение или кипение) и конденсация
Парообразование — это переход вещества из жидкого (твердого) состояния в газообразное. Обратный процесс называется конденсацией.
- Удельная теплота парообразования табличная величина.
- Уравнение теплового баланса
Если мы рассмотрим изолированную (нет обмена энергией с окружающей средой) систему тел (твердых или жидких), в которой теплообмен может совершаться только между телами входящими в эту систему, то в результате этого процесса в системе установится тепловое равновесие. Температуры всех тел станут одинаковыми и равными некоторому значению Q.
В процессе теплообмена тела, начальные температуры которых больше Q («горячие» тела), будут отдавать свою энергию, а тела, у которых начальные температуры меньше Q, — получать энергию.
Из закона сохранения энергии (т.к. система изолированная) следует, что количество теплоты, потерянное телами с более высокой температурой, будет равно количеству теплоты, приобретенному телами с более низкими температурами.
Qотд=Qполуч где Qотд — количество теплоты, отданное «горячими» телами; Qполуч — количество теплоты, полученное «холодными» телами.
Это уравнение носит название уравнения теплового баланса. А положение, что количество теплоты, потерянное «горячими» телами, равно количеству теплоты, приобретенному «холодными телами» называется законом теплообмена.
В приведенном выше подходе при составлении уравнения теплового баланса мы везде из большего значения температуры должны вычитать меньшее, тогда значения количеств теплоты всегда были положительными.
«Виртуальный банк» тепла
Довольно часто встречаются задачи в которых требуется найти конечную температуру системы. Хорошо, если из контекста понятно в каких агрегатных состояниях будут находиться вещества после прекращения теплообмена. Тогда уравнение теплового баланса удается записать с первого раза.
Но если непонятно что получится в конце (например, вода, смесь вода+лед, смесь вода+пар и т.п.
) то приходится либо по очереди перебирать все варианты, находить конечную температуру и смотреть не противоречит ли она равновесному состоянию данной системы (к примеру, смесь вода+лед не будет существовать при +150С), либо поэтапно сравнивать отдельные количества теплоты и все время отвечать на вопросы… «хватит — не хватит?».
Но есть и другой подход, основанный на замечательном свойстве закона сохранения энергии – связывать начальные и конечные состояния системы независимо от процесса перехода.
Если система сложно шла к установлению теплового равновесия, то всегда можно представить весь переход в виде набора из нескольких элементарных процессов, расчет которых не вызывает труда. Пусть даже эти элементарные процессы заведомо не могут протекать в реальной жизни.
Окончательный результат (в данном случае, конечная температура) все равно окажется такой же, как и в случае одного сложного процесса.
Поясним на примере. Пусть произошла разгерметизация кастрюли-скороварки с перегретой водой. Масса воды в кастрюле m. Начальная температура T (T>Tкипения). Какая часть воды испарится?
Сколько тепла забирает/отдает перегретая вода не совсем ясно, зато мы умеем рассчитывать, сколько выделит эта вода при остывании и сколько тепла потребуется для испарения некоторой массы при температуре кипения. Тогда предложим схему некоторого виртуального банка тепла.
Предположим, что вся перегретая вода остынет до температуры кипения. Тогда она выделит некоторое Q1=mc(T-Tкипения). Временно «отправим» это тепло в банк. Теперь найдем сколько потребуется тепла для испарения некоторой массы mп при температуре кипения? Это легко Q2=mпL.
Если система теплоизолирована, то тепло на испарение мы можем взять только из виртуального банка. Q1=Q2. Окончательно .
Такой прием особенно выгодно применять в случае теплообмена большого количества тел (и нагревателей), для процессов со сложной и непонятной физикой теплообмена и для поиска конечной температуры системы.
В последнем случае, можно мысленно охладить всю систему до температуры самого холодного тела. Посчитать выделившееся при этом тепло и пустить его на нагревание сразу всей системы.
Рекомендуемые страницы:
Источник: https://poisk-ru.ru/s15079t8.html
Тепловой баланс двигателя автомобиля: уровнение, формула КПД
В теории двигателестроения много внимания уделяется газообмену и распределению тепла в процессе работы ДВС. Немаловажный аспект в понимании работы – тепловой баланс двигателя.
Базовые понятия
Тепловым балансом называют соотношение количества теплоты, выполнившее полезную работу, к теплоте, растраченной впустую. Под напрасной растратой подразумеваются потери теплоты на нагрев элементов окружающей среды. Топливный баланс может быть составлен в процентном соотношении либо в единицах энергии (калориях, джоулях).
В зависимости от преследуемых целее, уравнение теплового баланса позволяет подсчитать соотношение общего количества теплоты на 1 час работы, фиксированный цикл, на 1 кг израсходованного вещества либо на единицу получаемой продукции.
В области техники понятие применяется для анализа и изучения различного рода тепловых процессов, происходящих в двигателях внутреннего сгорания, газотурбинных установках, печах и т.д. Полученные из уравнения данные позволяют рассчитать коэффициент полезного действия как всего агрегата в целом, так и отдельных элементов установки.
Иными словами, расчет теплового баланса позволяет нам узнать, насколько эффективно внутри двигателя происходит сгорание топливовоздушной смеси (ТПВС).
Уравнение

Левая часть уравнения теплового баланса (Q) – общее количество теплоты, подведенного в двигатель с горючим, вторая часть показывает распределение теплотворной способности топлива, где
- Qe – количество полезного тепла. Показывает количество теплоты, израсходовавшейся на преобразование возвратно-поступательного движения поршня во вращательное движение коленчатого вала. Это и будет эффективно расходованная энергия.
- Qохл – тепло, растраченное на обогрев антифриза. В двигателях с воздушным охлаждением этот параметр будет обозначать потери на нагрев воздуха.
- Qгаз – количество теплоты, вышедшее из двигателя вместе с отработавшими газами.
- Qхим – потери тепла вследствие неполноты сгорания топлива.
- Qост – остаточные потери, не учтенные в остальных пунктах.
- Qм – передавая смазочным материалам теплота.

Если говорить о процентном выражении, то Q – 100% полученного тепла.
Процентное соотношение общего количества тепла к каждому виду потерь можно получить по формуле:
(QHp = Q)
 Эффективность двигателя внутреннего сгорания
Эффективность двигателя внутреннего сгорания
Большая часть теплоты при сгорании топлива уходит на нагрев поршня, стенок цилиндра и ГБЦ, но наибольшие потери происходят при выходе выхлопных газов. Именно поэтому использование выхлопа для раскручивания турбины повышает КПД двигателя внутреннего сгорания.
Большая часть полезной работы затрачивается на преодоления трения, сжатия пружин и насосные потери, связанные с перекачиванием технических жидкостей (моторного масла, жидкости ГУР).
Под потерями на трение подразумевается не только сопротивление движению поршней, вращению коленчатого и распределительного валов, но и, к примеру, затрачиваемое усилие на вращение шкива генератора.

КПД конкретной модели двигателя зависит от многих параметров, но в целом можно сказать, что бензиновые агрегаты имеют эффективность в районе 20-25%, тогда как показатель атмосферных ДВС цикла Дизеля достигает 40%. Установка турбонагнетателя на дизельный двигатель позволяет получить внушительные 50-53% эффективности.
Борьба с потерями
Можно выделить 3 основные способа потери полезной энергии:
- топливная эффективность (порядка 25% всех потерь). Как бы ни старались конструкторы, но сжечь полностью порцию топлива и получить близкую к максимально возможной отдачу на современной стадии двигателестроения невозможно;
- тепловые потери в процентном эквиваленте достигают 35% от общей эффективности;
- механические потери, связанные с трением, насосными потерями (около 20%).
 Существует 2 основных способа получения большей отдачи от сгорания ТПВС: увеличить топливную эффективность и уменьшить потери. Чтобы получить большую отдачу от сгорания бензина, ТПВС нужно как можно сильнее сжать. Но в случае с бензиновыми двигателями мы натыкаемся на большую проблему – детонацию. Дизельным моторам детонация не страшна, но увеличение энергии приводит к чрезмерным нагрузкам на коленчатый вал, вкладыши коленвала и т.д. Поддерживать чрезвычайно высокую температуру в камере сгорания двигателя также нет возможности, так как детали ЦПГ, головки блока цилиндров имеют определенный коэффициент расширения. Изготовление деталей из сверхпрочных материалов удорожит себестоимость производства, сделав тем самым изготовление экономически невыгодным. Уменьшение потерь – действенный способ увеличения КПД двигателя. Именно желание уменьшить потери привело современное двигателестроение к облегчению деталей ЦПГ, уменьшению размера поршневых колец, ранней блокировке ГДТ в коробках автомат и тому подобным мерам.
Существует 2 основных способа получения большей отдачи от сгорания ТПВС: увеличить топливную эффективность и уменьшить потери. Чтобы получить большую отдачу от сгорания бензина, ТПВС нужно как можно сильнее сжать. Но в случае с бензиновыми двигателями мы натыкаемся на большую проблему – детонацию. Дизельным моторам детонация не страшна, но увеличение энергии приводит к чрезмерным нагрузкам на коленчатый вал, вкладыши коленвала и т.д. Поддерживать чрезвычайно высокую температуру в камере сгорания двигателя также нет возможности, так как детали ЦПГ, головки блока цилиндров имеют определенный коэффициент расширения. Изготовление деталей из сверхпрочных материалов удорожит себестоимость производства, сделав тем самым изготовление экономически невыгодным. Уменьшение потерь – действенный способ увеличения КПД двигателя. Именно желание уменьшить потери привело современное двигателестроение к облегчению деталей ЦПГ, уменьшению размера поршневых колец, ранней блокировке ГДТ в коробках автомат и тому подобным мерам.
Источник: https://autolirika.ru/teoriya/teplovoj-balans-dvigatelya.html
Алгоритм решения задач на уравнение теплового баланса — Физика дома
admin. Рубрики: Это надо знать. Опубликовано: Декабрь 28th, 2012
Задачи на составление уравнения теплового баланса пользуются большой популярностью на экзамене. Подобного рода задачи встречаются во второй и третьей части экзаменационного задания ЕГЭ по физике. Да и на экзамене ГИА они встречаются тоже.
И для решения задач этого типа, надо использовать алгоритм, применение которого значительно упрощает решение задач.Необходимо:
- Внимательно прочитать задачу, записать условие, записать искомую величину.
- Определить, в каком агрегатном состоянии находятся вещества в начальном состоянии.
- Рассмотреть, какие процессы и изменения происходят в задаче с веществами.
- Начертить график зависимости температуры от времени протекания процессов для всех тел и веществ, о которых говорится в задаче (процессы плавления (отвердевания) и парообразования (конденсации) вещества изображаются прямыми, параллельными оси времени).

- Выяснить, является ли данная система замкнутой (если система не замкнутая, то в условии даётся такая величина, как потери энергии. Она также приплюсовывается в общую сумму).
- Записать уравнение теплового баланса: сумма количеств теплоты отданных и полученных в системе тел равна нулю.

- Расписать все слагаемые, входящие в уравнение теплового баланса с учетом процессов, описанных в задаче.

- Подставить слагаемые в уравнение теплового баланса.
- Решить получившееся линейное уравнение (с точки зрения математики) относительно неизвестной величины.
Важно! Слагаемые для определения количеств теплоты, расписанные выше, имеют смысл только для данного графика. К каждой задаче график строится индивидуально с учетом условия задачи.
Посмотреть пример решения задачи на составление уравнения теплового баланса можно здесь.
Источник: http://fizika-doma.ru/eto-nado-znat/algoritm-resheniya-zadach-na-uravnenie-teplovogo-balansa.html
Решение задач на теплообмен с использованием уравнения теплового баланса
Калькулятор, представленный в данной статье, может решать широкий спектр задач на теплообмен (или задач на теплоемкость) — а именно, все те задачи, где отсутствует фазовый переход (то есть плавление/кристаллизация или испарение/конденсация). Для решения задач калькулятор использует уравнение теплового баланса, поэтому сначала небольшая теория:
Уравнение теплового баланса
Теплопередача или теплообмен — физический процесс передачи тепловой энергии от более горячего тела к менее горячему, либо непосредственно (при контакте), или через разделяющую (тела или среды) перегородку из какого-либо материала. Тела, участвующие в теплообмене, представляют собой термодинамическую систему.
Когда физические тела одной системы находятся при разной температуре, то происходит передача тепловой энергии, или теплопередача от одного тела к другому до наступления термодинамического равновесия (состояния системы, при котором остаются неизменными во времени макроскопические величины этой системы — температура, давление, объём, энтропия, в условиях изолированности от окружающей среды).
- Самопроизвольная передача тепла всегда происходит от более горячего тела к менее горячему, что является следствием второго закона термодинамики.
- Термодинамическая система называется теплоизолированной, если она не получает энергию извне и не отдаёт её и теплообмен происходит только между телами, входящими в эту систему.
- Для любой теплоизолированной системы тел справедливо следующее утверждение: Количество теплоты, отданное одними телами, равно количеству теплоты, принимаемому другими телами.
Это и есть уравнение теплового баланса.
Интерпретация такой записи: Алгебраическая сумма всех количеств теплоты (поглощенных и выделенных) в теплоизолированной системе равна нулю.
Если раскрыть количество теплоты (про формулу для расчета количества теплоты уже было написано здесь: Формула количества теплоты), то мы получим следующее выражение:
Именно это уравнение использует калькулятор, представленный ниже. Кроме того, калькулятор умеет учитывать количество теплоты, отданное или полученное извне системы. Чтобы использовать калькулятор, необходимо правильно заполнить таблицу, описывающую теплообмен в термодинамической системе. Как это сделать, описано под калькулятором на примерах типовых задач.
Для разделения полей можно использовать один из этих символов: Tab, «;» или «,» Пример: Lorem ipsum;Lorem ipsum;Lorem ipsum;Lorem ipsum;Lorem ipsum
Загрузить данные из csv файла
Точность вычисления
Знаков после запятой: 1
Примеры задач
Рассмотрим как нужно применять калькулятор для решения задач на теплообмен.
Пример 1
В латунный калориметр массой 200г с водой 400г при температуре 17С опустили тело из серебра массой 600г при 85С. Вода нагрелась до 22С. Определить удельную темлоёмкость серебра.
Как использовать калькулятор:
- Очищаем таблицу, нажав кнопку Очистить таблицу
- Добавляем в таблицу следующие строки:
| Латунь | 0.2 | 380 | 17 | 22 |
| Вода | 0.4 | 4200 | 17 | 22 |
| Серебро | 0.6 | ? | 85 | 22 |
Обратите внимание на использование знака вопроса в ячейке для удельной теплоемкости серебра
- Калькулятор определит искомое неизвестное и решит систему, выдав ответ: 232.3 (в принципе, немного не совпадает с приводимой везде удельной теплоемкостью серебра, но все равно достаточно близко к ней).
Пример 2
Три килограмма воды, находившейся при температуре двадцать градусов Цельсия, вскипятили в алюминиевом чайнике массой один килограмм. Удельная теплоёмкость воды равна четыре тысячи двести Дж/(кг×°C), удельная теплоёмкость алюминия равна девятьсот двадцать Дж/(кг×°C). Определить количество теплоты, затраченное при этом процессе.
Как использовать калькулятор:
- Очищаем таблицу, нажав кнопку Очистить таблицу
- Добавляем в таблицу следующие строки:
| Вода | 3 | 4200 | 20 | 100 |
| Алюминий | 1 | 920 | 20 | 100 |
- Ставим знак вопроса в поле Количество теплоты
- Калькулятор определит искомое неизвестное и решит систему, выдав ответ: -1081600 Дж. Минус в данном случае означает, что из внешней среды потребовалось отдать указанное количество теплоты.
Пример 3
В медном калориметре массой 100 г находится 1 кг воды при температуре 20° С. В воду опускают свинцовую деталь массой 2 кг, имеющую температуру 90° С. До какой температуры нагреется вода? (Потерями теплоты в калориметре пренебречь.)
Как использовать калькулятор:
- Очищаем таблицу, нажав кнопку Очистить таблицу
- Добавляем в таблицу следующие строки:
| Медь | 0.1 | 390 | 20 | ? |
| Вода | 1 | 4200 | 20 | ? |
| Свинец | 2 | 130 | 90 | ? |
Обратите внимание на использование знака вопроса во всех трех ячейках для конечной температуры
- Калькулятор определит искомое неизвестное и решит систему, выдав ответ: 24 градуса.
Таблица удельной теплоемкости некоторых веществ
Как видим, иногда в задачах не указывают удельную теплоемкость веществ, предполагая, что ученик сможет узнать ее из справочника. Для удобства пользования калькулятором ниже приведена таблица удельной теплоемкости некоторых веществ.
| Алюминий | 880 |
| Ацетон | 2180 |
| Бензол | 1700 |
| Висмут | 130 |
| Вода | 4200 |
| Глицерин | 2400 |
| Германий | 310 |
| Железо | 457 |
| Золото | 130 |
| Калий | 760 |
| Латунь | 380 |
| Литий | 4400 |
| Магний | 1300 |
| Медь | 390 |
| Натрий | 1300 |
| Никель | 460 |
| Олово | 230 |
| Ртуть | 138 |
| Свинец | 130 |
| Серебро | 235 |
| Спирт этиловый | 2430 |
| Сталь | 460 |
| Чугун | 500 |
Источники:
Источник: https://planetcalc.ru/7129/
Уравнение теплового баланса
Существует ряд задач на смешение веществ, обладающих различным агрегатным состоянием и температурой. Такие задачи обычно начинаются со слов: «в жидкость с определённой температурой вносят тело другой температуры». Далее в такой системе происходит уход энергии из одной части системы к другой.
Для описания такого перераспределения энергии можно использовать достаточно простую логику: если система теплоизолирована (энергия не выходит из системы), то сумма энергий, которые выделяются из всех частей системы, равна сумме энергий, которые поглощаются всеми частями системы, что называется уравнением теплового баланса:
- где
- — сумма теплот от процессов, требующих затрат энергии,
- — сумма теплот от процессов, требующих отвода энергии.
Для решения таких задач достаточно энергетически проследить все преобразования вещества из начального состояния в конечное, причём для всех веществ. Рассмотрим процессы:
- процессы, требующие увода энергии из системы:
- конденсация ()
- кристаллизация ()
- охлаждение ()
- процессы, требующие энергию:
- кипение ()
- плавление ()
- нагревание ()
Рис. 1. Фазовые превращения воды
Итак, лёд при низкой температуре начинают нагревать. Рассмотрим процессы, происходящие с выбранным нами веществом:
- процесс АВ — процесс нагревания твёрдого тела (льда), который продолжается до достижения температуры плавления (точка В),
- процесс ВС — процесс плавления, который продолжается до момента полного перехода твёрдого тела (льда) в жидкое состояние (вода) (точка С). При этом образовавшаяся жидкость (вода) находится при температуре плавления,
- процесс CD — процесс нагревания жидкости (воды), который продолжается до достижения температуры кипения (точка D),
- процесс DE — процесс парообразования (кипения), который продолжается до момента полного перехода тела из жидкой фазы (вода) в газообразное состояние (пар) (точка E). При этом образовавшийся газ (пар) находится при температуре кипения,
- процесс EF — процесс нагревания газообразной фазы (пара). Условно бесконечен.
Общий вид рис. 1, в целом, одинаков для большинства веществ, меняются только температуры плавления/кристаллизации, парообразования/конденсации, углы наклона графика к горизонтальной оси.
Пример: пусть в систему, содержащую массу льда при температуре , внесли массу пара при температуре , найти установившуюся температуру воды ().
Т.к. в задаче дана вода, поэтому у нас есть несколько констант. — температура плавления льда, — температура кипения воды, — теплоёмкость льда, — теплоёмкость воды, — теплоёмкость пара, — удельная теплота парообразования, — удельная теплота плавления льда.
Разделим эту задачу на две составляющие:
- процессы, требующие отвода энергии.
В нашем случае, тело, от которого уходит энергия, — это пар. Проследим его превращения: сначала пар остывает () до температуры кипения, потом пар конденсируется (), далее образовавшаяся масса воды охлаждается до конечной температуры ().
Тогда общая энергия, потерянная паром:
(2)
- процессы, требующие затрат энергии:
В нашем случае, тело, которое принимает энергию, — это лёд. Проследим его превращения: сначала лёд нагревается () до температуры плавления, далее лёд плавится (), после чего образовавшаяся масса воды нагревается до конечной температуры ().
- Тогда общая энергия, полученная льдом:
- (3)
- Подставим (2) и (3) в (1):
- (4)
Уравнение (4) и является искомым для получения интересующей нас температуры. В принципе, решение подобных задач (и план, описанный выше) создан для получения уравнения, подобного уравнению (4). Далее математическое разрешение данного уравнения приводит к ответу.
Вывод: Т.е. для решения подобного типа задач достаточно провести анализ, подобный уравнениям (2) и (3), и решить уравнение (4).
Источник: https://www.abitur.by/fizika/teoreticheskie-osnovy-fiziki/termodinamika-i-molekulyarnaya-fizika/processy-perexoda/uravnenie-teplovogo-balansa/
Решу егэ
В эксперименте установлено, что при температуре воздуха в комнате 29 °C на стенке стакана с холодной водой начинается конденсация паров воды из воздуха, если снизить температуру стакана до 27 °C.
По результатам этих экспериментов определите абсолютную и относительную влажность воздуха. Для решения задачи воспользуйтесь таблицей. Поясните, почему конденсация паров воды в воздухе может начинаться при различных значениях температуры.
Давление и плотность насыщенного водяного пара при различной температуре показано в таблице:
| 7 | 9 | 11 | 12 | 14 | 15 | 16 | 19 | 21 | 23 | 25 | 27 | 29 | 40 | 60 | ||
| 10 | 11 | 13 | 14 | 15 | 16 | 17 | 18 | 22 | 25 | 28 | 32 | 36 | 40 | 74 | 200 | |
| 7,7 | 8,8 | 10,0 | 10,7 | 11,4 | 12,11 | 12,8 | 13,6 | 16,3 | 18,4 | 20,6 | 23,0 | 25,8 | 28,7 | 51,2 | 130,5 |
Решение.
| № этапа | Содержание этапа решения | Оценка этапа в баллах |
| 1 | Водяной пар в воздухе становится насыщенным при температуре 27 °C. Следовательно, давление р водяного пара в воздухе равно давлению насыщенного пара при температуре 27 °C, из таблицы 36 гПа.Имеем: | 1 |
| 2 | 1 | |
| 3 | Конденсация паров воды происходит при условии равенства давления водяного пара, имеющегося в воздухе, давлению насыщенного водяного пара при данной температуре воздуха. Давление насыщенного водяного пара зависит от температуры. Поэтому при разной плотности водяного пара в воздухе температура начала конденсации пара (точка росы) оказывается различной. | 1 |
| Максимальный балл | 3 |
Источник: https://phys-ege.sdamgia.ru/test?theme=307
ПОИСК
выравнивание температур до некоторой конечной и. Принимая удельную теплоемкость воды равной 1, получим [c.33]
В уравнение теплового баланса для сорбента войдут члены dq , d(lii dq .
В соответствии с (II.4) dq = dq + dq . Для записи этих уравнений удобно использовать содержание сорбата у в долях (масс.) от сорбента.
Если — насыпная плотность сорбента, то уравнение материального баланса будет иметь вид [c.88]
Процесс смешения влажного воздуха различных состояний можно исследовать с помощью Я -диафаммы.
Если в камеру смещения поступают два потока влажного воздуха, состояние которых характеризуется в точках I и 2 (рис. 4.17) соответствующими параметрами / , Я,, / и 2.
2, 2, имеющие массы /И] и / 2, то состояние влажного воздуха после смещения можно определить из уравнения теплового баланса [c.105]
Законы термодинамики и различные физико-химические закономерности используют при конструировании реакционных аппаратов, при создании новых технологий и разработке математических моделей для проектирования и управления сложными химико-технологическими комплексами. При создании математических моделей составляют уравнения материально-тепловых балансов, уравнения изотерм и изобар химических реакций, выражения законов действующих масс. [c.13]
Проведенные расчеты показали, что для наиболее часто реализуемых на практике условий регенерации неподвижного слоя- 2 = = 1-3% (масс.), X = 2-5% (об.
), Тд = 450-500 °С-больших перепадов температуры на зерне катализатора не наблюдается. Поэтому без существенной погрешности можно принять зерно изотермичным по радиусу, что позволяет упростить уравнение теплового баланса (4.13).
Усреднив его по радиусу с учетом граничных условий (4.19), получим [c.88]
В однополочный контактный аппарат с кипящим слоем контактной массы газ поступает с температурой более низкой, чем температура зажигания катализатора.
В нижней части слоя газ нагревается за счет тепла реакции до заданной оптимальной температуры 550— 590° С и окисляется до заданной степени, которая при разных условиях может составлять от 60 до 80%. Температура поступающего газа определяется из уравнения теплового баланса слоя или ориентировочно по формуле (III.12).
Газ из форконтакта проходит пылеуловитель и теплообменник, а затем поступает в контактный аппарат с фильтрующими слоями катализатора для завершения окисления сернистого ангидрида. [c.150]
Решение. В данном случае можно пренебречь изменением масс, теплоемкостей и линейных скоростей по длине аппарата, так как зона интенсивного теплообмена обычно невелика. Поэтому уравнения теплового баланса можно решать независимо. [c.137]
При более точных расчетах, учитывающих изменение массы флегмы и паров по высоте отгонной части колонны, необходимо использовать уравнение теплового баланса для всей отгонной части колонны, расположенной ниже расчетного сечения. Это дает возможность более точно определить массу паров в данном сечении. Так, для сечения под верхней отгонной тарелкой уравнение теплового баланса имеет вид [c.134]
Заменяя в приведенном уравнении теплового баланса G , = SqG ., и решая его относительно массы циркулирующего катализатора, получаем [c.656]
Произведение расхода теплоносителя О на его среднюю удельную теплоемкость с условно называется водяным эквивалентом W.
Численное значение определяет массу воды, которая по своей тепловой емкости эквивалентно количеству тепла, необходимому для нагревания данного теплоносителя на 1 С, при заданном его расходе.
Поэтому если теплоемкости обменивающихся теплом жидкостей (с и Сз) можно считать не зависящими от температуры, то уравнение теплового баланса (VII, 1) принимает вид [c.262]
К адиабатным близки процессы, в которых тепловые эффекты велики и теплообмен затруднен (процессы горения, реакции в трубчатых аппаратах, в аппаратах с контактной массой и т, д.). В этом случае степень протекания реакции зависит от конечной температуры. Но значение последней, в свою очередь, определяется тепловым эффектом реакции.
Поэтому, в отлнчие от изотермического процесса, расчет выхода здесь сводится к совместному решению уравнения (XIV, 13) и уравнения, связывающего степень протекания реакции со значением конечной температуры (т е. уравнения теплового баланса). Графическое решение заключается в нахождении точки пересечения кривых, отвечающих этим уравнениям (см.
схему на рис 183) [c.477]
Рассмотрим вначале установившееся одномерное неизотермическое движение несжимаемой жидкости и газа в трубах. При этом предполагается, что жидкость является однофазной, т. е.
не претерпевает фазовых превращений, а скорость, плотность, давление и температура в каждом поперечном сечении распределены равномерно. Пусть горячая жидкость (газ) закачивается в скважину (рис. 1).
Выделим элемент эксплуатационной колонны dz, ограниченной сечениями z и z + dz, через которые происходит приток тепла с температурой Ti и отток тепла с температурой Та соответственно. Через стенки трубы данного элемента происходит потеря тепла в окружающую среду с температурой Т .
Выражая Tj и Tj через среднюю температуру элемента Т, составляя уравнение теплового баланса и используя закон сохранения массы, энергии и уравнение Вернули в механической форме, согласно ]1] получим следующее уравнение энергии [c.145]
Количественные соотношения теплообменивающихся жидко-стей находятся из уравнения теплового баланса.- Если масса нагреваемой жидкости т и теплоемкость ее с, то тепловой баланс в дифференциальной форме [c.7]
При расчете рабочей линии при совместном массо- и теплообмене (например, в регенераторе с отдувкой парами) расчет рабочей линии усложняется тем, что объем парогазовой смеси сильно зависит от тепла, поглощаемого на каждом участке. При этом приходится решать совместно уравнения теплового и материального баланса и вводить некоторые дополнительные допущения (см. главу IV). [c.52]
Массу острого пара, используемого на нагревание жидкости, определяют из уравнения теплового баланса, учитывая равенство конечных температур нагреваемой жидкости и конденсата [c.320]
Описание закономерностей работы АПЕ прежде всего должно быть направлено на установление взаимосвязи между образующими ее конструктивными элементами и протекающими в ней технологическими процессами.
С этой целью выделяются элементарные процессы переноса, протекающие в отдельных АПЕ, каждый из которых характеризуется определенным набором конструктивных, физических и кинетических параметров (см. табл. 4.3). Задавать основные конструктивные параметры АПЕ следует исходя из условия достижения в ней определенного технологического эффекта.
Таким образом, применительно к задачам САПР моделирование работы АПЕ необходимо для определения численных значений конструктивных параметров модели, при которых обеспечивается изменение ее физических параметров от значения на входе до значения на выходе.
Как уже было отмечено выше, значения физических параметров должны определяться из уравнений теплового и материального баланса, составленных на основании потоковых графов (рис. 4.12). В этом случае представляется возможным определить потоки массы и тепла в данной АПЕ [c.231]
Поясним возникающие вопросы простым примером. Пусть головка термометра, измеряющего изменения температуры в потоке газа и, заполнена веществом с удельной теплоемкостью с. Пусть масса этого вещества в головке равна т.
Наличием столбика вещества над головкой и теплоотводом через этот столбик и стеклянную трубку термометра пренебрежем. Площадь соприкосновения головки термометра с газом обозначим 5, а коэффициент теплопередачи через единицу этой поверхности а. Обозначая температуру термометра, т. е.
рабочего вещества в его головке /п, время т, мы легко составим уравнение теплового баланса [c.133]
При изотермическом режиме истечения тепловой поток расходуется на испарение жидкости. Определим скорость испарения исходя из уравнения материального баланса. Общее изменение массы газа в резервуаре за время х равно [c.35]
Общее уравнение теплового баланса.
Тепловой баланс процессов диазотирования, азосочетания и нитрозирования является основой для всех прочих технологических расчетов, так как на основании теплового баланса выявляется расход льда (а вместе с эти.
м и объем воды, прибавляющейся к реакционной массе в процессе охлаждения) или количество отни-мае.мого тепла, позволяющее определить требуемую поверхность охлаждения или установить мощность аппаратуры. [c.285]
Удельная теплоемкость металла определяется из уравнения теплового баланса калориметра. Металл массой т нагревается до температуры помещенный в воду с температурой он охлаж-даетс я до температуры нагревая до этой температуры воду. Массу воды (т ) в граммах можно принять численно равной объему воды в мл. [c.53]
Простой вид уравнений тепловых балансов (3.99), строго говоря, соответствует предположениям об отсутствии тепловых потерь в окружающую среду, т. е. о том, что вся теплота, отданная горячим теплоносителем, воспринимается на элементе df холодным теплоносителем и идет на повышение его температуры на величину dt .
Считается также, что в массе теплоносителей отсутствуют фазовые превращения, при которых выделение (или поглощение) значительного количества теплоты фазового перехода происходит без изменения температуры. Кроме того, уравнения тепловых балансов (3.
99) справедливы лишь в случаях, когда можно пренебречь переносом теплоты в направлении движения теплоносителей за счет теплопроводности и турбулентного переноса по сравнению с конвективным переносом, представленным в уравнениях (3.99).
Последнее обычно справедливо при движении теплоносителей со значительными скоростями, принятыми для эксплуатации ТОЛ (для капельных жидкостей 0,25-2,5 м/с, для газов и перегретых паров 5-30 м/с).
Однако, например, для жидкометаллических теплоносителей с высокими значениями коэффициентов теплопроводности (X = 5-420 Вт/(м К)), проходящих через ТОЛ с малыми скоростями вследствие значительной их вязкости, кондуктивный перенос теплоты (-Xgradi) вдоль поверхности теплообмена может оказаться сравнимым с конвективным переносом Gt).
В этом случае в простые балансовые соотношения (3.99) должны вводиться дополнительные слагаемые кондуктивного переноса. Сделанные здесь замечания существенны потому, что последующие выкладки с использованием уравнений (3.99) и, следовательно, формула (3.105) для вычисления средней разности температур теплоносителей, строго говоря, справедливы лишь при выполнении отмеченных здесь условий. [c.269]
В более общем случае необходимо учитывать различие температур потоков (Гс и Т и внутренний теплообмен между ними. Если принять, что тенло через стенку аппарата передается от нотока реагирующей смеси, то соответствующий член включается только в уравнение теплового баланса смеси.
Естественно, что если тепло при реакции выделяется, оно расходуется на нагрев более холодного потока, а при поглощении тепла реакцией оно отбирается от более горячего потока.
С учетом сказанного для холодного потока — смеси и горячего потока — контактной массы тепловые уравнения получим в виде [c.103]
Здесь уравнения (4.62)—(4.66) описывают средние скорости изменения концентраций инициатора, радикалов, мономеров и суммарной степени превращения в частицах дисперсной фазы. Уравнение (4.67) описывает нестационарный перенос тепла от единичного включения к сплошной фазе. Уравнения теплового баланса (4.68)—(4.
69) для реактора и рубашки составлены при допущении полного перемепшвания сплошной фазы в реакторе и теплоносителя в рубашке. Уравнение БСА (4.70) характеризует изменение в течение процесса функции распределения частиц дисперсной фазы по массам р (М, 1). В уравнениях (4.62)—(4.
70) введены следующие обозначения / ( г) — эффективность инициирования X — суммарная степень превращения мономеров АЯ — теплота полимеризации — эффективная энергия активации полимеризации 2 — коэффициент теплопроводности гранул р .
— плотность смеси — теплоемкость смеси — коэффициент теплоотдачи от поверхности гранулы к сплошной среде Оои сво — начальные концентрации мономеров кр (х) — эффективный коэффициент теплопередачи — поверхность теплообмена между реагирующей средой и теплоносителем, Ут — объем теплоносителя в рубашке Гу, и Тт — температура теплоносителя на входе в рубашку и в рубашке соответственно Qт— объемный расход теплоносителя V — объем смеси в реакторе — объем смеси [c.275]
Уравнения для газовой фазы. Обычно использование кривой равновесной конденсации ис очеш точно, если имеются большие различия в относительных молекулярных массах неконденсирующегося газа и пара. Кроме того, надо интегрировать уравнения теплового и массового баланса в газовой фазе по пути движения пара. Из баланса теплоты и массы находим соответстЕенно [c.353]
Структура потока и пламени. Потоки Qf , которые входит в уравнение теплового баланса, вычисляются но расходу через границы зоны и по удель[юй энтальпии газов при температуре в зоне. Расход газа и модель горения должны быть определены заранее.
Этого можно добиться одиим из трех способов из физических представлений, с помощью простых математических моделей для описания турбулентного пламеии [12, 13] или с применением подробных математических моделей на основе уравнений сохранения энергии, массы, импульса и баланса частиц.
Дальнейшее развитие зонного метода как полезного инструмента для расчета потока во многом будет зависеть от прогресса в определении структуры потока и пламени в топках по их производительности и расчетным параметрам. [c.120]
Обратимые и необратимые реакции.
Термохимические уравнения реакций являются количественным выражением закона сохранения массы-энергии и [юзволяют глубже проанализировать характер химических превращений, чем это доступно при использовании уравнений баланса массы веществ, вступающих в реакцию и образующихся после нее. По величине и знаку теплового эффекта реакции, вычисленного по таблицам, можно, не проводя опыта, установить, будет ли идти при обычной температуре тот или иной процесс. [c.49]
Г сли масса частпц будет двигаться и поступать в реакционное пространство со скоростью, равной скорости воспламенения а, то процесс горения будет стационарным и очаг горения установится в определенном месте, В таком с.пучае можно составить уравнение теплового баланса, аналогичное (4. 14), [c.262]
Хорошие результаты получены при использовании модели сложной ректификационной колонны, позволяющей по режимным переменным процесса (температурное поле колонны, значения расходов, давлений и пр.
) построить материальный и тепловой баланс уравнения массо- и теплообмена, а далее получить кривые фракционной разгонки (КФР), с любым наперед заданным интервалом между соседними точками КФР.
Таким образом, можно прогнозировать калество всех продуктов ректификации, и кроме того получать сведения о гидродинамическом режиме колонны (например флегмовые числа по секциям). [c.33]
Источник: https://www.chem21.info/info/1856500/




