![]()
![]()
![]()
![]()
V 23 Ванадий
50,9415(1) 1s2 2s2 2p6 3s2 3p6 3d3 4s2
Ванадий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 23. Расположен в 5-й группе (по старой классификации — побочной подгруппе пятой группы), четвертом периоде периодической системы.
Атом и молекула ванадия. Формула ванадия. Строение атома ванадия
- Изотопы и модификации ванадия
- Свойства ванадия (таблица): температура, плотность, давление и пр.
- Физические свойства ванадия
Химические свойства ванадия. Взаимодействие ванадия. Химические реакции с ванадием
Получение ванадия
Применение ванадия
Таблица химических элементов Д.И. Менделеева
Атом и молекула ванадия. Формула ванадия. Строение атома ванадия:
Ванадий (лат. Vanadium, от др.-сканд. Vanadís – «дочь Ванов») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением V и атомным номером 23. Расположен в 5-й группе (по старой классификации – побочной подгруппе пятой группы), четвертом периоде периодической системы.
Ванадий – металл. Относится к группе переходных металлов. Относится к черным металлам.
- Как простое вещество ванадий при нормальных условиях представляет собой пластичный металл серебристо-серого цвета по внешнему виду похожий на сталь.
- Молекула ванадия одноатомна.
- Химическая формула ванадия V.
Электронная конфигурация атома ванадия 1s2 2s2 2p6 3s2 3p6 3d3 4s2. Потенциал ионизации атома ванадия равен 6,74 эВ (650,1 кДж/моль).
Строение атома ванадия. Атом ванадия состоит из положительно заряженного ядра (+23), вокруг которого по четырем атомным оболочкам движутся 23 электрона. При этом 21 электрон находится на внутреннем уровне, а 2 электрона – на внешнем.
Поскольку ванадий расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями.
Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома хрома на 3d-орбитали находится три неспаренных электрона. На внешнем энергетическом уровне атома ванадия – на s-орбитали находятся два спаренных электрона.
В свою очередь ядро атома ванадия состоит из 23 протонов и 28 нейтронов.
Радиус атома ванадия составляет 134 пм.
Атомная масса атома ванадия составляет 50,9415(1) а. е. м.
Химически ванадий довольно инертен.
Изотопы и модификации ванадия:
Свойства ванадия (таблица): температура, плотность, давление и пр.:
| Общие сведения | |
| Название | Ванадий/ Vanadium |
| Символ | V |
| Номер в таблице | 23 |
| Тип | Металл |
| Открыт | Андрес Мануэль Дель Рио, Германия, 1801 г. |
| Внешний вид и пр. | Пластичный металл серебристо-белого цвета |
| Содержание в земной коре | 0,019 % |
| Содержание в океане | 1,5×10-7 % |
| Свойства атома | |
| Атомная масса (молярная масса) | 50,9415(1) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d3 4s2 |
| Радиус атома | 134 пм |
| Химические свойства | |
| Степени окисления | 0, +2, +3, +4, +5 |
| Валентность | +2, +3, +4, +5 |
| Ковалентный радиус | 122 пм |
| Радиус иона | (+5e)59 (+3e)74 пм |
| Электроотрицательность | 1,63 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 650,1 кДж/моль (6,74 эВ) |
| Электродный потенциал | |
| Физические свойства | |
| Плотность (при нормальных условиях) | 6,11 г/см3 |
| Температура плавления | 1910 °C (2183 K) |
| Температура кипения | 3407 °C (3680 K) |
| Уд. теплота плавления | 17,5 кДж/моль |
| Уд. теплота испарения | 460 кДж/моль |
| Молярная теплоёмкость | 24,95 Дж/(K·моль) |
| Молярный объём | 8,35 см³/моль |
| Давление паров | 0,01 мм.рт.ст. (при 1850 °C), 0,1 мм.рт.ст. (при 2044 °C), 1 мм.рт.ст. (при 2282 °C), 10 мм.рт.ст. (при 2590 °C), 100 (при 2955 °C) |
| Удельная теплоемкость при постоянном давлении | 0,502 Дж/г·K (при 20 – 100 °C) |
| Стандартная энтальпия образования ΔH (при 298 К, для состояния вещества – твердое тело) | 0 кДж/моль |
| Стандартная энергия Гиббса образования ΔG (при 298 К, для состояния вещества – твердое тело) | 0 кДж/моль |
| Стандартная энтропия вещества S (при 298 К, для состояния вещества – твердое тело) | 28,9 Дж/(моль·K) |
| Теплопроводность (при 300 K) | 30,7 Вт/(м·К) |
| Электропроводность в твердой фазе | 5х106 См/м |
| Сверхпроводимость при температуре | |
| Твёрдость | 7 по шкале Мооса, 628 МПа по Виккерсу |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 3,024 Å |
| Температура Дебая | 390 К |
Физические свойства ванадия:
Химические свойства ванадия. Взаимодействие ванадия. Химические реакции с ванадием:
Получение ванадия:
Применение ванадия:
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com
-




- карта сайта
- ванадий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле ванадия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/vanadiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Валентность ванадия (V), формулы и примеры
 Онлайн калькуляторы
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
 Справочник
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?! Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!

Плотность – 6,11 г/см3. Температуры плавления и кипения равны 1920oС и 3400oС, соответственно. Физико-химические свойства ванадия сильно зависят от чистоты метала. Так, чистый металл отличается ковкостью, тогда как наличие примесей в нем сильно ухудшает его пластичность и повышают твердость. В обычных условиях – химически стойкий металл.
Валентность ванадия в соединениях
Ванадий находится в четвертом периоде в VB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 23. В ядре атома ванадия содержится 23 протона и 27 нейтронов (массовое число равно 50). В атоме ванадия есть четыре энергетических уровня, на которых находятся 23 электрона (рис. 1).

Рис. 1. Строения атома ванадия.
- Электронная формула атома ванадия в основном состоянии имеет следующий вид:
- 1s22s22p63s23p63d34s2.
- А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):

Наличие трех неспаренных электронов свидетельствует о том, что ванадий в своих соединениях может проявлять валентность III (VIII2O3, VIIIF3, VIIICl3).
Атом ванадия способен переходить в возбужденное состояние: электроны 4s-подуровня распариваются и один из них занимает вакантную орбиталь 3d-подуровня:
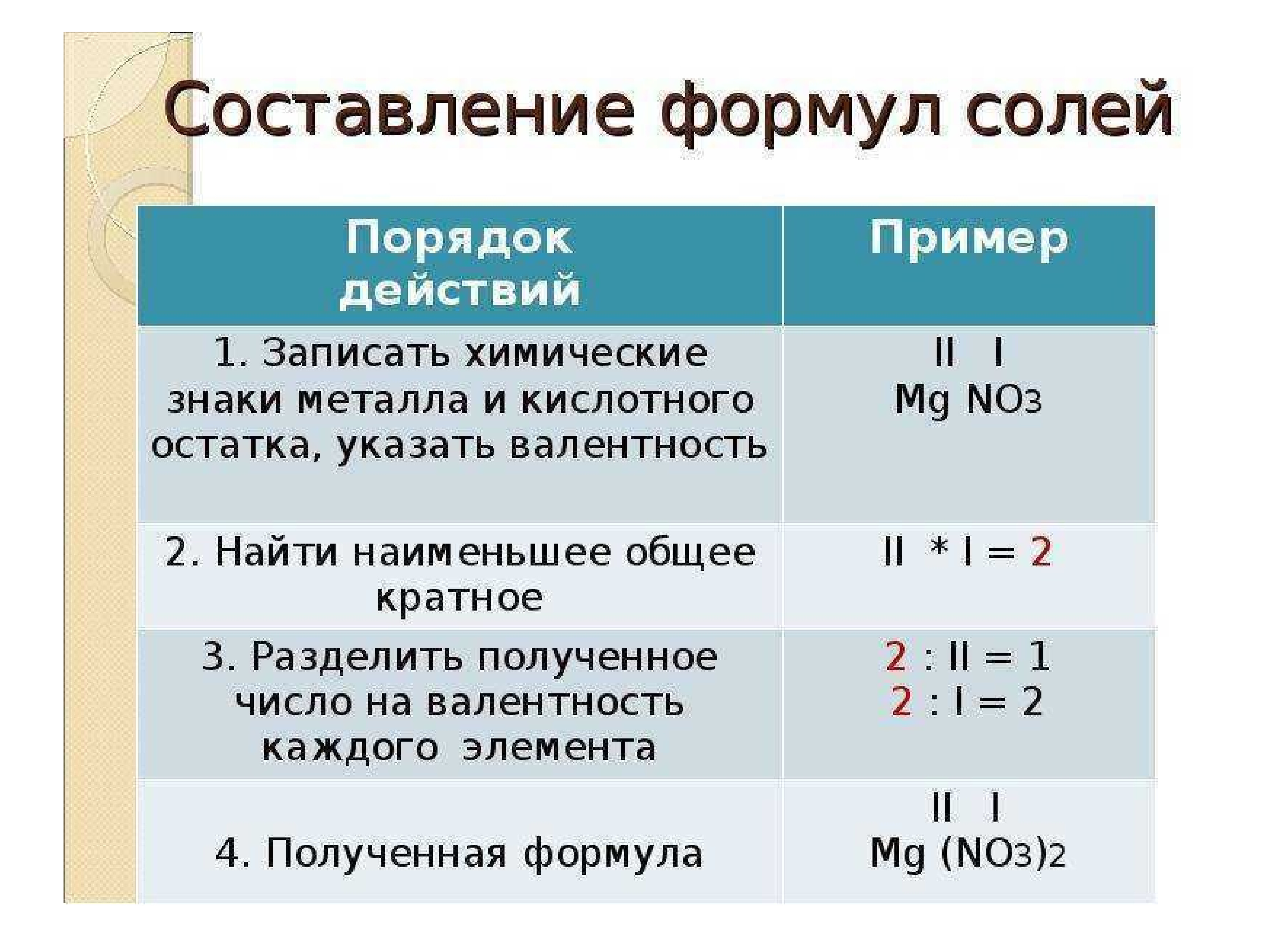
Наличие пяти неспаренных электронов свидетельствует о том, что ванадий также проявляет валентность V в своих соединениях (VV2O5, VVF5).
Известно, что у ванадия есть валентности II(VIIO) и IV (VIVO2, VIVCl4).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/ximiya/valentnost/valentnost-vanadiya/
Ванадий: свойства, атомная масса, формула, применение :: SYL.ru
Ванадий представляет собой химический элемент, обозначаемый символом «V». Атомная масса ванадия 50,9415 а. е. м., атомный номер – 23. Это твердый серебристо-серый, ковкий и плавкий металл, редко встречающийся в природе. Входит в состав более чем 60 минералов и даже может содержаться в ископаемом топливе.

Непризнанное открытие
Металл ванадий впервые был обнаружен мексиканским минерологом испанского происхождения Андресом Мануэлем Дель Рио в 1801 году. Исследователь извлек новый элемент из образца добытой в Мексике «коричневой» свинцовой руды. Как оказалось, соли металла обладают большим разнообразием цветов, поэтому Дель Рио первоначально назвал его «panchromium» (от греческого «παγχρώμιο» — «разноцветный»).
Позже минеролог переименовал элемент в erythronium (от греческого «ερυθρός» — «красный»), потому что большая часть солей приобретала красной оттенок при нагревании.
Казалось бы, невероятная удача улыбнулась малоизвестному в Европе ученому. Открытие нового химического элемента ванадия сулило если не славу, то, как минимум, признание коллег.
Однако из-за отсутствия весомого авторитета в научном мире достижение мексиканца проигнорировали.
В 1805 году французский химик Ипполит Виктор Колле-Декотильс предположил, что новый элемент, исследованный Дель Рио, был всего лишь образцом хромата свинца с примесями.
В конечном итоге мексиканский исследователь, чтобы окончательно не потерять лицо перед ученой братией, принял утверждение Колле-Декотиля и отказался от своего открытия. Впрочем, его достижение не кануло в небытие.
Сегодня Андрес Мануэль Дель Рио признан как первооткрыватель редкого металла.
Повторное открытие
В 1831 году швед Нильс Габриэль Сефстрём вновь обнаружил химический элемент ванадий в оксиде, полученном им при работе с железной рудой. В качестве его обозначения ученый выбрал литеру «V», которая еще не была присвоена ни одному элементу. Сефстрём назвал новый металл из-за его красивой и богатой окраски в честь древнескандинавской богини красоты Ванадис.
Новость вызвала повышенный интерес в научном сообществе. Сразу вспомнили о работах мексиканского минеролога. В том же 1831 году Фридрих Вёлер перепроверил и подтвердил предыдущее открытие Дель Рио. А геолог Джордж Уильям Фезерстонхауп даже предложил назвать металл «рионием» в честь первооткрывателя, но инициатива поддержана не была.

Неуловимый
Выделение металла ванадия в чистом виде оказалось затруднительным. До этого ученые работали лишь с его солями. Именно поэтому истинные свойства ванадия били неизвестны.
В 1831 году Берцелиус сообщил о получении металлизированного вещества, но Генри Энфилд Роско доказал, что Берцелиус фактически произвел нитрид ванадия (VN). В конечном итоге Роско произвел металл в 1867 году путем восстановления хлорида ванадия (VCl2) под действием водорода.
С 1927 года чистый ванадий получают путём восстановления пентаоксида ванадия с участием кальция.
Первое серийное промышленное использование элемента относится к 1905 году. Металл добавляли в стальной сплав для изготовления шасси гоночных автомобилей, а позже – в Ford Model T.
Характеристики ванадия позволяют снизить вес конструкции, одновременно увеличивая прочность на растяжение.
Кстати, немецкий химик Мартин Хенце обнаружил ванадий в клетках крови (или целомических клетках) морских обитателей – акцидий – в 1911 году.

Физические свойства
Ванадий представляет собой ковкий серо-синий металл средней твёрдости со стальным блеском и плотностью 6,11 г/см³. Некоторые источники описывают материал как мягкий, имея ввиду его высокую пластичность. Кристаллическая структура элемента сложнее большинства металлов и сталей.
Ванадий обладает хорошей устойчивостью к коррозии, щелочам, серной и соляной кислотам. Он окисляется на воздухе при температуре около 660°С (933К, 1220°F), хотя пассивация оксида происходит даже при комнатной температуре. Плавится данный материал при достижении температуры 1920°С, а при 3400°С — закипает.
Химические свойства
Ванадий под воздействием кислорода образует четыре типа оксидов:
| Цвет | Плотность | Кипение | Плавление | |
| VO (II) | Чёрный | 5,76 г/см³ | 3100°C | 1830°C |
| V2O3 (III) | Чёрный | 4,87 г/см³ | 3000°C | 1967°C |
| VO2 (IV) | Тёмно-синий | 4,65 г/см³ | 2700°C | 1542°C |
| V2O5 (V) | Оранжевый | 3,357 г/см³ | 2030°C | 670°C |
Соединения ванадия типа (II) являются восстановителями, а соединения типа (V) — окислителями. Соединения (IV) часто существуют как производные катиона ванадила.
Оксид
Наиболее коммерчески важным соединением является пятиокись ванадия. Это коричнево-жёлтое твёрдое вещество, хотя при свежевыпакованном осаждении из водного раствора его цвет является тёмно-оранжевым.

Оксид используется в качестве катализатора для получения серной кислоты. Это соединение окисляет диоксид серы (SO2) в триоксид (SO3). В этой окислительно-восстановительной реакции сера окисляется от +4 до +6, а ванадий снижается с +5 до +4. Формула ванадия выглядит следующим образом:
- V2O5 + SO2 → 2VO2 + SO3
- Катализатор регенерируется окислением кислорода:
- 2VO2 + O2 → V2O5
- Аналогичные процессы окисления используются в производстве малеинового ангидрида, фталевого ангидрида и нескольких других объемных органических соединений.
Этот оксид также применяют при получении феррованадия. Его нагревают с железом и ферросилицием с добавлением извести.
При использовании алюминия получают железо-ванадиевый сплав вместе с оксидом алюминия в качестве побочного продукта.
Из-за высокого коэффициента теплового сопротивления оксид ванадия (V) находит применение в качестве материала-детектора в болометрах и микроболометрических массивах в тепловизионных приборах.
Характеристики
Редкий металл имеет следующие характеристики:
- Кристаллическая структура: кубическая объёмно-центрированная.
- Звукопроводность: 4560 м/с (при 20°C).
- Валентность ванадия: V (реже IV, III, II).
- Тепловое расширение: 8,4 мкм/(м·К) (при 25°С).
- Теплопроводность: 30,7 Вт/(м·К).
- Электрическое сопротивление: 197 nΩ·м (при 20°C).
- Магнетизм: парамагнитный.
- Магнитная восприимчивость: +255·10-6 см3/моль (298K).
- Модуль упругости: 128 ГПа.
- Модуль сдвига: 47 ГПа.
- Объёмный модуль упругости: 160 ГПа.
- Коэффициент Пуассона: 0,37.
- Твёрдость по шкале Мооса: 6,7.
- Твердость по Виккерсу: 628-640 МПа.
- Твердость по Бринеллю: 600-742 Мпа.
- Категория элемента: переходный металл.
- Электронная конфигурация: 3d3 4s2.
- Теплота плавления: 21,5 кДж/моль.
- Теплота испарения: 444 кДж/моль.
- Молярная теплоёмкость: 24,89 Дж/(моль·К).
Ванадий в таблице Менделеева находится в 5-й группе (подгруппа ванадия), 4-м периоде, d-блоке.
Распространение
Ванадий в масштабах Вселенной составляет примерно 0,0001% от общего объёма вещества. Он распространён так же часто, как медь и цинк. Метал обнаружен в спектральном свечении Солнца и других звёзд.
Элемент является 20-м по распространённости в земной коре. Металл ванадий в кристаллической форме достаточно редок, но соединения этого материала встречаются в 65 различных минералах. Экономически значимыми из них являются патронит (VS4), ванадинит (Pb5(VO4)3Cl) и карнотит (K2(UO2)2(VO4)2·3H2O).
Ионы ванадила в изобилии распространены в морской воде и имеют среднюю концентрацию 30 нМа. Некоторые источники минеральной воды также содержат данные ионы в высоких концентрациях. Например, источники возле горы Фудзи содержат до 54 мкг/л.

Добыча
Большую часть этого редкого металла получают из ванадиевого магнетита, обнаруженного в ультраосновных магматических габбровых породах. Сырьё добывается главным образом в Южной Африке, северо-западном Китае и на востоке России. В 2013 году эти страны произвели более 97 % всего ванадия (79 000 тонн в весовом выражении).
Металл также присутствует в бокситах и месторождениях сырой нефти, угля, горючих сланцев и битуминозных песков. В сырой нефти сообщалось о концентрациях до 1200 промилле. Из-за окислительных свойств ванадия (некоторых его оксидов) после сжигания таких нефтепродуктов остатки элемента могут вызвать коррозию в двигателях и котлах.
По оценкам, 110 000 тонн вещества ежегодно попадает в атмосферу путем сжигания ископаемого топлива. Сегодня разрабатываются технологии по извлечению ценного вещества из углеводородов.
Производство
В основном ванадий используется в качестве добавок к стальным сплавам, называемым ферросплавами. Феррованадий получают непосредственно путем восстановления смеси из оксида ванадия с валентностью (V), оксидов железа и чистого железа в электрической печи.
Металл получают с использованием многоступенчатого процесса, который начинается с обжига измельченной ванадий-магнетитовой руды с добавлением хлорида натрия (NaCl) или карбоната натрия (Na2CO3) при температуре около 850°С с получением метаванадата натрия (NaVO3). Водный экстракт этого вещества подкисляют, получая поливанадатную соль, которая восстанавливается кальциевым металлом. В качестве альтернативы мелкосерийному производству пятиокись ванадия восстанавливается водородом или магнием.
Также используются многие другие методы, во всех из которых ванадий производится как побочный продукт других процессов. Его очистка возможна иодидным методом, разработанным Антоном Эдуардом ван Аркелем и Яном Хендриком де Бором в 1925 году. Он подразумевает образование иодида ванадия (III) и его последующее разложение с получением чистого металла:
2 V + 3I2 ⇌ 2 VI3
Достаточно экзотический способ получения этого элемента придумали японцы. Они разводят на подводных плантациях асцидии (тип хордовые), которые поглощают ванадий из морской воды. Затем их собирают и сжигают. Из образовавшегося пепла извлекают ценный метал. Кстати, его концентрация в этом случае гораздо выше, чем на самых богатых месторождениях.

Сплавы
Что собой представляют сплавы ванадия? Приблизительно 85 % производимого редкого металла используют для получения феррованадия или в качестве добавки к стали. В начале XX века было обнаружено, что даже небольшое количество ванадия значительно увеличивает прочность стали. Данный элемент образует стабильные нитриды и карбиды, что приводит к улучшению характеристик сталей и сплавов.
С этого времени отмечено применение ванадия в осях, рамах, коленчатых валах, шестернях и других важных компонентах колесного транспорта. Существуют две группы сплавов:
- Высокоуглеродистые с содержанием от 0,15 % до 0,25 % ванадия.
- Быстрорежущие инструментальные стали (HSS) с содержанием от 1% до 5% данного элемента.
Для сталей марки HSS может быть достигнута твердость выше HRC 60. Они используются в хирургических инструментах. В порошковой металлургии сплавы могут содержать до 18 % ванадия. Высокое содержание карбидов в этих сплавах значительно повышает износостойкость. Из них изготавливают инструменты и ножи.
Благодаря своим свойствам, ванадий стабилизирует бета-форму титана, повышает его прочность и температурную стабильность. Смешанный с алюминием в титановых сплавах, он используется в реактивных двигателях , высокоскоростных летательных аппаратах и зубных имплантатах.
Наиболее распространенным сплавом для бесшовных труб является титан 3/2,5, содержащий 2,5 % ванадия. Данные материалы широко распространены в аэрокосмической, оборонной и велосипедной промышленности.
Другим распространенным сплавом, выпускаемым главным образом в листах, является титан 6AL-4V, где 6 % алюминия и 4% ванадия.
Несколько ванадиевых сплавов демонстрируют сверхпроводящие свойства. Первый фазовый сверхпроводник А15 представлял собой соединение ванадия V3Si, которое было получено в 1952 году.
Ванадиево-галлиевая лента используется в сверхпроводящих магнитах.
Структура сверхпроводящей фазы A15 V3Ga аналогична структуре более распространенных сверхпроводников: станнида триниобия (Nb3Sn) и ниобий-титана (Nb3Ti).
Недавно учёные выяснили, что в Средние века в некоторые образцы дамасской и булатной стали добавляли небольшое количество ванадия (от 40 до 270 частей на миллион). Это улучшало свойства клинков. Однако неясно, где и как добывали редкий металл. Возможно, он входил в состав некоторых руд.

Применение
Помимо металлургии, ванадий используется и для других задач. Сечение теплового нейтронного захвата и короткий период полураспада изотопов, образующихся при захвате нейтронов, делают данный металл подходящим материалом для использования внутри термоядерного реактора.
Наиболее распространенный оксид ванадия — пентаоксид V2O5 — используется в качестве катализатора при производстве серной кислоты и в качестве окислителя в производстве малеинового ангидрида. Пеноксид ванадия используется при изготовлении керамических изделий.
Металл является важным компонентом смешанных металлоксидных катализаторов, используемых при окислении пропана и пропилена в акролеин, акриловую кислоту или аммоксидирование пропилена до акрилонитрила. Другой оксид ванадия – двуокись VO2 – используется при производстве стеклянных покрытий, которые блокируют инфракрасное излучение при определенной температуре.
Ванадиевая редокс-батарея представляет собой гальванический элемент, состоящий из водных ионов ванадия в различных состояниях окисления. Батареи такого типа были впервые предложены в 1930 годах, а коммерческое использование началось с 1980-х. Ванадат можно использовать для защиты стали от коррозии.
Ванадий имеет важное значение для здоровья человека. Он помогает регулировать углеродный и липидный обмен, участвует в выработке энергии. В сутки рекомендовано потреблять 6-63 мкг (данные ВОЗ) вещества, поступающего с пищевыми продуктами. Его вполне достаточно в крупах, бобовых, овощах, зелени, фруктах.
Источник: https://www.syl.ru/article/346444/vanadiy-svoystva-atomnaya-massa-formula-primenenie
Ванадий V
Ванадий в таблице менделеева занимает 23 место, в 4 периоде.
| Символ | V |
| Номер | 23 |
| Атомный вес | 50.9415000 |
| Латинское название | Vanadium |
| Русское название | Ванадий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь V: 1s2 2s2 2p6 3s2 3p6 4s2 3d3 Короткая запись:
V: [Ar] 4s2 3d3
- Одинаковую электронную конфигурацию имеют атом ванадия и Ti-1, Mn+2, Fe+3, Co+4
- Порядок заполнения оболочек атома ванадия (V) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
- На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
- Ванадий имеет 23 электрона, заполним электронные оболочки в описанном выше порядке:
- 2 электрона на 1s-подуровне
- 2 электрона на 2s-подуровне
- 6 электронов на 2p-подуровне
- 2 электрона на 3s-подуровне
- 6 электронов на 3p-подуровне
- 2 электрона на 4s-подуровне
- 3 электрона на 3d-подуровне
Степень окисления ванадия
Атомы ванадия в соединениях имеют степени окисления 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы ванадия
V 0
Валентность V
Атомы ванадия в соединениях проявляют валентность V, IV, III, II, I.
Валентность ванадия характеризует способность атома V к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа V
Квантовые числа определяются последним электроном в конфигурации, для атома V эти числа имеют значение N = 3, L = 2, Ml = 0, Ms = ½
Видео заполнения электронной конфигурации (gif): 

Источник: https://k-tree.ru/tools/chemistry/periodic.php?element=V
V — Ванадий

ВАНАДИЙ (лат. Vanadium), V (читается «ванадий»), химический элемент с атомным номером 23, атомная масса 50,9415. Природный ванадий представляет собой смесь двух нуклидов: стабильного 51V (99,76% по массе) и слабо радиоактивного 52V (период полураспада более 3,9·1017 лет). Конфигурация двух внешних электронных слоев 3s2p6d34s2. В периодической системе Менделеева расположен в четвертом периоде в группе VВ. Ванадий образует соединения в степенях окисления от +2 до +5 (валентности от II до V).
Радиус нейтрального атома ванадия 0,134 нм, радиус ионов V2+ — 0,093 нм, V3+ — 0,078 нм, V4+ — 0,067-0,086 нм, V5+ — 0,050-0,068 нм. Энергии последовательной ионизации атома ванадия 6,74, 14,65, 29,31, 48,6 и 65,2 эВ. По шкале Полинга электроотрицательность ванадия 1,63.
В свободном виде — блестящий серебристо-серый металл.
Физические и химические свойства: ванадий по внешнему виду похож на сталь, это достаточно твердый, но вместе с тем пластичный металл. Температура плавления 1920°C, температура кипения около 3400°C, плотность 6,11 г/см3. Кристаллическая решетка кубическая объемно центрированная, параметр а = 0,3024 нм.
Химически ванадий довольно инертен. Он стоек к действию морской воды, разбавленных растворов соляной, азотной и серной кислот, щелочей. С кислородом (O) ванадий образует несколько оксидов: VO, V2O3, V3O5, VO2,V2O5.
Оранжевый V2O5 — кислотный оксид, темно-синий VO2 — амфотерный, остальные оксиды ванадия — основные.
С галогенами ванадий образует галогениды составов VX2 (X = F, Cl, Br, I), VX3, VX4 (X = F, Cl, Br), VF5 и несколько оксогалогенидов (VOCl, VOCl2, VOF3 и др.).
Соединения ванадия в степенях окисления +2 и +3 — сильные восстановители, в степени окисления +5 проявляют свойства окислителей. Известны тугоплавкий карбид ванадия VC (tпл = 2800°С), нитрид ванадия VN, сульфид ванадия V2S5, силицид ванадия V3Si и другие соединения ванадия.
При взаимодействии V2O5 с основными оксидами образуются ванадаты — соли ванадиевой кислоты вероятного состава H2[O(V2O5)2.5].
История открытия: ванадий открыт в 1801 году мексиканским минералогом А. М. Дель Рио как примесь в свинцовой руде из рудника в Зимапане. Новый элемент Дель Рио назвал эритронием (от греческого erythros — красный) из-за красного цвета его соединений.
Однако впоследствии он решил, что им обнаружен не новый элемент, а разновидность хрома (Cr), открытого четырьмя годами ранее и еще почти не изученного. В 1830 мексиканским минералом занялся немецкий химик Ф. Велер, однако, отравившись фтористым водородом, он на несколько месяцев прекратил исследования. В том же году шведский химик Н.
Сефстрем обратил внимание на наличие в железной руде примеси, в которой наряду с известными элементами оказалось какое-то новое вещество. В результате анализа в лаборатории Й. Берцелиуса было доказано, что открыт новый элемент. Этот элемент образует соединения с красивой окраской, отсюда и название элемента, связанное с именем скандинавской богини красоты Ванадис.
В 1831 Велер доказал тождественность эритрония и ванадия, но за элементом сохранилось название, данное ему Сефстремом и Берцелиусом.
Нахождение в природе: в природе ванадий в свободном виде не встречается, относится к рассеянным элементам. Содержание ванадия в земной коре 1,6·10–2% по массе, в воде океанов 3.10–7%. Важнейшие минералы: патронит V(S2)2, ванадинит Pb5(VO4)3Cl и некоторые другие. Основной источник получения ванадия — железные руды, содержащие ванадий как примесь.
в промышленности при получении ванадия из железных руд с его примесью сначала готовят концентрат, в котором содержание ванадия достигает 8-16%.
Далее окислительной обработкой ванадий переводят в высшую степень окисления +5 и отделяют легко растворимый в воде ванадат натрия (Na) NaVO3.
При подкислении раствора серной кислотой выпадает осадок, который после высушивания содержит более 90% ванадия.
Первичный концентрат восстанавливают в доменных печах и получают концентрат ванадия, который далее используют при выплавке сплава ванадия и железа — так называемого феррованадия (содержит от 35 до 70% ванадия). Металлический ванадий можно приготовить восстановлением хлорида ванадия водородом (H), кальцийтермическим восстановлением оксидов ванадия (V2O5 или V2O3), термической диссоциацией VI2 и другими методами.
Применение: ванадий в основном используется как легирующая добавка при получении износоустойчивых, жаропрочных и коррозионно-стойких сплавов (прежде всего, специальных сталей), как компонент при получении магнитов.
Оксид ванадия V2O5 служит эффективным катализатором, например, при окислении сернистого газа SO2 в серный газ SO3 при производстве серной кислоты.
Соединения ванадия находят разнообразное применение в различных отраслях промышленности (текстильной, стекольной, лакокрасочной и др.).
Биологическая роль: ванадий постоянно присутствует в тканях всех организмов в ничтожных количествах. В растениях его содержание (0,1-0,2%) значительно выше, чем в животных (1·10–5-1·10–4%).
Некоторые морские организмы — мшанки, моллюски и, особенно, асцидии — способны концентрировать ванадий в значительных количествах (у асцидий ванадий находится в плазме крови или специальных клетках — ванадоцитах).
По-видимому, ванадий участвует в некоторых окислительных процессах в тканях. Мышечная ткань человека содержит 2·10–6% ванадия, костная ткань — 0,35·10–6%, в крови — менее 2·10–4% мг/л. Всего в организме среднего человека (масса тела 70 кг) 0,11 мг ванадия.
Ванадий и его соединения токсичны. Токсическая доза для человека 0,25 мг, летальная доза — 2-4 мг. Для V2O5 ПДК в воздухе 0,1-0,5 мг/м3.
Источник: http://WebElements.narod.ru/elements/V.htm
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Валентность ванадия, ниобия и тантала в соединениях бывает II, III, IV и V. Валентность V в обычных условиях наиболее стабильна. [1]
Валентность ванадия в соединениях, входящих в состав пород вторичного происхождения, вроде глин, известняков, песчаников, углей и железных руд, пока еще точно не установлена. Гиллебранд одно время считал, что ванадий в этих породах находится в пятивалентном состоянии, однако исследование некоторых содержащих ванадий песчаников2 Западного Колорадо, в которых ванадий оказался трехвалентным, показало несостоятельность этого взгляда. [2]
Валентность ванадия в окиснованадиевых работающих катализаторах зависит обычно не от состава, взятого для приготовления окисла ( V.
2 O5, V2O4, V2O3), а от состава реакционной смеси и условий протекания процесса.
При катализе водородо-кислородной смеси окислы ванадия окисляются до V2O6, независимо от их первоначального состава. [3]
Валентность ванадия в соединениях, входящих в состав пород вторичного происхождения, вроде глин, известняков, песчаников, углей и железных руд, пока еще точно не установлена. Гиллебранд одно время считал, что ванадий в этих породах находится в пятивалентном состоянии, однако исследование некоторых содержащих ванадий песчаников 2 Западного Колорадо, в которых ванадий оказался трехвалентный, показало несостоятельность этого взгляда. [4]
Обусловленное понижением валентности ванадия последовательное изменение окраски наглядно выявляется при действии Zn на солянокислый раствор NHUVOs. Пятивалентный ниобий восстанавливается цинком в кислой среде до МЬ 3, тогда как Та 5 совсем не восстанавливается. [5]
Следует, однако, подчеркнуть, что валентность ванадия ( и титана), определяемая в продуктах взаимодействия между компонентами катализатора методом окислительно-гидролитического титрования, во многих случаях в значительной степени занижена. [6]
Такая близость ьеличин нормальных потенциалов высших степеней валентности ванадия и хрома обусловливает большое сходство окислительно-восстановительных реакций этих элементов. [7]
Наиболее широко изученные хорошие катализаторы состоят РёР· соединений ванадия ( валентность ванадия — три или выше) Рё алкилпроизодных алюминия. Р’ состав РѕРґРЅРѕРіРѕ РёР· компонентов должен входить галоген.
Раздельное введение компонентов каталитической системы в реакционную смесь в присутствии мономера предпочтительно.
Средняя продолжительность жизни активного катализатора невелика Рё составляет РїСЂРё 30 РЎ приблизительно 5 — 10 РјРёРЅ. [8]
Таким образом, РїСЂРё возникновении 1 моль Рђ1 ( РЎ2Рќ5) 2РЎ1 валентность ванадия понижается РЅР° РѕРґРЅСѓ единицу, Р° РїСЂРё образовании 1 моль Рђ1 ( РЎ2Рќ5) 2РћРЎ2Рќ5 — РЅР° РґРІРµ единицы.
При значении исходного молярного соотношения А1 ( С2Н5) 3: VOC13 более 2 содержание хлора в растворе возрастает.
Рто объясняется трудностью восстановления ванадия РґРѕ одновалентной формы Рё установлением равновесия. [9]
Таким образом, РїСЂРё возникновении 1 моль Рђ1 ( РЎ2Рќ5) 2РЎ1 валентность ванадия понижается РЅР° РѕРґРЅСѓ единицу, Р° РїСЂРё образовании 1 моль Рђ1 ( РЎ2Рќ5) 2РћРЎ2Рќ5 — РЅР° РґРІРµ единицы.
При значении исходного молярного соотношения А1 ( С2Н5) 3: VOCl3 более 2 содержание хлора в растворе возрастает.
Рто объясняется трудностью восстановления ванадия РґРѕ одновалентной формы Рё установлением равновесия. [10]
Оксиды ванадия более низкой валентности характеризуются более высокими температурами плавления, поэтому поддержание низкой валентности ванадия может способствовать снижению деструкции цеолита. [11]
Таким образом, по этому механизму окисление металла протекает под воздействием кислорода из-за изменения валентности ванадия. [12]
Р�Р· приведенных схем РІРёРґРЅРѕ, что РїСЂРё образовании 1 моля Рђ1 ( РЎ2Рќ5) 2РЎ1 валентность ванадия понижается РЅР° РѕРґРЅСѓ единицу, Р° РїСЂРё образовании 1 моля ( РЎ2Рќ5) 2АЮСгН5 — РЅР° РґРІРµ единицы.
Р’ дальнейшем было установлено [45], что взаимодействие Рђ1 ( РЎ2Рќ8) 3 СЃ VOC13 РЅР° первой стадии протекает исключительно РїРѕ СЃРІСЏР·Рё ванадий — кислород, Р° РІ случае RA1 ( OR) G1 — РїРѕ СЃРІСЏР·Рё ванадий — хлор. [13]
Обнаруженные в работе Бобо [18] пять химических соединений по своим свойствам распадаются на две группы в зависимости от валентности ванадия.
Первые легко растворяются РІ разбавленных кислотах, вторые — только РІ концентрированных. Наиболее трудно растворим UVO5, РѕРЅ растворяется только РІ концентрированной горячей серной кислоте.
Соединения первой РіСЂСѓРїРїС‹ термически нестабильны, РѕРЅРё плавятся или разлагаются РїСЂРё температурах, близких Рє температуре плавления VaO5 — UVOs5 плавится СЃ разложением РїСЂРё 750 РЎ, РїСЂРё этом образуется пористый препарат, содержащий UsOs СЃ немного измененными параметрами. Соединения второй РіСЂСѓРїРїС‹ термически более устойчивы. РЎ, выше которой РѕРЅ разлагается РЅР° окисел урана Рё РґРІСѓРѕРєРёСЃСЊ ванадия. РЎ разлагается РЅР° UVOS Рё V2O5 РІ соответствии СЃ валентностью ванадия РІ РёСЃС…РѕРґРЅРѕРј соединении. [14]
Цредполагали, что первичные активные центры РјРѕРіСѓС‚ спонтанно переходить РІРѕ вторичные / менее активные / РїРѕ мономолекулярному механизму, принимать участие РІ реакция роста полимерной цепи или дезакти-визироваться СЃ понижением валентности ванадия. Рта последняя реакция, РїРѕ-РІРёРґРёРјРѕРјСѓ, бимолекулярна Рё может протекать СЃ участием затоми нигалкила. [15]
Страницы: 1 2
Источник: https://www.ngpedia.ru/id313171p1.html




