

Не все знают, что под пугающим названием «галогены» зачастую скрываются распространенные в быту вещества. Не в чистом виде, но все-таки. Отдельными представителями «семейства» ежедневно пользуется каждый человек.
Приведём примеры:
-
На упаковке любой зубной пасты имеется словосочетание со словом «фтор». Полезен для зубной эмали.
-
Хлор знаком любой домохозяйке и сотруднику клининговой компании. А уж его запах знают все, кто посещал бассейн или лечебные учреждения России. Не пустой звук для советских школьников. Даже не из курса химии, а из уроков химзащиты в рамках начальной военной подготовки (НВП).
-
Про «бром» ходили легенды среди военнослужащих СССР. Насколько сведения достоверны – неизвестно.
-
Темно-коричневая бутылочка с «йодом» – постоянный спутник любителя поиграть с котенком и непоседливого ребенка. Распространенный антисептик.
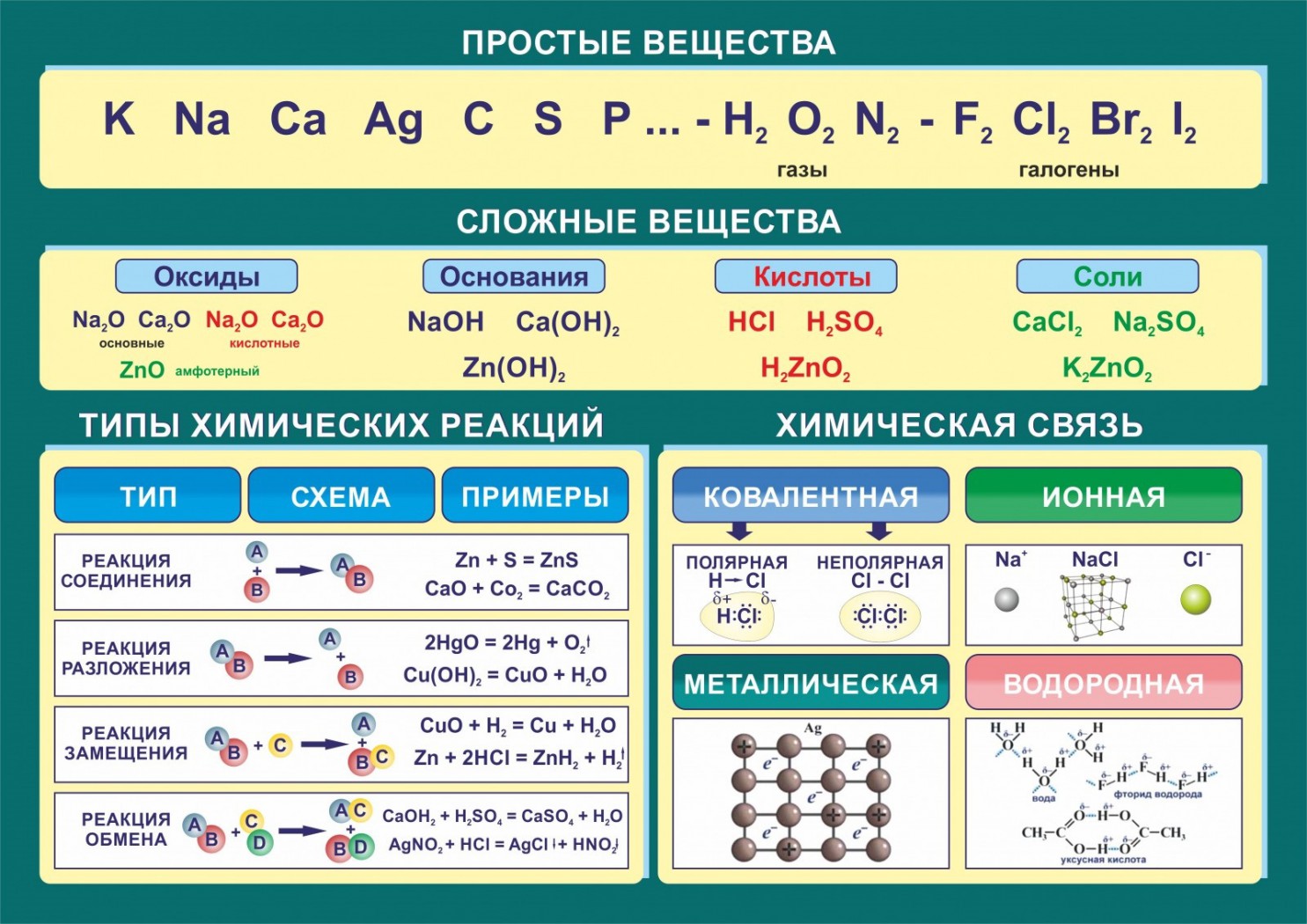
Что такое галогены
Определяют, как элементы 17-ой группы таблицы Менделеева. Сторонники «старой школы» выразились бы: «главной подгруппы VII группы».
Название представляет собой компиляцию греческих слов. Означает приблизительно «солерождающий». Такое определение было дано в XIX веке британским ученым Гэмфри Дэви.
Перечень и общая характеристика галогенов

С первыми четырьмя элементами из списка некоторое знакомство имеется. Надо заметить, что вещества хоть и достаточно распространенные, но в чистом виде в природе не встречаются. Только в составе соединений.

Астат – элемент не просто редкий, а самый редкий из всех встречающихся на планете. Его «запасы» оцениваются в 1 г. Свойства доподлинно не известны. Так как из-за радиоактивности и мизерной «продолжительности жизни» в достаточных количествах выделить не получилось.
Теннессин существует скорее теоретически. На Земле, по крайней мере, не нашли. Рекордное зафиксированное (и признанное) в лаборатории количество – 6 ядер. Включая изотоп.
Зато точно известен общий принцип построения наружного энергетического уровня: ns2np5. Под «n» понимается период расположения элемента.
Легко заметить, что до «идеальных» инертов не хватает всего-то электрончика. А так хочется. Не удивительно, что так агрессивны.
Физические свойства

Галогены – ярко выраженные неметаллы. Летучи, с характерно едким «ароматом». Причем для йода (I2) жидкое агрегатное состояние вообще не характерно. При разогреве просто испаряется фиолетовым дымком.
Хлор – настоящее боевое отравляющее вещество. И применялось в таком качестве. Попадая в незащищенные глаза и органы, образует кислоты. С соответствующими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг/л.
Насыщенность цветов с «утяжелением» ядер возрастает. Активность, напротив, падает.
В воде растворимость ограничена. Лучше ведёт себя с органическими растворителями. Растворы оригинально окрашены: от слабо желтого до фиолетового.
Химические свойства галогенов
Галогены (Hal) — мощные окислители, а фтор агрессивен настолько, что вступает в реакцию с собратьями. Происходит это при подогреве. Степень окисления «пострадавших» оказывается +1.
Общее уравнение:
![]()
- Можно сказать, что F реагирует со всеми простыми субстанциями, кроме отдельных благородных газов. А так (с облучением):
![]()
Остальные элементы ряда не взаимодействуют с:
- O;
- N;
- С (в модификации алмаза);
- Pt, Au;
- Xe, Kr.
С неметаллами
Водород окисляет фтор при любых условиях, со взрывом. Cl с подсветкой УФ или подогревом. Но тоже громко. Остальные только с нагреванием. Но уравнение едино:
![]()
- С фосфором взаимодействуют совершенно по-разному:
- ∗ F до получения пентафторида. Единственный, без нагревания:
![]()
- ∗ хлор и бром, в зависимости от концентрации:
- ∗ йод – недостаточно мощный окислитель:
∗ с серой также не все очевидно. Но только не с фтором. Окисление максимально, но с нагревом:
- ∗ бром и хлор реагируют нетипично и «неохотно»:
С металлами
Перед фтором ничто не устоит. Даже благородный класс, хоть и с нагревом:
- Остальные металлы прочим галогенам по силам. Не без подогрева:
Реакции замещения
Агрессивные вытесняют «тяжелых» соседей по группе:
- И с неметаллами не церемонятся:
- Хлор, как более активный, ведет себя несколько по-другому:
С водой
Фтор в своем репертуаре. Вода будет пылать синим пламенем и норовить плюнуть плавиковой кислотой:
- Хлор с бромом гораздо спокойнее. Да и процессы нестабильны, обратимы:
Йод с водой в видимые взаимодействия не вступает.
С растворами щелочей
И в этом случае фтор проявляется как резкий окислитель:
- Остальные ведут себя, как с водой. Но процесс при разных температурах проходит по разным сценариям:
Йод реагирует только по второму варианту.
Получение
Выделить вещество настолько активное, что норовит прореагировать со всем окружающим, не так просто.
Фтор
Обычно получают из сложных солей. При интенсивном нагреве (термолиз) провоцируется распад на более простые и нужный газ.
Или электролизом KF*3HF. Аналогичный метод применяется в промышленности.
Хлор
Из соляной кислоты. Неприятно и опасно даже в условиях лаборатории:
- Индустриально добывают из распространенной поваренной соли при помощи электролиза:
Бром и йод
«На коленке» – из солей. Окислителями, в кислом же окружении:
Химзаводам за сырьем ходить не надо. Морская вода, скважные жидкости. Остатки сожженных океанских/морских водорослей – настоящая йодная руда.
Применение галогенов
Как уже упоминалось, фтор применяется в лечебных и профилактических средствах. Соединения необходимы для изготовления алюминия.
Основная часть производимого хлора используется для синтеза соляной кислоты. Необходим в химической индустрии. Для сельскохозяйственных, бытовых ядохимикатов, чистящих средств, отбеливателей. Для очистителей воды.
Бром и йод применяются для медикаментов и в химической отрасли.
Заключение
О свойствах галогенов можно писать бесконечно. В данной статье не затрагивались темы взаимодействий с органическими веществами, например.
А ведь без них невозможен, скажем, фотосинтез. Одна из основ жизни. Без соляной кислоты невозможно пищеварение высших животных. Об этом мы расскажем в следующих публикациях.
Источник: https://nauka.club/khimiya/galogeny.html
Галогены
Галогены (греч. hals — соль + genes — рождающий) — химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np5:
- F — 2s22p5
- Cl — 3s23p5
- Br — 4s24p5
- I — 5s25p5
- At — 6s26p5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.

Природные соединения
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CaF2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит

Простые вещества — F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
- NaCl + H2O → (электролиз) NaOH + H2↑ + Cl2↑
- Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF — был впервые получен фтор.
- HF → F2 + H2
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
Cl2 + KBr → Br2 + KCl
Cl2 + KI → I2 + KCl

- В лабораторных условиях галогены могут быть получены следующими реакциями.
- HCl + MnO2 → MnCl2 + Cl2 + H2O
- HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
- Химические свойства
- Реакции с металлами
- Al + F2 → AlF3
- Cu + Cl2 → CuCl2
- Na + Br2 → NaBr
- Реакции с неметаллами
- F2 + H2 → HF (в темноте со взрывом)
- Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность ?
- Br2 + F2 → BrF (фтор более электроотрицателен, чем бром — F-)
- Br2 + I2 → BrI3 (бром более электроотрицателен, чем йод — I-)
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
- KCl + F2 → KF + Cl2
- KBr + Cl2 → KCl + Br2
- KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl2 + Si → SiCl4
Cl2 + H2 → HCl (на свету)

Реакция фтора с водой протекает очень энергично, носит взрывной характер.
H2O + F2 → HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + NaOH → (t) NaCl + NaClO3 + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
- Получение
- В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
- H2 + Cl2 → HCl
- В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
- NaCl + H2SO4 → NaHSO4 + HCl↑
- CaF2 + H2SO4 → CaSO4 + HF
- PBr3 + H2O → HBr↑ + H3PO3
- H2S + I2 → S + HI
- Химические свойства
- Кислотные свойства
- Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
- Na2O + HCl → NaCl + H2O
- ZnO + HI → ZnI2 + H2O
- KOH + HCl → KCl + H2O (реакция нейтрализации)
- С солями
- Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
- AgNO3 + HCl → AgCl + HNO3
- Li2CO3 + HBr → LiBr + H2CO3
- Восстановительные свойства
- В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
- HI + MnO2 → I2 + MnI2 + H2O
- HI + H2SO4 → I2 + H2S + H2O
- HI + O2 → H2O + I2
- HI + Br2 → HBr + I2
- HCl + H2SO4 → Cl2 + SO2 + H2O
- Реакция с оксидом кремния
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты. Mg + HBr → MgBr2 + H2↑ Zn + HCl → ZnCl2 + H2↑ 

Cr(OH)3 + HCl → CrCl3 + H2O
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
SiO2 + HF → SiF4 + H2O
Источник: https://studarium.ru/article/175
Общая характеристика галогенов — урок. Химия, 8–9 класс
Общая характеристика элементов
- Галогены — элементы (VIIA) группы периодической системы: фторF, хлорCl, бромBr, иодI и астатAt.
- Астат является радиоактивным элементом и встречается в природе редко.
- Все галогены относятся к неметаллам.
- В атомах галогенов на внешнем энергетическом уровне находится по (7) электронов:
- F +9)2)7
- Cl +17)2)8)7
- Br +35)2)8)18)7
- I +53)2)8)18)18)7
- Валентные электроны галогенов образуют три электронные пары, а один электрон внешнего энергетического уровня остаётся неспаренным.
С возрастанием порядкового номера от фтора к иоду увеличиваются радиусы атомов, снижается их электроотрицательность. Значит, неметаллические свойства галогенов по группе сверху вниз ослабевают.
До завершения внешнего электронного слоя атомам галогенов не хватает только одного электрона, поэтому им наиболее характерна степень окисления (–1).
У фтора электроотрицательность больше, чем у остальных элементов, и поэтому степень окисления (–1) — его единственная возможная степень окисления в соединениях.
Атомы других галогенов способны также и отдавать валентные электроны, проявляя при этом положительные степени окисления (+1), (+3), (+5), (+7). Так, положительные степени окисления атомы хлора проявляют в соединениях с более электроотрицательными фтором, кислородом и азотом.
Галогены образуют с металлами соединения с ионной связью, а с другими неметаллами — соединения с ковалентной полярной связью.
Общая характеристика простых веществ
Атомы галогенов соединяются попарно и образуют двухатомные молекулы: F2, Cl2, Br2, I2.
Связь в молекулах ковалентная неполярная, одинарная. Кристаллическая решётка — молекулярная. Поэтому у галогенов невысокие температуры кипения и плавления.
При обычных условиях фтор представляет собой светло-жёлтый газ, хлор — жёлто-зелёный газ, бром — красно-коричневую жидкость, иод — тёмно-фиолетовые кристаллы.

Фтор

Хлор
Бром

Иод
Твёрдый иод при нагревании легко возгоняется (переходит в газообразное состояние и обратно в твёрдое, не превращаясь в жидкость).

- Возгонка иода
- У всех галогенов — резкий неприятный запах, и они очень токсичны.
- В ряду галогенов с увеличением относительной молекулярной массы возрастают температуры кипения и плавления, увеличивается плотность, более интенсивной становится окраска.
- В воде галогены растворяются слабо.
- Фтор с водой вступает в химическую реакцию и вытесняет из неё кислород:
- 2F2+2H2O=4HF+O2↑.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/galogeny-khlor-i-ego-soedineniia-161110/re-798cd5b5-38ea-48f2-aed3-2d2396cded6f
Подгруппа VII a. Галогены
 Галогены (от греч. halos — соль и genes — образующий) — элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
Галогены (от греч. halos — соль и genes — образующий) — элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
- Общая электронная конфигурация внешнего энергетического уровня — nS2nP5.
- С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства);
- Галогены — сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
| Символ элемента | F | Cl | Br | I | At |
| Порядковый номер | 9 | 17 | 35 | 53 | 85 |
| Строение внешнего электронного слоя | 2s22p5 | 3s23p5 | 4s24p5 | 5s25p5 | 6s26p5 |
| Энергия ионизации, эв | 17,42 | 12,97 | 11,84 | 10,45 | ~9,2 |
| Относительная электроотрицательность (ЭО) | 4,0 | 3,0 | 2,8 | 2,5 | ~2,2 |
| Радиус атома, нм | 0,064 | 0,099 | 0,114 | 0,133 | – |
| Степени окисления | -1 | -1, +1, +3, +5, +7 |
-1, +1, +3 +5, +7 |
-1, +1, +3, +5, +7 |
– |
- Молекулы галогенов состоят из двух атомов.
- С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
- Получение
- Фтор получают электролизом расплава гидрофторида калия KHF2 (разлагается лишь HF):
- 2HF → H2 + F2
- Анод: 2F— — 2ē → F2
- В промышленности хлор в основном получают электролизом водного раствора хлорида натрия:
- 2NaCl + 2Н2О → Н2↑ + 2NaОН + Сl2↑
- В лаборатории хлор получают действием различных окислителей на соляную кислоту:
- МnО2 + 4НСl → МnСl2 + Сl2↑ + 2Н2О
- 2KMnO4 + 16HCl →2MnCl2 + 5Cl2 + 2KCl + 8H2O
- K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
- Аналогично получают бром и иод, окисляя НВr, НI или их соли:
- 6КВr + К2Сr2О7 +7Н2SО4 → ЗВr2 + Сr2(SО4)3 + 4К2SО4 + 7Н2О.
- Химические свойства F2
- Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду.
- Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты:
- 2Аl + 3F2 → 2АlF3
- 2Fе + 3F2 → 2FеF3
- Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические:
- Н2 + F2 → 2НF (со взрывом)
- Si + 2F2 → SiF4(г)
- При нагревании фтор окисляет все другие галогены (их степень окисления +1):
- Cl2 + F2 → 2ClF
- При облучении фтор реагирует даже с инертными (благородными) газами:
- Хе + F2 → ХеF2
- Взаимодействие фтора со сложными веществами также протекает очень энергично:
- 3F2 + ЗН2О → F2О↑ + 4НF + Н2О2 (со взрывом)
- Химические свойства Сl2
- Свободный хлор реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов:
- 2Аl + ЗСl2 → 2АlСl3(кр)
- 2Fе + ЗСl2 → 2FeСl3(кр)
- Si + 2Сl2 → SiCl4(ж)
- Н2 + Сl2 → 2НСl(г)
- Реакция замещения и присоединения с углеводородами:
- СН3-СН3 + Сl2 → СН3-СН2Сl + НСl,
- СН2=СН2 + Сl2 → СН2Cl — СН2Сl.
- Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
- Сl2 + 2НВr → 2НСl + Вr2,
- Сl2 + 2НI → 2НСl + I2,
- Сl2 + 2КВr → 2КСl + Вr2
- Обратимо реагирует с водой:
- Сl2 + Н2О↔ НСl + НСlO (хлорная вода)
- С щелочами:
- Сl2 + 2NаОН → NаСl + NаСlO + Н2О (на холоде),
- ЗСl2 + 6КОН → 5КСl + КClO3 + ЗН2О (при нагревании).
- Химические свойства Br2
- По химической активности бром занимает промежуточное положение между хлором и иодом. Взаимодействует со многими простыми веществами:
- 2Аl + ЗВr2 → 2АlВr3(кр)
- Si +2Вr2 → SiBr4(ж)
- Н2 + Вr2 → 2НВr(г)
- Бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду»:
- Br2 + H2O = HBr + HBrO
- При растворении в растворах щелочей на холоду происходит образование бромида и гипобромита
- 2NaOH + Br2 =NaBr + NaBrO + H2O
- При повышенных температурах (около 100°С) — бромида и бромата:
- 6NaOH + 3Br2 = 5NaBr + NaBrO3 + 3H2O.
- При реакции брома с растворами иодидов выделяется свободный иод:
Br2+ 2KI = I2+ 2KBr.
С органическими веществами, имеющими двойную или тройную связь. Обесцвечивание бромной воды – качественная реакция на непредельное соединение:
C2H4 + Br2 = C2H4Br2.
Химические свойства I2
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании.
- Взаимодействие же йода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
- Н2 + I2 ↔2НI
- Йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды».
- Но йод способен растворяться в растворах иодидов с образованием комплексных анионов:
- I2 + I− → I−3.
- Образующийся раствор называется раствором Люголя.
- Сероводород H2S, тиосульфат натрия Na2S2O3 и другие восстановители восстанавливают его до I— :
- I2 + H2S = S + 2HI
- Хлор и другие сильные окислители в водных растворах переводят его в IO3— :
- 5Cl2 + I2 + 6H2O = 2HIO3 + 10НСl
- Адсорбируясь на крахмале, йод окрашивает его в темно-синий цвет- качественная реакция на йод.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к йоду. Каждый галоген в ряду F — I может вытеснять последующий из его соединений с водородом или металлами, т.е. каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов.

Источник: http://himege.ru/podgruppa-vii-a-galogeny/
2.3.1. Химические свойства водорода и галогенов
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов.
Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов.
Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:

С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
- Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
- Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
- При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
- В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген.
Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике.
Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ.
Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены.
К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
- При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
- Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
- Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
- Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5).
При этом происходит образование пентафторида фосфора:
- При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
- При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
- Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
- Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
- Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
- Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
- Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
- Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
- а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-vodoroda-i-galogenov
Галогены — это… Что такое Галогены?
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 14 декабря 2011. |
|
|||
|
|||
|
|||
|
Галоге́ны (от греч. ἁλός — соль и γένος — рождение, происхождение; иногда употребляется устаревшее название гало́иды) — химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева (по устаревшей классификации — элементы главной подгруппы VII группы)[1].
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается.
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Распространённость элементов и получение простых веществ
Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений.
Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к иоду. Количество астата в земной коре измеряется граммами, а унунсептий в природе отсутствует. Фтор, хлор, бром и иод производятся в промышленных масштабах, причем хлор производится в гораздо больших количествах.
В природе эти элементы встречаются в основном в виде галогенидов (за исключением иода, который также встречается в виде иодата натрия или калия в месторождениях нитратов щелочных металлов).
Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах.
Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF2).
Основным способом получения простых веществ является окисление галогенидов. Высокие положительные стандартные электродные потенциалы Eo(F2/F−) = +2,87 В и Eo(Cl2/Cl−) = +1,36 В показывают, что окислить ионы F− и Cl− можно только сильными окислителями. В промышленности применяется только электролитическое окисление.
При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале (+1,32 В) и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г.
французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF2 в безводной плавиковой кислоте.
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. При этом протекают следующие реакции:
полуреакция на аноде:
полуреакция на катоде:
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом оказался катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na+ переходить из анодного пространства в катодное.
Переход катионов поддерживает электронейтральность в обеих частях электролизёра, так как в течение электролиза отрицательные ионы удаляются от анода (превращение 2Cl− в Cl2) и накапливаются у катода (образование OH−).
Перемещение OH− в противоположную сторону могло бы тоже поддерживать электронейтральность, но ион OH− реагировал бы с Cl2 и сводил на нет весь результат.
Бром получают химическим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения иода из природных рассолов, богатых I−. В качестве окислителя в обоих случаях используют хлор, обладающий более сильными окислительными свойствами, а образующиеся Br2 и I2 удаляются из раствора потоком воздуха.
Физические свойства галогенов
Фтор является трудносжижаемым, а хлор легкосжижаемым газом с удушливым резким запахом. Энергия связи галогенов сверху вниз по ряду изменяется не равномерно.
Фтор имеет аномально низкую энергию связи (151 кДж/моль), это объясняется тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (Cl2 243, Br2 199, I2 150,7, At2 117 кДж/моль).
От хлора к астату энергия связи постепенно ослабевает, что связано с увеличением атомного радиуса. Аналогичные аномалии имеют и температуры кипения (плавления):
| Простое вещество | Температура плавления, °C | Температура кипения, °C |
| F2 | −220 | −188 |
| Cl2 | −101 | −34 |
| Br2 | −7 | 58 |
| I2 | 113,5 | 184,885 |
| At2 | 244 | 309[2] |
Химические свойства галогенов
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к астату. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Al + 3F2 = 2AlF3 + 2989 кДж,
2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
Н2 + F2 = 2HF + 547 кДж,
Si + 2F2 = SiF4(г) + 1615 кДж.
При нагревании фтор окисляет все другие галогены по схеме
Hal2 + F2 = 2НalF
где Hal = Cl, Br, I, At, причем в соединениях HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
Хе + F2 = XeF2 + 152 кДж.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
3F2 + ЗН2О = OF2↑ + 4HF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж,
2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж,
Si + 2Cl2 = SiCl4(Ж) + 662 кДж,
Н2 + Cl2 = 2HCl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + hν → 2Cl,
Cl + Н2 → HCl + Н,
Н + Cl2 → HCl + Cl,
Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов (hν), которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
СН3-СН3 + Cl2 → СН3-СН2Cl + HCl,
СН2=СН2 + Cl2 → СН2Cl — СН2Cl.
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
Cl2 + 2HBr = 2HCl + Br2,
Cl2 + 2HI = 2HCl + I2,
Cl2 + 2KBr = 2KCl + Br2,
а также обратимо реагирует с водой:
Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1 (в HCl), у других +1 (в хлорноватистой кислоте HOCl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде),
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
Si + 2Br2 = SiBr4(ж) + 433 кДж,
Н2 + Br2 = 2HBr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен её окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов:
I2 + I− → I−3.
Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату.
Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов. Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием):
2Li + At2 = 2LiAt — астатид лития.
А при диссоциации образуются не только протоны, но и ионы At+:HAt диссоц. на:2HAt=H++At-+H-+At+.
Примечания
- ↑ Таблица Менделеева на сайте ИЮПАК
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 211. — 623 с. — 100 000 экз.
Источник: https://dic.academic.ru/dic.nsf/ruwiki/81674




