
Определение органических веществ записано в учебнике химии, но не каждый может его дословно воспроизвести. А зря, ведь органические вещества составляют большинство из известных веществ в природе. На сегодняшний день таких соединений наука насчитывает свыше 20 миллионов.
Имеются в виду не только образующие биологические организмы (в клетке их около трети по массе). Целые государства существуют за счет продажи продуктов предположительно органического происхождения (нефть, природный газ). Последние во многом определяют энергетическую составляющую мирового производства. Плюс залежи каменного угля.
Огромно значение данные вещества имеют в химической индустрии. Например, без кокса невозможна выплавка ферроуглеродных сплавов.
Что такое органические вещества
Это все углеродосодержащие соединения. Примеры и характеристика органических веществ приведены ниже.

Не входят в «братство»:
- карбиды;
- соли угольной кислоты;
- отдельные оксиды;
- роданиды;
- цианиды.
Многообразие группы объясняется необычными свойствами «прародителя» C:
- образует цепи, в том числе замкнутые;
- поддерживает одинарные и больше связи;
- прочно связывается с большинством элементов;
- обладает способностью синтезировать изомеры. Соединения с изменчивой топологией. То есть идентичные по составу и массе молекулы, отличные в структуре;
- гомология – добавление группы CH2.
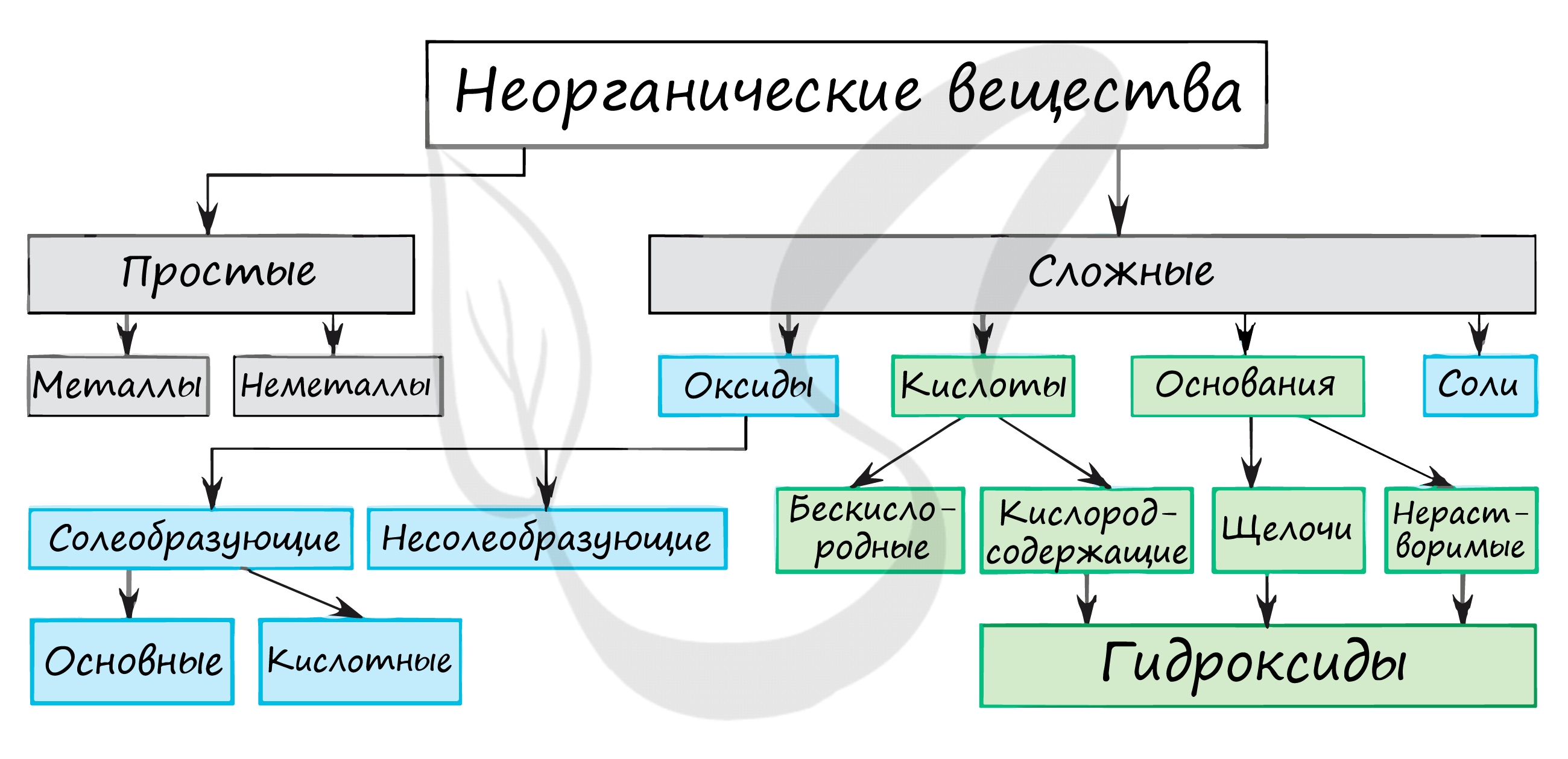
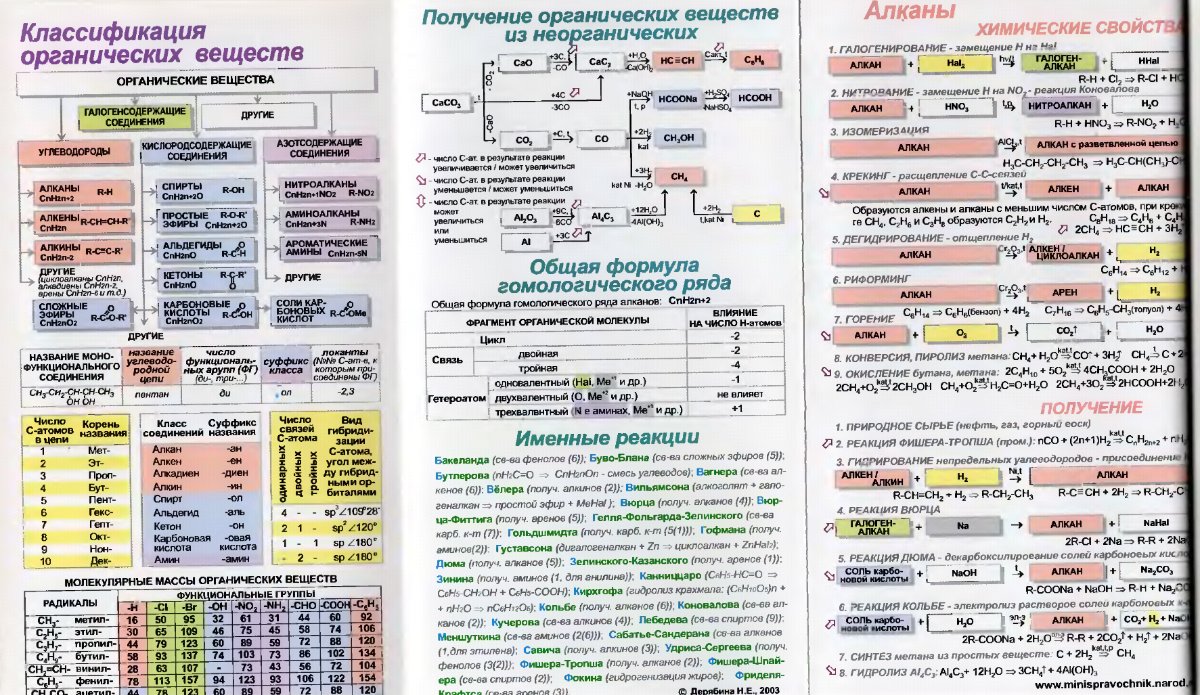
Классификация органических веществ
Разделяют по особенностям углеродной цепи и функциональным группам. Ниже дано описание и приведены структурные формулы органических веществ по классам.
По углеродному скелету

- Под ациклическими и циклическими понимают незамкнутую или замкнутую углеродную связь соответственно.

Как видно, представители могут иметь разветвленное строение. Имеет значение количество взаимосвязей углеродной основы. Включают спирты, кетоны, кислоты и подобные.
Из интересных веществ – ацетон, метанол, искусственное топливо (бензин), уксусная кислота.

В карбоциклическом кольце не попадаются чужеродные атомы. Только углерод. Из представителей получают пигменты (окрашивающие препараты), синтезируют смолы и пластики.

В гетероциклических кольцах имеют место вкрапления кислорода, азота, серы и не только. Применяют для производства красителей, лекарственных препаратов, пластиков.
По группам
Органические вещества или углеводороды, как следует из термина, содержат исключительно C и H. Разнообразие вносят функциональные группы с отличными атомами.

Спирты подразделяют на одно- и многоатомные. В зависимости от числа групп –OH. В фенолах группа присоединена к ароматическому кольцу.

- Одноатомные спирты используют для пищевой и химической промышленности.
- Этиленгликоль применяют для получения искусственных волокон и незамерзающих жидкостей (антифризов).
- Глицерин – для лекарственных средств, парфюмерии, легкой промышленности и взрывчатых веществ.
Фенолы аналогично подразделяют на одно-, двух- и многоатомные. Собственно, фенол, типичный представитель, важен в синтезе смол, а как антисептик используется в медицинской отрасли.
Альдегиды и кетоны используют как сырье для синтеза смол, полимеров, медикаментов, дезинфицирующих препаратов, консервантов. Высшие – для одеколонов и духов. Ацетон – универсальный растворитель.
Карбоновые кислоты классифицируются по числу карбоксильных групп. Применяются в легкой и пищевой промышленности (добавки), в парфюмерии, для органического синтеза.
Нитросоединения, содержащие азот органику — являются потенциально взрывчатыми веществами. А отдельные – не потенциально. Для чего нужны и так понятно. Пример – тринитротолуол. Он же тротил.
Амины – органоаммиачные соединения. Большинство ядовито, некоторые канцерогенны. Характерный представитель – анилин. Участвуют в изготовлении смол, пигментов, клеящих средств, искусственных волокон. Также нужны для изготовления пестицидов, гербицидов, удобрений, медицинских препаратов (уротропин).
Галогенопроизводные, содержащие хлор (фреоны), ранее использовались в качестве хладагента в морозильном оборудовании. Но из-за вреда озоновому слою не рекомендуются.
Химикаты в индустрии являются растворителями, сырьем для инсектицидов и т. п. Жутковатый представитель семейства, синильная кислота – не только ингредиент боевых отравляющих веществ. Без нее затруднительна добыча драгоценных металлов и покрытие ими поверхностей.
То, из чего состоят все организмы. От высших животных до микроводорослей.
Белки
Объединенные пептидной связью α-аминокислоты.
Посмотрим, какими свойствами они обладают, и какие функции выполняют:
- обеспечивают рост клеток;
- составляют энзимы и отдельные гормоны;
- поддерживают наличие антител для иммунитета, свертываемость крови;
- отвечают за перемещение необходимых для жизнедеятельности веществ;
- белки-ферменты ускоряют биохимические взаимодействия.
Часть поставляется с пищей, остальные производится организмом.
Липиды
Делят на простые (жирные кислоты + глицерин) и сложные (с высокомолекулярными кислотами).
Характеристика:
- действующие и резервируемое питание (1 г – 39 кДж);
- поддерживают рост клеточных перегородок;
- смягчение ударов;
- термоизоляция;
- участвуют в гормональной регуляции;
- при окислении выделяют воду;
- растворяя, переводят витамины в усваиваемую форму.
Углеводы
Простые и сложные сахара.
Кратко охарактеризуем:
- основное питание клетки (1 г – 18 кДж);
- материал оболочки клетки;
- запас энергии;
- некоторые не позволяют крови свертываться в сосудах.
Человек состоит из органических веществ и окружен ими. Скорее можно перечислить неорганических соседей: стекло, металл да керамика.
Даже электроника постепенно переходит на органику. Без нее немыслимы сельское хозяйство, фармацевтика. Великая наука – органическая химия.
Источник: https://nauka.club/khimiya/organicheskie-veshchestva.html
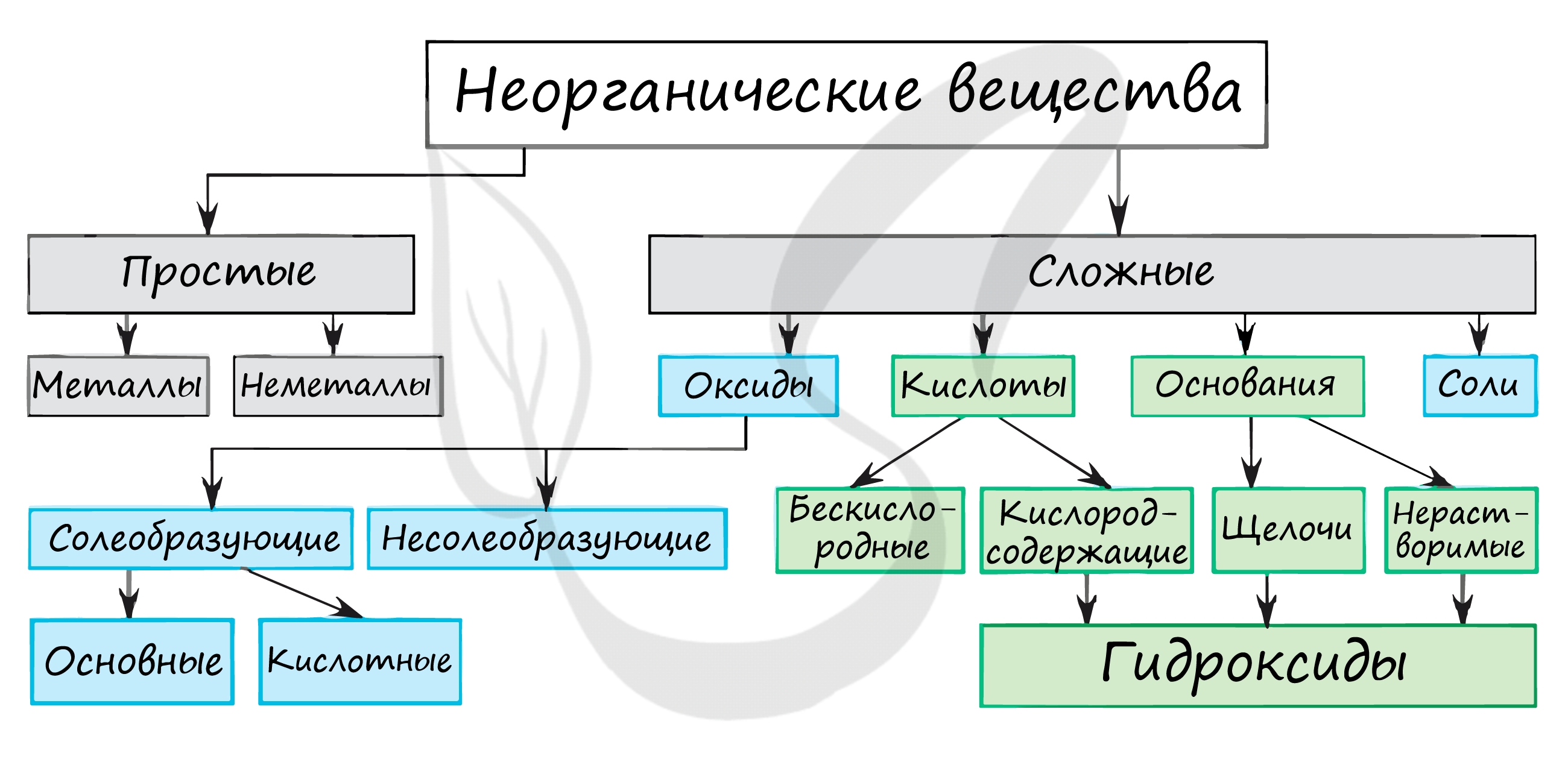
Классификация органических соединений
Органические соединения отличаются своей многочисленностью и разнообразием. Поэтому необходима их систематизация.
- Органические соединения классифицируют, учитывая два основных структурных признака:
- — строение углеродной цепи(углеродного скелета);
- — наличие и строение функциональных групп.
- — Углеродный скелет (углеродная цепь) — последовательность химически связанных между собой атомов углерода.
- — Функциональная группа — атом или группа атомов, определяющие принадлежность соединения к определенному классу и ответственные за его химические свойства.
Классификация соединений по строению углеродной цепи
В зависимости от строения углеродной цепи органические соединения делят на ациклические и циклические.

Ациклические соединения — соединения с открытой (незамкнутой) углеродной цепью. Эти соединения называются также алифатическими.
Среди ациклических соединений различают предельные (насыщенные), содержащие в скелете только одинарные связи C-C и непредельные (ненасыщенные),включающие кратные связи C = C и C C.
Ациклические соединения
— предельные:

— непредельные:
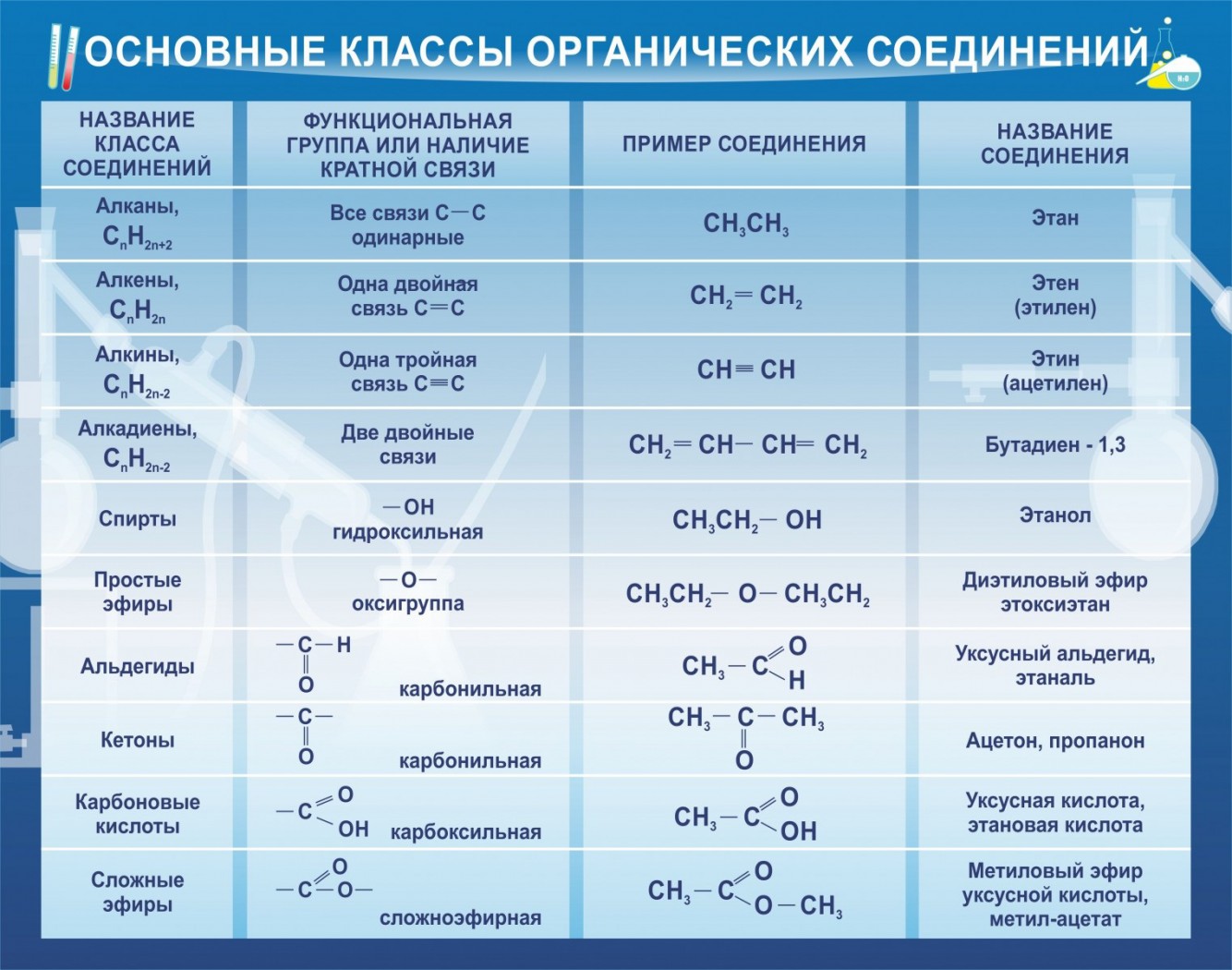
Ациклические соединения подразделяют также на соединения с не разветвленной и разветвленной цепью. В этом случае учитывается число связей атома углерода с другими углеродными атомами.
- Цепь, содержащая только первичные и вторичные атомы углерода, называется не разветвленной или нормальной (обозначается буквой «н-» перед названием соединения).
- Цепь, в которую входят третичные или четвертичные атомы углерода, является разветвленной (в названии часто обозначается приставкой «изо» ).
- Например:

- Атомы углерода:
- — первичный;
- — вторичный;
- — третичный.
- Циклические соединения — соединения с замкнутой углеродной цепью.
- В зависимости от природы атомов, составляющих цикл, различают карбоциклические и гетероциклические соединения.
Карбоциклические соединения содержат в цикле только атомы углерода. Они делятся на две существенно различающихся по химическим свойствам группы: алифатические циклические — сокращенно алициклические — и ароматические соединения.
Карбоциклические соединения
— алицеклические:

— ароматические:

Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов — гетероатомов ( от греч. heteros- другой, иной) — кислород, азот, серу и др.
Гетероциклические соединения

- Соединения, в состав которых входят только углерод и водород, называются углеводородами.
- Другие, более многочисленные, органические соединения можно рассматривать как производные углеводородов, которые образуются при введении в углеводороды функциональных групп, содержащих другие элементы.
- В зависимости от природы функциональных групп органические соединения делят на классы. Некоторые наиболее характерные функциональные группы и соответствующие им классы соединений приведены в таблице:
Классы органических соединений

- Примечание: к функциональным группам иногда относят двойную и тройную связи.
- В состав молекул органических соединений могут входить две или более одинаковых или различных функциональных групп.
- Например: HO- CH2-CH2 -OH (этиленгликоль); NH2 -CH2 — COOH (аминокислота глицин).
Все классы органических соединений взаимосвязаны. Переход от одних классов соединений к другим осуществляется в основном за счет превращения функциональных групп без изменения углеродного скелета. Соединения каждого класса составляют гомологический ряд.
Источник: http://examchemistry.com/content/lesson/orgveshestva/klassifikaciaorgvev.html
Органические соединения. Классы органических соединений :
Все вещества, которые содержат углеродный атом, помимо карбонатов, карбидов, цианидов, тиоционатов и угольной кислоты, представляют собой органические соединения.
Это значит, что они способны создаваться живыми организмами из атомов углерода посредством ферментативных или прочих реакций.
На сегодняшний день многие органические вещества можно синтезировать искусственно, что позволяет развивать медицину и фармакологию, а также создавать высокопрочные полимерные и композитные материалы.

Классификация органических соединений
Органические соединения являются самым многочисленным классом веществ. Здесь присутствует порядка 20 видов веществ. Они различны по химическим свойствам, отличаются физическими качествами. Их температура плавления, масса, летучесть и растворимость, а также агрегатное состояние при нормальных условиях также различны. Среди них:
- углеводороды (алканы, алкины, алкены, алкадиены, циклоалканы, ароматические углеводороды);
- альдегиды;
- кетоны;
- спирты (двухатомные, одноатомные, многоатомные);
- простые эфиры;
- сложные эфиры;
- карбоновые кислоты;
- амины;
- аминокислоты;
- углеводы;
- жиры;
- белки;
- биополимеры и синтетические полимеры.
Данная классификация отражает особенности химического строения и наличие специфических атомных групп, определяющих разность свойств того или иного вещества. В общем виде классификация, в основе которой лежит конфигурация углеродного скелета, не учитывающая особенностей химических взаимодействий, выглядит по-другому. Соответственно ее положениям, органические соединения делятся на:
- алифатические соединения;
- ароматические вещества;
- гетероциклические вещества.
Данные классы органических соединений могут иметь изомеры в разных группах веществ. Свойства изомеров различны, хотя их атомный состав может быть одинаковым. Это вытекает из положений, заложенных А. М.
Бутлеровым. Также теория строения органических соединений является руководящей основой при проведении всех исследований в органической химии. Ее ставят на один уровень с менделеевским Периодическим законом.
Теория строения органических соединений
Само понятие о химическом строении ввел А. М. Бутлеров. В истории химии оно появилось 19 сентября 1861 года. Ранее в науке существовали различные мнения, а часть ученых вовсе отрицало наличие молекул и атомов.
Потому в органической и неорганической химии не было никакого порядка. Более того, не существовало закономерностей, по которым можно было судить о свойствах конкретных веществ.
При этом были и соединения, которые при одинаковом составе проявляли разные свойства.

Утверждения А. М. Бутлерова во многом направили развитие химии в нужное русло и создали для нее прочнейший фундамент.
Посредством нее удалось систематизировать накопленные факты, а именно, химические или же физические свойства некоторых веществ, закономерности вступления их в реакции и прочее.
Даже предсказание путей получения соединений и наличие некоторых общих свойств стало возможным благодаря данной теории. А главное, А. М. Бутлеров показал, что структуру молекулы вещества можно объяснить с точки зрения электрических взаимодействий.
Логика теории строения органических веществ
Поскольку до 1861 года в химии многие отвергали существование атома или же молекулы, то теория органических соединений стала революционным предложением для ученого мира. И поскольку сам Бутлеров А. М. исходит лишь из материалистических умозаключений, то ему удалось опровергнуть философские представления об органике.
Ему удалось показать, что молекулярное строение можно распознать опытным путем посредством химических реакций.
К примеру, состав любого углевода можно выяснить посредством сжигания его определенного количества и подсчета образовавшейся воды и углекислого газа.
Количество азота в молекуле амина подсчитывается также при сжигании путем измерения объема газов и выделения химического количества молекулярного азота.
Если рассматривать суждения Бутлерова о химическом строении, зависящем от структуры, в обратном направлении, то напрашивается новый вывод. А именно: зная химическое строение и состав вещества, можно эмпирически предположить его свойства. Но самое главное — Бутлеров объяснил, что в органике встречается огромное количество веществ, проявляющих разные свойства, но имеющие одинаковый состав.
Общие положения теории
Рассматривая и исследуя органические соединения, Бутлеров А. М. вывел некоторые важнейшие закономерности. Он объединил их в положения теории, объясняющей строение химических веществ органического происхождения. Положения теории таковы:
- в молекулах органических веществ атомы соединены между собой в строго определенной последовательности, которая зависит от валентности;
- химическое строение — это непосредственный порядок, согласно которому соединены атомы в органических молекулах;
- химическое строение обуславливает наличие свойств органического соединения;
- в зависимости от строения молекул с одинаковым количественным составом возможно появление различных свойств вещества;
- все атомные группы, участвующие в образовании химического соединения, имеют взаимное влияние друг на друга.

Все классы органических соединений построены согласно принципам данной теории. Заложив основы, Бутлеров А. М. смог расширить химию как область науки.
Он пояснил, что благодаря тому, что в органических веществах углерод проявляет валентность равную четырем, обуславливается многообразие данные соединений. Наличие множества активных атомных групп определяет принадлежность вещества к определенному классу.
И именно за счет наличия специфических атомных групп (радикалов) появляются физические и химические свойства.
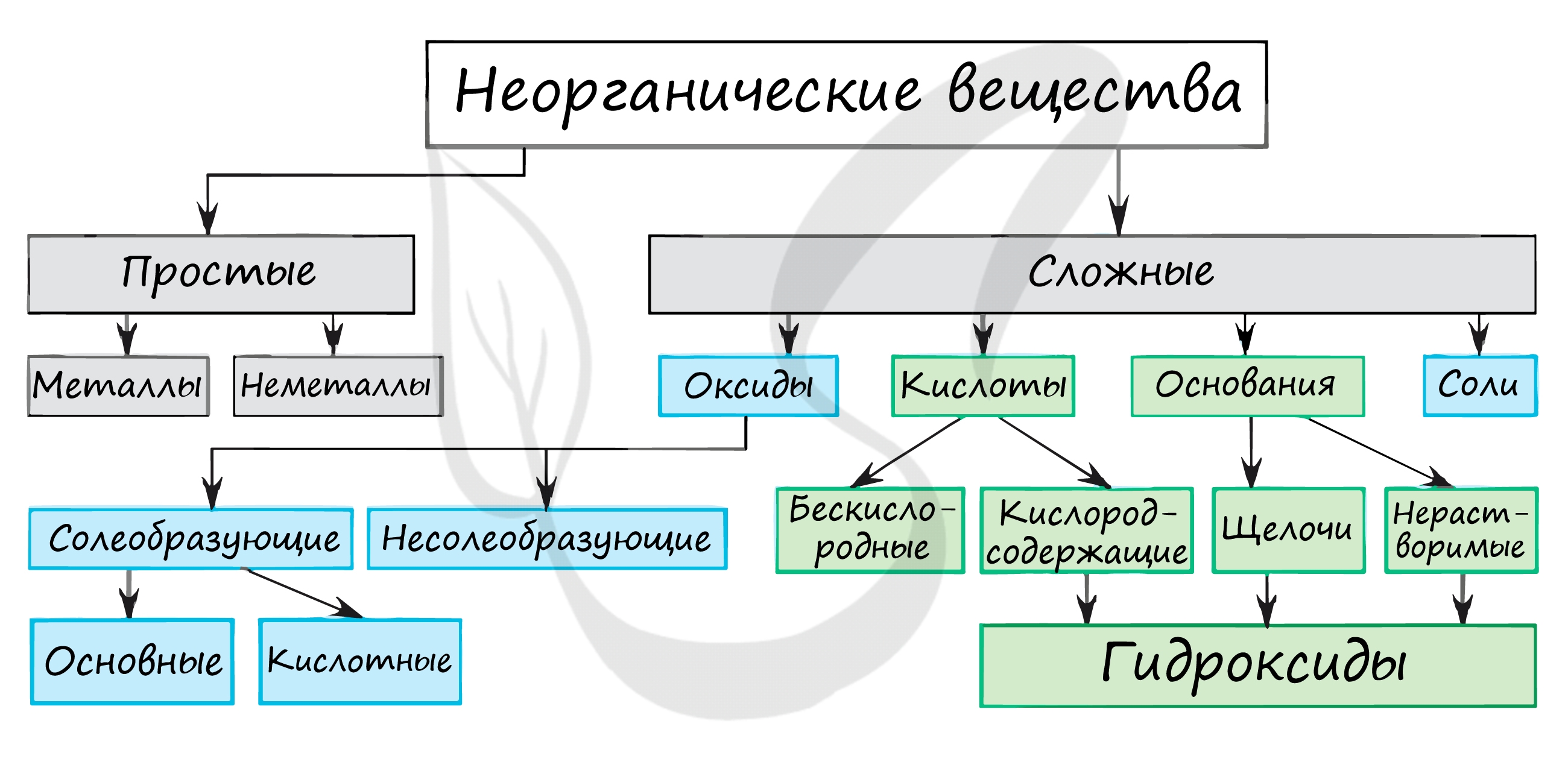
Углеводороды и их производные
Данные органические соединения углерода и водорода являются самыми простыми по составу среди всех веществ группы.
Они представлены подклассом алканов и циклоалканов (насыщенных углеводородов), алкенов, алкадиенов и алкатриенов, алкинов (непредельных углеводородов), а также подклассом ароматических веществ.
В алканах все атомы углерода соединены только одинарной С-С связью, из-за чего в состав углеводорода уже не может быть встроен ни один атом Н.
В непредельных углеводородах водород может встраиваться по месту наличия двойной С=С связи. Также С-С связь может быть тройной (алкины).
Это позволяет данным веществам вступать во множество реакций, связанных с восстановлением или присоединением радикалов.
Все остальные вещества для удобства изучения их способности вступать в реакции рассматриваются как производные одного из классов углеводородов.

Спирты
Спиртами называются более сложные, чем углеводороды органические химические соединения. Они синтезируются в результате протекания ферментативных реакций в живых клетках. Самым типичным примером является синтез этанола из глюкозы в результате брожения.
В промышленности спирты получают из галогеновых производных углеводородов. В результате замещения галогенового атома на гидроксильную группу и образуются спирты. Одноатомные спирты содержат лишь одну гидроксильную групп, многоатомные — две и более. Примером двухатомного спирта является этиленгликоль. Многоатомный спирт — это глицерин. Общая формула спиртов R-OH (R — углеродная цепь).
Альдегиды и кетоны
После того как спирты вступают в реакции органических соединений, связанные с отщеплением водорода от спиртовой (гидроксильной) группы, замыкается двойная связь между кислородом и углеродом.
Если данная реакция проходит по спиртовой группе, расположенной у концевого углеродного атома, то в результате ее образуется альдегид. Если углеродный атом со спиртовой расположен не на конце углеродной цепи, то результатом реакции дегидратации является получение кетона.
Общая формула кетонов — R-CO-R, альдегидов R-COH (R — углеводородный радикал цепи).

Эфиры (простые и сложные)
Химическое строение органических соединений данного класса усложненное. Простые эфиры рассматриваются как продукты реакции между двумя молекулами спиртов. При отщеплении воды от них образуется соединение образца R-O-R. Механизм реакции: отщепление протона водорода от одного спирта и гидроксильной группы от другого спирта.
Сложные эфиры — продукты реакции между спиртом и органической карбоновой кислотой. Механизм реакции: отщепление воды от спиртовой и карбоновой группы обеих молекул. Водород отщепляется от кислоты (по гидроксильной группе), а сама ОН-группа отделяется от спирта. Полученное соединение изображается как R-CO-O-R, где буковой R обозначены радикалы — остальные участки углеродной цепи.
Карбоновые кислоты и амины
Карбоновыми кислотами называются особенные вещества, играющие важную роль в функционировании клетки. Химическое строение органических соединений такое: углеводородный радикал (R) с присоединенной к нему карбоксильной группой (-СООН). Карбоксильная группа может располагаться только у крайнего атома углерода, потому как валентность С в группе (-СООН) равна 4.
Амины — это более простые соединения, которые являются производными углеводородов. Здесь у любого атома углерода располагается аминный радикал (-NH2).
Существуют первичные амины, у которых группа (-NH2) присоединяется к одному углероду (общая формула R-NH2). У вторичных аминов азот соединяется с двумя углеродными атомами (формула R-NH-R).
У третичных аминов азот соединен с тремя углеродными атомами (R3N), где р — радикал, углеродная цепь.
Аминокислоты
Аминокислоты — комплексные соединения, которые проявляют свойства и аминов, и кислот органического происхождения.
Существует несколько их видов в зависимости от расположения аминной группы по отношению к карбоксильной. Наиболее важны альфа-аминокислоты.
Здесь аминная группа расположена у атома углерода, к которому присоединена карбоксильная. Это позволяет создавать пептидную связь и синтезировать белки.
Углеводы и жиры
Углеводы являются альдегидоспиртами или кетоспиртами. Это соединения с линейной или циклической структурой, а также полимеры (крахмал, целлюлоза и прочие).
Их важнейшая роль в клетке — структурная и энергетическая. Жиры, а точнее липиды, выполняют те же функции, только участвуют в других биохимических процессах.
С точки зрения химического строения жир является сложным эфиром органических кислот и глицерина.
Источник: https://www.syl.ru/article/187587/new_organicheskie-soedineniya-klassyi-organicheskih-soedineniy
Урок по теме: "Предмет органической химии. Классификация и номенклатура органических соединений. Химические свойства основных классов органических соединений
- Поурочное планирование теоретических занятий
- Специальность__190623. «Техническая эксплуатация подвижного состава железных дорог, 230115 «Программирование в компьютерных системах», 100701 «Коммерция»,
- Дисциплина химия_____
- Лекция №1
Предмет органической химии. Классификация и номенклатура органических соединений. Химические свойства основных классов органических соединений.
Содержание.
1. Орг. момент 2 мин.
2.План урока. 5 мин
1. Предмет органической химии.
2. Классификация органических соединений.
3. Валентность. Химическое строение как порядок соединения атомов в молекулы по валентности.
- 4. Пути развития органической химии и причины выделения в самостоятельную науку
- Цель обучения:
- Определить понятия:
- органическая химия,
- органические соединения,
- углеводороды,
- природные и искусственные органические соединения.
СРЕДСТВА ОБУЧЕНИЯ
- Презентации к уроку;
- Таблицы.
3. Раскрытие содержание проблемы 35 мин.
Введение.
Вопрос №1. Предмет органической химии.
Органической химией называют химию соединений углерода независимо от способа получений этих соединений, их природных веществ или искусственным путем (синтетическим).
Предметом изучения органической химии являются углеводороды и их производные, в состав которых могут входить почти все элементы таблицы Менделеева.
Как самостоятельная наука органическая химия cформилась в начале 19 века, когда из объектов живой природы было выделено много органических соединений, а также синтетическим путем были получены муравьиная кислота, щавелевая кислота, мочевина. Отделение органической химии от неорганической вызвано следующими причинами:
-
Органические соединения очень многочисленны. В настоящее время выделено более 9 млн. органических соединений, в то время как неорганических соединений известно лишь около 700 тысяч.
-
Они обладают такими особенностями свойств, как низкие температуры плавления и кипения, легкая воспламеняемость и летучесть, плохая тепло- и электропроводность.
-
Органические соединения имеют более сложное строение молекул по сравнению с неорганическими, они связаны с живой природой и принадлежат к более высокоорганизованной материи.
Основной задачей органической химии ранее являлось изучение свойств соединений, выделяемых и из продуктов жизнедеятельности живых организмов, сейчас ее главное направление – это разработка высокоселективных синтетических методов получения веществ с заданными свойствами.
Вопрос2. Классификация органических соединений.
- КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- Развитие теории химического строения позволило Бутлерову провести четкую классификацию органических соединений.
- По строению углеродного скелета все органические вещества делятся на три основных вида:
-
Соединения с открытой цепью углеродных атомов (жирные, алифатические, ациклические).
-
Соединения с замкнутой цепью углеродных атомов (карбоциклические, изоциклические).
-
Соединения с замкнутой цепью, состоящей не только из атомов углерода, но и других элементов (гетероатомов), например: N, O, S (гетероциклические соединения).
- Внутри каждого раздела проводится более детальная классификация по признаку состава и наличия функциональных групп.
- Состоят из атомов
- Функциональная группа
- 1.
- Углеводороды
- С, Н
- —
- 2.
- Галогенопроизводные
- С, Н, Гал
- Гал
- 3.
- Кислородсодержащие соединения
- С, Н, О
- а) спирты
- -ОН
- б) альдегиды и кетоны
- >С=О
- в) карбоновые кислоты
- О
- ____С
- ОН
- 4.
- Серосодержащие соединения
- С, Н, S (О)
- а) тиоспирты
- -SH
- б) тиоэфиры
- -S-
- в) сульфокислоты
- 5.
- Азотсодержащие соединения
- С, Н, N (О)
- а) нитросоединения
- -NО2
- б) амины
- -NH2
- 6.
- Элементорганические соединения
- С, Н, Э
- а) металлорганические
- С, Н, Ме
- б) кремнийорганические
- С, Н, Si (O)
- в) фосфорорганические
и т.д.
С, Н, Р (О)
и др.
Вопрос 3. Валентность. Химическое строение как порядок соединения атомов в молекулы по валентности.
ОБРАЗОВАНИЕ КОВАЛЕНТНОЙ СВЯЗИ
При сближении двух атомов, имеющих неспаренные электроны, происходит перекрывание электронных облаков неспаренных электронов, приводящее к образованию единой электронной орбитали с повышенной электронной плотностью между ядрами.
![]()
(1) (2) (3)
Рисунок 2
Возникающая между ядрами область повышенной электронной плотности обуславливает притяжение ядер и химическое связывание атомов. Таким образом, физический смысл образования ковалентной связи состоит в образовании из двух атомных орбиталей общей (связующей) орбитали с наибольшей электронной плотностью между ядрами, которую называют молекулярной орбиталью.
- При рассмотрении характера связи и механизмов реакций удобно бывает пользоваться электронными формулами, где внешние электроны изображают в виде точек.
- СН3-СН3
- СН2=СН2
- СНСН
- Н Н
. . . .
Н : С : С : Н
. . . .
Н Н
Н Н
. . . .
- Н : С : :С : Н
- Н : С ::: С : Н
- Разновидностью ковалентной связи является донорно-акцепторная, которая образуется за счет обобщения неподеленной пары электронов, принадлежащей одному из соединяющих атомов.
- Пути развития органической химии и причины выделения в самостоятельную науку
В состав органических веществ входят С, H, N, O, S, P, и др. Название «органическая» произошло от слова «организм», так как с середины 17 века вещества делили по их происхождению на минеральные, животные и растительные (органические). Все органические вещества получали из организмов животных или растений.
Считалось, что все органические соединения образуются под воздействием особой таинственной жизненной силы. Эта идеалистическая теория получила название виталистической. Учение о жизненной силе соответствовало идеалистической философии того времени.
Началом к опровержению неправильной теории виталистов служат работы немецкого химика Вёлера. В 1824 г. он получил синтетическим путем щавелевую кислоту НООС-СООН, в 1828 г. – мочевину. В 1842 г русский ученый Зинин синтезировал анилин С6Н5NH2; Кольбе в 1845 СН3СООН, Бертло в 1854 осуществил синтез жира, А.М.
Бутлеров в 1861 г. впервые синтезировал сахаристое вещество.
Сейчас известно около 6 млн. органических веществ, тогда как число неорганических ≈ 300 тыс.
Значение органических соединений в жизни человека огромно. Органические вещества содержатся во всех растительных и животных организмах, входят в состав нашей пищи, служат материалом для изготовления одежды, образуют различные виды топлива, используются нами в качестве лекарства, красителей и т.д.
Обмен веществ связан с изменениями органических веществ. Основные продукты питания: жиры, белки, углеводы – относятся к органическим веществам. В основе процессов, протекающих при переработке и хранении пищевых продуктов (брожение, созревание сыров, прогоркание жиров и др.) лежат превращение органических соединений.
Во многих важнейших отраслях промышленности применяется органическое сырье. Знание основ органической химии и свойств органических веществ, входящих в состав пищевых продуктов, необходимо для будущей практической деятельности работников молочной промышленности.
Вопрос 4. Пути развития органической химии и причины выделения в самостоятельную науку
Пути развития органической химии и причины выделения в самостоятельную науку
Особенно благоприятные условия для развития органической химии в нашей стране сложились после победы Октябрьской революции. Была создана сеть научных учреждений, в которых ученые-органики Н.Д.Зелинский, А.Е.Фаворский, С.В. Лебедев, и др.
получили простор для исследований и для воспитания молодых научных кадров. В первую очередь нашей стране была необходима тяжелая химическая промышленность, обеспечивающая потребность народного хозяйства и обороны.
Такая промышленность была создана и в годы Великой Отечественной войны она помогла одержать победу советским людям.
В послевоенные годы химическая промышленность продолжала развиваться. Важной составной частью химической промышленности являются производства, основанные на достижениях органической химии.
-
Промышленность тяжелого (основного) органического синтеза. Кислородосодержащие (спирты, альдегиды, кетоны, кислоты, эфиры). Азотсодержащие органические соединения (нитросоединения, амины, нитрилы). Галогенсодержащие. Частью тяжелого органического синтеза является нефтехимическая промышленность.
-
Производство ядохимикатов и органических удобрений.
-
Промышленность синтетических смол и пластических масс.
-
Промышленность синтетического каучука.
-
Промышленность химических волокон.
-
Лакокрасочная промышленность.
-
Анилинокрасочная промышленность.
-
Химико-фармацевтическая промышленность.
-
Промышленность реактивов и высокочистых веществ.
Органическая химия, как химия углеродистых соединений, выделена из общей химии в самостоятельную дисциплину по следующим причинам: органические соединения обладают рядом отличительных особенностей:
-
содержат углерод;
-
многие имеют большую молекулярную массу;
-
в отличие от неорганических веществ характерны не ионные, а ковалентные связи;
-
кипят и плавятся при более низких температурах, чем неорганические;
-
при сильном нагревании без кислорода разлагаются и обугливаются, а с кислородом с образованием СО2 и Н2О;
-
большинство химических реакций с органическими веществами протекает медленно;
-
широко распространенно явление изомерии.
-
органические соединения очень многочисленны (около 6 млн.)
Выделение органической химии в самостоятельную дисциплину обусловлено и той исключительной ролью, которой играют органические соединения в живой природе и в жизни человека.
Основными источниками органических веществ являются: нефть, природные газы, попутные нефтяные газы и промышленные газы нефтепереработки, твердые горючие ископаемые и т.д.
- Нефть – ценный источник моторных топлив и смазочных масел. При вторичной переработке нефти (крекинг, пиролиз, окисление, дегидрирование) получают многочисленные органические вещества. Большие запасы природных и попутных нефтяных газов делают их в настоящее время одним из наиболее дешевых источников сырья для синтеза многих химических веществ.
- Каменный уголь, сланцы, торф – используется как топливо, и как источник органических веществ (фенолов, бензола, толуола, нафталина и др.)
- Древесина и растительные отходы – богатейший возобновляемый источник органических веществ.
Убедившись, что данное вещество органическое — приступают к его выделению и очистке. Для очистки веществ применяются следующие методы: перекристаллизация, перегонка, возгонка, экстракция, хроматография.
После того как вещество получено в чистом виде приступают к изучению его физических констант: определяются: температура плавления, температура кипения, относительная плотность, показатель преломления.
4. Вывод. Задание на дом: учебник …………………… 3 мин.
Задание на дом. Учебник О.С.Габриелян. 10кл.
П.1
Контрольные вопросы:
-
Какие вещества называют органическими?
-
Что является предметом органической химии?
-
Какие основные источники органических веществ вы знаете?
-
Почему органическая химия выделена в отдельную науку?
Литература: О.С.Габриелян, 10кл.
Источник: https://infourok.ru/urok-po-teme-predmet-organicheskoy-himii-klassifikaciya-i-nomenklatura-organicheskih-soedineniy-himicheskie-svoystva-osnovnih-kl-654620.html
Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
| Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле. |
| Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ. |
| Классификация органических веществ по составу | ||
| Углеводороды | Кислородсодержащие вещества | Азотсодержащие вещества |
| Состоят из атомов углерода и водорода | Содержат также атомы кислорода | Содержат также атомы азота |
Углеводороды
| Углеводороды– это вещества, состав которых отражается формулой СхНу, то есть в их составе только атомы углерода и водорода. |
В зависимости от типа связей между атомами С, они делятся на предельные или насыщенные (все связи одинарные) и непредельные (ненасыщенные) — в молекуле присутствуют двойные и тройные связи.
Кроме того, углеводороды делятся на циклические (углеродная цепь образует кольцо) и ациклические или алифатические (углеродная цепь не замкнута в кольцо).
| Углеводороды | |||||
| Предельные (содержат только одинарные связи) | Непредельные (содержат двойные или тройные связи между атомами углерода) | ||||
| Алканы | Циклоалканы | Алкены | Алкадиены | Алкины | Ароматические углеводороды |
| Углеводороды с открытой (незамкнутой) углеродной цепью | Атомы углерода соединены в замкнутый цикл | Одна двойная связь | Две двойные связи | Одна тройная связь | Циклические углеводороды с тремя двойными связями (бензольное кольцо) |
| CnH2n+2 | CnH2n | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n-6 |
| ЭтанCH3-CH3 | Циклобутан | ЭтиленCH2=CH2 | ДивинилCH2=CН-СН=СH2 | АцетиленСН≡СН | Бензол |
| Ациклические углеводороды | |
| С неразветвленной цепью | С разветвленной углеродной цепью |
| н-БутанCH3-CH2-CH2-CH3 | Изобутан |
Кислородсодержащие органические вещества
Так как кислород имеет валентность II, он может образовать либо 2 одинарные связи, либо одну двойную. Соответственно, в органической молекуле он соединяется с водородом и углеродом.
Основные функциональные группы, содержащие кислород:
|
| Кислородсодержащие органические вещества | |||||
| Группа ОН | Группа С=О | Группа -СОО- | |||
| Гидроксил | Карбонил | Карбоксил | |||
| Спирт | Фенол | Альдегид | Кетон | Карбоновая кислота | Сложный эфир |
| R-OH | |||||
| МетанолCH3-OH | Фенол | Ацетальдегид | Пропанон | Уксусная кислота | Метилацетат |
Азотсодержащие органические вещества
Азотсодержащие вещества можно также разделить на классы по наличию определенных функциональных групп.
- амины – содержат группы –NН2, –NH–, либо -N< ,
- нитрилы (группа –СºN),
- азотистые гетероциклы.
Некоторые органические вещества содержат и азот, и кислород.
К ним относятся:
- нитросоединения –NO2
- амиды –CONH2,
- аминокислоты – полифункциональные соединения, которые содержат и карбоксильную группу –COOH, и аминогруппу –NH2
| Азотсодержащие вещества | |||||
| Амины | Нитрилы | Нитросоединения | Амиды | Аминокислоты | Гетероциклы |
| -NH2-NH—N |
Источник: https://chemege.ru/klassy-organika/
Основные понятия органической химии — Химия
ОРГАНИЧЕСКАЯ ХИМИЯ
Основные понятия
органической химии
Органическая химия – это
область химии, изучающая соединения углерода. Углерод выделяется среди всех
элементов тем, что его атомы могут связываться друг с другом в длинные цепи или
циклы. Именно это свойство позволяет углероду образовывать миллионы
соединений, изучением которых занимается органическая химия.
Теория химического строения А. М. Бутлерова.
Современная теория строения
молекул объясняет и огромное число органических соединений, и зависимость
свойств этих соединений от их химического строения. Она же полностью
подтверждает основные принципы теории химического
строения, разработанные выдающимся русским ученым А. М. Бутлеровым.
- Основные положения этой теории
(иногда ее называют структурной): - 1) атомы в молекулах соединены между собой в определенном порядке
химическими связями согласно их валентности; - 2) свойства вещества определяются не только качественным составом, но и
строением, и взаимным влиянием атомов. - 3) по свойствам вещества можно определить его строение, а по строению –
свойства.
Важным следствием теории строения
был вывод о том, что каждое органическое соединение должно иметь одну
химическую формулу, отражающую ее строение. Такой вывод теоретически
обосновывал хорошо известное уже тогда явление изомерии,— существование веществ с одинаковым молекулярным
составом, но обладающих различными свойствами.
Изомеры – вещества,
одинаковые по составу, но разные по строению
Структурные формулы. Существование изомеров потребовало
использования не только простых молекулярных формул, но и структурных
формул, отражающих порядок связи атомов в молекуле каждого изомера. В
структурных формулах ковалентная связь обозначается черточкой. Каждая черточка
означает общую электронную пару, связывающую атомы в молекуле.
- Структурная формула — условное
изображение строения вещества с учетом химических связей. - Классификация органических соединений.
- Для классификации
органических соединений по типам и построения их названий в молекуле
органического соединения принято выделять углеродный
скелет и функциональные группы. - Углеродный скелет представляет собой последовательность химически связанных между собой атомов углерода.
Типы углеродных скелетов. Углеродные скелеты разделяют
на ациклические (не
содержащие циклов), циклические и гетероциклические.
В гетероциклическом скелете в
углеродный цикл включается одни или несколько атомов, отличных от углерода. В
самих углеродных скелетах нужно классифицировать отдельные атомы углерода по
числу химически связанных с ними атомов углерода. Если данный атом углерода
связан с одним атомом углерода, то его называют первичным, с двумя —
вторичным, тремя — третичным и четырьмя — четвертичным.
Поскольку атомы углерода могут
образовывать между собой не только одинарные, но и кратные (двойные и тройные)
связи, то соединения, содержащие только
одинарные связи С––С , называют насыщенными,
соединения с кратными связями называют ненасыщенными.
Углеводороды – соединения, в
которых атомы углерода связаны только с атомами водорода.
Углеводороды признаны в
органической химии родоначальными. Разнообразные соединения
рассматриваются как производные углеводородов, полученные введением в них
функциональных групп.
Функциональные группы. В большинстве органических соединений,
кроме атомов углерода и водорода, содержатся атомы других элементов (не
входящие в скелет). Эти атомы или их
группировки, во многом определяющие химические и физические свойства органических
соединений, называют функциональными
группами.
Функциональная группа оказывается
окончательным признаком, по которому соединения относятся к тому или иному
классу.
Важнейшие функциональные группы
| Функциональные группы | Класс соединения | |
| обозначение | название | |
| — F, —Cl, — Br, — I | галоген | галогенопроизводные углеводородов |
| — OH | гидроксил | спирты, фенолы |
| карбонил | альдегиды, кетоны | |
| карбоксил | карбоновые кислоты | |
| — NH2 | аминогруппа | амины |
| — NO2 | нитрогруппа | нитросоединения |
Гомологический ряд. Для описания органических соединений
полезным является понятие гомологического ряда. Гомологический ряд образуют
соединения, отличающиеся друг от друга на группу —СН2— и обладающие
сходными химическими свойствами. Группы СН2 называются
гомологической
разностью.
Примером гомологического ряда
может служить ряд предельных углеводородов (алканов). Простейший его
представитель — метан СН4. Гомологами метана являются: этан С2Н6,
пропан С3Н8, бутан С4Н10,
пентан С5Н12, гексан С6Н14, гептан
С7Н16 и т. д. Формула любого последующего гомолога
может быть получена прибавлением к формуле предыдущего углеводорода
гомологической разности.
Состав молекул всех членов
гомологического ряда может быть выражен одной общей формулой. Для
рассмотренного гомологического ряда предельных углеводородов такой формулой
будет СnН2n+2,
где n — число
атомов углерода.
Номенклатура органических соединений. В настоящее время
признана систематическая номенклатура ИЮПАК (IUРАС — Международный
союз теоретической и прикладной химии).
По правилам ИЮПАК название
органического соединения строится из названия главной цепи, образующего корень
слова, и названий функций, используемых в качестве приставок или суффиксов.
Для правильного построения
названия необходимо провести выбор главной цепи и нумерацию атомов углерода в
ней.
Нумерацию атомов углерода в
главной цепи начинают с того конца цепи, ближе к которому расположена старшая
группа. Если таких возможностей оказывается несколько, то нумерацию
проводят таким образом, чтобы либо кратная связь, либо другой заместитель,
имеющийся в молекуле, получили наименьший номер.
В карбоциклических соединениях
нумерацию начинают от того атома углерода, при котором находится старшая
характеристическая группа. Если при этом невозможно выбрать однозначную
нумерацию, то цикл нумеруют так, чтобы заместители имели наименьшие
номера.
В группе циклических углеводородов особо
выделяются ароматические углеводороды, для которых характерно наличие
в молекуле бензольного кольца. Некоторые широко известные представители
ароматических углеводородов и их производных имеют тривиальные названия,
использование которых разрешено правилами ИЮПАК: бензол, толуол, фенол,
бензойная кислота.
Радикал С6Н5—, образованный
из бензола, называется фенил, а не
бензил. Бензилом называют радикал С6Н5СН2—,
образованный из толуола.
Составление названия органического соединения. Основу названия
соединения составляет корень слова, обозначающий предельный углеводород с тем
же числом атомов, что и главная цепь (мет-, эт-,
проп-, бут-, пент: гекс- и т. д.).
Затем следует суффикс,
характеризующий степень насыщенности, -ан, если
в молекуле нет кратных связей, -ен при
наличии двойных связей и -ин для
тройных связей, (например пентан, пентен, пентин).
Если кратных связей в
молекуле несколько, то в суффиксе указывается число таких связей: —диен, —триен, а после суффикса обязательно арабскими цифрами
указывается положение кратной связи (например, бутен-1, бутен-2, бутадиен-1,3):
Далее в суффикс выносится
название самой старшей характеристической группы в молекуле с указанием ее
положения цифрой. Прочие заместители обозначаются с помощью приставок. При этом
они перечисляются не в порядке старшинства, а по алфавиту.
Положение
заместителя указывается цифрой перед приставкой, например: 3-метил; 2-хлор и т. п. Если в молекуле имеется несколько одинаковых
заместителей, то перед названием соответствующей группы словом указывается их
количество (например, диметил-,
трихлор- и т. д.).
Все цифры в названиях молекул отделяются от слов дефисом, а
друг от друга запятыми. Углеводородные радикалы имеют свои названия.
- Предельные углеводородные
радикалы: - Непредельные углеводородные
радикалы: - Ароматические углеводородные
радикалы: - В качестве примера назовем
следующее соединение: - 1) Выбор цепи однозначен,
следовательно, корень слова — пент; далее следует суффикс −ен, указывающий на наличие кратной связи; - 2) порядок нумерации обеспечивает
старшей группе (—ОН) наименьший номер; - 3) полное название соединения
заканчивается суффиксом, обозначающим старшую группу (в данном случае суффикс —ол указывает на
наличие гидроксильной группы); положение двойной связи и гидроксильной
группы указывается цифрами. - Следовательно, приведенное
соединение называется пентен-4-ол-2.
Тривиальная номенклатура представляет собой совокупность
несистематических исторически сложившихся названий органических соединений
(пример: ацетон, уксусная кислота, формальдегид и т. д.).
Изомерия.
Выше было показано, что способность атомов углерода к
образованию четырех ковалентных связей, в том числе и с другими атомами
углерода, открывает возможность существования нескольких соединений одного
элементного состава — изомеров. Все изомеры делят на два больших класса
— структурные изомеры и пространственные изомеры.
- Структурными называют изомеры
с разным порядком соединения атомов. - Пространственные изомеры имеют одинаковые заместители у каждого
атома углерода и отличаются лишь их
взаимным расположением в пространстве. - Структурные изомеры. В соответствии с приведенной выше
классификацией органических соединений по типам среди структурных изомеров
выделяют три группы: - 1) соединения, отличающиеся углеродными
скелетами: - 2) соединения, отличающиеся
положением заместителя или кратной связи в молекуле: - 3) соединения, содержащие
различные функциональные группы и относящиеся к различным классам
органических соединений:
Пространственные изомеры (стереоизомеры). Стереоизомеры можно
разделить на два типа: геометрические изомеры и оптические изомеры.
Геометрическая изомерия характерна для соединений, содержащих
двойную связь или цикл.
В таких молекулах часто возможно провести условную
плоскость таким образом, что заместители у различных атомов углерода могут
оказаться по одну сторону (цис-) или по разные
стороны (транс-) от этой плоскости.
Если изменение ориентации этих
заместителей относительно плоскости возможно только за счет разрыва одной
из химических связей, то говорят о наличии геометрических изомеров.
Геометрические изомеры отличаются своими физическими и химическими свойствами.
Взаимное влияние атомов в молекуле.
Все
составляющие молекулу атомы находятся во взаимосвязи и испытывают взаимное
влияние. Это влияние передается в основном через систему ковалентных
связей с помощью так называемых электронных эффектов.
Электронными
эффектами называют смещение электронной плотности в молекуле под влиянием
заместителей.
Атомы,
связанные полярной связью, несут частичные заряды, обозначаемые греческой
буквой “дельта” (δ ). Атом, “оттягивающий” электронную
плотность δ -связи в свою сторону, приобретает отрицательный
заряд δ − .
При рассмотрении пары атомов, связанных ковалентной
связью, более электроотрицательный атом
называют электроноакцептором. Его партнер по δ -связи
соответственно будет иметь равный по величине дефицит электронной плотности, т.
е.
частичный положительный заряд δ +, и будет
называтьсяэлектронодонором.
Смещение
электронной плотности по цепи σ -связей называется индуктивным
эффектом и обозначается I.
Индуктивный
эффект передается по цепи с затуханием. Направление смещения электронной
плотности всех σ -связей обозначается прямыми стрелками.
В
зависимости от того, удаляется ли электронная плотность от рассматриваемого
атома углерода или приближается к нему, индуктивный эффект
называют отрицательным (-I) илиположительным (+I). Знак
и величина индуктивного эффекта определяются различиями в
электроотрицательности между рассматриваемым атомом углерода и группой, его
вызывающей.
Электроноакцепторные
заместители, т.е. атом или группа атомов, смещающие электронную плотность σ -связи
от атома углерода, проявляют отрицательный индуктивный эффект (−I-эффект).
Электронодонорные
заместители, т. е. атом или группа атомов, смещающие электронную плотность к
атому углерода, проявляют положительный индуктивный эффект(+I-эффект).
+I-эффект
проявляют алифатические углеводородные радикалы, т. е. алкильные
радикалы (метил, этил и т. д.).
- Большинство
функциональных групп проявляют -I-эффект: галогены, аминогруппа, гидроксильная,
карбонильная, карбоксильная группы. - Индуктивный
эффект проявляется и в случае, когда связанные атомы углерода различны по
состоянию гибридизации. Так, в молекуле пропена метильная группа проявляет
+I-эффект, поскольку атом углерода в ней находится в sp3-гибридном
состоянии, а sp2-гибридизованный атом (при двойной связи) выступает в роли
электроноакцептора, так как имеет более высокую электроотрицательность : - При
передаче индуктивного эффекта метильной группы на двойную связь в первую
очередь ее влияние испытывает подвижная π -связь.
Влияние
заместителя на распределение электронной плотности, передаваемое по π -связям,
называют мезомерным эффектом (М). Мезомерный эффект также может быть
отрицательным и положительным. В структурных формулах его изображают изогнутой
стрелкой, начинающейся у центра электронной плотности и завершающейся в том
месте, куда смещается электронная плотность.
Наличие
электронных эффектов ведет к перераспределению электронной плотности в молекуле
и появлению частичных зарядов на отдельных атомах. Это определяет реакционную
способность молекулы.
Классификация органических реакций
− Классификация по типу разрыва химических связей в реагирующих
частицах. Из их числа можно выделить две большие группы реакций
— радикальные и ионные.
Радикальные реакции — это
процессы, идущие с гомолитическим разрывом ковалентной связи. При
гомолитическом разрыве пара электронов, образующая связь, делится таким
образом, что каждая из образующихся частиц получает по одному электрону. В
результате гомолитического разрыва образуются свободные радикалы:
- Нейтральный атом или частица с неспаренным электроном называется свободным радикалом.
- Ионные реакции — это
процессы, идущие с гетеролитическим разрывом ковалентных связей, когда оба
электрона связи остаются с одной из ранее связанных частиц: - В
результате гетеролитического разрыва связи получаются заряженные частицы: нуклеофильная
и электрофильная.
Нуклеофильная
частица (нуклеофил) — это частица, имеющая пару электронов на внешнем
электронном уровне. За счет пары электронов нуклеофил способен образовывать
новую ковалентную связь.
Электрофильная
частица (электрофил) — это частица, имеющая незаполненный внешний электронный
уровень. Электрофил представляет незаполненные, вакантные орбитали для
образования ковалентной связи за счет электронов той частицы, с которой он
взаимодействует.
−Классификация по составу и
строению исходных веществ и продуктов реакции. В органической химии все
структурные изменения рассматриваются относительно атома (или атомов) углерода,
участвующего в реакции. Наиболее часто встречаются следующие типы превращений:
- присоединение
- замещение
- отщепление (элиминирование)
- полимеризация
- В соответствии с вышеизложенным
хлорирование метана под действием света классифицируют как радикальное
замещение, присоединение галогенов к алкенам — как электрофильное
присоединение, а гидролиз алкилгалогенидов — как нуклеофильное замещение.
Источник: https://www.sites.google.com/site/himiyasppk/novosti-sajta/informacionnye-materialy




