Характерными свойствами металлов являются наличие металлического блеска и пластичности, высокая электро- и теплопроводность. Характерные свойства металлов обусловлены их строением.
Атомы металлов не однородны. Атом состоит из положительно заряженного тяжелого ядра, и окружающих ядро отрицательно заряженных электронов. Число электронов равно порядковому номеру элемента в таблице Д.И. Менделеева.
В ядре атома находятся положительно заряженные элементарные частицы, называемые протонами. Количество протонов равно количеству окружающих ядро электронов. Кроме протонов, в ядре находятся тяжелые электрически нейтральные частицы – нейтроны.
Масса электрона в 1840 раз меньше массы протона или нейтрона. Таким образом, вся масса атома сосредоточена в его ядре.
Электроны быстро вращаются вокруг ядра. Внешние, так называемые валентные, электроны у всех металлов относительно слабо связаны с ядром. Слабой связью внешних валентных электронов с ядром и объясняются характерные металлические свойства.
Замечание Между понятием «металл» как химический элемент и как вещество есть некоторая разница. Химия делит все элементы на металлы и неметаллы по их поведению в химических реакциях.
Теория металлического состояния рассматривает крупные скопления атомов металлов, в котором они обладают характерными металлическими свойствами: пластичностью, высокой тепло- и электропроводностью, металлическим блеском.
Эти свойства характерны для больших групп атомов. У отдельных атомов таких свойств нет.
Атомы в металле находятся в ионизированном состоянии. Атомы металлов, отдавая часть внешних валентных электронов, превращаются в положительно заряженные ионы. Свободные электроны непрерывно перемещаются между ними, образуя подвижный электронный газ.
При комнатной температуре все металлы, кроме ртути, представляют собой твердые тела, имеющие кристаллическое строение. Для кристаллов характерно строго определенное расположение в пространстве ионов, образующих кристаллическую решетку.
Металлы имеют кристаллические решетки различных типов. Каждая кристаллическая решетка может быть охарактеризована элементарной кристаллической ячейкой.
Элементарная кристаллическая ячейка – наименьший комплекс атомов, повторяя который многократно, можно построить весь кристалл.
У металлов чаще всего встречаются три типа элементарных кристаллических ячеек: В кубической объемноцентрированной (ОЦК) решетке восемь ионов располагаются по вершинам и один в центре куба, на пересечении диагоналей.
Объемноцентрированную кубическую решетку имеют кристаллы железа при комнатной температуре, хрома, вольфрама, молибдена, ванадия и др.
Эта решетка характеризуется всего одним параметром решетки – расстоянием между центрами двух ионов, расположенных по одному ребру, обозначенным на рисунке а.
 Многие металлы, используемые в технике, имеют гранецентрированную кубическую решетку. В элементарной решетке гранецентрированного куба ионы расположены по вершинам куба и в центре каждой грани (на пересечении ее диагоналей). Центр куба остается свободным. Такую кристаллическую решетку имеют кристаллы меди, никеля, алюминия, свинца, серебра и др. гранецентрированная решетка также характеризуется одним параметром – длиной ребра куба а.
Многие металлы, используемые в технике, имеют гранецентрированную кубическую решетку. В элементарной решетке гранецентрированного куба ионы расположены по вершинам куба и в центре каждой грани (на пересечении ее диагоналей). Центр куба остается свободным. Такую кристаллическую решетку имеют кристаллы меди, никеля, алюминия, свинца, серебра и др. гранецентрированная решетка также характеризуется одним параметром – длиной ребра куба а.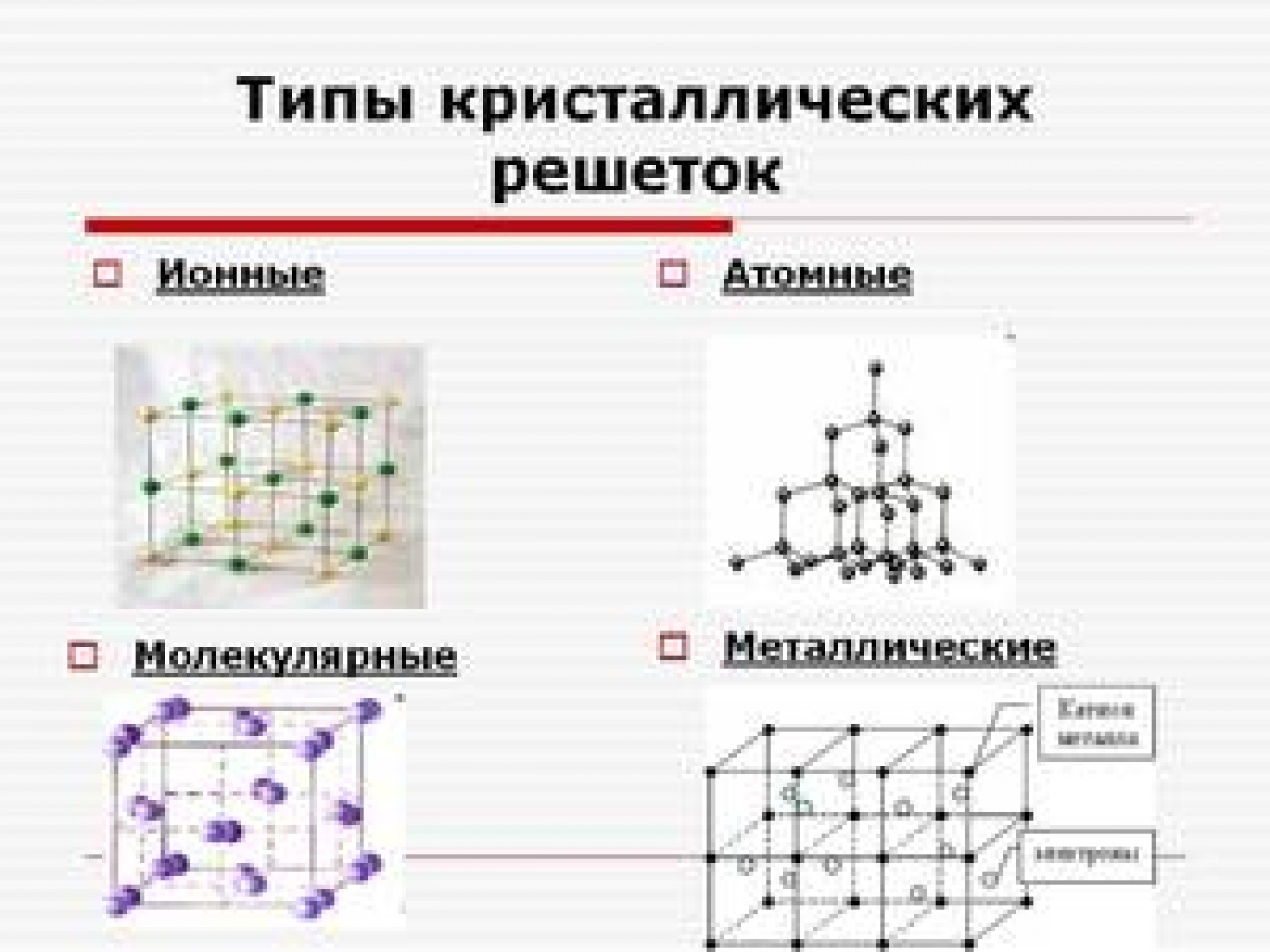 Элементарная ячейка гексагональной плотноупакованной решетки представляет собой шестигранную призму. По основаниям призмы расположены правильные шестиугольники по вершинам которых и в их центрах находятся ионы. Посередине между основаниями вклинивается правильный треугольник с ионами по вершинам.
Элементарная ячейка гексагональной плотноупакованной решетки представляет собой шестигранную призму. По основаниям призмы расположены правильные шестиугольники по вершинам которых и в их центрах находятся ионы. Посередине между основаниями вклинивается правильный треугольник с ионами по вершинам. Гексагональная решетка характеризуется двумя параметрами: а и с. Наибольшая плотность упаковки достигается при соотношении параметров с/а = 1.633. Гранецентрированная решетка с таким соотношением параметров называется гранецентрированной плотноупакованной. Такую решетку имеют титан, цирконий, кобальт, цинк, магний и др.
Гексагональная решетка характеризуется двумя параметрами: а и с. Наибольшая плотность упаковки достигается при соотношении параметров с/а = 1.633. Гранецентрированная решетка с таким соотношением параметров называется гранецентрированной плотноупакованной. Такую решетку имеют титан, цирконий, кобальт, цинк, магний и др.
Строение металлических сплавов
Под металлическим сплавом понимают вещество, получаемое сплавлением двух или более элементов, обладающее характерными металлическими свойствами.
Металлические сплавы получают сплавлением элементов – металлов или металлов с неметаллами при преимущественном содержании металлов. Строение сплавов сложнее, чем чистых металлов.
При кристаллизации жидкого сплава могут получаться твердые металлические сплавы с различным строением.
Механическая смесь двух чистых металлов А и В получается в том случае, когда в процессе кристаллизации сплава из жидкого состояния разнородные атомы не входят в общую кристаллическую решетку.
В механической смеси каждый металл образует самостоятельные кристаллы.
Кристаллы каждого их металлов, находящиеся в этом сплаве, обладают теми же строением и свойствами, которыми они обладают в куске чистого металла.
Твердый раствор – сплав, у которого атомы растворимого элемента размещены в кристаллической решетке растворителя. На микрошлифе твердого раствора кристаллы после травления выглядят одинаково. В кристаллах твердого раствора существует только один тип кристаллической решетки.
Растворителем является тот элемент, кристаллическую решетку которого имеет твердый раствор. Растворимый элемент может либо замещать элемент-растворитель в узлах кристаллической решетки, либо располагаться в междоузлиях.
По типу расположения атомов растворимого элемента в кристаллической решетке твердые растворы делят на две группы: замещения и внедрения.
Твердые растворы внедрения образуют металлы с неметаллами. Атомы неметаллов меньше атомов металлов. Поэтому атомы неметаллов могут располагаться в междоузлиях кристаллической решетки металлов. Внедрившийся атом вызывает искажение решетки металла-растворителя. Все твердые растворы внедрения – растворы с ограниченной растворимостью.
Химические соединения металлы образуют как с металлами так и с неметаллами. Химическое соединение характеризуется определенной температурой плавления, скачкообразным изменением свойств при изменении состава.
Химические соединения металлов с неметаллами образуются при строго определенных соотношениях входящих в них элементов, соответствующих нормальным валентностям. Химические соединения обладают повышенной твердостью и пониженной пластичностью.
Кристаллическая решетка химического соединения имеет сложное строение.
Диаграмма состояния
Диаграмма состояния представляет собой графическое изображение состояния сплава. Если изменится состав сплава, его температура, давление, то состояние сплава изменится, и это находит отражение в диаграмме состояния.
Диаграмма состояния показывает устойчивые состояния, которые при данных условиях обладают минимальным уровнем свободной энергии. Поэтому диаграмма состояния может также называться диаграммой равновесия, поскольку показывает, какие при данных условиях существуют равновесные фазы.
Следовательно, и изменения в состоянии, которые отображены на диаграмме, относятся к равновесным условиям, т.е. при отсутствии перенагрева или переохлаждения.
Так как превращения в отсутствии перенагрева или переохлаждения в действительности не могут совершаться, поэтому диаграмма состояния представляет собой теоретический случай.
Общие закономерности сосуществования устойчивых фаз, отвечающих теоретическим условиям равновесия, описываются правилом фаз или законом Гиббса.
Закон Гиббса дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов. Фазой называется однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав или структура вещества изменяется скачком.
Однородная жидкость – однофазная система. Смесь двух видов кристаллов – двухфазная система. Компонентами называются вещества, образующие систему. Чистый металл – однокомпонентная система.
Сплав двух металлов – двухкомпонентная система.
Среди диаграмм состояния металлических сплавов самое большое значение имеет диаграмма состояния системы железо-углерод. Это объясняется наиболее широким применением в технике железоуглеродистых сплавов.
Диаграмма железо-углерод относится к диаграммам состояния для сплавов с ограниченной растворимостью. Диаграмма железо-углерод, как ясно из названия, должна распространяться от железа до углерода.
Железо образует с углеродом ряд химических соединений, но надежно установлено лишь одно Fe3C – карбид железа или цементит.
Каждое устойчивое химическое соединение можно рассматривать как компонент, а диаграмму изучать по частям.

Следовательно, рассматривая диаграмму железо-углерод на участке от железа до цементита, мы можем компонентами системы считать железо и цементит.
Рассмотрим свойства отдельных компонентов. Железо. Температура плавления 1539 °С. Железо аллотропическое вещество. Атомы элемента могут образовывать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако устойчивым, а, следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии.
- В ряде случаев (и для железа в том числе) при изменении температуры или давления может оказаться, что для одного и того же металла более устойчивой будет другая решетка, чем та, которая была при другой температуре или давлении.
- Так для железа характерны две кристаллические решетки: • объемноцентрированный куб;
- • гранецентрированный куб.
Существование одного металла в нескольких кристаллических формах носит название полиморфизма или аллотропии. Различные кристаллические формы одного и того же вещества называются полиморфными или аллотропическими модификациями.
Аллотропические формы обозначаются греческими буквами α, β, γ и т.д., которые в виде индексов добавляются к символу, обозначающему элемент. Аллотропическая форма, существующая при самой низкой температуре, обозначается через α, следующая через β и т.д.
Превращение одной аллотропической формы в другую при нагреве чистого металла сопровождается поглощением тепла и происходит при постоянной температуре. На термической кривой превращение отмечается горизонтальным участком.
При охлаждении происходит выделение тепла теоретически при той же температуре, что и при нагреве, но практически при более низкой вследствие переохлаждения.
 Явление полиморфизма основано на едином законе об устойчивости состояния с наименьшим запасом энергии.
Явление полиморфизма основано на едином законе об устойчивости состояния с наименьшим запасом энергии. Запас свободной энергии зависит от температуры. Поэтому в одном интервале температур более устойчивой является модификация α, а в другом модификация γ.
Запас свободной энергии зависит от температуры. Поэтому в одном интервале температур более устойчивой является модификация α, а в другом модификация γ. Железо имеет две температуры полиморфного превращения: 911 и 1392 °С.
Железо имеет две температуры полиморфного превращения: 911 и 1392 °С.
Особо следует рассмотреть образование растворов углерода в железе. Растворимость С в Fe существенно зависит от того, в какой кристаллической форме существует железо.
Диаметр атома углерода (в свободном состоянии) равен 1.54 A. В объемноцентрированной решетке имеется 12 свободных мест в середине ребер. Диаметр такого свободного места 0.62 A. Такой объем явно недостаточен для помещения в нем атома углерода.

В гранецентрированной кристаллической решетке в центре имеется пора диаметром 1.02 A. В этой поре атом углерода может поместиться, вызывая естественно некоторое увеличение размера решетки γ-железа.
Таким образом, геометрические соображения подсказывают, что α-железо не растворяет, а γ-железо растворяет углерод. В действительности α-железо растворяет углерод, но в очень небольшом количестве ≈ 0.02%.
 Твердый раствор углерода в α-железе называется ферритом, а в γ-железе аустенитом.
Твердый раствор углерода в α-железе называется ферритом, а в γ-железе аустенитом.
Цементит. Цементит – это химическое соединение углерода с железом (карбид железа Fe3C).
Так как растворимость углерода в α-железе мала, то при нормальных температурах в подавляющем большинстве случаев в структуру стали входят высокоуглеродистые фазы в виде цементита.
Кристаллическая структура цементита очень сложна.
 Температура плавления цементита 1600 °С. Аллотропических превращений не испытывает. Цементит имеет высокую прочность ~ 800 НВ и практически нулевую пластичность.
Температура плавления цементита 1600 °С. Аллотропических превращений не испытывает. Цементит имеет высокую прочность ~ 800 НВ и практически нулевую пластичность.
Цементит — соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Процесс имеет огромное практическое значение.
Историческая справка. Начало изучению диаграммы железо-углерод (а также железоуглеродистых сплавов и процессов термической обработки) было положено работой Чернова Д.К.
«Критический обзор статей Лаврова и Калакуцкого о стали и стальных орудиях и собственные исследования Д.К.Чернова по этому же предмету», опубликованной в 1868 году.
Этот год можно считать годом возникновения науки металловедения.
В этой работе Чернов впервые указал на существование в стали критических точек, и на зависимость их положения от содержания углерода. Таким образом, Чернов дал первое представление о диаграмме железо-углерод.
Диаграмма железо-цементит имеет двойную концентрационную ось абсцисс. Содержание углерода и содержание цементита. Линия ABCD является ликвидусом. Это линия – геометрическое место точек начала кристаллизации. Линия AHJECF – солидус. Геометрическое место точек конца кристаллизации.
- Так как железо с углеродом образует химическое соединение Fe3C, и еще имеет две аллотропические формы α и γ следовательно в системе существуют следующие фазы: • жидкость (жидкий раствор углерода в железе) располагается выше линии ликвидус и обозначается Ж;
- • цементит Fe3C – вертикаль DFKL, обозначается Ц;
• феррит – структурная составляющая, которая представляет собой α-железо, растворяющая в незначительном количестве углерод, область феррита левее линий GPQ и AHN, обозначается Feα; • аустенит – структура, представляющая собой твердый раствор углерода в γ-железе, область аустенита на диаграмме NJESG, обозначается Feγ.
Три горизонтальные линии на диаграмме HJB, ECF, PSK указывают на протекание трех нонвариантных реакций. Вариантность – это число степеней свободы системы. Если число степеней свободы равно нулю (нонвариантная система), то нельзя изменить внешние и внутренние факторы системы (температуру, давление, концентрацию) без того, чтобы это не вызвало изменение числа фаз.
При 1499 °С (линия HJB) протекает перитектическая реакция: Ж + Feα → Feγ
Перитектическая реакция представляет собой реакцию, когда жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов.
В результате перитектической реакции образуется аустенит. Реакция имеет место только у сплавов, содержащих углерода от 0.1 до 0.5%.
При температуре 1147 °С (горизонталь ECF) протекает эвтектическая реакция: Ж → Feγ + Ц
Эвтектическая реакция – реакция кристаллизации одновременно двух (или более) видов кристаллов из жидкости. Механическая смесь двух (или более) видов кристаллов называется эвтектикой. В результате этой реакции образуется эвтектическая смесь. Эвтектическая смесь аустенита и цементита называется ледебуритом. Эта реакция протекает у всех сплавов, содержащих углерода > 2.14%.
При температуре 727 °С (горизонталь PSK) протекает эвтектоидная реакция: Feγ → Feα + ЦII Превращение протекает аналогично кристаллизации эвтектики, но исходным раствором является не жидкость, а твердый раствор.
Такое превращение называется эвтектоидным, а смесь полученных кристаллов эвтектоидом. Эвтектоидная смесь феррита и цементита называется перлитом и имеет вид перламутра. У всех сплавов, содержащих свыше 0.02% углерода, т.е. практически у всех промышленных железоуглеродистых сплавов имеет место перлитное (эвтектоидное) превращение.
Кристаллы выделившиеся из твердого раствора называются вторичными кристаллами и обозначаются символом II (например Цп) в отличие от первичных кристаллов, выделяющихся из жидкости.
У всех сплавов, содержащих менее 2.14% углерода, в результате первичной кристаллизации получается структура аустенита; у всех сплавов содержащих более 2.14% углерода, структура состоит из ледебурита с избыточным аустенитом или цементитом.
Это различие в структуре при высоких температурах и создает существенное отличие в технологических и механических свойствах сплавов.
Наличие эвтектики делает сплав нековким, вместе с тем более низкая температура плавления высокоуглеродистых сплавов облегчает применение их как литейных материалов.
Железоуглеродистые сплавы, содержащие менее 2.14% углерода называются сталями, а более 2.14% — чугунами.
Различают три группы сталей: • эвтектоидные, содержащие около 0.8% углерода, их структура перлит;
• доэвтектоидные, содержащие < 0.8% углерода, их структура Ф+П (феррит + перлит) ; • заэвтектоидные 0.8÷2 % углерода, имеют структуру ЦII + П (цементит вторичный + перлит).
Источник: https://all4study.ru/proizvodstvo/stroenie-i-svojstva-metallov.html
Строение и структура металлов
- ГЛАВА 7
- МЕТАЛЛЫ В СТРОИТЕЛЬСТВЕ
- Общие сведения о металлах. Классификация металлов
Металлы (от лат.
metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения.
Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия.
Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов).
Все металлы и сплавы подразделяются на две группы: черные металлы и цветные.
Черные металлы представляют собой сплав железа с небольшим количеством углерода.
Наряду с углеродом черные металлы могут содержать кремний, марганец, фосфор, серу и другие химические элементы, попадающие в металлы из руд или добавляемые в них в процессе плавки.
Для улучшения качества или придания специфических свойств в состав черных металлов вводят легирующие добавки — медь, никель, хром, кремний.
- В зависимости от содержания углерода черные металлы подразделяются на чугуны и стали.
- В сталях содержится до 2% углерода, а в чугунах содержится от 2 до 6,7% углерода.
- Цветные металлы представляют собой сплавы на основе алюминия, магния, меди, никеля, хрома, цинка, олова, свинца.
Металлы состоят из зерен, тесно прилегающих друг к другу. Эти зерна можно заметить на свежем изломе металлического стержня невооруженным глазом. Более четко структура металла видна под микроскопом при сильном увеличении.
В зависимости от химического состава структурные составляющие железоуглеродистых сплавов носят следующие наименования:
- — аустенит — твердый раствор углерода в гамма-железе (гамма-железо — одна из форм кристаллов чистого железа); предельная концентрация углерода в аустените 1,7%; аустенит немагнитен, характеризуется большой вязкостью, хорошей сопротивляемостью истиранию и химической стойкостью;
- — феррит — технически чистое железо, которое характеризуется малой твердостью, небольшой прочностью и высокой пластичностью; феррит магнитен; свойства феррита в значительной степени зависят от размера его зерна; в структуре стали феррит располагается в виде отдельных светлых зерен, перемежающихся с темными участками перлита, или в виде светлых окаймлений вокруг зёрен перлита;
- — цементит — химическое соединение железа с углеродом; обладает высокой твердостью, но в, то, же время хрупок; форма цементита в стали оказывает влияние на ее механические свойства, особенно на ударную вязкость;
- — перлит — смесь цементита и феррита; содержание углерода в перлите 0,83 %', чем мельче зерна перлита в металле, тем выше его механические свойства.
Химический состав и структура металла предопределяет его физические и механические свойства: прочность, твердость, плотность. Механические свойства в значительной степени позволяют определить, насколько хорошо будет работать деталь в эксплуатационных условиях.
Строение и структура металлов
Металлы относятся к твердым телам кристаллического строения.
Твердое тело —это агрегатное состояние вещества, характеризующееся стабильностью формы и объема.По своему внутреннему строению твердые тела разделяются на кристаллические и аморфные.
Кристаллы — это твёрдые тела, частицы которых располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры.
Точнее, частицы колеблются около определенных положений равновесия. Если их мысленно соединить прямыми линиями, то получается своего рода «скелет» кристалла. Такое изображение кристалла называется кристаллической решеткой.
Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур.
Большинство из них (но не все) обнаружены в природе или созданы искусственно.
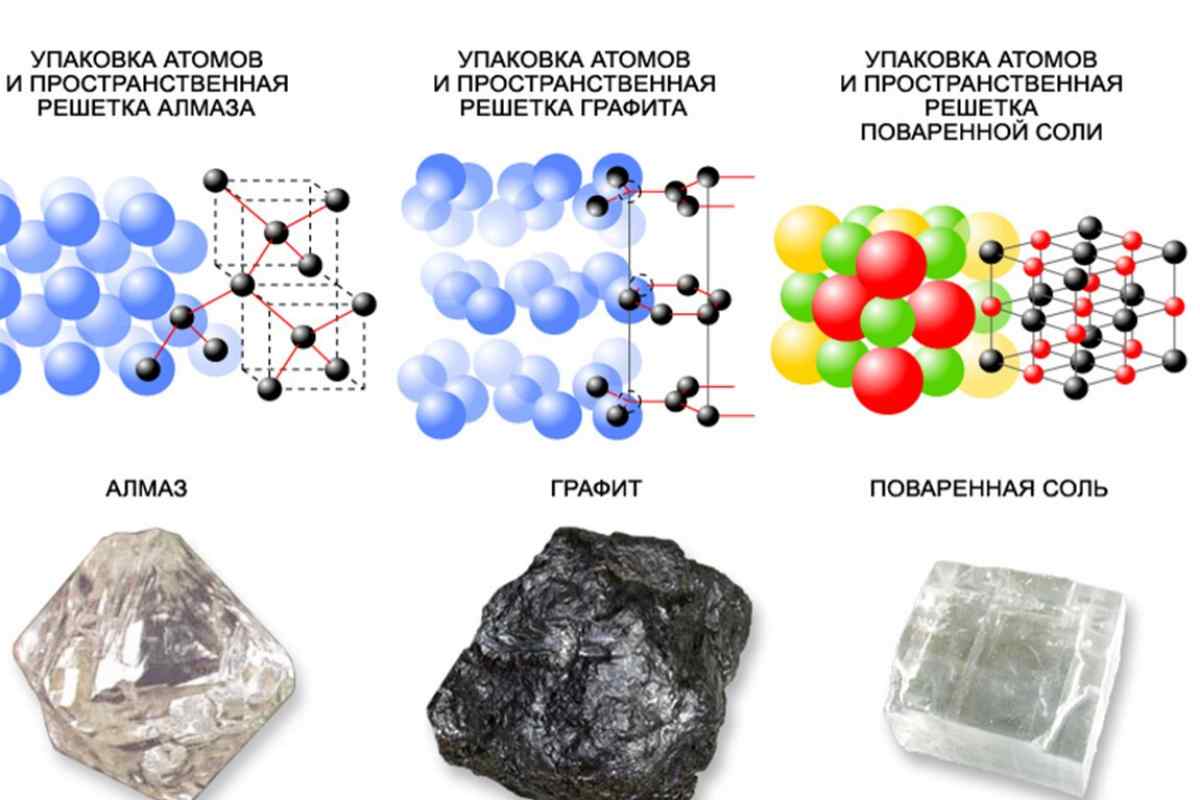
Рис. 7.1. Виды кристаллического строения металлов
На рис. 7.1. приведены примеры простых кристаллических решеток: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемно-центрированная кубическая решетка; 4 – гексагональная решетка.
Металлы имеют относительно сложные типы кубических решеток — объемно центрированная (ОЦК) и гранецентрированная (ГЦК) кубические решетки.

Рис. 7.2. Объемно-центрированная кристаллическая решетка
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис.7.2.), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
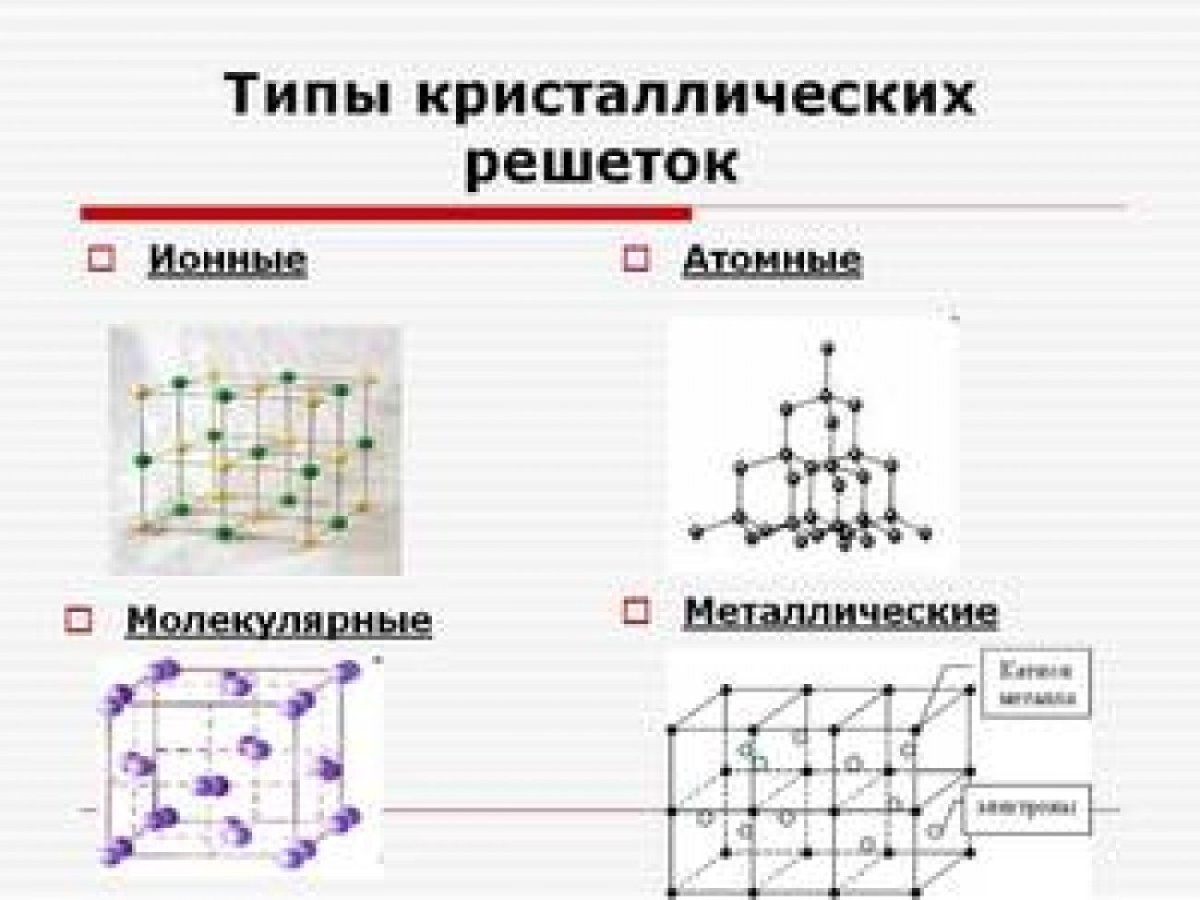
Рис.7.3. Гранецентрированная кристаллическая решетка
В гранецентрированной кристаллической решетке (ГЦК-решетки) (рис.7.3) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.

Рис.7.4. Гексагональная плотноупакованная кристаллическая решетка
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис.7.4). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
В гексагональных решетках отношение параметра с/а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, бериллий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями, как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки – это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряются в нанометрах (1 нм = 10-9 м = 10 Å). Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки принимают два параметра – сторону шестигранника а и высоту призмы с.
Когда отношение с/а = 1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (рис. 7.4).
Некоторые металлы имеют гексагональную решетку с менее плотной упаковкой атомов (с/а > 1,633). Например, для цинка с/а = 1,86, для кадмия с/а = 1,88.
Параметры, а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой, а лежит в пределах 0,228-0,398 нм, а с в пределах 0,357- 0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.
Таким образом, ОЦК — и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом понимается количество ближайших соседей данного атома.
Источник: https://megaobuchalka.ru/1/18277.html
Общие физические свойства металлов — урок. Химия, 8–9 класс
Металлы — это простые вещества, образованные металлическими химическими элементами.
В металлах существует особый вид связи — металлическая химическая связь.
Металлическая связь — это химическая связь, образующаяся за счёт притяжения катионов (положительно заряженных ионов) металлов и свободно перемещающихся электронов (так называемого «электронного газа»), заряженных отрицательно.

- На рисунке изображена модель кристаллической решётки металлов: в узлах кристаллической решётки находятся как электрически нейтральные, так и положительно заряженные катионы металлов, а между ними свободно перемещаются отрицательно заряженные электроны (электронный газ).
- За счёт наличия в кристаллах свободно движущихся электронов для большинства металлов характерны общие физические свойства: особый металлический блеск, высокие электропроводность и теплопроводность, ковкость и другие.
- Общие физические свойства металлов
- Агрегатное состояние и цвет металлов
- При обычных условиях все металлы (за исключением ртути, её температура плавления — (–39) °C) являются твёрдыми веществами.
- Способность металлов отражать падающий на них свет является причиной наличия у них особого металлического блеска.
- Металлы не имеют запаха.
- В своём большинстве металлы имеют серебристо-белый или серебристо-серый цвет. Исключение составляют медь (красного цвета) и золото (жёлтого цвета).
В технике металлы принято подразделять на чёрные и цветные. Как правило, к чёрным металлам относят железо и его сплавы, а к цветным — все остальные металлы.
 |
 |
 |
| Алюминий Al | Капельки ртути Hg | Медь Cu |
Электро- и теплопроводностьМеталлы хорошо проводят тепло. Все металлы хорошо проводят электрический ток, что обусловлено наличием в кристаллической решётке электронов, которые способны свободно перемещаться. Очень хорошими проводниками электрического тока являются золото (Au), медь (Cu) и серебро (Ag).
Пластичность
Металлы в большинстве своём пластичны. Их можно ковать, вытягивать в проволоку и прессовать. Исключение составляют сурьма и висмут, они хрупкие и от удара рассыпаются.
Температура плавления
Температура плавления металлов изменяется в широком интервале: от (–39) °C у ртути до (3420) °C у вольфрама. По температуре плавления металлы условно подразделяют на:
- легкоплавкие (температура плавления до (1000) °C);
- среднеплавкие (температура плавления от (1000) °C до (1600) °C);
- тугоплавкие (температура плавления выше (1600) °C).
- Плотность
- Плотность различных металлов также колеблется в сравнительно широких пределах: от (0,53) г/см³ у лития до (22,61) г/см³ у осмия.
- По плотности металлы принято подразделять на лёгкие (плотность меньше (5) г/см³) и тяжёлые (плотность свыше (5) г/см³).
Источник: https://www.yaklass.ru/p/himija/89-klass/klassy-neorganicheskikh-veshchestv-14371/metally-15154/re-a5531b87-3eac-40ca-a3ae-f4f5a1d95caa
Строение металлов
Металлы – твёрдые элементы, сплавы которых широко применяются в промышленности, строительстве и повседневной жизни.
Пластичность, твёрдость, тепло- и электропроводность, а также способность к плавке и ковке обусловлены строением металлов.

Электронное строение атома металла включает:
- положительно заряженное ядро;
- отрицательно заряженные электроны.
Ядро состоит из протонов и нейтронов. Количество протонов, заряд ядра и число электронов соответствуют порядковому номеру металла в периодической таблице.
Электроны в металлических атомах расположены намного дальше от ядра, чем электроны неметаллов. Этим объясняется лёгкость отделения валентных электронов, поэтому металлы всегда являются восстановителями в химических реакциях.
Атомы всех металлов, за исключением ртути, образуют кристаллические решётки. Кристаллическая решётка состоит из повторяющихся комплексов атомов – элементарных кристаллических ячеек, которые бывают трёх видов. Их отличия описаны в таблице строения металлов.
| Вид решётки | Характеристика | Примеры |
| Кубическая объёмно-центрированная (ОЦК) | Восемь ионов находятся по углам условного куба, один – в середине | Fe, Cr, Mo, W, V |
| Кубическая гранецентрированная | Ионы располагаются в углах куба и в центре каждой грани. Центр куба свободен | Cu, Ag, Ni, Pb, Al |
| Гексагональная плотноупакованная | Шестигранная призма. В углах и в центре между ними находятся ионы. Посередине призмы лежат ионы, образующие треугольник | Zn, Ti, Mg, Co, Zr |
Рис. 1. Виды решёток металлов.
Металлы отличаются от неметаллов характерными физическими свойствами:
- имеют металлический блеск;
- проводят электрический ток и тепло;
- не имеют запаха;
- обладают серебристо-серым цветом (исключение – медь и золото).
Благодаря пластичности и плавке металлы могут образовывать сплавы – смеси химических элементов. Большую часть сплавов составляют металлы, остальное – случайные примеси и специально вводимые вещества. Сплавы отличаются высокой прочностью, упругостью, хрупкостью. Широко применяются сплавы на основе железа (чёрные металлы) и алюминия (цветные металлы).
Высокую электропроводность обуславливают свободные электроны, перемещающиеся по кристаллической решётке под действием электрических полей. При нагревании электропроводность уменьшается.
Классификация металлов приведена в таблице.
| Признак | Вид | Пример |
| Температура кипения | Легкоплавкие (Т1000°С) | Au, Cu, Ni |
| Плотность | Лёгкие (ρ5 г/см3) | Os |
| Твёрдость | Мягкие – режутся ножом | Na, Rb, Cs |
| Твёрдые – используются для резки | Cr |
В химии по структуре орбиталей атома металла различают s-, p-, d-, f-металлы.
Металлы являются восстановителями и вступают в реакцию с неметаллами, образуя оксиды, гидроксиды, соли. Самыми активными являются щелочные и щелочноземельные металлы, расположенные в I и II группах таблицы Менделеева. Благородные металлы (Au, Ag, Pt) малоактивны и не взаимодействуют с кислородом и водой.
Рис. 2. Шкала активности металлов.
Особенности химического взаимодействия металлов с другими элементами описаны в таблице.
| Взаимодействие | Продукты | Уравнение |
| С кислородом | Оксиды | 2Mg + O2 → 2MgO |
| С серой | Сульфиды | Zn + S → ZnS |
| С азотом | Нитриды | 6Li + N2 → 2Li3N |
| С фосфором | Фосфиды | 3Ca + 2P → Ca3P2 |
| С галогенами | Галогениды | 2Na + Cl2 → 2NaCl |
| С водой | Гидроксиды | 2Na + 2H2O → 2NaOH + H2 |
| С кислотами | Соли | 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 |
| С солями (замещают менее активные металлы) | Соль | 2Fe + Cu2SO4 → Fe2SO4 + 2Cu |
Золото растворяется в царской водке (смеси соляной и азотной кислот), серебро – в концентрированной азотной и горячей серной кислотах.
Рис. 3. Золото.
Рассмотрели особенности строения атомов металлов, физические и химические свойства. Металлы состоят из элементарных кристаллических ячеек, отличающихся конфигурацией.
Элементы обладают металлическим блеском, электропроводностью, пластичностью, твёрдостью. Металлы – восстановители. Наиболее активные находятся в I и II группах таблицы Менделеева.
Металлы реагируют с кислородом, водой, кислотами, галогенами и неметаллами.
Средняя оценка: 4.7. Всего получено оценок: 163.
Источник: https://obrazovaka.ru/himiya/stroenie-metallov-osobennosti-tablica.html
Особенности строение металлов и сплавов
Металлы и их сплавы повсеместно используются для изготовления конструкций машин, оборудования, инструмента и т. д.
Общее свойство металлов и сплавов — их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах.
В кристалле элементарные частицы (атомы, ионы) сближены до соприкосновения. Для упрощения пространственное изображение принято заменять схемами, где центры тяжести частиц представлены точками.
В точках пересечения прямых линий располагаются атомы; они называются узлами решетки. Расстояния a, b и c между центрами атомов, находящихся в соседних узлах решетки, называют параметрами, или периодами решетки.
Строение сплавов. Для рассмотрения строения и св-в сплавов вводятся следующие понятия:
компоненты– химические элементы, входящие в состав сплава;
фаза – однородная часть системы, имеющий одинаковый состав и св-ва и отделения от остальных частей поверхн. Раздела.
Система – софокупность фаз, наход. В состоянии устойчивого равновесия.
Атомно-кристаллические несовершенства структуры
Встречающиеся в природе кристаллы, как монокристаллы, так и зерна в поликристаллах, никогда не обладают строгой периодичностью в расположении атомов т. е. не являются «идеальными» кристаллами. В действительности «реальные» кристаллы содержат те или иные несовершенства (дефекты) кристаллического строения.
Дефекты в кристаллах принято классифицировать по характеру их измерения в пространстве на точечные (нульмерные), линейные (одномерные), поверхностные (двухмерные), объемные (трехмерные).
Точечными дефектами называются такие нарушения периодичности кристаллической решетки, размеры которых во всех измерениях сопоставимы с размерами атома.
Линейные дефекты в кристаллах характеризуются тем, что их поперечные размеры не превышают нескольких межатомных расстояний, а длина может достигать размера кристалла. К линейным дефектам относятся дислокации — линии, вдоль и вблизи которых нарушено правильное периодическое расположение атомных плоскостей кристалла.
В кристаллах встречаются и так называемые смешанные дислокации. Дислокации не могут обрываться внутри кристалла — они должны быть либо замкнутыми, либо выходить на поверхность кристалла.
ДЕРЕВЯННЫЕ МАТЕРИАЛЫ
Древесина была всегда необходимой для человеческих потребностей. Из-за своих уникальных физических свойств, древесина держит заслуженный статус как технический, материальный и функциональный товар.
Древесина является стойкой, закалённой, относительно лёгкой, так как её клетки, в основном, заполнены воздухом.
Будучи растительного происхождения, она мягкая, по сравнению с железом или камнем (другими материалами эквивалентной силы), и поэтому сравнительно легка в обработке, но, при этом, удивительно прочна.
- Вместе с тем древесина имеет недостатки она подвержена горению и загниванию, разрушению от воздействия насекомых и грибов
- Технологический процесс изготовления деревянных конструкций включает в себя следующие операции:
- Заготовка пиломатериалов,
- Сушка древесины;
- Сортировка;
- Механическая обработка;
- Нанесение защитных покрытий;
- Сборка конструкций;
- Контроль качества
- ПОЛИМЕРНЫЕ МАТЕРИАЛЫ
- Полимерные материалы находят всё большее применение в строительстве и других отрослях промышленности.
Различают природные и синтетические полимеры. К природным полимерам относятся натуральный каучук, целлюлоза, слюда, асбест, шерсть. Однако ведущее место занимают синтетические полимеры, получаемые в процессе химич. Синтеза.
По составу все полимеры делятся на органические, элементоорганические и неорганические.
Основная цепь элементоОРГ соедин. Построена из атомов кремния и кислорода.
Неорганические полимеры (силикатное стекло, керамика, слюда) не содержат атомов углерода. Основой их являются оксиды кремния, алюминия, магния.
Органические полимеры составл. Наибольшую группу соединений, состоят из атомов углерода, водорода, кислорода, азота, серы и галогенов.
Пластмассы хар-ся значительно большим, чем элатомеры, межмолекулярным взаимодействием. Пластмассы классифицруют по виду наполнителя (твердый или газообразный) и по реакции связующего полимера к повторным нагревам.
Резины (эластомеры) – низкомодульные конструкц. Мат., продукт вулканизации каучука. Это плстмассы с редкосетчатой структурой, в которым связующим выступает полимер.
КЕРАМИЧЕСКИЕ МАТЕРИАЛЫ
Керамическими называются искусственные каменные материалы и изделия, получаемые из глин и их смесей с минеральными добавками путем их формования, сушки, обжига. Сырьем для керамических материалов служат различные глины.
Керамические материалы и изделия объединяют в группы по назначению и свойствам, по основному используемому сырью или его фазовому составу.
По назначению строительные керамические материалы и изделия классифицируются на стеновые материалы, пустотелые изделия для перекрытий, облицовочные материалы для наружной и внутренней отделки зданий, кровельные материалы, трубы, огнеупорные материалы, заполнители для легких бетонов, санитарно-технические изделия, специальные изделия.
Большая прочность, значительная долговечность, декоративность многих видов керамики, а также распространенность в природе сырьевых материалов обусловили широкое применение керамических материалов и изделий в строительстве. В долговечности керамических материалов можно убедиться на примере Московского Кремля, стены которого сложены почти 500 лет назад.
- Сво-ва: Водопоглощение, Предел прочности при сжатии
- КОМПОЗИЦИОННЫЕ МАТЕРИАЛЫ
- Композиционные материалы, представляют собой металлические и неметаллические матрицы (основы) с заданным распределением в них упрочнителей (волокон, дисперсных частиц и др.)
- Классификация композиционных материалов.
- По виду наполнителя: а) волокнистые.
- Б) С дисперсными частицами;
- По схеме расположения наполнителей:
- А) С одноосным расположением: параллельные волокна.
- По природе компонентов:
- а) содержащие Ме или сплавы;
- б) содерж. неМе элементы;
в) содерж. Компонент из неорганич. Соединений;
г) Содерж. Компонент из органич. Соединений.
3.1. Волокнистые композиционные материалы. Часто композиционный материал представляет собой слоистую структуру, в которой каждый слой армирован большим числом параллельных непрерывных волокон.
Композиционные материалы отличаются от обычных сплавов более высокими значениями временного сопротивления и предела выносливости (на 50 – 10 %), модуля упругости, коэффициента жесткости и пониженной склонностью к трещинообразованию.
Прочность композиционных (волокнистых) материалов определяется свойствами волокон; матрица в основном должна перераспределять напряжения между армирующими элементами.
3.2. Дисперсно-упрочненные композиционные материалы.
- материалах матрица является основным элементом,несущим нагрузку
- Стекловолокниты.
- Стекловолокниты – это композиция, состоящая из синтетической смолы, являющейся связующим, и стекловолокнистого наполнителя.
- Карбоволокниты.
- Карбоволокниты (углепласты) представляют собой композиции,состоящие из полимерного связующего (матрицы) и упрочнителей в видеуглеродных волокон (карбоволокон).
- Карбоволокниты с углеродной матриццей.
- Коксованные материалы получают из обычных полимерныхкарбоволокнитов, подвергнутых пиролизу в инертной или восстановительнойатмосфере.
- Бороволокниты.
- Бороволокниты представляют собой композиции из полимерногосвязующего и упрочнителя – борных волокон.
- Органоволокниты.
- Органоволокниты представляют собой композиционные материалы,состоящие из полимерного связующего и упрочнителей (наполнителей) в видесинтетических волокон.
- ВОЛОКНИСТЫЕ КОМПОЗИТЫ
Конструкционная матрица должна иметь необходимую пластичность и быть работоспособной в той области температур, для которой предназначен композит. Для изготовления композитов, работающих при t ниже 200 град. Используют полимерные матрицы.
К таким композитам относятся стекло-, угле-, боро- и органопластики. Стеклопластики применяют для изготовления корпусов автомобилей, лодок, некоторых бытовых приборов.
Углепластики используют в судо- и автомобилестроении, в производстве спортивного инвенторя.
Пластичность металлов сообщает конструкции необходимую вязкость. Это способствует быстрому выравниванию локальных механических нагрузок.
- Таким образом, наиболее важным критерием выбора матричного материала является рабочая температура эксплуатации композита.
- Помимо высокой прочности и жесткости, основными требованиями, предъявляемыми к волокнам для композитов, служат хорошее смачивание материала волокна расплавленной матрицей в процессе изготовления, слабое взаимодействие волокна с матрицей и его высокая окислительная стойкость.
- Прочность и модуль упругости, а также сопротивление материалов удару для однонапраленных композиционных материалов на основе алюминия, магния и титана повышаются по мере увелечения в композиции объемного содержания волокон.
- Основными недостатками являются сложность изготовления и высокая стоимость.
Источник: https://infopedia.su/2xac82.html
1. Строение металлов
Материаловедение: конспект лекций [litres]Алексеев Виктор Сергеевич
Металлы и их сплавы – основной материал в машиностроении. Они обладают многими ценными свойствами, обусловленными в основном их внутренним строением. Мягкий и пластичный металл или сплав можно сделать твердым, хрупким, и наоборот.
Для того чтобы сознательно изменять свойства металлов, необходимо знать основы их кристаллического строения. Как известно, все тела состоят из большого количества атомов, которые удерживаются силами сцепления, совершая колебания большой частоты возле точек равновесия.
Поскольку атомы разных металлов различны, каждый металл имеет свои определенные свойства. Эти свойства зависят от расположения атомов между собой, характера их связей, от расстояния между ними. Если изменить расстояние между атомами или порядок их расположения, изменятся и свойства металла.
В аморфных телах – смоле, стекле, канифоли и т. п. – атомы расположены беспорядочно. В металлах они находятся в определенном геометрическом порядке, образуя кристаллы, поэтому металлы являются кристаллическими телами.
Металлы различаются не только порядком расположения атомов, но и кристаллической решеткой, которая представляет собой воображаемую пространственную сетку, состоящую из элементарных ячеек, в узлах которой находятся атомы.
Различают следующие кристаллические решетки металлов с плотной упаковкой атомов: кубическую объемно—центрированную, кубическую гранецентрированную и гексагональную.
В ячейке кубической объемно—центрированной решетки атомы расположены в вершинах и центре куба.
Такая ячейка содержит девять атомов (хром, вольфрам, ванадий, молибден, литий, а при определенных температурах – железо и другие металлы).
В ячейке кубической гранецентрированной решетки атомы находятся в вершинах куба и на пересечении диагоналей каждой плоскости. Такая ячейка имеет 14 атомов (свинец, никель, медь, золото, серебро, пластина, железо при определенных температурах и другие металлы).
В ячейке гексагональной кристаллической решетки атомы располагаются в вершинах и в центре шестигранных оснований призмы, а три атома – в средней ее плоскости, при этом такая ячейка содержит 17 атомов (магний, цинк, кадмий, осмий, бериллий и другие металлы).
При определенных условиях некоторые металлы – железо, титан, цирконий, стронций, кобальт, кальций и другие могут перестраиваться из одного вида кристаллической решетки в другой, например из кубической объемно—центрированной – в гранецентрированную и даже гексагональную. Элементарная ячейка отображает только один элемент, или одну ячейку, кристаллической решетки.
Вся кристаллическая решетка в реальном металле состоит из большого числа многократно повторяющихся элементарных ячеек.
Большое значение имеет расстояние между атомами ячейки кристаллической решетки или между параллельными атомными плоскостями, образующими элементарную ячейку. Чем больше это расстояние, тем менее прочен металл.
Расстояние между ними измеряется в ангстремах – 1 А = = 10 –8 см или в нанометрах – 1 А = 0,1 нм.
Из практики известно, что железо прочнее меди, а медь прочнее алюминия.
Данный текст является ознакомительным фрагментом.
Следующая глава
Строение древесины
Сделав только поперечный срез, можно четко рассмотреть строение древесины. Каждый брусок необтесанного дерева имеет кору – это кожа дерева, которая не используется в работе, ее обязательно снимают. Под корой располагается зона роста дерева, которая
Строение древесины
Сделав только поперечный срез, можно четко рассмотреть строение древесины. Каждый брусок необтесанного дерева имеет кору – это кожа дерева, которая не используется в работе, ее обязательно снимают. Под корой располагается зона роста дерева, которая
ЛЕКЦИЯ № 1. Строение древесины 1. Виды древесных пород и части дерева
Растущие деревья имеют следующие составные части: корни, ствол, ветви, листья. Корневая система деревьев выполняет функции поставщика влаги и питательных веществ из почвы по стволу и ветвям к листьям.
2. Макроскопическое строение древесины
При поперечном разрезе ствола дерева можно установить главные макроскопические признаки: заболонь, ядро, годичные слои, сердцевинные лучи, сосуды, смоляные ходы и сердцевинные повторения.У молодых деревьев всех пород древесина
§ 3.3 Строение атомов и периодический закон Менделеева Свойства простых тел, а также формы и свойства соединений элементов, находятся в периодической зависимости (или, выражаясь алгебраически, образуют периодическую функцию) от их атомных весов.
Д.И. Менделеев
Считается,
§ 3.6 Строение ядер Чем больше в ядре должно поместиться нуклонов, тем больше должна быть площадь поверхности ядра, где происходят присоединения то протонов, то нейтронов… Этим особенностям лучше всего отвечает форма ядра в виде двух пирамид Хеопса, соединённых
§ 3.9 Кристаллическое строение элементарных частиц и их распады А если и в самом деле, протоны и нейтроны как кирпичики ядерных конструкций сложены из электронов и позитронов?… то могли же нуклоны возникнуть в виде кубических квазикристаллических образований,
§ 4.14 Строение вещества и химическая связь Что, наконец, представляется нам затверделым и плотным,
То состоять из начал крючковатых должно несомненно,
Сцепленных между собой наподобие веток сплетённых.
В этом разряде вещей, занимая в нём первое место,
Будут алмазы
Глава 32 Строение Пространства – Времени «Действие есть кривизна Мира» Павел Дмитриевич Успенский, 1911 год Мы уже предполагали аналогии квантового строения микромира и макромира, при определенных условиях. Далее, будет показаны законы резонансного строения нашего
2. Зеренное строение металлов. Границы зерен и субзерен
Металлы – это поликристаллические тела, они состоят из мелких кристаллов. Характеризуются металлическими свойствами и составляют 50 % всех химических элементов. Строение металлов и их сплавов кристаллическое.В
8. Плавление металлов и строение расплавов
Плавление – это физический процесс перехода металла из твердого состояния в жидкое расплавленное. Плавление – процесс, обратный кристаллизации, происходит при температуре выше равновесной, т. е. при перегреве. Поскольку
10. Строение слитка и аморфные сплавы
Строение стального слитка впервые дано в 1878 г. Д.К. Черновым. Структура литого слитка состоит из трех основных зон. Первая зона – наружная мелкозернистая корка, которая состоит из дезориентированных мелких кристаллов –
Источник: https://tech.wikireading.ru/8727




