В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Температуры кипения кетонов несколько выше, чем у изомерных им альдегидов.
Метаналь (формальдегид) — газ, альдегиды С2–C5 и кетоны С3–С4 — жидкости, высшие карбонильные соединения — твердые вещества.
Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода.
С увеличением углеводородного радикала растворимость в воде падает. Ароматические карбонильные соединения в воде плохо растворимы.
Отличительной чертой многих альдегидов является их запах.
Низшие альдегиды имеют резкий запах (хотя при сильном разведении запах становится приятным и напоминает аромат плодов), у альдегидов, содержащих С4-С6 – неприятный запах, высшие альдегиды и кетоны обладают цветочными запахами. Альдегиды и кетоны хорошо растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные.
Альдегиды в природе
Альдегиды широко распространены в природе. Высшие альдегиды, особенно непредельные и ароматические входят в состав эфирных масел и содержатся в фруктах, плодах, цветах, душистых и пряных растениях. Их используют в пищевой промышленности и парфюмерии.
Человек давно использует лечебные свойства некоторых альдегидов. Пиродоксаль является одной из форм витамина В6.
В эфирных маслах аниса, акации, укропа, боярышника доминирует среди других «пахнущих» компонентов анисовый альдегид C8H8O2.
В плодах тропического растения ванили содержится ароматический альдегид ванилин (4-гидрокси-3-метоксибензальдегид) C8H8O3, который придает им характерный запах. Ванилин — кристаллическое вещество, хорошо растворяется в спирте, эфире, мало растворяется в воде.

 Коричный альдегид С6Н5СН=СНСНО содержится в масле корицы, его получают при обработке перегретым паром коры дерева корицы. Он обусловливает запах корицы, гвоздики.
Коричный альдегид С6Н5СН=СНСНО содержится в масле корицы, его получают при обработке перегретым паром коры дерева корицы. Он обусловливает запах корицы, гвоздики.
Куминовый альдегид С10Н12О содержится в масле тмина, гелиотропин (пиперональ) C8H6O3 – содержится в цветках гелиотропа и сирени.

 Пеларгоновый альдегид (нониловый альдегид, нонаналь) СН3(СН2)7СНО содержится в розовом и лимонном масле, в эфирных маслах цитрусовых растений. Пеларгоновый альдегид обладает запахом апельсина, его используют как пищевой ароматизатор.
Пеларгоновый альдегид (нониловый альдегид, нонаналь) СН3(СН2)7СНО содержится в розовом и лимонном масле, в эфирных маслах цитрусовых растений. Пеларгоновый альдегид обладает запахом апельсина, его используют как пищевой ароматизатор.
Альдегиды в природе

Физические свойства некоторых альдегидов

Формальдегид (муравьиный альдегид, метаналь) НСН=О – бесцветный газ с резким запахом, хорошо растворяется в воде, спиртах и полярных раствориелях. Иритант, токсичен!
- Ирританты – группа веществ (слезоточивого или раздражающего действия), вызывающих раздражительные реакции при попадании на слизистые и кожу, и воздействии на дыхательные пути (респираторный эффект).
- Формальдегид опасен для здоровья!

- Попадая в кровь, он уплотняет клеточную мембрану эритроцитов (красных кровяных клеток) настолько, что она теряет свои свойства, а ведь именно эритроциты снабжают клетки кислородом.
Водный 40%-ный раствор формальдегида называется формалином. Он обладает сильным дезинфицирующим действием и используется для хранения биологических препаратов.
Ацетальдегид (уксусный альдегид, этаналь) СН3СН=О – бесцветная легкокипящая жидкость, с резким запахом зеленой листвы. Хорошо растворяется в спирте, эфире, в воде растворяется неограниченно. Из-за очень низкой температуры кипения (210С) хранят и перевозят ацетальдегид в виде тримера – паральдегида.
Ирритант, очень токсичен! Он способен соединяться с белками и другими органическими соединениями в организме, подавляет дыхательные процессы в клетках.
Он является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Образуется при термической обработке полимеров и пластиков.
Акролеин (акриловый альдегид, пропеналь) СН2=CHCH=O – жидкость с резким неприятным запахом. Вследствие своей высокой реакционной способности акролеин является токсичным, сильно раздражающим слизистые оболочки глаз и дыхательных путей.
Он является одним из продуктов термического разложения глицерина и жиров-глицеридов, чем объясняется раздражающие слизистые оболочки свойства дыма горелых жиров. Подобный процесс наблюдается при пригорании жиров.
Он проявляет реакции, характерные для этиленовых углеводородов и альдегидов.
Бензальдегид(бензойный альдегид) C6H5CH=O – бесцветная маслянистая жидкость с запахом горького миндаля, плохо растворимая в воде, но хорошо растворимая в этаноле.
Он содержится в миндале, листьях черемухи, косточках персиков, абрикосов, слив, в листьях лавровишен, в маслах нероли, цветов акации, апельсина, гиацинта, в эфирном масле эвкалипта.
Бензальдегид легко окисляется на воздухе, образуя бензойную кислоту.

Фенилэтаналь (фенилуксусный альдегид) C6H5CH2CHO — бесцветная жидкость с сильным запахом гиацинта. По сравнению с бензальдегидом лучше соответствует рецептору цветочного запаха.

Кетоны в природе
Гептанон-2 С7Н14О представляет собой жидкость с гвоздичным запахом, обуславливает запах многих плодов и молочных продуктов.
Гидроксифенилбутанон-2 (кетон малины) С10Н12О2 содержится в спелых ягодах малины. Его используют для придания вкуса и аромата в пищевой промышленности и включают в состав синтетических душистых композиций. Это один из самых дорогих компонентов, используемых в пищевой промышленности.
Физические свойства некоторых кетонов
- Ацетофенон (метилфенилкетон) C6H5COCH3 — кристаллическое вещество, растворяется в спирте, эфире, бензоле, не растворяется в воде.
- Бензофенон (дифенилкетон) (С6Н5)2С=О — кристаллическое вещество, растворимое в эфире, спирте, бензоле, нерастворимое в воде.
- Физические характеристики альдегидов и кетонов
- Альдегиды и кетоны
Источник: https://himija-online.ru/organicheskaya-ximiya/aldegidy-i-ketony/fizicheskie-svojstva-aldegidov-i-ketonov.html
Альдегиды
Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь — CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.

Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.

Получение альдегидов и кетонов
- Окисление спиртов
- Пиролиз солей карбоновых кислот
- Каталитическое дегидрирование спиртов
- Реакция Кучерова
- Гидролиз дигалогеналканов
- Окисление метана
- Кумольный способ получения ацетона (и фенола)
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов. 
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов. 
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа. 
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути. В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны. 
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного. В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду. 
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид. 
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
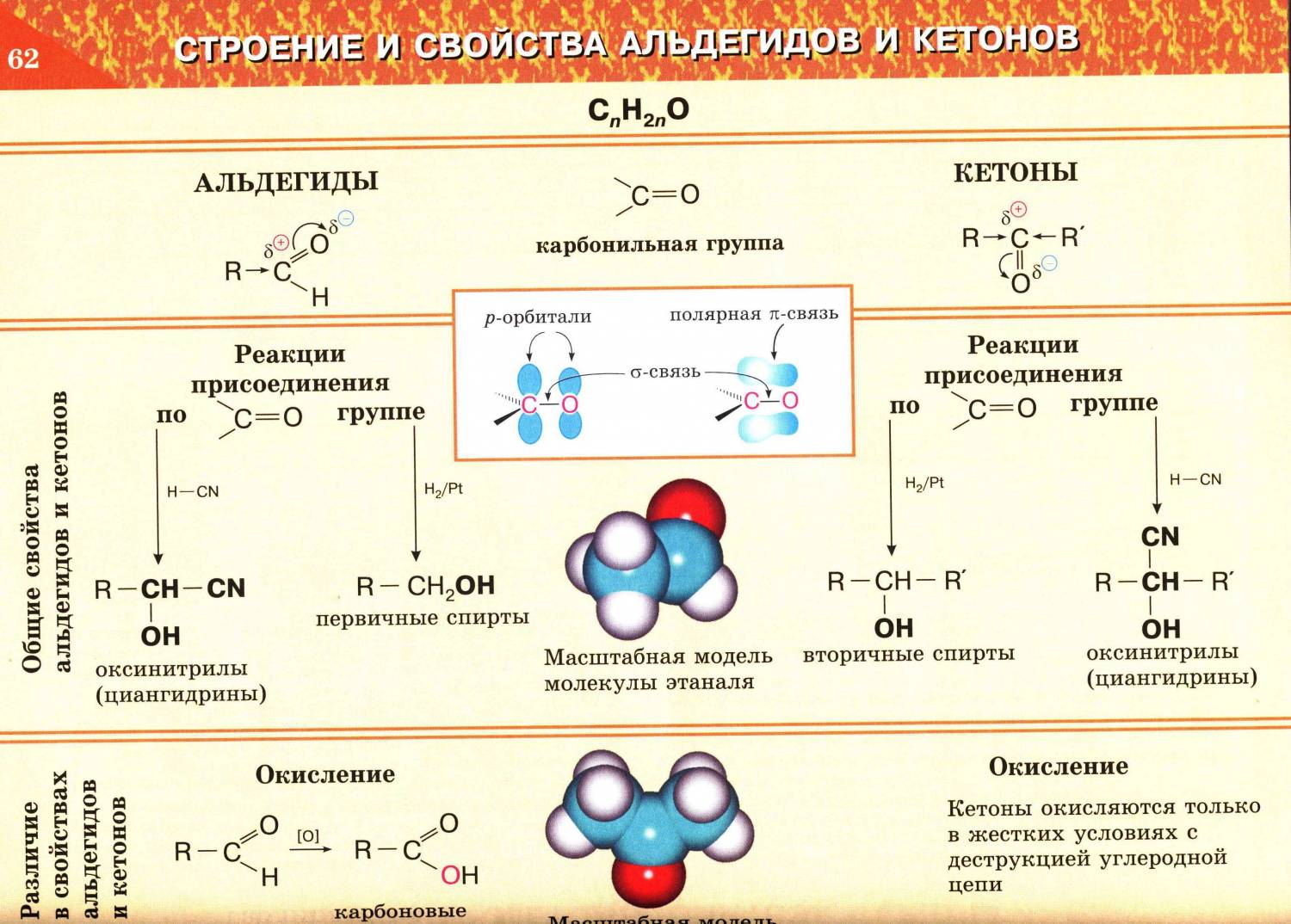
Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
- Реакции присоединения
- Окисление альдегидов
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+). Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов. Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода. 2CH3CHO + 5O2 → 4CO2 + 4H2O Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов. Кетоны, в отличие от альдегидов, в реакции окисления не вступают. Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты. Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
Источник: https://studarium.ru/article/189
Альдегиды и кетоны — номенклатура, получение, химические свойства

Строение альдегидов и кетонов
 Альдегиды – органические вещества, молекулы которых содержат карбонильную группу С=O , соединенную с атомом водорода и углеводородным радикалом.
Альдегиды – органические вещества, молекулы которых содержат карбонильную группу С=O , соединенную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов имеет вид:
- В простейшем альдегиде – формальдегиде роль углеводородного радикала играет другой атом водорода:
- Карбонильную группу, связанную с атомом водорода, часто называют альдегидной:
- Кетоны – органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. Очевидно, общая формула кетонов имеет вид:

- Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне – ацетоне – карбонильная группа связана с двумя метильными радикалами: 
Номенклатура и изомерия альдегидов и кетонов
- В зависимости от строения углеводородного радикала, связного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:

- В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль.Например:

Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. Поэтому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:

Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).

Физические свойства альдегидов
В молекуле альдегида или кетона вследствие большей электороотрицательности атома кислорода по сравнению с углеродным атомом связь С=O сильно поляризована за счет смещения электронной плотности π-связи к кислороду:

Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов.
Это связано с тем, что в молекулах альдегидов и кетонов в отличие от спиртов нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей.
Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Химические свойства альдегидов и кетонов
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
1. Реакции восстановления.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе. Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты. Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2.
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
2. Реакции окисления. Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты.
- Окисление кислородом воздуха. Например, из пропионового альдегида (пропаналя) образуется пропионовая кислота:
- Окисление слабыми окислителями (аммиачный раствор оксида серебра).
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее тонкой ровной пленкой. Получается замечательное серебряное зеркало. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
3. Реакция полимеризации:
n СH2=O → (-CH2-O-)n параформ n=8-12
Получение альдегидов и кетонов
Применение альдегидов и кетонов
- Формальдегид (метаналь, муравьиный альдегид) H2C=O:
а) для получение фенолформальдегидных смол;
б) получение мочевино-формальдегидных (карбамидных) смол;
в) полиоксиметиленовые полимеры;
г) синтез лекарственных средств (уротропин);
д) дезинфицирующее средство; - е) консервант биологических препаратов (благодаря способности свертывать белок).
- Уксусный альдегид (этаналь, ацетальдегид) СН3СН=О:
а) производство уксусной кислоты; - б) органический синтез.
- Ацетон СН3-СО-СН3:
а) растворитель лаков, красок, ацетатов целлюлозы; - б) сырье для синтеза различных органических веществ.
Источник: http://himege.ru/aldegidy-i-ketony-nomenklatura-poluchenie-ximicheskie-svojstva/
Химические свойства
Первая группа свойств — реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи.
В реакциях присоединения пи-связь рвется и образуются две сигма связи — одна с углеродом, вторая — с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде — частичный отрицательный.
Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород — положительно заряженная часть молекулы.
Первое свойство — гидрирование, присоединение водорода.

Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования — никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.

У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство — гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.

Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты, наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая — гидрат формальдегида и уксусного альдегида — возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство — присоединение синильной кислоты.

Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство — присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.

Как обычно в реакциях присоединения к карбонильной группе — плюс к минусу, а минус к плюсу.
Пятое свойство — реакция с гидросульфитом натрия.

И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа — реакции полимеризации и поликонденсации.
2. Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид — это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство — полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
![]()
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство — поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.

В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.

Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение — от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств — реакции окисления.
3. Окисление альдегидов и кетонов
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу — окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.

Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль — ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу — окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.
Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду.
Так вот это неверно — по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты.
Реакция встречается на егэ очень часто.
Десятая реакция — окисление альдегидов подкисленным раствором перманганата калия при нагревании.
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO2, проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция — горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.
- Запишем уравнение реакции в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними.
Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2.
Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n.
Слева атомов кислорода столько же — 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород.
Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения — галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде.
Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом.
Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.
Источник: https://stepenin.ru/organic/aldehydes/properties
Химические свойства альдегидов и кетонов
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
- Строение, изомерия и гомологический ряд альдегидов и кетонов
- Химические свойства альдегидов и кетонов
- Способы получения альдегидов и кетонов
| Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. |
Структурная формула альдегидов:
| Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами. |
- Структурная формула кетонов:
- 1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
- Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
- При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
- В качестве катализаторов процесса используют кислоты или основания.
- Полуацетали существует только при низкой температуре.
| Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. |
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении альдегиды превращаются в карбоновые кислоты. Альдегид → карбоновая кислота |
| Метаналь окисляется сначала в муравьиную кислоту, затем в углекислый газ:Формальдегид→ муравьиная кислота→ углекислый газ |
| Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны |
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
Видеоопыт окисления муравьиного альдегида гидроксидом меди (II) можно посмотреть здесь.
| Например, муравьиный альдегид окисляется гидроксидом меди (II) |
- HCHO + Cu(OH)2 = Cu + HCOOH + H2O
- Чаще в этой реакции образуется оксид меди (I):
- HCHO + 2Cu(OH)2 = Cu2O + HCOOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра
- Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
- Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
| Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония |
| Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония |
- Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
- Упрощенный вариант реакции:
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
| Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота |
- Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
- Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2nО + 3n/2O2 → nCO2 + nH2O + Q
| Например, уравнение сгорания метаналя: |
CH2O + O2 = CO2 + H2O
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
| Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя |
Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
- Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:
- Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:
- Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
Источник: https://chemege.ru/ximicheskie-svojstva-aldegidy-ketony/




