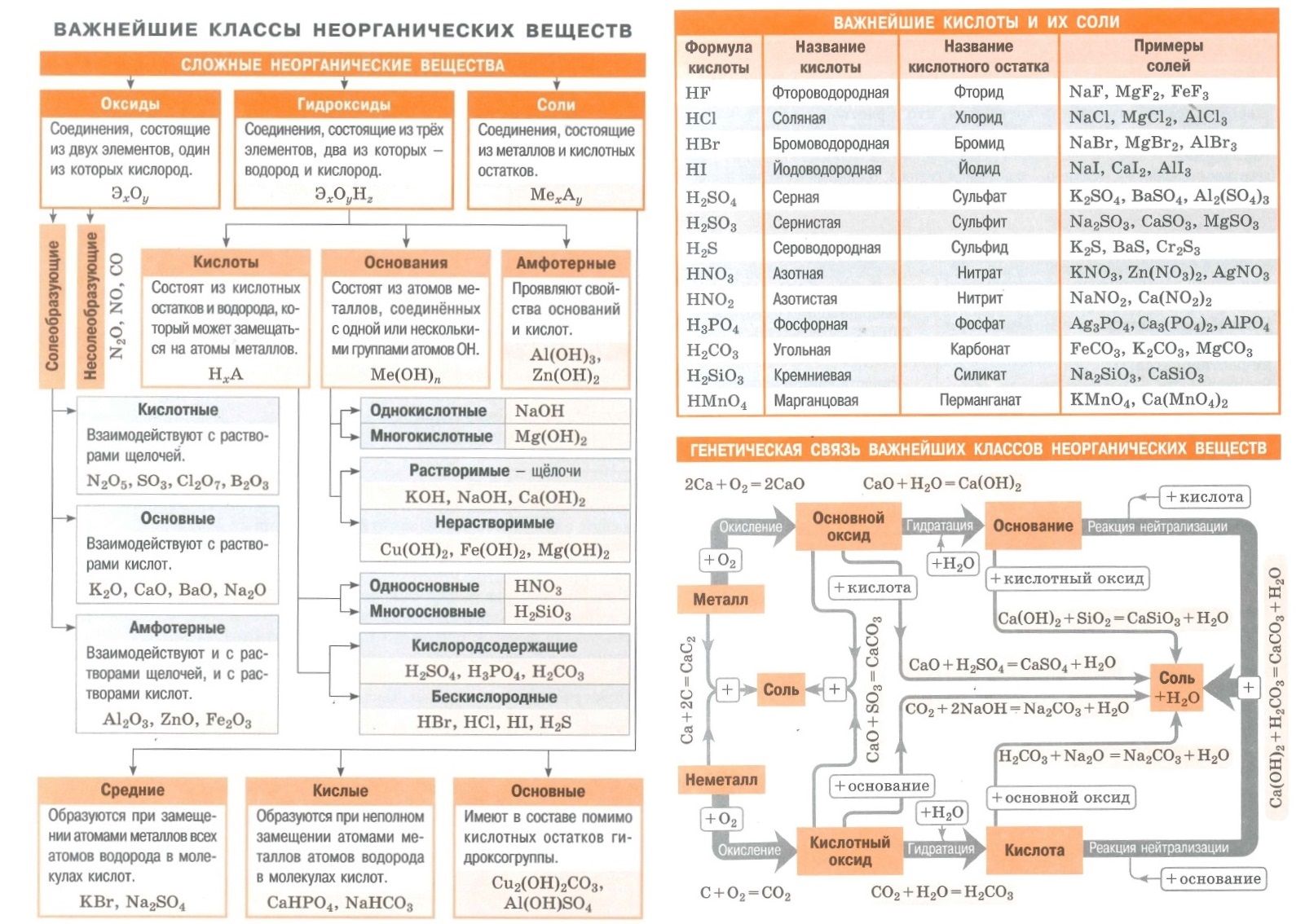
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
![]() Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты.
Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам: Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:
Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства: Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
- Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):
 Основные оксиды реагируют с кислотными оксидами с образованием солей:
Основные оксиды реагируют с кислотными оксидами с образованием солей: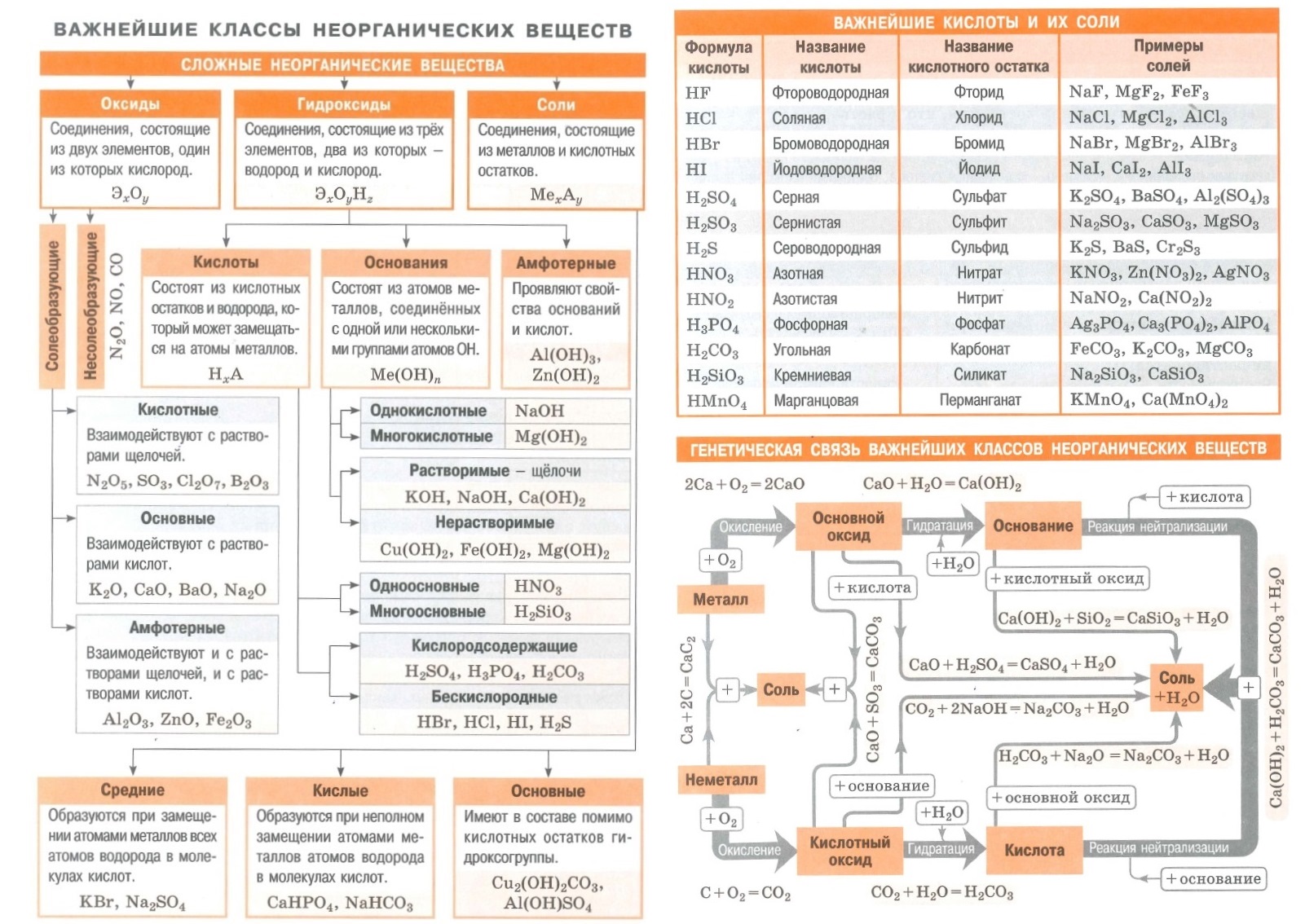 Аналогично реагируют и с кислотами, но с выделением воды:
Аналогично реагируют и с кислотами, но с выделением воды: Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
- Кислотные оксиды в реакции с водой образуют кислоты:
 Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями. - Кислотные оксиды взаимодействуют с основными оксидами, образую соли:
 Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:
Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями: Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды: - Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: При обжиге или горении различных бинарных соединений:Термическое разложение солей, кислот и оснований :Взаимодействие некоторых металлов с водой:
Применение оксидов
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Источник: https://in-chemistry.ru/oksidy-klassifikatsiya-svojstva-poluchenie-primenenie
Урок 32. Химические свойства оксидов – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 32 «Химические свойства оксидов» из курса «Химия для чайников» узнаем о всех химических свойствах кислотных и основных оксидов, рассмотрим с чем они реагируют и что при этом образуется.
Так как химический состав кислотных и основных оксидов различен, они отличаются своими химическими свойствами.
1. Химические свойства кислотных оксидов
а) Взаимодействие с водой Вы уже знаете, что продукты взаимодействия оксидов с водой называются «гидроксиды»:

Поскольку оксиды, вступающие в эту реакцию, делятся на кислотные и основные, то и образующиеся из них гидроксиды также делятся на кислотные и основные. Таким образом, кислотные оксиды (кроме SiO2) реагируют с водой, образуя кислотные гидроксиды, которые являются кислородсодержащими кислотами:
Каждому кислотному оксиду соответствует кислородсодержащая кислота, относящаяся к кислотным гидроксидам. Несмотря на то что оксид кремния SiO2 с водой не реагирует, ему тоже соответствует кислота H2SiO3, но ее получают другими способами.
б) Взаимодействие с щелочами Все кислотные оксиды реагируют со щелочами по общей схеме:

В образующейся соли валентность атомов металла такая же, как и в исходной щелочи. Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду.
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:

Если же в реакцию вступает кислотный оксид N2О5, которому соответствует кислота HNO3 (указана в квадратных скобках), то в составе образующейся соли будет остаток этой кислоты — NO3 с валентностью, равной I:

- Поскольку все кислотные оксиды реагируют со щелочами с образованием солей и воды, этим оксидам можно дать другое определение.
- Кислотными называются оксиды, реагирующие со щелочами с образованием солей и воды.
- в) Реакции с основными оксидами
- Кислотные оксиды реагируют с основными оксидами с образованием солей в соответствии с общей схемой:

В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию.
Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2SO4 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — SO4, валентность которого равна II:

Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4, то в составе образующейся соли будет остаток этой кислоты — РO4 с валентностью, равной III.
2. Химические свойства основных оксидов
а) Взаимодействие с водой
Вы уже знаете, что в результате взаимодействия основных оксидов с водой образуются основные гидроксиды, которые иначе называются основаниями:

К таким основным оксидам относятся оксиды: Li2O, Na2O, K2O, CaO, BaO.
При написании уравнений соответствующих реакций следует помнить, что валентность атомов металла в образующемся основании равна его валентности в исходном оксиде.
Основные оксиды, образованные такими металлами, как Cu, Fe, Cr, с водой не реагируют. Соответствующие им основания получают другими способами.
б) Взаимодействие с кислотами
Практически все основные оксиды реагируют с кислотами с образованием солей по общей схеме:
- Следует помнить, что в образующейся соли валентность атомов металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
- Поскольку все основные оксиды реагируют с кислотами с образованием солей и воды, этим оксидам можно дать другое определение.
- Основными называются оксиды, реагирующие с кислотами с образованием солей и воды.
- в) Взаимодействие с кислотными оксидами
- Основные оксиды реагируют с кислотными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию.
Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3, то в состав соли будет входить остаток этой кислоты — NO3, валентность которого, как вы уже знаете, равна I.
Поскольку рассмотренные нами кислотные и основные оксиды в результате различных реакций образуют соли, их называют солеобразующими. Существует, однако, небольшая группа оксидов, которые в аналогичных реакциях не образуют солей, поэтому их называют несолеобразующими.
Краткие выводы урока:
- Все кислотные оксиды реагируют со щелочами с образованием солей и воды.
- Все основные оксиды реагируют с кислотами с образованием солей и воды.
- Кислотные и основные оксиды являются солеобразующими. Несолеобразующие оксиды — CO, N2О, NO.
- Основания и кислородсодержащие кислоты являются гидроксидами.
Надеюсь урок 32 «Химические свойства оксидов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-32-himicheskie-svojstva-oksidov.html
Свойства оксидов
Свойства оксидов
Оксиды — это сложные химические вещества, представляющие собой химические соединения простых элементов с кислородом. Они бывают солеобразующими и не образующие соли. При этом солеобразующие бывают 3-х типов: основными (от слова «основание»), кислотными и амфотерными.
Примером окислов, не образующих соли, могут быть: NO (окись азота) — представляет собой бесцветный газ, без запаха. Он образуется во время грозы в атмосфере. CO (окись углерода) — газ без запаха, образуется при сгорании угля. Его обычно называют угарным газом. Существуют и другие окислы, не образующие соли.
Теперь разберём подробнее каждый вид солеобразующих окислов.
Основные оксиды
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами. Например, к основным относятся следующие: K2O (окись калия), CaO (окись кальция), FeO (окись железа 2-валентного).
- Рассмотрим химические свойства оксидов на примерах
- 1. Взаимодействие с водой: — взаимодействие с водой с образованием основания (или щёлочи)
- CaO+H2O→ Ca(OH)2 (известная реакция гашения извести, при этом выделяется большое количества тепла!)
- CaO+H2SO4→ CaSO4+ H2O (Кристаллы этого вещества CaSO4 известны всем под названием «гипс»).
- CaO+CO2→ CaCO3 (Это вещество известно всем — обычный мел!)
2. Взаимодействие с кислотами: — взаимодействие с кислотой с образованием соли и воды (раствор соли в воде) 3. Взаимодействие с кислотными оксидами: образование соли
- Кислотные оксиды
- Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
- Примерами кислотных окислов могут быть:
- CO2 (всем известный углекислый газ), P2O5 — оксид фосфора (образуется при сгорании на воздухе белого фосфора), SO3 — триокись серы — это вещество используют для получения серной кислоты.
- — химическая реакция с водой
CO2+H2O→ H2CO3 — это вещество — угольная кислота — одна из слабых кислот, её добавляют в газированную воду для «пузырьков» газа. С повышением температуры растворимость газа в воде уменьшается, а его излишек выходит в виде пузырьков.
— реакция с щелочами (основаниями):
CO2+2NaOH→ Na2CO3+H2O- образовавшееся вещество (соль) широко используется в хозяйстве. Её название — кальцинированная сода или стиральная сода, — отличное моющее средство для подгоревших кастрюль, жира, пригара. Голыми руками работать не рекомендую!
— реакция с основными оксидами:
CO2+MgO→ MgCO3 — получившая соль — карбонат магния — ещё называется «горькая соль».
Амфотерные оксиды
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами). Наиболее частое применение слово «амфотерный» в нашем случае относится к оксидам металлов.
- Примером амфотерных оксидов могут быть:
- ZnO — окись цинка (белый порошок, часто применяемый в медицине для изготовления масок и кремов), Al2O3 — окись алюминия (называют еще «глинозёмом»).
- Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например:
- — реакция с кислотным оксидом:
- ZnO+H2CO3→ ZnCO3 + H2O — Образовавшееся вещество — раствор соли «карбоната цинка» в воде.
- — реакция с основаниями:
- ZnO+2NaOH→ Na2ZnO2+H2O — полученное вещество — двойная соль натрия и цинка.
Получение оксидов
Получение оксидов производят различными способами. Это может происходить физическим и химическим способами. Самым простым способом является химическое взаимодействие простых элементов с кислородом. Например, результатом процесса горения или одним из продуктов этой химической реакции являются оксиды.
Например, если раскалённое железный прутик, да и не только железный (можно взять цинк Zn, олово Sn, свинец Pb, медь Cu, — вообщем то, что имеется под рукой) поместить в колбу с кислородом, то произойдёт химическая реакция окисления железа, которая сопровождается яркой вспышкой и искрами.
Продуктом реакции будет чёрный порошок оксида железа FeO:
- 2Fe+O2→ 2FeO
- Полностью аналогичны химические реакции с другими металлами и неметаллами. Цинк сгорает в кислороде с образованием окисла цинка
- 2Zn+O2→ 2ZnO
- Горение угля сопровождается образованием сразу двух окислов: угарного газа и углекислого газа
- 2C+O2→ 2CO — образование угарного газа.
C+O2→ CO2 — образование углекислого газа. Этот газ образуется если кислорода имеется в более, чем достаточном количестве, то есть в любом случае сначала протекает реакция с образованием угарного газа, а потом угарный газ окисляется, превращаясь в углекислый газ.
Получение оксидов можно осуществить другим способом — путём химической реакции разложения. Например, для получения окисла железа или окисла алюминия необходимо прокалить на огне соответствующие основания этих металлов:
Fe(OH)2→ FeO+H2O
 Твёрдый оксид алюминия — минерал корунд
Твёрдый оксид алюминия — минерал корунд  Оксид железа (III). Поверхность планеты Марс имеет красновато-оранжевый цвет из-за наличия в грунте оксида железа (III).
Оксид железа (III). Поверхность планеты Марс имеет красновато-оранжевый цвет из-за наличия в грунте оксида железа (III).  Твёрдый оксид алюминия — корунд
Твёрдый оксид алюминия — корунд  Растворы оксидов
Растворы оксидов
- 2Al(OH)3→ Al2O3+3H2O, а также при разложении отдельных кислот:
- H2CO3→ H2O+CO2 — разложение угольной кислоты
- H2SO3→ H2O+SO2 — разложение сернистой кислоты
- Получение оксидов можно осуществить из солей металлов при сильном нагревании:
- CaCO3→ CaO+CO2 — прокаливанием мела получают окись кальция (или негашенную известь) и углекислый газ.
- 2Cu(NO3)2→ 2CuO + 4NO2 + O2 — в этой реакции разложения получается сразу два окисла: меди CuO (чёрного цвета) и азота NO2 (его ещё называют бурым газом из-за его действительно бурого цвета).
- Ещё одним способом, которым можно осуществить получение окислов — это окислительно-восстановительные реакции
- Cu + 4HNO3(конц.)→ Cu(NO3)2 + 2NO2 + 2H2O
- S + 2H2SO4(конц.)→ 3SO2 + 2H2O
Оксиды хлора
 Молекула ClO2
Молекула ClO2  Молекула Cl2O7
Молекула Cl2O7  Закись азота N2O
Закись азота N2O  Азотистый ангидрид N2O3
Азотистый ангидрид N2O3  Азотный ангидрид N2O5
Азотный ангидрид N2O5  Бурый газ NO2
Бурый газ NO2
Известны следующие оксиды хлора: Cl2O, ClO2, Cl2O6, Cl2O7. Все они, за исключением Cl2O7, имеют желтую или оранжевую окраску и не устойчивы, особенно ClO2, Cl2O6. Все оксиды хлора взрывоопасны и являются очень сильными окислителями.
- Реагируя с водой, они образуют соответствующие кислородсодержащие и хлорсодержащие кислоты:
- Так, Cl2O — кислотный оксид хлора хлорноватистой кислоты.
- Cl2O + H2O→ 2HClO — Хлорноватистая кислота
- ClO2 — кислотный оксид хлора хлорноватистой и хлорноватой кислоты, так как при химической реакции с водой образует сразу две этих кислоты:
- ClO2 + H2O→ HClO2 + HClO3
- Cl2O6 — тоже кислотный оксид хлора хлорноватой и хлорной кислот:
- Cl2O6 + H2O→ HClO3 + HClO4
- И, наконец, Cl2O7 — бесцветная жидкость — кислотный оксид хлора хлорной кислоты:
- Cl2O7 + H2O→ 2HClO4
Оксиды азота
Азот — газ, который образует 5 различных соединений с кислородом — 5 оксидов азота. А именно:
— N2O — гемиоксид азота. Другое его название известно в медицине под названием веселящий газ или закись азота — это бесцветный сладковатый и приятный на вкус на газ. — NO — моноксид азота — бесцветный, не имеющий ни запаха ни вкуса газ.
— N2O3 — азотистый ангидрид — бесцветное кристаллическое вещество — NO2 — диоксид азота.
Другое его название — бурый газ — газ действительно имеет буро-коричневый цвет — N2O5 — азотный ангидрид — синяя жидкость, кипящая при температуре 3,5 0C
Из всех этих перечисленных соединений азота наибольший интерес в промышленности представляют NO — моноксид азота и NO2 — диоксид азота. Моноксид азота (NO) и закись азота N2O не реагируют ни с водой, ни с щелочами.
Азотистый ангидрид (N2O3) при реакции с водой образует слабую и неустойчивую азотистую кислоту HNO2, которая на воздухе постепенно переходит в более стойкое химическое вещество азотную кислоту Рассмотрим некоторые химические свойства оксидов азота:
- Реакция с водой:
- 2NO2 + H2O→ HNO3 + HNO2 — образуется сразу 2 кислоты: азотная кислота HNO3 и азотистая кислота.
- 2NO2 + 2NaOH→ NaNO3 + NaNO2 + H2O — образуются две соли: нитрат натрия NaNO3 (или натриевая селитра) и нитрит натрия (соль азотистой кислоты).
- Реакция с солями:
- 2NO2 + Na2CO3→ NaNO3 + NaNO2 + CO2 — образуются образуются две соли: нитрат натрия и нитрит натрия, и выделяется углекислый газ.
- Получают диоксид азота (NO2) из моноксида азота (NO) с помощью химической реакции соединения c кислородом:
- 2NO + O2→ 2NO2
Реакция с щелочью:
Оксиды железа
Железо образует два оксида: FeO — оксид железа (2-валентный) — порошок чёрного цвета, который получают восстановлением оксида железа (3-валентного) угарным газом по следующей химической реакции:
Fe2O3+CO→ 2FeO+CO2
Этот основной оксид, легко вступающий в реакции с кислотами. Он обладает восстановительными свойствами и быстро окисляется в оксид железа (3-валентный).
4FeO +O2→ 2Fe2O3
Оксид железа (3-валентный) — красно-бурый порошок (гематит), обладающий амфотерными свойствами (может взаимодействовать и с кислотами и со щелочами). Но кислотные свойства этого оксида выражены настолько слабо, что наиболее часто он его используют, как основной оксид .
Есть ещё так называемы смешанный оксид железа Fe3O4. Он образуется при горении железа, хорошо проводит электрический ток и обладает магнитными свойствами (его называют магнитным железняком или магнетитом). Если железо сгорает, то в результате реакции горения образуется окалина, состоящая сразу из двух оксидов: оксида железа (III) и (II) валентные.
Оксид серы
Сернистый газ SO2
Оксид серы SO2 — или сернистый газ относится к кислотным оксидам, но кислоту не образует, хотя отлично растворяется в воде — 40л оксида серы в 1 л воды (для удобства составления химических уравнений такой раствор называют сернистой кислотой).
При нормальных обстоятельствах — это бесцветный газ с резким и удушливым запахом горелой серы. При температуре всего -10 0C его можно перевести в жидкое состояние.
- В присутствии катализатора -оксида ванадия (V2O5) оксид серы присоединяет кислород и превращается в триоксид серы
- 2SO2 +O2→ 2SO3
- Растворённый в воде сернистый газ — оксид серы SO2 — очень медленно окисляется, в результате чего сам раствор превращается в серную кислоту
- Если сернистый газ пропускать через раствор щелочи, например, гидроксида натрия, то образуется сульфит натрия (или гидросульфит — смотря сколько взять щёлочи и сернистого газа)
- NaOH + SO2→ NaHSO3 — сернистый газ взят в избытке
- 2NaOH + SO2→ Na2SO3 + H2O
Если сернистый газ не реагирует с водой, то почему его водный раствор даёт кислую реакцию?! Да, не реагирует, но он сам окисляется в воде, присоединяя к себе кислород. И получается, что в воде накапливаются свободные атомы водорода, которые и дают кислую реакцию (можете проверить каким-нибудь индикатором!)
Источник: https://www.kristallikov.net/page29.html
Оксиды
Оксиды – это соединения, образованные атомами двух элементов, одним из которых является кислород в степени окисления (-2).
К оксидам относятся все соединения элементов с кислородом, например Fe2O3, P4O10, кроме содержащих атомы кислорода, связанные химической связью друг с другом:
- пероксиды (Na2O2);
- надпероксиды (KO2);
- озониды (KO2).

и соединения фтора с кислородом (OF2, O2F2), которые следует назвать не оксидами фтора, а фторидами кислорода, так как степень окисления кислорода в них положительная.

Физические свойства оксидов
Температуры плавления и кипения оксидов меняются в очень широком интервале. При комнатной температуре они, в зависимости от типа кристаллической решетки, могут находиться в различных агрегатных состояниях. Это определяется природой химической связи в оксидах, которая может быть ионной или ковалентной полярной.
В газообразном и жидком состояниях при комнатной температуре находятся оксиды, образующие молекулярные кристаллические решетки. С увеличением полярности молекул температуры плавления и кипения повышаются (таблица 1).
Таблица 1: Температуры плавления и кипения некоторых оксидов (при давлении 101,3 кПа)
| CO2 | CO | SO2 | ClO2 | SO2 | Cl2O7 | H2O | |
| Tплавления,⁰C | -78 (Tвозгонки) | -205 | -75,46 | -59 | -16,8 | -93,4 | |
| Tкипения, ⁰C | -191,5 | -10,1 | 9,7 | 44,8 | 87 | 100 |
Оксиды, образующие ионные кристаллические решетки, например, CaO, BaO и другие являются твердыми веществами, имеющими очень высокие температуры плавления (>1000⁰C)/
В некоторых оксидах связи ковалентные полярные. Они образуют кристаллические решетки, где атомы связаны несколькими «мостиковыми» атомами кислорода, образуя бесконечную трехмерную сеть, например, Al2O3, SiO2, TiO2, BeO и эти оксиды тоже имеют очень высокие температуры плавления.
Классификация оксидов по химическим свойствами

- Несолеобразующие оксиды – оксиды, которым не соответствуют ни кислоты, ни основания.
- Солеобразные оксиды – это двойные оксиды, в состав которых входят атомы одного металла в разных степенях окисления.
Металлы, проявляющие в соединениях несколько степеней окисления, образуют двойные, или солеобразные оксиды. Например, Pb3O4, Fe3O4, Mn3O4 (формулы этих оксидов могут быть записаны также в виде 2PO·PbO2, FeO·Fe2O3, MnO·Mn2O3 соответственно).
Например, Fe3O4→FeO·FeO3: представляет собой основной оксид FeO химически связанный с амфотерным оксидом Fe2O3, который в данном случае проявляет свойства кислотного оксида.
И Fe3O4 формально можно рассматривать как соль, образованную основанием Fe(OH)2 и кислотой [HFeO2], которая не существует в природе:
От гидрата оксида свинца (IV), как от кислоты, и Pb(OH2), как основания, могут быть получены два двойных оксида Pb2O3, Pb3O4(сурик), которые можно рассматривать как соли. Первый является свинцовой солью метасвинцовой кислоты (H2PbO3), а второй – ортосвинцовой кислоты (H4PbO4).
Среди оксидов, особенно среди оксидов d–элементов, много соединений переменного состава (бертолиды), содержание кислорода в которых не соответствует стехиометрическому составу, а изменяется в довольно широких пределах, например, состав оксида титана (II) TiO изменяется в пределах TiO0,65 – TiO1,25.
Солеобразующие оксиды – это оксиды, которые образуют соли. Оксиды этого типа делятся на три класса: основные, амфотерные и кислотные.
- Основные оксиды – оксиды, элемент которых при образовании соли или основания становится катионом.
- Кислотные оксиды – это оксиды, элемент которых при образовании соли или кислоты входит в состав аниона.
- Амфотерные оксиды – это оксиды, которые в зависимости от условий реакции могут проявлять как свойства кислотных, так и свойства основных оксидов.
- При образовании солей степени окисления элементов, образующих оксиды, не изменяются, например:

- Если при образовании соли происходит изменение степеней окисления элементов, образующих оксиды, то получившуюся соль следует отнести к соли другой кислоты или другого основания, например:

- Fe2(SO4)3 представляет собой соль, образованную серной кислотой и гидроксидом железа (III)- Fe(OH)3, которому соответствует оксид Fe2O3.

- Образовавшиеся соли являются солями азотистой (H+3NO2) и азотной (H+5NO3) кислот, которым соответствуют оксиды:

Закономерности изменения свойств оксидов
Увеличение степени окисления и уменьшение радиуса его иона (при этом происходит уменьшение эффективного отрицательного заряда на атоме кислорода –δ0) делают оксид более кислотным. Это и объясняет закономерное изменение свойств оксидов от основных к амфотерным и далее к кислотным.
А) В одном периоде при увеличении порядкового номера происходит усиление кислотных свойств оксидов и увеличение силы соответствующих им кислот.
Таблица 2: Зависимость кислотно-основных свойств оксидов от эффективного заряда на атоме кислорода
| Оксид | Na2O | MgO | Al2O3 | SiO2 | P4O1023 | SO3 | Cl2O7 |
| Эффективный заряд δ0 | -0,81 | -0,42 | -0,31 | -0,23 | -0,13 | -0,06 | -0,01 |
| Кислотно- основные свойства оксида | Основный | Основный | Амфотерный | Кислотный |
- Б)В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов:

- В)При повышении степени окисления элемента усиливаются кислотные свойства оксидов и ослабевают основные:
- Таблица 3: Зависимость кислотно-основных свойств от степени окисления металлов
Список литературы: Общая и неорганическая химия, Ю. М. Коренев, В. П. Овчаренко, 2000г Ю. М. Коренев Источник: Общая и неорганическая химия, Ю. М. Коренев, В. П. Овчаренко, 2000г Дата в источнике: 2000 год
Источник: https://mplast.by/encyklopedia/oksidyi/
Оксиды
Оксиды — соединения двух элементов, один из которых кислород в степени окисления -2.
Несолеобразующие (безразличные, индифферентные) оксиды СО, SiO, N20, NO.
Солеобразующие оксиды:
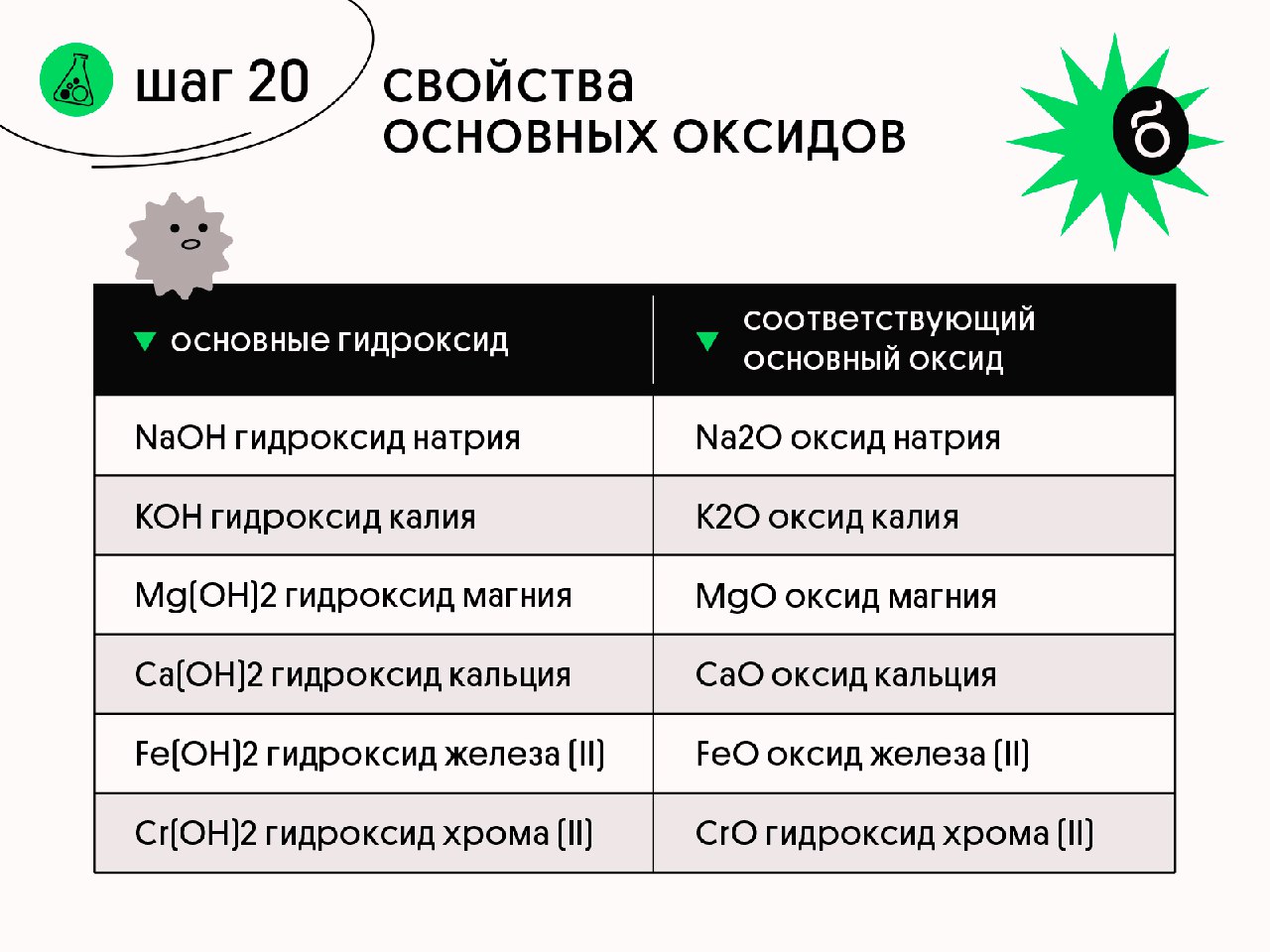
Основные. Оксиды, гидраты которых являются основаниями. Оксиды металлов со степенями окисления +1 и +2 (реже +3). Примеры: Na2O — оксид натрия, СаО — оксид кальция, CuO — оксид меди (II), СоО — оксид кобальта (II), Bi2O3 — оксид висмута (III), Mn2O3 — оксид марганца (III).
Амфотерные. Оксиды, гидраты которых являются амфотерными гидроксидами. Оксиды металлов со степенями окисления +3 и +4 (реже +2). Примеры: Аl2O3 — оксид алюминия, Cr2O3 — оксид хрома (III), SnO2 — оксид олова (IV), МnO2 — оксид марганца (IV), ZnO — оксид цинка, ВеО — оксид бериллия.
Кислотные. Оксиды, гидраты которых являются кислородсодержащими кислотами. Оксиды неметаллов.
Примеры: Р2О3 — оксид фосфора (III), СO2 — оксид углерода (IV), N2O5 — оксид азота (V), SO3 — оксид серы (VI), Cl2O7 — оксид хлора (VII). Оксиды металлов со степенями окисления +5, +6 и +7.
Примеры: Sb2O5 — оксид сурьмы (V). СrОз — оксид хрома (VI), МnОз — оксид марганца (VI), Мn2O7 — оксид марганца (VII).

Изменение характера оксидов при увеличении степени окисления металла
| Изменение характера оксидов при увеличении с. о. металла | Cr+2O (осн.) | Cr+32O 3(амф.) | Cr+6O 3(кисл.) |
| Mn+2O (осн.) | Mn+4O2 (амф.) | Mn+6O3 (кисл.) | |
| Mn+32O3 (осн.) | Mn+72O 7 (кисл.) |
Оксиды бывают твердые, жидкие и газообразные, различного цвета. Например: оксид меди (II) CuO черного цвета, оксид кальция СаО белого цвета — твердые вещества. Оксид серы (VI) SO3 — бесцветная летучая жидкость, а оксид углерода (IV) СО2 — бесцветный газ при обычных условиях.
Агрегатное состояние
Твердые:
CaO, СuО, Li2O и др. основные оксиды; ZnO, Аl2O3, Сr2O3 и др. амфотерные оксиды; SiO2, Р2O5, СrO3 и др. кислотные оксиды.
Жидкие:
SO3, Cl2O7, Мn2O7 и др..
Газообразные:
CO2, SO2, N2O, NO, NO2 и др..
Растворимость в воде
- Растворимые:
- а) основные оксиды щелочных и щелочноземельных металлов;
- б) практически все кислотные оксиды (исключение: SiO2).
- Нерастворимые:
- а) все остальные основные оксиды;
- б) все амфотерные оксиды
- в) SiO2
Химические свойства
1. Кислотно-основные свойства
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия, которые иллюстрируются следующей схемой:

Пример:

(только для оксидов щелочных и щелочно-земельных металлов) (кроме SiO2).

Амфотерные оксиды, обладая свойствами и основных и кислотных оксидов, взаимодействуют с сильными кислотами и щелочами:

2. Окислительно — восстановительные свойства
Если элемент имеет переменную степень окисления (с. о.), то его оксиды с низкими с. о. могут проявлять восстановительные свойства, а оксиды с высокими с. о. — окислительные.
Примеры реакций, в которых оксиды выступают в роли восстановителей:
Окисление оксидов с низкими с. о. до оксидов с высокими с. о. элементов.
- 2C+2O + O2 = 2C+4O2
- 2S+4O2 + O2 = 2S+6O3
- 2N+2O + O2 = 2N+4O2
- Оксид углерода (II) восстанавливает металлы из их оксидов и водород из воды.
- C+2O + FeO = Fe + 2C+4O2
- C+2O + H2O = H2 + 2C+4O2
- Примеры реакций, в которых оксиды выступают в роли окислителей:
Восстановление оксидов с высокими с о. элементов до оксидов с низкими с. о. или до простых веществ.
- C+4O2 + C = 2C+2O
- 2S+6O3 + H2S = 4S+4O2 + H2O
- C+4O2 + Mg = C0 + 2MgO
- Cr+32O3 + 2Al = 2Cr0 + 2Al2O3
- Cu+2O + H2 = Cu0 + H2O
- Использование оксидов малоактивных металлов дпя окисления органических веществ.

Некоторые оксиды, в которых элемент имеет промежуточную с. о., способны к диспропорционированию;
например:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
Способы получения
- 1. Взаимодействие простых веществ — металлов и неметаллов — с кислородом:
- 4Li + O2 = 2Li2O;
- 2Cu + O2 = 2CuO;
- S + O2 = SO2
- 4P + 5O2 = 2P2O5
- 2.
Дегидратация нерастворимых оснований, амфотерных гидроксидов и некоторых кислот:
- Cu(OH)2 = CuO + H2O
- 2Al(OH)3 = Al2O3 + 3H2O
- H2SO3 = SO2↑ + H2O
- H2SiO3 = SiO2 + H2O
- 3. Разложение некоторых солей:
- 2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
- CaCO3 = CaO + CO2↑
- (CuOH)2CO3 = 2CuO + CO2↑ + H2O
- 4.
Окисление сложных веществ кислородом:
- CH4 + 2O2 = CO2 + H2O
- 4FeS2 + 11O2 = 2Fe2O3 + 8SO2
- 4NH3 + 5O2 = 4NO + 6H2O
- 5.
Восстановление кислот-окислителей металлами и неметаллами:
- Cu + H2SO4 (конц) = CuSO4 + SO2↑ + 2H2O
- 10HNO3 (конц) + 4Ca = 4Ca(NO3)2 + N2O↑ + 5H2O
- 2HNO3 (разб) + S = H2SO4 + 2NO↑
6. Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).
Источник: http://examchemistry.com/content/lesson/veshestva/oksidi.html
Оксиды. Химические свойства и способы получения
Оксиды — сложные вещества, состоящие из двух элементов, один из которых — атом кислорода в степени окисления -2.
По способности образовывать соли оксиды делят на солеобразующие и несолеобразующие (СО,SiO,NO,N2О).
Солеобразующие оксиды, в свою очередь, классифицируют на основные, кислотные и амфотерные.
Основными называются оксиды, которым соответствуют основания, кислотными — оксиды, которым отвечают кислоты.
К амфотерным относятся оксиды, проявляющие химические свойства как основных, так и кислотных оксидов.
Основные оксиды образуют только элементы-металлы: щелочные (Li2О, Na2О, К2О, Cs2О, Rb2О), щелочноземельные (CaO, SrO, BaO, RaO) и магний (MgO), а также металлы d-семейства в степени окисления +1, +2, реже +3(Cu2O, CuO, Ag2O, СrO, FeO, MnO, СоO, NiO).
 Кислотные оксиды образуют как элементы-неметаллы (СО2, SO2, NO2,Р2O5, Cl2O7), так и элементы-металлы, степень окисления атома металла должна быть +5 и выше(V2O5, СrO3, Mn2O7, MnO3). Амфотерные оксиды образуют только элементы металлы (ZnO, AI2O3, Fe2O3, BeO, Cr2O3, PbO, SnO, MnO2).
Кислотные оксиды образуют как элементы-неметаллы (СО2, SO2, NO2,Р2O5, Cl2O7), так и элементы-металлы, степень окисления атома металла должна быть +5 и выше(V2O5, СrO3, Mn2O7, MnO3). Амфотерные оксиды образуют только элементы металлы (ZnO, AI2O3, Fe2O3, BeO, Cr2O3, PbO, SnO, MnO2).
В обычных условиях оксиды могут находиться в трех агрегатных состояниях: все основные и амфотерные оксиды твердые вещества, кислотные оксиды могут быть жидкими (SO3,Сl2O7,Mn2O7), газообразными (CO2, SO2, NO2) и твердыми (P2O5, SiO2).
Некоторые имеют запах (NO2, SO2), однако большинство оксидов запаха не имеют.
Одни оксиды окрашены: бурый газ NO2, вишнево-красный CrO3, черные CuO и Ag2O, красные Cu2O и HgO, коричневый Fe2O3, белые SiO2, Аl2O3 и ZnO, другие — бесцветные (H2O, CO2, SO2).
Большинство оксидов устойчивы при нагревании; легко разлагаются при нагревании оксиды ртути и серебра. Основные и амфотерные оксиды имеют немолекулярное строение, для них характерна кристаллическая решетка ионного типа. Большинство кислотных оксидов вещества молекулярного строения (одно из немногих исключений — оксид кремния (IV), имеющий атомную кристаллическую решетку).

Химические свойства оксидов

- Al2O3+6KOH+3H2O=2K3[Al(OH)6] — гексагидроксоалюминат калия;
ZnO+2NaOH+H2O=Na2[Zn(OH)4] — тетрагидроксоцинкат натрия;
Источник: http://himege.ru/oksidy-svojstva/
Химические свойства оксидов для ЕГЭ 2020
1 группа — несолеобразующие — N2O, NO, CO, SiO.
2 группа — солеобразующие:
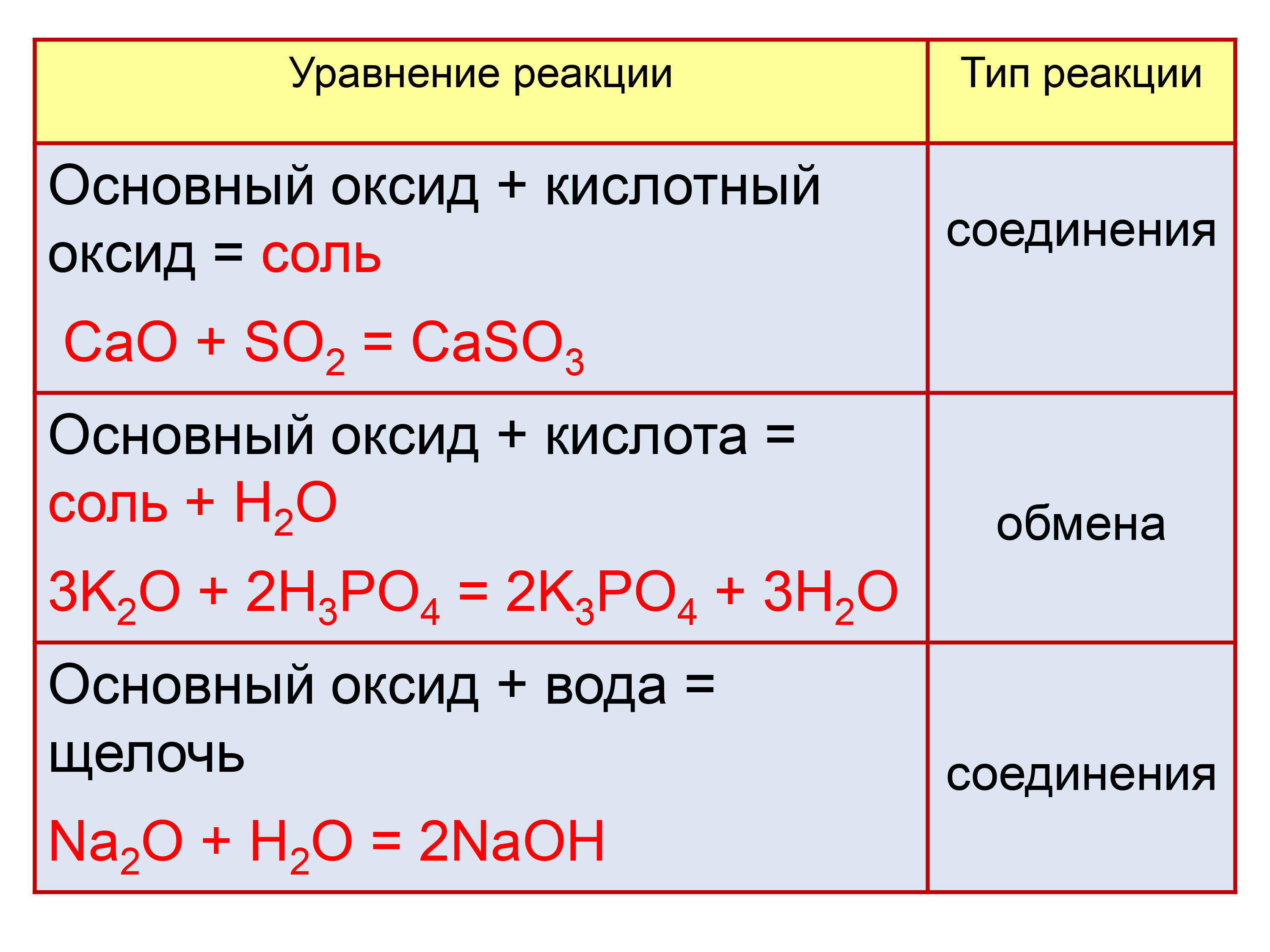
- Основные — это такие оксиды, которым соответствуют основания. Оксиды металлов, степень окисления которых +1, +2 : Na2O, CaO, CuO, FeO, CrO. Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания: 1) щелочные металлы; 2) щелочноземельные металлы; 3) некоторые — CrO, MnO, FeO. Типичные реакции основных оксидов:
- Основный оксид + кислота → соль + вода (реакция обмена).
- Основный оксид + кислотный оксид → соль (реакция соединения)
- Основный оксид + вода → щелочь (реакция соединения).
- Кислотные —— это такие оксиды, которым соответствуют кислоты.Оксиды неметаллов. Оксиды металлов, степень окисления которых > +5: SO2, SO3, P2O5, CrO3, Mn2O7. Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов:
- Кислотный оксид + основание → соль + вода (реакция обмена).
- Кислотный оксид + основный оксид → соль (реакция соединения).
- Кислотный оксид + вода → кислота (реакция соединения)
- Амфотерные — это оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Оксиды металлов, степень окисления которых +2, +3, +4: BeO, ZnO, Al2O3, Cr2O3, MnO2. Взаимодействуют как с кислотами так и с основаниями. Реагируют с основными и кислотными оксидами. Амфотерные оксиды с водой непосредственно не соединяются. Типичные реакции амфотерных оксидов:
- Амфотерный оксид + кислота → соль + вода (реакция обмена).
- Амфотерный оксид + основание → соль + вода или комплексное соединение.
Оксид углерода 2 и 4
Оксид углерода(II) в химическом отношении – инертное вещество. Не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты: CO + NaOH = HCOONa.
- Взаимодействие с кислородом
- При нагревании в кислороде сгорает красивым синим пламенем: 2СО + О2 = 2СО2.
- Взаимодействие с водородом: СО + Н2 = С + Н2О.
Взаимодействие с другими неметаллами. При облучении и в присутствии катализатора взаимодействует с галогенами: СО + Cl2 = COCl2 (фосген). и серой СО + S = COS (карбонилсульфид).
- Восстановительные свойства
- СО – энергичный восстановитель. Восстанавливает многие металлы из их оксидов:
- C+2O + CuO = Сu + C+4O2.
- Взаимодействие с переходными металлами
- С переходными металлами образует карбонилы:
- Ni + 4CO = Ni(CO)4;
- Fe + 5CO = Fe(CO)5.
Оксид углерода (IV) (углекислый газ, диоксид углерода, двуокись углерода,угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом. Химически оксид углерода (IV) инертен.
Окислительные свойства
С сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа: С + СО2 = 2СО.
- Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа: 2Mg + CO2 = 2MgO + C.
- Свойства кислотного оксида
- Типичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
- Na2O + CO2 = Na2CO3,
- 2NaOH + CO2 = Na2CO3 + H2O,
- NaOH + CO2 = NaHCO3.
Качественна реакция — для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат: CaCO3 + H2O + CO2 = Сa(HCO3)2.
Изучай химические свойства
- кислот,
- металлов и неметаллов,
- солей,
- оснований и амфотерных гидроксидов.
Решай с ответами:
- задание 5 по химии
- задание 7 по химии
- задание 10 по химии
Источник: https://bingoschool.ru/blog/21/
Оксиды: их классификация и химические свойства
Билет № 17
1. Оксиды: их классификация и химические свойства (взаимодействие с водой, кислотами и щелочами)
Оксиды — сложные вещества, состоящие из двух элементов, один из которых кислород (в степени окисления −2).
Оксиды делят на кислотные, осно́вные, амфотерные и несолеобразующие (безразличные).
Кислотным оксидам соответствуют кислоты. Кислотными свойствами обладают большинство оксидов неметаллов и оксиды металлов в высшей степени окисления, например CrO3.
- Многие кислотные оксиды реагируют с водой с образованием кислот. Например, оксид серы (IV), или серни́стый газ, реагирует с водой с образованием серни́стой кислоты:
- SO2 + H2O = H2SO3
- Кислотные оксиды реагируют со щелочами с образованием соли и воды. Например, оксид углерода (IV), или углекислый газ, реагирует с гидроксидом натрия с образованием карбоната натрия (соды):
- CO2 + 2NaOH = Na2CO3 + H2O
- Осно́вным оксидам соответствуют основания. К осно́вным относятся оксиды щелочных металлов (главная подгруппа I группы),
магния и щелочноземельных (главная подгруппа II группы, начиная с кальция), оксиды металлов побочных подгрупп в низшей степени окисления (+1 +2).
- Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием оснований. Так, оксид кальция реагирует с водой, получается гидроксид кальция:
- CaO + H2O = Ca(OH)2
- Основные оксиды реагируют с кислотами с образованием соли и воды. Оксид кальция реагирует с соляной кислотой, получается хлорид
кальция: - CaO + 2HCl = CaCl2 + H2O
- Амфотерные оксиды реагируют и с кислотами, и со щелочами. Так, оксид цинка реагирует с соляной кислотой, получается хлорид цинка:
- ZnO + 2HCl = ZnCl2 + H2O
- Оксид цинка взаимодействует и с гидроксидом натрия с образованием цинката натрия:
- ZnO + 2NaOH = Na2ZnO2 + H2O
С водой амфотерные оксиды не взаимодействуют. Поэтому оксидная пленка цинка и алюминия защищает эти металлы от коррозии.
Несолеобразующим (безразличным) оксидам не соответствуют гидроксиды, они не реагируют с водой. Несолеобразующие оксиды не реагируют ни с кислотами, ни со щелочами. К ним относится оксид азота (II) NO.
Иногда к несолеобразующим относят угарный газ, но это неудачный пример, т.к. этот оксид реагирует с гидроксидом натрия с образованием соли:
CO + NaOH = HCOONa(эта реакция не для запоминания! Изучается в 10–11 классах)
2. Задача. Вычисление массы продукта реакции, если известно количество вещества одного из исходных веществ.
Пример:
Сколько г хлорида цинка можно получить, имея 0,5 моль соляной кислоты?
Решение:
- Записываем уравнение реакции.
- Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
0,5 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль - Составляем пропорцию:
0,5 моль — х моль2 моль — 1 моль
- Находим x:
x = 0,5 моль • 1 моль / 2 моль = 0,25 моль - Находим молярную массу хлорида цинка:
M(ZnCl2) = 65 + 35,5 • 2 = 136 (г/моль) - Находим массу соли:
m (ZnCl2) = M • n = 136 г/моль • 0,25 моль = 34 г
Ответ: 34 г.
автор: Владимир Соколов
Источник: https://staminaon.com/ru/chemistry/chemistry_9-17.htm




