ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
Органическая химия — это химия углеводородов и их производных.
Основные положения теории строения органических соединений:
- Все атомы, образующие молекулы органического вещества, связаны в определённой последовательности согласно их валентностям.
- Свойства веществ зависят от строения молекул, т. е. свойства и строение взаимосвязаны между собой.
- Зная свойства вещества, можно установить его строение, и наоборот, химическое строение органического соединения может много сказать о его свойствах.
- Химические свойства атомов и атомных группировок не являются постоянными, а зависят от других атомов (атомных групп), находящихся в молекуле. При этом наиболее сильное влияние атомов наблюдается в случае, если они непосредственно связаны друг с другом.
- Ниже приводятся основные термины, используемые в органической химии.
- Изомерией называют явление существования органических соединений с одинаковым качественным и количественным составом, но с различными свойствами.
- Изомерами называют химические соединения, имеющие одинаковый качественный и количественный состав, но разное химическое строение и разные свойства.
Структурной называют изомерию, вызванную наличием химических соединений с одинаковым составом, но с различным порядком связи структурных элементов. Различают изомерию углеродного скелета, изомерию положения заместителя или кратной связи.
- Геометрическая, или цис-транс-изомерия, — явление существования веществ с различным расположением заместителей относительно двойной связи.
- Геометрическая изомерия возможна как у соединений с двойной связью, так и у алициклических соединений.
- Если одинаковые группы атомов располагаются по разные стороны от плоскости π-связи, то такие соединения называют транс-изомерами, если одинаковые группы атомов располагаются по одну сторону от плоскости -связи, то такие соединения называют цис-изомерами.
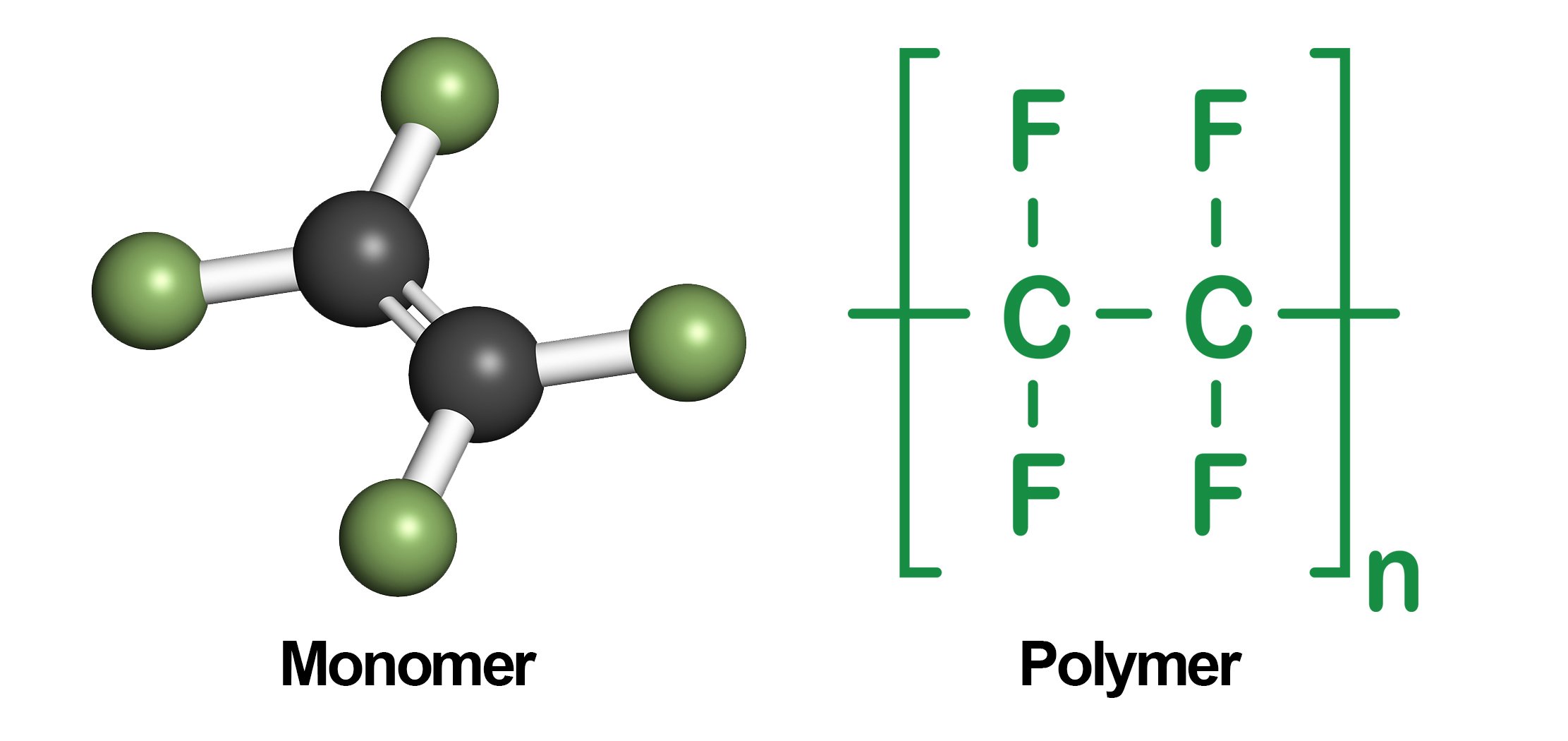
Вещества, обладающие сходным химическим строением и химическими свойствами, но отличающиеся между собой на одну или несколько CH2-групп, называют гомологами. Гомологи образуют гомологичные ряды. Свой гомологичный ряд существует для каждого класса органических соединений.
Химическую связь, максимальная электронная плотность которой находится на линии связывания ядер, называют σ-связью. Химическую связь, максимальная электронная плотность которой находится вне линии связывания ядер, называют π-связью.
В молекулах органических веществ атом углерода всегда находится в одном из трёх гибридных состояний с различными типами гибридизации:
sp3-гибридизация. При этой гибридизации происходит смешение одной 2s- и трёх 2p-орбиталей, в результате чего образуются четыре одинаковые sp3-гибридные орбитали. Валентный угол 109° 28′. Атом углерода, находящийся в состоянии sp3, связан с четырьмя другими атомами простыми (одинарными) связями. Все эти связи являются σ-связями.
sp2-гибридизация. При этой гибридизации происходит смешение одной 2s- и двух 2p-орбиталей, в результате чего образуются три одинаковые sp2-гибридные орбитали. Валентный угол 120°. Атом углерода, находящийся в состоянии sp2, связан с каким-либо другим атомом двойной связью, например: >C=CC=O; >C=N–. Одна из двойных связей является σ-связью, другая — π-связью.
sp-гибридизация. При этой гибридизации происходит смешение одной 2s- и одной 2p-орбитали, в результате чего образуются две одинаковые sp-гибридные орбитали. Валентный угол 180°. Атом углерода, находящийся в состоянии sp, связан с каким-либо другим атомом тройной связью, например: –C≡C–; –C≡N. Одна из тройных связей является σ-связью, две другие — π-связями.
Углеводородами называют органические вещества, состоящие только из углерода и водорода. По составу их классифицируют на насыщенные и ненасыщенные, по строению — на алифатические, циклические и ароматические.
Алканами называют предельные алифатические углеводороды, отвечающие общей формуле CnH2n+2, в молекулах которых атомы углерода связаны между собой простой (одинарной) σ-связью.
Родоначальником класса предельных углеводородов является метан, CH4. Он представляет собой газ без цвета и запаха, очень мало растворим в воде. Его температура кипения равна –162 °С, а температура плавления — –182 °С. Метан широко распространён в природе. Он образуется в результате разложения без доступа воздуха остатков животных и растительных организмов.
Метан — основной компонент природного газа, кроме того, его получают в качестве попутного газа при нефтедобыче.
Метан, как и другие представители предельных углеводородов, достаточно устойчивы химически. Они не взаимодействуют ни со щелочами, ни с кислотами (за исключением азотной), не реагируют с активными металлами.
Для метана прежде всего характерны реакции замещения, которые протекают по радикальному механизму. Этот механизм химической реакции подробнее изучают в курсе органической химии.
Взаимодействие метана с хлором протекает на свету или при температуре 300 °С. Иногда этот процесс может сопровождаться взрывом. При этом происходит последовательное замещение атомов водорода на хлор. В зависимости от соотношения в качестве основного продукта реакции могут образовываться различные хлорпроизводные:


При сгорании метана в кислороде или на воздухе выделяется углекислый газ, вода и значительное количество тепла:
![]()
Именно поэтому его используют в качестве дешёвого топлива.
Термическое разложение метана протекает по различным направления в зависимости от температуры:

При температуре около 800 °С в присутствии никелевого катализатора метан вступает во взаимодействие с водяными парами с образованием так называемого синтез-газа:
![]()
В дальнейшем из синтез-газа получают многочисленные продукты органического синтеза.
Этан — ближайший гомолог метана. Его брутто-формула C2H6, структурная формула H3C–CH3. Он представляет собой газ без цвета и запаха, очень мало растворим в воде. Его температура кипения равна –89 °С, а температура плавления –183 °С. Этан широко распространен в природе. В составе попутного газа встречается до 10—15% этана.
Так же, как и метан, этан вступает в реакции замещения:

На воздухе этан горит слабо светящимся пламенем:
![]()
Реакция дегидрирования, т. е. отщепление водорода, приводит к этилену:
![]()
Этан используют как исходное сырье для получения этилена, каучуков и т. д.
Этилен, брутто-формула C2H4, структурная формула H2C=CH2, представляет собой бесцветный газ, малорастворимый в воде. Его температура кипения равна –103,7 °С, а температура плавления –169,1 °С.
Этилен в промышленности получают из этана или метана. Эти реакции были описаны выше. В лабораторной практике этилен получают с помощью реакции дегидратации (отщепления воды) от этилового спирта.
Одновременно катализатором этого процесса и водоотнимающим средством является концентрированная серная кислота:
- Для этилена характерны реакции присоединения. Он легко обесцвечивает раствор брома в воде или четырёххлористом углероде, присоединяет водород (реакция гидрирования), бромоводород (реакция гидробромирования) и воду (реакция гидратации):
Этилен широко применяют для синтеза различных органических веществ: этилового спирта, стирола, галогенпроизводных, полиэтилена, окиси этилена и т. д.
Ацетилен (этин), брутто-формула C2H2, структурная формула HC=CH, представляет собой бесцветный газ, немного растворимый в воде. Его температура кипения равна –83,8 °С.
- Ацетилен в промышленности получают из метана (реакция описана выше) или этана. В лабораторной практике ацетилен получают с помощью реакции карбида кальция с водой или кислотами:
- Для ацетилена прежде всего характерны реакции присоединения.
- В присутствии катализаторов он легко присоединяет водород, образуя вначале этилен, а потом этан:
- Ацетилен обесцвечивает раствор брома в воде или четырёххлористом углероде. При этом происходит последовательное присоединение брома по кратным связям:
- Присоединение хлороводорода вначале приведет к образованию хлористого винила, а затем 1,1-дихлорэтана:
Ацетилен реагирует с водой с образованием уксусного альдегида (реакция Кучерова). Катализатором в данном процессе выступают соли ртути.
- При сгорании ацетилена в кислороде развивается очень высокая температура, поэтому ацетилен-кислородное пламя используют для сварки и резки металлов:
Ацетилен имеет огромное значение как исходное вещество в органическом синтезе. Из ацетилена получают уксусный альдегид, который далее перерабатывают в уксусную кислоту и её различные эфиры; винилацетилен, перерабатываемый в хлоропрен и хлоропреновые каучуки; хлорвинил и поливинилхлорид; дихлорэтан, глицерин, винилацетат, поливинилацетатный клей.
Тренировочные задания
- 1. Для метана верны следующие утверждения:
- 1) его молекула образована атомом углерода в sp-гибридном состоянии 2) это низкокипящая жидкость, хорошо растворимая в воде 3) это низкокипящий газ, плохо растворимый в воде 4) является основным компонентом природного газа
- 5) легко реагирует с разбавленной серной кислотой
- 2. Для метана верны следующие утверждения:
- 1) его молекула образована атомом углерода в состоянии sp2-гибридизации 2) метан реагирует с парами разбавленной азотной кислоты 3) метан обладает характерным неприятным запахом 4) сгорает на воздухе с образованием угарного газа и воды
- 5) сгорает на воздухе с образованием углекислого газа и воды.
- 3. Для этана верны следующие утверждения:
- 1) это бесцветный газ, немного легче воздуха 2) это бесцветный газ, немного тяжелее воздуха 3) при его взаимодействии с водой образуется этиловый спирт 4) при его дегидрировании образуется этилен
- 5) все атомы углерода в нём — третичные
- 4. Для этана верны следующие утверждения:
- 1) оба атома углерода в его молекуле являются первичными 2) не реагирует с гидроксидом натрия 3) реагирует с серной кислотой 4) реагирует с метаном
- 5) обладает резким неприятным запахом
- 5. Для этилена верны следующие утверждения:
- 1) оба атома углерода в его молекуле находятся в состоянии sp2-гибридизации 2) плотность паров этилена равна плотности паров азота 3) не реагирует с водой 4) не сгорает в кислороде
- 5) не присоединяет хлор
- 6. Для этилена верны следующие утверждения:
- 1) при нормальных условиях это легкокипящая жидкость, хорошо растворимая в воде 2) оба атома углерода в его молекуле находятся в состоянии sp3-гибридизации 3) взаимодействует с водой с образованием уксусной кислоты 4) взаимодействует с бромной водой с образованием 1,2-дибромэтана
- 5) взаимодействует с водой с образованием этилового спирта
- 7. Для ацетилена верны следующие утверждения:
- 1) при нормальных условиях это газ, пары которого легче воздуха 2) при нормальных условиях это газ, пары которого тяжелее воздуха 3) не реагирует с бромом 4) реагирует с водой с образованием этанола
- 5) реагирует с водой с образованием уксусного альдегида
- 8. Для ацетилена верны следующие утверждения:
- 1) атомы углерода в его молекуле находятся в состоянии sp2-гибридизации и соединены двойной связью 2) атомы углерода в его молекуле соединены тройной связью и находятся в состоянии sp-гибридизации 3) при его сгорании в кислороде образуется угарный газ и вода 4) при его сгорании в кислороде образуется углекислый газ и вода
- 5) реагирует с азотом
Ответы
Источник: https://himi4ka.ru/ogje-2018-po-himii/urok-20-uglevodorody-predelnye-i-nepredelnye-metan-jetan-jetilen-acetilen.html
Определение истинной формулы этана по плотности его паров
Задача 1.27.В результате анализа некоторого образца газообразного углеводорода в нем обнаружено 5,92 г углерода и 1,48 г водорода. Плотность паров этого вещества при нормальных условиях составляла 1,34 г/л. Найти молекулярную формулу углеводорода.Дано:масса углерода: m(С) = 5,92 г;масса водорода: m(Н) = 18,33 г;
плотность паров искомого вещества: р(СхНу) = 1,34 г/л.
Найти: молекулярную формулу углеводорода.Решение:Шаг 1. В состав углеводорода входит только углерод и водород. Обозначим формулу как СхНу. Следовательно, требуется определить неизвестные индексы х, у.
Шаг 2. В условии нет указаний на химическую реакцию.
Шаг 3. Вычислим соотношение количеств вещества (n.) углерода и водорода. Используем соотношение: m = n . М.

Шаг 4. Находим простейшую формулу.
N(С):N(Н) = 0,493: 1,48
Выбираем наименьшее значение (в данном случае «0,493») и делим на него оба числа:

Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: С1Н3.
Шаг 5. Выявление истинной формулы.
Вещества с формулой СН3 не существует. В истинной формуле индексы будут в некоторое число раз больше, чем в простейшей.
Для определения, во сколько раз необходимо увеличить индексы в простейшей формуле, сравним истинную молярную массу искомого вещества с молярной массой простейшей формулы.
Молярную массу истинной формулы можно определить, используя данные о плотности вещества из условия, по алгоритму:
р(СхНy) —> m(порции СхНу объемом 22,4л) —>Мистин. (СхНу)
Плотность искомого газообразного вещества составляет 1,34 г/л при н.у. Это значит, что 1 л этого газа имеет массу 1,34 г. Определим массу 22,4 л по пропорции:
1,34 г — масса 1 л газах г — масса 22,4 л газа
![]()
По закону Авогадро 22,4 л — это объем одного моля любого газа при нормальных условиях. Следовательно, 30 г — это масса 1 моль искомого газа, а это и есть его молярная масса:
Mистин.(СхНу) = 30 г/моль.
Определим значение молярной массы для простейшей формулы:
Мпрост. = 1 . 12 + 3 . 1 = 15 г/моль.
Истинная молярная масса больше молярной массы простейшей формулы, следовательно, индексы в простейшей формуле необходимо увеличивать.
Умножаем индексы в простейшей формуле на 2 и получаем: С2Н6 . М(С2Н6) = 30 г/моль.
Ответ: С2Н6.
Источник: http://buzani.ru/zadachi/ege-khimiya/823-kak-opredelit-istinnuyu-formulu-etana-zadacha-1-27
Формула Этана структурная химическая
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: C2H6
| C | Углерод | 12,011 | 2 | 79,9% |
| H | Водород | 1,008 | 6 | 20,1% |
Молекулярная масса: 30,07
Этан (лат. Ethanum), C2H6 — органическое соединение, второй член гомологического ряда алканов. В природе содержится в составе природного газа, нефти и других углеводородах. По сравнению с метаном и пропаном более пожаро- и взрывоопасен. Малотоксичен. Обладает наркотическим действием, которое ослабляется ничтожной растворимостью в воде и крови. Класс опасности — четвёртый.
Свойства
Физические свойства
Этан при н. у. — бесцветный газ, без запаха и вкуса. Молярная масса — 30,07. Температура плавления −182,81 °C, кипения −88,63 °C. Плотность ρгаз.=0,001342 г/см³ или 1,342 кг/м³ (н. у.), ρжидк.=0,561 г/см³ (T=-100 °C). Давление паров при 0 °С — 2,379 МПа. Нерастворим в воде.
Химические свойства
Химическая формула C2H6 (рациональная СН3СН3). Наиболее характерны реакции замещения водорода галогенами, проходящие по свободно радикальному механизму.
Термическое дегидрирование этана при 550—650 °С приводит к этилену, при температурах свыше 800 °С — к ацетилену (образуются также бензол и сажа).
Прямое хлорирование при 300—450 °С — к этилхлориду, нитрование в газовой фазе дает смесь (3:1) нитроэтана и нитрометана.
- Физиологическое действие
- Обладает слабым наркотическим и галлюциногенным действием (ослаблено за счет низкой растворимости в жидкостях организма).
- Получение
- В промышленности
В промышленности получают из нефтяных и природных газов, где он составляет до 10 % по объёму. В России содержание этана в нефтяных газах очень низкое. В США и Канаде (где его содержание в нефтяных и природных газах высоко) служит основным сырьём для получения этилена.
- В лабораторных условиях
- Получают из иодметана по реакции Вюрца, из ацетата натрия электролизом по реакции Кольбе, сплавлением пропионата натрия с щелочью, из этилбромида по реакции Гриньяра, гидрированием этилена (над Pd) или ацетилена (в присутствии никеля Ренея).
- Применение
- Основное использование этана в промышленности — получение этилена.
- Интересные факты
- Предположительно, на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси.
Источник: http://formula-info.ru/khimicheskie-formuly/je/formula-etana-strukturnaya-khimicheskaya
Этан структура, свойства, использование и риски / химия
этан простой углеводород формулы C2H6 с природой бесцветного газа без запаха, который имеет очень ценное и разнообразное применение в синтезе этилена. Кроме того, это один из земных газов, который также был обнаружен на других планетах и звездных телах вокруг Солнечной системы. Он был открыт ученым Майклом Фарадеем в 1834 году.
Среди большого количества органических соединений, образованных атомами углерода и водорода (известных как углеводороды), есть те, которые находятся в газообразном состоянии при температурах и давлениях окружающей среды, которые чрезвычайно используются во многих отраслях промышленности..

Они обычно происходят из газообразной смеси, называемой «природный газ», продукта, представляющего большую ценность для человечества, и составляют метан, этан, пропан и бутан, среди прочих; классифицируется в зависимости от количества атомов углерода в его цепи.
индекс
- 1 Химическая структура
- 2 свойства
- 2.1 Растворимость этана
- 2.2 Кристаллизация этана
- 2.3 Сжигание этана
- 2.4 Этан в атмосфере и в небесных телах
- 3 использования
- 3.1 Производство этилена
- 3.2 Обучение основным химическим веществам
- 3.3 Хладагент
- 4 Риск этана
- 5 ссылок
Химическая структура
- Этан является молекулой с формулой С2H6, обычно рассматривается как объединение двух метильных групп (-CH3) с образованием углеводорода простой углерод-углеродной связи. Это также самое простое органическое соединение после метана, представленное следующим образом:
- H3С-СН3
- Атомы углерода в этой молекуле обладают sp-гибридизацией3, поэтому молекулярные связи имеют свободное вращение.
Также существует внутреннее явление этана, которое основано на одинаковом вращении молекулярной структуры и минимальной энергии, необходимой для вращения связи на 360 градусов, которое ученые назвали «этановым барьером»..
По этой причине этан может встречаться в различных конфигурациях в зависимости от его вращения, даже если существует более стабильная конформация, когда атомы водорода находятся напротив друг друга (как показано на рисунке)..

Синтез этана
- Этан может быть легко синтезирован из электролиза Колбе, органической реакции, в которой происходят две стадии: электрохимическое декарбоксилирование (удаление карбоксильной группы и выделение углекислого газа) двух карбоновых кислот и комбинация продуктов промежуточные соединения с образованием ковалентной связи.
- Точно так же электролиз уксусной кислоты приводит к образованию этана и углекислого газа, и эта реакция используется для синтеза первого.
- Окисление уксусного ангидрида под действием пероксидов, концепция, аналогичная концепции электролиза Колбе, также приводит к образованию этана.
Таким же образом он может быть эффективно отделен от природного газа и метана процессом сжижения с использованием криогенных систем для улавливания этого газа и отделения его от смесей с другими газами..
Для этой роли предпочтителен процесс турбонаддува: газовая смесь пропускается через турбину, создавая ее расширение, пока ее температура не опустится ниже -100ºC..
Уже на этом этапе компоненты смеси могут быть дифференцированы, так что жидкий этан будет отделен от газообразного метана и других видов, связанных с использованием перегонки.
свойства
Этан встречается в природе как газ без цвета и запаха при стандартных давлениях и температурах (1 атм и 25 ° C). Он имеет температуру кипения -88,5 ºC и температуру плавления -182,8 ºC. Кроме того, он не подвержен воздействию сильных кислот или оснований..
Растворимость в этаноле
Молекулы этана имеют симметричную конфигурацию и имеют слабые силы притяжения, которые удерживают их вместе, называемые силами рассеивания.
Когда пытаются растворить этан в воде, силы притяжения, возникающие между газом и жидкостью, очень слабы, поэтому очень трудно соединить этан с молекулами воды..
По этой причине растворимость этана является значительно низкой, слегка увеличиваясь при повышении давления в системе..
Кристаллизация этана
Этан может затвердеть, что приводит к образованию нестабильных кристаллов этана с кубической кристаллической структурой.
При понижении температуры выше -183,2 ° С эта структура становится моноклинной, что повышает стабильность ее молекулы.
Сжигание этана
- Этот углеводород, даже если он широко не используется в качестве топлива, может использоваться в процессах сжигания для производства углекислого газа, воды и тепла, который представлен следующим образом:
- 2С2H6 + 7O2 → 4CO2 + 6H2O + 3120 кДж
- Существует также возможность сжигания этой молекулы без избытка кислорода, который известен как «неполное сгорание» и который приводит к образованию аморфного углерода и оксида углерода в нежелательной реакции, в зависимости от количества применяемого кислорода. :
- 2С2H6 + 3О2 → 4C + 6H2O + Тепло
- 2С2H6 + 4О2 → 2C + 2CO + 6H2O + Тепло
- 2С2H6 + 5О2 → 4CO + 6H2O + Тепло
В этой области сгорание происходит посредством ряда свободнорадикальных реакций, которые пронумерованы сотнями различных реакций. Например, такие соединения, как формальдегид, ацетальдегид, метан, метанол и этанол, могут образовываться в неполных реакциях сгорания..
Это будет зависеть от условий, при которых протекает реакция, и от участия свободнорадикальных реакций. Этилен также может образовываться при высоких температурах (600-900 ºC), что является продуктом, весьма востребованным промышленностью..
Этан в атмосфере и небесных телах
- Этан присутствует в атмосфере планеты Земля в следах, и есть подозрение, что человеку удалось удвоить эту концентрацию с тех пор, как он начал заниматься производственной деятельностью.
- Ученые считают, что большая часть присутствия этана в атмосфере обусловлена сжиганием ископаемого топлива, хотя глобальные выбросы этана сократились почти вдвое с тех пор, как были усовершенствованы технологии добычи сланцевого газа ( источник природного газа).
- Эта разновидность также произведена естественно воздействием солнечных лучей на атмосферный метан, который рекомбинирует и формирует молекулу этана.
Этан существует в жидком состоянии на поверхности Титана, одной из лун Сатурна.
Это происходит в большем количестве в реке Вид Флумина, которая течет более 400 километров к одному из своих морей. Также было обнаружено, что это соединение на кометах и на поверхности Плутона.
приложений
Производство этилена
Использование этана основано главным образом на производстве этилена, наиболее широко используемого органического продукта в мире, посредством процесса, известного как паровой крекинг..
Этот процесс состоит из подачи подачи этана, разбавленного паром, в печь, быстрого нагревания без кислорода.
Реакция происходит при очень высокой температуре (между 850 и 900 ºC), но время пребывания (время, которое этан проводит в печи) должно быть коротким, чтобы реакция была эффективной. При более высоких температурах вырабатывается больше этилена.
Обучение основным химическим веществам
Этан также был изучен в качестве основного компонента в образовании основных химических веществ. Окислительное хлорирование является одним из процессов, предложенных для получения винилхлорида (компонента из ПВХ), заменяя менее дорогие и более сложные.
холодильный
Наконец, этан используется в качестве хладагента в обычных криогенных системах, также показывая способность замораживать небольшие образцы в лаборатории для анализа..
Это очень хороший заменитель воды, который занимает больше времени для охлаждения деликатных образцов, а также может привести к образованию вредных кристаллов льда.
Этан рискует
-Этан обладает способностью воспламеняться, особенно когда он связывается с воздухом. При процентном содержании этана в воздухе от 3,0 до 12,5% может образоваться взрывоопасная смесь.
- -Он может ограничивать содержание кислорода в воздухе, в котором он находится, и по этой причине представляет собой фактор риска удушья для людей и животных, которые присутствуют и подвергаются воздействию.
- -Этан в замороженной жидкой форме может сильно обжечь кожу, если он вступает в непосредственный контакт с ней, а также действовать как криогенная среда для любого объекта, к которому он прикасается, мгновенно замораживая его.
- -Пары жидкого этана тяжелее воздуха и концентрируются на земле, это может представлять опасность воспламенения, которое может вызвать цепную реакцию горения.
-Прием этана может вызвать тошноту, рвоту и внутреннее кровотечение. Вдыхание, помимо удушья, вызывает головные боли, спутанность сознания и перепады настроения. Смерть от остановки сердца возможна при высокой экспозиции.
-Он представляет собой парниковый газ, который вместе с метаном и углекислым газом способствует глобальному потеплению и изменению климата, вызванному загрязнением человека. К счастью, он менее распространен и долговечен, чем метан, и поглощает меньше радиации, чем этот..
ссылки
- Britannica, E. (s.f.). Этан. Получено с сайта britannica.com
- Нес, Г. В. (с.ф.). Монокристаллические структуры и распределения электронной плотности этана, этилена и ацетилена. Восстановлено с rug.nl
Источник: https://ru.thpanorama.com/articles/qumica/etano-estructura-propiedades-usos-y-riesgos.html
Физические свойства этана C2H6: плотность, вязкость, теплопроводность
Рассмотрены тепловые и физические свойства этана C2H6 в газообразном и сжиженном состояниях. Свойства этана представлены в виде таблиц при различных температурах.
Этан представляет собой органический газ, относящийся к газам метанового ряда, он входит в состав природного и нефтяного газов, содержится в нефти. В основном применяется в качестве сырья для синтеза этилена, каучука, бензина, а также спиртов и многих других органических веществ.
По своим физическим свойствам этан представляет собой газ с температурой кипения минус 88°С, без цвета и запаха, имеет молекулярную массу 30,07 и газовую постоянную 276,5 Дж/(кг·К).
Основные тепловые и некоторые физические свойства этана представлены в следующей таблице:
| Молекулярная масса μ | — | 30,0694 |
| Плотность газа при с. у. | кг/м3 | 1,342 |
| Плотность жидкости при -180°С | кг/м3 | 648,8 |
| Газовая постоянная R | Дж/(кг·К) | 276,507 |
| Температура в тройной точке Tтр | °С | -182,802 |
| Давление в тройной точке Ртр | МПа | 1,13·10-6 |
| Температура кипения при 101325 Па | °С | -88,58 |
| Критическая температура Ткр | °С | 32,18 |
| Критическое давление, Ркр | МПа | 4,8714 |
| Критический объем vкр | м3/кг | 4891·10-6 |
| Теплота сублимации при 0°С | кДж/кг | 968,43 |
| Коэффициент теплопроводности при с. у. | Вт/(м·К) | 0,018 |
Плотность этана
Плотность этана почти в два раза выше, чем плотность метана и при стандартных условиях (0°С и 105 Па) составляет 1,342 кг/м3. Наибольшую плотность газообразный этан имеет вблизи температуры кипения — она может достигать более двух килограмм на кубометр. Этан немногим тяжелее воздуха: плотность воздуха при стандартных условиях имеет значение 1,293 кг/м3.
Плотность этана, как и других газов, становится меньше при нагревании. Например, при температуре 300°С и нормальном атмосферном давлении она составляет всего 0,63 кг/м3.
В таблице представлены значения плотности этана газообразного при различных температурах в интервале от -88 до 427°С и нормальном атмосферном давлении (101325 Па).
| 185 | -88 | 2,03 | 440 | 167 | 0,82 |
| 190 | -83 | 1,97 | 450 | 177 | 0,81 |
| 200 | -73 | 1,86 | 460 | 187 | 0,79 |
| 210 | -63 | 1,76 | 470 | 197 | 0,77 |
| 220 | -53 | 1,68 | 480 | 207 | 0,75 |
| 230 | -43 | 1,6 | 490 | 217 | 0,74 |
| 240 | -33 | 1,53 | 500 | 227 | 0,72 |
| 250 | -23 | 1,47 | 510 | 237 | 0,71 |
| 260 | -13 | 1,41 | 520 | 247 | 0,7 |
| 270 | -3 | 1,35 | 530 | 257 | 0,68 |
| 273 | 1,34 | 540 | 267 | 0,67 | |
| 280 | 7 | 1,3 | 550 | 277 | 0,66 |
| 290 | 17 | 1,26 | 560 | 287 | 0,65 |
| 300 | 27 | 1,21 | 570 | 297 | 0,63 |
| 310 | 37 | 1,17 | 580 | 307 | 0,62 |
| 320 | 47 | 1,14 | 590 | 317 | 0,61 |
| 330 | 57 | 1,1 | 600 | 327 | 0,6 |
| 340 | 67 | 1,07 | 610 | 337 | 0,59 |
| 350 | 77 | 1,04 | 620 | 347 | 0,58 |
| 360 | 87 | 1,01 | 630 | 357 | 0,57 |
| 370 | 97 | 0,98 | 640 | 367 | 0,57 |
| 380 | 107 | 0,96 | 650 | 377 | 0,56 |
| 390 | 117 | 0,93 | 660 | 387 | 0,55 |
| 400 | 127 | 0,91 | 670 | 397 | 0,54 |
| 410 | 137 | 0,88 | 680 | 407 | 0,53 |
| 420 | 147 | 0,86 | 690 | 417 | 0,52 |
| 430 | 157 | 0,84 | 700 | 427 | 0,52 |
Плотность сжиженного этана в температурном диапазоне -182…-93°С составляет от 549,7 до 652,4 кг/м3. Этан может находиться в жидком состоянии при температурах ниже минус 88°С. В этих условиях плотность этана может иметь значение до 652 кг/м3 (при температуре до -182°С). При нагревании плотность сжиженного этана, так же как и газообразного, — снижается.
| 91 | -182 | 652,4 | 135 | -138 | 602,8 |
| 92 | -181 | 650,4 | 140 | -133 | 597 |
| 95 | -178 | 645,7 | 145 | -128 | 591,4 |
| 100 | -173 | 640 | 150 | -123 | 585,6 |
| 105 | -168 | 635 | 155 | -118 | 579,8 |
| 110 | -163 | 630 | 160 | -113 | 573,9 |
| 115 | -158 | 624,8 | 165 | -108 | 568 |
| 120 | -153 | 619,5 | 170 | -103 | 562 |
| 125 | -148 | 614 | 175 | -98 | 555,9 |
| 130 | -143 | 608,5 | 180 | -93 | 549,7 |
Вязкость этана
В таблице приведены значения коэффициента динамической вязкости этана в газообразном и жидком состояниях в интервале температуры от -172 до 600 градусов Цельсия.
При стандартных условиях вязкость газа этана составляет 85,5·10-7 Па·с и при нагревании увеличивается. Однако сжиженный этан, как и многие другие жидкости, при росте температуры становится менее вязким.
Этан в жидком виде намного более вязкий, чем в газообразном состоянии. При температуре, например -100°С коэффициент динамической вязкости сжиженного C2H6 почти в 30 раза больше, чем газообразного.
| -100 | 55,2 | 100 | 115 |
| -75 | 62,3 | 150 | 128 |
| -50 | 70,3 | 200 | 141 |
| -25 | 78 | 250 | 152,5 |
| 85,5 | 300 | 164 | |
| 25 | 92,9 | 400 | 190 |
| 50 | 102 | 500 | 214 |
| 75 | 107 | 600 | 238 |
| -172 | 8780 | -101 | 1750 |
| -169 | 7870 | -87 | 1370 |
| -167 | 7290 | -72 | 1140 |
| -165 | 6750 | -58 | 970 |
| -162 | 6240 | -43 | 900 |
| -123 | 2710 | -30 | 820 |
| -113 | 2360 | -3 | 670 |
| -106 | 2070 | 15 | 550 |
Теплопроводность этана
Значения коэффициентов теплопроводности газообразного этана представлены в таблице в диапазоне температуры от -40 до 300°С. Теплопроводность этана при стандартных условиях ниже значения коэффициента теплопроводности метана и составляет 0,018 Вт/(м·град).
При нагревании коэффициент теплопроводности этана увеличивается и при температуре 300°С становится равным 0,0659 Вт/(м·град). По сравнению с воздухом при низких температурах этан является менее теплопроводным, но при нагревании выше 120°С становится лучшим проводником тепла.
| -40 | 0,0138 | 140 | 0,0378 |
| -20 | 0,0157 | 160 | 0,041 |
| 0,018 | 180 | 0,0443 | |
| 20 | 0,0206 | 200 | 0,0477 |
| 40 | 0,0232 | 220 | 0,0511 |
| 60 | 0,0259 | 240 | 0,0547 |
| 80 | 0,0288 | 260 | 0,0584 |
| 100 | 0,0317 | 280 | 0,0621 |
| 120 | 0,0347 | 300 | 0,0659 |
Источники:
Источник: http://thermalinfo.ru/svojstva-gazov/organicheskie-gazy/fizicheskie-svojstva-etana-plotnost-vyazkost-teploprovodnost
Задание 6
Составьте конспект ответа, характеризующего метан и этан. Оформите свой ответ в виде таблицы.
Ответ
| Молекулярная формула | CH4 | C2H6 |
| Структурная формула | ||
| Образование связей | В молекуле метана и этана атомы углерода находятся в sp3-гибридном состоянии.В молекуле метана имеются четыре C–H связи, а в молекуле этана их 6, каждая из этих связей образуется таким образом, что sp3-орбиталь атома углерода перекрывается с s-орбиталью атома водорода. | |
| В молекуле этана имеется C–C связь, которая образуется таким образом, что sp3-орбиталь одного атома углерода перекрывается с одной sp3-орбиталью другого атома углерода. | ||
| Все связи относятся к σ-связям, так как они образуются в результате перекрывания орбиталей вдоль линии, соединяющих центры ядер. | ||
| Нахождение в природе | В виде залежей природного газа, в составе попутных нефтяных газов, в каменноугольных пластах, внутри ледяных кристаллов в толще вечной мерзлоты. | В составе природного газа. |
| Получение | В лаборатории получают при сплавлении ацетата натрия с гидроксидом натрия:CH3COOH + NaOH ⟶ CH4 + Na2CO3В промышленности получают из природного газа. | В лаборатории из иодметана с металлическим натрием:2CH3I + 2Na ⟶ C2H6 + 2NaIВ промышленности получают из природного газа. |
| Физические свойства | Бесцветный газ, без запаха и вкуса, tкип. = -161,58°C. | Бесцветный газ, без запаха и вкуса, tкип. = -88,6°C. |
| Химические свойства |
|
|
| Применение | В качестве топлива, для получения водорода и синтеза других органических соединений. | Для получения этилена. |
gomolog.ru1https://gomolog.ru/reshebniki/10-klass/rudzitis-i-feldman-2019/9/zadanie-6.html
gomolog.ru11https://gomolog.ru/reshebniki/10-klass/rudzitis-i-feldman-2019/9/zadanie-6.html
Источник: https://gomolog.ru/reshebniki/10-klass/rudzitis-i-feldman-2019/9/zadanie-6.html
ПОИСК
Плотность углеводородных жидкостей. Плотность различных нефтей можно найти в стандартных таблицах. Однако, если нефть содержит значительное количество примесей с высокой упругостью паров (метан, этан, азот), то эти таблицы применять нельзя.
Молекулы веществ, имеющих высокую упругость паров, обладают значительной кинетической энергией, которая влияет па плотность смеси.
Для определения плотности жидких углеводородов с относительной молекулярной массой ниже 33, молярная доля азота, кислорода и изо-парафинов в которых менее 5%, моишо воспользоваться формулой, которая применима в интервале температур —(140+-184,4)° С, [c.
37] Процессы образования положительно заряженных молекулярных и осколочных ионов целесообразно рассмотреть на одном из простейших углеводородов — этане.
Первым этаном взаимодействия молекулы этана с ионизирующими электронами является образование молекулярного иона, характеризующего молекулярный вес и эмпирическую формулу соединения [c.22]
Прочным дигидридом является этан gH , остальные весьма неустойчивы. Углерод способен образовать еще ряд гидридов, в основе которых лежат цепи из углеродных атомов линейного и циклического строения, построенные с помощью либо только одинарных, либо также двойных и тройных связей углеводороды разных классов имеют состав,, выражаемый следующими общими формулами [c.97]
Метод состоит в допущении существования в многоатомной молекуле нескольких (иногда многих) видов гармонических колебаний с различными частотами, причем энергия каждого из них выражается формулой вида (VI.129). Нелинейная молекула из т атомов имеет Зт — 6 видов колебаний.
Для линейной молекулы вследствие уменьшения на единицу числа вращательных степеней свободы число видов колебаний составляет Зт—5. Если в молекуле имеется степень свободы внутреннего вращения (например, метильных групп вокруг линии связи в этане), число колебаний уменьшается до Зт — 7.
В общем случае, когда число видов колебаний составляет Зт — х, сумму по состояниям приближенно записывают следующим образом [c.227]
Этан содержит 80% С и 20% Н. Плотность этана по отношению к водороду Дн, = 15. Вывести формулу этана. [c.17]
Структурные формулы, например, таких соединений, как метан состава СН4 и этан состава СаНе, имеют следующий вид [c.20] Первая показывает, что в метане все четыре валентности углерода затрачены на соединение с четырьмя атомами одновалентного водорода из второй же структурной формулы видно, что каждый из двух углеродных атомов этана на соединение с водородом затрачивает лишь по три валентности, а за счет одной валентности каждого из углеродных атомов осуществляется их связь друг с другом. Таким образом, в этане уже имеется цепь из двух углеродных атомов. [c.20]
Это, по-прежнему, формула этана и пропана, хотя внешне они выглядят иначе. Однако формулу НдС—СНд следует предпочесть, так как она яснее отражает тот факт, что в этане связаны друг с другом два атома углерода. [c.221]
Они, как и электронные формулы, показывают порядок соединения атомов в молекуле, их взаимосвязь друг СН4-с другом. Для упрощения структурные формулы принято изображать в сокращенном виде, отмечая только связи между атомами, образующими цепь. Например, этан СНз— [c.81]
Упр. 28. В состав вещества входят элементы углерод, азот и водород. Массовые доли углерода и азота равны соответственно 53,33 и 31,11%. Относительная плотность этого вещества по этану равна 1,5. Какова молекулярная формула вещества [c.62]
Возвратимся теперь к рассмотрению структурных формул предельных углеводородов.
Прежде всего мы можем отметить, что каждый последующий член гомологического ряда предельных углеводородов можно рассматривать как предыдущий углеводород, один из атомов водорода которого замещен на метильный радикал СНз— (или, как обычно говорят, на метильную группу или просто на метил). Например, этан можно рассматри- [c.27]
Для сложных органических соединений более ясное представление о структуре дают не полностью развернутые, а сокращенные структурные формулы. Например, этан Н3С—СНз, пропан СН3—СН —СИ .-Прим. ред. [c.295]
Парафиновые (метановые) углеводороды имеют общую формулу ,iH2n+2.
Углеводороды i—С4 (метан, этан, пропан, бутан) при нормальных условиях — газы, С5— ie при температуре 20 °С — жидкости, Сп и высшие при обычных условиях находятся в твердом состоянии.
В пластовых флюидах газоконденсатных месторождений количество атомов углерода в нормальных парафинах доходит до = 33 и даже больше, обычно же /г = 22—25. [c.20]
Так, углеводороды этан ( aHg) и пропан (СаНз) содержат >пи соответственно из двух и трех атомов углерода. Строение их. гражают следующие структурные и электронные формулы [c.455]
Таким образом, атомные массы, полученные методом Канниццаро, представляют собой либо истинные атомные массы, либо их целочисленные кратные. Если бы в табл. 6-3 были включены только этан, бензол и этилхлорид, в качестве атомной массы углерода можно было бы принять значение 24.
Если же, наоборот, в таблицу оказались включенными еще дополнительные данные о других соединениях водорода и при этом всего лишь один анализ привел бы для углерода к массе 6 единиц, это минимальное значение следовало бы принять в качестве атомной массы углерода, и тогда формулы приведенных в табл.
6-3 соединений приобрели бы вид С2Н4, С4Н6, С,2Нв, СгНС1з и т.д. Однако сколько бы соединений углерода ни было проанализировано методом Канниццаро, его масса в расчете на массу одной молекулы соединения всегда оказывалась целочисленным кратным 12.
Поэтому в качестве атомной массы углерода и принято значение 12. [c.289]
Все нециклические алканы описываются общей химической формулой С Н2 + 2- По мере повышения молекулярной массы алканов происходит систематическое возрастание их температуры плавления и температуры кипения. Метан, этан, пропан и бутан в нормальных условиях-газы пентан и следующие алканы вплоть до С20Н42-жидкости, а С21Н44 и высшие алканы-воскообразные твердые вещества. [c.282]
С, кДж/(кг К) м-о — динамическая вязкость паров при О °С, Па-с / — бензол 2 — и-октан 3 — к-геп-тан < —гексан 5—н-пентаи б —к-бутаи 7 — пропан в — пропилеи 3 — этилен /О —этан // —ацетилен —по формуле (2.42). [c.64]
Несколько хуже обстоит дело с предельной частью первой фракции. Как указывалось выше, она содержит метан и этан. Кроме того, если анализируемые газы богаты пропаном, то вместе с пропиленом в первую фракцию попадает некоторая часть пропана (пропорционально его упругости и концентрации).
Таким образом, в первой фракции могут содер каться три пре-,дельных углеводорода, раздельное определение которых посредством сжигания уже невозможно. В этом случае применяется следующий метод, основанный на законе Генри-Дальтона и дающий сравнительно точные результаты.
Содержание пропана в первой фракции вычисляется из соотношения между упругостями паров пропилена и пропана при температуре перехода (—65°) и концентрации этих углеводородов во второй фракции по формуле [c.864]
Углеводородные природные газы состоят из простейших представителей парафиновых, или, как их называют, метановых углеводородов. Сюда относятся метан СН4, этан jHe, пропан aHg, бутан и изобутан, имеющие формулу СШ . В природных нефтяных газах присутствуют и пары наиболее летучих жидких углеводородов. Строение простейших парафиновых углеводородов следующее [c.233]
В четвертой главе рассмотрена проблема стерических факторов обычных (молекулярных) и радикальных реакций как часть проблемы реакционной способности частиц. На основе метода переходного состояния получены формулы для вычисления стерических факторов мономолекулярных и бимолекулярных реакций и зависимости их от температуры.
Разработан приближенный метод расчета стерических факторов реакций присоединения и замещения радикалов с непредельными и предельными углеводородами, а также реакций диспропорционированияи рекомбинации радикалов.
Этот метод расчета стерических факторов радикальных реакций основан на квантово-механических соображениях и апрокси-мации сумм состояний радикалов при помощи сумм состояний молекул, близких по своему химическому строению к радикалам.
Приближенный способ расчета применен к вычислению стерических факторов обратимых реакций присоединения радикалов —Н, СНз к непредельным углеводородам (этилен, пропилен, изобутилен, аллен, ацетилен и др.), обратимых реакций замещения этих радикалов с непредельными и предельными углеводородами (метан, этан, пропан, бута- [c.10]
С общекинетической точки зрения большой интерес представляет исследование кинетического изотопного эффекта при высокотемпературном крекинге меченых этапов [1221 (С Нз — С Нз и С Нз — С Нз).
Явление кинетическога изотопического эффекта состоит в изменении скорости превращения химических соединений вследствие изменения их изотопического состава. Изучение этого эффекта дает возможность сделать существенные выводы относцтельно закономерностей элементарных химических реакций и механизма суммарных реакций.
Так, исследование кинетического изотопического эффекта при высокотемпературном крекинге меченых атомов в смеси с обычным этаном позволило по измерениям радиоактивности образующегося в процессе крекинга метана установить, что скорость разрыва связи С — С меньше таковой для связи С — С на 11 +2%, что значительно превышает величину 3 /о, находимую из формул для теории изотопического эффекта (121, 124]. Вероятность раз- [c.60]
Газообразные алканы способны образовывать с водой, особенно под давлением, молекулярные соединения, для которых температура разложения при давлении 0,1 МПа и критическая температура соответственно равны с метаном — 29 и 21,5°С, с этаном — 15,8 и 14,5 °С, с пропаном О и 8,5°С.
Такого типа гидраты часто вымерзают на внутренних стенках газопроводов. Гидраты — соединения включения (клатраты) представляют собой снегоподобные вещества, общей формулы М /гНгО, где значение п изменяется от 5,75 до 17 в зависимости от состава газа и условий образования [16]. [c.
193]
Общая формула Hj j, Алканы относятся к насыщенным углеводородам, потому что они не содержат кратных связей.
По номенклатуре ШРАС названия алканов образуются прибавлением суффикса -ан к греческому числительному, соответствующему количеству атомов углерода в цепи алкана.
Исключения составляют первые четыре представителя этого класса, для которых приняты тривиальные названия СН — метан, С Н — этан, С Н — пропан, С,Н ( — бутан (см. табл. 7). [c.181]
ГОМОЛОГИЧЕСКИЕ РЯДЫ — группы родственных органических соединений с одинаковыми химическими свойствами н суммарными формулами, отличающимися между собой на одну или больше групп СНа.
Например, гомологический ряд насыщенных углеводородов (метана) имеет общую формулу Си Щп+2- метан СН4, этан СгН , пропан СдНв, бутан С4Н10 и др. Для членов определенного Г. р. химические реакции обусловлены наличием общей функциональной группы.
Физико-химические свойства соединений Г. р. закономерно изменяются с увеличением молекулярной массы. [c.79]
Предельные углеводороды — алканы. При зр -гибридизации четыре орбитали углерода совершенно равноценны и расположены под углом 109 28, образуя правильный тетраэдр, в центре которого находится атом углерода.
Такая форма гибридизации атома углерода возникает в предельных углеводородах — алканах (рис. 83).
Гомологический ряд алканов составляют соединения, отвечающие общей формуле С Н2п+2 СН4 — метан, СаНв — этан, СзНа — пропан, С4Н10 — бутан, С,5Н,2 — пентан и т. д. [c.255]
Так называемые насыщенные, или предельные, углеводороды содержат ординарные или сигма-связи между углеродными атомами. Они составляют гомологический ряд общей формулы С На +2. где п — число углеродных атомов, входящих в состав данной молекулы. Например, метан СН, этан СаНв, пропан С,Не, бутан С4Н10, пентан С5Н12, гексан СвН и т. д. [c.465]
Моногалогенпроизводные (галогеналкилы). Строение моногалогенпроизводных предельных углеводородов может быть выражено общей формулой Н—X, где X — какой-нибудь галоген.
Поэтому моногалогенпроизводные часто рассматривают как соединения, в которых галоген связан с алкильным радикалом Н, и называют галогвналкилами.
Исходя из этого отдельные названия моногалогенпроизводных выводят из прилагательного, образованного из названия соответствующего галогена (хлористый, бромистый, иодистый, фтористый), и из названия радикала. Так, метану и этану соответ- [c.91]
По женевской номенклатуре названия альдегидов производят от женевских названий соответствующих по углеродному скелету углеводородов (стр. 48), добавляя к этим названиям окончание -ал-, если требуется, после него ставят цифру, указывающую номер углеродного атома цепи, входящего в состав альдегидной группы.
При выборе в формуле самой длинной углеродной цепи в последнюю должен быть включен и альдегидный углерод. Нумерацию начинают с того конца, к которому ближе простейший боковой радикал.
В соответствии с этим по женевской номенклатуре название муравьиного альдегида — метанал, уксусного — этанал, н-валерианового (I) — пентанал, изовалерианового (И) — 2-метилбутанал-4, а его изомера по положению альдегидной группы (П1) — 2-метилбутанал-1. [c.136]
Напишите структурную формулу вещества состава СзНеОг, если известно, что водный раствор его имеет кислую реакцию, а при взаимодействии с раствором гидроксида натрия образуется соль, сплавление которой с гидроксидом натрия дает этан. [c.80]
Изображенные так называемые развернутые формулы (в них отдельно обозначен каждый атом и каждая связь) вначале кажутся очень наглядными, в действительности же становятся трудно читаемыми уже при небольшом усложнении молекулы.
Поэтому широко применяют сокраш,енные структурные формулы, которые передают порядок химической связи атомов и являются более удоб-кыми и наглядными. Метан, этан и пропан можно сокращенно изобразить так СН4, СН3-СН3, СНз—СН..-СН3. [c.
221]
Алканами, или нециклическими предельными углеводородами, называют соединения углерода с водородом с общей формулой С Н2п+2, в которых все атомы углерода связаны между собой одинарными связями.
Совокупность этих соединений образует гомологический ряд, в котором каждый последующий член отличается от предыдущего на гомологическую разность СН2.
Первые четыре члена гомологического ряда алканов имеют свои исторические названия СН4 — метан, — этан, СзНз — пропан, [c.125]
Примером гомологического ряда может служить ряд предельных углеводородов (алканов). Простейший его представитель — метан СН .
Гомологами метана являются этан СаН,, пропан СаН,, бутан С Н и, пентан СьНг , гексан СвНх , гептан С,Н1в и т. д.
Формула любого последующего гомолога может быть получена прибавлением к формуле предыдущего углеводорода гомологической разности. [c.276]
Гомологические ряды непредельных углеводородов. Соединения гомологического ряда этилена изображаются общей формулой СпНап. Названия гомологов по рациональной номенклатуре производятся от названий соответствующих предельных углеводородов путем замены окончания -ан на -илен. Например этан СаН,— этилен С2Н4, пропан СзН, — пропилен СаН, и т. д. [c.288]
Из приведенных формул метана и этана можно также видеть, что какой бы атом водорода в этих соедине- нйях мы ни замещал на метильную груплу, всегда получаются соответственно этан (из метана) и пропан (из этана). Таким образом, все aтo 5Ы водорода в молекулах метана и этана равноценны. [c.28]
Источник: https://www.chem21.info/info/1178475/




