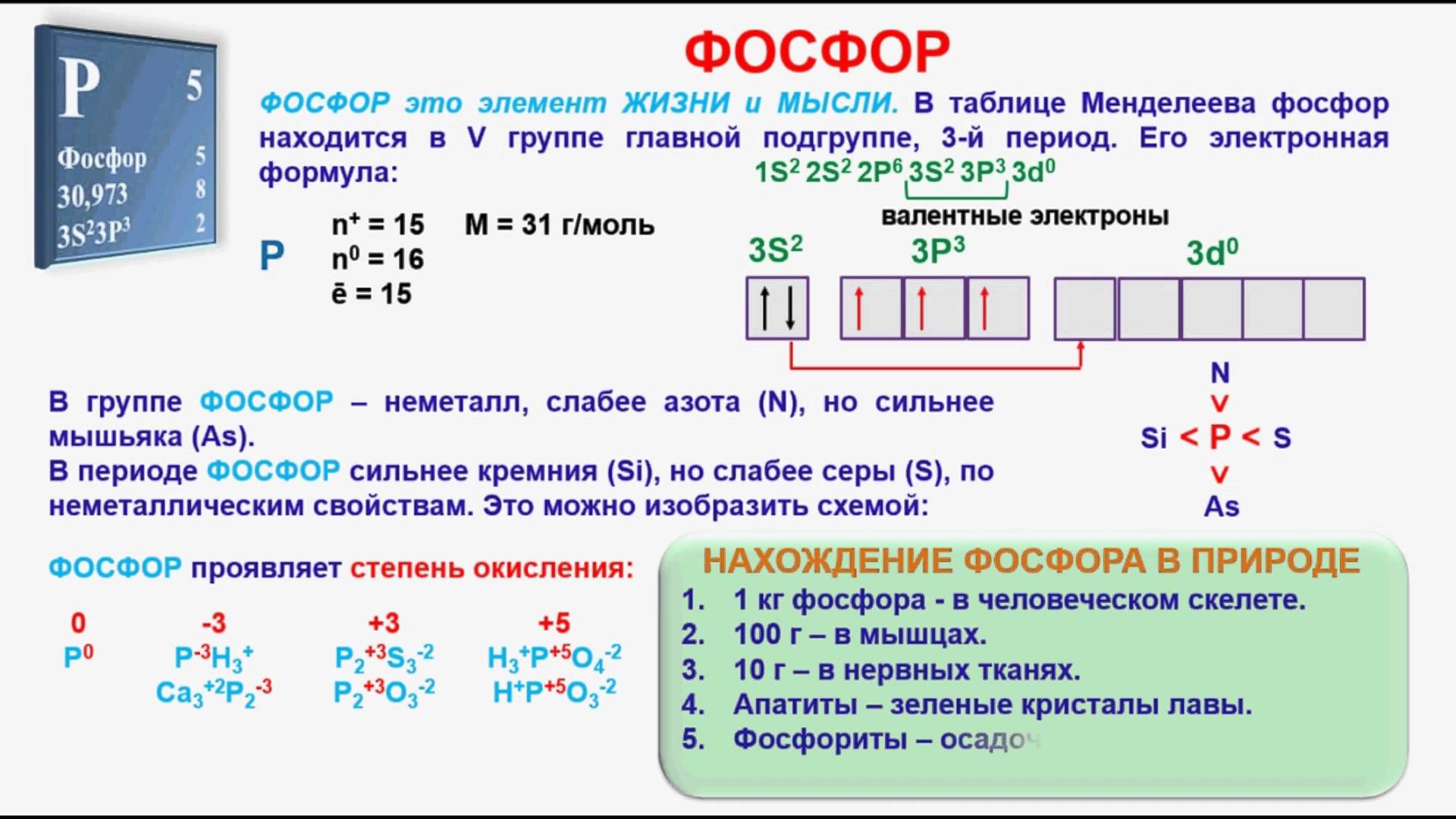
Фосфор — элемент 3-го периода и VA-группы Периодической системы, порядковый номер 15. Электронная формула атома [10Ne]3s23p3, устойчивая степень окисления в соединениях +V.
Электроотрицательность фосфора (2,32) значительно ниже, чем у типичных неметаллов, и немного выше, чем у водорода. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, проявляет неметаллические (кислотные) свойства. Большинство фосфатов нерастворимы в воде.
В природе — тринадцатый по химической распространенности элемент (шестой среди неметаллов), встречается только в химически связанном виде. Жизненно важный элемент.
Недостаток фосфора в почве восполняется введением фосфорных удобрений — главным образом суперфосфатов.
Аллотропные модификации фосфора

 Красный и белый фосфор Р. Известно несколько аллотропных форм фосфора в свободном виде, главные — это белый фосфор Р4 и красный фосфор Pn. В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.).
Красный и белый фосфор Р. Известно несколько аллотропных форм фосфора в свободном виде, главные — это белый фосфор Р4 и красный фосфор Pn. В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.).
Красный фосфор состоит из полимерных молекул Pn разной длины. Аморфный, при комнатной температуре медленно переходит в белый фосфор. При нагревании до 416 °С возгоняется (при охлаждении пара конденсируется белый фосфор). Нерастворим в органических растворителях. Химическая активность ниже, чем у белого фосфора. На воздухе загорается только при нагревании.
Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек. Не ядовит.
Белый фосфор состоит из молекул Р4. Мягкий как воск (режется ножом). Плавится и кипит без разложения (tпл 44,14 °С, tкип 287,3 °С, р 1,82 г/см3). Окисляется на воздухе (зеленое свечение в темноте), при большой массе возможно самовоспламенение.
В особых условиях переводится в красный фосфор. Хорошо растворим в бензоле, эфирах, сероуглероде. Не реагирует с водой, хранится под слоем воды. Чрезвычайно химически активен. Проявляет окислительно-восстановительные свойства.
Восстанавливает благородные металлы из растворов их солей.
Применяется в производстве Н3Р04 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит.
Уравнения важнейших реакций фосфора:
Получение в промышленности фосфора
- — восстановление фосфорита раскаленным коксом (песок добавляют для связывания кальция):
- Ca3(PО4)2 + 5С + 3SiО2 = 3CaSiO3 + 2Р + 5СО (1000 °С)
- Пар фосфора охлаждают и получают твердый белый фосфор.
Красный фосфор готовят из белого фосфора (см. выше), в зависимости от условий степень полимеризации n (Pn) может быть различной.
Соединения фосфора
Фосфин РН3. Бинарное соединение, степень окисления фосфора равна — III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3-гибридизация).
Мало растворим в воде, не реагирует с ней (в отличие от NH3). Сильный восстановитель, сгорает на воздухе, окисляется в HNО3 (конц.). Присоединяет HI. Применяется для синтеза фосфорорганических соединений.
Сильно ядовит.
- Уравнения важнейших реакций фосфина:
- Получение фосфина в лаборатории:
- СазP2 + 6НСl (разб.) = ЗСаСl + 2РНз
Оксид фосфора (V) P2O5. Кислотный оксид. Белый, термически устойчивый. В твердом и газообразном состояниях димер Р4О10 со строением из четырех тетраэдров [O=Р(O)3], связанных по трем вершинам (Р — О-P).
При очень высоких температурах мономеризуется до P2O5. Существует также стеклообразный полимер (Р205)п. Чрезвычайно гигроскопичен, энергично реагирует с водой, щелочами. Восстанавливается белым фосфором.
Отнимает воду у кислородсодержащих кислот.
Применяется как весьма эффективный дегидратирующий агент для осушения твердых веществ, жидкостей и газовых смесей, реагент в производстве фосфатных стекол, катализатор полимеризации алкенов. Ядовит.
- Уравнения важнейших реакций оксида фосфора +5:

- Получение: сжигание фосфора в избытке сухого воздуха.
Ортофосфорная кислота Н3Р04. Оксокислота. Белое вещество, гигроскопичное, конечный продукт взаимодействия P2O5 с водой.
Молекула имеет строение искаженного тетраэдра [Р(O)(OН)3] (sр3-гибридизадия), содержит ковалентные σ-связи Р — ОН и σ, π-связь Р=O. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворяется в воде (548 г/100 г Н20).
Слабая кислота в растворе, нейтрализуется щелочами, не полностью — гидратом аммиака. Реагирует с типичными металлами. Вступает в реакции ионного обмена.
Качественная реакция — выпадение желтого осадка ортофосфата серебра (I). Применяется в производстве минеральных удобрений, для осветления сахарозы, как катализатор в органическом синтезе, компонент антикоррозионных покрытий на чугуне и стали.
- Уравнения важнейших реакций ортофосфорной кислоты:

- Получение фосфорной кислоты в промышленности:
- кипячение фосфоритной руды в серной кислоте:
- Ca3(PO4)2 + 3H2SO4 (конц.) = 2Н3РО4 + 3CaSO4
Ортофосфат натрия Na3PO4. Оксосоль. Белый, гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Реагируется в растворе с цинком и алюминием.
Вступает в реакции ионного обмена.
Качественная реакция на ион РО43-
- — образование желтого осадка ортофосфата серебра(I).
- Применяется для устранения «постоянной» жесткости пресной воды, как компонент моющих средств и фотопроявителей, реагент в синтезе каучука. Уравнения важнейших реакций:

- Получение: полная нейтрализация Н3Р04 гидроксидом натрия или по реакции:

Гидроортофосфат натрия Na2HPO4. Кислая оксосоль. Белый, при умеренном нагревании разлагается без плавления. Хорошо растворим в воде, гидролизуется по аниону. Реагирует с Н3Р04 (конц.), нейтрализуется щелочами. Вступает в реакции ионного обмена.
- Качественная реакция на ион НРО42- — образование желтого осадка ортофосфата серебра (I).
- Применяется как эмульгатор при сгущении коровьего молока, компонент пищевых пастеризаторов и фотоотбеливателей.
- Уравнения важнейших реакций:

- Получение: неполная нейтрализация Н3Р04 гидроксидом натрия в разбавленном растворе:
- 2NaOH + Н3РО4 = Na2HPO4 + 2H2O
Дигидроортофосфат натрия NaH2PO4. Кислая оксосоль. Белый, гигроскопичный. При умеренном нагревании разлагается без плавления. Хорошо растворим в воде, анион Н2Р04 подвергается обратимой диссоциации. Нейтрализуется щелочами. Вступает в реакции ионного обмена.
- Качественная реакция на ион Н2Р04 — образование желтого осадка ортофосфата серебра(1).
- Применяется в производстве стекла, для защиты стали и чугуна от коррозии, как умягчитель воды.
- Уравнения важнейших реакций:

- Получение: неполная нейтрализация H3PО4 едким натром:
Н3РО4 (конц.) + NaOH (разб.) = NaH2PO4 + H2O
Ортофосфат кальция Са3(PO4)2— Оксосоль. Белый, тугоплавкий, термически устойчивый. Нерастворим в воде. Разлагается концентрированными кислотами. Восстанавливается коксом при сплавлении. Основной компонент фосфоритных руд (апатиты и др.).
- Применяется для получения фосфора, в производстве фосфорных удобрений (суперфосфаты), керамики и стекла, осажденный порошок — как компонент зубных паст и стабилизатор полимеров.
- Уравнения важнейших реакций:
Фосфорные удобрения
Смесь Са(Н2Р04)2 и CaS04 называется простым суперфосфатом, Са(Н2Р04)2 с примесью СаНР04 — двойным суперфосфатом, они легко усваиваются растениями при подкормке.
Наиболее ценные удобрения — аммофосы (содержат азот и фосфор), представляют собой смесь аммонийных кислых солей NH4H2PO4 и (NH4)2HPO4.
Хлорид фосфора (V) PCI5. Бинарное соединение. Белый, летучий, термически неустойчивый. Молекула имеет строение тригональной бипирамиды (sp3 d-гибридизация).
В твердом состоянии димер P2Cl10 с ионным строением РСl4+[РСl6]—. «Дымит» во влажном воздухе. Весьма реакционноспособный, полностью гидролизуется водой, реагирует со щелочами. Восстанавливается белым фосфором.
Применяется как хлорагент в органическом синтезе. Ядовит.
- Уравнения важнейших реакций:
- Получение: хлорирование фосфора.
Источник: http://himege.ru/fosfor/
Фосфор
Фосфор (греч. phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество, легко воспламеняющееся и светящееся.

Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.

Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*SiO2 — фосфорит
- 3Ca3(PO4)2*Ca(F,Cl,OH)2 — апатит

- Получение
- В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
- Ca3(PO4)2 + SiO2 + C → (t) CaSiO3 + P + CO
- Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до P2.
- Реакции с неметаллами
- 4P + 3O2 → 2P2O3 (недостаток кислорода)
- 4P+ 5O2 → 2P2O5 (избыток кислорода)
- Схожим образом происходит взаимодействие фосфора и хлора.
- 2P + 3Cl2 → 2PCl3 (недостаток хлора)
- 2P + 5Cl2 → 2PCl5 (избыток хлора)
- P + S → P2S3
- Реакции с металлами
- Реакция с водой
- Реакция с щелочами
- Восстановительные свойства
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое отравляющее вещество. Ca3P2 + H2O → Ca(OH)2 + PH3↑ 
2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество является и окислителем, и восстановителем). P + H2O → (t) PH3 + H3PO4
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования. P + LiOH + H2O → LiH2PO2 + PH3↑ (LiH2PO2 — гипофосфит лития)
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя. KClO3 + P → KCl + P2O5 
Оксид фосфора V — P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
- Получение
- P + O2 → P2O5
- Химические свойства
- Кислотные свойства
- P2O5 + Na2O → Na3PO4
- 6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
- 4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида — соотношение 4:1)
- 2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида — соотношение 2:1)
- Дегидратационные свойства
- Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
- HClO4 + P2O5 → HPO3 + Cl2O7 (HPO3 — метафосфорная кислота)
- HNO3 + P2O5 → HPO3 + N2O5
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту. P2O5 + 3H2O = 2H3PO4 P2O5 + H2O = HPO3 (при недостатке воды) Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль — определяет соотношение основного оксида/основания и кислотного оксида.

Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота — H3PO4 (соли — фосфаты PO43-)
- Метафосфорная кислота — HPO3 (соли — метафосфаты PO3-)
- Фосфористая — H3PO3 (соли — фосфиты PO33-)
- Фосфорноватистая — H3PO2 (соли гипофосфиты — PO23- )
- Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
- CuSO4 + H3PO2 + H2O → Cu + H2SO4 + H3PO4
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора, взаимодействия оксида фосфора V с водой.
- Ca3PO4 + H2SO4 → CaSO4 + H3PO4
- P2O5 + H2O → H3PO4
- PCl5 + H2O → H3PO4 + HCl
- Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
- P + HNO3 + H2O → H3PO4 + NO

Химические свойства
- Кислотные свойства
- 3K2O + H3PO4 = 2K3PO4 + 3H2O
- 3KOH + H3PO4 = K3PO4 + 3H2O
- 2KOH + H3PO4 = K2HPO4 + H2O
- KOH + H3PO4 = KH2PO4 + H2O
- Реакции с солями
- AgNO3 + H3PO4 → Ag3PO4 + HNO3
- В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
- K2CO3 + H3PO4 → K3PO4 + H2O + CO2
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные соли (фосфаты, гидрофосфаты и дигидрофосфаты).
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg + H3PO4 → Mg3(PO4)2 + H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 + H2O
Соли фосфорной кислоты
- Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
- 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
- Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука — Ca3(PO4)2
- Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат — Ca(H2PO4)2*H2O
- Преципитат — CaHPO4*2H2O
- Костная мука — продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4

Источник: https://studarium.ru/article/169
Фосфор (Р) – роль в организме, применение, суточная потребность, источники
Фосфор (Phosphorus, Р) – химический элемент, который играет важную роль макроэлемента в организме человека и берет непосредственное участие в формировании, развитии и поддержании здоровья сердечно-сосудистой системы, головного мозга и опорно-двигательного аппарата.
Основными функциями фосфора также являются – превращение жиров, углеводов, передача нервных импульсов, синергичная работа с кальцием в формировании костного скелета и зубов. Данный элемент входит в состав фосфолипидов, белков, ДНК и АТФ, в связи с чем по праву имеет титул – «элемент жизни».

В чистом виде Р из-за высокой химической активности практически не встречается, тем не менее, он участвует в образовании около 190 минералов, наиболее популярными из которых являются – апатит и фосфорит. По расчётам ученых, масса земной коры на 0,08-0,09% состоит из фосфора.
История – краткая справка
Свое название фосфор получил от двух древнегреческих слов «φῶς» (свет), и «φέρω» (несу), объеденив которые получаем – светоносный.
Впервые о существовании фосфора заявил в 1669 году немецкий алхимик из г. Гамбург – Хеннинг Бранд (Hennig Brandt). Получил же Бранд совершенно случайно – когда пытался добыть золото из человеческой мочи.
Конечно, логика у людей тех времен была уникальна – раз моча золотистая, значит в ней может присутствовать золото.
В результате многодневного отстаивания, а после длительного выпаривания мочи, вместо жидкости в емкости остались белые воскоподобные частички непонятного вещества, которые могли ярко гореть и мерцать в темноте. Нововыявленное вещество Х.Бранд назвал «чудотворным носителем света» (phosphorus mirabilis).
Далее, Р смогли добыть — немецкий химик Иоганн Кункель (Johannes Kunckel), в 1680 г. англо-ирландский химик и физик Роберт Бойль (англ. Robert Boyle), в 1743 г. немецкий химик Андреас Маргграф (Andreas Marggraf) и другие.
Получить красный фосфор сумел в середине XIX в — А.Шрёттер, что произошло при нагревании белого фосфора без контакта с кислородом.
Общие данные
Расположение в периодической таблице Д.И. Менделеева: в старой версии — III период, III ряд, V группа, в новой версии таблицы – 15 группа, 3 период.
- Атомный номер – 15
- Атомная масса – 30,973762
- Электронная конфигурация – [Ne] 3s2 3p3
- Температура плавления (°С) – 44,15
- Температура кипения (°С) – 279,85
- CAS: 7723-14-0
Физико-химические свойства. Фосфор известен во многих модификациях – белый, красный, желтый, черный, металлический и др., которые еще называются аллотропными. Физические и химические свойства напрямую зависят от его формы, особенно его химическая активность.
Белый фосфор – химически активное вещество белого цвета с легкой желтизной или зеленоватостью, схожее на парафин, легко поддается деформации при небольших физических усилиях.
Плохо растворим в воде, при контакте с кислородом и светом начинает светиться бледно-зеленым цветом. Небольшое воздействие температуры способно привести к самовозгоранию вещества.
Очень ядовит – попадание внутрь всего 0,05-0,15 г вещества может привести к летальному исходу. При контакте с кожей также способен самовоспламеняться, после чего оставляет сильные ожоги.
Красный фосфор – более устойчивая форма элемента к термическому воздействию, которую получают из его белой формы. Окрашен в красные, фиолетовые цвета с металлическим отблеском.
Не растворяется в воде, не светится в темноте, способен самопроизвольно загореться при ударе или трении. Ядовитость в тысячи раз меньше по сравнению с белым.
Применяется при изготовлении спичечных коробков – входит в состав терочной поверхности.
Биологическая роль фосфора в организме
В организме фосфор присутствует в виде ортофосфорной и пирофосфорной кислот. Этот элемент входит в состав фосфолипидов, АТФ (аденозинтрифосфорная кислота), нуклеиновых кислот (ДНК, РНК), фосфопротеидов, нуклеотидов, различных ферментов и коферментов. В костях человека Р находится в форме гидроксилапатита, в зубной эмали – в виде фторапатита.

- В целом, 1% массы тела человека припадает на фосфор в тех или иных формах, из которых около 85% элемента содержится в составе костей из зубов.
- Регулирование метаболизма фосфорных соединений производят витамин D и гормоны.
- Фосфор выполняет множество важных и полезных функций, среди которых:
- Формирование, развитие и крепость костей и зубов, предотвращение развития кариеса и остеопороза;
- Участие в передаче нервных импульсов от нервной системы по всему организму;
- Поддержание функционирования и здоровья нервной системы;
- Участие в поддержании сократительной функции мышечных тканей, и соответственно – в работе сердца;
- Участие в обменных процессах белков, жиров и углеводов;
- Выполняет роль регулирования окислительно-восстановительных реакций в организме;
- Поддерживает кислотно-щелочной баланс (рН);
- Участие в образовании щитовидной железой и надпочечниками ряда гормонов;
- Повышает благотворное влияние на организм кальция, железа, калия и различных витаминов (А, F, D);
- В виде фосфорнокислых солей входит в состав мягких тканей головного мозга, и соответственно участвует в его формировании и развитии;
- Выполняет роль энергетического жизнеобеспечения организма.
- Белый фосфор используется преимущественно в военном деле – зажигательные бомбы и другие виды оружия.
- Красный фосфор уже используется в промышленности – спичечные коробки, производство ламп накаливания (как газопоглотитель), различные виды топлива и зажигательных смесей, смазочные материалы, защитных средств для металла от коррозии, в качестве дополнительного вещества для умягчения воды.
- В агропромышленном секторе фосфорную кислоту используют для производства некоторых удобрений – преципитата, суперфосфата и других.
- Кроме того, Р используют для изготовления некоторых видов зубной пасты, пищевой промышленности.
Суточная потребность
Рекомендуемые суточные дозы фосфора в зависимости от пола и возраста:
| Дети | до 1 года | 100-275 мг |
| От 1 до 3 лет | 460-3000 мг | |
| От 3 до 9 лет | 500-3000 мг | |
| Подростки | от 9 до 18 лет | 1250—4000 мг |
| Взрослые | от 18 до 70 лет | 700-4000 мг |
| Лица преклонного возраста | старше 70 лет | 700-3000 мг |
| Во время беременности | до 3000—3500 мг |
Для максимальной эффективности усваивания организмом фосфора его необходимо одновременно употреблять с кальцием, в соотношении – 1,5 (Р) : 1 (Са).
Суточная доза фосфора повышается при обильных физических нагрузках, занятиях спортом.
Нехватка фосфора — симптомы
Дефицит фосфора в организме (гипофосфатемия) дает о себе знать, когда его количество в сыворотке крови составляет 0,81-0,32 ммоль/л и меньше. Это может вызвать ряд осложнений со здоровьем, среди которых:
- Постоянная усталость, быстрая утомляемость, вялость;
- Повышенная раздражительность, чувство тревоги;
- Нарушение дыхательной функции;
- Скованность в движении, нарушения координации, боль в суставах;
- Головокружения, «туманность» сознания;
- Отсутствие аппетита, колебания веса;
- Повышенная восприимчивость к простудным заболевания и другим ОРЗ;
- Замедление роста ребенка, а также нарушения в формировании костно-мышечного скелета и зубов в детском организме.
- Нарушения усвояемости Р организмом, что обычно связано с – гиповитаминоз D, длительные жесткие диеты и голодания, алкоголизм, мальабсорбция;
- Повышенное выведение Р из организма, причиной чего могут стать – заболевания почек, гиповитаминоз D, гиперфункция паращитовидных желез, увеличенный объем внутриклеточной жидкости, прием некоторых лекарственных препаратов (мочегонных и кортикостероидов).
- Избыток в организме – алюминия (Al), кальция (Са) и магния (Mg), железа (Fe), эстрогенов, андрогенов и тироксина;
- Другие причины – стремительный рост костной ткани у детей в период развития, недостаток Р в пище, наличие хронических болезней почек, щитовидных и паращитовидных желез.
Применение Р с лечебной целью целесообразно в следующих случаях:
- Заболевания костно-мышечной системы – остеопороз, гетерогенные оссификации, опухолевый остеолиз, частые переломы;
- Гипофосфатемия – недостаток фосфора в организме;
- Оксалатный тип почечнокаменной болезни;
- Гиперкальциемия (переизбыток в организме кальция) при онкологических болезнях.
В качестве препаратов фосфора чаще всего применяют биофосфонаты («Этидронат»), «Кальция глицерофосфат».
Избыток фосфора
Избыток фосфора в организме (гиперфосфатемия) также, как и нехватка может вызвать ряд осложнений со здоровьем, среди которых:
Причины переизбытка фосфора
- Переизбыток витамина Д;
- Острый ацидоз – резкое нарушение кислотно-щелочного баланса в организме в сторону повышения кислотности;
- Процессы, сопровождающиеся разрушением мышечных волокон и эритроцитов;
- Заболевания почек, сопровождающиеся снижением скорости фильтрации клубочками;
- Гипофункция щитовидных и паращитовидных желез;
- Прием мочегонных (диуретиков) и слабительных препаратов, частые клизмы.
Источники фосфора
В каких продуктах содержится фосфор больше всего?
- Растительные и животные источники (мг на 100 г): семечки конопли (1650), сухие дрожжи (1290), тыквенные семечки (1233), черные семечки (1158), мак (870), горчица в порошке (828), кунжут (774), семечки дыни (755), какао в порошке (734), сыр «Пармезан» твердый (694), семена льна (642), кешью (593), сыр «Гауда» (546), овёс (523), грецкий орех (513), творог (500), фисташки (490), миндаль (481), карп (415), фасоль (407), арахис (397), горох (329), крупа гречневая (298), тунец (280), яйцо (198), курятина (178), кефир (140), картофель (58), капуста (31).
- Химические источники (Р): «Этидронат», «Кальция глицерофосфат», «Фосален», витаминно-минеральные комплексы «Витрум», пищевые добавки Е338, Е339, Е340, Е341, Е342, Е343.
- Синтез в организме: — .
Взаимодействие фосфора с другими веществами
- Избыточное количество в организме алюминия, кальция, магния, железа, эстрогенов, андрогенов и тироксина понижают усвояемость фосфора, а также его полную активность;
- Прием Р в сочетании с кальцием (пропорция 1,5 Р к 1 Са) взаимодополняют друг друга, тем самым повышая свою активность.
- Повышенное количество витамина D способствует переизбытку фосфора, однако, недостаток D приводит к недостатку Р.
- При воздействии кислорода — Р легко окисляется.
Видео
Обсудить Р и другие минералы на форуме…

Источник: https://medicina.dobro-est.com/fosfor-p-rol-v-organizme-primenenie-sutochnaya-potrebnost-istochniki.html
Фосфор (P, Phosphorus)
Фосфор открыл в 1669 году алхимик из Гамбурга Хенниг Бранд, который проводил опыты с выпариванием человеческой мочи, пытаясь получить философский камень.
Вещество, образовавшееся после многочисленных манипуляций, оказалось похожим на воск, необыкновенно ярко, с мерцанием, горело. Новому веществу было дано название phosphorus mirabilis (от латинского чудотворный носитель огня).
Несколькими годами позже фосфор получил Иоганн Кункель, а также, независимо от двух первых учёных, Р. Бойлем.
Общая характеристика фосфора
Фосфор является элементом XV группы III периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 15 и атомной массой 30,974. Принятое обозначение – Р.

Нахождение в природе
Фосфор содержится в морской воде и земной коре в основном в виде минералов, которых около 190 (самые важные – апатит и фосфорит). Входит в состав всех частей зелёных растений, белков, ДНК.
Физические и химические свойства
фосфор является неметаллом с высокой химической активностью, в свободном виде практически не встречается. Известны четыре модификации фосфора – красный, белый, чёрный и металлический.

Суточная потребность в фосфоре
Для нормального функционирования организм взрослого человека должен получать 1,0-2,0 г фосфора в сутки. Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.
Продукты питания богатые фосфором
Основные поставщики фосфора – рыба и морепродукты, творог, сыр, орехи, бобовые и крупы. Достаточное количество фосфора содержат чеснок и шпинат, морковь, петрушка, тыква и капуста, ягоды, грибы и мясо, говяжья печень и куриные яйца.

Признаки нехватки фосфора
Недостаточное количество фосфора в организме характеризуется усталостью и слабостью, может сопровождаться потерей аппетита и внимания, частыми простудными заболеваниями, тревогой и чувством страха.
Признаки избытка фосфора
Признаками избытка фосфора в организме служат кровотечения и кровоизлияния, развивается анемия, возникает почечнокаменная болезнь.
Полезные свойства фосфора и его влияние на организм
Фосфор обеспечивает нормальные рост костной и зубной тканей организма, поддерживает их в здоровом состоянии, также участвует в синтезе белка, играет важную роль в обмене жиров, белков и углеводов. Без фосфора не могут функционировать мышцы, и не происходит умственная деятельность.

Усвояемость фосфора
При приёме минеральных комплексов стоит помнить о наилучшем балансе фосфора и кальция (3:2), а также о том, что чрезмерное количество магния и железа замедляет процесс усвоения фосфора.
Применение фосфора в жизни
Фосфор широко применяется в промышленности и сельском хозяйстве, прежде всего из-за его горючести. Его используют в производстве топлива, спичек, взрывчатых веществ, фосфорных удобрений и защиты поверхностей металлов от коррозии.
Источник: http://www.calorizator.ru/element/p
Фосфор — урок. Химия, 8–9 класс
Фосфор — химический элемент № (15). Он расположен в VА группе Периодической системы.
P15+15)2e)8e)5e
На внешнем слое атома фосфора содержатся пять валентных электронов, до его завершения не хватает трёх электронов. Поэтому в соединениях с металлами и водородом фосфор проявляет степень окисления (–3), а при взаимодействии с более электроотрицательными элементами: кислородом, фтором и другими — положительные степени окисления ( +3) или (+5).
В атоме фосфора больше электронных слоёв по сравнению с атомом азота, поэтому его электроотрицательность, окислительные и неметаллические свойства выражены слабее.
В земной коре фосфор находится в виде фосфатов. Чаще встречается фосфат кальция Ca3(PO4)2.
Фосфор — жизненно важный элемент. Он входит в состав нуклеиновых кислот и АТФ, которые необходимы каждой клетке любого живого организма. Фосфат кальция содержится в костной ткани и придаёт ей твёрдость.
Химическому элементу фосфору характерна аллотропия. Он образует несколько простых веществ, отличающихся строением.
Белый фосфор состоит из четырёхатомных молекул P4.
Он представляет собой белое (с жёлтым оттенком), похожее на воск вещество, которое светится в темноте из-за окисления кислородом воздуха.

Как все молекулярные соединения, белый фосфор летуч. Он имеет чесночный запах. Не растворяется в воде, но растворяется в сероуглероде. Белый фосфор очень ядовит. В порошкообразном состоянии может самовоспламеняться. Хранят его под водой.
Красный фосфор имеет атомную кристаллическую решётку.
Красный фосфор представляет собой порошок и по своим свойствам резко отличается от белого. Он не имеет запаха, не растворяется в воде и в сероуглероде. Неядовит. Активность красного фосфора ниже, чем белого.

Аллотропные модификации фосфора взаимопревращаемы. Белый фосфор превращается в красный на свету или при длительном нагревании без доступа воздуха. Красный фосфор при сильном нагревании и охлаждении паров превращается в белый.
Химические свойства разных аллотропных модификаций фосфора похожи. Белый фосфор более активен и вступает в реакции легче.
- Окислительные свойства фосфор проявляет в реакциях с активными металлами:
- Полученные соединения называются фосфидами (Na3P — фосфид натрия).
- В отличие от азота фосфор не соединяется с водородом.
Восстановительные свойства фосфор проявляет в реакции с кислородом. Белый фосфор самовоспламеняется на воздухе, а красный загорается при нагревании. При этом образуется густой белый дым оксида фосфора(V):
4P0+5O20=t2P2+5O5−2.

Красный фосфор используется при изготовлении спичек.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/fosfor-i-ego-soedineniia-163104/re-c8a737b1-f108-48c4-886a-b61b2d1ba1cf
Фосфор
Один из наиболее распространённых простых веществ в земной коре – фосфор. В чистом виде не встречается, т.к. имеет высокую активность и быстро вступает в реакции. Входит в состав живых организмов.

Фосфор находится в V группе, в третьем периоде таблицы Менделеева. Располагается под 15 номером. Известно шесть изотопов фосфора, полученных искусственным путём.
Фосфор – элемент р-семейства. Атом фосфора состоит из положительно заряженного ядра +15 и 15 отрицательно заряженных электронов, располагающихся на трёх электронных оболочках.
Пять валентных электронов располагаются на внешнем энергетическом уровне: 2 – на s-орбитали, 3 – на p-орбитали. В обычном состоянии p-орбиталь остаётся незавершённой, и фосфор проявляет III валентность.
В возбуждённом состоянии электроны с s-орбитали переходят на p-орбиталь, и фосфор приобретает высшую валентность – V.
Рис. 1. Строение атома фосфора.
Электронная формула фосфора – 1s22s22p63s23p3.
Фосфор при нормальных условиях постоянно находится в одном агрегатном состоянии. Это твёрдое кристаллическое вещество, нерастворимое в воде. Относительная атомная масса – 31 а.е.м., молярная масса – 30,9738 г/моль.
Фосфору свойственна аллотропия – способность модифицироваться. Модификации отличаются физическими свойствами фосфора. Особенности видов описаны в таблице.
| Тип | tпл., °С | tкип., °С | ρ, г/см3 | Характеристика |
| Белый | 44 | 280 | 1,823 | Из-за примесей может иметь жёлтый цвет. Наиболее мягкая модификация, режущаяся ножом, со специфическим запахом. Молекула состоит из четырёх атомов (Р4), расположенных в виде тетраэдра. Окисляется на воздухе со свечением, воспламеняется при 40°С. Токсичен, имеет небольшие смертельные дозы (0,05-0,15 г) |
| Красный | 593 под давлением 4,36 МПа | – | 2,4 | Получается при нагревании белого фосфора в отсутствии воздуха и под ионизирующим излучением. Представляет собой полимер (Pn), состоящий из нескольких молекул Р4. Не ядовитый, не светится. Воспламеняется при 210°С. Не плавится в обычных условиях, а сразу улетучивается. Из паров образуется белый фосфор |
| Чёрный | 1000 под давлением 18·105 Па | – | 2,69 | Получается при длительном нагревании белого фосфора при 230°С под высоким давлением. Имеет металлический блеск. Похож на графит, жирный на ощупь. Не растворяется даже в органических растворителях. Имеет свойства полупроводника. Можно поджечь при предварительном прокаливании до 500°С |
Рис. 2. Модификации фосфора.
При обычных условиях фосфор имеет только три модификации. Однако под высоким давлением из чёрного фосфора можно получить металлический фосфор. Это самая плотная модификация (3,83 г/см3), проводящая электрический ток.
Активность снижается при переходе от одной модификации к другой. Поэтому активным является белый фосфор, инертным – металлический.
Фосфор вступает в реакции со многими простыми и сложными веществами. Особенности химических свойств описаны в таблице.
| Реакция | Особенности | Уравнение |
| С кислородом | В избытке кислорода образуется оксид фосфора (V). При медленном окислении получается оксид фосфора (III) | – 4P + 5O2 → 2P2O5; – 4P + 3O2 → 2P2O3 |
| С галогенами и неметаллами | Восстанавливает | – 2P + 3Cl2 → 2PCl3; – B + P → BP |
| С металлами | Окисляет. Образует фосфиды | 3Mg + 2P → Mg3P2 |
| С водой | Реагирует с водяным паром, образуя фосфин и фосфорную кислоту. Красный фосфор реагирует при нагревании и катализаторе, образуя фосфорную кислоту | – 8Р + 12Н2О → 5РН3 + 3Н3РО2; – 2Р + 8Н2О → 2Н3РО2 + 5Н2 |
| С кислотой | Связывается с водородом, замещая неметаллы | 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O |
| Со щелочами | Образует фосфин | 4Р + 3KOH + 3Н2О → РН3 + 3KH2PO2 |
Фосфор не взаимодействует со свободным водородом.
В природе фосфор встречается в виде солей и минералов. В частности входит в состав апатита.
В организме животных и человека фосфор выполняет структурную функцию. Его содержат:
- белки;
- ДНК;
- АТФ;
- фосфолипиды;
- костная, нервная, мышечная ткани.
Фосфор участвует в постройке клеточной мембраны, в метаболизме, в механизме сокращения мышц. Вместе с кальцием в виде фосфата кальция Са3(PO4)2 придаёт прочность скелету.
Фосфор участвует в круговороте веществ. Основной источник фосфора – растения, получающие его из почвы. В грунт фосфор попадает в результате гниения. Специальные бактерии перерабатывают органические вещества, содержащие фосфор, в фосфаты – неорганические соединения, усвояемые растениями.
Рис. 3. Круговорот фосфора.
Фосфор – один из важнейших элементов неорганической химии, входящий в состав живых организмов. Электронная конфигурация – 1s22s22p63s23p3. Имеет переменную валентность – III и V.
Это твёрдый неметалл, образующий три аллотропические формы – белый, красный и чёрный фосфор. Формы отличаются физическими и химическими свойствами. Самый активный – белый фосфор, окисляющийся на воздухе.
Элемент реагирует с кислородом, металлами, неметаллами, галогенами, кислотами, водой и щелочами. Фосфор не реагирует с водородом.
Средняя оценка: 4.6. Всего получено оценок: 116.
Источник: https://obrazovaka.ru/himiya/fosfor-formula-svoystva-9-klass.html




