Инфоурок › Химия ›Презентации›Презентация по химии: «Кислородные соединения углерода»


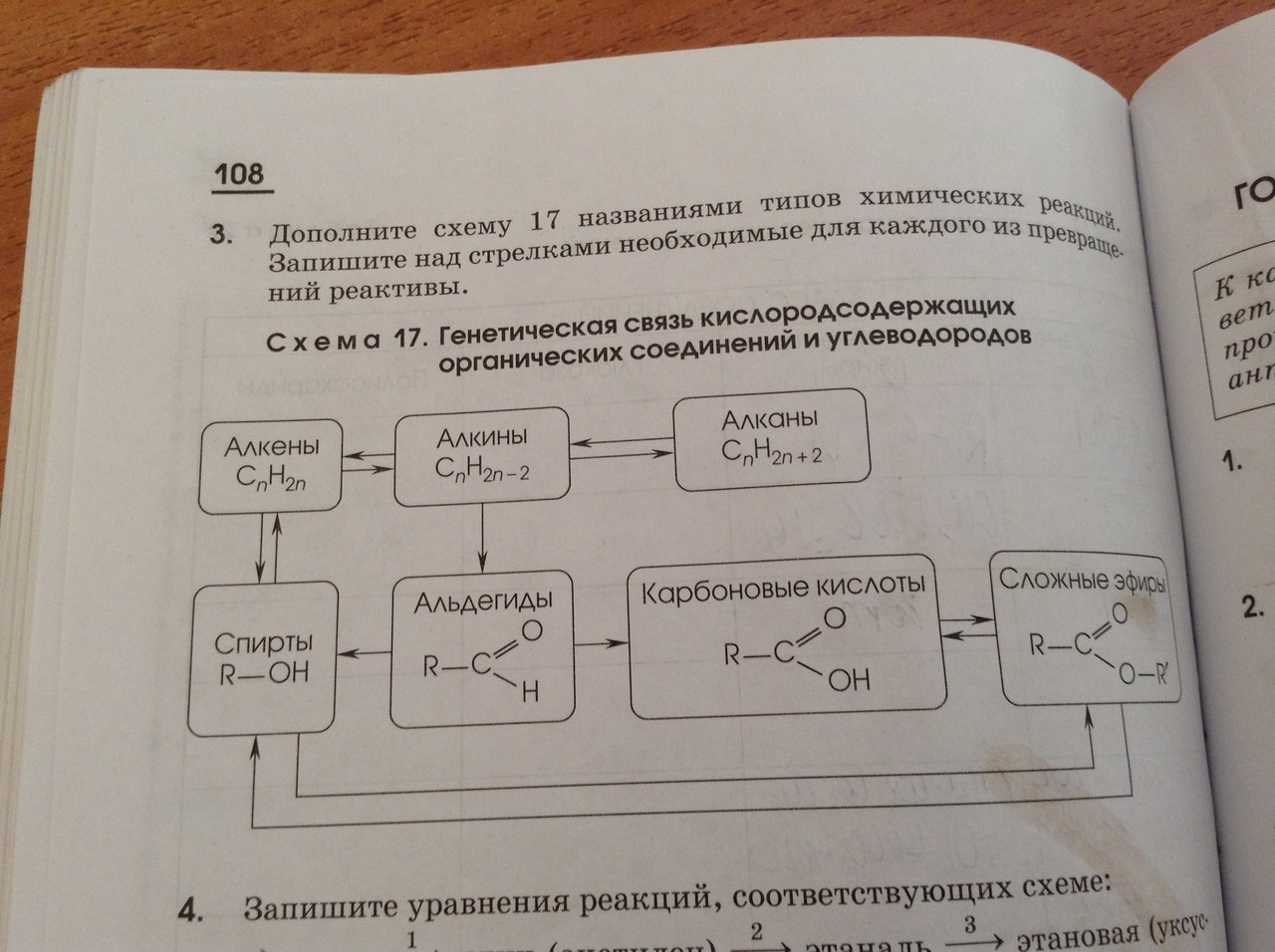





Описание презентации по отдельным слайдам:
1 слайд Описание слайда:
учитель химии БОУСОШ № 10 Плешань Ирина Алексеевна Кислородные соединения углерода
2 слайд Описание слайда:
Без углерода не существует ни одного растения или животного…
3 слайд Описание слайда:
Углерод в виде сажи, кокса, древесного угля, костных углей широко используется в металлургии, синтезе органических веществ, как топливо, в быту.
4 слайд Описание слайда:
Соединения углерода Оксиды углерода Угольная кислота Оксид углерода (II) Оксид углерода (IV) Карбонаты Гидрокарбонаты Аргонит (жемчуг) Мрамор Известняк Мел
5 слайд Описание слайда:
Углерод образует два оксида CO оксид углерода(II) или угарный газ CO2 оксид углерода (IV) или углекислый газ
6 слайд Описание слайда:
Оксид углерода (II) иначе угарный газ Оксид углерода (II) — сильный и очень опасный яд! При работе с оксидом углерода (II) необходимо соблюдать особые меры предосторожности. Получение. В промышленности оксид углерода (И) получают: 1.
Неполным сжиганием кокса: 2 С + 0₂ =ͭ 2 СО. 2.
Пропусканием через раскаленный кокс водяного пара, при этом образуется смесь оксида углерода (II) с водородом — водяной газ: С + Н₂ =ͭ СО + Н₂ водяной газ или оксида углерода (IV): СO₂ + С =ͭ 2 СО .
7 слайд Описание слайда:
Получение угарного газа
8 слайд Описание слайда:
Физические свойства бесцветный газ, не имеющий запаха, плохо растворим в воде, немного легче воздуха Химические свойства несолеобразующий оксид Молекулы СО очень прочны, поскольку связь между атомами углерода и кислорода в них тройная. Для оксида углерода (II) характерны восстановительные свойства.
Поскольку для углерода наиболее характерна (устойчива) степень окисления +4, оксид углерода (II) при нагревании является активным восстановителем.
В кислороде и на воздухе он горит голубоватым пламенем, выделяя много тепла: 2 С²O +O ₂ =ͭ 2С⁴ O₂ˉ² + Q Также он восстанавливает металлы из оксидов: CuO + CO =ͭ Cu + CO₂ Горение угарного газа
9 слайд Описание слайда:
Применение CO
10 слайд Описание слайда:
Применяется оксид углерода (II) при производстве чугуна и метанола
11 слайд Описание слайда:
Оксид углерода (IV) Получение.
Образуется при горении угля, угарного газа; в промышленности как побочный продукт при производстве извести: СаСO₃ ↔СаО + С0₂↑; в лаборатории при действии кислот на мел или мрамор: СаСO₃ + 2 НСl = СаСl₂ + Н₂O + СO₂↑; в природе при медленном окислении в биохимических процессах (дыхание, гниение, брожение). Растворение оксида углерода (IV) – обратимый процесс: H₂O + CO₂ ↔ H₂CO₃ Для углекислого газа не характерны ни окислительные, ни восстановительные свойства, хотя некоторые наиболее активные металлы горят в оксиде: CO₂ + 2Mg = 2MgO + С или углекислый газ,
12 слайд Описание слайда:
* Физические свойства — бесцветный газ, примерно в 1,5 раза тяжелее воздуха, поэтому его можно «переливать» из сосуда в сосуд (рис. 46), в воде достаточно хорошо растворим (газированная вода — это раствор С0₂ в воде). При обычной температуре и высоком давлении оксид углерода (IV) сжижается.
При его испарении поглощается так много теплоты, что часть оксида углерода (IV) превращается в снегообразную массу — «сухой лед». Последний применяют для хранения скоропортящихся продуктов, мороженого. В твердом состоянии оксид углерода (IV) имеет молекулярную кристаллическую решетку. — Оксид углерода (IV) не горит и не поддерживает горение.
Горящая лучинка гаснет, если ее ввести в цилиндр с углекислым газом. Поэтому его используют для тушения пожаров.
13 слайд Описание слайда:
Химические свойства Химические свойства. Оксид углерода (IV) — типичный кислотный оксид, взаимодействует со щелочами и основными оксидами, с водой: 2 NaOH + С02 = Na2C03 + Н20; СаО + С02 =ͭ СаС03 .
При пропускании углекислого газа через раствор гидроксида кальция (известковую воду) наблюдается помутнение в результате образования СаС03: Са(ОН)2 + С02 = СаС03 ↓ + Н20 . Эта реакция является качественной — на оксид углерода (IV). При растворении оксида углерода (IV) в воде образуется угольная кислота: С02 + Н20 ↔Н2С03 .
При высоких температурах оксид углерода (IV) проявляет свойства окислителя → взаимодействует с углем и активными металлами: С⁴О₂+С° =ͭ 2С²O, 2 Mg° + С⁴O₂ =ͭ 2 Mg+20 + С0.
14 слайд
15 слайд Описание слайда:
Фотосинтез
16 слайд Описание слайда:
Угольная кислота – соединение крайне непрочное и распадается на CO2 и H2O уже в момент образования:
17 слайд Описание слайда:
Угольная кислота Н₂С0₃ существует только в растворе, даже при слабом нагревании она полностью разлагается на С0₂ и Н₂0, очень слабая, как двухосновная она диссоциирует по двум ступеням и поэтому образует два ряда солей — средние и кислые соли: Н2С03 ↔ Н+ + HC03 НСО₃̵ ← гидрокарбонат-ион НС03⁻↔Н⁺ + СО₃²⁻ СОз²⁻ ←карбонат-ион
18 слайд Описание слайда:
Соли угольной кислоты Карбонаты( CaCO3, Na2CO3) Гидрокарбонаты(Ca(HCO3)2, NaHCO3)
19 слайд Описание слайда:
Отношение карбонатов к воде и температуре.
20 слайд Описание слайда:
Отношение карбонатов к кислотам.
Качественной реакцией на карбонаты и гидрокарбонаты является их взаимодействие с растворами кислот, при котором с шипением выделяются пузырьки углекислого газа: CO₃²- + 2 Н+ = Н20 + С02 ↑, НСОз ̄+ H+ = Н20 + CO2 ↑ При пропускании образовавшегося С02 через известковую воду выпадает осадок СаС03 (раствор мутнеет): С02 + Са2+ + 2 ОН- = СаС03 ↓ + Н20 При избытке С02 помутнение исчезает в результате образования Са(НС03)2: СаС03 + Н20 + С02 = Са2+ + 2 НСО₃̄
21 слайд Описание слайда:
Применение.
Из солей угольной кислоты наиболее широко применяют: соду в виде Na2C0310 Н20 (кристаллическая сода), Na2C03 (кальцинированная сода), она потребляется стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтяной и другими отраслями промышленности, в быту как моющее средство; NaHC03 (питьевая сода) — в медицине, в хлебопечении, в пищевой промышленности; карбонат калия, или поташ, К2С03 используют для получения мыла, при изготовлении тугоплавкого стекла; СаС03 (известняк, мрамор).
22 слайд Описание слайда:
Применение
23 слайд Описание слайда:
На земле живут три брата Из семейства карбонатов. Старший брат – красавец Мрамор, Славен именем Каррары. Превосходный зодчий, он Строил Рим и Парфенон.
24 слайд Описание слайда:
Всем известен Известняк, Потому и назван так. Знаменит своим трудом, Строит он за домом дом.
25 слайд Описание слайда:
И способен, и умел Младший мягкий братец Мел. Как рисует, посмотри, Этот СаСО3
26 слайд
Скрыть
Важно! Узнайте, чем закончилась проверка учебного центра «Инфоурок»?
Краткое описание документа:
Общая информация
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Источник: https://infourok.ru/prezentaciya_po_himii_kislorodnye_soedineniya_ugleroda-360278.htm
Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2

Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)

Химические свойства
- Реакции с неметаллами
- При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
- C + H2 → (t) CH4 (метан)
- 2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
- С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
- С + F2 → (t) CF4
- Реакции с металлами
- Ca + C → CaC2 (карбид кальция, СО углерода = -1)
- Al + C → Al4C3 (карбид алюминий, СО углерода -4)
- Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
- Восстановительные свойства
- Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
- Fe2O3 + C → Fe + CO2
- ZnO + C → Zn + CO
- FeO + C → Fe + CO
- Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
- SiO2 + C → (t) Si + CO
- Может восстановить и собственный оксид:
- CO2 + C → CO
- Реакция с водой
- Реакции с кислотами
- В реакциях с кислотами углерод проявляет себя как восстановитель:
- C + HNO 3(конц.) → (t) CO2 + NO2 + H2
- C + HNO3 → CO2 + NO + H2O
- C + H2SO4(конц.) → CO2 + SO2 + H2O
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.


Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑

Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
- Получение
- В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
- CO2 + C → (t) CO
- C + H2O → (t) CO + H2
- В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
- HCOOH → (H2SO4) CO + H2O
- Химические свойства
- Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
- CO + O2 → CO2
- Fe2O3 + CO → Fe + CO2
- FeO + CO → Fe + CO2
- Образование карбонилов — чрезвычайно токсичных веществ.
- Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
- Получение
- В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
- CaCO3 → (t) CaO + CO2↑
- C6H12O6 → C2H5OH + CO2↑
- В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
- CaCO3 + HCl → CaCl2 + H2O + CO2↑
- Углекислый газ образуется при горении органических веществ:
- C3H8 + O2 → CO2 + H2O
Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
- 2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
- KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
- Na2O + CO2 → Na2CO3
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ. CO2 + H2O ⇄ H2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
- Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
- CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)
- Средние и кислые соли
- Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
- Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
- LiHCO3 + LiOH → Li2CO3 + H2O
- Нагревание солей угольной кислоты
- При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на соответствующий оксид металла, углекислый газ и воду.
- MgCO3 → (t) MgO + CO2
- KHCO3 → (t) K2CO3 + CO2↑ + H2O
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха. MgCO3 + HCl → MgCl2 + CO2↑ + H2O Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Источник: https://studarium.ru/article/166
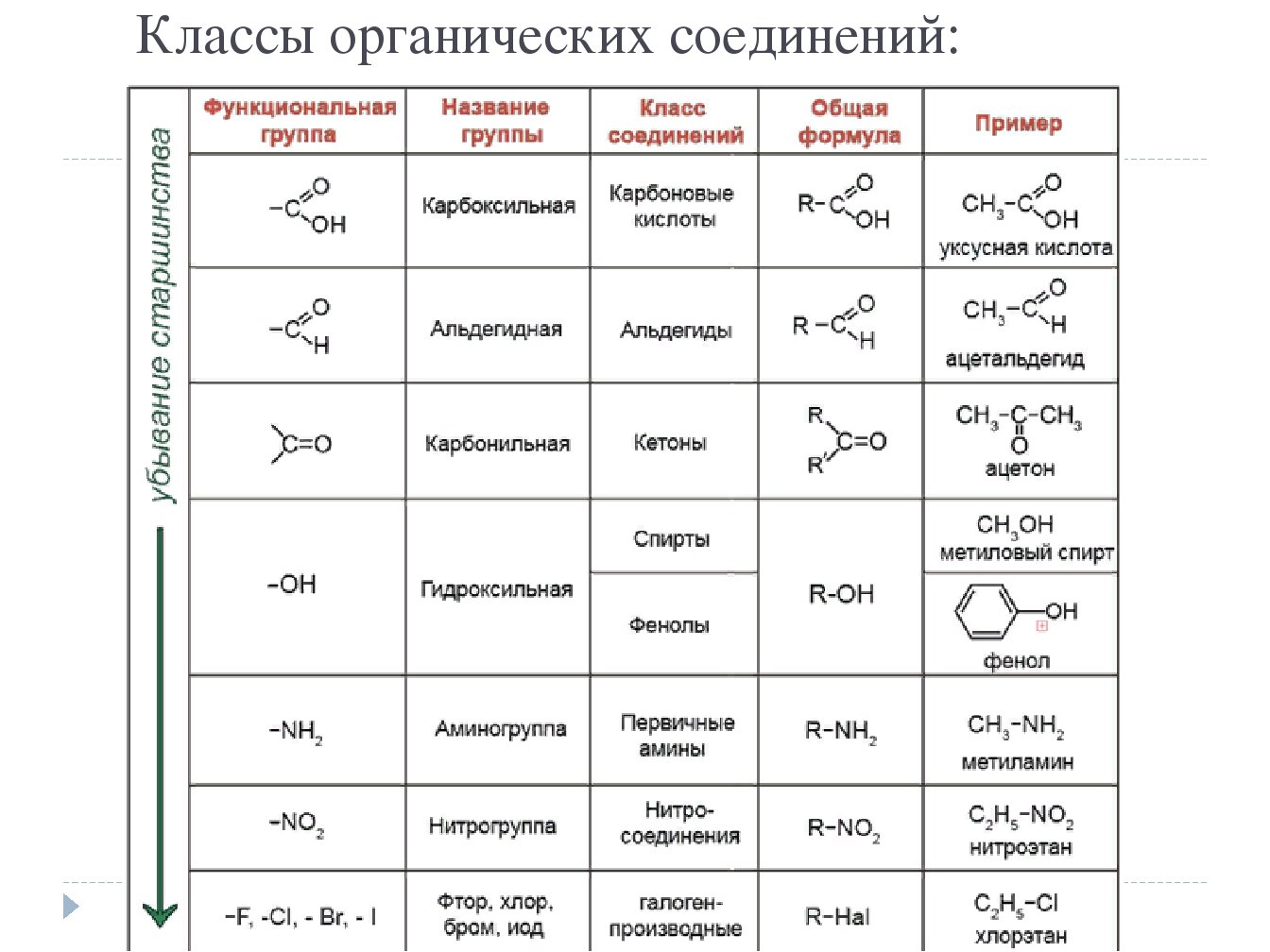
Кислородсодержащие органические соединения
 Автор Карманова Ольга Геннадьевна 319 статей
Автор Карманова Ольга Геннадьевна 319 статей
Моносахариды
В молекулах моносахаридов может содержаться от трёх до шести атомов углерода. Моносахариды содержат функциональные группы: – `»OH»` и `>»C»=»O»`. Среди них есть альдегидоспирты (альдозы) и кетоноспирты (кетозы).
- Простейший моносахарид – глицериновый альдегид:
- Остальные моносахариды по числу атомов углерода подразделяют не тетрозы `(«C»_4″H»_8″O»_4)`, пентозы `(«C»_5″H»_(10)»O»_5)` и гексозы `(«C»_6″H»_(12)»O»_6)`. Ниже представлены примеры пентоз и гексоз:

Молекулы моносахаридов могут существовать не только в линейной (открытой), но и в циклической форме.
Линейные молекулы вследствие вращения групп атомов вокруг простых связей `»C»-«C»` могут быть изогнуты в пространстве таким образом, что гидроксильная группа сблизится с атомом кислорода карбонильной группы, находящейся на противоположном конце молекулы. На предложенном рисунке изображены изогнутая открытая форма глюкозы и фруктозы:


Функциональные группы – спиртовая и карбонильная – взаимодействуют между собой: атом водорода `»OH»` – группы присоединяется к кислороду карбонила, а между первым атомом углерода `»C»(1)` (при циклизации глюкозы) и вторым `»C»(2)` (для фруктозы) и атомом кислорода образуется связь. Возникающая новая форма молекулы – шестичленный кислородсодержащий цикл (для глюкозы) и пятичленный (для фруктозы) – не содержит альдегидную группу. Образовавшуюся гидроксильную группу, связанную с атомом углерода называют гликозидным гидроксилом (помечен звёздочкой):
Гликозидный гидроксил может по-разному располагаться в пространстве. Это приводит к существованию двух циклических форм моносахаридов: альфа и бета. В `α`-форме гликозидный гидроксил и группа `»CH»_2″OH»` при `»C»(5)` находятся по разные стороны от плоскости кольца , а в `β`-форме — эти группы находятся по одну сторону от плоскости кольца:

В кристаллическом состоянии моносахариды находятся только в циклической форме (`α` или `β`), в водных растворах существует равновесие, которое сдвинуто в сторону циклических форм:

Шестичленные циклы называются пиранозными, а пятичленные – фуранозными. Ниже представлен фуранозный цикл для `β`-рибозы (в данном случае гликозидный гидроксил и группа `»CH»_2″OH»` при `»C»(4)` находятся по одну сторону от плоскости кольца):

Глюкоза, фруктоза и рибоза – белые кристаллические вещества, обладающие сладким вкусом, хорошо растворимые в воде.
Углеводы являются очень распространёнными природными соединениями, входят в состав растений и живых организмов. В растениях они образуются в результате фотосинтеза: `n»CO»_2+m»H»_2″O»->»C»_n(«H»_2″O»)_m+n»O»_2`.
- Реакции с участием альдегидной группы
- 1. Глюкоза как альдегид обладает восстановительными свойствами и реагирует с аммиачным раствором оксида серебра (реакция «серебряного зеркала»), окисляясь при этом в соль глюконовой кислоты:
- CH2OH-(CHOH)4-COH+2Ag(NH3)2OH→t°{mathrm{CH}}_2mathrm{OH}-(mathrm{CHOH})_4-mathrm{COH}+2left[mathrm{Ag}({mathrm{NH}}_3)_2
ight]mathrm{OH}xrightarrow{mathrm t^circ} - →t°CH2OH-(CHOH)4-COONH4+2Ag↓+3NH3↑+H2Oxrightarrow{mathrm t^circ}{mathrm{CH}}_2mathrm{OH}-(mathrm{CHOH})_4-{mathrm{COONH}}_4+2mathrm{Ag}downarrow+3{mathrm{NH}}_3uparrow+{mathrm H}_2mathrm O.
- 2. Аналогично протекает окисление глюкозы свежеприготовленным гидроксидом меди (II) при нагревании до глюконовой кислоты:
- CH2OH-(CHOH)4-COH+2Cu(OH)2→t°{mathrm{CH}}_2mathrm{OH}-(mathrm{CHOH})_4-mathrm{COH}+2mathrm{Cu}(mathrm{OH})_2xrightarrow{mathrm t^circ}
- →t°CH2OH-(CHOH)4-COOH+Cu2O↓+2H2Oxrightarrow{mathrm t^circ}{mathrm{CH}}_2mathrm{OH}-(mathrm{CHOH})_4-mathrm{COOH}+{mathrm{Cu}}_2mathrm Odownarrow+2{mathrm H}_2mathrm O.
- 3. Глюкоза окисляется бромной водой до глюконовой кислоты:
- CH2OH-(CHOH)4-COH+Br2+H2O→{mathrm{CH}}_2mathrm{OH}-(mathrm{CHOH})_4-mathrm{COH}+{mathrm{Br}}_2+{mathrm H}_2mathrm O
ightarrow - →CH2OH-(CHOH)4-COOH+2HBr
ightarrow{mathrm{CH}}_2mathrm{OH}-(mathrm{CHOH})_4-mathrm{COOH}+2mathrm{HBr}. - 4. Под действием водорода в присутствии катализатора альдегидная группа глюкозы восстанавливается в спиртовую группу, образуется шестиатомный спирт сорбит:
- CH2OH-(CHOH)4-COH+H2→t°NiCH2OH-(CHOH)4-CH2OH{mathrm{CH}}_2mathrm{OH}-(mathrm{CHOH})_4-mathrm{COH}+{mathrm H}_2xrightarrow[{mathrm t^circ}]{mathrm{Ni}}{mathrm{CH}}_2mathrm{OH}-(mathrm{CHOH})_4-{mathrm{CH}}_2mathrm{OH}
- 5. Окисление глюкозы разбавленной азотной кислотой (жёсткое окисление) приводит к образованию двухосновной глюкаровой кислоты:
- CH2OH-(CHOH)4-COH+2HNO3→{mathrm{CH}}_2mathrm{OH}-(mathrm{CHOH})_4-mathrm{COH}+2{mathrm{HNO}}_3
ightarrow - →HOOC-(CHOH)4-COOH+2NO↑+2H2O
ightarrowmathrm{HOOC}-(mathrm{CHOH})_4-mathrm{COOH}+2mathrm{NO}uparrow+2{mathrm H}_2mathrm O. - Глюкоза не вступает в некоторые реакции альдегидов, например, в реакцию c `»NaHSO»_3`.
- Реакции с участием гидроксильных групп
1. Образование гликозидов. При действии метилового спирта в присутствии газообразного хлороводорода с участием гликозидного гидроксила образуется простой эфир – метилгликозид:

2. Образование простых и сложных эфиров. Простые эфиры образуются при взаимодействии избытка алкилгалогенидов со спиртами:

Сложные эфиры глюкозы могут быть получены при взаимодействии глюкозы с карбоновыми кислотами и их функциональными производными: ангидридами и галогенангидридами кислот. При избытке ацилирующего агента все спиртовые группы молекулы переходят в сложноэфирные:

3. С гидроксидом меди (II) без нагревания глюкоза реагирует как многоатомный спирт и даёт характерное синее окрашивание (качественная реакция на многоатомные спирты).
- Брожение
- 1. Спиртовое брожение под действием дрожжевых ферментов:
- C6H12O6→ферменты2C2H5OH+2CO2↑{mathrm C}_6{mathrm H}_{12}{mathrm O}_6xrightarrow{mathrm{ферменты}}2{mathrm C}_2{mathrm H}_5mathrm{OH}+2{mathrm{CO}}_2uparrow.
- 2. Молочнокислое брожение с образованием молочной кислоты под влиянием молочнокислых бактерий:
- 3. Маслянокислое брожение глюкозы приводит к образованию масляной кислоты:
- C6H12O6→ферментыCH3-CH2-CH2-COOH+2CO2+2H2↑{mathrm C}_6{mathrm H}_{12}{mathrm O}_6xrightarrow{mathrm{ферменты}}{mathrm{CH}}_3-{mathrm{CH}}_2-{mathrm{CH}}_2-mathrm{COOH}+2{mathrm{CO}}_2+2{mathrm H}_2uparrow.
- Окисление глюкозы в живых системах
- В живых организмах большая часть (примерно `70%`) глюкозы подвергается окислению кислородом воздуха (реакция обратна процессу фотосинтеза):
- `»C»_6″H»_(12)»O»_6+6″O»_2->6″CO»_2+6″H»_2″O»+2816` кДж.
Выделяющаяся энергия используется для обеспечения процессов жизнедеятельности организма (сокращение мышц, синтез белков и т. д.).
Фруктоза обладает химическими свойствами многоатомных спиртов и кетонов. Как многоатомный спирт фруктоза даёт ярко-синее окрашивание с гидроксидом меди (II) без нагревания (см. хим.
свойства глюкозы), образует простые и сложные эфиры. При восстановлении карбонильной группы образуется шестиатомный спирт.
В отличие от глюкозы фруктоза не окисляется аммиачным раствором оксида серебра (не вступает в реакцию «серебряного зеркала») и бромной водой.
Поскольку рибоза является альдегидоспиртом, её химические свойства аналогичны свойствам глюкозы.
Дисахариды
Дисахариды состоят из двух остатков моносахаридов. Циклические молекулы моносахаридов соединены друг с другом простой эфирной связью. Важнейшие дисахариды – сахароза, мальтоза и лактоза. Все они являются изомерами и имеют формулу `»C»_(12)»H»_(22)»O»_(11)`.
Молекула сахарозы состоит из двух циклов: шестичленного (остатка `α`-глюкозы в пиранозной форме) и пятичленного (остатка `β`-фруктозы в фуранозной форме):
В молекуле сахарозы нет гликозидного гидроксила, поэтому её циклическая форма не может раскрываться и переходить в альдегидную форму. Сахароза не окисляется `»Cu»(«OH»)_2` и `[«Ag»(«NH»_3)_2]»OH»`, то есть является невосстанавливающим сахаром.
- В молекуле мальтозы остатки циклической глюкозы соединены между собой `1,4`-гликозидной связью, то есть в образовании связи участвуют гидроксильные группы первого углеродного атома одной молекулы (гликозидный гидроксил) и четвёртого – другой (спиртовой гидроксил):
- Мальтоза является восстанавливающим сахаром, поскольку один из остатков глюкозы сохранил гликозидный гидроксил.
Все перечисленные дисахариды – твёрдые кристаллические вещества, хорошо растворимые в воде и сладкие на вкус.
- Определяются их строением.
- 1, Все они гидролизуются в кислой среде. Так например, сахароза при нагревании в воде в присутствии минеральной кислоты образует глюкозу и фруктозу:
- C12H22O11+H2O→t°H+C6H12O6глюкоза+C6H12O6фруктоза{mathrm C}_{12}{mathrm H}_{22}{mathrm O}_{11}+{mathrm H}_2mathrm Oxrightarrow[{mathrm t^circ}]{mathrm H^+}underset{mathrm{глюкоза}}{{mathrm C}_6{mathrm H}_{12}{mathrm O}_6}+underset{mathrm{фруктоза}}{{mathrm C}_6{mathrm H}_{12}{mathrm O}_6},
- а мальтоза даёт только глюкозу:
- C12H22O11+H2O→H+2C6H12O6{mathrm C}_{12}{mathrm H}_{22}{mathrm O}_{11}+{mathrm H}_2mathrm Oxrightarrow{mathrm H^+}2{mathrm C}_6{mathrm H}_{12}{mathrm O}_6.
- 2, Восстанавливающие дисахариды (мальтоза, лактоза и др.) реагируют с окислителями по упрощённой схеме таким образом:
- C12H22O11+Ag2O→NH3C12H22O12+2Ag↓{mathrm C}_{12}{mathrm H}_{22}{mathrm O}_{11}+{mathrm{Ag}}_2mathrm Oxrightarrow{{mathrm{NH}}_3}{mathrm C}_{12}{mathrm H}_{22}{mathrm O}_{12}+2mathrm{Ag}downarrow
- C12H22O11+2Cu(OH)2→t°C12H22O12+Cu2O↓+2H2O{mathrm C}_{12}{mathrm H}_{22}{mathrm O}_{11}+2mathrm{Cu}(mathrm{OH})_2xrightarrow{mathrm t^circ}{mathrm C}_{12}{mathrm H}_{22}{mathrm O}_{12}+{mathrm{Cu}}_2mathrm Odownarrow+2{mathrm H}_2mathrm O
- 3, Сахароза реагирует с гидроксидом кальция с образованием растворимого в воде вещества – сахарата кальция.
- 4, Будучи многоатомным спиртом, сахароза даёт ярко-синее комплексное соединение – сахарат меди (II) при добавлении к её раствору медного купороса `(«CuSO»_4*5″H»_2″O»)`.
Полисахариды
Крахмал, а также целлюлоза относятся к третьей группе углеводов – полисахаридам. Общая формула полисахаридов `(«C»_6″H»_(10)»O»_5)_n`. Все они состоят из циклических остатков глюкозы, различным образом соединённых друг с другом.
Молекулы крахмала состоят из линейных и разветвлённых цепей, содержащих остатки `α`-глюкозы. Фрагмент линейной структуры крахмала:
Линейная полимерная молекула (амилоза) свёрнута в спираль, куда могут вовлекаться другие молекулы, например, йода. Другая фракция крахмала (амилопектин) имеет разветвлённое строение, а её макромолекулы имеют шаровидную форму.
- Молекулы целлюлозы состоят из линейных цепей, содержащих остатки `β`-глюкозы:
Основное отличие между крахмалом и целлюлозой заключается в структуре их молекул. Молекулы крахмала имеют линейную и разветвлённую структуру, молекулы целлюлозы – только линейную. Этим объяснятся то, что целлюлоза является основой волокон хлопка, льна и т. д.
, из которых производят ткани. Целлюлоза отличается от крахмала важным структурным параметром: она построена из β-формы глюкозидных звеньев, а крахмал – из `alpha`-формы.
В первом случае считают, что между глюкозными звеньями имеется β-связь, а во втором – `alpha`-связь.
- Линейное строение макромолекул целлюлозы, удерживаемых относительно друг друга межмолекулярными водородными связями с участием гидроксильных групп, обеспечивает ей повышенную механическую прочность.
Крахмал представляет собой белый порошок, не растворимый в холодной воде. В горячей воде набухает, образует клейстер. Целлюлоза – твёрдое волокнистое вещество, нерастворимое в воде.
1, Крахмал и целлюлоза подвергаются гидролизу в кислой среде при нагревании:
C6H10O5n+nH2O→t°H+nC6H12O6{left({mathrm C}_6{mathrm H}_{10}{mathrm O}_5
ight)}_n+n{mathrm H}_2mathrm Oxrightarrow[{mathrm t^circ}]{mathrm H^+}mathrm nC_6{mathrm H}_{12}{mathrm O}_6.
Целлюлоза, в отличие от крахмала, не усваивается организмом, поскольку не подвергается ферментативному гидролизу. Она гидролизуется при длительном кипячении в водных растворах сильных кислот.
- 2, Крахмал даёт интенсивное синее окрашивание с йодом – это качественная реакция на крахмал и на йод.
- 3, Целлюлоза образует сложные эфиры с азотной кислотой, уксусной кислотой или уксусным ангидридом (это более сильное этерифицирующее средство, чем уксусная кислота):
- Если состав целлюлозы записать таким образом: `[«C»_6″H»_7″O»_2(«OH»)_3]_n`, выделив три гидроксильные группы, которые участвуют в образовании сложноэфирных связей, то уравнение реакции примет вид:
- `[«C»_6″H»_7″O»_2(«OH»)_3]_n+3n»HO»-«NO»_2->[«C»_6″H»_7″O»_2(«ONO»_2)_3]_n+3n»H»_2″O»`.
- 4, Крахмал и целлюлоза не вступают в реакцию «серебряного зеркала».
Источник: https://zftsh.online/course/1366/7-uglevody
Кислородные соединения углерода
В соединениях с кислородом атомы углерода проявляют, как правило, устойчивую положительную степень окисления +4.Наиболее важными в практическом отношении являются диоксид углерода СО2 и соли несуществующей в свободном состоянии угольной кислоты — карбонаты.
Кроме того, есть небольшая группа килородсодержащих соединений углерода, в которых он имеет степень окисления +2. Это монооксид углерода СО и его производные.
СО — оксид углерода (II), угарный газ. В молекуле СО существует тройная связь. Две из трех связей образованы по обменному механизму, а одна — по донорно-акцепторному.
Это самая прочная из всех двухатомных молекул (энергия связи 1069 кДж/моль), поэтому СО является химически малоактивным веществом.
Наличие неподеленных электронных пар у атомов углерода и кислорода обусловливает возможность образования прочных комплексных соединений с d-элементами
Физические свойства
При обычной температуре СО — бесцветный газ, без запаха, очень плохо растворяется в воде, лучше — в спирте.
Монооксид углерода — ядовитый газ, разрушает комплекс гемоглобина с кислородом.
Способы получения
- 1. Промышленные:
- С + H2O → CO + Н2
- СН4 + Н2О → СО + ЗН2
- СН4 + СО2 → 2СО + 2Н2 В качестве катализаторов используют Ni, MgO, Al2О3.
- 2СН4 + 3О2 → 2СО + 4Н2О
- 2С + О2 = 2СО (горение угля в недостатке О2)
- 2. Лабораторные:
- HCOOH → CО + Н2О
- Н2С2O4 → CО + CО2+ Н2О
Химические свойства
Со — несолеобразующий оксид
При обычных условиях не реагирует с водой, кислотами, щелочами, поэтому относится к типу несо леобразующих оксидов. Однако формально его можно рассматривать как ангидрид муравьиной кислоты. Основанием для этого является его образование при дегидратации НСООН (см. выше), а также получение формиата натрия при пропускании СО через концентрированный раствор NaOH под высоким давлением:
СО + NaOH → HCOONa формиат натрия
Со — сильный восстановитель
- 1. Взаимодействие с кислородом и галогенами:
- 2СО + О2 = 2СО2
- СО + Cl2 = COCl2 фосген
- 2. Восстановление металлов из их оксидов (реакции осуществляются при Т — 300—1500°С):
- 2СО + SnО2 → Sn + 2СО2
- 4СО + Fe3O4 → 3Fe + 4CО2
- 3.
Восстановление водорода из воды:
- СО + Н2О = Н2 + CО2
- Эта реакция в присутствии катализаторов, содержащих Pt или Pd, происходит при обычной температуре, что используется для удаления СО из выхлопных газов автомобилей.
- 4.
Восстановление некоторых благородных металлов из солей (при комнатной Т):
- СО + PdCl2 + Н2О = Pd↓ + СО2↑ + 2HCl
Синтез органических соединений
- 1. Синтез метанола СО + 2Н2 → СН3ОН
- 2. Синтез метана и его гомологов: СО + 3Н2 → CН4 + Н2О
- nCO + (2n + 1)H2 → СnН2n + nН2O
Образование карбонилов металлов
- Молекулы СО довольно легко присоединяются к атомам некоторых d-металлов. В образовании донорно-акцепторных связей участвуют неподеленные электронные пары атомов углерода в молекулах СО и свободные орбитали атомов металлов:
- 4СО + Ni = [Ni(CO)4] тетракарбонил никеля
- 5СО + Fe = [Fe(CO)5] пентакарбонил железа
Образование карбокси — гемоглобина
- СО связывается с ионами Fe2+ в гемоглобине (НЬ) подобно О2. Сродство НЬ человека к СО более чем в 200 раз превышает сродство к О2, поэтому СО способен вытеснять О2 из оксигемоглобина НЬО2:
- НЬО2 + СО → НbСО + О2
- Этим и объясняется высокая токсичность угарного газа.
Диоксид углерода
СО2 — оксид углерода (IV), углекислый газ, угольный ангидрид, диоксид углерода. В молекуле СО2 атом углерода связан полярными ковалентными связями с двумя атомами кислорода: O=С=O. Молекула имеет симметричное линейное строение, вследствие чего в целом неполярна (дипольный момент равен O).
Физические свойства
При обычных условиях СО2 — бесцветный негорючий газ, значительно тяжелее воздуха, со слабым кисловатым запахом и вкусом Уже при комнатной температуре под давлением сжижается, а при более низкой температуре превращается в твердую снегообразную массу («сухой лед»). О растворении в воде — см. ниже.
Способы получения
- 1. Разложение карбонатов и гидрокарбонатов:
- СаСО3 → СаО + CО2↑
- 2NaHCО3 = Na2CО3 + CО2↑ + Н2O
- 2.
Сжигание угля и других видов топлива:
- СxНy + О2 → СО2 + Н2O
- 3. Действие сильных кислот на карбонаты и гидрокарбонаты:
- MgCО3 + 2HCl = MgCl2 + Н2O + CО2↑
- 4.
Спиртовое брожение глюкозы:
- С6Н12O6 → 2СО2↑ + 2С2Н5ОН
Химические свойства
СО2 — кислотный оксид, ангидрид угольной кислоты
Химически диоксид углерода — довольно инертное вещество. Основной тип взаимодействия СО2 связан с проявлением свойств кислотного оксида.
1. Взаимодействие с водой.
При растворении углекислого газа в воде небольшая часть его молекул (менее 1 %) соединяется с молекулами Н20, образуя очень слабую угольную кислоту:
СО2 + Н2O = Н2СО3
2. Взаимодействие со щелочами и основными оксидами.
- СО2 + 2NaOH = Na2CО3 карбонат натрия
- СО2 + NaOH = NaHCО3 гидрокарбонат натрия
- СО2 + Са(ОН)2 = СаСО3↓ + Н2O
- Эта реакция используется как качественная для обнаружения
СО2↑. - 3. Взаимодействие с водными растворами солей, образованных очень слабыми кислотами (слабее угольной):
- Na2SiО3 + СО2 + Н2O = H2SiО3↓ + Na2CО3
- С6Н5ОК + СО2 + Н2O = С6Н5ОН + КНСО3
Фотосинтез
СО2 — биохимически активное вещество. В листьях растений на свету из СО2 и Н2O образуются углеводы и кислород:
nСО2 + mН2O → Сn(Н2O)m + nО2
СО2 — окислитель в реакциях с сильными восстановителями
- При высокой температуре диоксид углерода реагирует с очень активными металлами, а также с другими сильными восстановителями (С, Н2, NH3).
Примеры реакций:
- СО2 + 2Мg = 2МgО + С
- СО2 + С = 2СО
- СО2 + ЗН2 → СН3ОН + Н2O
- а) Синтез мочевины (карбамида):
- СО2 + 2NH3 → CO(NH2)2 + Н2O
- б) Получение питьевой соды по методу Сольвэ:
- NaCl + NH3 + СО2 + Н2O = NaHCO3 + NH4Cl
Угольная кислота и карбонаты
Растворимость угольного ангидрида в воде при обычных условиях сравнительно невелика (в 1 л воды — 1 л СО2), при этом только очень небольшая его часть (менее 1 %) соединяется с водой, образуя непрочную угольную кислоту:
СО2 + Н2O → Н2СО3
Н2СО3 — слабая двухосновная кислота
- Будучи 2-основной кислотой, Н2СО3 диссоциирует ступенчато с образованием гидрокарбонат- и карбонат-анионов:
- Н2СО3 → Н+ + НСО3-
- НСО3- → Н+ + СО32-
- Угольная кислота существует только в водных растворах, где количество ее молекул и анионов в сотни раз меньше, чем количество растворенных молекул СО2.
- Н2СО3 как индивидуальное вещество не имеет никакого значения, но ее соли очень устойчивы и весьма распространены.
Карбонаты
Растворимость в воде. Гидролиз
Растворимыми в воде солями являются карбонаты щелочных металлов и аммония. Вследствие высокой степени гидролиза их водные растворы имеют сильнощелочную реакцию и в целом ряде случаев ведут себя как основания средней силы.
Na2СО3 + Н2O = NaOH + NaHСО3
СО32- + Н2O = ОН- + НСО3-
Химические свойства
Карбонаты щелочных Me при нагревании до т. пл. (~ 800 — 1000°С) не разлагаются. Все остальные карбонаты разлагаются, не достигнув т. пл., образуя углекислый газ и соответствующий оксид МеО. Термическое разложение СаСО3 широко используется для получения негашеной извести и СО2:
- СаСО3 = СаО + СО2↑
- При температуре от 700 до 900″С эта реакция обратима, ее равновесие смещают путем изменения давления СО2.
Особенно легко разлагается карбонат аммония: - (NH4)2CО3 = 2NH3↑ + СО2↑ + Н2O
Взаимодействие с кислотами
- Почти все кислоты, даже такие слабые, как уксусная, легко разлагают карбонаты, вытесняя из них угольную кислоту в виде СО2 и Н2O:
- Na2CО3 + 2HCl = 2NaCl + Н2O + CО2↑
- СаСО3 + 2HNO3 = Са(NO3)2 + Н2O + CО2↑
- (NH4)2CО3 + 2СН3СООН = 2CH3COONH4 + CО2 + Н2O
Превращение в гидрокарбонаты
- При пропускании СО2 в растворы карбонатов или при постепенном добавлении к ним кислот происходит образование кислых солей — гидрокарбонатов:
- Na2C3 + СО2 + Н2O = 2NaHC3
- Na2C3 + HCI = NaHCO3 + NaCl
- В природе происходит медленное растворение известняков под действием атмосферных осадков и СО2:
- СаСО3 + Н2O + СО2 = Са(НСO3)2
Гидрокарбонаты
Катионы NH4+, щелочных и щелочноземельных Me, а также некоторые другие 2-зарядные катионы образуют с анионами НСО3- соли — гидрокарбонаты. Все они легко растворяются в воде, за исключением NaHCО3.
- При кипячении растворов гидрокарбонатов происходит их превращение в карбонаты или гидроксиды металлов с отщеплением СО2:
- Са(НСО3)2 = СаСО3↓ + Н2O + СО2↑
- Mg(HCО3)2 = Мg(ОН)2↓ + Н2O + 2СО2↑
- Водные растворы гидрокарбонатов также имеют щелочную среду вследствие гидролиза, но рН значительно меньше, чем у растворов карбонатов. Гидролиз аниона НСО3- протекает по схеме:
- НСО3- + Н2O → ОН- + Н2СО3
Питьевая сода NaHCО3
- Сода — один из главных продуктов неорганического синтеза.
В промышленности ее получают ам миачно-хлоридным способом, основанном на малой растворимости NaHCО3 в воде (метод Сольвэ):
- NH3 + CО2 + Н2O = NH4HCО3
- NH4HCО3 + NaCl = NaHCО3 + NH4Cl
- NH3 + CО2 + Н2O + NaCI = NaHCО3 + NH4Cl
- При прокаливании NaHCО3 разлагается с образованием Na2CО3, СО2 и воды.
Качественная реакция на карбонат — анионы
- 1. Распознавание карбонатов в виде твердых веществ производится с помощью HCl или H2SО4 (разбавленных растворов) Выделяющийся при их взаимодействии СО2 определяют по помутнению известковой воды:
- СО32- + 2Н+ = СО2↑ + Н2O
- СО2 + Са(ОН)2 = СаСО3↓ + Н2O
- При избытке СО2 помутнение исчезает и раствор вновь становится прозрачным:
- СаСО3 + Н2O + СО2 = Са(НСО3)2
2. Распознавание карбонат-анионов в растворе можно осуществить введением катионов Са2+ , что приводит к выпадению в осадок нерастворимого СаСО3.
Исторические и технические названия некоторых карбонатов
- Na2CО3•10Н2O — Кристаллическая сода
- Na2CО3 — Кальцинированная сода
- NaHCО3 — Питьевая сода
- К2СО3 — Поташ
- СаСО3 — Кальцит, известняк, мел, мрамор
- MgCО3 — Магнезит
- СаСО3•МgСО3 — Доломит
- (СиОН)2СО3 — Малахит, основной карбонат меди
- FeCО3 — Шпатовый железняк
Источник: http://examchemistry.com/content/lesson/neorgveshestva/oksidugleroda.html
6.5. Кислородосодержащие соединения углерода
6.5.1. Общая характеристика и свойства
Из множества
кислородосодержащих соединений углерода
мы рассмотрим лишь СО (угарный газ, т.е.
оксид углерода(II)), СО2
(углекислый газ или оксид углерода(IV)),
угольную кислоту и ее соли.
Молекулу угарного
газа С формирует в s2p2-состоянии.
При образовании же СО2 атом углерода
возбуждается, приобретая sp3-конфигурацию,
т.е. имеет 4 неспаренных электрона на
4-х орбиталях. Две из них (s- и px-)
дают две
png» width=»19″>-связи
с двумя О, а две другие (py-
и рz-) формируют два
-перекрывания
с р-орбиталями атомов кислорода. Но т.к.
гибридизации подвергаются лишь орбитали,
участвующие в
png» width=»19″>-связях,
то имеем sp-гибридизацию, а значит,
молекула СО2 линейна (рисунок 7) и
потому (несмотря на полярность ХС в
данной частице) она неполярна.
Тем не менее растворим
в воде гораздо лучше углекислый
газ (1 л в 1 л
при 15°С), чем угарный (0,03 л в 1 л), хотя
частица СО полярна.
Бóльшая
растворимость СО2
объясняется тем, что его молекулы (в
отличие от СО) при обычных
условиях химически
соединяются с водой, образуя угольную
кислоту (отсюда
название СО2
– «углекислый
газ»).
Однако СО (в отличие от СО2)
при нагревании
реагирует с водой по типу
ОВР, проявляя
восстановительные
свойства:
Оксид
углерода (II) восстанавливает
также М из их оксидов (что используется
в металлургии):
6.5.2. Токсичность оксидов
CO может формировать
донорно-акцепторную связь с металлами,
предоставляя свою НЭП на свободную
орбиталь М. В частности, именно вледствие
образования такой связи блокируется
железо гемоглобина крови. Из-за этого
гемоглобин теряет способность переносить
О2, и человек, надышавшись газом
СО, погибает, т.е. «угорает» (отсюда
название СО – «угарный газ»).
Обычно в воздухе
содержится 10-5% CO, что значительно
(в 100 раз!) меньше его предельно
допустимой концентрации (ПДК) –
10-3%.
В помещении указанная
ПДК превышается, если рано (когда
угли еще не прогорели) закрыть трубу
печи (и значит, прекратить тягу). В этом
случае из-за недостатка кислорода
топливо сгорает до CO. Углекислый газ
гораздо менее токсичен – отравляет
лишь при 5% содержании его в воздухе. А
ПДК – 0,1%28.
6.5.3. Синтез и обнаружение диоксида углерода
Угольная кислота
слабая, очень неустойчива и даже в
растворе отщепляет воду, переходя в газ
СО2, поэтому его можно получит,
действуя, например, раствором HCl
на CaCО3.
Данная реакция является
также качественной на карбонат-ионы.
Их присутствие считают установленным,
если при добавлении соляной кислоты к
анализируемой пробе выделяются пузырьки
газа (без запаха), которые проходя
через «известковую воду» (насыщенный
раствор Ca(ОН)2),
вызывают ее помутнение:
Если же
пропускать СО2 через «известковую
воду» достаточно долго, то осадок
СаСО3 растворяется из-за
перехода в кислую соль Са(НСО3)2.
Эта реакция осуществляется под землей,
где природная вода насыщена углекислым
газом, а при выходе раствора на поверхность
идет обратный процесс:
В промышленности СО2
получается как дополнительный
продукт при термическом разложении
известняка СаСО3.
6.5.4. Применение со2 и проблемы его утилизации
Углекислый газ применяют
достаточно широко. Для получения
газированных напитков и в производстве
соды; в качестве инертной среды; для
организации безопасных взрывов и тушения
пожаров (ибо в углекислом газе горят
только такие активные металлы, как
магний или алюминий).
В атмосфере СО2
лучше сохраняются овощи, а при их
выращивании в теплицах углекислый газ
является хорошим газовым удобрением,
и т.д. В виде же «сухого льда» СО2
используют для охлаждения продуктов и
рассеивания туманов.
С другой стороны,
из-за интенсивного сжигания топлива в
последние десятилетия содержание СО2
в атмосфере повышается (уже возросло с
0,03% до 0,06% в промышленных районах).
Это,
по мнению ряда ученых, приводит к
потеплению климата, результатом чего
может быть не только утрата части суши
(из-за таяния вечных льдов) и учащение
стихийных бедствий, но даже изменение
суточного вращения Земли (последствия
чего трудно даже предсказать). Так что
существует проблема связывания
СО2.
Ученые ищут способы,
которые позволили бы превращать
углекислый газ в ценные органические
вещества, как это делают растения,
благодаря наличию в них хлорофилла.
(Круговорот С в природе показан на
рисунок 9.) И одна из задач химии –
создание катализаторов, подобных
хлорофиллу, но достаточно дешевых.
Рис.9 Круговорот
углерода в природе
Отметим, что есть
водяные бактерии, которые превращают
углекислый газ в сахар, а сахар – в
нефть.
Подсчитали, что таким образом
1 га водоема может дать больше топлива
(а, значит, связать больше СО2), чем
1 га суши с самыми перспективными
растениями.
Так что может быть стоит
заняться разведением этих микробов. А
пока предлагается производственные
отходящие газы, содержащие СО2,
пропускать через раствор щелочи:
При этом
СО2 поглощается достаточно
полно, ибо равновесие (1) смещено
вправо. И одновременно получается ценный
продукт – питьевая сода.
Карбонаты и их
применение. Соли угольной кислоты
гораздо устойчивее к отщеплению СО2,
чем сама кислота, и все выделены в
свободном состоянии. Из средних
солей хорошо растворимы лишь карбонаты
ЩМ.
Причем не только карбонаты, но и
гидрокарбонаты ЩМ, гидролизуясь по
аниону, создавают щелочную среду.
Благодаря, в частности, этому, соли
натрия и калия, выпускаемые содовым
производством, находят широкое применение.
Например, питьевая
сода (NaHCO3) используется
в медицине (от изжоги).
В еще больших
масштабах применяется поташ К2СО3
и особенно (как более дешевый продукт)
кальцинированная сода Na2CO3
(получается кальцинацией, т.е.
прокаливанием, NaHCO3):
в качестве стиральных порошков, для
изготовления стекла, мыла и др. Поэтому
содовое производство – одно из крупнейших
в химической промышленности.
На практике широко
используются и малорастворимые
природные карбонаты кальция: известняк
(для получения СаО и СО2 и в качестве
строительного камня), мрамор (как
облицовочная плитка), мел (для
побелки) и др.
Источник: https://studfile.net/preview/7300528/page:23/
Кислородные соединения углерода: строение молекул, физические и химические свойства. Медико- биологическое значение углерода и его соединений
Кислородные соединения углерода Углерод образует два оксида — СО и С02.
Оксид углерода(II) СО — бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, так как он очень ядовит.
Попадая при дыхании в кровь, быстро соединяется с гемоглобином, образуя прочное соединение карбоксигемоглобин (объясните происхождение этого термина), лишая тем самым возможности гемоглобин переносить кислород. При вдыхании воздуха, содержащего 0,1% СО, человек может внезапно потерять сознание и умереть.
Угарный газ образуется при неполном сгорании топлива (напишите уравнение соответствующей химической реакции), вот почему так опасно преждевременное закрывание дымоходов.
Оксид СО относят, как вы уже знаете, к несолеобразующим оксидам, так как, будучи оксидом неметалла, он должен реагировать со щелочами и основными оксидами, однако этого не наблюдается.
СО — хороший восстановитель. Он сгорает в кислороде, образуя углекислый газ: 2СО + 02 = 2С02
Оксид углерода(II) способен отнимать кислород у оксидов металлов, т. е. восстанавливать металлы из их оксидов:
Fе203 + ЗСО = 2Fе + ЗС02
Именно это свойство оксида углерода(II) используется в металлургии при выплавке чугуна.
Оксид углерода(IV) С02 — широко известный под названием углекислый газ — бесцветный, не имеющий запаха газ. Он примерно в полтора раза тяжелее воздуха. При обычных условиях в 1 объеме воды растворяется 1 объем углекислого газа.
При давлении примерно 60 атм углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твердую снегообразную массу, которую в промышленности прессуют, — это известный вам сухой лед, который применяется для хранения пищевых продуктов.
С02 — это типичный кислотный оксид: взаимодействует со щелочами (например, вызывает помутнение известковой воды), с основными оксидами и водой.
Он не горит и не поддерживает горения и потому применяется для тушения пожаров. Однако магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи:
- С02 + 2Мg = 2МgO + С
- Углекислый газ получают, действуя на соли угольной кислоты — карбонаты растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии на мел или мрамор соляной кислоты:
- СаС03 + 2НСl = СаСl2 + Н20 + С02
- В промышленности большие количества углекислого газа получают обжигом известняка: СаС03 = СаО + СO2
- Углекислый газ, кроме уже названной области применения, используют также для изготовления шипучих напитков и для получения соды.
- При растворении оксида углерода(IV) в воде образуется угольная кислота Н2С03, которая очень нестойкая и легко разлагается на исходные компоненты — углекислый газ и воду:
- CO2 + Н20 —> H2CO3
- Равновесие этой реакции смещено влево.
Как двухосновная кислота она образует два ряда солей: средние — карбонаты и кислые — гидрокарбонаты. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Кислые соли, как правило, растворимы в воде.
- При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Так, если через известковую воду пропускать углекислый газ, то она сначала помутнеет из-за выпавшего в осадок нерастворимого в воде карбоната кальция, однако при дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция:
- СаС03 + Н20 + С02 = Са(НС03)2
- Именно наличием этой соли и объясняется временная жесткость воды. При нагревании растворимый гидрокарбонат кальция снова превращается в нерастворимый карбонат:
- Са(НС03)2 = СаС03 + Н20 + С02
Эта реакция приводит к образованию накипи на стенках котлов, труб парового отопления и домашних чайников, а в природе в результате этой реакции формируются в пещерах свисающие вниз.
Другие соли кальция и магния, в частности хлориды и сульфаты, придают воде постоянную жесткость. Кипячением постоянную жесткость воды устранить нельзя.
Приходится использовать другой карбонат — соду Nа2С03, которая переводит эти ионы Са2+ в осадок, например:
- СаСl2 + Na2С03 = СаС034- + 2NаСl
- Соду можно использовать и для устранения временной жесткости воды.
- Карбонаты и гидрокарбонаты можно обнаружить с помощью растворов кислот: при действии на них кислот наблюдается характерное «вскипание» из-за выделяющегося углекислого газа:
CO + 2Н+ = Н20 + С02 НС03 + Н+ = Н20 + С02
Эта реакция является качественной реакцией на соли угольной кислоты.
Углерод, обладая исключительной способностью образовывать вместе с другими элементами длинные цепи атомов, дает многочисленное разнообразие органических соединений. Благодаря углероду возникло все богатство и разнообразие видов растений и животных.
В настоящее время широко обсуждаются вопросы загрязнения биосферы диоксидом углерода, поступающим из продуктов сжигания топлива. Увеличение концентрации CO2 в воздухе на 20% может вызвать глобальное повышение температуры на Земле на 4-50С – «Парниковый эффект».
Особенно вредное действие на организм человека оказывает оксид углерода (II) или угарный газ. При вдыхании оксид углерода (II) попадает в кровь и образует прочное соединение с гемоглобином – карбоксигемоглобин. При этом гемоглобин теряет способность связывать кислород, что и является причиной смерти при тяжелых отравлениях угарным газом.
В медицине применяется:
1. Активированный уголь (карболен); адсорбент при отравлениях алкалоидами, солями тяжелых металлов и т.д.; находит широкое применение в хемосорбции.
2. Гидрокарбонат натрия NaHCO3 ; понижает кислотность желудочного сока; водные растворы используются для полосканий и примочек.
Источник: https://infopedia.su/11×9556.html




