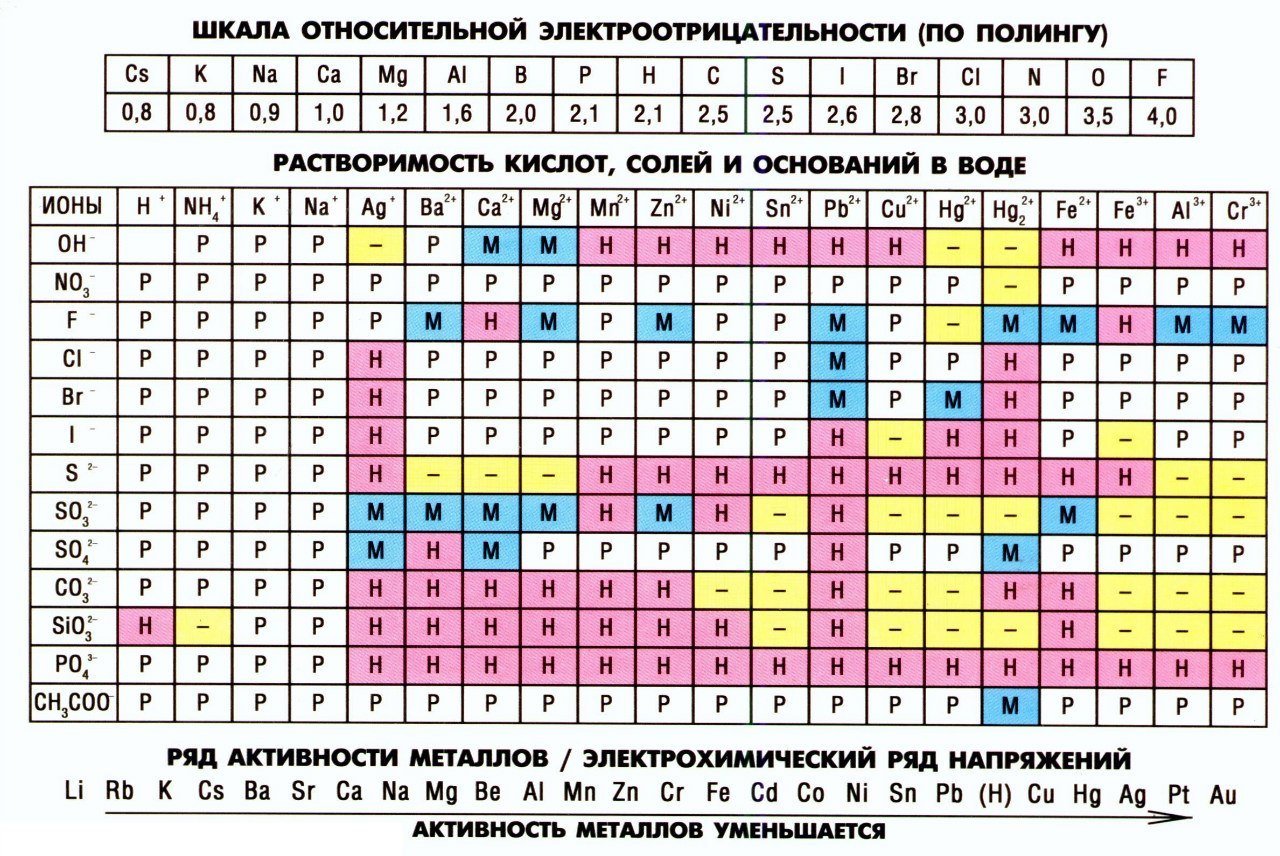
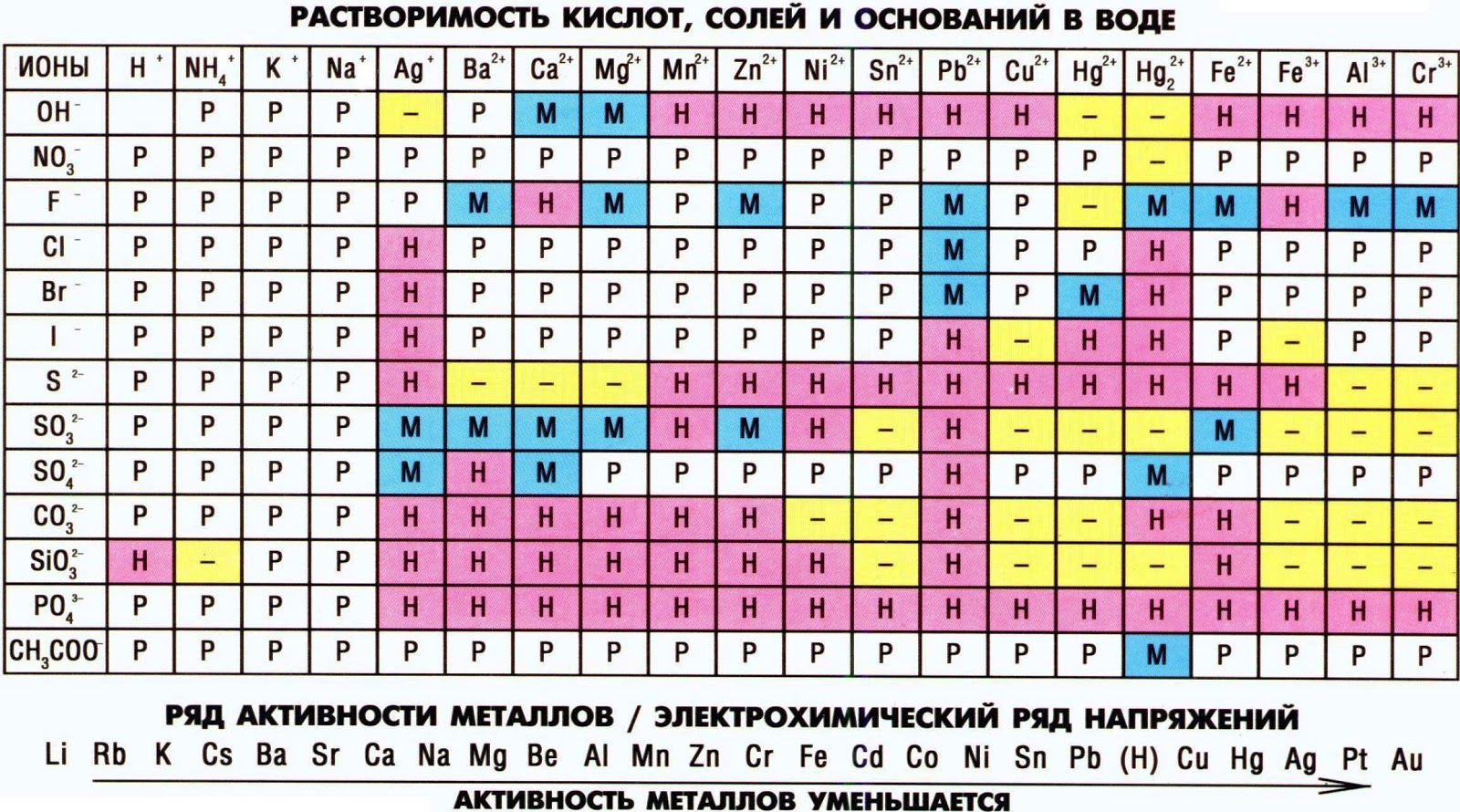
Электроотрицательность (ЭО) — это способность атомов притягивать электроны при связывании с другими атомами.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s2 2p5) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.

Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
 Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na—Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Степень окисления
Степень окисления (СО) — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.


При образовании ионной связи происходит переход электрона от менее электроотрицательного атома к более электроотрицательному, атомы теряет свою электронейтральность, превращается в ионы. возникают целочисленные заряды.
При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl).
Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.


На этом рисунке изображены степени окисления, характерные для первых 20 элементов.
Обратите внимание. Высшая СО как правило равна номеру группы в таблице Менделеева.
У металлов главных подгрупп – одна характерная СО, у неметаллов, как правило, наблюдается разброс СО.
Поэтому неметаллы образуют большое количество соединений и обладают более «разнообразными» свойствами, по сравнению с металлами.
Примеры определения степени окисления
- Определим степени окисления хлора в соединениях:

- Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.

Здесь удобно пользоваться следующим приемом:- 1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
Валентность
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов образовывать определённое число химических связей с атомами других элементов.

В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей. Если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами, т.е.
его валентность будет равна n + m. При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния.
Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4— и NH4+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
В ряде случаев, валентность может численно совпадать со степенью окисления, но ни коим образом они не тождественны друг другу. Например, в молекулах N2 и CO реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления азота равна 0, углерода +2, кислорода −2.

В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
Ещё несколько «коварных» вопросов, в которых часто делают ошибки.
Источник: http://himege.ru/stepen-okisleniya-valentnost/
Как определить возможные степени окисления элемента
- Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
- Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).
- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.
- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
- Валентность элементов не имеет знака.
- У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
- У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2H4 (гидразин) — валентность азота равна III, а степень окисления равна +2.
- H2 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
Кпп ваз 2110 характеристики
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение.
Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных.
Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.

Элементы с постоянной степенью окисления
- Степень окисления = +№ группы
- I группа главная подгруппа степень окисления +1.
- II группа главная подгруппа степень окисления +2.
- III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)H4(-), B2(+3)H6(-), B(+3)H3(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)H2(-).
- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например H2(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.
- Низшая степень окисления = +№ группы – 8.
- Промежуточная степень окисления = +№ группы – 2.
Пример
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Датчик положения коленвала приора 16 клапанов
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.

Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям.
Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.

Содержание
- Что такое степень окисления
- Как определить
- Что мы узнали?
- Оценка доклада
Бонус
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.
Рис. 1. Ряд электроотрицательности.
Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
- Существует таблица, в которой указаны все возможные степени окисления элементов.
- Название
- Символ
- Степень окисления
Из-за блокировщика рекламы некоторые функции на сайте могут работать некорректно! Пожалуйста, отключите блокировщик рекламы на этом сайте

Вам нужны консультации по Химии по Skype? Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Степень окисления
С целью объективного сравнения значений электроотрицательности атомов при расчёте степеней окисления, в 2013 году IUPAC дал рекомендацию использовать шкалу Аллена.
* Так, например, по шкале Аллена электроотрицательность азота 3,066, а хлора 2,869.


Представим, что обе связи являются не ковалентными, а ионными. Если бы они были ионными, то с каждого атома водорода на более электроотрицательный атом кислорода перешло бы по одному электрону. Обозначим эти переходы синими стрелками.
*В этом примере, стрелка служит для наглядной иллюстрации полного перехода электронов, а не для иллюстрации индуктивного эффекта.

Легко заметить, что число стрелок показывает количество перешедших электронов, а их направление — направление перехода электронов.
Не крутится замок зажигания
На атом кислорода направлено две стрелки, это значит, что к атому кислорода переходит два электрона: 0 + (-2) = -2. На атоме кислорода образуется заряд равный -2. Это и есть степень окисления кислорода в молекуле воды.
С каждого атома водорода уходит по одному электрону: 0 — (-1) = +1. Значит, атомы водорода имеют степень окисления равную +1.

Сумма степеней окисления всегда равняется общему заряду частицы.
Например, сумма степеней окисления в молекуле воды равна: +1(2) + (-2) = 0. Молекула — электронейтральная частица.
- Если мы вычисляем степени окисления в ионе, то сумма степеней окисления, соответственно, равна его заряду.
- Например, S -2 — атом серы в степени окисления -2, S 2- — анион серы с зарядом -2.
- S +6 O -2 4 2- — значения степеней окисления атомов в сульфат-анионе (заряд иона выделен зелёным цветом).
Теперь рассмотрим случай, когда соединение имеет смешанные связи: Na2SO4. Связь между сульфат-анионом и катионами натрия — ионная, связи между атомом серы и атомами кислорода в сульфат-ионе — ковалентные полярные. Запишем графическую формулу сульфата натрия, а стрелками укажем направление перехода электронов.
*Структурная формула отображает порядок ковалентных связей в частице (молекуле, ионе, радикале). Структурные формулы применяют только для частиц с ковалентными связями. Для частиц с ионными связями понятие структурной формулы не имеет смысла. Если в частице имеются ионные связи, то применяют графическую формулу.
- Видим, что от центрального атома серы уходит шесть электронов, значит степень окисления серы 0 — (-6) = +6.
- Концевые атомы кислорода принимают по два электрона, значит их степени окисления 0 + (-2) = -2
- Мостиковые атомы кислорода принимают по два электрона, их степень окисления равна -2.
Степень окисления ионов натрия равна их заряду, а т.е. +1.
Определим степени окисления элементов в надпероксиде (супероксиде) калия. Для этого составим графическую формулу супероксида калия, стрелочкой покажем перераспределение электронов. Связь O-O является ковалентной неполярной, поэтому в ней перераспределение электронов не указывается.
* Надпероксид-анион является ион-радикалом. Формальный заряд одного атома кислорода равен -1, а другого, с неспаренным электроном, 0.
- Значения среднеарифметических степеней окисления обычно указывают в брутто-формулах или формульных единицах, чтобы показать что сумма степеней окисления равна общему заряду системы.
- Для случая с надпероксидом: +1 + 2(-0,5) = 0
Кислород — элемент VIА — группы, следовательно в его атоме 6 валентных электронов. Представим, что в молекуле воды связи ионные, в этом случае атом кислорода получил бы октет электронов.
- Степень окисления кислорода соответственно равна: 6 — 8 = -2.
- А атомов водорода: 1 — 0 = +1
- Любой химический элемент характеризуется высшей и низшей степенями окисления.
- Низшая степень окисления — это заряд, который приобретает атом в результате приёма максимального количества электронов на внешний электронный слой.
Большинство неметаллов главных подгрупп старается заполнить свой внешний электронный слой до восьми электронов, после этого атом приобретает устойчивую конфигурацию (правило октета). Поэтому, чтобы определить низшую степень окисления, необходимо понять сколько атому не хватает валентных электронов до октета.
Например, азот — элемент VА группы, это значит, что в атоме азота пять валентных электронов. До октета атому азота не хватает трёх электронов. Значит низшая степень окисления азота равна: 0 + (-3) = -3
Источник: https://ProDemio.ru/kak-opredelit-vozmozhnye-stepeni-okislenija/
Степень окисления и валентность: расчет, таблица, задания

Степень окисления ― это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна. В этом материале мы рассмотрим степень окисления и валентность химических элементов.
Расчет степени окисления
Существуют следующие правила для определения степеней окисления (СО):
- CO любого элемента в простом веществе (Н2, Al, S) равна 0.
- Сумма всех CO атомов в молекуле равна 0.
- Наиболее электроотрицательные элементы в соединении имеют отрицательные CO, а атомы элементов с меньшей электроотрицательностью ― положительные.
Например, азот более электроотрицательный, чем водород, поэтому он имеет заряд –3, а водород +1. В молекуле три атома водорода, каждый дает заряд +1, а в сумме +3, молекула сама нейтральна, заряд = 0.

- Максимальная CO любого элемента равна номеру группы (исключения: медь, серебро, золото, фтор, кислород), а минимальная отрицательная равна N – 8, где N ― номер группы.
- Некоторые элементы имеют постоянные CO, их нужно знать, они помогут вычислить СО других элементов, имеющих несколько значений СО.
- щелочных металлов +1;
- Mg, Be и щелочноземельных металлов +2;
- алюминия +3;
- фтора –1;
- водорода +1 (кроме гидридов NaH, CaH2 и др., где степень окисления водорода ―1);
- кислорода –2 (кроме OF2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода ―1).
Пример расчета степеней окисления в сложной молекуле (серная кислота):
Изображаем структурную формулу молекулы, черточка ― это связь, пара электронов.

Из черточки рисуем стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть ― нет перехода электронов.

У кислорода и водорода известные степени окисления: у кислорода -2, у водорода +1. Степень окисления серы принимаем за X.

- Составляем уравнение (складываем все степени окисления и приравниваем к 0, так как молекула является нейтральной)
- +1 + (+1) + (-2) + (-2) + (-2) + (-2) + Х = 0
- X = +6
Валентность — что это?
Валентность ― способность атомов образовывать определенное количество связей с другими атомами.
Валентные возможности атомов определяются:
- числом неспаренных электронов (одноэлектронных орбиталей);
- наличием свободных орбиталей;
- наличием неподеленных пар электронов.
- Если нарисовать структурную формулу и посчитать количество черточек (связей) мы узнаем валентность.
- Для примера разберем молекулу серной кислоты:
Взаимосвязь между высшей валентностью элемента и числом неспаренных электронов
| № группы | I | II | III | IV | V | VI | VII | I | II | III | IV | V | VI | VII |
| Элементы | Li | Be | B | C | N | O | F | Na | Mg | Al | Si | P | S | Cl |
| Число неспаренных электронов в основном состоянии |
1 | 1 | 2 | 3 | 2 | 1 | 1 | 1 | 2 | 3 | 2 | 1 | ||
| Число неспаренных электронов в возбужденном состоянии |
— | 2 | 3 | 4 | — | — | — | — | 2 | 3 | 4 | 5 | 4 6 |
3 5 7 |
| Высшая валентность | I | II | III | IV | III | II | I | I | II | III | IV | V | IV | VII |
Рассмотрим атом серы, какие валентности он может иметь.
Для атома серы переход в возбужденное состояние возможен. В процессе возбуждения электроны атома серы переходят с 3s- и 3p-подуровней на свободные орбитали 3d-подуровня:

Примеры ЕГЭ на расчет степени окисления и валентность
Задание 1
- Ряд элементов: 1) Na 2) Cl 3) Si 4) Mn 5) Cr
- Из числа указанных в ряду элементов выберите два элемента, которые
в соединениях могут проявлять валентность I. - Ответ: 12
- Решение: Na – находится в первой группе, значит он может проявлять валентность только 1, а Cl находится в VII группе, то он может проявлять различные валентности, но самое главное, что в соединении HCl он проявляет валентность равную I.
Задание 2
Ряд элементов: 1) Al 2)S 3)Cr 4)P 5)Si
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в высших оксидах равна +6. Запишите в поле ответа номера выбранных элементов.
Ответ: 23
Решение: Нам нужно найти те элементы, которые находятся в VI группе – это сера и хром, именно их мы и выбираем.
Задание 3
Ряд элементов: 1) Al 2) Si 3)Mg 4) C 5) N
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления. Запишите в поле ответа номера выбранных элементов.
Ответ: 13
Решение: Что значит найти постоянную степень окисления? Это значит то, что вещество должно проявлять только одну степень окисления. Например алюминий всегда проявляет степень окисления +3, а магний только +2.
Задание 4
Ряд элементов: 1) B 2) Al 3) F 4) Fe 5) N
Из числа указанных в ряду элементов выберите два элемента, которые проявляют в оксидах степень окисления как +2, так и +3. Запишите в поле ответа номера выбранных элементов.
Ответ: 45
Решение: Мы видим степени окисления +2 и +3, это однозначно железо, потому что у него есть оксиды: FeO и Fe2O3. Азот может принимать любую степень окисления от -3 до +5, поэтому этот вариант нам тоже подходит. NO и N2O3
Задание 5
- Ряд элементов: 1) S 2) Na 3) Al 4) Si 5) Mg
- Из числа указанных в ряду элементов выберите два элемента, которые в соединении с кислородом проявляют степень окисления +4.
- Ответ: 14
Решение: Соединения с кислородом в степени окисления +4 имеют общий вид: ЭO2.
Есть такой оксид, как SiO2 и SO2, значит эти элементы могут проявлять степень окисления +4 с кислородом.
Источник: https://novstudent.ru/stepen-okisleniya-i-valentnost/
Степень окисления
Степень окисления
При изучении ионной и ковалентной полярной химической связи вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют би парными (от лат. би — «два») или двухэлементными.
Вспомним типичные бпнарные соединения, которые мы привели в качестве примера для рассмотрения механизмов образования ионной и ковалентноЙ полярной химической связи: NaHl — хлорид натрия и НСl — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом -1. а атом хлора принял электрон и превратился в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так: ![]()
В молекуле же НСl связь образуется за счет спаривания не-спаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком атома хлора:

При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора:

Такие условные заряды называются степенью окисления. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:
![]()
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов пли к которым смещены общие электронные пары, то есть атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления -1 во всех соединениях. Кислород, второй после фтора по значению элекгроотрицательности элемент, почти всегда имеет степень окисления -2, кроме соединений со фтором, например:
![]()
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, то есть атомы менее электроотрицательных элементов. Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
I группы во всех соединениях степень окисления равна +1,II группы равна +2. III группы — +3, например:
В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора в соединении Сl2О2. Обозначим степень окисления -2кислорода: Сl2О2. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) • 7 =14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора:
(+14):2 = +7.
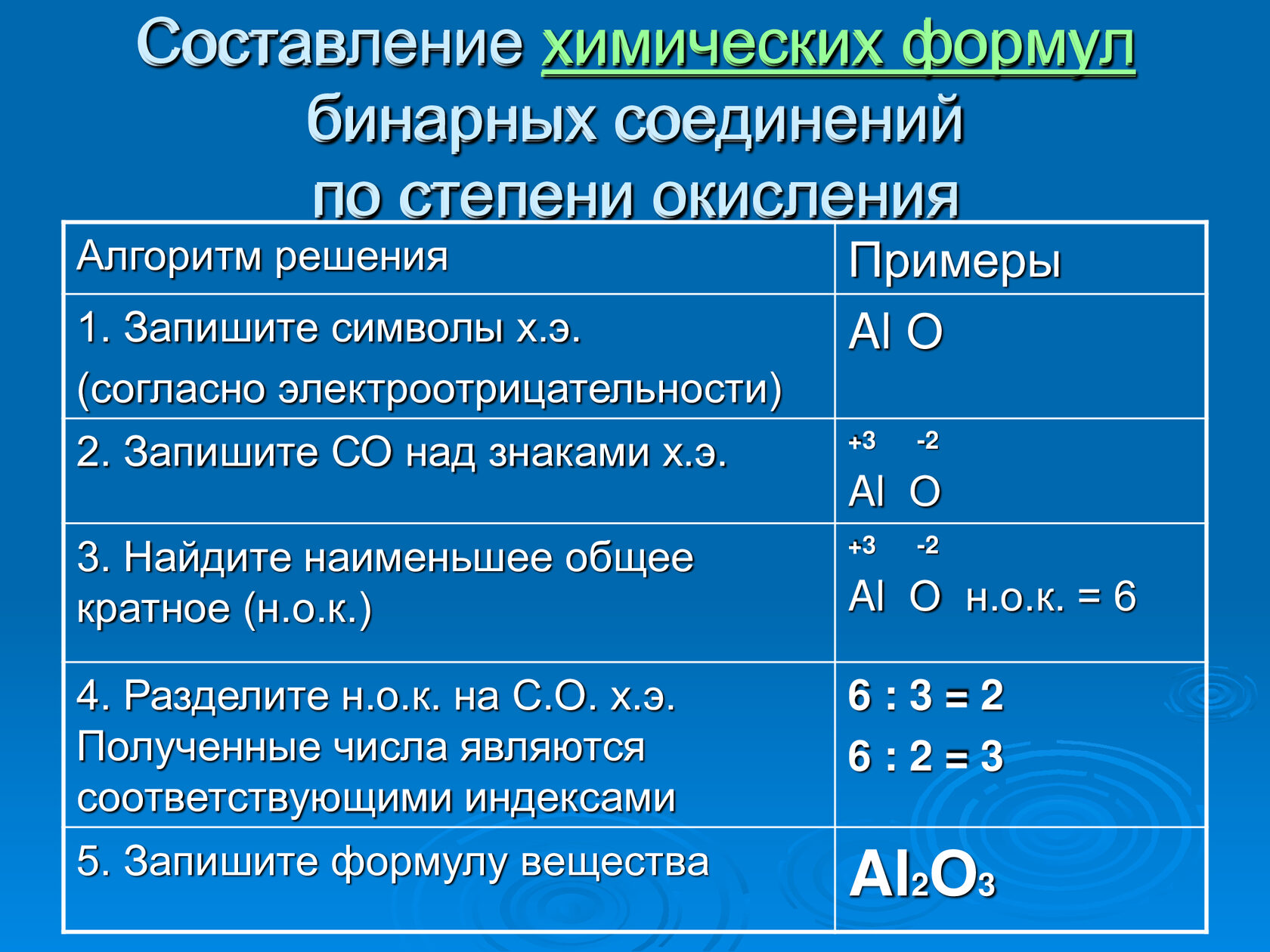
Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия н углерода рядом АlС, причем сначала знак алюминия, так как это металл. Определим по таблице элементов Менделеева число внешних электронов: у Аl — 3 электрона, у С — 4. Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до «заветной восьмерки» 4 электрона и получит при этом степень окисления -4.
Запишем эти значения в формулу: АlС, и найдем наименьшее общее кратное для них, оно равно 12. Затем рассчитаем индексы:
Знать степени окисления элементов необходимо и для того, чтобы уметь правильно называть химическое соединение.
Названия бинарных соединений состоят из двух слов — названий образующих их химических элементов. Первое слово обозначает электроотрицательную часть соединения — неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть — металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже.
Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которая ставится в конце.

Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А.Фурктуа, Л.Гитоном и К.Бертолле в 1785г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность ученых рядных стран и издает рекомендации по номенклятурс веществ и терминологии, используемой к химии.
Источник: http://chemistrykz.blogspot.com/p/blog-page_7512.html
1.3.2 Электроотрицательность. Степень окисления и валентность химических элементов
- Видеоурок 1: Электроотрицательность
- Видеоурок 2: Степень окисления химических элементов
- Видеоурок 3: Валентность. Определение валентности
- Лекция: Электроотрицательность. Степень окисления и валентность химических элементов
- Электроотрицательность
- Электроотрицательность – это способность атомов притягивать к себе электроны других атомов для соединения с ними.
Судить об электроотрицательности того или иного химического элемента легко по таблице. Вспомните, на одном из наших уроков было сказано о том, что она возрастает при движении слева направо по периодам в таблице Менделеева и с перемещением снизу вверх по группам.

К примеру, дано задание определить какой элемент из предложенного ряда наиболее электроотрицателен: C (углерод), N (азот), O (кислород), S (сера)? Смотрим по таблице и находим, что это О, потому что он правее и выше остальных.
Какие же факторы оказывают влияние на электроотрицательность? Это:
- Радиус атома, чем он меньше, тем электроотрицательность выше.
- Заполненность валентной оболочки электронами, чем их больше, тем выше электроотрицательность.
Из всех химических элементов фтор является наиболее электроотрицательным, потому как у него малый атомный радиус и на валентной оболочке 7 электронов.
К элементам, имеющим низкую электроотрицательность, относятся щелочные и щелочноземельные металлы. У них большие радиусы и очень мало электронов на внешней оболочке.
Значения электроотрицательности атома не могут быть постоянными, т.к.
она зависит от многих факторов в числе которых перечисленные выше, а также степень окисления, которая может быть различной у одного и того же элемента. Поэтому принято говорить об относительности значений электроотрицательности.
Вы можете пользоваться следующими шкалами:


Значения электроотрицательности вам понадобятся при записи формул бинарных соединений, состоящих из двух элементов. К примеру, формула оксида меди Cu2O — первым элементом следует записывать тот, чья электроотрицательность ниже.
В момент образования химической связи если разница электроотрицательности между элементами больше 2,0 образуется ковалентная полярная связь, если меньше, ионная.
Степень окисления
Степень окисления (СО) – это условный или реальный заряд атома в соединении: условный – если связь ковалентная полярная, реальный – если связь ионная.
Атом приобретает положительный заряд при отдаче электронов, а отрицательный заряд – при принятии электронов.Когда образуется ионная связь, происходит определенный переход электрона, от менее электроотрицательного атома к атому большей электроотрицательности.
Так же, в данном процессе, атомы всегда теряют электронейтральность и впоследствии превращаются в ионы. Так же образуются целочисленные заряды.
При образовании ковалентной полярной связи, электрон переходит только частично, поэтому возникают частичные заряды.
Степени окисления записываются над символами со знаком «+»/«-». Есть и промежуточные СО.
Максимальная СО элемента положительная и равна № группы, а минимальная отрицательная для металлов равна нулю, для неметаллов = (№группы – 8).
Элементы с максимальной СО только принимают электроны, а с минимальной, только отдают. Элементы же, имеющие промежуточные СО могут и отдавать и принимать электроны.
Рассмотрим некоторые правила, которыми стоит руководствоваться для определения СО:
- СО всех простых веществ равна нулю.
- Равна нулю и сумма всех СО атомов в молекуле, так как любая молекула электронейтральна.
- В соединениях с ковалентной неполярной связью СО равна нулю (О20), а с ионной связью равна зарядам ионов (Na+Cl- СО натрия +1, хлора -1). СО элементов соединений с ковалентной полярной связью рассматриваются как с ионной связью (H :Cl = H+Cl-, значит H+1Cl-1).
- Элементы в соединении, имеющие наибольшую электроотрицательность, имеют отрицательные степени окисления, если наименьшую положительные. Исходя из этого можно сделать вывод, что металлы имеют только «+» степень окисления.
Постоянные степени окисления:
- Щелочные металлы +1.
- Все металлы второй группы +2. Исключение: Hg +1, +2.
- Алюминий +3.
- Фтор –1.
- Водород +1. Исключение: гидриды активных металлов NaH, CaH2 и др., где степень окисления водорода равна –1.
- Кислород –2. Исключение: F2-1O+2 и пероксиды, которые содержат группу –О–О–, в которой степень окисления кислорода равна –1.
Когда образуется ионная связь, происходит определенный переход электрона, от менее электроотрицательного атома к атому большей электроотрицательности.
Так же, в данном процессе, атомы всегда теряют электронейтральность и впоследствии превращаются в ионы. Так же образуются целочисленные заряды.
При образовании ковалентной полярной связи, электрон переходит только частично, поэтому возникают частичные заряды.
Валентность
Валентность – это способность атомов образовать n — число химических связей с атомами других элементов.
А еще валентность – это способность атома удержать другие атомы возле себя. Как вам известно из школьного курса химии, разные атомы связываются друг с другом электронами внешнего энергетического уровня. Неспаренный электрон ищет для себя пару у другого атома. Эти электроны внешнего уровня называются валентными.
Значит валентность можно определить и как число электронных пар, связывающих атомы друг с другом. Посмотрите структурную формулу воды: Н – О – Н. Каждая черточка – это электронная пара, значит показывает валентность, т.е. кислород здесь имеет две черточки, значит он двухвалентен, от молекул водорода исходят по одной черточке, значит водород одновалентен.
При записи валентность обозначается римскими цифрами: О (II), Н (I). Может указываться и над элементом.
Валентность бывает постоянной либо переменной. К примеру, у щелочей металлов она постоянна и равняется I. А вот хлор в различных соединениях проявляет валентности I, III, V, VII.
Как определить валентность элемента?
- Вновь обратимся к Периодической таблице. Постоянная валентность у металлов главных подгрупп, так металлы первой группы имеют валентность I, второй II. А у металлов побочных подгрупп валентность переменная. Также она переменная и у неметаллов. Высшая валентность атома равна № группы, низшая равна = №группы — 8. Знакомая формулировка. Не означает ли это то, что валентность совпадает со степенью окисления. Помните, валентность может совпадать со степенью окисления, но данные показатели не тождественны друг другу. Валентность не может иметь знака =/-, а также не может быть нулевой.
- Второй способ определения валентности по химической формуле, если известна постоянная валентность одного из элементов. Например, возьмем формулу оксида меди: CuО. Валентность кислорода II. Видим, что на один атом кислорода в данной формуле приходится один атом меди, значит и валентность меди равна II. А теперь возьмем формулу посложнее: Fe2O3. Валентность атома кислорода равна II. Таких атомов здесь три, умножаем 2*3 =6. Получили, что на два атома железа приходится 6 валентностей. Узнаем валентность одного атома железа: 6:2=3. Значит валентность железа равна III.
- Кроме того, когда необходимо оценить «максимальную валентность», всегда следует исходить из электронной конфигурации, которая имеется в «возбужденном» состоянии.
| Предыдущий урок | Следующий урок |
Источник: https://cknow.ru/knowbase/752-132-elektrootricatelnost-stepen-okisleniya-i-valentnost-himicheskih-elementov.html
Окисление состояние — Oxidation state
Степень окисления , иногда называют окислительным числом , характеризует степень окисления (потеря электронов ) в качестве атома в химическом соединении .
Концептуально, степень окисления, которое может быть положительным, отрицательным или равно нулю, это гипотетический заряд , что атом будет иметь , если все связи с атомами различных элементов были на 100% ионной , без ковалентной составляющей. Это никогда не совсем верно для реальных связей.
Термин окисление впервые было использовано Лавуазием для обозначения реакции вещества с кислородом. Намного позже, стало ясно , что вещество, при окисляется, теряет электроны, а смысл был расширен , чтобы включить другие реакции , в которых теряются электроны, независимо от того, идет ли речь кислород.
Окислительные состояния , как правило , представлен целыми числами , которые могут быть положительными, нулевым или отрицательным. В некоторых случаях, средняя степень окисления элемента представляет собой фракцию, например, 8 / 3 для железа в магнетит ( Fe3 вывода4 ).
Наибольшее известное состояние окислениякак сообщается, в +9tetroxoiridium (IX)катиона (УМС + 4 ). Он предсказалчто даже состояние +10 окисления может быть достигнутопомощьюплатиныв катиона tetroxoplatinum (Х) (PtO 2+ 4 ).
Низкая степень окисления -4, какдляуглеродавметанеили дляхромав [Cr (CO)4]4-.
Увеличение степени окисления атома, за счет химической реакции, известен как окисление; уменьшение степени окисления известно как сокращения . Такие реакции включают формальный перенос электронов: чистый выигрыш в электронах , находящихся сокращение, и чистую потерю электронов , находящихся окисление. Для чистых элементов, степень окисления равна нулю.
Степень окисления атома не представляет «реальный» заряд атома, или любой другой реальной атомной собственности. Это особенно верно в отношении состояний высокой степени окисления, где энергия ионизации требуется для получения умножения положительного иона намного больше , чем энергия , доступной в химических реакциях.
Кроме того, состояние окисления атомов в данном соединении может изменяться в зависимости от выбора электроотрицательности шкалы , используемой при их расчете. Таким образом, степень окисления атома в соединении чисто формализм. Тем не менее важно в понимании номенклатурных конвенций неорганических соединений.
Кроме того , ряд наблюдений , касающихся химических реакций может быть объяснено на базовом уровне в терминах состояний окисления.
В неорганической номенклатуре, степень окисления представлена римская цифра помещенной после имени элемента внутри круглых скобок или в виде верхнего индекса после символа элемента.
Июпак определение степени окисления
состояние Окисление
А «Комплексное определение состояния Термина окисления (Рекомендация ИЮПАКА 2016 год)» было опубликовано со свободным доступом. Это перегонка из IUPAC технического доклада «К всеобъемлющему определению степени окисления» от 2014 г. В настоящее время IUPAC Gold Book определением степени окисления является:
Окисление состояние атома является заряд этого атома после ионного приближения его гетероядерными связей …
а термин степень окисления практически синонимами.
Основополагающий принцип заключается в том , что ионные знаки для двух атомов, которые связаны выводятся из распределения электронов в МО ЛКАО модели.
В связи между двумя различными элементами, электроны , облигации назначаются ее основной вклад атомной; в связи между двумя атомами одного и того же элемента, электроны разделены поровну.
При практическом использовании, знак ионного приближения следует шестигранник электроотрицательности :
| H 2,300 | Он 4,160 | ||||||||||||||||
| Li 0,912 | Будьте 1,576 | B 2,051 | C 2,544 | N 3,066 | O 3,610 | F 4,193 | Ne 4,787 | ||||||||||
| Na 0,869 | Mg 1,293 | Al 1,613 | Si , 1,916 | P 2,253 | S 2,589 | Cl 2,869 | Ar 3,242 | ||||||||||
| K 0,734 | Ca 1,034 | Sc 1,19 | Ti 1,38 | V 1.53 | Cr 1,65 | Mn 1,75 | Fe 1,80 | Co 1,84 | Ni 1,88 | Cu 1,85 | Zn 1,59 | Ga 1,756 | Ge 1,994 | Как 2.211 | Se 2,424 | Br 2,685 | Kr 2,966 |
| Rb 0,706 | Sr 0,963 | Y 1,12 | Zr 1,32 | Nb 1,41 | Mo 1,47 | Tc 1,51 | Ru 1,54 | резус — 1,56 | Pd 1,58 | Ag 1,87 | Cd 1,52 | В 1.656 | Sn 1,824 | Sb 1,984 | Te 2,158 | Я 2,359 | Xe 2,582 |
| Cs 0,659 | Ba 0,881 | Lu 1,09 | Hf 1,16 | Та 1,34 | W 1.47 | Re 1,60 | Os 1,65 | Ir 1,68 | Pt 1,72 | Au 1,92 | Hg 1,76 | Tl 1,789 | Pb 1,854 | Bi 2,01 | По 2,19 | В 2.39 | Rn 2,60 |
| Fr 0,67 | Ra 0,89 |
Источник: https://ru.qwe.wiki/wiki/Oxidation_state




