Углеводороды ряда метана при обыкновенной температуре химически весьма инертны, почему они и получили название парафинов (от латинских слов parum affinis — обладающий малым сродством).
С большинством химических реагентов эти углеводороды в указанных условиях или вовсе не реагируют, или реагируют чрезвычайно медленно.
При сравнительно невысоких температурах протекает лишь небольшое число реакций, при которых происходит замена атомов водорода на различные атомы и группы (реакции металеп-cuu). Эти реакции ведут к получению производных соответствующих углеводородов.
К реакциям присоединения парафины вообще неспособны в силу насыщенности всех связей атомов углерода.
1. Действие галогенов
Важной реакцией парафиновых углеводородов является взаимодействие их с галоидами На свету эти углеводороды могут последовательно замещать атомы водорода на атомы галоида, например:

При этих реакциях хлор действует энергичнее других галоидов. Труднее всего реагирует иод, и притом реакция не идет до конца, так как, например, при взаимодействии метана с йодом образуется йодистый водород, реагирующий с йодистым метилом с образованием метана и иода (обратимая реакция):
![]()
Чтобы реакция дошла до конца, необходимо образующийся йодистый водород все время удалять из сферы реакции (па-пример, добавлением окиси ртути или йодноватой кислоты).
2. Действие азотной кислоты
Азотная кислота при обыкновенной температуре почти не действует на парафиновые углеводороды; при нагревании же действует главным образом как окислитель. Однако, как нашел М. И.
Коновалов (1889), при нагревании азотная кислота действует отчасти и «нитрующим» образом; особенно хорошо идет реакция нитрования со слабой азотной кислотой при нагревании и повышенном давлении.
Реакция нитрования выражается уравнением
![]()
т. е. один из атомов водорода заменяется на остаток NO2 (ни-трогруппа) и выделяется вода.
Особенности строения изомеров сильно отражаются на течении этой реакции, так как легче всего она ведет к замещению на нитрогруппу атома водорода в остатке СИ (имеющемся лишь в некоторых изомерах), менее легко замещается водород в группе СН2 и еще труднее — в остатке СН3.
Парафины довольно легко нитруются в газовой фазе при 150—475° С двуокисью азота или парами азотной кислоты; при этом происходит частично и. окисление. Нитрованием метана получается почти исключительно нитрометан:
![]()
Последующие гомологи дают смесь различных нитропарафинов вследствие попутно идущего расщепления. При нитровании этана получаются нитроэтан СН3—СН2—NO2 и нитрометан СН3—NO2. Из пропана образуется смесь нитропарафинов:

Из нормального бутана:

Нитрование парафинов в газовой фазе теперь осуществляется в промышленном масштабе.
3. Действие серной кислоты
Серная кислота при обыкновенной температуре не действует на парафины; при высокой температуре действует как окислитель. При слабом нагревании дымящая серная кислота может действовать на парафиновые углеводороды (особенно на углеводороды изострое-ния, содержащие группу СН), образуя сульфокислоту и воду (реакция сульфирования):

4. Одновременное действие сернистого ангидрида и кислорода
При совместном действии сернистого ангидрида и кислорода воздуха под влиянием ультрафиолетовых лучей или добавок перекисей парафиновые углеводороды, даже нормального строения, реагируют с образованием суль-фокислот (реакция сульфоокисления):

5. Одновременное действие сернистого ангидрида и хлора
При совместном действии сернистого ангидрида и хлора при освещении ультрафиолетовым излучением или под влиянием некоторых катализаторов происходит замещение атома водорода с образованием так называемых сульфохлори-дов (реакция сульфохлорирования):
![]()
Вместо смеси SO2 и Cl2 можно пользоваться хлористым сульфурилом.
6. Действие кислорода и окислителей
Кислород и окислители, даже такие сильные, как хромовая кислота и пер-манганат, при обыкновенной температуре почти не действуют на парафиновые углеводороды. При повышенной температуре сильные окислители медленно действуют на предельные углево-
дороды таким образом, что в каком-нибудь месте молекулы разрывается связь между атомами углерода и молекула распадается на отдельные осколки, окисляющиеся при этом в органические кислоты. Эти кислоты всегда содержат в молекуле меньшее число атомов углерода, чем исходный углеводород, т. е. реакции окисления являются всегда реакциями распада (расщепления) молекулы углеводорода.
Газообразный кислород при обыкновенной температуре воз-се или почти не действует на парафины. При высокой температуре углеводороды воспламеняются и горят, причем происходит полное разрушение органической молекулы, ведущее к образованию углекислого газа и воды.
Лишь сравнительно недавно было исследовано действие кислорода и воздуха на алканы (преимущественно твердые) при средних температурах, когда окисление протекает довольно энергично, но не приводит к воспламенению.
Оказалось, что и в этом случае происходит частичное расщепление молекул углеводородов с образованием кислородсодержащих веществ, главным образом органических кислот.
В настоящее время окисление смеси высших твердых предельных углеводородов — окисление парафина — проводится в крупных промышленных масштабах для получения жирных кислот.
В последнее время промышленное значение получает так называемое регулируемое (проводимое при сравнительно низких температурах) окисление кислородом или воздухом также и низших предельных углеводородов: метана, этана, пропана и бутана. При этом получаются смеси спиртов, альдегидов, ке-тонов и кислот, причем промежуточно образуются, очевидно, простейшие перекисные соединения. При окислении пропана, например, могут получаться следующие вещества:
Обычно окисление пропана в промышленных условиях проводят таким образом, чтобы получить возможно больше ацетальдегида.
7. Действие высоких температур
При высоких температурах все парафиновые углеводороды подвергаются более или менее глубокому распаду с разрывом связей С—С или С—Н.
При этом образуются продукты, состав которых зависит от условий термического воздействия (температура, давление, продолжительность нагревания) и от природы углеводорода.
Так как осуществление этич процессов в принципе несложно, а получающиеся продукты являются ценным топливом и важным сырьем для химической промышленности, этот путь использования парафиновых углеводородов интенсивно изучался и широко распространен.
Метан лучше всех других углеводородов выдерживает нагревание: он начинает заметно разлагаться лишь около 800° С. Важнейшим продуктом превращения метана является ацетилен, который получается с хорошим выходом только в специальных условиях. Одновременно получаются этилен к водород.
При понижении температуры содержание ацетилена в продуктах распада понижается, а этилена — увеличивается; понижение давления способствует увеличению выхода обоих углеводородов.
Выше 1600° С, а также при длительном нагревании до 800—1600° С метан распадается главным образом на углерод и водород.
Этан при температуре 575—1000е С распадается преимущественно на этилен, ацетилен и водород; при дальнейшем нагревании происходит обугливание и вместе с тем образование ароматических углеводородов.
Термический распад более сложных углеводородов происходит по-разному в зависимости от температуры.
Чем длиннее и разветвленнее углеродный скелет молекулы парафина, тем легче происходит термическое разложение.
Так, одинаковая степень термического распада достигается у пропана при 700— 800° С, а у бутана при 650—750° С. Следующие гомологи начинают распадаться при еще более низких температурах.
Химические реакции, происходящие при термическом распаде углеводородов, обычно называют крекингом (англ. — растрескивание, разламывание). Механизм процесса крекинга довольно сложен. Первичными продуктами реакции являются свободные радикалы, вступающие затем во взаимодействие между собой и с другими молекулами.
Конечными продуктами крекинга, проводимого при 450—550 °С, являются смеси более низкомолекулярных углеводородов (насыщенных, ненасыщенных и циклических).
При 550—650°С происходит более глубокий крекинг: получается много углистого остатка (кокса), простейших газообразных углеводородов (насыщенных и ненасыщенных), а также смесь жидких углеводородов, в которой преобладают ароматические углеводороды. При более длительном нагревании образуется больше циклических углеводородов и меньше ненасыщенных.
Выше 1000° С распад идет уже главным образом до углерода (кокс) и водорода. Крекинг высших углеводородов в атмосфере водорода, особенно под давлением и в присутствии катализаторов (например, окиси железа), приводит к смеси, в которой преобладают парафиновые углеводороды (Бергиус).
Предыдущая страница | Сдедующая страница | Содержание
Источник: http://www.xumuk.ru/organika/49.html
Предельные углеводороды. Свойства предельных углеводородов. Гомологический ряд углеводородов
 Предельные углеводороды
Предельные углеводороды
Предельные углеводороды — их название говорит за себя! Это сложные химические вещества, молекулы которых состоят из атомов водорода и атомов углерода.
Предельные углеводороды образуют гомологический ряд углеводородов, каждое химическое вещество в таком ряду отличается от предыдущего в химическом строении на одно и тоже количество атомов водорода и углерода.
Гомологический ряд углеводородов
- CH4 — метан
- C2H6 — этан
- C3H8 — пропан
- C4H10 — бутан
- C5H12 — пентан
- C6H14 — гексан
- C7H16 — гептан
- C8H18 — октан
- C9H20 — нонан
- C10H22 — декан …
Гомологический ряд углеводородов характеризуется общей формулой, по которой можно определить формулу любого вещества данного ряда. Для предельных углеводородов — эта формула
CnH2n+2
C увеличением молекулярной массы вещества (увеличивается количество атомов углерода и водорода в молекуле) происходит увеличение температуры кипения этого вещества. Поэтому следует отметить, что вещества с CH4 по C4H10 — газы, с C5H12 по C15H32 — жидкости, далее — это твёрдые вещества!
Предельные углеводороды имеют ещё несколько названий — насыщенные углеводороды или парафины.
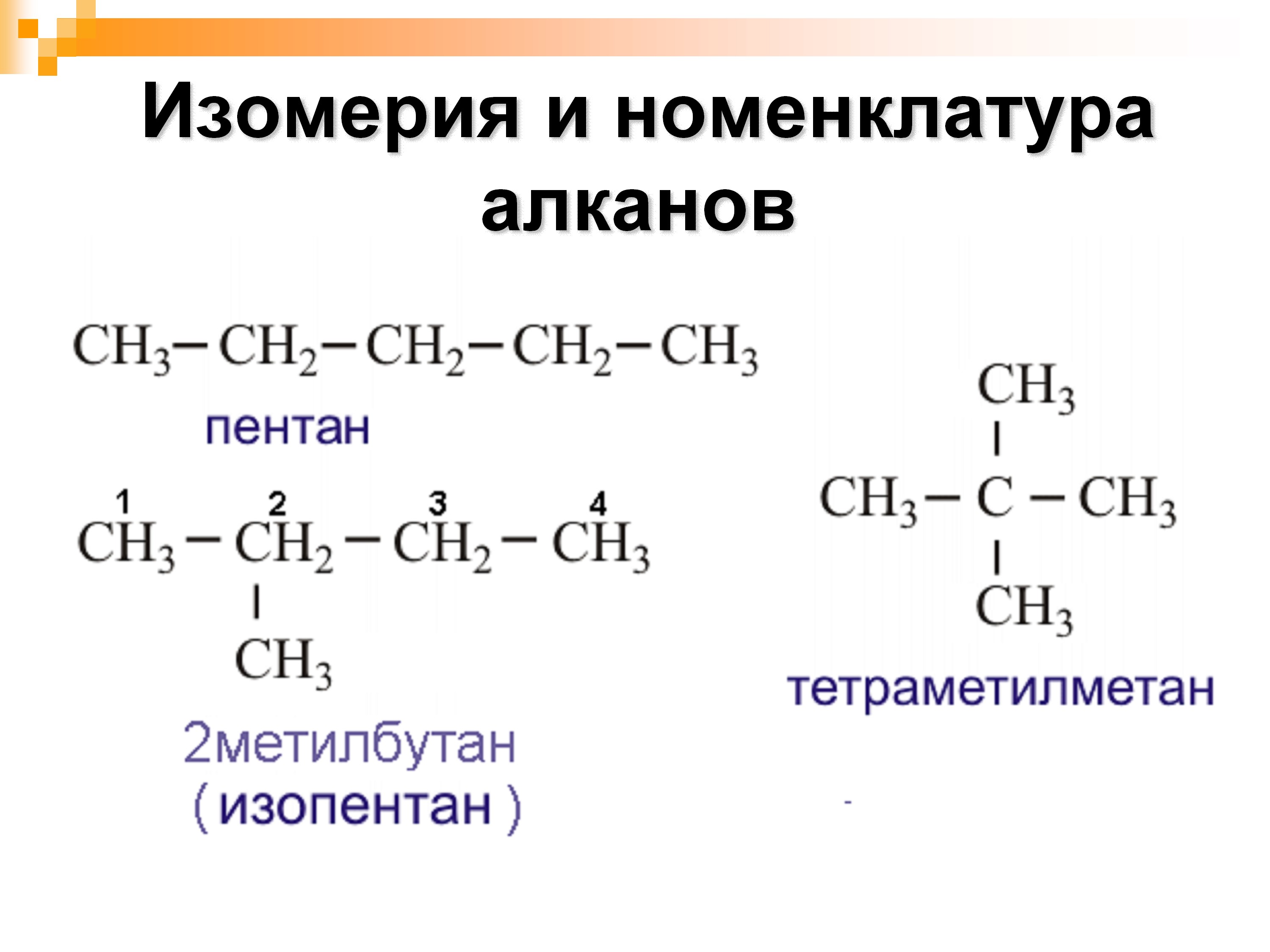
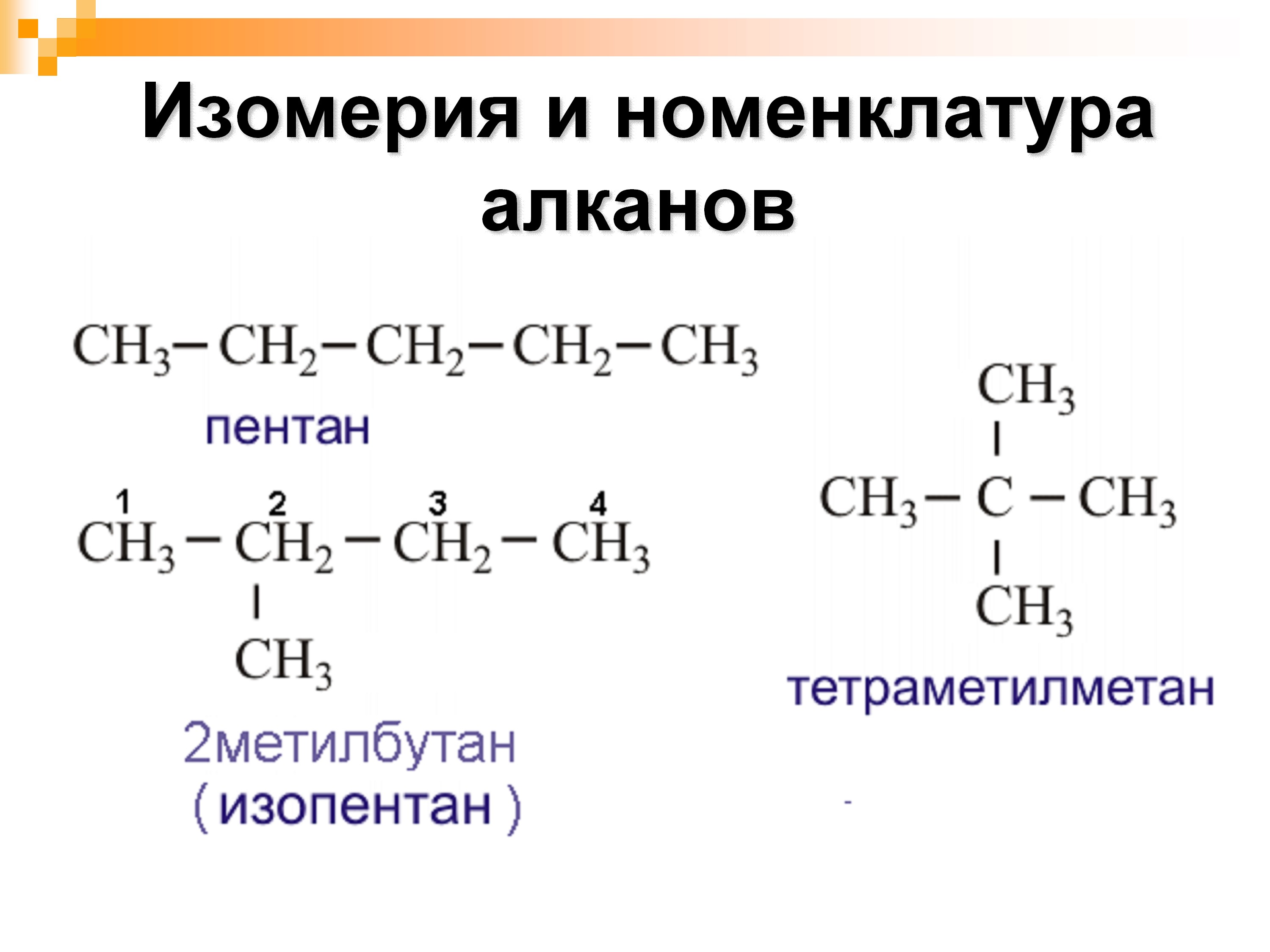
Предельные углеводороды образуют изомеры — вещества, которые имеют одинаковое число атомов одних и тех же элементов, но разное пространственное строение. Например, группа CH3 (или метил), может соединяться не с первым, а со вторым или третьим атомом водорода.
Изомеры характерны для предельных углеводородов, начиная с C4H10 — бутана.
Слева — формула газа — бутан, справа — тот же бутан, только в форме изомера.
Если от предельного углеводорода отсоединить один атом водорода — то образуется очень активное химическое вещество, которое, практически, не существует в свободном состоянии, мгновенно вступает в реакцию.
В химическом отношении при комнатной температуре все алканы инертные (то есть не вступают в химические реакции). Но при повышении температур — проявляют достаточную химическую активность.
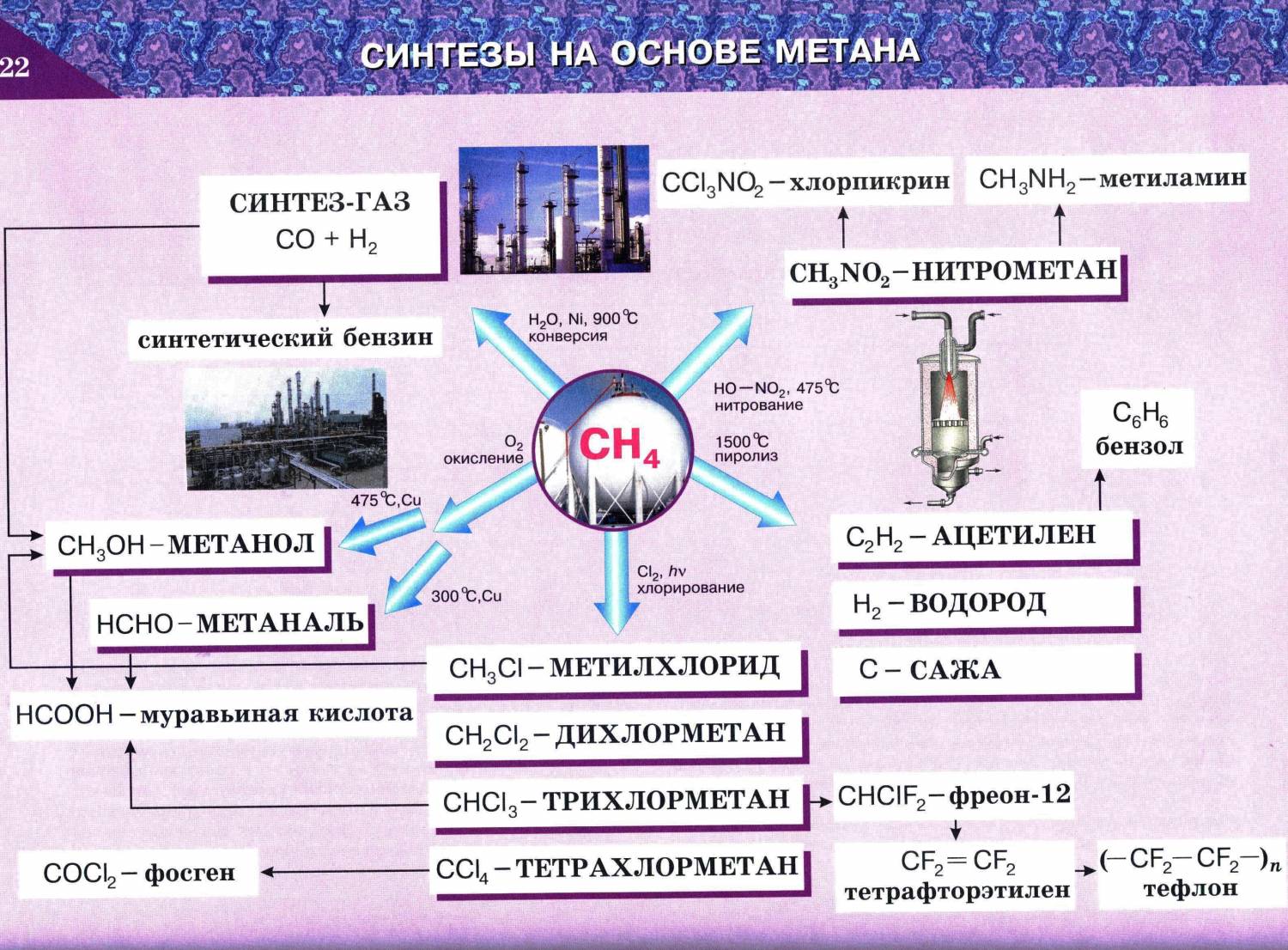
Свойства предельных углеводородов



Источник: https://www.kristallikov.net/page54.html
Предельные углеводороды — это… Что такое Предельные углеводороды?
Предельные углеводороды
Эта статья — о химических соединениях. Статью о канадской алюминиевой компании Alcan см. ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными соединениями и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp³ гибридизации. Простейшим представителем класса является метан (CH4).
Номенклатура

Химическая структура метана, простейшего алкана
Рациональная
Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название алкил1алкил2алкил3алкил4метан, например:
а- н-бутил-втор-бутил-изобутилметан
б- триизопропилметан
в- триэтил-пропилметан
Систематическая ИЮПАК
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи.
В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающий радикал, затем название радикала и название главной цепи. Если радикалы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых радикалов указывают приставками ди-, три-, тетра-.
Если радикалы не одинаковые, то их названия перечисляются в алфавитном порядке. Например:

2,6,6-триметил-3-этилгептан
Гомологический ряд и изомерия
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета. Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Число этих изомеров возрастает с огромной скоростью по мере увеличения числа атомов углерода. Для алканов с n = 1..12 число изомеров равно 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355
| Метан | CH4 | CH4 |
| Этан | CH3—CH3 | C2H6 |
| Пропан | CH3—CH2—CH3 | C3H8 |
| н-Бутан | CH3—CH2—CH2—CH3 | C4H10 |
| н-Пентан | CH3—CH2—CH2—CH2—CH3 | C5H12 |
| н-Гексан | CH3—CH2—CH2—CH2—CH2—CH3 | C6H14 |
| н-Гептан | CH3—CH2—CH2—CH2—CH2—CH2—CH3 | C7H16 |
| н-Октан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C8H18 |
| н-Нонан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C9H20 |
| н-Декан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C10H22 |
Физические свойства
- Температура плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При нормальных условиях алканы с CH4 до C4H10 — газы; с C5H12 до C17H36 — жидкости. И после C18H38 — твёрдые тела.
- Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так например, при нормальних условиях н-пентан жидкость, а неопентан — газ.
| n | Название | Ткип | Тпл | Плотность | Показатель преломления |
| 1 | Метан | −164 | −182,48 | 0,466 (-452324) | — |
| 2 | Этан | −88,63 | −183,3 | 0,546 | — |
| 3 | Пропан | −42,1 | −189,7 | 0,5853 (-45) | — |
| 4 | Бутан | −0,5 | −138,35 | 0,5788 | 1,3326 |
| 4а | Изобутан | −11,73 | −159,60 | 0,5510 | 1,3508 |
| 5 | Пентан | 36,1 | −130 | 0,626 | 1,3575 |
| 6 | Гексан | 68,7 | −95 | 0,659 | 1,3749 |
| 7 | Гептан | 98,4 | −91 | 0,684 | 1,3876 |
| 8 | Октан | 125,7 | −57 | 0,703 | 1,3974 |
| 9 | Нонан | 150,8 | −54 | 0,718 | 1,4054 |
| 10 | Декан | 174,1 | −30 | 0,730 | 1,4119 |
| 11 | Ундекан | 195,9 | −25,6 | ||
| 12 | Додекан | 216,3 | −9,7 | ||
| 13 | Тридекан | 235,5 | −6,0 | ||
| 14 | Тетрадекан | 253,6 | 5,5 | ||
| 15 | Пентадекан | 270,7 | 10 | ||
| 16 | Гексадекан | 287,1 | 18,1 | ||
| 17 | Гептадекан | 302,6 | 22 | ||
| 18 | Октадекан | 317,4 | 28 | ||
| 19 | Нонадекан | 331,6 | 32 | ||
| 20 | Эйкозан | 345,1 | 36,4 | ||
| 21 | Генэйкозан | 215 (15 мм рт ст) | 40,4 | ||
| 22 | Докозан | 224,5 (15 мм рт ст) | 44,4 | ||
| 23 | Трикозан | 234 (15 мм рт ст) | 47,4 | ||
| 24 | Тетракозан | 243 (15 мм рт ст) | 51,1 | ||
| 25 | Пентакозан | 259 (15 мм рт ст) | 53,3 | ||
| 26 | Гексакозан | 262 (15 мм рт ст) | 57 | ||
| 27 | Гептакозан | 270 (15 мм рт ст) | 60 | ||
| 28 | Октакозан | 280 (15 мм рт ст) | 61,1 | ||
| 29 | Нонакозан | 286 (15 мм рт ст) | 64 | ||
| 30 | Триаконтан | 304 (15 мм рт ст) | 66 | ||
| 40 | Тетраконтан | — | 81,4 | ||
| 50 | Пентаконтан | 421 | 92,1 | ||
| 60 | Гексаконтан | — | 98,9 | ||
| 70 | Гептаконтан | — | 105,3 | ||
| 100 | Гектан | — | 115,2 |
Спектральные свойства
ИК-спектроскопия
В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С-Н в области 2850-3000 см-1. Частоты валентных колебаний связи С-С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С-Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см-1, однако метильная группа дает в спектрах слабую полосу при 1380 см-1.
УФ-спектроскопия
Чистые алканы не поглощают в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для снятия УФ-спектров других соединений.
ЯМР-спектроскопия
Масс-спектрометрия
Химические свойства
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить.
Горение
- Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
- CH4 + 2O2 → CO2 + 2H2O + Q
- В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь(в зависимости от нехватки кислорода)
- В общем случае уравнение реакции горения для любого углеводорода CxHy, можно записать в следующем виде:
- CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
Галогенирование
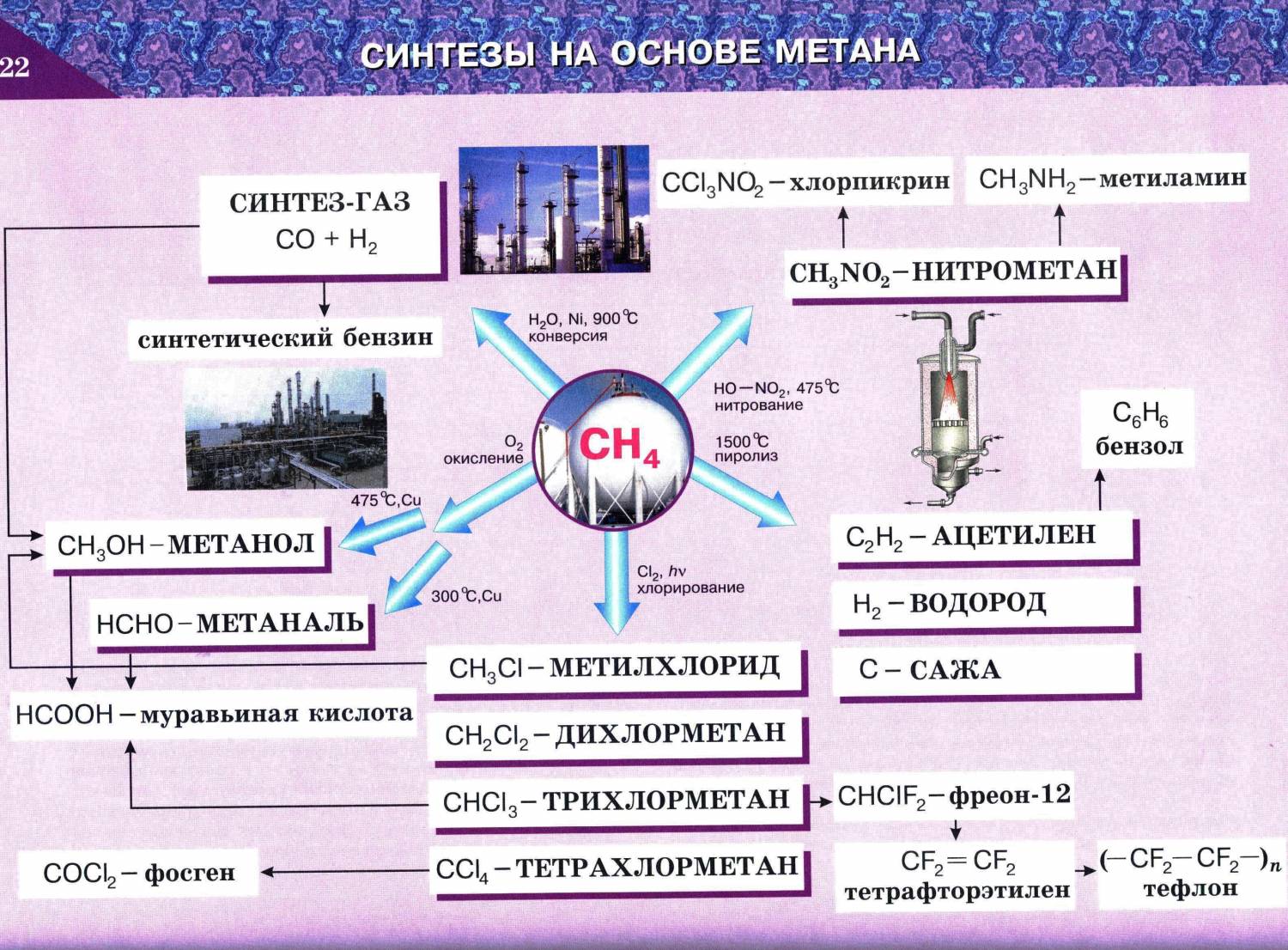
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода.
Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный.
При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного.
Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
- Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
- Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
- С фтором реакция протекает со взрывом (как правило, фтор разбавляют азотом или растворителем).
Нитрование
Алканы реагируют с азотной кислотой или N2O4 в газовой фазе с образованием нитропроизводных: RH + HNO3 = RNO2 + H2O Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. В 1930—1950 гг.
пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг».
С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10-15 атомов С в углеродном скелете) и фракции солярового масла (12-20 атомов С).
Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450°С и низком давлении — 10-15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана: CH4→С+2H2 — при 1000 °C
Частичный крекинг: 2CH4→C2H2+3H2 (Ацетилен) — при 1500 °C
Получение
Главным источником алканов (а также других углеводородов) является нефть и природный газ, которые обычно встречаются совместно.
Восстановление спиртов
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода.
H3C−CH2−CH2−CH2OH→H3C−CH2−CH2−CH3
Восстановление карбонильных соединений
Гидрирование непредельных углеводородов
CnH2n+H2→CnH2n+2
CnH2n-2+2H2→CnH2n+2
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты — RCOO- перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путем сдваивания с подобным радикалом, и образуется R-R. Например:
2CH3COO- — 2e → 2[CH3COO•] → 2CH3• → C2H6
2C3H7COOK →{электролиз}→ C6H14
Газификация твердого топлива
Проходит при повышенной температуре и давлении. Катализатор Ni:
C+2H2→CH4
Реакция Вюрца
2R-Br + 2Na = R-R + 2NaBr
реакция идёт в ТГФ при температуре −80 °C.
при взаимодействии R и R` возможно образование смеси продуктов (R-R, R`-R`, R-R`)
Синтез Фишера-Тропша
nCO + (2n+1)H2→CnH2n+2 + H2O
Биологическое действие
Обладают наркотическим действием, которое возрастает с увеличением числа атомов углерода. При хроническом действии нарушают работу нервной системы, что проявляется в виде бессонницы, брадикардии, повышенной утомляемости и функциональных неврозов.
Литература
- Общая токсикология / под ред. А. О. Лойта. Спб.: ЭЛБИ-СПб., 2006
Ссылки
Источник: https://biograf.academic.ru/dic.nsf/ruwiki/1583971/biograf.academic.ru/dic.nsf/ruwiki/1104877
Предельный углеводороды (алканы) | Химия онлайн
- Алканы – это углеводороды, в молекулах которых все атомы углерода находятся в sр3-гибридизации и связаны друг с другом только σ-связями.
- Алканы (насыщенные алифатические углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
- Алканы (парафины) – алифатические (нециклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи.
- Алканы – название предельных углеводородов по международной номенклатуре.
Парафины – исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – имеющий мало сродства, малоактивный).
Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода. Каждый атом углерода в молекуле алкана связан простыми связями с четырьмя атомами («С» или «Н») и не может присоединить другие атомы.
Общая формула алканов – CnH2n+2, где n – число атомов углерода.
Простейшие представители алканов:
Модели молекул

При сравнении этих соединений видно, что они отличаются друг от друга на группу —СН2— (метилен). Добавляя к пропану еще одну метиленовую (-СН2-) группу, получим бутан С4Н10, затем алканы С5Н12, С6Н14 и т.д.
- Строение алканов
- Гомологический ряд метана
- Изомерия алканов
- Номенклатура алканов
- Физические свойства алканов
- Химические свойства алканов
- Получение алканов
- Применение алканов
Источник: https://himija-online.ru/organicheskaya-ximiya/alkany/alkany-predelnye-uglevodorody.html
Х и м и я

Предельные углеводороды называют алканами.
Алканы – это соединения, в которых атомы углерода соединены между собой только простыми (одиночными) ковалентными связями.
У алканов отсутствуют кратные (двойные и тройные) связи. По этой причине каждая молекула алкана содержит максимальное число атомов водорода.
Простейший представитель алканов – метан:
Метан открывает ряд алканов. Наращивание углеродной цепи на один атом углерода ведёт к увеличению состава на группу СН2. Такое количественное изменение состава приводит к новому соединению, обладающему несколько иными свойствами, качественно отличающимися от исходного соединения. Однако общий характер соединений сохраняется.

Таким образом, в огромном многообразии органических веществ могут быть выделены ряды однотипных соединений, в которых каждый последующий член отличается от предыдущего на группу СН2.
Такие ряды называют гомологическими рядами, их члены по отношению друг к другу являются гомологами.
Следовательно, углеводороды метан, этан, пропан, бутан и т.д. – гомологи одного и того же ряда, который называют рядом предельных или насыщенных углеводородов, рядом алканов, или по первому представителю, — рядом метана.
Состав любого из гомологов отвечает общей формуле СnHn+2 (где n – число атомов углерода). Эта закономерность даёт возможность написать формулу состава для предельного углеводорода с любым числом С-атомов, например С18Н38 (октадекан), С100Н202 (цетан).
Состав одновалентных радикалов, получаемых отнятием атома водорода от молекулы предельного углеводорода, выражает формула: СnHn+1-. Названия их образуются заменой окончания – ан в названии углеводорода окончанием – ил:
- от метана производится метил СН3-,
- от этана – этил С2Н5-,
- от пропана – пропил С3Н7- и т.д.
- Когда выше перечисленные радикалы входят в состав более сложных соединений, то в названия этих соединений присутствуют названия радикалов. Например в спиртах:
- метиловый — СН3-ОН,
- этиловый — С2Н5-ОН,
- пропиловый — С3Н7-ОН и т.д.
- Как и в других гомологических рядах, в ряду метана проявляется всеобщий закон природы – закон перехода количественных изменений в качественные.
- Как мы уже упоминали выше, изменение состава молекулы на группу СН2 каждый раз приводит к новому веществу, которое хотя и миеет много общего с соседними членами ряда, но вместе с тем по некоторым свойствам отличается от них.
- Различие гомологов ясно проявляется в физических свойствах.
- Низшие члены ряда алканов (от СН4 до С4Н10) – газы.
- Средние члены от С5Н12 до С16Н34) – жидкости (при температуре 20град.С).
- Алканы с ещё большим числом атомов углерода при обычных условиях находятся в твёрдом состоянии.
- Бензины (С5Н12 –С10Н22),
- Керосины (С10Н22 — С16Н34),
- Соляровые масла (С12 – С20),
- Мазут. Мазут содержит ещё более тяжёлые углеводороды. Из мазута получают вазелин и парафин.
Во всех случаях температуры кипения и затвердевания тем выше, чем больше молекулярный вес углеводорода.
В то же время все алканы в химическом отношении подобны метану. Они весьма инертны, вступают лишь в реакции замещения водорода, протекающие крайне медленно.
Все алканы горят и могут быть использованы в качестве топлива. Они входят в состав нефти и продуктов её перегонки. При фракционной прегонке нефть разделяют на отличающиеся по температуре кипения фракции и получают следующие нефтепродукты:
Источник: http://xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai/views/alchemy/theory/chemistry/organic-chemistry/saturated_hydrocarbons.php
Предельные углеводороды
Углеводороды, атомы углерода которых связаны одинарными связями, называются насыщенными или предельными углеводородами.
К насыщенным углеводородам относятся ациклические (алканы) и карбоциклические (циклоалканы) соединения. Они отличаются пространственным строением и количеством атомов.
Ряд веществ, сходных по строению, химическим свойствам, но отличающихся количеством атомов, называется гомологическим. Вещества, входящие в состав гомологического ряда, называются гомологами.
Алканы – это гомологический ряд метана CH4. Циклоалканы или нафтены – гомологический ряд циклопропана. Общее описание предельных углеводородов представлено в таблице.
| Признак | Алканы | Циклоалканы |
| Общая формула | CnH2n+2 | CnH2n |
| Форма молекулы | Линейная, разветвлённая | Циклическая в виде треугольника, квадрата, пятиугольника, шестиугольника |
| Примеры гомологов | CH4 – метан | C3H6 – циклопропан |
| C2H6 – этан | C4H8 – циклобутан | |
| C3H8 – пропан | C5H10 – циклопентан | |
| C4H10 – бутан | C6H12 – циклогексан | |
| C5H12 – пентан | C7H14 – циклогептан | |
| C6H14 – гексан | C8H16 – циклооктан | |
| C7H16 – гептан | C9H18 – циклононан | |
| C8H18 – октан | C10H20 – циклодекан | |
| C9H20 – нонан | C11H22 – циклоундекан | |
| C10H22 – декан | C12H24 – циклододекан |
Соединения, которые имеют одинаковое количество атомов, но разное строение, называются изомерами. Все алканы, начиная с бутана, имеют изомеры. К названию прибавляется приставка изо- (изобутан, изопентан, изогексан). Формула остаётся неизменной.
Рис. 1. Структурная формула бутана и изобутана.
Для циклоалканов характерны три вида изомерии:
- пространственная – расположение относительно плоскости цикла;
- углеродная – присоединение к СН2-группе дополнительных групп;
- межклассовая – образование изомеров с алкенами.
В зависимости от присоединяемой группы меняется название вещества. Например, метилциклопропан имеет циклическую структуру в виде треугольника с присоединённым метилом (СН3). Название «1,2-диметилциклопентан» говорит о циклическом строении с двумя присоединёнными молекулами метила. Цифры указывают, к каким углам пятиугольника присоединён метил.
В углах фигуры циклоалканов всегда находится группа CH2, поэтому её часто не записывают, а просто рисуют фигуру. Количество углов указывает на количество атомов углерода. Дополнительные группы дописывают к углам через штрих.
Рис. 2. Примеры графических формул циклоалканов.
Существуют промышленные и лабораторные способы получения алканов. В промышленности:
- выделение из нефти, газа, каменного угля;
- газификация твёрдого топлива: C + 2H2 → CH4.
В лаборатории:
- гидролиз карбида алюминия:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4; - реакция замещения:
2CH3Cl + 2Na → CH3-CH3 + 2NaCl; - реакция обмена:
CH3COONa + NaOH → Na2CO3 + CH4.
Циклоалканы получают путём выделения из природных источников – нефти, газа, а также при дегидрировании алканов и гидрировании аренов:
- С6Н14 ↔ C6H12 + Н2;
- C6H6 + 3H2 → C6H12.
Алканы и циклоалканы имеют схожие химические свойства. Это малоактивные вещества, реагирующие только при дополнительных условиях – нагревании, давлении. Реакции предельных углеводородов:
- горение:
CH4 + 2O2 → CO2 + 2H2O + Q; - замещение (например, галогенирование):
- присоединение:
- разложение:
Рис. 3. Горение метана.
С увеличением молекулярной массы предельных углеводородов и, соответственно, числа атомов углерода в гомологических рядах увеличивается температура кипения веществ.
Циклоалканы кипят и плавятся при более высоких температурах, чем алканы. Метан, этан, пропан, бутан – газы. Вещества, в состав которых входит 5-15 атомов углерода (с C5H12 по C15H32) – жидкости.
Вещества, содержащие более 15 атомов углерода, – находятся в твёрдом состоянии.
Схожие по свойствам вещества – алканы и циклоалканы – относятся к предельным углеводородам.
Алканы – соединения с линейным строением молекул, циклоалканы – циклические углеводороды, образующие треугольные, четырёхугольные, пятиугольные структуры.
Насыщенные углеводороды получают из полезных ископаемых, а также промышленным или лабораторным путём. Это малоактивные вещества, вступающие в реакции замещения, присоединения, горения, разложения только при дополнительных условиях.
Средняя оценка: 4.7. Всего получено оценок: 185.
Источник: https://obrazovaka.ru/himiya/predelnye-uglevodorody-molekulyarnaya-massa-sposoby-polucheniya.html
Экология СПРАВОЧНИК
Предельные углеводороды (бутан, пентан, гексан, гептан, октан) среди органических соединений наиболее инертны. При попадании в организм человека оказывают наркотическое действие, вызывают потерю координации движения и расслабление организма. С ростом числа атомов углерода в предельных углеводородах отрицательное действие на организм человека усиливается.[ …]
Предельные углеводороды СпН2п+2 (алканы, парафины).[ …]
Предельные углеводороды после отделения от ароматических углеводородов и олефинов с помощью (СЮ4)2 чаще всего подвергают сжиганию с последующим определением образующегося углекислого газа кулонометрическим методом.
Содержание ароматических углеводородов после их отделения от олефинов устанавливают с помощью Нд(1МОз)2 либо сжигают в токе кислорода и по количеству С02 рассчитывают содержание этих углеводородов [71-74].[ …
]
Углеводороды (в дальнейшем могут быть обозначены СН или 2СН, если речь идет об их сумме) относятся к одним из основных примесей, загрязняющих атмосферный воздух.
Этот класс загрязнителей состоит из предельных углеводородов не-разветвленного (ряд метана) и разветвленного (изобутан, изо-пентан) строения, непредельных углеводородов (ряд этилена, ряд ацетилена), ароматических углеводородов (бензол, толуол, ксилол), а также производных углеводородов (например, хлор-производные, спирты) и других соединений.[ …]
Предельные углеводороды вследствие строения молекул не вступают в реакции присоединения, а в реакции замещения вступают лишь при высоких температурах и давлении. Такие углеводороды и названы парафинами, что означает «обладающий малым сродством».[ …]
Углеводороды предельного ряда могут окисляться различными путями [478, с. 129]. Окисление клетками Ps.
aeruginosa происходит по схеме: предельные углеводороды -> непредельные углеводороды -> спирты кетосоединения -> жирные кислоты диоксид углерода и вода.
Возможно также окисление через гидропероксид и далее до жирных кислот, а кроме того, образование жирных кислот через вторичные спирты и метилалкилкетоны.[ …]
Анализ предельных углеводородов Сх—С8, изомеров С4—С5 и непредельных углеводородов С?—С». Разделение проводится на двух последовательно расположенных колонках 7 и 10 (см. рис. 27). Колонка 7 длиной 2,2 м (й == 0,4 см) из нержавеющей стал?! заполнена окисью алюминия, модифицированной 3% КаОН (от массы сорбента).[ …]
Бензол, предельные углеводороды и нафтеновые углеводороды при содержании их до 0,1 мг/л не мешают определению ксилолов, а алкилбензолы и непредельные углеводороды мешают.[ …]
Для разделения предельных углеводородов и их изомеров служит колонка 7 длиной 2 м и внутренним диаметром 0,4 см, заполненная инзенским кирпичом, пропитанным диб утилфталатом или смесью гексадскана и тетрадекана (в отношении 1 : 1) в количестве 25% массы кирпича.[ …]
Рассматриваемые углеводороды подвержены окислению. Предельные углеводороды окисляются (горят) с образованием диоксида углерода и воды: СН4+202=С02+2Н20+880 кДж.[ …]
Механизм действия предельных углеводородов, в основном, несомненно тот же, что и всех прочих «индифферентных наркотиков» (о теориях наркотического действия см. книги Лазарева). Но действие это все же отлично от действия других известных наркотиков (спирты, кетоны, эфиры и т. д.). Поэтому углеводороды предложено относить к числу наркотиков особого (второго) типа (Люблина).[ …]
Несмотря на то, что предельные углеводороды среди органических соединений наиболее инертны, они являются сильными наркотиками, кроме того вызывают покраснение, зуд, пигментацию кожи. Производные углеводородов, как правило, более токсичны, чем сами углеводороды.[ …]
Определению не мешают предельные углеводороды, галоидные алкилы, спирты, простые и сложные эфиры, альдегиды, кетоны и кислоты; мешают определению фенилгидразин и пи-разолины.[ …]
В гомологическом ряду предельных углеводородов сила наркотического действия возрастает с увеличением числа атомов углерода в молекуле.[ …]
При концентрации суммы углеводородов порядка 0,3 мг/дм3 у работающих к концу вахты отмечены снижение обоняния и возбудимости нервной системы, головная боль, слабость, сердцебиение.
Наблюдались также острые отравления с летальным исходом при несоблюдении правил техники безопасности при зачистке резервуаров, емкостей или цистерн из-под нефти. По результатам вскрытия установлено значительное полнокровие мозга, кровоизлияние в бронхах и отек легких.
Концентрация паров нефти от 100 мг/дм3 и выше опасна для жизни даже при вдыхании в течение 5-10 мин. Присутствие сероводорода и повышенная температура усиливают токсичность предельных углеводородов.[ …]
Анализ смеси, содержащей предельные углеводороды С,—С4, сероводород, двуокись углерода и закись азота. Анализ производится на колонке длиной 5 м диаметром 0,4 см, заполненной инзенским кирпичом, пропитанным смесью гексадекана с тетрадеканом (1 : 1) в количестве 25% массы кирпича.[ …]
Керосин состоит в основном из предельных углеводородов, иногда с примесью сернистых и ароматических соединений, химический состав его зависит от способа и источника получения. Керосин испаряется на воздухе, нары его с воздухом образуют взрывчатые смеси.[ …]
Разделение кизкокипящих газов, предельных углеводородов С1—СГ) и их изомеров. Такой анализ производится на двух последовательно соединенных колонках по схеме, представленной на рис. 22. В качестве детектора применяется катарометр. Анализ производится в изотермическом режиме при температуре 20СС, в качестве газа-носителя используется азот или аргон.[ …]
Действие на кожу слабее, чем действие предельных углеводородов. Все X. У. способны вызывать первичное раздражение кожи, а также аллергические дерматиты.[ …]
Действие на кожу слабее, чем действие предельных углеводородов. Все X. У. способны вызывать первичное раздражение кожи, а также аллергические дерматиты.[ …]
Технический продукт, получаемый присоединением предельных углеводородов к непредельным при алкилировании бутан-бутеновой фракции газов термического или каталитического крекинга.[ …]
Способностью образовывать газогидраты обладают предельные углеводороды (метан, этан, пропан), их галоидные дериваты (фреоны), хлор, углекислый газ и другие вещества [137].[ …]
По мере удлинения цепи углеродных атомов в молекуле предельных углеводородов температуры их кипения и плавления повышаются, плотность возрастает (табл. 3.).
Метан, этан, пропан, бутан — газы; изомеры по сравнению с соответствующими нормальными углеводородами имеют более низкую температуру кипения.
Пропан и бутан под давлением могут находиться в жидком состоянии и при нормальной температуре.[ …]
| Хроматограмма смеси, содержащей двуокись серы, сероводород, двуокись углерода и предельные углеводороды С2—С5. |  |
Попутные газы (А. В. Топчиев, Б. А. Кренцель) выделяются из недр земли при добыче нефти. Они содержат предельные углеводороды. Выходя вместе с нефтью из недр земли, они увлекают за собой растворенные в нефти углеводороды — пентан и гексан. Эти газы после крекинга превращаются в непредельные углеводороды и являются богатым источником сырья для технического синтеза (см. рис. 54 и 55).[ …]
Хроническое отравление не приводит к тяжелым органическим изменениям. В результате длительного контакта с углеводородами у рабочих развиваются вегетативные нарушения. Изменения характеризуются гипотонией, повышенной утомляемостью, бессонницей, понижением тонуса капилляров, наблюдаются гормональные нарушения у женщин.
Под влиянием паров некоторых предельных углеводородов отмечена неустойчивость реакций центральной нервной системы. Такое действие проявляется и при высоких, и при низких пороговых концентрациях. Запах бутана ощущается при концентрации в воздухе 328 мг/м3, пентана — 217 мг/м3.
Постоянный контакт с предельными УВ вызывает покраснение, пигментацию кожи и зуд.[ …]
Радиационная полимеризация может протекать и при радиолизе веществ, не имеющих вначале кратных связей, например предельных углеводородов и других классов соединений, за счет образования ненасыщенных связей в результате облучения.
Укрупнение молекул может происходить и при взаимодействии образовавшегося радикала или возбужденной молекулы с насыщенной молекулой, сопровождающемся отрывом атома или молекулы водорода. Такой процесс следует считать скорее поликонденсацией [18].
Обычная поликонденсация протекает с бифункциональными или полифункциональными соединениями [20], при этом в большинстве случаев выделяется вода. Под действием радиации поликонденсация возможна только в том случае, если облучение приводит к образованию полифункциональных соединений.[ …]
Реакция протекает при обычной температуре почти количественно. Полученный формальдегид определяют колориметрически (см. стр. 482). Так как из предельных углеводородов только метан образует формальдегид, то эта реакция является специфичной для метана. Предложены индикаторы — сигнализаторы для определения концентрации метана в воздухе шахт.[ …]
Они являются продуктами перегонки нефти, а также сланцев и по химическому составу представляют собой смесь разнообразных соединений, главным образом углеводородов (циклического и открытого строения), и некоторого количества кислородных, сернистых и азотистых веществ. Из предельных углеводородов могут встречаться нормальные парафины, парафины с разветвленной цепью и циклические (нафтены или циклопарафины) из непредельных — олефины и циклические непредельные (ароматические углеводороды).[ …]
В целом на территории ОНГКМ по условиям формирования углеводородных аномалий в водах выделяются два крупных района.
Для района техногенного распространения углеводородов под влиянием ОГХК характерны подземные и поверхностные воды типов С3Н6, С4Н8, формирующихся под влиянием смешения со сточными водами переработки газа и конденсата, сумма предельных углеводородов меньше суммы непредельных углеводородов при соотношении компонентов СГЦ< или = С4Н8, С3Н6. При метановом типе УВГ в подземных водах сумма предельных углеводородов меньше суммы непредельных, а в поверхностных водах сумма предельных больше суммы непредельных. Суммарное содержание углеводородов в подземных водах этого района, занимающего значительные площади по правому берегу р.Урал, выше чем в водах левого берега. В правобережье выделяются участки с техногенно повышенным суммарным содержанием углеводородов: р.Черная и среднее течение р.Каргалки, а в левобережье — р.Донгуз.[ …]
Другие вариации факторного анализа подтверждают обособленное положение по отношению к углеводородным газам минерализации подземных вод и четырех компонентов предельных углеводородов — ¡,пС4Ню, СгНб, СзН».[ …]
Первая фракция перегонки каменноугольной смолы (легкий маслопродукт) представляет собой смесь органических веществ в составе, вес. %: бензол и его гомологи 80; олефины 3—5; циклические углеводороды 1 —1,5; предельные углеводороды 0,5— 1,0; нитрилы 0,2—0,3; фенолы 5—15; пиридин 1—3; сероуглерод и тиофен 0,1; ацетон и кумарон 1,0—1,5.[ …]
Верхний этаж включает разрез на глубине от 983 до 1118 м палеогеновых отложений, представленных сверху вниз известняком, глиной.
Суммарное содержание углеводородных газов составляет (2053-5057)-ЮЛ СКЦ, 270-469, сумма предельных углеводородов 320-542; непредельных УВГ (1733-4055)-10‘4 см3/кг; суммарное содержание непредельных больше суммы предельных.
В процентном соотношении метан составляет 9,3-13,2 %, бутилен 20,2-50,1; углекислый газ 67,9-79,3; азот 17,8-28,3 %. Тип углеводородного состава — С4Н8, по прочим газам — С02.[ …]
Некоторые микроорганизмы обладают широким диапазоном действия, в то время как другие — узкоспециализированы и могут разрушать только определенные вещества, например, один из видов Bacterium [102] способен окислять в ряду предельных углеводородов высшие члены ряда, начиная с гексадекана.[ …]
В процессе окисления октадекана образуются октадециловые эфиры пальмитиновой и стеариновой кислот. В метантенках углеводород-окисляющие бактерии из рода Pseudomonas способны в анаэробных условиях осуществлять дегидрирование некоторых предельных углеводородов до олефинов [11].[ …]
Другим процессом, который приводит к укрупнению молекул и к образованию твердых осадков, является сшивка. Поликонденсация с образованием молекулярного водорода, о которой шла речь выше, является по сути сшивкой.
Сшиваться в принципе могут все органические молекулы: полимерные молекулы, продукты конденсации и низкомолекулярные молекулы, в том числе и предельные углеводороды [20]. Но выходы этих процессов, конечно, очень различны и для появления в процессе облучения твердого вещества потребуется разная доза.
Одновременно при облучении будет протекать и деструкция молекул с выходами, также зависящими от природы вещества. Однако конечным наблюдаемым результатом для водных растворов органических веществ является образование осадков.[ …]
На некоторых предприятиях улавливаются специфические загрязняющие вещества, относящиеся к категории прочих. При всем своем разнообразии они образуют относительно однородные комплексы, подлежащие, как правило, совместному извлечению из отходящих газов с использованием однотипных технологий очистки.
Так, для извлечения из отходящих газов органических кислот, альдегидов, а также предельных углеводородов (которые выделяются в самостоятельную категорию загрязняющих веществ, но по существу могут рассматриваться совместно с другими органическими соединениями) обычно используют дожигание в печах и реже адсорбцию.
Эти вещества входят, как правило, в больших количествах в состав отходящих газов от крупных стационарных источников предприятий химической и нефтехимической промышленности, могут эффективно улавливаться и утилизироваться с включением процессов очистки отходящих газов в технологическую схему основного производства.[ …]
Согласно проведенным оценкам ПДВ, выбросы в атмосферу в настоящее время можно представить следующими величинами (табл. 5.33). По данным табл. 5.33, ежегодно выбрасывается около 233,5 т ЗВ.
Наибольший вклад в суммарное загрязнение атмосферы вносит факел сжигания попутного газа (91%), затем следуют дизельная установка 1Д-12 — 4%, дизельная установка У1-Д6 -2,6, эстакада налива нефти — 2,4%.
Последняя всецело обеспечивает поступление в атмосферу предельных углеводородов через дыхательный клапан. Несмотря на внедрение бессажевого сжигания попутного газа на факеле (оголовок “голубая свеча”), выбросы оксидов углерода, азота и диоксида серы остаются значительными.
Это и определяет доминирующие компоненты валовых выбросов в атмосферу от всех источников загрязнения: около 62% приходится на оксид углерода, 21% — на диоксид серы, 12% — на диоксид азота, далее следуют УВ предельные — около 2%, метан, керосин.[ …]
После начала эксплуатации месторождения дегазированная нефть транспортируется до ДНС, в качестве накопителя используется резервуар РВС-2000, снабженный дыхательным клапаном. Этот резервуар в составе сооружений нефтепровода послужит основным источником загрязнения атмосферы (более 98,8%).
Всего, по данным расчетов, через 8 источников загрязнения в атмосферу будет выделяться около 82 т ЗВ ежегодно. Кроме резервуара хранения нефти (точечный источник) утечки ЗВ будут происходить в узлах задвижек и фланцевых соединениях арматуры, насосном оборудовании, узлах учета нефти и др.
Преобладающими загрязнителями являются смесь предельных углеводородов С,-С]0, а также сероводород, испаряющиеся при хранении и транспортировке.[ …]
Несмотря на важность жидкостной экстракции и большое количество работ в этой области [34] до сих пор выбор растворителя, пригодного для выделения определяемого соединения, осуществляется в основном эмпирически. Обычно выбирают систему с наивысшим коэффициентом распределения данного вещества.
В порядке увеличения полярности органической фазы для облегчения подбора рекомендованы следующие системы растворителей: гексан (циклогексан)/этанол + вода < бензол/метанол + вода < хлороформ/метанол + вода < этилацетат/вода < бута-нол-1 (бутанол-2)/вода и др.
В работе 35 при исследовании экстракции фосфорорганических препаратов показано, что независимо от природы извлекаемого компонента (если он, конечно, не обладает ярко выраженными кислотными или основными свойствами) растворители по возрастанию экстрагирующей способности располагаются в следующий ряд: предельные < непредельные < хлорпроизводные < ароматические углеводороды < простые эфиры < спирты < сложные эфиры < растительные масла. Такая дифференциация объясняется различной способностью органических растворителей к сольватации извлекаемых веществ. Наименее эффективно экстрагируют эти вещества предельные углеводороды, соль-ватирующие ФОС за счет ван-дер-ваальсовых взаимодействий с энергией 1 кДж/моль. Непредельные углеводороды, как и ароматические, вследствие дополнительного л-взаимодействия являются более эффективными экстрагентами. Еще более высокой экстракционной способностью обладают хлорсодержащие углеводороды, образующие с экстрагируемыми соединениями водородные связи, причем дихлорметан и хлороформ обычно более эффективны, чем четыреххлористый углерод. По этой же причине хорошо извлекают ФОС спирты и эфиры, различная природа которых позволяет дифференцировать степень извлечения отдельных соединений.[ …]
Источник: https://ru-ecology.info/term/41251/
Алканы
Алканы — это ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2 (CH4, C2C6, …). Алканы также называют парафинами. Каждый атом углерода в молекуле алкана имеет максимальное количество связанных с ним других атомов, то есть четыре, поэтому такие углеводороды и называют насыщенными.
Связи
Электронная конфигурация атома углерода с атомным числом 6, 1s22s22p2, не может образовать четыре связи, а только две, поэтому здесь имело место sp3-гибридизация, то есть перераспределение четырёх электронов с двух разных энергетических уровней на один. Образованные связи электронов углерода (с орбитали sp3) и водорода (орбиталь s) образуют очень прочную связь σ. Ввиду прочности связи, насыщенные углеводороды имеют низкую реакционную способность.
Геометрия
Наличие четырёх орбиталей у атома углерода создаёт форму правильного тетраэдра и все углы между орбиталями равны 109°28'. Длина связи между атомами углерода и водорода составляет 0,109 нм, между двумя атомами углерода — 0,154 нм.
Реакции
Атомы в молекулах алканов соединены сильной σ-связью. В реакции связи C-C и C-H имеют равную вероятность разрушиться для образования нового соединения, поэтому результатом реакции всегда является сложная смесь продуктов. В нормальных условиях алканы не реагируют с кислотами, с основаниями, ни с сильными окислителями.
При разрыве связи в алканах возможны два сценария: разрыв связи с образованием двух радикалов, A:B → A• + • B. Такой разрыв называется гомолитический (гомо — одинаковый).
В другом случае происходит разрыв с образованием ионов, когда общая пара электронов отходит к одному из атомов: A:B → A + :B, такой разрыв называется гетеролитический.
Соответствующим образом называются виды реакции алканов: гомолитические и гетеролитические реакции.
На данный момент известны два типа реакции алканов, в которых не разрываются связи C-C — это галогенирование и нитрирование. Ниже даны примеры реакций метана.
Галогенирование
Реакция галогенирования проходит при температуре 300-400°C или под воздействием ультрафиолетовых лучей. В процессе реакции образуются галогеноалканы. Чаще всего встречаются реакции с хромом и бромом, реакции со фтором опасны из-за возможности взрыва, с йодом реакция не проходит.
Процесс галогенирования состоит из трёх этапов: инициирование, рост цепи и обрыв цепи.
1. Инициирование — гомолитическое расщепление галогена на два радикала: Cl2 → 2Cl• (воздействие световой энергии, hν) 2. Развитие цепи — свободные радикалы, взаимодействуют с молекулами и возможны две реакции: (1) Cl• + CH4 → HCl + •CH3 (2) Cl• + CH4 → CH3Cl + H• Энергия атомарного водорода значительно выше чем метильного радикала CH3, поэтому реакция (2) не протекает. 3. Обрыв цепи — радикалы реагируют между собой и образуют продукты: Cl• + Cl• → Cl2 CH3• + CH3• → 2CH3 CH3• + Cl• → CH3Cl
Горение
Основное применение алканов — это топливо, поэтому реакцию горения можно назвать самой популярной для предельных углеводородов. В реакции горения алканы превращаются в воду и углекислый газ. Реакция горения является экзотермической и требует большого количества энергии, например, искра или огонь. Общая реакция горения алканов:
R + O2 → CO2 + H2O + тепло 2CnH2n+2 + (3n+1)O2 → 2nCO2 + (2n+2)H2O + тепло
Реакция горения метана
CH4 + 2O2 → CO2 + 2H2O + 212 ккал/моль
Нитрирование
При температуре 140°C, при повышении давления, алканы реагируют с азотной кислотой, атом водорода замещается на остаток азотной кислоты NO2, продукты реакции называются нитросоединениями:
CH4 + HO-NO2 → CH3-NO2 + H2O (140°C, p)
Синтез
Синтез Вюрца
В 1855 году Адольф Вюрц открыл, что в реакции металлического натрия с галогеноалканом образуется соль натрия:
2CH3I + 2Na• → 2Na+I- + CH3CH3
Свободные радикалы галогеноалкана реагируют друг с другом, образуя более длинные соединения. Общее уравнение реакции имеет вид:
2R-X + 2Na → 2NaX + R-R
Восстановление галогеналкилов
Большинство галогеналкилов в реакции с цинком и катионами водорода (или кислотой Брёнстеда-Лоури) образуют алканы. В такой реакции, цинк является восстановителем и позволяет заменить галоген на водород:
2C4H9Br (2-бромбутан) + H+ (кислота) + Zn → 2C4H10 (бутан) + ZnBr2
Реактивы Гриньярда
Реактивы Гриньярда — это органические соединения, в которых присутствует связь металл-углерод. Такие реактивы образуются в результате реакции галогеналкила с магнием в растворе диэтилового эфира:
R-X + Mg → RMgX (в растворе диэтилового эфира)
Реакция также проходит с хлоридами, бромидами и иодидами алкилов. В процессе гидролиза, реактивы Гриньярда преобразовываются в алканы:
CH3MgI + H2O → CH4 + HO-Mg-I C2H5MgBr + H2O → C2H6 + HO-Mg-Br
Получение и применение
Алканы получают либо с помощью синтеза, либо из природных источников (природный газ, нефть, уголь). Применение насыщенных углеводородов очень обширно, алканы используются в качестве газового, бензинового, дизельного и ракетного топлива. Вазелин, растворители и парафин — также заслуга алканов.
Свойства алканов
Алканы с содержанием от одного до четытрёх атомов углерода находятся в газообразном состоянии, от пяти до 17 атомов углерода — жидкости, с количеством атомов углерода больше 18 находятся в твёрдом состоянии. Бесцветные, безвкусные и не имеют запаха, обычно к алканам добавляют примеси, что бы они имели запах, например в газ метан или в бензин.
sp3-гибридизация делает алканы наименее полярными из всех органических соединений, откуда следует, что они плохо растворяются в полярных растворах, поэтому температуры кипения и плавления будут в основном зависить только от молекулярного веса, в среднем, температура кипения предельных углеводородов увеличивается на 25-30 градусов на каждый атом углерода после пентана. Разветвлённые алканы имеют более низкую температуру кипения, поскольку более разветвлённые молекулы имеют меньшую площадь поверхности, поэтому межмолекулярные связи более слабы и закипают раньше.
Вязкость вещества зависит от размера молекулы, так, чем больше атомов углерода в молекуле, тем она больше и тем больше вероятность взаимодействия молекул и, как следствие, больше вязкость. Алканы с числом углеродов от 20 до 35 являются основным компонентом для смазочных материалов.
Номенклатура
Название алканов состоит из двух частей: префикс обозначает количество атомов углерода, к нему пристраивается суффикс -ан, который означает тип соединения, т.е. алкан.
| 1 | Метан | СH4 |
| 2 | Этан | CH3—CH3 |
| 3 | Пропан | CH3—CH2—CH3 |
| 4 | Бутан | CH3—(CH2)2—CH3 |
| 5 | Пентан | CH3—(CH2)3—CH3 |
| 6 | Гексан | CH3—(CH2)4—CH3 |
| 7 | Гептан | CH3—(CH2)5—CH3 |
| 8 | Октан | CH3—(CH2)6—CH3 |
| 9 | Нонан | CH3—(CH2)7—CH3 |
| 10 | Декан | CH3—(CH2)8—CH3 |
| 11 | Ундекан | CH3—(CH2)9—CH3 |
| 12 | Додекан | CH3—(CH2)10—CH3 |
| 13 | Тридекан | CH3—(CH2)11—CH3 |
| 14 | Тетрадекан | CH3—(CH2)12—CH3 |
| 15 | Пентадекан | CH3—(CH2)13—CH3 |
| 16 | Гексадекан | CH3—(CH2)14—CH3 |
| 17 | Гептадекан | CH3—(CH2)15—CH3 |
| 18 | Октадекан | CH3—(CH2)16—CH3 |
| 19 | Нонадекан | CH3—(CH2)17—CH3 |
| 20 | Эйкозан | CH3—(CH2)18—CH3 |
| Таблица 1. Номенклатура алканов |
Источник: https://k-tree.ru/articles/himiya/organicheskaya_himiya/alkani




