Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2

Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)

Химические свойства
- Реакции с неметаллами
- При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
- C + H2 → (t) CH4 (метан)
- 2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
- С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
- С + F2 → (t) CF4
- Реакции с металлами
- Ca + C → CaC2 (карбид кальция, СО углерода = -1)
- Al + C → Al4C3 (карбид алюминий, СО углерода -4)
- Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
- Восстановительные свойства
- Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
- Fe2O3 + C → Fe + CO2
- ZnO + C → Zn + CO
- FeO + C → Fe + CO
- Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
- SiO2 + C → (t) Si + CO
- Может восстановить и собственный оксид:
- CO2 + C → CO
- Реакция с водой
- Реакции с кислотами
- В реакциях с кислотами углерод проявляет себя как восстановитель:
- C + HNO 3(конц.) → (t) CO2 + NO2 + H2
- C + HNO3 → CO2 + NO + H2O
- C + H2SO4(конц.) → CO2 + SO2 + H2O
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.


Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑

Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
- Получение
- В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
- CO2 + C → (t) CO
- C + H2O → (t) CO + H2
- В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
- HCOOH → (H2SO4) CO + H2O
- Химические свойства
- Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
- CO + O2 → CO2
- Fe2O3 + CO → Fe + CO2
- FeO + CO → Fe + CO2
- Образование карбонилов — чрезвычайно токсичных веществ.
- Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
- Получение
- В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
- CaCO3 → (t) CaO + CO2↑
- C6H12O6 → C2H5OH + CO2↑
- В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
- CaCO3 + HCl → CaCl2 + H2O + CO2↑
- Углекислый газ образуется при горении органических веществ:
- C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
- 2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
- KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
- Na2O + CO2 → Na2CO3
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ. CO2 + H2O ⇄ H2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
- Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
- CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)
- Средние и кислые соли
- Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
- Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
- LiHCO3 + LiOH → Li2CO3 + H2O
- Нагревание солей угольной кислоты
- При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на соответствующий оксид металла, углекислый газ и воду.
- MgCO3 → (t) MgO + CO2
- KHCO3 → (t) K2CO3 + CO2↑ + H2O
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха. MgCO3 + HCl → MgCl2 + CO2↑ + H2O Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Источник: https://studarium.ru/article/166
Углерод химические и физические свойства

Углерод – это, наверное, один из самых впечатляющих элементов химии на нашей планете, который обладает уникальной способностью образовывать огромное множество различных органических и неорганических связей.
Одним словом, углеродные соединения, которые обладают уникальными характеристиками – основа жизни на нашей планете.
Что такое углерод

В химической таблице Д.И. Менделеева углерод находится под шестым номером, входит в 14 группу и носит обозначение «С».
Физические свойства
Это водородное соединение, входящее в группу биологических молекул, молярная масса и молекулярная масса которого – 12,011, температура плавления составляет 3550 градусов.

- Степень окисления данного элемента может быть: +4, +3, +2, +1, 0, -1, -2, -3, -4, а плотность составляет 2,25 г/см3.
- В агрегатном состоянии углерод твердое вещество, а кристаллическая решетка атомная.
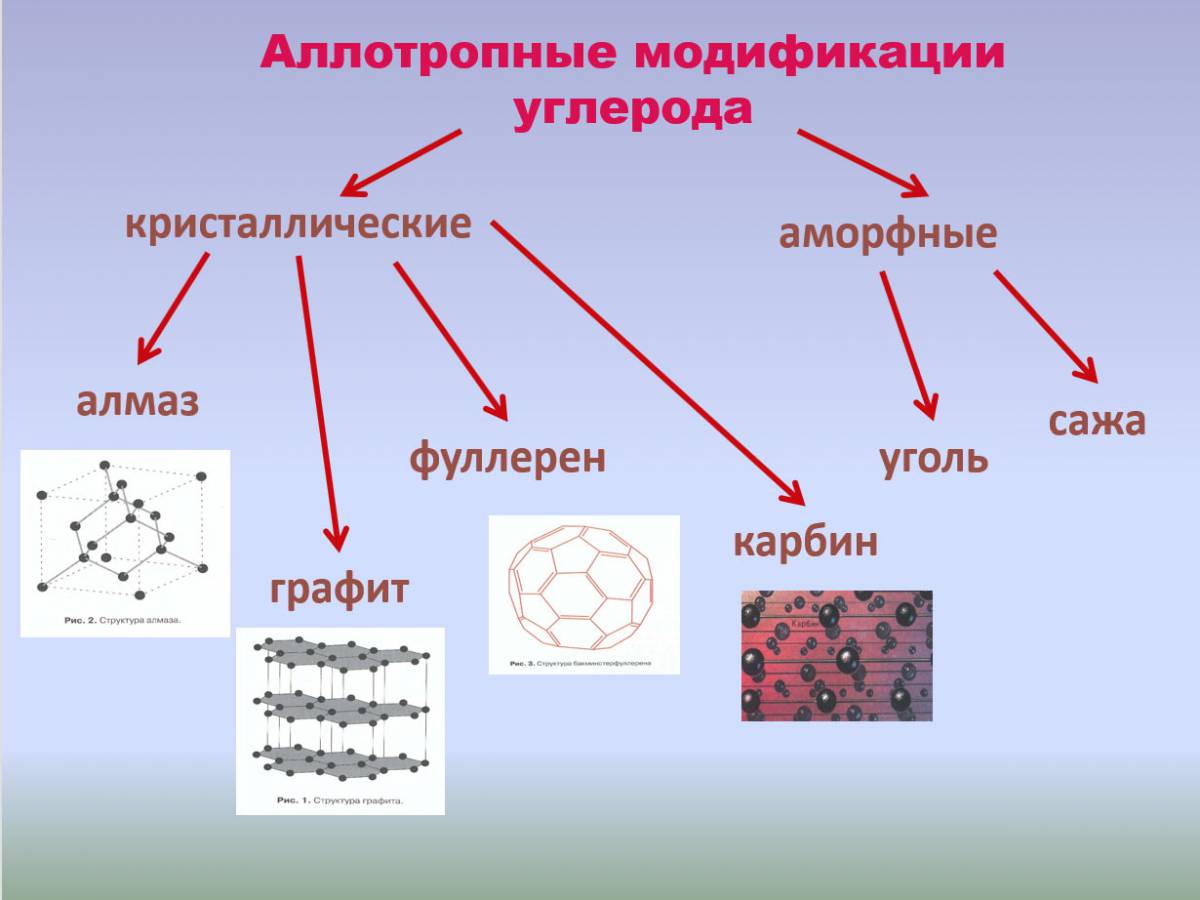
- Углерод имеет следующие аллотропные модификации:
- алмаз,
- графит,
- фуллерен,
- карбин.
Строение атома
Атом вещества имеет электронную конфигурацию вида 1S22S22P2. На внешнем уровне у атома 4 электрона, находящиеся на двух разных орбиталях.

Если же брать возбужденное состояние элемента, то его конфигурация становится 1S22S12P3.
К тому же атом вещества может быть первичным, вторичным, третичным и четвертичным.
Химические свойства

Пребывая в нормальных условиях, элемент инертен и во взаимодействие с металлами и неметаллами вступает при повышенных температурах:
- взаимодействует с металлами, вследствие чего образуются карбиды,
- вступает в реакцию с фтором (галоген),
- при повышенных температурах взаимодействует с водородом и серой,
- при повышении температуры обеспечивает восстановление металлов и неметаллов из оксидов,
- при 1000 градусах вступает во взаимодействие с водой,
- при повышении температуры горит.
Получение углерода
Углерод в природе можно найти в виде черного графита либо же, что очень редко, в виде алмаза. Ненатуральный графит получают с помощью реакции кокса с кремнеземом.

А ненатуральные алмазы получают, применяя тепло и давление вместе с катализаторами. Так металл расплавляется, а получившийся алмаз выходит в виде осадка.

Добавление азота приводит к получению желтоватых алмазов, а бора – голубоватых.
История открытия
Углерод использовался людьми с давних времен. Грекам был известен графит и уголь, а алмазы впервые нашлись в Индии. К слову, в качестве графита люди часто принимали схожие по виду соединения. Но даже несмотря на это, графит широко использовался для письма, ведь даже слово «графо» с греческого языка переводится как «пишу».

В настоящее время графит используется так же в письме, в частности его можно встретить в карандашах. В начале 18 века в Бразилии началась торговля алмазами, были открыты многие месторождения, а уже во второй половине 20 века люди научились получать ненатуральные драгоценные камни.
На настоящий момент ненатуральные алмазы используются в промышленности, а настоящие – в ювелирной сфере.
Роль углерода в организме человека
В тело человека углерод попадает вместе с пищей, в течение суток – 300 г. А общее количество вещества в человеческом организме составляет 21% от массы тела.

Из данного элемента состоят на 2/3 мышцы и 1/3 костей. А выводится из тела газ вместе с выдыхаемым воздухом либо же с мочевиной.
Стоит отметить: без этого вещества жизнь на Земле невозможна, ведь углерод составляет связи, помогающие организму бороться с губительным влиянием окружающего мира.
Таким образом, элемент способен составлять продолжительные цепи либо же кольца атомов, которые представляют собой основу для множества других важных связей.
Нахождение в природе углерода
Элемент и его соединения можно встретить повсюду. В первую очередь отметим, что вещество составляет 0,032% от общего количества земной коры.

Одиночный элемент можно встретить в каменном угле. А кристаллический элемент находится в аллотропных модификациях. Также в воздухе постоянно растет количество углекислого газа.
Большую концентрацию элемента в окружающей среде можно встретить в качестве соединений с различными элементами. Например, двуокись углерода содержится в воздухе в количестве 0,03%. В таких минералах как известняк или же мрамор, содержатся карбонаты.
Все живые организмы несут в себе соединения углерода с иными элементами. К тому же остатки живых организмов становятся такими отложениями, как нефть, битум.
Применение углерода
Соединения этого элемента широко используются во всех сферах нашей жизни и перечислять их можно бесконечно долго, поэтому мы укажем несколько из них:
- графит используется в грифелях карандашей и изготовлении электродов,
- алмазы нашли свое широкое применение в ювелирной сфере и в буровом деле,
- углерод используют как восстановитель для выведения таких элементов, как железная руда и кремний,
- активированный уголь, состоящий в основном из этого элемента, широко используется в медицинской области, промышленности и в быту.
Источник: https://tvercult.ru/nauka/uglerod-himicheskie-i-fizicheskie-svoystva
Углерод. Аллотропия углерода — урок. Химия, 8–9 класс
Углерод — химический элемент № (6). Он расположен в IVА группе Периодической системы.
C6+6)2e)4e
На внешнем слое атома углерода содержатся четыре валентных электрона, и до его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами углероду характерна степень окисления (–4), а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления: ( +2) или (+4).
В природе углерод встречается как в виде простых веществ, так и в виде соединений. В воздухе содержится углекислый газ.
В земной коре распространены карбонаты (например, CaCO3 образует мел, мрамор, известняк).
Горючие ископаемые (уголь, торф, нефть, природный газ) состоят из органических соединений, главным элементом которых является углерод.
Углерод относится к жизненно важным элементам, так как входит в состав молекул всех органических веществ.
Углерод образует несколько аллотропных видоизменений, из которых наиболее известны алмаз и графит.
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.
Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.

Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.

Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления ((3700) °С).

Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа, древесный уголь и кокс. Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией.

Аллотропные модификации углерода в химических реакциях могут проявлять и окислительные, и восстановительные свойства. Окислительные свойства углерода выражены слабее, чем у других неметаллов второго периода (азота, кислорода и фтора).
- Взаимодействие с металлами.
- Углерод реагирует с металлами при высокой температуре с образованием карбидов:
- 4Al0+3C0=tAl+34C−43.
- В этой реакции углерод выступает как окислитель.
- Взаимодействие с водородом.
Реакция происходит при сильном нагревании. Образуется метан. Углерод — окислитель.
C0+2H02=tC−4H+14.
- Взаимодействие с кислородом.
Углерод горит в кислороде с образованием углекислого газа и проявляет в этой реакции восстановительные свойства:
C0+O02=tC+4O−22.
- Взаимодействие с оксидами металлов.
- Углерод способен восстанавливать металлы из их оксидов:
- 2Cu+2O+C0=t2Cu0+C+4O2.
- Применение простых веществ
- Алмаз применяется:
- для обработки твёрдых поверхностей;
- для резки стекла;
- для изготовления буров и свёрл;
- для изготовления ювелирных украшений.
Графит используется:
- при изготовлении карандашей;
- как твёрдая смазка в подшипниках;
- для изготовления электродов;
- в качестве замедлителя нейтронов в ядерных реакторах;
- для получения искусственных алмазов.
Сажа:
- входит в состав типографской краски, крема для обуви;
- используется как наполнитель для производства резины.
Уголь используется:
- в противогазах, промышленных и бытовых фильтрах;
- для очистки сахарного сиропа, спирта и т. д.;
- в медицине.
Кокс применяется в металлургической промышленности.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/uglerod-i-ego-soedineniia-163475/re-28df6da6-8e46-4344-9b2d-1694f2fff357
Углерод — характеристика элемента и химические свойства
Характеристика углерода. Свойства простых веществ и соединений
 Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Физические свойства: углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа.
Атом углерода имеет 6 электронов: 1s22s22p2. Последние два электрона располагаются на отдельных р-орбиталях и являются неспаренными. В принципе, эта пара могла бы занимать одну орбиталь, но в таком случае сильно возрастает межэлектронное отталкивание. По этой причине один из них занимает 2рх, а другой, либо 2ру, либо 2рz-орбитали.
 Различие энергии s- и р-подуровней внешнего слоя невелико, поэтому атом довольно легко переходит в возбужденное состояние, при котором один из двух электронов с 2s-орбитали переходит на свободную 2р. Возникает валентное состояние, имеющее конфигурацию 1s22s12px12py12pz1. Именно такое состояние атома углерода характерно для решетки алмаза — тетраэдрическое пространственное расположение гибридных орбиталей, одинаковая длина и энергия связей.
Различие энергии s- и р-подуровней внешнего слоя невелико, поэтому атом довольно легко переходит в возбужденное состояние, при котором один из двух электронов с 2s-орбитали переходит на свободную 2р. Возникает валентное состояние, имеющее конфигурацию 1s22s12px12py12pz1. Именно такое состояние атома углерода характерно для решетки алмаза — тетраэдрическое пространственное расположение гибридных орбиталей, одинаковая длина и энергия связей.
Это явление, как известно, называют sp3-гибридизацией, а возникающие функции – sp3-гибридными. Образование четырех sp3-cвязeй обеспечивает атому углерода более устойчивое состояние, чем три р—р- и одна s—s-связи.
Помимо sp3-гибридизации у атома углерода наблюдается также sp2— и sp-гибридизация. В первом случае возникает взаимное наложение s- и двух р-орбиталей. Образуются три равнозначные sp2— гибридных орбитали, расположенные в одной плоскости под углом 120° друг к другу.
Третья орбиталь р неизменна и направлена перпендикулярно плоскости sp2.

При sp-гибридизации происходит наложение орбиталей s и р. Между двумя образующимися равноценными гибридными орбиталями возникает угол 180°, при этом две р-орбитали у каждого из атомов остаются неизменными.

Аллотрорпия углерода. Алмаз и графит
В кристалле графита атомы углерода расположены в параллельных плоскостях, занимая в них вершины правильных шестиугольников. Каждый из атомов углерода связан с тремя соседними sp2-гибридными связями. Между параллельными плоскостями связь осуществляется за счет ван-дер-ваальсовых сил.
Свободные р-орбитали каждого из атомов направлены перпендикулярно плоскостям ковалентных связей. Их перекрыванием объясняется дополнительная π-связь между атомами углерода.
Таким образом, от валентного состояния, в котором находятся атомы углерода в веществе, зависят свойства этого вещества.
Химические свойства углерода
Наиболее характерные степени окисления: +4, +2.
При низких температурах углерод инертен, но при нагревании его активность возрастает.
Углерод как восстановитель:
- — с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание: - 2C0 + O2 –t°= 2C+2O угарный газ
- — со фтором
С + 2F2 = CF4 - — с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Углерод как окислитель:
- — с некоторыми металлами образует карбиды
- 4Al + 3C0 = Al4C3
- Ca + 2C0 = CaC2-4
- — с водородом — метан (а также огромное количество органических соединений)
- C0 + 2H2 = CH4
- — с кремнием, образует карборунд (при 2000 °C в электропечи):
- Si + C = SiC.
Нахождение углерода в природе
Ссвободный углерод встречается в виде алмаза и графита.
В виде соединений углерод находится в составе минералов: мела, мрамора, известняка – СаСО3, доломита – MgCO3*CaCO3; гидрокарбонатов – Mg(НCO3)2 и Са(НCO3)2, СО2 входит в состав воздуха; углерод является главной составной частью природных органических соединений – газа, нефти, каменного угля, торфа, входит в состав органических веществ, белков, жиров, углеводов, аминокислот, входящих в состав живых организмов.

Неорганические соединения углерода
Ни ионы С4+ , ни С4- ‑ ни при каких обычных химических процессах не образуются: в соединениях углерода имеются ковалентные связи различной полярности.
Оксид углерода (II) СО
Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, t°кип = -192°C; t пл. = -205°C.
- Получение
1) В промышленности (в газогенераторах): - C + O2 = CO2
- CO2 + C = 2CO
- 2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH = H2O + CO - H2C2O4 = CO + CO2 + H2O
- Химические свойства
- При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид.
- 1) с кислородом
- 2C+2O + O2 = 2C+4O2
- 2) с оксидами металлов
- C+2O + CuO = Сu + C+4O2
- 3) с хлором (на свету)
- CO + Cl2 –hn= COCl2(фосген)
- 4) реагирует с расплавами щелочей (под давлением)
- CO + NaOH = HCOONa (формиат натрия)
- 5) с переходными металлами образует карбонилы
- Ni + 4CO –t°= Ni(CO)4
- Fe + 5CO –t°= Fe(CO)5
Оксид углерода (IV) СO2
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение.
Получение
- Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка:
CaCO3 –t°= CaO + CO2
- Действием сильных кислот на карбонаты и гидрокарбонаты:
- CaCO3 + 2HCl = CaCl2 + H2O + CO2
- NaHCO3 + HCl = NaCl + H2O + CO2
- Химические свойства СO2
Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты - Na2O + CO2 = Na2CO3
- 2NaOH + CO2 = Na2CO3 + H2O
- NaOH + CO2 = NaHCO3
- При повышенной температуре может проявлять окислительные свойства
- С+4O2 + 2Mg –t°= 2Mg+2O + C0
- Качественная реакция
- Помутнение известковой воды:
- Ca(OH)2 + CO2 = CaCO3¯(белый осадок) + H2O
Оно исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2
Угольная кислота и её соли
- H2CO3 — Кислота слабая, существует только в водном растворе:
- CO2 + H2O ↔ H2CO3
- Двухосновная:
H2CO3 ↔ H+ + HCO3— Кислые соли — бикарбонаты, гидрокарбонаты
HCO3— ↔ H+ + CO32- Cредние соли — карбонаты - Характерны все свойства кислот.
- Карбонаты и гидрокарбонаты могут превращаться друг в друга:
- 2NaHCO3 –t°= Na2CO3 + H2O + CO2
- Na2CO3 + H2O + CO2 = 2NaHCO3
- Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида:
- CuCO3 –t°= CuO + CO2
- Качественная реакция — «вскипание» при действии сильной кислоты:
- Na2CO3 + 2HCl = 2NaCl + H2O + CO2
- CO32- + 2H+ = H2O + CO2
Карбиды
- Карбид кальция:
- CaO + 3 C = CaC2 + CO
- CaC2 + 2 H2O = Ca(OH)2 + C2H2 .
- Ацетилен выделяется при реакции с водой карбидов цинка, кадмия, лантана и церия:
- 2 LaC2 + 6 H2O = 2La(OH)3 + 2 C2H2 + H2.
- Be2C и Al4C3 разлагаются водой с образованием метана:
- Al4C3 + 12 H2O = 4 Al(OH)3 = 3 CH4.
- В технике применяют карбиды титана TiC, вольфрама W2C (твердые сплавы), кремния SiC (карборунд – в качестве абразива и материала для нагревателей).
Цианиды
получают при нагревании соды в атмосфере аммиака и угарного газа:
Na2CO3 + 2 NH3 + 3 CO = 2 NaCN + 2 H2O + H2 + 2 CO2
Синильная кислота HCN – важный продукт химической промышленности, широко применяется в органическом синтезе. Ее мировое производство достигает 200 тыс. т в год. Электронное строение цианид-аниона аналогично оксиду углерода (II), такие частицы называют изоэлектронными:
- C=O: [:C=N:]–
- Цианиды (0,1-0,2%-ный водный раствор) применяют при добыче золота:
- 2 Au + 4 KCN + H2O + 0,5 O2 = 2 K[Au(CN)2] + 2 KOH.
- При кипячении растворов цианидов с серой или сплавлении твердых веществ образуются роданиды:
KCN + S = KSCN. - При нагревании цианидов малоактивных металлов получается дициан: Hg(CN)2 = Hg + (CN)2. Растворы цианидов окисляются до цианатов:
- 2 KCN + O2 = 2 KOCN.
- Циановая кислота существует в двух формах:
- H-N=C=O; H-O-C=N:
В 1828 г. Фридрих Вёлер (1800-1882) получил из цианата аммония мочевину: NH4OCN = CO(NH2)2 при упаривании водного раствора.
Это событие обычно рассматривается как победа синтетической химии над «виталистической теорией».
Существует изомер циановой кислоты – гремучая кислота
H-O-N=C.
Ее соли (гремучая ртуть Hg(ONC)2) используются в ударных воспламенителях.
Синтез мочевины (карбамида):
CO2 + 2 NH3 = CO(NH2)2 + H2O. При 1300С и 100 атм.
Мочевина является амидом угольной кислоты, существует и ее «азотный аналог» – гуанидин.
Карбонаты
Важнейшие неорганические соединения углерода – соли угольной кислоты (карбонаты). H2CO3 – слабая кислота (К1 =1,3·10-4; К2 =5·10-11). Карбонатный буфер поддерживает углекислотное равновесие в атмосфере. Мировой океан обладает огромной буферной емкостью, потому что он является открытой системой. Основная буферная реакция – равновесие при диссоциации угольной кислоты:
- H2CO3 ↔ H+ + HCO3— .
- При понижении кислотности происходит дополнительное поглощение углекислого газа из атмосферы с образованием кислоты:
CO2 + H2O ↔ H2CO3 . - При повышении кислотности происходит растворение карбонатных пород (раковины, меловые и известняковые отложения в океане); этим компенсируется убыль гидрокарбонатных ионов:
- H+ + CO32-↔ HCO3—
- CaCO3(тв.) ↔ Ca2+ + CO32-
Твердые карбонаты переходят в растворимые гидрокарбонаты. Именно этот процесс химического растворения избыточного углекислого газа противодействует «парниковому эффекту» – глобальному потеплению из-за поглощения углекислым газом теплового излучения Земли. Примерно треть мирового производства соды (карбонат натрия Na2CO3) используется в производстве стекла.
Источник: http://himege.ru/uglerod-xarakteristika-elementa-i-ximicheskie-svojstva/
Углерод

Углерод — это, пожалуй, основной и самый удивительный химический элемент на Земле, ведь с его помощью формируется колоссальное количество разнообразных соединений, как неорганических, так и органических. Углерод является основой всех живых существ, можно сказать, что углерод, наравне с водой и кислородом, — основа жизни на нашей планете! Углерод имеет разнообразие форм, которые не похожи ни по своим физико-химическим свойствам, ни по внешнему виду. Но всё это углерод!
История открытия углерода
Углерод был известен человечеству ещё с глубокой древности. Графит и уголь использовались ещё древними греками, а алмазы нашли применение в Индии. Правда, за графит частенько принимали похожие по внешнему виду соединения. Тем не менее, графит имел широкое применение в древности, в частности для письма.
Даже его название происходит от греческого слова «графо» — «пишу». Графит сейчас используется в карандашах. Алмазами начали впервые торговать в Бразилии в первой половине 18 века, с этого времени открыто множество месторождений, а в 1970 году была разработана технология получения алмазов искусственным путём.
Такие искусственные алмазы применяются в промышленности, натуральные же, в свою очередь, в ювелирном деле.
Углерод в природе
Содержание углерода в земной коре составляет всего около 0,15%. Казалось бы, один из основных элементов, а так мало… На самом деле, углерод подвержен постоянному круговороту из земной коры через биосферу в атмосферу и наоборот. Из углерода состоят природный газ, нефть, уголь, торф, известняки и многие другие соединения.
Наиболее значимое количество углерода собрано в атмосфере и гидросфере в виде углекислого газа. В атмосфере углерода содержится около 0,046%, а еще больше — в растворенном виде в Мировом Океане.
Кроме того, как мы видели выше, углерод является основой живых организмов. Например, в теле человека массой 70 кг содержится около 13 кг углерода! Это только в одном человеке! А углерод содержится также во всех растениях и животных. Вот и считайте…
 Круговорот углерода в природе
Круговорот углерода в природе
Аллотропные модификации углерода
Углерод — уникальный химический элемент, который образует так называемые аллотропные модификации, или, проще говоря, различные формы. Эти модификации подразделяются кристаллические, аморфные и в виде кластеров.
Кристаллические модификации имеют правильную кристаллическую решётку. К этой группе относятся: алмаз, фуллерит, графит, лонсдейлит, углеродные волокна и трубки. Подавляющее большинство кристаллических модификаций углерода на первых местах в рейтинге «Самые твёрдые материалы в мире» .
 Аллотропные формы углерода: a) лонсдейлит; б) алмаз;в) графит; г) аморфный углерод; д) C60 (фуллерен); е) графен;
Аллотропные формы углерода: a) лонсдейлит; б) алмаз;в) графит; г) аморфный углерод; д) C60 (фуллерен); е) графен;
ж) однослойная нанотрубка
Аморфные формы образованы углеродом с небольшими примесями других химических элементов. Основные представители этой группы: уголь (каменный, древесный, активированный), сажа, антрацит.
Самыми сложными и высокотехнологичными являются соединения углерода в виде кластеров. Кластеры — это особая структура, при которой атомы углерода расположены таким образом, что образуют полую форму, которая заполнена изнутри атомами других элементов, например, воды. В этой группе не так уж и много представителей, в неё входят углеродные наноконусы, астралены и диуглерод.
 Графит — «тёмная сторона» алмаза
Графит — «тёмная сторона» алмаза
Применение углерода
Углерод и его соединения имеют огромное значение в жизнедеятельности человека. Из углерода образованы главные виды топлива на Земле — природный газ и нефть. Соединения углерода широко применяются в химической и металлургической промышленности, в строительстве, в машиностроении и медицине.
Аллотропные модификации в виде алмазов используют в ювелирном деле, фуллерит и лонсдейлит в ракетостроении. Из соединений углерода изготавливаются различные смазки для механизмов, техническое оборудование и многое другое.
Промышленность в настоящее время не может обойтись без углерода, он используется везде!
Источник: http://www.alto-lab.ru/elements/uglerod/
Углерод и его соединения
Углерод встречается в природе, как в свободном виде, так и в соединениях. В свободном виде встречается в виде аллотропных видоизменений – алмаз, графит, карбин, фуллерен.

Алмаз
Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, ρ = 3,5 г/см3; t°пл. = 3730°C; t°кип. = 4830°C.
Можно получить из графита при p > 50 тыс. атм; t° = 1200°C.
- Применение:
- Шлифовальный порошок, буры, стеклорезы, после огранки — бриллианты.
- Графит
- Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток; ρ = 2,5 г/см3.
- Применение:
- Электроды, карандашные грифели, замедлитель нейтронов в ядерных реакторах, входит в состав некоторых смазочных материалов.
- Карбин
- Чёрный порошок; ρ = 2 г/см3; полупроводник.
- Состоит из линейных цепочек –C≡C–C≡C– и =С=С=С=С=.
- При нагревании переходит в графит.
В конце 80-х годов XX века было обнаружено ещё одно аллотропное видоизменение – фуллерит. Он, в отличие от алмаза и графита, имеет не атомную, а молекулярную кристаллическую решётку.
Атомы углерода могут образовывать также полые трубки – так называемые нанотрубки. В настоящее время фуллерены и нанотрубки рассматриваются в качестве основы для технологий будущего.
Соединения углерода весьма распространены: все живые организмы, каменный уголь, торф, нефть и др. содержат углерод. Углерод входит в состав многих неорганических веществ (известняк, мел, мрамор и др).
ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА
Углерод — малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
| С – восстановитель С0 – 4 е—→ С+4 или С0 – 2 е—→ С+2 |
С – окислитель С0 + 4 е—→ С-4 |
1) с кислородом
|
1) с некоторыми металлами образует карбиды
|
Оксид углерода(II) – СО
(угарный газ, окись углерода, монооксид углерода)
Физические свойства: бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
Источник: http://www.yoursystemeducation.com/uglerod-i-ego-soedineniya/
2.3.4. Химические свойства углерода и кремния
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем.
1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
- Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
- Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
- Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
- а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам.
Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
- Карбиды активных металлов гидролизуются водой:
- а также растворами кислот-неокислителей:
- При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
- При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
- С хлором, бромом и йодом кремний реагирует только при нагревании.
При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
- Так с хлором реакция протекает при 340-420 оС:
- С бромом – 620-700 оС:
- С йодом – 750-810 оС:
- Все галогениды кремния легко гидролизуются водой:
- а также растворами щелочей:
- Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
- При температуре 1200-1500 оС кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
- С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
- Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
- При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
- С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500оС. При этом образуется водород и диоксид кремния:
- Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
- Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-ugleroda-i-kremnija




