Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ?
В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда — CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos — соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp3
- Валентный угол (между химическими связями) составляет 109°28'

Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- В ходе крекинга нефти получается один алкан и один алкен.
- C8H18 → C4H8 + C4H10
- C12H26 → C6H12 + C6H14
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан. 
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия. Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3 CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
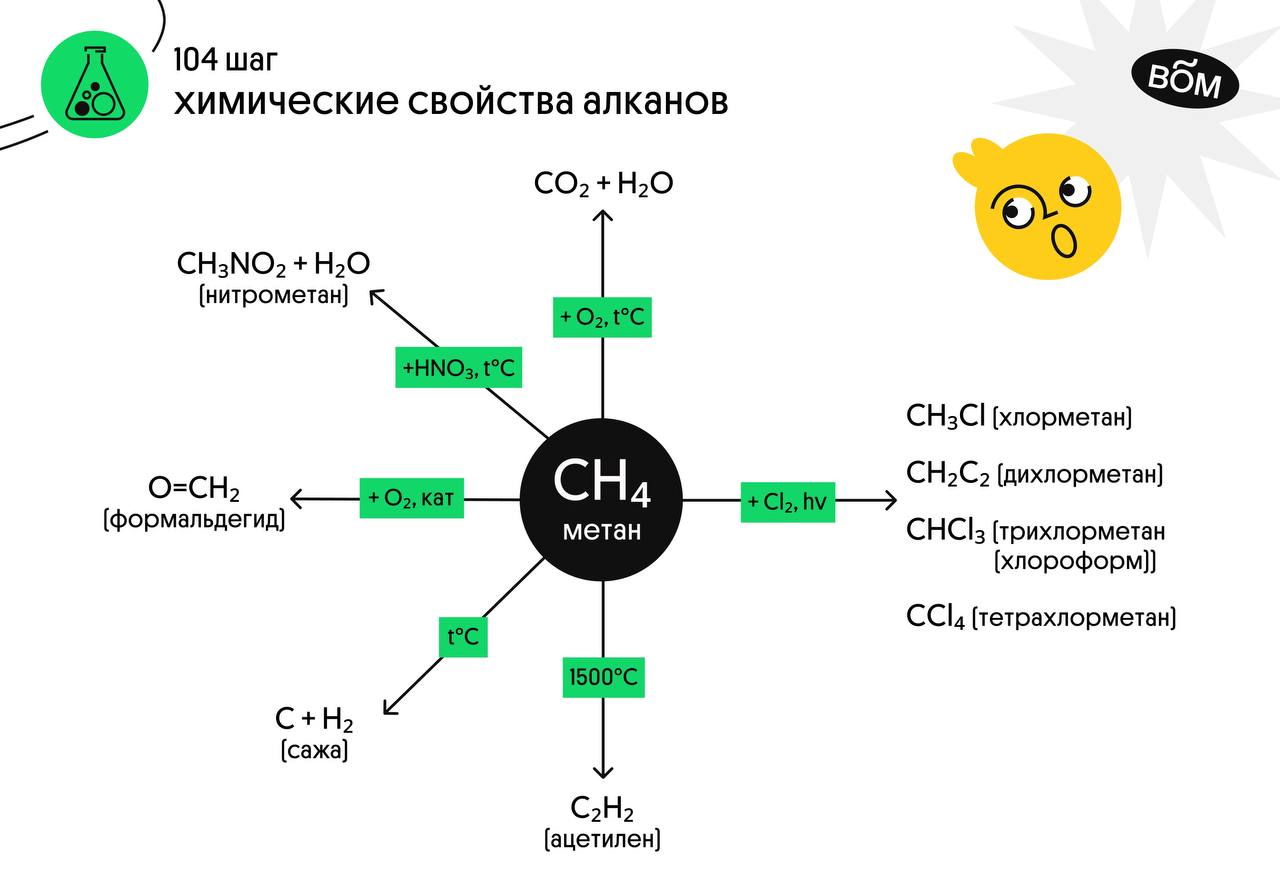
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
- С3H8 + O2 → CO2 + H2O
- В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
- CH4 + O2 → CH3-OH (метанол)
- Пиролиз
- CH4 → (t > 1000°С) C + H2
- CH4 → (t = 1500-1600°С) CH≡CH + H2↑
- CH4 → (t = 1200°С, кат., P) CH2=CH2 + H2↑
- C2H6 → (t = 1200°С, кат., P) CH2=CH2 + 2H2↑
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее — у вторичного и значительно труднее — у первичного. Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму. CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.
Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения — в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
Источник: https://studarium.ru/article/181
Алканы: химические и физические свойства, получение и применение в промышленности

Гомологический ряд метана

В случае с метаном CH4 можно привести общую формулу для алканов: CnH (2n+2), где n — это количество атомов углерода в соединении.
Приведём таблицу алканов, в которых n находится в пределах от 1 до 10.
Изомерия алканов
- Изомерами называют те вещества, молекулярная формула которых совпадает, однако строение или структура отличается.
- Для класса алканов характерны 2 типа изомерии: углеродного скелета и оптическая изомерия.
Приведём пример структурного изомера (т. е. вещества, отличающимся лишь строением углеродного скелета) для бутана C4H10.
Оптическими изомерами называют такие 2 вещества, молекулы которых имеют похожую структуру, но не могут быть совмещены в пространстве. Явление оптической или зеркальной изомерии возникает у алканов, начиная с гептана C7H16.
Номенклатура веществ
Чтобы дать алкану правильное название, необходимо воспользоваться номенклатурой ИЮПАК. Для этого использоваться следующая последовательность действий:
 Выбрать самую длинную неразветвленную цепь из атомов углерода.
Выбрать самую длинную неразветвленную цепь из атомов углерода.- Пронумеровать атомы в цепи. Нумерацию необходимо начинать с той стороны, к которой ближе находится заместитель (ответвление).
- Сформировать и записать название вещества. В его начале цифрами нужно указать, при каких атомах находятся заместители. После номера указывается их количество («ди» — 2 заместителя, «три» — 3, «тетра» — 4), затем через дефис — их названия, перечислять которые нужно в алфавитном порядке. После этого указывается наименование главной цепи. Названия заместителей формируются при помощи суффикса -ил: так, заместитель -CH3 получит название метил, а -CH2-CH2-CH3 — пропил. Главная цепь именуется так же, как и алкан с соответствующим количеством углеродных атомов.
По приведённому выше плану попробуем дать название следующему алкану.
 Нужно выбрать самую длинную цепь. Очевидно, что ей является последовательность из 7 атомов углерода.
Нужно выбрать самую длинную цепь. Очевидно, что ей является последовательность из 7 атомов углерода.- Следует определить, с какой стороны пойдёт нумерация. В конкретном случае она начнётся с того конца, ближе к которому находится ответвление, т. е. с левого края.
- В приведённой молекуле есть 4 заместителя с 1 атомом углерода (при 2, 4 и дважды при 5 атомах) и 1 заместитель с 2 атомами (при 4 атоме в главной цепи). Основная цепь состоит из 7 атомов, её название — гептан. Сформулированное для вещества имеет название: 2,3,5,5-тетраметил-4-этилгептан.
Физические свойства алканов
 В обычных условиях неразветвленные алканы с CH4 до C4H10 — это газообразные вещества, начиная с С5Н12 и до C13H28 — жидкие и обладающие специфическим запахом, все последующие — твёрдые. Получается, что с увеличением длины углеродной цепи растут температуры кипения и плавления. Чем сильнее разветвлена структура алкана, тем при более низкой температуре он кипит и плавится.
В обычных условиях неразветвленные алканы с CH4 до C4H10 — это газообразные вещества, начиная с С5Н12 и до C13H28 — жидкие и обладающие специфическим запахом, все последующие — твёрдые. Получается, что с увеличением длины углеродной цепи растут температуры кипения и плавления. Чем сильнее разветвлена структура алкана, тем при более низкой температуре он кипит и плавится.
Газообразные алканы не обладают цветом. А также все представители этого класса не могут растворяться в воде.
Алканы, имеющие агрегатное состояние газа, могут гореть, при этом пламя будет либо бесцветным, либо обладать бледно-голубым оттенком.
Химические свойства
В обычных условиях алканы достаточно малоактивны. Это объясняется прочностью σ-связей между атомами C-C и C-H. Поэтому необходимо обеспечить специальные условия (например, довольно высокую температуру или свет), чтобы проведение химической реакции стало возможным.
Реакции замещения
К реакциям этого типа относятся галогенирование и нитрование. Галогенирование (взаимодействие с Cl2 или Br2) происходит при нагревании или же под воздействием света. Во время реакции, протекающей последовательно, образуются галогеналканы.
Для примера можно записать реакцию хлорирования этана.
Бромирование будет проходить аналогичным образом.
Нитрование — это реакция со слабым (10%) раствором HNO3 или с оксидом азота (IV) NO2. Условия для проведения реакций — температура 140 °C и давление.
- C3H8 + HNO3 = C3H7NO2 + H2O.
- В результате образуются два продукта — вода и аминокислота.
Реакции разложения
При проведении реакций разложения всегда требуется обеспечивать высокую температуру. Это необходимо для разрыва связей между атомами углерода и водорода.
- Так, при проведении крекинга потребуется температура в интервале от 700 до 1000 °C. Во время реакции разрушаются -С-С- связи, образуется новый алкан и алкен:
- C8H18 = C4H10 + C4H8
Исключение — крекинг метана и этана. В результате этих реакций выделяется водород и образуется алкин ацетилен. Обязательным условием является нагревание до 1500 °C.
- C2H4 = C2H2 + H2
- Если превысить температуру в 1000 °C, можно добиться пиролиза с полным разрывом связей в соединении:
- C3H8 = 3C + 4H2
- Во время пиролиза пропила был получен углерод C, а также выделился водород H2.
Реакции дегидрирования
Дегидрирование (отщепление водорода) происходит по-разному для различных алканов. Условия проведения реакции — температура в пределах от 400 до 600 °C, а также присутствие катализатора, в роли которого могут выступать никель или платина.
- Из соединения, в углеродном скелете которого 2 или 3 атома C, образуется алкен:
- C2H6 = C2H4 + H2.
- Если в цепи молекулы 4—5 атомов углерода, то после дегидрирования получится алкадиен и водород.
- C5H12 = C4H8 + 2H2.
- Начиная с гексана, во время реакции образуется бензол или производные от него вещества.
- C6H14 = C6H6 + 4H2
- Следует также упомянуть реакцию конверсии, проводящуюся для метана при температуре 800 °C и в присутствии никеля:
- CH4 + H2O = CO + 3H2
- Для других алканов конверсия нехарактерна.
Окисление и горение
- Если алкан, нагретый до температуры не более 200 °C, будет взаимодействовать с кислородом в присутствии катализатора, то в зависимости от прочих условий проведения реакции будут различаться получаемые продукты: это могут быть представители классов альдегидов, карбоновых кислот, спиртов или кетонов.
- В случае полного окисления алкан сгорает до конечных продуктов — воды и CO2:
- C9H20 + 14O2 = 9CO2 + 10H2O
Если во время окисления количество кислорода оказалось недостаточным, конечным продуктом вместо углекислого газа станет уголь или CO.
Проведение изомеризации
Если обеспечить температуру около 100—200 градусов, для неразветвленных алканов становится возможна реакция перегруппировки. Второе обязательное условие для проведения изомеризации — присутствие катализатора AlCl3. В таком случае происходит изменение структуры молекул вещества и образуется его изомер.
Получение и применение алканов
 Значительную долю алканов получают, выделяя их из природного сырья. Чаще всего перерабатывают природный газ, главным компонентом, которого является метан или же подвергают крекингу и ректификации нефть.
Значительную долю алканов получают, выделяя их из природного сырья. Чаще всего перерабатывают природный газ, главным компонентом, которого является метан или же подвергают крекингу и ректификации нефть.
А также следует вспомнить о химических свойствах алкенов. В 10 классе одним из первых лабораторных способов, изучаемых на уроках химии, является гидрирование непредельных углеводородов.
- C3H6 + H2 = C3H8
- Например, в результате присоединения водорода к пропилену получается единственный продукт — пропан.
- При помощи реакции Вюрца из моногалогеналканов получают алканы, в структурной цепи которых число углеродных атомов удвоено:
- 2CH4H9Br + 2Na = C8H18 + 2NaBr.
- Ещё один способ получения — взаимодействие соли карбоновой кислоты со щёлочью при нагревании:
- C2H5COONa + NaOH = Na2CO3 + C2H6.
- Кроме того, метан иногда получают в электрической дуге (C + 2H2 = CH4) или при взаимодействии карбида алюминия с водой:
- Al4C3 + 12H2O = 3CH4 + 4Al (OH)3.
Алканы широко применяются в промышленности в качестве низкого по стоимости топлива. А также их используют как сырьё для синтеза других органических веществ. С этой целью обычно применяют метан, необходимый для получения аммиака и синтез-газа. Некоторые другие предельные углеводороды используют, чтобы получать синтетические жиры, а также как основу для смазочных материалов.
Для наилучшего понимания темы «Алканы» создан не один видеоурок, в котором подробно рассмотрены такие темы, как структура вещества, изомеры и номенклатура, а также показаны механизмы химических реакций.
Источник: https://tvercult.ru/nauka/alkanyi-fizicheskie-i-himicheskie-svoystva-primenenie
Что такое алканы
Алканами в химии называют предельные углеводороды, у которых углеродная цепь является незамкнутой и состоит из атомов углерода, связанных друг с другом при помощи одинарных связей.
Также характерной особенностью алканов есть то, что они совсем не содержат двойных либо тройных связей.
Порой алканы называют парафинами, дело в том, что парафины собственно и являются смесью предельных углеродов, то есть алканов.
Формула алканов
- Формулу алкана можно записать как:
- СnР2n+2
- При этом n больше или равно 1.
Изомерия алканов
Алканам свойственна изомерия углеродного скелета. При этом соединения могут принимать разные геометрические формы, как например это показано на картинке ниже.

Изомерия углеродного скелета алканов
С увеличением роста углеродной цепи увеличивается и количество изомеров. Так, например, у бутана есть два изомера.

Получение алканов
Алкан как правило получают различными синтетическими методами. Скажем, один из способов получения алкана предполагает реакцию «гидрирования», когда алканы добываются из ненасыщенных углеводов под воздействием катализатора и при температуре.
Физические свойства алканов
Алканы от других веществ отличаются полным отсутствием цвета, также они не растворим в воде. Температура плавления алканов повышается с увеличением их молекулярной массы и длины углеводородной цепи.
То есть чем более разветвленным является алкан, тем у него большая температура горения и плавления. Газообразные алканы и вовсе горят бледно-голубым или бесцветным пламенем, при этом выделяя много тепла.
Химические свойства алканов
Алканы в химическом плане малоактивные вещества, по причине прочности крепких сигма связей С-С и С-Н. При этом связи С-С неполярны, а С-Н малополярны.
А так как все это малополяризируемые виды связей, которые относятся к сигма виду, то разрываться они будут по механизму гомолитическому, в результате чего образуются радикалы.
И как следствия химические свойства алканов представляют собой в основном реакции радикального замещения.

Так выглядит формула химической реакции радикального замещения алканов (галогенирование алканов).
Помимо этого также можно выделить такие химические реакции как нитрирование алканов (реакция Коновалова).

Реакция эта протекает при температуре 140 С, причем лучше всего именно с третичным атомом углерода.
Крекинг алканов – эта реакция протекает при действии высоких температур и катализаторов. Тогда создаются условия, когда высшие алканы могут рвать свои связи образуя алканы более низкого порядка.

Окисление алканов – в различных условиях эта химическая реакция может привести к образованию спирта, альдегида и уксусной кислоты. При полном окислении реакция протекает вплоть до образования воды и углекислого газа.
Применение алканов
Алканы имеют широкое применение в таких промышленных сферах как синтез нефти, топлива и т. д.
Алканы, видео
И в завершение видео урок о сущности алканов.

При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник: https://www.poznavayka.org/himiya/alkanyi-opredelenie-stroenie-fizicheskie-i-himicheskie-svoystva/
Алканы: общие сведения. Физические и химические свойства алканов :
Предельные углеводороды – это такие соединения, которые представляют собой молекулы, состоящие из атомов углерода, находящихся в состоянии гибридизации sp3.
Они связаны между собой исключительно ковалентными сигма-связями. Название «предельные» или «насыщенные» углеводороды исходит из того факта, что эти соединения не имеют возможности присоединять какие-либо атомы.
Они предельны, полностью насыщены. Исключение составляют циклоалканы.
Что такое алканы?
Алканы – это углеводороды предельные, а их углеродная цепь незамкнута и состоит из атомов углерода, связанных между собой при помощи одинарных связей.
Она не содержит иных (то есть двойных, как у алкенов, или же тройных, как у алкилов) связей. Алканы также называют парафинами.
Это название они получили, так как общеизвестные парафины являются смесью преимущественно данных предельных углеводородов С18-С35 с особой инертностью.
Общие сведения об алканах и их радикалах
Их формула: СnР2n+2, здесь n больше или равно 1. Молярная масса вычисляется по формуле: М = 14n + 2. Характерная особенность: окончания в их названиях — «-ан». Остатки их молекул, которые образуются в результате замещения водородных атомов на иные атомы, имеют название алифатических радикалов, или алкилов.
Их обозначают буквой R. Общая формула одновалентных алифатических радикалов: СnР2n+1, здесь n больше или равно 1. Молярная масса алифатических радикалов вычисляется по формуле: М = 14n + 1. Характерная особенность алифатических радикалов: окончания в названиях «-ил».
Молекулы алканов имеют свои особенности строения:
- связь С-С характеризуется длиной 0,154 нм;
- связь С-Н характеризуется длиной 0,109 нм;
- валентный угол (угол между связями углерод-углерод) равен 109 градусов и 28 минут.
Начинают гомологический ряд алканы: метан, этан, пропан, бутан и так далее.
Физические свойства алканов
Алканы – это вещества, которые не имеют цвета и нерастворимы в воде. Температура, при которой алканы начинают плавиться, и температура, при которой они закипают, повышаются в соответствии с увеличением молекулярной массы и длины углеводородной цепи.
От менее разветвленных к более разветвленным алканам температуры кипения и плавления понижаются. Газообразные алканы способны гореть бледно-голубым либо бесцветным пламенем, при этом выделяется довольно много тепла. СН4-С4Н10 представляют собой газы, у которых отсутствует также и запах.
С5Н12-С15Н32 – это жидкости, которые обладают специфическим запахом. С15Н32 и так далее – это твердые вещества, которые также не имеют запаха.
Химические свойства алканов
Данные соединения являются малоактивными в химическом плане, что можно объяснить прочностью трудноразрываемых сигма-связей — С-С и С-Н. Также стоит учитывать, что связи С-С неполярны, а С-Н малополярны.
Это малополяризуемые виды связей, относящиеся к сигма-виду и, соответственно, разрываться по наибольшей вероятности они станут по механизму гомолитическому, в результате чего будут образовываться радикалы.
Таким образом, химические свойства алканов в основном ограничиваются реакциями радикального замещения.

Реакции нитрования
Алканы взаимодействуют только с азотной кислотой с концентрацией 10% либо с оксидом четырехвалентного азота в газовой среде при температуре 140°С. Реакция нитрования алканов носит название реакции Коновалова. В результате образуются нитросоединения и вода: CH4 + азотная кислота (разбавленная) = CH3 – NO2 (нитрометан) + вода.
Реакции горения
Предельные углеводороды очень часто применяются как топливо, что обосновано их способностью к горению: СnР2n+2 + ((3n+1)/2) O2 = (n+1) H2O + n СО2.
Реакции окисления
В химические свойства алканов также входит их способность к окислению. В зависимости от того, какие условия сопровождают реакцию и как их изменяют, можно из одного и того же вещества получить различные конечные продукты. Мягкое окисление метана кислородом при наличии катализатора, ускоряющего реакцию, и температуры около 200 °С может дать в результате следующие вещества:
- 1) 2СН4 (окисление кислородом) = 2СН3ОН (спирт – метанол).
- 2) СН4 (окисление кислородом) = СН2О (альдегид – метаналь или формальдегид) + Н2О.
- 3) 2СН4 (окисление кислородом) = 2НСООН (карбоновая кислота – метановая или муравьиная) + 2Н2О.

Также окисление алканов может производиться в газообразной или жидкой среде воздухом. Такие реакции приводят к образованию высших жирных спиртов и соответствующих кислот.
Отношение к нагреванию
При температурах, не превышающих +150-250°С, обязательно в присутствии катализатора, происходит структурная перестройка органических веществ, которая заключается в изменении порядка соединения атомов. Данный процесс называется изомеризацией, а вещества, полученные в результате реакции – изомерами.
Таким образом, из нормального бутана получается его изомер — изобутан.
При температурах 300-600°С и наличии катализатора происходит разрыв связей С-Н с образованием молекул водорода (реакции дегидрирования), молекул водорода с замыканием углеродной цепи в цикл (реакции циклизации или ароматизации алканов):
- 1) 2СН4 = С2Н4 (этен) + 2Н2.
- 2) 2СН4 = С2Н2 (этин) + 3Н2.
- 3) С7Н16 (нормальный гептан) = С6Н5 – СН3 (толуол) + 4Н2.
Реакции галогенирования
Такие реакции заключаются во введении в молекулу органического вещества галогенов (их атомов), в результате чего образуется связь С-галоген. При взаимодействии алканов с галогенами образуются галогенпроизводные. Данная реакция обладает специфическими особенностями.
Она протекает по механизму радикальному, и чтобы ее проинициировать, необходимо на смесь галогенов и алканов воздействовать ультрафиолетовым излучением или же просто нагреть ее. Свойства алканов позволяют реакции галогенирования протекать, пока не будет достигнуто полное замещение на атомы галогена.
То есть хлорирование метана не закончится одной стадией и получением метилхлорида. Реакция пойдет далее, будут образовываться все возможные продукты замещения, начиная с хлорметана и заканчивая тетрахлорметаном.
Воздействие хлора при данных условиях на другие алканы приведет к образованию различных продуктов, полученных в результате замещения водорода у различных атомов углерода. От температуры, при которой идет реакция, будет зависеть соотношение конечных продуктов и скорость их образования. Чем длиннее углеводородная цепь алкана, тем легче будет идти данная реакция.
При галогенировании сначала будет замещаться атом углерода наименее гидрированый (третичный). Первичный вступит в реакцию после всех остальных. Реакция галогенирования будет происходить поэтапно. На первом этапе заместиться только один атом водорода. C растворами галогенов (хлорной и бромной водой) алканы не взаимодействуют.

Реакции сульфохлорирования
Химические свойства алканов также дополняются реакцией сульфохлорирования (она носит название реакции Рида). При воздействии ультрафиолетового излучения алканы способны реагировать со смесью хлора и диоксида серы. В результате образуется хлороводород, а также алкильный радикал, который присоединяет к себе диоксид серы.
В результате получается сложное соединение, которое становится стабильным благодаря захвату атома хлора и разрушения очередной его молекулы: R–H + SO2 + Cl2 + ультрафиолетовое излучение = R–SO2Cl + HCl. Образовавшиеся в результате реакции сульфонилхлориды находят широкое применение в производстве поверхностно-активных веществ.
Источник: https://www.syl.ru/article/141249/mod_alkanyi-obschie-svedeniya-fizicheskie-i-himicheskie-svoystva-alkanov
Строение и физические свойства алканов
Алканы (парафины) – ациклические насыщенные углеводороды, состав которых выражается общей формулой CnH2n+2 (n – число атомов углерода). Рассмотрим химическое и пространственное строение алканов.
Атомы углерода в алканах связаны посредством одинарных связей. Значения электроотрицательностей атомов углерода и водорода равны 2,5 и 2,1 соответственно, т.е.
близки, поэтому С-С связи в алканах ковалентные неполярные, а С-Н связи – слабополярные.
В алканах одна s-орбиталь и три р-орбитали атомов углерода гибридизованы и находятся в состоянии sp3— гибридизации. Подробнее о гибридизации атомных орбиталей описано в разделе Химическая связь и строение молекул.
Четыре sp3-гибридные орбитали атома углерода направлены к вершинам тетраэдра, с углом между ними около 109°28′, и длиной связи С–С равной 1,54 Å – именно в этом случае отталкивание между электронами и энергия системы минимальны.
При перекрывании этих орбиталей друг с другом, и с s-орбиталями атомов водорода образуются σ-связи С–С и С–Н.

- В молекуле метана гибридизованные орбитали атома углерода перекрываются со сферическими орбиталями атомов водорода.
- Важно помнить, что в процессе гибридизации происходит только изменение формы орбиталей одного и того же атома, в то время как перекрывание орбиталей двух разных атомов приводит к возникновению химической связи между ними.
- Образование С-С – связей в молекулах алканов происходит за счет перекрывания гибридных орбиталей двух атомов углерода:

Физические свойства
При комнатной температуре алканы от С1 до С4 являются газами, от С5 до С16-жидкостями, а более высокие алканы — твердые и воскоподобные.
Температура кипения нормальных алканов увеличиваются с ростом углеводородной цепи, однако по мере роста числа атомов углерода в цепи темп ее увеличения замедляется. Кривая температуры плавления не имеет такой же плавной зависимости. Между нечетными и четными алканами наблюдается только небольшое нелинейное повышение температуры плавления, что представлено на рисунке ниже.

Физические свойства разветвленных алканов отличны от свойств н-алканов с таким же числом атомов углерода в цепи. Так, чем больше разветвлений в цепи, тем ниже их температуры кипения и плавления.
Циклоалканы С2-С3 – газы, высшие – жидкости или твердые вещества. Теппературы кипения циклоалканов примерно на 20 К выше, чем температуры кипения соответствующих н-алканов.
Растворимость
Растворимость алканов в воде ничтожна, однако в органических растворителях они хорошо растворяются.
Существует 2 эмпирических правила, которые связывают температуры плавления (или кипения) вещества с его растворимостью.
- Для веществ одинаковой химической природы, лучшую растворимость имеют вещества с более низкой температурой плавления, по сравнению с веществами с более высокой температурой плавления. Это объясняется тем, что силы взаимодействия внутри кристаллической решетки, которые должны преодалеваться при растворении более слабые у веществ с низкой температурой плавления.
- Для веществ одинаковой химической природы, лучшую растворимость имеют вещества с более низкой температурой кипения, по сравнению с веществами с более высокой температурой плавления.
Все растворители можно разделить на:
- Растворители с сильными (например, вода) межмолекулярными. Здесь действуют такие межмолекулярные силы как силы Ван-дер-Ваальса, дипольное притяжение, водородные связи, связывающие отдельные молекулы воды.
- Растворители с слабыми (бензол, гексан) межмолекулярными взаимодействиями. Здесь действуют в основном силы Ван-дер-Ваальса.
Чтобы вещество растворилось в воде необходимо чтобы энергия, выделяющаяся при растворении была достаточной для преодаления как сил сцепления между молекулами растворяемого вещества, так и сильных сил сцепления между молекулами воды. Силы сцепления в бензоле или гексане могут быть легко преодалены, в независимости от энергии, необходимой для разделения самих частиц растворенного вещества.
Значимым параметром при растворении вещества является температура. В основном (хотя и не всегда) увеличение температуры ведет к увеличению растворимости.
Углеводороды и в частности алканы, в которых силы сцепления слабы, будут растворяться в растворителях, межмолекулярные силы сцепления в которых также слабы (неполярные растворители).
В этом влучае, первоначально существующие силы заменяются на равноценные и значительных изменений энергии не происходит. В силу отсутствия сильно электроотрицательных атомов в молекулах углеводородов, они не способны к прочному сцеплению с молекулами воды.
Разрыв межмолекулярных связей молекулы воды энергетически невыгоден и углеводороды в ней нерастворимы.
В растворителях меньшей полярности и с меньшей склонностью к образованию водородных связей углеводороды способны более или менее растворяться.
Также следует помнить, что водородная связь в воде, чем в других ассоциированных растворителях, так что растворимость углеводородов в них будет выше по сравнению с растворимостью в воде.
Кроме этого, с увеличением углеводородного остатка растворителя, его химическая природа приближается к природе растворенного вещества и тенденция к растворимости увеличивается. Например, при комнатной температуре гексан не растворяется в метаноле, но растворяется в этаноле.
Номенклатура и изомерия алканов описаны в разделе Номенклатура и изомерия органических соединений
Источник: http://zadachi-po-khimii.ru/organic-chemistry/stroenie-i-fizicheskie-svojstva-alkanov.html
Урок №7. Физические и химические свойства алканов — ХиМуЛя.com
- Физические
свойства - В
обычных условиях - С1-
С4 – газы - С5-
С15 – жидкие - С16
– твёрдые
Температуры плавления и кипения алканов,
их плотности увеличиваются в гомологическом ряду с ростом молекулярной массы.
Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных
растворителях (например, в бензоле) и сами являются хорошими растворителями. Физические
свойства некоторых алканов представлены в таблице.
Таблица 2. Физические свойства некоторых алканов
| Название | Формула | tпл °С | tкип °С |
| Метан | СН4 | -182,5 | -161,5 |
| Этан | С2Н6 | -182,8 | -88,6 |
| Пропан | С3Н8 | -187,7 | -42 |
| Бутан | С4Н10 | -138,3 | -0,5 |
| Пентан | C5H12 | -129,7 | +36,1 |
| Гексан | С6Н14 | -95,3 | 68,7 |
| Гептан | С7H16 | -90,6 | 98,4 |
| Октан | C8H18 | -56,8 | 124,7 |
| Нонан | С9Н20 | -53,7 | 150,8 |
| Декан | C10H22 | -29,6 | 174,0 |
| Пентадекан | C15H32 | +10 | 270,6 |
| Эйкозан | С20Н42 | 36,8 | 342,7 |
| Пентакозан | C25H52 | 53,7 | 400 |
Химические свойства алканов
1. Реакции замещения.
а)
Галогенирование
при действии
света — hν или нагревании (стадийно – замещение атомов
водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик,
академик, лауреат Нобелевской премии Н. Н. Семёнов )
- В
реакции образуются вещества галогеналканы
RГ или
СnH2n+1Г - (Г — это галогены F, Cl, Br, I)
- CH4 + Cl2 hν → CH3Cl + HCl (1 стадия)
; - метан хлорметан CH3Cl + Cl2 hν → CH2Cl2 + HCl
(2 стадия); - дихлорметан
- СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия);
- трихлорметан
- CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия).
- тетрахлорметан
- Скорость реакции замещения водорода на атом галогена у
галогеналканов выше, чем у соответствующего алкана, это связано с взаимным
влиянием атомов в молекуле:
Источник: https://www.sites.google.com/site/himulacom/zvonok-na-urok/10-klass—tretij-god-obucenia/urok-no7-fiziceskie-i-himiceskie-svojstva-alkanov
Алканы: физические и химические свойства, получение и применение
- I. Физические свойства
- В обычных условиях
- С1- С4 – газы
- С5- С15 – жидкие
- С16 – твёрдые
Температуры плавления и кипения алканов, их плотности увеличиваются в гомологическом ряду с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями. Физические свойства некоторых алканов представлены в таблице.
Таблица 2. Физические свойства некоторых алканов
| Название | Формула | tпл °С | tкип °С |
| Метан | СН4 | -182,5 | -161,5 |
| Этан | С2Н6 | -182,8 | -88,6 |
| Пропан | С3Н8 | -187,7 | -42 |
| Бутан | С4Н10 | -138,3 | -0,5 |
| Пентан | C5H12 | -129,7 | +36,1 |
| Гексан | С6Н14 | -95,3 | 68,7 |
| Гептан | С7H16 | -90,6 | 98,4 |
| Октан | C8H18 | -56,8 | 124,7 |
| Нонан | С9Н20 | -53,7 | 150,8 |
| Декан | C10H22 | -29,6 | 174,0 |
| Пентадекан | C15H32 | +10 | 270,6 |
| Эйкозан | С20Н42 | 36,8 | 342,7 |
| Пентакозан | C25H52 | 53,7 | 400 |
- Плотности алканов
- II. Химические свойства алканов
- 1. Реакции замещения
- а) Галогенирование
При действии света — hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов )
- В реакции образуются вещества галогеналканы RГ или Сn H2n+1Г
- (Г — это галогены F, Cl, Br, I)
- CH4 + Cl2 hν → CH3Cl + HCl (1 стадия)
- метан хлорметан
- CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия)
- дихлорметан
- СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия)
- трихлорметан
- CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия)
- тетрахлорметан
- Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
Источник: https://kardaeva.ru/dlya-uchenika/10-klass/94-uroki/266-alkany-fizicheskie-i-khimicheskie-svojstva-poluchenie-i-primenenie
Физические и химические свойства алканов
ЗНАНИЯ
Физические свойства
Метан (СН4) – это природный газ, бесцветный, не имеющий запах и вкус. Метан применяют в качестве топлива. Малорастворим в воде и почти вдвое легче воздуха. Молекулярная масса его составляет 16 г/моль; tплав = -182,49оС; tкип. = -161,56оС; tвспышки = -87,8оС; tсамовоспламенения = -537,8оС.
Этан, пропан и бутан являются газообразными веществами, далее от пентана до пентадекана – составляют жидкие вещества и следующие предельные углеводороды – твердые вещества. В обычных температурных условиях под высоким давлением газообразные вещества могут находиться в виде жидкостей.
Это является их отличительным свойством и успешно применяется при их транспортировке.
- Химические свойства
- Для алканов характерны реакции замещения, которые в свою очередь, делятся на реакции галогенирования и реакцию нитрования. Рассмотрим первый случай:
- 1) Реакция галогенирования в алканах
Например, взаимодействие метана с хлором протекает под действием света(hν) или действуют на реакцию нагреванием. Происходит стадийное замещение атомов водорода на галоген. Реакция носит последовательный цепной характер.
В результате образуются такие соединения, как галогеналканы RНаl или СnH2n+1Hal, где Hal– это F, Cl, Br и I.
Реакции взаимодействия алканов с галогенами протекают достаточно сложно. Такой тип реакций относят к свободнорадикальному механизму. Напомним, что молекулы хлора распадаются на атомы под действием световой энергии:
Атомы хлора с одним неспаренным электроном являются химически активными. В результате его взаимодействии с метаном образуется также свободный и химически очень активный радикал – метил (СН3-), активность которого определяется также наличием неспаренного электрона:
В данном случае радикал метил моментально вступает в химическую реакцию уже с другой молекулой хлора, при этом разрываются связи между атомами и отщепляются свободные атомы хлора с неспаренными электронами. В результате получаются новые химически активные частицы, которые последовательно вызывают дальнейшие процессы.
Необходимо отметить, что значимый вклад в учении о химических процессах, катализе, а также цепных реакций внёс русский физик и физико-химик, академик, лауреат Нобелевской премии (1956 г) Николай Николаевич Семёнов (1896 – 1987).
Таким образом, цепными реакциями называют такие химические реакции, в ходе которых происходит цепь последовательных превращений.
- Полученные соединения называют галогенпроизводными, большинство из которых применяют в качестве растворителей.
- Взаимодействие с другими галогенами проводят гораздо реже, так как, например, реакция с фтором сопровождается взрывом, с бромом требуется инициатор, а в случае с йодом реакция обратима и поэтому, для удаления HI из реакции необходимо применять окислитель.
- 2) Реакции горения
- В результате реакций горения алканов образуется оксид углерода(IV) и вода. Общую формулу можно записать так:
- CnH2n+2 + O2t°С → nCO2 + (n+1)H2O
Однако важно помнить, что химическая реакция метана с кислородом в отношениях 1:2 или с воздухом 1:10 при поджигании – взрывоопасна! Это касается также этана, пропана и бутана, образующиеся в каменноугольных шахтах, заводских котельных и в жилых помещениях.
3) Реакции разложения
При нагревании выше 1000оС алканы разлагаются, например, метан:
При более продолжительном их нагревании(до 1500оС) происходит радикальный разрыв связей С-С (крекинг) и в результате образуются алкены. Реакция протекает под действием катализаторов. Например, при крекинге метана и этана образуется ацетилен:
Этилен успешно применяют в получении синтетических каучуков, спиртов, и много других веществ, используемых в быту.
4) Реакции изомеризации
Источник: http://uchilegko.info/chemistry/fizicheskie-i-himicheskie-svoystva-alkanov






