Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2. Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.

Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
- Дегидрирование алканов
- Дегидрогалогенирование галогеналканов
- Дегалогенирование дигалогеналканов
- Внутримолекулярная дегидратация спиртов
В результате крекинга нефти образуется один алкан и один алкен. C12H26 → C6H12 + C6H14
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный. CH3-CH3 → (t, кат) CH2=CH2 + H2 
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода. 
В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь. 
При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен. Внутримолекулярная дегидратация спиртов происходит при t > 140 °C. 
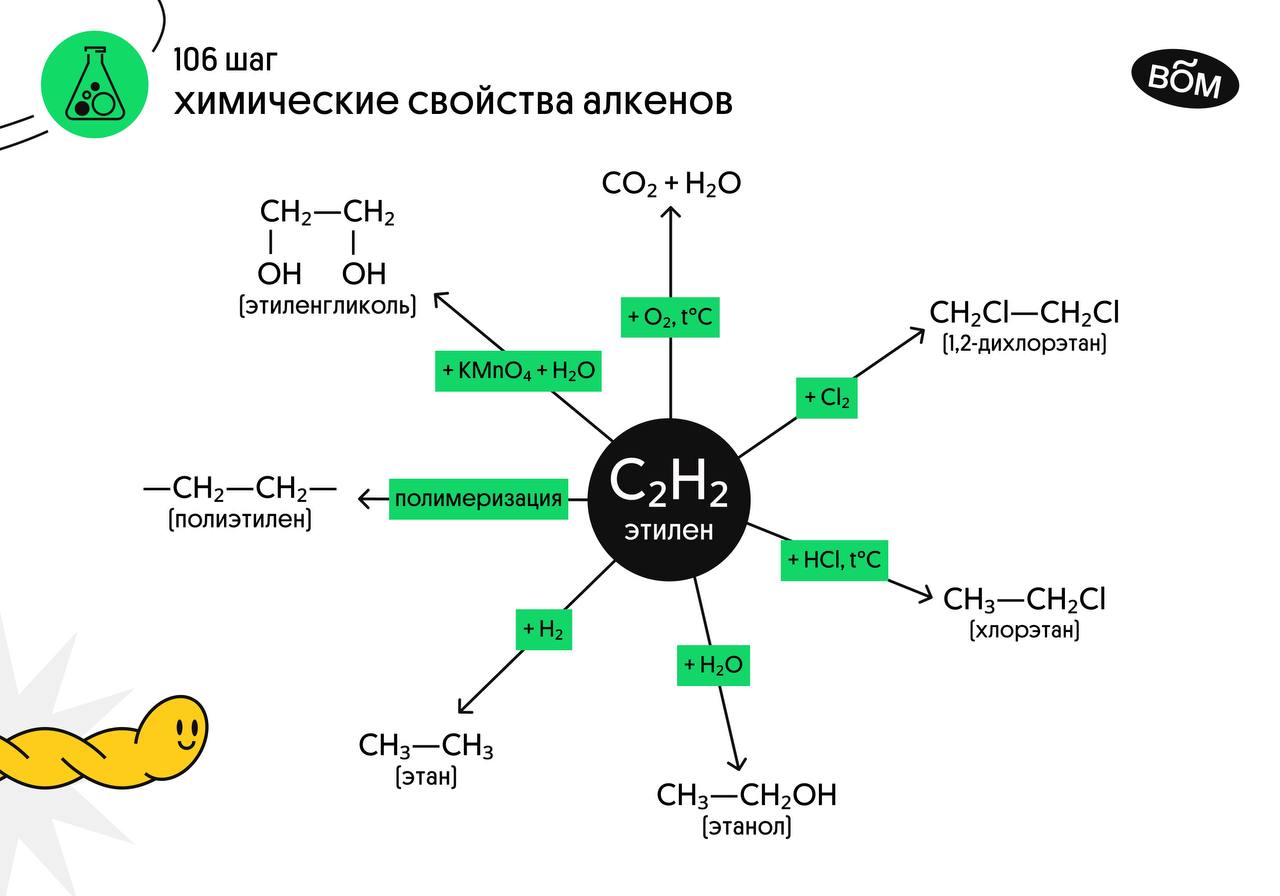
Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Гидратация
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь). 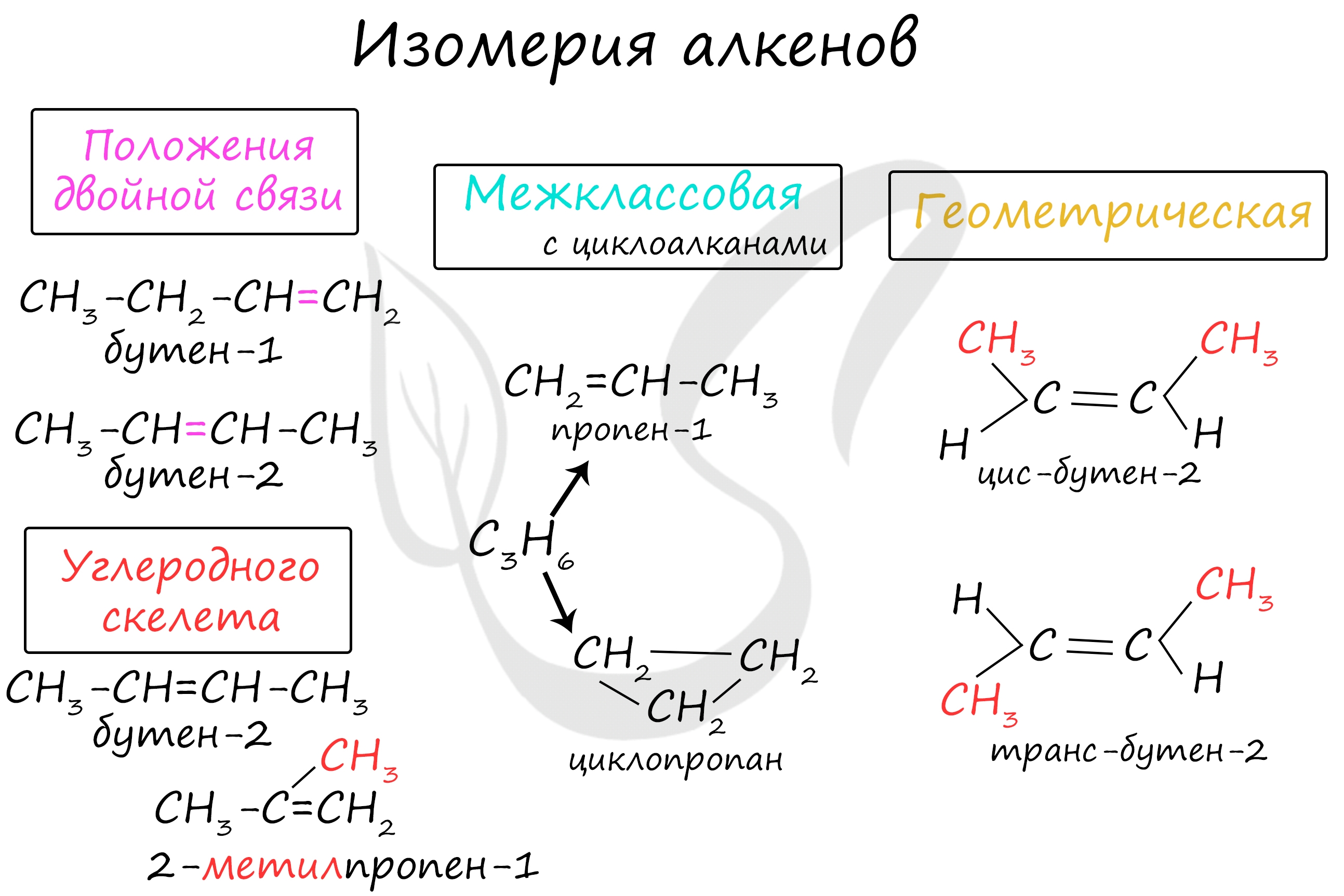
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу. Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы. 
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения. Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода. 
Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа — к наименее гидрированному. 
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном окислении образуются окиси. Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2. В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной связи.
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров. Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
Источник: https://studarium.ru/article/183
Физические свойства алкенов, применение, способы получения :
Органические соединения, содержащие пи-связь – это непредельные углеводороды. Они являются производными алканов, в молекулах которых произошло отщепление двух атомов водорода.
Образовавшиеся свободные валентности формируют новый тип связи, которая располагается перпендикулярно плоскости молекулы. Так возникает новая группа соединений – алкены.
Физические свойства, получение и применение веществ этого класса в быту и промышленности мы рассмотрим в этой статье.

Гомологический ряд этилена
Общая формула всех соединений, называемых алкенами, отражающая их качественный и количественный состав, – это CnH2n.
Названия углеводородов по систематической номенклатуре имеют следующий вид: в термине соответствующего алкана изменяется суффикс с -ан на -ен, например: этан – этен, пропан — пропен и т. д.
В некоторых источниках можно встретить еще одно название соединений этого класса – олефины. Далее мы изучим процесс образования двойной связи и физические свойства алкенов, а также определим их зависимость от строения молекулы.
Как образуется двойная связь
Электронную природу пи-связи на примере этилена можно представить следующим образом: атомы карбона в его молекуле находятся в форме sp2-гибридизации. В этом случае формируется сигма-связь.
Еще две гибридные орбитали – по одной от атомов углерода, формируют простые сигма-связи с водородными атомами. Два оставшихся свободных гибридных облака атомов карбона перекрываются над и под плоскостью молекулы – образуется пи-связь.
Именно она определяет физические и химические свойства алкенов, речь о которых пойдет далее.

Пространственная изомерия
Соединения, имеющие один и тот же количественный и качественный состав молекул, но различное пространственное строение, называются изомерами. Изомерия встречается в группе веществ, называемых органическими. На характеристику олефинов большое влияние оказывает явление оптической изомерии.
Она выражается в том, что гомологи этилена, содержащие у каждого из двух углеродных атомов при двойной связи различные радикалы или заместители, могут встречаться в форме двух оптических изомеров. Они отличаются друг от друга положением заместителей в пространстве относительно плоскости двойной связи.
Физические свойства алкенов в этом случае также будут разными. Например, это касается температур кипения и плавления веществ. Так, олефины неразветвленного строения углеродного скелета имеют более высокие температуры кипения, чем соединения-изомеры. Также температуры кипения цис-изомеров алкенов выше, чем транс-изомеров.
В отношении температур плавления картина противоположная.
Сравнительная характеристика физических свойств этилена и его гомологов
Первые три представителя олефинов являются газообразными соединениями, затем, начиная с пентена C5H10 и до алкена с формулой C17H34, – жидкости, а далее идут твердые вещества. У гомологов этена прослеживается следующая тенденция: температуры кипения соединений снижаются. Например, у этилена этот показатель равен -169,1°C, а у пропилена -187,6°C.
Зато температуры кипения с увеличением молекулярной массы повышаются. Так, у этилена она равна -103,7°C, а у пропена -47,7°C. Подводя итог сказанному, можно сделать вывод, звучащий кратко: физические свойства алкенов зависят от их молекулярной массы.
С ее увеличением изменяется агрегатное состояние соединений в направлении: газ – жидкость – твердое вещество, а также снижается температура плавления, а температуры кипения возрастают.

Характеристика этена
Первый представитель гомологического ряда алкенов – это этилен. Он является газом, малорастворимым в воде, но хорошо растворяющимся в органических растворителях, не имеющим цвета. Молекулярная масса — 28, этен немного легче воздуха, имеет едва уловимый сладковатый запах. Он легко вступает в реакции с галогенами, водородом и галогеноводородами.
Физические свойства алкенов и парафинов тем не менее достаточно близки. Например, агрегатное состояние, способность метана и этилена к жесткому окислению и т. д. Как же можно различить алкены? Как выявить непредельный характер олефина? Для этого существуют качественные реакции, на которых мы и остановимся подробнее.
Напомним, какую особенность в строении молекулы имеют алкены. Физические и химические свойства этих веществ определяются наличием в их составе двойной связи. Чтобы доказать ее присутствие, пропускают газообразный углеводород через фиолетовый раствор перманганата калия или бромную воду. Если они обесцветились, значит, соединение содержит в составе молекул пи-связи.
Этилен вступает в реакцию окисления и обесцвечивает растворы KMnO4 и Br2 .
Механизм реакций присоединения
Разрыв двойной связи заканчивается присоединением к свободным валентностям карбона атомов других химических элементов. Например, при взаимодействии этилена с водородом, называемом гидрогенизацией, получается этан.
Необходим катализатор, например порошковидный никель, палладий или платина. Реакция с HCl заканчивается образованием хлорэтана.
Алкены, содержащие более двух атомов углерода в составе своих молекул, проходят реакцию присоединения галогеноводородов с учетом правила В. Марковникова.

Как гомологи этена взаимодействуют с галогеноводородами
Если перед нами стоит задание «Охарактеризуйте физические свойства алкенов и их получение», нам нужно рассмотреть правило В. Марковникова более подробно.
Практическим путем установлено, что гомологи этилена реагируют с хлороводородом и другими соединениями по месту разрыва двойной связи, подчиняясь некоторой закономерности.
Она заключается в том, что атом водорода присоединяется к наиболее гидрогенизированному углеродному атому, а ион хлора, брома или йода – к карбоновому атому, содержащему наименьшее количество атомов водорода. Эта особенность протекания реакций присоединения получила название правила В. Марковникова.
Гидратация и полимеризация
Продолжим далее рассматривать физические свойства и применение алкенов на примере первого представителя гомологического ряда – этена. Его реакция взаимодействия с водой используется в промышленности органического синтеза и имеет важное практическое значение. Впервые процесс был проведен еще в XIX веке А.М.
Бутлеровым. Реакция требует выполнения ряда условий. Это, прежде всего, использование концентрированной серной кислоты или олеума в качестве катализатора и растворителя этена, давление порядка 10 атм и температура в пределах 70°. Процесс гидратации происходит в две фазы.
Вначале по месту разрыва пи-связи к этену присоединяются молекулы сульфатной кислоты, при этом образуется этилсерная кислота. Затем полученное вещество реагирует с водой, получается этиловый спирт.
Этанол – важный продукт, применяемый в пищевой промышленности для получения пластмасс, синтетических каучуков, лаков и других продуктов органической химии.

Полимеры на основе олефинов
Продолжая изучать вопрос применения веществ, относящихся к классу алкенов, изучим процесс их полимеризации, в котором могут участвовать соединения, содержащие непредельные химические связи в составе своих молекул.
Известно несколько типов реакции полимеризации, по которым происходит образование высокомолекулярных продуктов – полимеров, например таких как полиэтилен, полипропилен, полистирол и т. д. Свободнорадикальный механизм приводит к получению полиэтилена высокого давления.
Это одно из наиболее широко применяемых соединений в промышленности. Катионно-ионный тип обеспечивает получение полимера стереорегулярного строения, например полистирола. Он считается одним из наиболее безопасных и удобных в использовании полимеров.
Изделия из полистирола устойчивы к агрессивным веществам: кислотам и щелочам, негорючие, легко окрашиваются. Еще один вид механизма полимеризации – димеризация, он приводит к получению изобутена, применяемого в качестве антидетонационной добавки к бензину.
Способы получения
Алкены, физические свойства которых мы изучаем, получают в лабораторных условиях и промышленности различными методами. В опытах в школьном курсе органической химии используют процесс дегидратации этилового спирта с помощью водоотнимающих средств, например таких, как пятиокись фосфора или сульфатная кислота.
Реакция проводится при нагревании и является обратной процессу получения этанола.
Еще один распространенный способ получения алкенов нашел свое применение в промышленности, а именно: нагревание галогенопроизводных предельных углеводородов, например хлорпропана с концентрированными спиртовыми растворами щелочей – гидроксида натрия или калия.
В реакции происходит отщепление молекулы хлороводорода, по месту появления свободных валентностей атомов карбона образуется двойная связь. Конечным продуктом химического процесса будет олефин – пропен. Продолжая рассматривать физические свойства алкенов, остановимся на главном процессе получения олефинов — пиролизе.
Промышленное производство непредельных углеводородов ряда этилена
Дешевое сырье – газы, образующиеся в процессе крекинга нефти, служат источником получения олефинов в химической промышленности. Для этого применяют технологическую схему пиролиза – расщепление газовой смеси, идущее с разрывом углеродных связей и образованием этилена, пропена и других алкенов.
Пиролиз проводят в специальных печах, состоящих из отдельных пирозмеевиков. В них создается температура порядка 750-1150°C и присутствует водяной пар в качестве разбавителя. Реакции происходят по цепному механизму, идущему с образованием промежуточных радикалов.
Конечный продукт – это этилен или пропен, их получают в больших объемах.

Мы подробно изучили физические свойства, а также применение и способы получения алкенов.
Источник: https://www.syl.ru/article/369749/fizicheskie-svoystva-alkenov-primenenie-sposobyi-polucheniya
Алкены
Алкены – углеводороды, содержащие в своей молекуле одну двойную связь. Также могут быть классифицированы как ненасыщенные углеводороды (наравне с алкинами и алкадиенами).
Общая формула: CnH2n.
Гибридизация
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации, остальные атомы углерода находятся в состоянии sp3-гибридизации.
Виды изомерии: изомерия цепи, изомерия положения двойной связи, межклассовая изомерия с циклоалканами, цис-транс-изомерия.
Номенклатура
Название алкенов образуется из названия алкильного радикала с суффиксом -ен.
Физические свойства
Физические свойства алкенов практически не отличаются от таковых у соответствующих алканов. Низшие алкены (C2–C4) – газы при нормальных условиях, средние (до C17) – жидкие, высшие являются твердыми веществами. Все алкены нерастворимы в воде и хорошо растворяются в органических растворителях.
Химические свойства
За счет электронов p-связи в молекулах алкенов имеется область повышенной электронной плотности (облако p-электронов над и под плоскостью молекулы). Поэтому двойная связь склонна подвергаться атаке электрофильным (электронодефицитным) реагентом. В этом случае будет происходить гетеролический разрыв связей и реакция пойдет по ионному механизму как электрофильное присоединение.
С другой стороны, углерод-углеродная p-связь, являясь неполярной, может разрываться гомолитически, и тогда реакция будет идти по радикальному механизму.
Для алкенов наиболее характерны реакции присоединения по двойной связи.
Присоединение галогенов по двойной связи С=С происходит легко в обычных условиях (при комнатной температуре, без катализатора). Например, быстрое обесцвечивание синей окраски раствора брома в воде (бромной воды) служит качественной реакцией на наличие двойной связи. Эти реакции протекают по механизму электрофильного присоединения с гетеролитическим разрывом связей в молекуле галогена.


Окисление алкенов
Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакция Вагнера).
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4, поэтому она используется как качественная реакция на алкены. Также возможно окисление до спиртов, альдегидов, кислот, а также полное окисление до углекислого газа и воды (горение).
Источник: http://mmlab5.uginfo.sfedu.ru/tutorial/chapters/chapter3_1.html
Урок №13-14. Физические и химические свойства алкенов — ХиМуЛя.com
Физические свойства некоторых
алкенов показаны в табл. 1. Первые три представителя гомологического ряда
алкенов (этилен, пропилен и бутилен) — газы, начиная с C5H10 (амилен,
или пентен-1) — жидкости, а с С18Н36 — твердые вещества.
С увеличением молекулярной массы повышаются температуры плавления и кипения.
Алкены нормального строения кипят при более высокой температуре, чем их
изомеры, имеющие изостроение.
Температуры кипения цис-изомеров выше, чем
транс-изомеров, а температуры плавления — наоборот.
Алкены плохо растворимы в воде (однако
лучше, чем соответствующие алканы), но хорошо — в органических растворителях.
Этилен и пропилен горят коптящим пламенем.
Таблица
1. Физические свойства некоторых алкенов
| Название | Формула | t пл,°С |
t кип,°С |
| Этилен (этен) | С2Н4 | -169,1 | -103,7 |
| Пропилен (пропен) | С3Н6 | -187,6 | -47,7 |
| Бутилен (бутен-1) | C4H8 | -185,3 | -6,3 |
| Цис-бутен-2 | С4Н8 | -138,9 | 3,7 |
| Транс-бутен-2 | С4Н8 | -105,5 | 0,9 |
| Изобутилен (2-метилпропен) | С4Н8 | -140,4 | -7,0 |
| Амилен (пентен-1) | C5H10 | -165,2 | +30,1 |
| Гексилен (гексен-1) | С6Н12 | -139,8 | 63,5 |
| Гептилен (гептен-1) | C7H14 | -119 | 93,6 |
| Октилен (октен-1) | C8H16 | -101,7 | 121,3 |
| Нонилен (нонен-1) | C9H18 | -81,4 | 146,8 |
| Децилен (децен-1) | С10Н20 | -66,3 | 170,6 |
Химические
свойства алкенов
Для алкенов наиболее типичными являются
реакции присоединения. В реакциях присоединения двойная связь выступает как
донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
- Реакции
присоединения - 1. Гидрирование
(гидрогенизация – взаимодействие с водородом): - CnH2n +
H2 t, Ni → CnH2n+2 - 2. Галогенирование (взаимодействие
с галогенами): - CnH2n + Г2 →
СnH2nГ2
Источник: https://www.sites.google.com/site/himulacom/zvonok-na-urok/10-klass—tretij-god-obucenia/urok-no13-fiziceskie-i-himiceskie-svojstva-alkenov
Алкены: химические свойства
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс «40 шагов к 100 баллам на ЕГЭ по химии«.
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
Характеристики хим. связей
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Еπ = Е(С=С) — Е(С-С) = 620 — 348 = 272 кДж/моль
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
Например, при гидрировании бутена-2 образуется бутан.
Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление.
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан.
Хлорирование пропена
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
Например, при взаимодействии этилена с бромоводородом образуется бромэтан.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан.
Гидрохлорирование пропилена
1.4. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
- Например, при взаимодействии этилена с водой образуется этиловый спирт.
- Гидратация алкенов также протекает по ионному (электрофильному) механизму.
- Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
- Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
Гидратация пропилена
1.5. Полимеризация
- Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
- nM → Mn (M – это молекула мономера)
- Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен.
Полимеризация этилена
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида):
Каталитическое окисление этилена
Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида:
Окисление этилена над оксидом серебра
2.2. Мягкое окисление
Мягкое окисление алкенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Окисление алкенов водным раствором перманганата калия без нагревания
Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2)
«Мягкое» окисление этилена водным раствором перманганата калия
2.3. Жесткое окисление алкенов
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
Продукты окисления алкенов
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
Окисление бутилена-2 перманганатом калия в серной кислоте
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
Окисление изобутилена подкисленным раствором перманганата калия
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия:
Окисление бутена-2 водным раствором перманганата калия при нагревании
Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон:
Окисление изобутилена перманганатом в водной среде при нагревании
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
- Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
- В общем виде уравнение сгорания алкенов выглядит так:
- CnH2n + 3n/2O2 → nCO2 + nH2O + Q
- Например, уравнение сгорания пропилена:
- 2C3H6 + 9O2 → 6CO2 + 6H2O
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500оС или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1.
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Например, при изомеризации бутена-1 может образоваться бутен-2 или 2-метилпропен
CH2=CH-CH2-CH3 → CH3-CH=CH-CH3
Изомеризация бутилена
Источник: https://zen.yandex.ru/media/id/5c254b1f7a90a300abfc3cca/5dc0976fecfb8000af2da657




