
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом.
Классификация спиртов
- По числу гидроксильных групп (атомности) спирты делятся на:
- Одноатомные, например:

- Двухатомные (гликоли), например:

- Трехатомные, например:
- По характеру углеводородного радикала выделяют следующие спирты:
- Предельные, содержащие в молекуле лишь предельные углеводородные радикалы, например:


- Непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
Ароматические, т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:

- Органические вещества,содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений-фенолы.
- Например:

- Существуют и полиатомные (многоатомные спирты),содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит)

Номенклатура и изомерия спиртов
При образовании названий спиртов к названию углеводорода,соответствующего спирту,добавляют (родовой) суффикс-ол.
Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-,тетра- и т.д.-их число:
- В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
- Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия- спирты изомерны простым эфирам:
- Давайте дадим название спирту, формула которого указана ниже:
- Порядок построения названия:
1. Углеродная цепь нумеруется с конца к которому ближе находится группа –ОН.
2. Основная цепь содержит 7 атомов С, значит соответствующий углеводород — гептан.
3. Число групп –ОН равно 2, префикс – «ди».
4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2 и 4.
Название спирта: гептандиол-2,4
Физические свойства спиртов
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды. Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы.
Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения.
Так, пропан с относительной молекулярной массой 44 при обычных условиях является газом, а простейший из спиртов-метанол,имея относительную молекулярную массу 32, в обычных условиях-жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов,содержащих от 1 до 11 атомов углерода-жидкости.Высшие спирты(начиная с C12H25OH) при комнатной температуре-твердые вещества.
Низшие спирты имеют алкогольный запах и жгучий вкус,они хорошо растворимы в воде.По мере увеличения углеродного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Химические свойства спиртов
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные группы, поэтому химические свойства спиртов определяются взаимодействием друг на друга этих групп.
Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
- Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал,с одной стороны, и вещества,содержащего гидроксильную группу и не содержащего углеводородный радикал,-с другой. Такими веществами могут быть,например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами(замещаться на них)
- Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
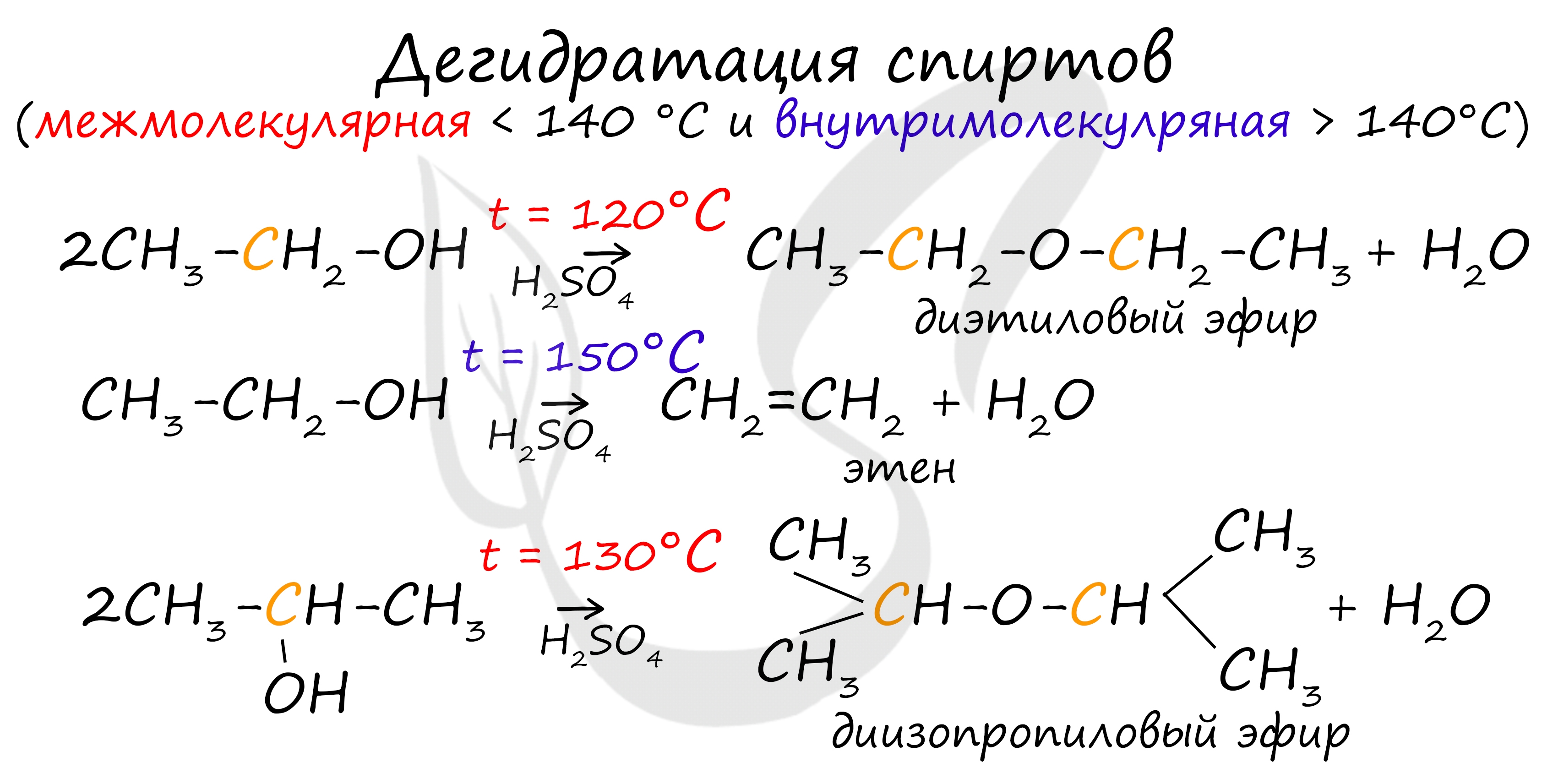
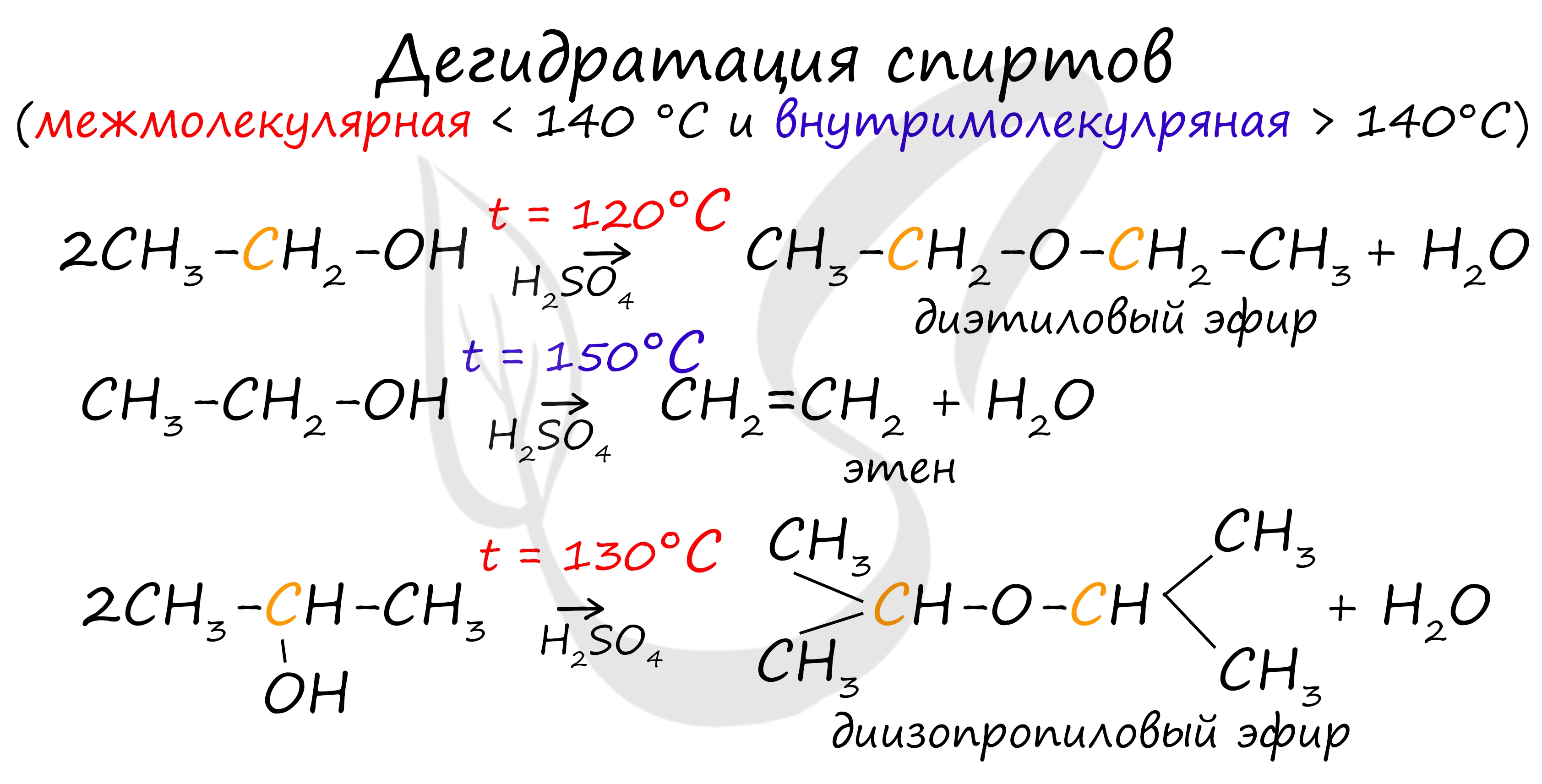
Данная реакция обратима. - Межмолекулярная дегидратация спиртов- отщепление молекулы воды от двух молекул спиртов при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры.Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140°С образуется диэтиловый (серный) эфир. - Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров( реакция этерификации)
Реакция этерификации катализируется сильными неорганическими кислотами. Например, при взаимодействии этилового спирта и уксусной кислоты образуется-этилацетат:
- Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры,чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140°С в присутствии концентрированной серной кислоты:
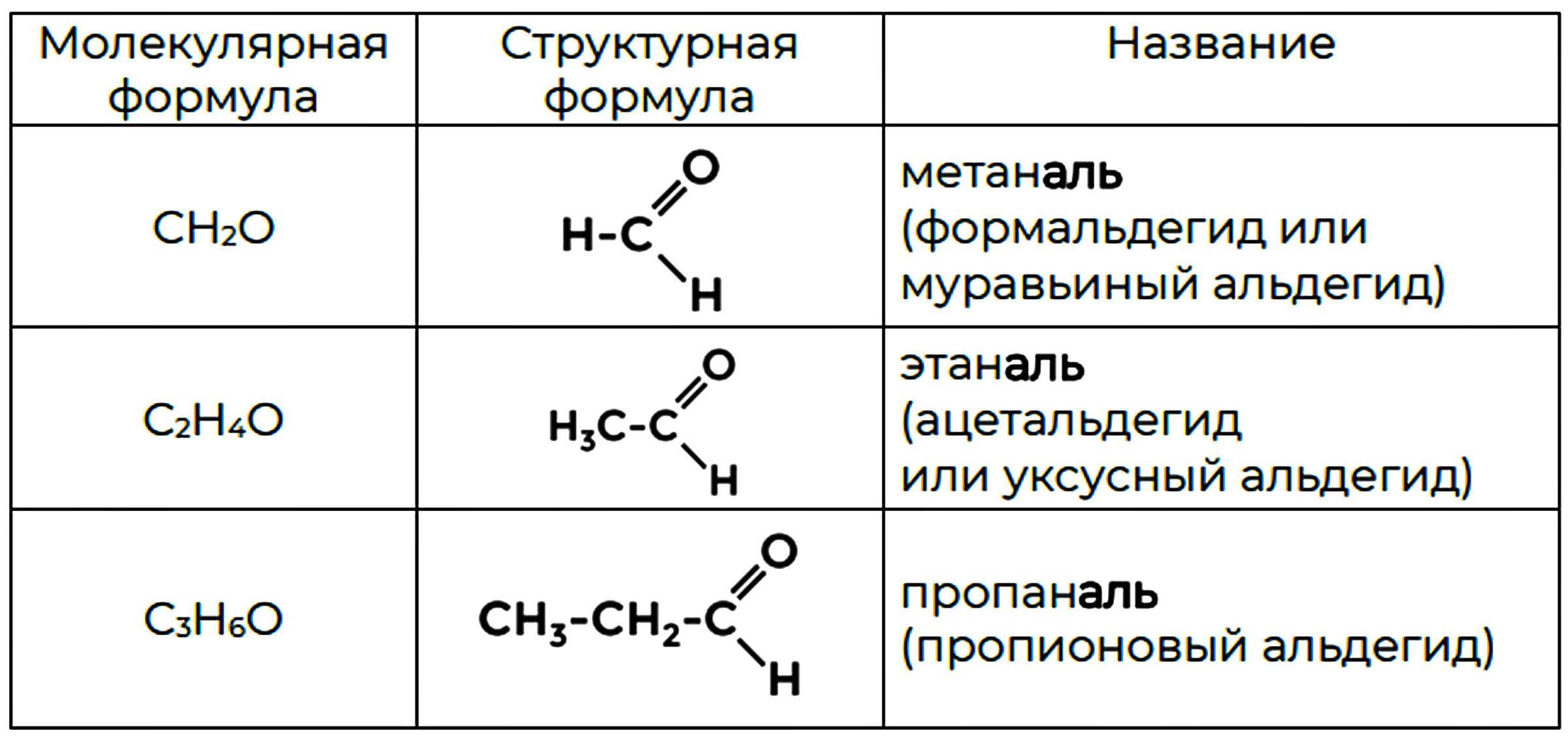
- Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты: При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
- Дегидрирование спиртов. При пропускании паров спирта при 200-300 °С над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
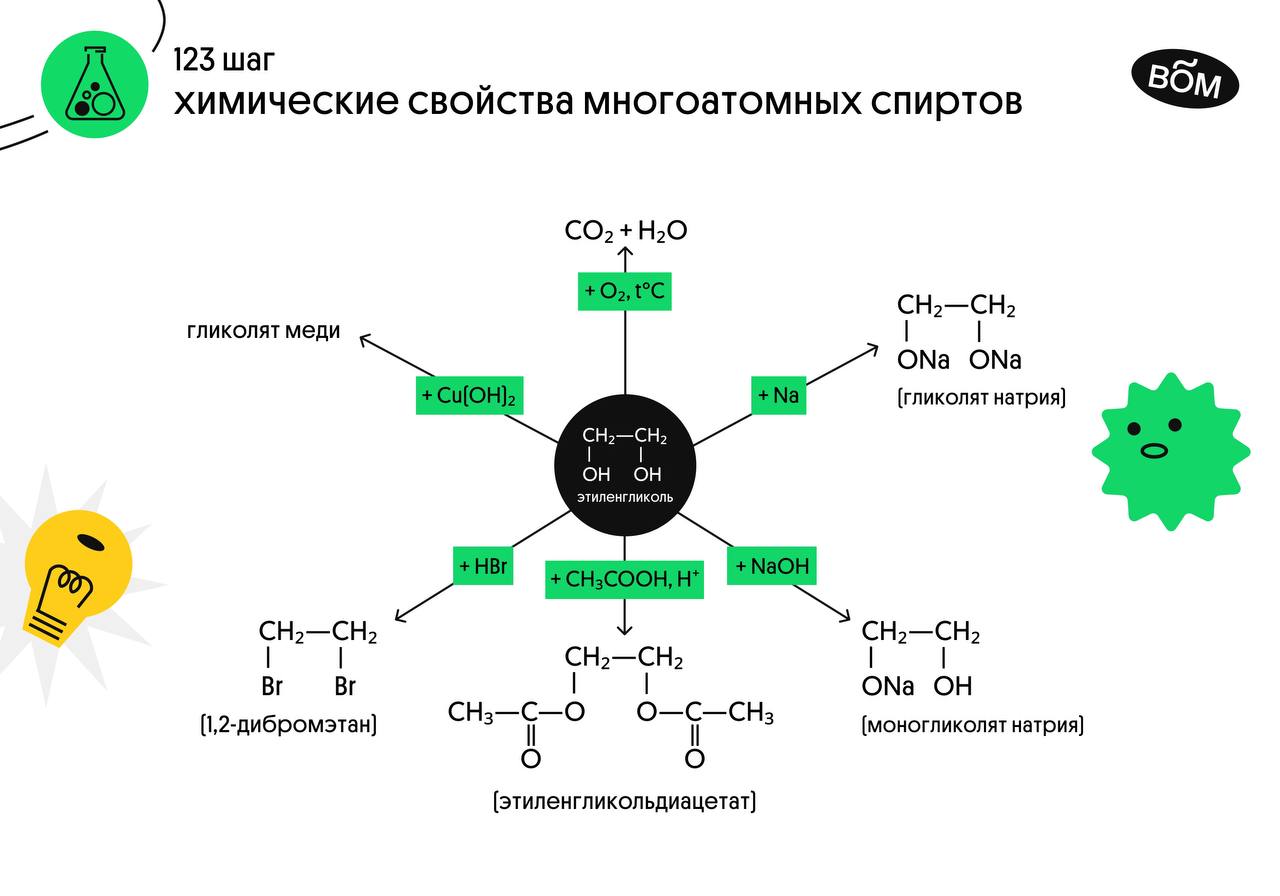
- Качественная реакция на многоатомные спирты.
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Получение спиртов:
Применение спиртов
Метанол (метиловый спирт СН3ОН) — бесцветная жидкость с характерным запахом и температурой кипения 64,7 °С. Горит чуть голубоватым пламенем. Историческое название метанола — древесный спирт объясняется одним из путей его получения способом перегонки твердых пород дерева (греч. methy — вино, опьянеть; hule — вещество, древесина).
Метанол требует осторожного обращения при работе с ним. Под действием фермента алкогольдегидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывают гибель зрительного нерва и полную потерю зрения. Попадание в организм более 50 мл метанола вызывает смерть.
Этанол (этиловый спирт С2Н5ОН) — бесцветная жидкость с характерным запахом и температурой кипения 78,3 °С. Горюч. Смешивается с водой в любых соотношениях. Концентрацию (крепость) спирта обычно выражают в объемных процентах.
«Чистым» (медицинским) спиртом называют продукт, полученный из пищевого сырья и содержащий 96 % (по объему) этанола и 4 % (по объему) воды.
Для получения безводного этанола — «абсолютного спирта» этот продукт обрабатывают веществами, химически связывающими воду (оксид кальция, безводный сульфат меди (II) и др.).
Для того чтобы сделать спирт, используемый в технических целях, непригодным для питья, в него добавляют небольшие количества трудноотделимых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатурированным, или денатуратом.
Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт — важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.
Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.
Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Этандиол-1,2 (этиленгликоль) — бесцветная вязкая жидкость. Ядовит. Неограниченно растворим в воде. Водные растворы не кристаллизуются при температурах значительно ниже О °С, что позволяет применять его как компонент незамерзающих охлаждающих жидкостей — антифризов для двигателей внутреннего сгорания.
Пролактриол-1,2,3 (глицерин) — вязкая сиропообразная жидкость, сладкая на вкус. Неограниченно растворим в воде. Нелетуч. В качестве составной части сложных эфиров входит в состав жиров и масел.
Широко используется в косметике, фармацевтической и пищевой промышленностях. В косметических средствах глицерин играет роль смягчающего и успокаивающего средства. Его добавляют к зубной пасте, чтобы предотвратить ее высыхание.
К кондитерским изделиям глицерин добавляют для предотвращения их кристаллизации. Им опрыскивают табак, в этом случае он действует как увлажнитель, предотвращающий высыхание табачных листьев и их раскрошивание до переработки.
Его добавляют к клеям, чтобы предохранить их от слишком быстрого высыхания, и к пластикам, особенно к целлофану.
В последнем случае глицерин выполняет функции пластификатора, действуя наподобие смазки между полимерными молекулами и, таким образом, придавая пластмассам необходимую гибкость и эластичность.
Источник: http://himege.ru/spirty-nomenklatura-poluchenie-ximicheskie-svojstva/
Спирты
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH. Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы OH — глицерины) и т.д.

Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).

Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.

Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.

Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
- Гидратация алкенов
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
- Получение этанола брожением глюкозы
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПиртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором щелочи образуются спирты. 
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода. 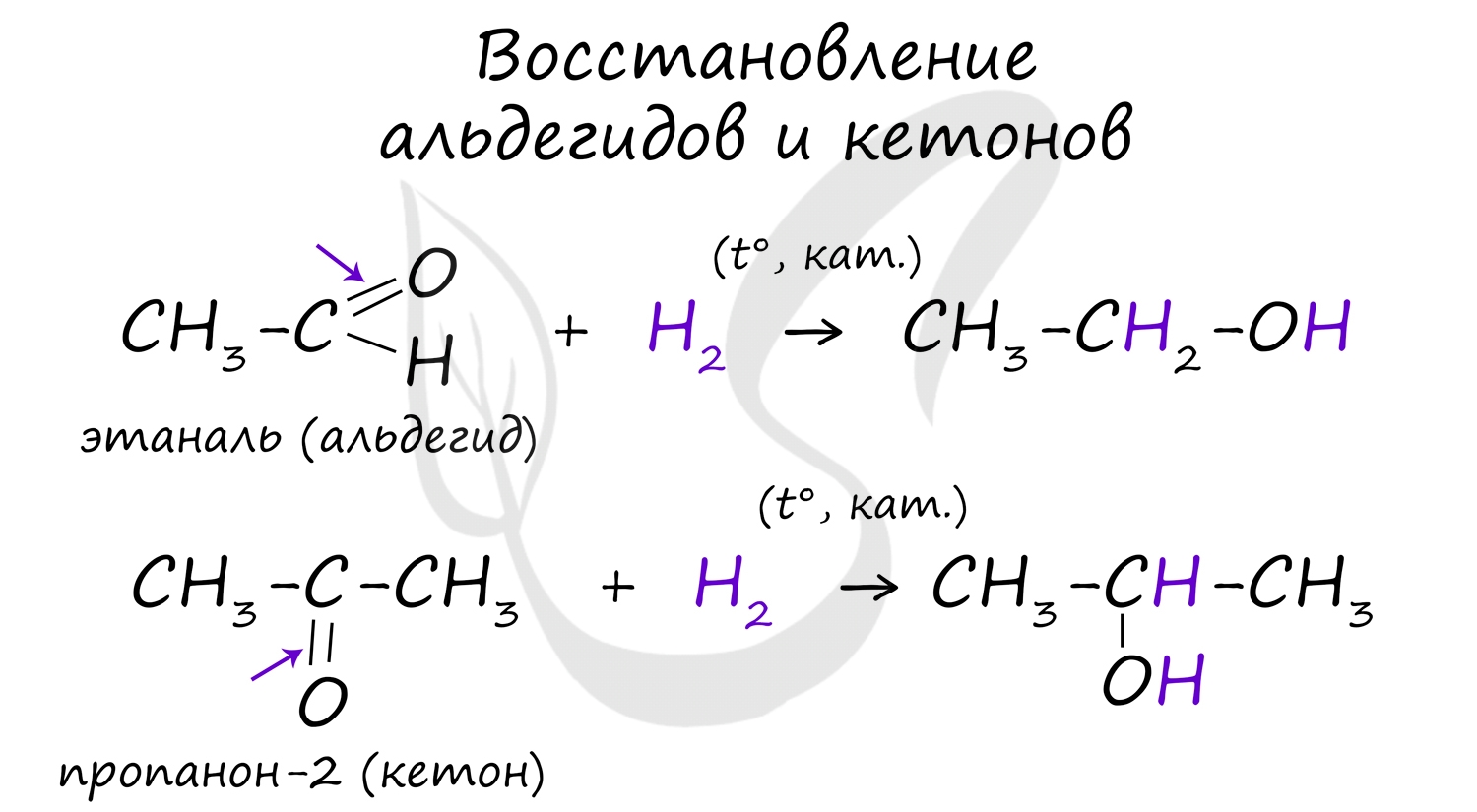
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты. 
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола. CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол. 
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль). 
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
- Окисление спиртов
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.  Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента. Возможен межмолекулярный механизм дегидратации (при t < 140°С), в результате которого образуются простые эфиры. При более высокой температуре (t > 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены. Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
Источник: https://studarium.ru/article/187
Физические свойства спиртов, водородные связи | Химия онлайн
Метиловый спирт (метанол, карбинол, древесный спирт) – простейший одноатомный спирт, бесцветная жидкость (tкип= 64,5; tпл= -97; ρ= 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде, горюч. Пары метанола взрывоопасны. Пары метанола взрывоопасны. Сильный яд!
Метанол вызывает слепоту (достаточно 10 мл). При употреблении внутрь 70 мл и более наступает летальный исход. Смерть наступает от паралича верхних дыхательных путей.
Действие метанола на организм
Этиловый спирт (этанол, винный спирт) – бесцветная жидкость, с запахом спирта, хорошо смешивается с водой, ядовитое наркотическое вещество. Кипит при 78,30С, замерзает при -1140С. Горит слабо светящимся пламенем. В виде ректификата (спирта, очищенного перегонкой) он содержит 95,6 % спирта и 4,4% воды.
Винный спирт – исторически сложившееся название, которое отражает, что этанол является основным компонентом винной продукции.
Этиловый спирт разрушает кровеносную, нервную, пищеварительную системы. Вызывает сильное привыкание и деградацию личности. При употреблении 300 мл, в перерасчете на чистый спирт, может вызвать смертельный исход.
- Так как метанол и этанол фактически не отличить друг от друга, то большинство отравления суррогатным алкоголем связано с употреблением продукции, содержащей метиловый спирт вместо этилового.
- Действие этанола на организм
- А знаете ли вы?
Одноатомным спиртом является и холестерин. Его еще называют холестеролом. Холестерин – компонент желчи, играет важную роль в организме, из него синтезируются многие биологически активные соединения.
Он участвует в обмене желчных кислот, в синтезе гормонов коры надпочечников и половых желез.
Отложение холестерина на стенках сосудов приводит к атеросклерозу, а в желчном пузыре – к образованию желчных камней.
Низшие члены ряда предельных одноатомных спиртов, содержащие от одного до десяти атомов углерода, — жидкости. Высшие спирты (начиная с С11Н23ОН) при комнатной температуре — твёрдые вещества. Все алканолы легче воды, бесцветны. Низшие спирты имеют характерный алкогольный запах и жгучий вкус.


Полярность связи О-Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
- Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы.

- Ассоциация молекул R-OH
- Из-за способности образовывать водородные связи в гомологическом ряду спиртов нет газообразных веществ.
В водных растворах водородные связи образуются не только между молекулами спиртов, но также между молекулами спиртов и воды. Образованием водородных связей между молекулами спирта и воды объясняется их хорошая растворимость в воде.

- Гидратация молекул R-OH
- Водородные связи не прочны и при испарении спиртов легко разрываются.
- Видеоопыт «Физические свойства спиртов»
С увеличением углеводородного радикала растворимость спиртов в воде уменьшается. Высшие спирты практически нерастворимы в воде. Метиловый, этиловый, н-пропиловый, изопропиловый спирты, а также этиленгликоль и глицерин смешиваются с водой в любых отношениях. Растворимость фенола в воде ограничена.
Предельные одноатомные спирты
Источник: https://himija-online.ru/organicheskaya-ximiya/spirty/fizicheskie-svojstva-spirtov-vodorodnye-svyazi.html
Спирты и фенолы
Спирты – органические вещества, содержащие одну или более гидроксильных групп (−OH), напрямую связанных с атомом углерода в состоянии sp3-гибридизации).
Фенолы – соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца.
Номенклатура и классификация
При использовании номенклатуры ИЮПАК названия спиртов характеризуются суффиксом —ол. В зависимости от числа гидроксильных групп спирты бывают одно-, двух-, трехатомные. В зависимости от того, при каком атоме углерода находится гидроксильная группа, спирты классифицируют на первичные, вторичные и третичные.
Строение и физические свойства
Строение спиртов отчасти схоже со строением воды. Как и в воде, между молекулами спирта образуются водородные связи, поэтому спирты имеют более высокие температуры плавления и кипения, чем можно было бы ожидать.
Влияние гидроксильной группы на свойства вещества особенно велико в соединениях с короткой углеводородной цепочкой.
Например, метанол и этанол неограниченно смешиваются с водой, имеют довольно высокие плотности и температуры кипения для своей молекулярной массы, а высшие спирты являются гидрофобными и мало отличаются по свойствам от аналогичных углеводородов без гидроксильной группы [9].
При рассмотрении фенолов необходимо выделить влияние гидроксильной группы –OH на ароматическое кольцо, которое повышает в бензольном кольце электронную плотность (особенно в орто- и пара-положениях) благодаря одной из неподелённых пар электронов кислорода, учавствующей в сопряжении с π-системой бензольного кольца.
Смещение неподелённой электронной пары атома О в сторону бензольного кольца приводит к усилению полярности связи O–H. В итоге молекулы фенола распадаются в водных растворах с элиминированием протона, а значит фенол проявляет себя как слабая кислота.
Это является основным отличием фенолов от спиртов, являющихся неэлектролитами. Основная часть одноатомных фенолов при нормальных условиях – бесцветные кристаллические вещества с низкой температурой плавления и специфическим запахом. Фенолы плохо растворяются в воде, но с легкостью – в органических растворителях.
Они токсичны, а при хранении на воздухе постепенно окисляются и темнеют.
Химические свойства
Кислотно-основные реакции спиртов. Спирты способны проявлять как кислотные, так и основные свойства. Как кислоты, спирты с щелочными и щелочноземельными металлами, а также сильными основаниями (например, амидами или гидридами) реагируют с образованием алкоголятов:
- 2C2H5OH + 2Na → 2C2H5ONa + H2.
- Спирты также проявляют основные свойства – образуют соли с сильными кислотами (соли алкоксония) и дают донорно-акцепторные комплексы с кислотами Льюиса:
- R–OH + AlCl3 ⇄ R–OH+AlCl–3.
- По связи О–Н → фенолы в большинстве реакциий активнее спиртов, так как эта связь полярнее из-за смещения электронной плотности от кислорода к бензольному кольцу (участие неподеленной электронной пары атома кислорода в системе π-сопряжения). Фенол с растворами щелочей дает соли – феноляты (например, фенолят калия – C6H5OК):
- C6H5OH + NaOH = C6H5ONa + H2O.
Превращение спиртов в галогеналканы. Одной из наиболее важных реакций с участием связи C–O является превращение спиртов в галогеноалканы. Гидроксильная группа в спиртах может быть замещена на атом галогена:
![]()
- Превращение спиртов в эфиры неорганических кислот. При действии концентрированной азотной кислоты могут быть получены органические нитраты:
- C2H5OH + HNO3 → C2H5O–NO2 +H2O.
- Превращение спиртов в простые эфиры. Медленно нагревая спирты в присутствии серной кислоты обеспечивается межмолекулярная дегидратация спиртов с образованием простых эфиров:
| 2ROH | ROR + H2O. |
Превращение спиртов в сложные эфиры. Сложные эфиры получаются из спиртов в реакциях с органическими кислотами при нагревании с участием кислотного катализатора (чаще всего, концентрированной серной кислоты). Этот процесс имеет название кислотно-каталитической реакции этерификации:

Реакции окисления спиртов. Первичные спирты в зависимости от выбора агента окисляются до альдегидов или карбоновых кислот:
| CH2═CH–CH2OH | CH2═CH–CHO. |
Вторичные – до соответствующих кетонов и кислот:
| R–CHOH–R´ | R–CO–R´. |
Третичные спирты устойчивы к окислению, однако под действием сильных окислителей могут быть расщеплены с разрывом углеродной цепи в различные карбонильные соединения.
Реакции восстановления спиртов. Неактивированные гидроксильные группы довольно устойчивы к гидрогенолизу и могут быть восстановлены в довольно жёстких условиях. Реакции гидрирования протекают при высоких температурах и давлении, в качестве катализаторов используются: никель, смешанные оксиды хрома-меди и т. д.
| RCH2OH + H2 | RCH3 + H2O. |
Методы получения
- Реакции окисления. Для получения первичных спиртов применяют окисление металлорганических соединений:
- R–MgBr + CH2O + H2O → R–CH2OH + Mg(OH)Br.
- При окислении алкенов происходит образование двухатомных спиртов:

- Реакции восстановления. При мягком восстановлении карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров также образуются спирты:
- R–CHO + 2[H] → R–CH2OH;
- R–COOR´ + 4[H] → R–CH2OH + R´OH.
- Реакции присоединения – активно используется в промышленности при синтезе метанола:
- CO + 2H2 CH3OH.
- Реакции замещения (гидролиза):
- RCH2Cl + OH– → RCH2OH + Cl–,
- CH3–Br + NaOH (водн.) CH3–OH + NaBr,
- ClCH2–CH2Cl + 2NaOH (водн.) HOCH2–CH2OH + 2NaCl,
- C6H5Cl + NaOH (p, 340°С) C6H5OH + NaCl.
Биохимические методы производства. Известный с давних времён способ получения этанола – спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Схематично реакцию можно выразить уравнением [10]:
C6H12O6 → 2C2H5OH + 2CO2.
Кумольный способ получения фенола: (1949 г., Р. Ю. Удрис, П. Г. Сергеев, Б. Д. Кружалов). Получают сразу два продукта – куол и ацетон из кумола. Технология считается практически безотходной (выход полезных продуктов более 99 %) и экономичной. Сейчас кумольный способ используют как основной в мировом производстве фенола:

Применение
Одноатомные насыщенные спирты C3–C9, из которых главным компонентом является изоамиловый спирт, представляют основной компонент сивушного масла – побочного продукта спиртового брожения. Амиловый спирт используется для получения сложных эфиров, для целей парфюмерии и в производстве бездымного пороха.
Пирокатехин и гидрохинон (парадигидроксибензол, бензол-1,4-диол) используют в фотографии как проявитель, в производстве красителей, лекарственных веществ. Фенол активно используется для производства фенолформальдегидных смол, поликарбона и эпоксидных смол, нейлона и капрона.
Фенол и его производные также обуславливают консервирующие свойства коптильного дыма. Бутанол – компонент в топливных элементах и сырье для производства водорода. В 2007 г. в Великобритании начались продажи биобутанола в качестве добавки к бензину.
Метанол используется для выпуска формальдегида, который используется для производства фенолформальдегидных смол и формалина, уксусной кислоты. Метанол используется для заправки гоночных мотоциклов и автомобилей. Этанол широко применяется как растворитель и антисептик: в пищевой промышленности; в качестве автомобильного топлива.
Смесь этанола с бензином обозначается буквой Е. Цифрой и буквой Е обозначается процентное содержание этанола. Е85 – означает смесь из 85 % этанола и 15 % бензина. Биоэтанол как топливо нейтрален в качестве источника парниковых газов.
Он обладает нулевым балансом диоксида углерода, поскольку при его производстве путём брожения и последующим сгоранием выделяется столько же CO2, сколько до этого было взято из атмосферы использованными для его производства растениями. Глицерин фармацевтическая и парфюмерная промышленность, смягчитель кожи и тканей, производство взрывчатых веществ.
Источник: http://mmlab5.uginfo.sfedu.ru/tutorial/chapters/chapter6_1.html
Спирты: физические и химические свойства, получение, применение
 Физические свойства
Физические свойства
МЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде.
- В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
- · С–ОН с отщеплением ОН-группы
- · О–Н с отщеплением водорода
- Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона (Н+) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О – свойства основания и нуклеофильного реагента.

С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений. Вследствие доступности гидроксильных соединений, в особенности спиртов, каждая из этих реакций является одним из лучших способов получения определенных органических соединений.
- I. Кислотно-основные
- RO— + H+ ↔ ROH ↔ R+ + OH—
- алкоголят-ион
- Кислотные свойства уменьшаются в ряду, а основные возрастают:
| HOH → R-CH2-OH → R2CH-OH → R3C-OH вода первичный вторичный третичный |
- Кислотные свойства
- С активными щелочными металлами:
- 2C2H5OH + 2 Na → 2C2H5ONa + H2
- этилат натрия
- Алкоголяты подвергаются гидролизу, это доказывает, что у воды более сильные кислотные свойства
- C2H5ONa + H2O ↔ C2H5OH + NaOH
- Основные свойства
- С галогенводородными кислотами:
- C2H5OH + HBr H2SO4(конц)↔ C2H5Br + H2O
- бромэтан

Лёгкость протекания реакции зависит от природы галогенводорода и спирта – увеличение реакционной способности происходит в следующих рядах:
| первичные |
Источник: http://www.yoursystemeducation.com/spirty-fizicheskie-i-ximicheskie-svojstva-poluchenie-primenenie/
Спирты — понятие, свойства, применение
-

История открытия
По мнению историков, уже за 8 веков до нашей эры человек употреблял напитки, содержащие этиловый спирт. Их получали методом сбраживания фруктов или меда. В чистом виде этанол был выделен из вина арабами примерно в VI-VII веках, а европейцами — на пять столетий позже. В XVII веке перегонкой древесины был получен метанол, а в XIX веке химики установили, что спирты — это целая категория органических веществ.
Классификация
— По количеству гидроксилов спирты делят на одно-, двух-, трех-, многоатомные. Например, одноатомный этанол; трехатомный глицерин.— По тому, с каким числом радикалов связан атом углерода, соединенный с группой ОН—, спирты разделяют на первичные, вторичные, третичные.— По характеру связей радикала спирты бывают предельными, непредельными, ароматическими. В ароматических спиртах гидроксил связан не напрямую с бензольным кольцом, а через другой (другие) радикалы.— Соединения, в которых ОН— прямо связана с бензольным циклом, считаются отдельным классом фенолов.
Свойства

Простейшие спирты смешиваются с водой в любых пропорциях. Если же в молекулу входит более 9 радикалов, то вообще не растворяются в воде. Все спирты хорошо растворяются в органических растворителях. — Спирты горят, выделяя большое количество энергии. — Вступают в реакции с металлами, в результате чего получаются соли — алкоголяты. — Взаимодействуют с основаниями, проявляя качества слабых кислот.— Реагируют с кислотами и ангидридами, проявляя оснóвные свойства. Результатом реакций являются сложные эфиры. — Воздействие сильными окислителями приводит к образованию альдегидов или кетонов (в зависимости от вида спирта).
— При определенных условиях из спиртов получают простые эфиры, алкены (соединения с двойной связью), галогенуглеводороды, амины (производные от аммиака углеводороды).
Спирты токсичны для человеческого организма, некоторые — ядовиты (метилен, этиленгликоль). Этилен оказывает наркотическое воздействие. Опасны и пары спиртов, поэтому работы с растворителями на основе спирта должны производиться с соблюдением техники безопасности.
Тем не менее, спирты участвуют в естественном метаболизме растений, животных и человека. К категории спиртов относятся такие жизненно важные вещества как витамины A и D, стероидные гормоны эстрадиол и кортизол. Более половины липидов, поставляющих энергию нашему организму, имеют в своей основе глицерин.
Применение
— В органическом синтезе.— Биотопливо, добавки в топливо, ингредиент тормозной жидкости, гидравлических жидкостей.— Растворители.— Сырье для производства ПАВ, полимеров, пестицидов, антифризов, взрывчатых и отравляющих веществ, бытовой химии.— Душистые вещества для парфюмерии. Входят в состав косметических и медицинских средств.
— Основа алкогольных напитков, растворитель для эссенций; сахарозаменитель (маннит и т.п.); краситель (лютеин), ароматизатор (ментол).
В нашем магазине можно купить спирты разного вида
Бутиловый спирт

Фурфуриловый спирт
Одноатомный спирт. Востребован для полимеризации смол и пластиков, как растворитель и пленкообразователь в лакокрасочной продукции; сырье для органического синтеза; связующий и уплотняющий агент при производстве полимербетона.
Изопропиловый спирт (пропанол-2)
Вторичный одноатомный спирт. Активно используется в медицине, металлургии, химпроме. Заменитель этанола в парфюмерных, косметических, дезинфицирующих продуктах, средствах бытовой химии, антифризах, очистителях.
Этиленгликоль
Двухатомный спирт. Применяется при производстве полимеров; красок для типографий и текстильного производства; входит в состав антифризов, тормозных жидкостей, теплоносителей. Используется для осушения газов; как сырье для органического синтеза; растворитель; средство для криогенной «заморозки» живых организмов.
Глицерин
Трехатомный спирт. Востребован в косметологии, пищепроме, медицине, как сырье в орг. синтезе; для изготовления взрывчатого вещества нитроглицерина. Применяется в сельском хозяйстве, электротехнике, текстильной, бумажной, кожевенной, табачной, лакокрасочной индустрии, в производстве пластиков и средств бытовой химии.
Маннит
Шестиатомный (многоатомный) спирт. Применяется как пищевая добавка; сырье для изготовления лаков, красок, олиф, смол; входит в состав ПАВ, парфюмерных продуктов.
Источник: https://pcgroup.ru/blog/spirty-ponyatie-svojstva-primenenie/
Физические и химические свойства спиртов
ОПРЕДЕЛЕНИЕ
Спирты представляют собой соединения, содержащие одну или несколько гидроксильных групп -( mathrm{OH} ), связанных с углеводородным радикалом.
Общая формула для гомологичного ряда одноатомных одноатомных спиртов ( mathrm{CnH} 2 mathrm{n}+1 mathrm{OH} ). Во имя спиртов присутствует суффикс — ол.
В зависимости от количества гидроксильных групп спирты разделяют на один (( mathrm{CH} 3 mathrm{OH} ) — метанол, ( mathrm{C} 2 mathrm{H} 5 mathrm{OH} ) — этанол), два — (( mathrm{CH} 2(mathrm{OH})-mathrm{CH} 2- OH ) — этиленгликоль) и триатомный ( mathrm{CH} 2(mathrm{OH})-mathrm{CH}(mathrm{OH})-mathrm{CH} 2-mathrm{OH}- )-глицерин). В зависимости от того, какой атом углерода присутствует в гидроксильной группе, различают первичный (( mathrm{R}-mathrm{CH} 2-mathrm{OH} )), вторичный (( mathrm{R} 2 mathrm{CH}-mathrm{OH} )) и третичный спирты (( mathrm{R} 3 mathrm{C}-mathrm{OH} )).
- Для ограничения одноатомных спиртов типична изомерия углеродного скелета (начиная с бутанола), а также изомерия положения гидроксильной группы (начиная с пропанола) и межклассовой изомерии с эфирами.
- ( mathrm{CH} 3-mathrm{CH} 2-mathrm{CH} 2-mathrm{CH} 2-mathrm{OH} )(бутанол-1)
- ( mathrm{CH} 3-mathrm{CH}(mathrm{CH} 3)-mathrm{CH} 2-mathrm{OH} )(2-метилпропанол-1)
- ( mathrm{CH} 3-mathrm{CH}(mathrm{OH})-mathrm{CH} 2-mathrm{CH} 3 )(бутанол-2)
- ( mathrm{CH} 3-mathrm{CH} 2-mathrm{O}-mathrm{CH} 2-mathrm{CH} 3 )(диэтиловый эфир)
- Химические свойства спиртов
- 1. Реакция протекает с разрывом ( mathrm{OH} )-связи:
- — кислотные свойства спиртов выражены очень слабо. Спирты реагируют с щелочными металлами
- ( 2 mathrm{C} 2 mathrm{H} 5 mathrm{OH}+2 mathrm{K}
ightarrow 2 mathrm{C} 2 mathrm{H} 5 mathrm{OK}+mathrm{H} 2 ) - но не реагируют с щелочами. В присутствии воды алкоголяты полностью гидролизуются:
- ( mathrm{C} 2 mathrm{H} 5 mathrm{OK}+mathrm{H} 2 mathrm{O}
ightarrow mathrm{C} 2 mathrm{H} 5 mathrm{OH}+mathrm{KOH} ) - Это означает, что спирты являются более слабыми кислотами, чем вода.
- — образование сложных эфиров под действием минеральных и органических кислот:
- ( mathrm{CH} 3-mathrm{COH}+mathrm{H}-mathrm{OCH} 3 { } mathrm{CH} 3 mathrm{COOCH} 3+mathrm{H} 2 mathrm{O} )
— окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются до альдегидов, которые, в свою очередь, могут быть окислены до карбоновых кислот.
- ( mathrm{R}-mathrm{CH} 2-mathrm{OH}+[mathrm{O}]
ightarrow mathrm{R}-mathrm{CH}=mathrm{O}+[mathrm{O}]
ightarrow mathrm{R}-mathrm{COOH} ) - Вторичные спирты окисляются до кетонов:
- ( mathrm{R}_{-} mathrm{CH}(mathrm{OH})-mathrm{R}^{prime}+[mathrm{O}]
ightarrow mathrm{R}-mathrm{C}left(mathrm{R}^{prime}
ight)=mathrm{O} ) - Третичные спирты более устойчивы к окислению.
2. Реакция с разрывом связи ( mathrm{C}-mathrm{O} ).
- — внутримолекулярная дегидратация с образованием алкенов (происходит при сильном нагревании спиртов с водоотталкивающими веществами (концентрированная серная кислота)):
- ( mathrm{CH} 3-mathrm{CH} 2-mathrm{CH} 2-mathrm{OH}
ightarrow mathrm{CHZ}-mathrm{CH}=mathrm{CH} 2+mathrm{H} 2 mathrm{O} ) - — межмолекулярная дегидратация спиртов с образованием простых эфиров (происходит, когда спирты слабо нагреваются с водоотталкивающими веществами (концентрированная серная кислота)):
- ( 2 mathrm{C} 2 mathrm{H} 5 mathrm{OH}
ightarrow mathrm{C} 2 mathrm{H} 5-mathrm{O}-mathrm{C} 2 mathrm{H} 5+mathrm{H} 2 mathrm{O} ) - — слабые основные свойства спиртов проявляются в обратимых реакциях с галогенидами водорода:
- ( mathrm{C} 2 mathrm{H} 5 mathrm{OH}+mathrm{HBr}
ightarrow mathrm{C} 2 mathrm{H} 5 mathrm{Br}+mathrm{H} 2 mathrm{O} ) - Физические свойства спиртов
Нижние спирты (вплоть до С15) являются жидкостями, а более высокие — твердыми. Метанол и этанол смешивают с водой в любых пропорциях. С увеличением молекулярной массы растворимость спиртов в оде уменьшается. Спирты имеют высокие температуры кипения и плавления из-за образования водородных связей.
- Получение спиртов
- Производство спиртов возможно с использованием биотехнологического (ферментационного) метода дерева или сахара.
- Лабораторные методы получения спиртов включают:
- — гидратация алкенов (реакция протекает при нагревании и в присутствии концентрированной серной кислоты)
- ( mathrm{CH} 2=mathrm{CH} 2+mathrm{H} 2 mathrm{O}
ightarrow mathrm{CH} 3 mathrm{OH} ) - — гидролиз алкилгалогенидов под действием водных растворов щелочей
- ( mathrm{CH} 3 mathrm{Br}+mathrm{NaOH}
ightarrow mathrm{CHZOH}+mathrm{NaBr} ) - ( mathrm{CH} 3 mathrm{Br}+mathrm{H} 2 mathrm{O}
ightarrow mathrm{CHZOH}+mathrm{HBr} ) - — восстановление карбонильных соединений
- ( mathrm{CH} 3-mathrm{CH}-mathrm{O}+2[mathrm{H}]
ightarrow mathrm{CH} 3-mathrm{CH} 2-mathrm{OH} ) - Примеры решения проблем
- ПРИМЕР 1
Массовые доли углерода, водорода и кислорода в молекуле одноатомного спирта составляют 51,18, 13,04 и 31,18% соответственно. Выведите формулу алкоголя.
Обозначим количество элементов, входящих в молекулу спирта, по индексам ( x, y, z ). Тогда формула алкоголя вообще будет выглядеть — ( mathrm{CXHyOz} ).
- Запишем соотношение:
- x: ( mathrm{x} : mathrm{y} : mathrm{z}=omega(mathrm{C}) / mathrm{Ar}(mathrm{C}) : omega(mathrm{H}) / mathrm{Ar}(mathrm{H}) : omega(mathrm{O}) / mathrm{Ar}(mathrm{O}) );
- ( mathrm{x} : mathrm{y} : mathrm{z}=51,18 / 12 : 13,04 / 1 : 31,18 / 16 );
x: ( x : y : z=4.208 : 13.04 : 1.949
)
Мы делим полученные значения на наименьшие, т. Е. На 1.949. Мы получаем:
( mathrm{x} : mathrm{y} : mathrm{z}=2 : 6 : 1 )
Следовательно, формула спирта представляет собой ( mathrm{C} 2 mathrm{H} 6 mathrm{O} mathrm{1} ). Или ( mathrm{C} 2 mathrm{H} 5 mathrm{OH} ) представляет собой этанол.
- Формула для одноатомного спирта представляет собой ( mathrm{C} 2 mathrm{H} 5 mathrm{OH} )
- ПРИМЕР 2
Какой объем кислорода потребуется для полного сжигания 31,25 мл этилового спирта ( (
ho=0,8 mathrm{г} / mathrm{мл} ) )?
- Напишите уравнение реакции для полного сгорания этанола:
- ( mathrm{C} 2 mathrm{H} 5 mathrm{OH}+3 mathrm{O} 2
ightarrow 2 mathrm{CO} 2 uparrow+3 mathrm{H} 2 mathrm{O} ) - Масса этанола будет равна:
- ( mathrm{m}(mathrm{C} 2 mathrm{H} 5 mathrm{OH})=mathrm{V}(mathrm{C} 2 mathrm{H} 5 mathrm{OH}) imes
ho ) - ( M(C 2 H 5 O H)=31,25 imes 0,8=25 г )
Молярная масса этанола, рассчитанная с использованием таблицы химических элементов D.I. Менделеева — 46 г / моль. Затем количество этанольного вещества будет равно:
- ( mathrm{n}(mathrm{C} 2 mathrm{H} 5 mathrm{OH})=mathrm{m}(mathrm{C} 2 mathrm{H} 5 mathrm{OH}) / mathrm{M}(mathrm{C} 2 mathrm{H} 5 mathrm{OH}) )
- 25/46 = 0,54 моль.
- ( mathrm{n}(mathrm{C} 2 mathrm{H} 5 mathrm{OH}) ) = Согласно уравнению реакции ( mathrm{n}(mathrm{C} 2 mathrm{H} 5 mathrm{OH}) : mathrm{n}(mathrm{O} 2)=1 : 3 ),( mathrm{n}(mathrm{O} 2)=mathrm{Z} imes mathrm{n}(mathrm{C} 2 mathrm{H} 5 mathrm{OH})=1,62 mathrm{моль} ). Тогда объем кислорода будет равен:
- ( mathrm{V}(mathrm{O} 2)=mathrm{n}(mathrm{O} 2) imes mathrm{V} mathrm{m} )
- ( mathrm{V}(mathrm{O} 2)=1,62 imes 22,4=36,288 mathrm{л} )
Объем кислорода — 36,288 литра.
Источник: https://sciterm.ru/spravochnik/fizicheskie-i-himicheskie-svojstva-spirtov/
Урок №62. Одноатомные спирты. Метанол. Этанол. Физические свойства. Физиологическое действие спиртов на организм. Применение. Многоатомные спирты. Этиленгликоль. Глицерин. Применение. — ХиМуЛя.com
СПИРТЫ
Спиртами называют производные
углеводородов, содержащие группу (или несколько групп) -ОН, называемую
гидроксильной группой или гидроксилом.
По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на
одноатомные (с одним гидроксилом), двухатомные (с двумя гидроксилами),
трехатомные (с тремя гидроксилами) и многоатомные.
- ОДНОАТОМНЫЕ
СПИРТЫ - Общая формула: CnH2n+1-OH
- Простейшие представители:
МЕТАНОЛ (древесный спирт)
СН3ОН– жидкость
(tкип=64,5; tпл=-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает
слепоту, смерть наступает от паралича верхних дыхательных путей.
Метанол СН3ОН используют как
растворитель, а также в производстве формальдегида, применяемого для получения
фенолформальдегидных смол, в последнее время метанол рассматривают как
перспективное моторное топливо. Большие объемы метанола используют при добыче и
транспорте природного газа. Метанол – наиболее токсичное соединение среди всех
спиртов, смертельная доза при приеме внутрь – 100 мл.
ЭТАНОЛ (винный спирт) С2Н5ОН – б/цв
жидкость, с запахом спирта, хорошо смешивается с водой, ядовитое наркотическое
вещество.
Этанол С2Н5ОН –
исходное соединение для получения ацетальдегида, уксусной кислоты, а также для
производства сложных эфиров карбоновых кислот, используемых в качестве
растворителей. Кроме того, этанол – основной компонент всех спиртных напитков,
его широко применяют и в медицине как дезинфицирующее средство. Применение этанола
- Получение этанола:
- ·
брожение глюкозы - C6H12O6 дрожжи→ 2C2H5OH + 2CO2↑
- ·
гидратация алкенов - CH2=CH2 + HOH t,kat-H3PO4→ CH3-CH2-ОH
- Свойства спиртов:
- Спирты
горят в кислороде и на воздухе, как и углеводороды: - 2CH3OH + 3O2
t→ 2CO2 +
4H2O + Q - МНОГОАТОМНЫЕ
СПИРТЫ - Многоатомные спирты– органические соединения, в молекулах которых содержится несколько
гидроксильных групп (-ОН), соединённых с углеводородным радикалом.
Источник: https://www.sites.google.com/site/himulacom/zvonok-na-urok/9-klass—vtoroj-god-obucenia/urok-no62-odnoatomnye-spirty-metanol-etanol-fiziceskie-svojstva-fiziologiceskoe-dejstvie-spirtov-na-organizm-primenenie-mnogoatomnye-spirty-etilenglikol-glicerin-primenenie




