Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ?

В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

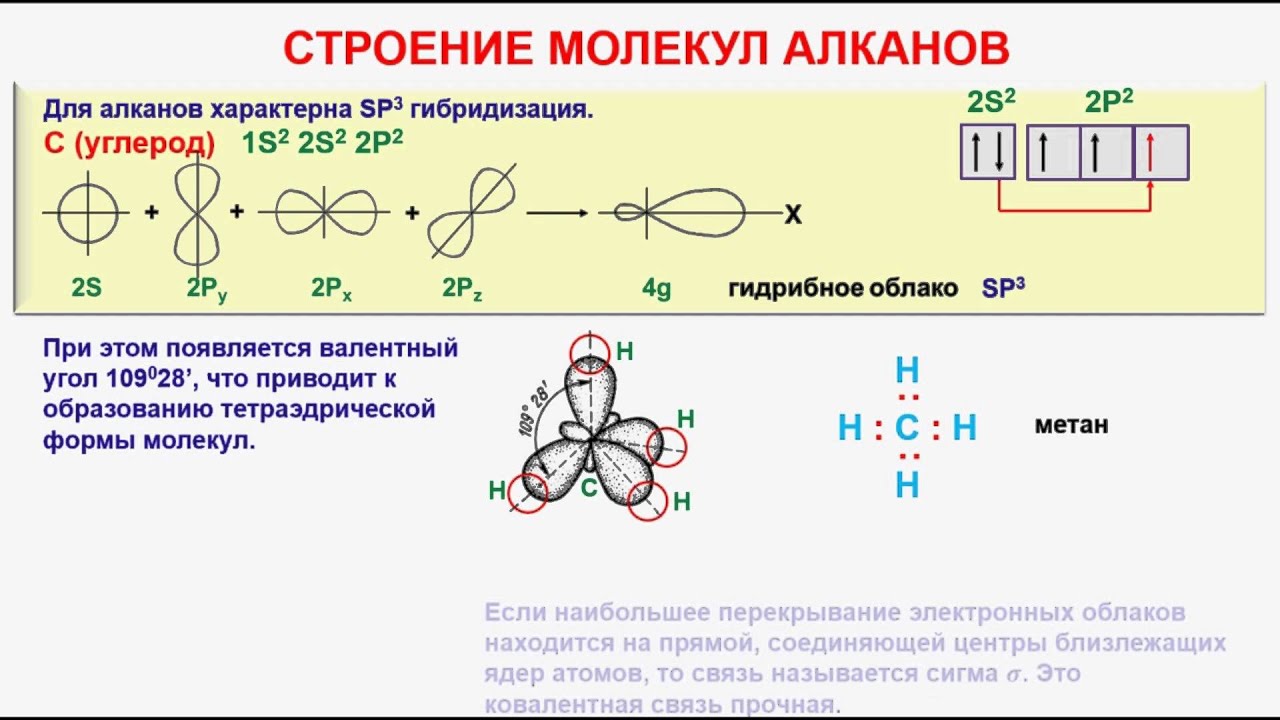
Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда — CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos — соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp3
- Валентный угол (между химическими связями) составляет 109°28'
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- В ходе крекинга нефти получается один алкан и один алкен.
- C8H18 → C4H8 + C4H10
- C12H26 → C6H12 + C6H14
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан. 
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия. Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3 CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
- С3H8 + O2 → CO2 + H2O
- В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
- CH4 + O2 → CH3-OH (метанол)
- Пиролиз
- CH4 → (t > 1000°С) C + H2
- CH4 → (t = 1500-1600°С) CH≡CH + H2↑
- CH4 → (t = 1200°С, кат., P) CH2=CH2 + H2↑
- C2H6 → (t = 1200°С, кат., P) CH2=CH2 + 2H2↑
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее — у вторичного и значительно труднее — у первичного. Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму. CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.
Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения — в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
Источник: https://studarium.ru/article/181
Урок 18. Алканы – HIMI4KA
Самоучитель по химии › Органическая химия
Алканы — это углеводороды незамкнутого (нециклического) строения, в молекулах которых атомы углерода соединены только простыми связями. Например:

Задание 18.1. Допишите атомы водорода и попробуйте ответить на вопрос: существует ли углеводород, имеющий большее число атомов водорода в молекуле?
Поэтому-то алканы обычно называют предельными углеводородами, то есть содержащими максимально возможное (предельное) число атомов водорода в молекуле.

Гомологический ряд, номенклатура, изомерия
Алканы образуют гомологический ряд с общей формулой
где n — число атомов углерода в молекуле. Если
- n = 1 → СН4, это метан;
- n = 2 → С2Н6, это этан;
- n = 3 → С3Н8, или СН3–СН2–СН3, это пропан.
Начиная с n = 4 для алканов возможна изомерия, то есть для вещества состава C4H10 существуют два соединения различного строения, а значит, различные по свойствам:

Следующий гомолог с n = 5 имеет уже три изомера, один из них н-пентан, то есть пентан нормального (неразветвлённого) строения.
Задание 18.2. Составьте графические формулы всех изомеров пентана (их три). Назовите эти изомеры.

Строение молекул
Атомы углерода и водорода в молекулах алканов соединены только простыми связями. Это ковалентные, слабо полярные связи.
Все С–Н связи в молекуле метана равноценны и направлены в пространстве к вершинам тетраэдра. Это σ-связи (сигма-связи), очень прочные.
Поэтому метан и другие алканы с трудом вступают в химические реакции (на разрыв σ-связей нужно затратить много энергии).
Все химические реакции алканов идут в особых условиях (нагревание, присутствие катализатора, освещение и др.), то есть при обычных условиях реакции алканов невозможны.

Свойства алканов
Физические свойства
Поскольку все связи в молекулах алканов слабо полярны, то в молекулах отсутствуют какие-либо значительные заряды. Поэтому молекулы алканов слабо притягиваются друг к другу. В результате все алканы — это либо газы, либо летучие жидкости, либо твёрдые легкоплавкие вещества (табл. 8).

Смесь газообразных углеводородов образует природный газ. Начиная с n = 16, алканы являются твёрдыми веществами. Очищенные твёрдые предельные углеводороды называют парафином.
Неполярные углеводороды практически нерастворимы в полярном растворителе, например в воде, но прекрасно растворяются в неполярных растворителях. Таким растворителем является смесь жидких алканов (бензин, керосин). Природная смесь твёрдых, жидких и газообразных углеводородов называется нефтью.
Нефть в основном состоит из алканов и циклоалканов. При переработке нефти получают: попутный нефтяной газ, смесь жидких алканов (бензин, керосин), твёрдых алканов (асфальт, парафин) и другие нефтепродукты.
Такой способ переработки нефти называется нефтеперегонкой и осуществляется при её нагревании в специальных ректификационных колоннах.
Задание 18.3. Бензин представляет собой смесь алканов с числом атомов углерода от 5 до 9. Составьте их молекулярные формулы.
Химические свойства
Алканы, в принципе, не способны к реакциям присоединения, так как имеют максимально возможное число атомов водорода. Поэтому их называют насыщенными углеводородами.
Для алканов наиболее характерна реакция замещения. В результате такой реакции происходит замещение одного атома водорода алкана на новую группу или на атом (на каждой стадии). Характер химической связи при этом не изменяется.
К таким реакциям относятся:
- Реакция хлорирования, которая происходит под действием солнечного света:

- Реакция нитрования, которая происходит при нагревании:

Обратите внимание: молекулу азотной кислоты в органических реакциях рекомендуется записывать как НО–NO2, так как в результате реакций с ней в молекуле исходного вещества появляется нитрогруппа –NО2.
Для алканов возможны реакции окисления. В растворе они не происходят. Но в присутствии катализаторов алканы окисляются до кислот:
Обратите внимание! Знак [О] означает, что происходит неполное (мягкое) окисление. Окислителями могут быть разные вещества, не только кислород, например, перманганат калия KMnO4.
При полном окислении (горении) любой алкан (и любой углеводород!) превращается в углекислый газ и воду:
Газообразные алканы горят бесцветным пламенем, т. е. сгорают полностью! При этом выделяется много теплоты, поэтому алканы применяются в качестве топлива: природный газ, бензин, керосин, мазут и т. д.
Задание 18.4. Расставьте коэффициенты в уравнении реакции горения.
- При нагревании до очень высоких температур в отсутствии кислорода происходит разрушение (крекинг) молекулы углеводорода:
- При этом образуются и непредельные углеводороды.
Задание 18.5. Укажите формулы непредельных углеводородов.
Процессы крекинга используют при переработке нефти.
Задание 18.6. Напишите уравнения реакций:
- хлорирования этана;
- нитрования метана;
- горения пентана.
Получение и применение алканов
Алканы широко распространены в природе. Простейший алкан — метан — образуется в результате разложения без доступа воздуха остатков растительных и животных организмов, этот газ выделяется на болотах, поэтому он так и называется: «болотный газ».
Метан накапливается в шахтах, где добывают каменный уголь, из-за этого на шахтах иногда бывают взрывы, так как смесь метана с воздухом взрывоопасна. Это следует учитывать и в быту, так как природный газ является источником тепла в газовых плитах.
Метан составляет 95–97 % природного газа.
Алканы — ценное сырьё для получения смазочных масел, пластмасс, красок, стиральных порошков и т. д. Смеси алканов — бензин, керосин — топливо для автомобилей, тракторов, ракет, самолётов. Поэтому их получают в больших количествах в основном при переработке нефти и газа.
В лаборатории в небольших количествах алканы можно получить нагреванием соли карбоновой кислоты со щёлочью:
Внимание! Здесь и далее буквой R обозначается любой углеводородный радикал.
Так, метан получают нагреванием ацетата натрия в присутствии щёлочи:
Метан можно получить гидролизом карбида алюминия (см. урок 13.1):
- Кроме того, в лаборатории алканы получают синтезом Вюрца из галогенпроизводных под действием натрия:
- где R и R1 — предельные радикалы.
Выводы
Алканы — предельные, насыщенные углеводороды, в молекулах которых имеется максимально возможное (предельное) числа атомов углерода.
Поэтому состав всех алканов СnH2n+2 и они не способны вступать в реакции присоединения. Все связи в молекулах алканов — неполярные, простые, очень прочные, поэтому алканы с трудом вступают в химические реакции.
Это реакции замещения, крекинга, горения и каталитического окисления.
Источник: https://himi4ka.ru/samouchitel-po-himii/urok-18-alkany.html
Класс Алканы
Органическая химия — это химия углерода, валентность которого равна 4. Т.е., каждый атом углерода образует 4 связи (сигма-связи). Это может быть связь — С — С — , это может быть связь -С-H. Одинарная связь считается насыщенной, т.е. достигается максимальное перекрывание электронной плотности между атомами.
- Предельные углеводороды —
- (углеводороды с насыщенными связями)
- Сигма-связь (σ- )

- Атомы углерода находятся в состоянии Sp³-гибридизации:

Т.е.
вещества класса Алканы (парафины — старое название) – алифатические (нециклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными, насыщенными) связями в неразветвленные или разветвленные цепи. Угол между связями С-C составляет 109°28′, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг)
-

- Общая формула алканов:
- СnH2n+2
- n = числу атомов углерода.
- Номенклатура веществ класса алканов строится из двух частей.
- Первая часть «говорит» о количестве атомов углерода, вторая — о связи -С-С-. У алканов вторая часть — всегда -ан, а первую часть надо выучить:
| Название (приставка) | Количество атомов углерода | Формула |
| мет-(метан) | 1 | CH4 |
| эт-(этан) | 2 | C2H6 |
| проп-(пропан) | 3 | C3H8 |
| бут-(бутан) | 4 | C4H10 |
| пент-(пентан) | 5 | C5H12 |
| гекс-(гексан) | 6 | C6H14 |
- Физические свойства алканов:
- C1-C4 — газообразные вещества;
- С5- С17 — жидкости;
- С18-… — твердые вещества.
класс алканы —
Химические свойства
Алканы — довольно химически устойчивы. Между атомами насыщенная связь, поэтому вещества класса алканы очень слабо активны.
Максимум на что они способны это:
Реакции замещения: реакция идет на свету по радикальному механизму:
- С2H6 + Cl2 = C2H5Cl + HCl, такое замещение может идти до полного замещения атомами хлора атомов водорода: С2Сl6.
Реакция Вюрца — «именная» реакция удлиннения цепи: C2H5Cl + 2Na +ClC2H5 → C4H10 + 2NaCl (из этана получили бутан) - Реакция Коновалова: c разбавленной азотной кислотой под давлениемС2H6 + HNO3 (HO-NO2) → С2H5NO2 + H2O
- Реакции разложения (крекинг): длинные вещества класса алканы разлагается на алкан (более короткий) и алкен:CH3–CH2–CH3(пропан) –400°C> CH4(метан)+ CH2=CH2 (этилен)
- Окисление алканов (горение): как и все органические вещества, алканы горят до образования углекислого газа и воды:
- 2C2H6 + 7O2 = 4CO2 + 6H2O
- Получение веществ класса алканы:
- Из неорганических веществ: гидролиз карбида алюминия:
Al4C3 + 12H2O = 4Al(OH)3 +3CH4 (метан)
C+2H2 = CH4 (при высоком давлении и температуре) - Гидрирование алкенов:
С2H4 + H2 = C2H6 (этан) - Еще одна «именная» реакция: реакция Кольбе: электролиз солей карбоновых кислот:
2СH3COONa -(электролиз)-→ СH3-CH3 (этан) + 2СO2 +2Na - Реакция солей карбоновых кислот с аналогичными щелочами:
C2H5COONa + NaOH ––t°> C2H6 + Na2CO3
- Вопрос из олимпиадных заданий (2015 г)

- Давайте сначала определимся с атомами углерода — какие из них будут третичными
- Вот пример:

- «Третичный» — атом углерода, связанный с тремя другими атомами С
- н-гептан — гептан линейного строение, «без ответвлений» — только первичные и вторичные атомы СCH3-CH2-CH2-CH2-CH2-CH3
название по номенклатуре ИЮПАК — 2,2-диметилбутан
В этом веществе будут 3 первичных атома (CH3-), один вторичный (-CH2-) и один четвертичный (С)
- в ЕГЭ это вопрос А13 и А14 — Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Обсуждение: «Класс алканы»
(Правила комментирования)
Источник: https://distant-lessons.ru/ximiya/alkany
Что такое алканы
Алканами в химии называют предельные углеводороды, у которых углеродная цепь является незамкнутой и состоит из атомов углерода, связанных друг с другом при помощи одинарных связей.
Также характерной особенностью алканов есть то, что они совсем не содержат двойных либо тройных связей.
Порой алканы называют парафинами, дело в том, что парафины собственно и являются смесью предельных углеродов, то есть алканов.
Формула алканов
- Формулу алкана можно записать как:
- СnР2n+2
- При этом n больше или равно 1.
Изомерия алканов
Алканам свойственна изомерия углеродного скелета. При этом соединения могут принимать разные геометрические формы, как например это показано на картинке ниже.

Изомерия углеродного скелета алканов
С увеличением роста углеродной цепи увеличивается и количество изомеров. Так, например, у бутана есть два изомера.

Получение алканов
Алкан как правило получают различными синтетическими методами. Скажем, один из способов получения алкана предполагает реакцию «гидрирования», когда алканы добываются из ненасыщенных углеводов под воздействием катализатора и при температуре.
Физические свойства алканов
Алканы от других веществ отличаются полным отсутствием цвета, также они не растворим в воде. Температура плавления алканов повышается с увеличением их молекулярной массы и длины углеводородной цепи.
То есть чем более разветвленным является алкан, тем у него большая температура горения и плавления. Газообразные алканы и вовсе горят бледно-голубым или бесцветным пламенем, при этом выделяя много тепла.
Химические свойства алканов
Алканы в химическом плане малоактивные вещества, по причине прочности крепких сигма связей С-С и С-Н. При этом связи С-С неполярны, а С-Н малополярны.
А так как все это малополяризируемые виды связей, которые относятся к сигма виду, то разрываться они будут по механизму гомолитическому, в результате чего образуются радикалы.
И как следствия химические свойства алканов представляют собой в основном реакции радикального замещения.

Так выглядит формула химической реакции радикального замещения алканов (галогенирование алканов).
Помимо этого также можно выделить такие химические реакции как нитрирование алканов (реакция Коновалова).

Реакция эта протекает при температуре 140 С, причем лучше всего именно с третичным атомом углерода.
Крекинг алканов – эта реакция протекает при действии высоких температур и катализаторов. Тогда создаются условия, когда высшие алканы могут рвать свои связи образуя алканы более низкого порядка.

Окисление алканов – в различных условиях эта химическая реакция может привести к образованию спирта, альдегида и уксусной кислоты. При полном окислении реакция протекает вплоть до образования воды и углекислого газа.
Применение алканов
Алканы имеют широкое применение в таких промышленных сферах как синтез нефти, топлива и т. д.
Алканы, видео
И в завершение видео урок о сущности алканов.

При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник: https://www.poznavayka.org/himiya/alkanyi-opredelenie-stroenie-fizicheskie-i-himicheskie-svoystva/
Урок №7. Физические и химические свойства алканов — ХиМуЛя.com
- Физические
свойства - В
обычных условиях - С1-
С4 – газы - С5-
С15 – жидкие - С16
– твёрдые
Температуры плавления и кипения алканов,
их плотности увеличиваются в гомологическом ряду с ростом молекулярной массы.
Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных
растворителях (например, в бензоле) и сами являются хорошими растворителями. Физические
свойства некоторых алканов представлены в таблице.
Таблица 2. Физические свойства некоторых алканов
| Название | Формула | tпл °С | tкип °С |
| Метан | СН4 | -182,5 | -161,5 |
| Этан | С2Н6 | -182,8 | -88,6 |
| Пропан | С3Н8 | -187,7 | -42 |
| Бутан | С4Н10 | -138,3 | -0,5 |
| Пентан | C5H12 | -129,7 | +36,1 |
| Гексан | С6Н14 | -95,3 | 68,7 |
| Гептан | С7H16 | -90,6 | 98,4 |
| Октан | C8H18 | -56,8 | 124,7 |
| Нонан | С9Н20 | -53,7 | 150,8 |
| Декан | C10H22 | -29,6 | 174,0 |
| Пентадекан | C15H32 | +10 | 270,6 |
| Эйкозан | С20Н42 | 36,8 | 342,7 |
| Пентакозан | C25H52 | 53,7 | 400 |
Химические свойства алканов
1. Реакции замещения.
а)
Галогенирование
при действии
света — hν или нагревании (стадийно – замещение атомов
водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик,
академик, лауреат Нобелевской премии Н. Н. Семёнов )
- В
реакции образуются вещества галогеналканы
RГ или
СnH2n+1Г - (Г — это галогены F, Cl, Br, I)
- CH4 + Cl2 hν → CH3Cl + HCl (1 стадия)
; - метан хлорметан CH3Cl + Cl2 hν → CH2Cl2 + HCl
(2 стадия); - дихлорметан
- СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия);
- трихлорметан
- CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия).
- тетрахлорметан
- Скорость реакции замещения водорода на атом галогена у
галогеналканов выше, чем у соответствующего алкана, это связано с взаимным
влиянием атомов в молекуле:
Источник: https://www.sites.google.com/site/himulacom/zvonok-na-urok/10-klass—tretij-god-obucenia/urok-no7-fiziceskie-i-himiceskie-svojstva-alkanov
Алканы: физические и химические свойства, получение и применение
- I. Физические свойства
- В обычных условиях
- С1- С4 – газы
- С5- С15 – жидкие
- С16 – твёрдые
Температуры плавления и кипения алканов, их плотности увеличиваются в гомологическом ряду с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями. Физические свойства некоторых алканов представлены в таблице.
Таблица 2. Физические свойства некоторых алканов
| Название | Формула | tпл °С | tкип °С |
| Метан | СН4 | -182,5 | -161,5 |
| Этан | С2Н6 | -182,8 | -88,6 |
| Пропан | С3Н8 | -187,7 | -42 |
| Бутан | С4Н10 | -138,3 | -0,5 |
| Пентан | C5H12 | -129,7 | +36,1 |
| Гексан | С6Н14 | -95,3 | 68,7 |
| Гептан | С7H16 | -90,6 | 98,4 |
| Октан | C8H18 | -56,8 | 124,7 |
| Нонан | С9Н20 | -53,7 | 150,8 |
| Декан | C10H22 | -29,6 | 174,0 |
| Пентадекан | C15H32 | +10 | 270,6 |
| Эйкозан | С20Н42 | 36,8 | 342,7 |
| Пентакозан | C25H52 | 53,7 | 400 |
- Плотности алканов
- II. Химические свойства алканов
- 1. Реакции замещения
- а) Галогенирование
При действии света — hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов )
- В реакции образуются вещества галогеналканы RГ или Сn H2n+1Г
- (Г — это галогены F, Cl, Br, I)
- CH4 + Cl2 hν → CH3Cl + HCl (1 стадия)
- метан хлорметан
- CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия)
- дихлорметан
- СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия)
- трихлорметан
- CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия)
- тетрахлорметан
- Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
Источник: https://kardaeva.ru/dlya-uchenika/10-klass/94-uroki/266-alkany-fizicheskie-i-khimicheskie-svojstva-poluchenie-i-primenenie
Алканы
Алканы — это ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2 (CH4, C2C6, …). Алканы также называют парафинами. Каждый атом углерода в молекуле алкана имеет максимальное количество связанных с ним других атомов, то есть четыре, поэтому такие углеводороды и называют насыщенными.
Связи
Электронная конфигурация атома углерода с атомным числом 6, 1s22s22p2, не может образовать четыре связи, а только две, поэтому здесь имело место sp3-гибридизация, то есть перераспределение четырёх электронов с двух разных энергетических уровней на один. Образованные связи электронов углерода (с орбитали sp3) и водорода (орбиталь s) образуют очень прочную связь σ. Ввиду прочности связи, насыщенные углеводороды имеют низкую реакционную способность.
Геометрия
Наличие четырёх орбиталей у атома углерода создаёт форму правильного тетраэдра и все углы между орбиталями равны 109°28'. Длина связи между атомами углерода и водорода составляет 0,109 нм, между двумя атомами углерода — 0,154 нм.
Реакции
Атомы в молекулах алканов соединены сильной σ-связью. В реакции связи C-C и C-H имеют равную вероятность разрушиться для образования нового соединения, поэтому результатом реакции всегда является сложная смесь продуктов. В нормальных условиях алканы не реагируют с кислотами, с основаниями, ни с сильными окислителями.
При разрыве связи в алканах возможны два сценария: разрыв связи с образованием двух радикалов, A:B → A• + • B. Такой разрыв называется гомолитический (гомо — одинаковый).
В другом случае происходит разрыв с образованием ионов, когда общая пара электронов отходит к одному из атомов: A:B → A + :B, такой разрыв называется гетеролитический.
Соответствующим образом называются виды реакции алканов: гомолитические и гетеролитические реакции.
На данный момент известны два типа реакции алканов, в которых не разрываются связи C-C — это галогенирование и нитрирование. Ниже даны примеры реакций метана.
Галогенирование
Реакция галогенирования проходит при температуре 300-400°C или под воздействием ультрафиолетовых лучей. В процессе реакции образуются галогеноалканы. Чаще всего встречаются реакции с хромом и бромом, реакции со фтором опасны из-за возможности взрыва, с йодом реакция не проходит.
Процесс галогенирования состоит из трёх этапов: инициирование, рост цепи и обрыв цепи.
1. Инициирование — гомолитическое расщепление галогена на два радикала: Cl2 → 2Cl• (воздействие световой энергии, hν) 2. Развитие цепи — свободные радикалы, взаимодействуют с молекулами и возможны две реакции: (1) Cl• + CH4 → HCl + •CH3 (2) Cl• + CH4 → CH3Cl + H• Энергия атомарного водорода значительно выше чем метильного радикала CH3, поэтому реакция (2) не протекает. 3. Обрыв цепи — радикалы реагируют между собой и образуют продукты: Cl• + Cl• → Cl2 CH3• + CH3• → 2CH3 CH3• + Cl• → CH3Cl
Горение
Основное применение алканов — это топливо, поэтому реакцию горения можно назвать самой популярной для предельных углеводородов. В реакции горения алканы превращаются в воду и углекислый газ. Реакция горения является экзотермической и требует большого количества энергии, например, искра или огонь. Общая реакция горения алканов:
R + O2 → CO2 + H2O + тепло 2CnH2n+2 + (3n+1)O2 → 2nCO2 + (2n+2)H2O + тепло
Реакция горения метана
CH4 + 2O2 → CO2 + 2H2O + 212 ккал/моль
Нитрирование
При температуре 140°C, при повышении давления, алканы реагируют с азотной кислотой, атом водорода замещается на остаток азотной кислоты NO2, продукты реакции называются нитросоединениями:
CH4 + HO-NO2 → CH3-NO2 + H2O (140°C, p)
Синтез
Синтез Вюрца
В 1855 году Адольф Вюрц открыл, что в реакции металлического натрия с галогеноалканом образуется соль натрия:
2CH3I + 2Na• → 2Na+I- + CH3CH3
Свободные радикалы галогеноалкана реагируют друг с другом, образуя более длинные соединения. Общее уравнение реакции имеет вид:
2R-X + 2Na → 2NaX + R-R
Восстановление галогеналкилов
Большинство галогеналкилов в реакции с цинком и катионами водорода (или кислотой Брёнстеда-Лоури) образуют алканы. В такой реакции, цинк является восстановителем и позволяет заменить галоген на водород:
2C4H9Br (2-бромбутан) + H+ (кислота) + Zn → 2C4H10 (бутан) + ZnBr2
Реактивы Гриньярда
Реактивы Гриньярда — это органические соединения, в которых присутствует связь металл-углерод. Такие реактивы образуются в результате реакции галогеналкила с магнием в растворе диэтилового эфира:
R-X + Mg → RMgX (в растворе диэтилового эфира)
Реакция также проходит с хлоридами, бромидами и иодидами алкилов. В процессе гидролиза, реактивы Гриньярда преобразовываются в алканы:
CH3MgI + H2O → CH4 + HO-Mg-I C2H5MgBr + H2O → C2H6 + HO-Mg-Br
Получение и применение
Алканы получают либо с помощью синтеза, либо из природных источников (природный газ, нефть, уголь). Применение насыщенных углеводородов очень обширно, алканы используются в качестве газового, бензинового, дизельного и ракетного топлива. Вазелин, растворители и парафин — также заслуга алканов.
Свойства алканов
Алканы с содержанием от одного до четытрёх атомов углерода находятся в газообразном состоянии, от пяти до 17 атомов углерода — жидкости, с количеством атомов углерода больше 18 находятся в твёрдом состоянии. Бесцветные, безвкусные и не имеют запаха, обычно к алканам добавляют примеси, что бы они имели запах, например в газ метан или в бензин.
sp3-гибридизация делает алканы наименее полярными из всех органических соединений, откуда следует, что они плохо растворяются в полярных растворах, поэтому температуры кипения и плавления будут в основном зависить только от молекулярного веса, в среднем, температура кипения предельных углеводородов увеличивается на 25-30 градусов на каждый атом углерода после пентана. Разветвлённые алканы имеют более низкую температуру кипения, поскольку более разветвлённые молекулы имеют меньшую площадь поверхности, поэтому межмолекулярные связи более слабы и закипают раньше.
Вязкость вещества зависит от размера молекулы, так, чем больше атомов углерода в молекуле, тем она больше и тем больше вероятность взаимодействия молекул и, как следствие, больше вязкость. Алканы с числом углеродов от 20 до 35 являются основным компонентом для смазочных материалов.
Номенклатура
Название алканов состоит из двух частей: префикс обозначает количество атомов углерода, к нему пристраивается суффикс -ан, который означает тип соединения, т.е. алкан.
| 1 | Метан | СH4 |
| 2 | Этан | CH3—CH3 |
| 3 | Пропан | CH3—CH2—CH3 |
| 4 | Бутан | CH3—(CH2)2—CH3 |
| 5 | Пентан | CH3—(CH2)3—CH3 |
| 6 | Гексан | CH3—(CH2)4—CH3 |
| 7 | Гептан | CH3—(CH2)5—CH3 |
| 8 | Октан | CH3—(CH2)6—CH3 |
| 9 | Нонан | CH3—(CH2)7—CH3 |
| 10 | Декан | CH3—(CH2)8—CH3 |
| 11 | Ундекан | CH3—(CH2)9—CH3 |
| 12 | Додекан | CH3—(CH2)10—CH3 |
| 13 | Тридекан | CH3—(CH2)11—CH3 |
| 14 | Тетрадекан | CH3—(CH2)12—CH3 |
| 15 | Пентадекан | CH3—(CH2)13—CH3 |
| 16 | Гексадекан | CH3—(CH2)14—CH3 |
| 17 | Гептадекан | CH3—(CH2)15—CH3 |
| 18 | Октадекан | CH3—(CH2)16—CH3 |
| 19 | Нонадекан | CH3—(CH2)17—CH3 |
| 20 | Эйкозан | CH3—(CH2)18—CH3 |
| Таблица 1. Номенклатура алканов |
Источник: https://k-tree.ru/articles/himiya/organicheskaya_himiya/alkani
Алкены: гомологический ряд, изомерия, строение и номенклатура
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс «40 шагов к 100 баллам на ЕГЭ по химии«.
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкенов.
- Строение, изомерия и гомологический ряд алкенов
- Химические свойства алкенов
- Получение алкенов
Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
Гомологический ряд алкенов
- Общая формула гомологического ряда алкенов CnH2n.
- Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
- Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
sp2-гибридизация
При образовании σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
Сигма-связь
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
пи-Связь
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120 градусов друг к другу:
Изображение с сайта orgchem.ru
Это соответствует плоско-треугольному строению молекулы.
Например, молекуле этилена C2H4 соответствует плоское строение.
Изображение с сайта orgchem.ru
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
Например, в молекуле пропилена присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение и располагается вне плоскости двойной связи.
Изображение с сайта orgchem.ru
Изомерия алкенов
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
- Изомеры углеродного скелета отличаются строением углеродного скелета.
- Например.
- Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен
Бутен-1Метилпропен
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
- Например.
- Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан
- Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
- Например.
- Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2.
Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
Например.
Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере метильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере — по разные стороны.
цис-транс-Изомерияцис-транс-Бутен-2
- Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
- Например.
- Для пентена-1 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода).
Номенклатура алкенов
В названиях алкенов для обозначения двойной связи используется суффикс -ЕН.
Например, алкен имеет название метилпропен.
Метилпропен
При этом правила составления названий (номенклатура) для алкенов в целом такие же, как и для алканов, но дополняются некоторыми пунктами:
1. Углеродная цепь, в составе которой есть двойная связь, считается главной.
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода при двойной связи получили наименьший номер. Нумерацию следует начинать с более близкого к двойной связи конца цепи.
3. В конце молекулы вместо суффикса АН добавляют суффикс ЕН и указывают наименьший номер атома углерода при двойной связи в углеродной цепи.
4. Для простейших алкенов применяются также исторически сложившиеся (тривиальные) названия:
Тривиальные названия алкенов
Радикалы, содержащие двойную связь, также носят тривиальные названия:
Названия радикалов алкенов
Источник: https://zen.yandex.ru/media/id/5c254b1f7a90a300abfc3cca/5dc08ff6433ecc00b1aeae05






