HPO3
Метафосфорная кислота — одноосновная кислота, простейшая формула которой HPO3; действительный же состав её молекул выражается формулой (HPO3)n, где n = 3,4,5 и т. д. В чистом виде представляет собой стекловидную массу, легко растворимую в воде.
· Получают взаимодействием оксида фосфора(V) c водой:
![]()
Физико-химические свойства
Метафосфорная кислота представляет собой белое стеклообразное вещество, хорошо растворимое в воде и, присоединяя её, постепенно переходит в ортофосфорную кислоту:
![]()
- Очень ядовитое вещество.
- H3PO4
- Ортофо́сфорная кислота́ (фо́сфорная кислота́) — неорганическая кислота средней силы, с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы.
При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Фосфорную кислоту получают из фосфата:
![]()
Можно получить гидролизом пентахлорида фосфора:
![]()
Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
![]()
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и её концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]ClO4.
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
![]()
Качественной реакцией на ион РО43− является образование ярко-жёлтого осадка молибденофосфата аммония:
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
![]()
![]()
![]()
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
![]()
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение:
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии.
Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшуюкоррозию.
Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
В составе гидрожидкостей НГЖ-5У и ее иностранных аналогов.
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов.
При применении адгезивных материалов 2 и 3 поколения требуется протравливание эмали зуба кислотой, с последующим промыванием и просушиванием.
Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
С появлением адгезивных материалов 4 и 5 поколения стали использовать технику тотального протравливания (дентин — эмаль).
В адгезивных системах 6 и 7 поколения отдельный этап протравливания кислотой отсутвует. Так адгезивы являются самопротравливающимися.
Хотя некоторые производители все же рекомендуют для усиления адгезии кратковременно протравливать эмаль и при использовании самопротравливащих адгезивов.
- H4P2O7
- Дифосфорная кислота — неорганическое соединение, четырёхосновная кислородсодержащая кислота с формулой H4P2O7, бесцветные кристаллы, растворимые в воде, образует кристаллогидраты.
- Получение:
- Растворение оксида фосфора в воде:
- Нагревание ортофосфорной кислоты:
- Реакция ортофосфорной кислоты с оксидом фосфора:
- Физические свойства:
Дифосфорная кислота — белое аморфное или кристаллическое вещество, очень гигроскопично. Существует в двух кристаллических модификациях с температурами плавления 54,3 и 71,5°С, смесь плавится при 61°С.
- Хорошо растворяется в воде, этаноле, эфире.
- Является четырёхосновной кислотой с константами диссоциации p K1 = 1, p K2 = 2, p K3 = 6,6, p K4 = 9,6.
- Образует кристаллогидраты вида H4P2O7•n H2O, где n = 1, 5 и 6
- Химические свойства:
- При нагревании в вакууме разлагается:
- При кипячении водных растворов переходит в ортофосфорную кислоту:
- Реагирует с щелочами с образованием нормальных или кислых солей:
- Вступает в обменные реакции:
Источник: http://kursak.net/hpo3-metafosfornaya-kislota/
Фосфорная кислота. Свойства, добыча, применение и цена фосфорной кислоты
Веселье приносит и вкус бодрящий. Фраза из рекламы «Кока-Колы» не раскрывает нюансов бодрящего вкуса напитка.
Между тем, один из его компонентов – фосфорная кислота. Не сложно догадаться, что в ее основе – фосфор.

Это биогенный элемент, то есть, необходимый организму. Суточная норма фосфора на половину единицы больше, чем у кальция.
Значит ли это, что кислота в газировке полезна? Разберемся в вопросе, рассмотрев весь комплекс свойств соединения.
Свойства фосфорной кислоты
В естественном состоянии фосфорная кислота – бесцветные кристаллы. Они сохраняются до 42,3 градусов Цельсия.
В твердом виде соединение не практично, посему, переводится людьми в раствор фосфорной кислоты. Ее полное название – ортофосфорная.
Это значит, что в кислоте наибольшее число гидроксогрупп, а конкретно 3OH. Формула соединения: — H3PO4.
Существуют, так же, метофосфорная кислота с одной гидроксогруппой и пирофосфорная.
Приставка «пиро» используется для двухмерных ангидридов, то есть оксидов, из которых с помощью воды получают кислоты.
Итак, просто фосфорной кислотой принято называть соединение с приставкой «орто». Это наиболее известный и распространенный реагент.
Растворяясь в воде, вещество делает ее вязкой, тягучей. Причина – цепляние молекул друг за друга. Вместо рук – водородные связи.
В итоге, жидкость напоминает сироп. Запаха фосфорная кислота в воде не имеет, впрочем, как и в кристаллах.
Если говорить о концентрации раствора, фосфорным принято называть 85-процентный. Для сильных кислот это, как говорится, ударная доза.
Но, героиня статьи к сильным не относится. Химическая активность соединения средняя.
Одна из причин малой реакционности – нерастворимость солей фосфорной кислоты.
Вот взаимодействует она с металлами, стоящими до водорода, но осаждающаяся соль покрывает их.
В итоге, кислота не может пробиться к металлу. Реакция заканчивается, едва начавшись.
Состав фосфорной кислоты дает нерастворимую соль и при взаимодействии с оксидами металлов. Реакция тоже зачаточна.
Полноценно взаимодействия протекают лишь с более слабыми кислотами. К таковым относятся: угольная, кремниевая, сероводородная. Ортофосфорная вытесняет их из водных растворов их солей.
Со щелочами реакция возможна лишь при правильном соотношении компонентов.
Если щелочь в недостатке, взаимодействие замрет, не дойдя до конца. Идти до него долго, ведь реакция многоступенчатая, как собственно, и с аммиаком.

Сначала, получается дигидроортофосфат с формулой NH4H2PO4. Потом, с аммиаком реагирует уже дегидроортофосфат, образуя гидрофосфат аммония.
Специфическая для героини статьи реакция – постепенная потеря воды при нагреве. Сначала, получается пирофосфорная, а потом и тетраметофосфорная.
Возможна и обратная реакция фосфорной кислоты. Она получается из тетраметафосфорной при растворении в воде 5-го оксида фосфора.
Определяющим для ортофосфорной кислоты является и взаимодействие с нитратом серебра.
Если в «сиропе» выпал желтоватый осадок, значит, это вовсе не сироп, а ортофосфорная кислота. Итог реакции – фосфат серебра.
Именно он оседает на дно емкости. Ее низ заполнится и при реакции с другими кислотами, однако, осадок будет белым, а не желтым.
Добыча фосфорной кислоты
Фосфор – один из самых распространенных элементов земной коры. В списке из 20-ти позиций он находится на 11-ом месте.
В процентном соотношении, это около 1% от общей массы пород. С химической точки зрения фосфор довольно активен, особенно белый.
Красный и черный во взаимодействия вступают с неохотой. Тем не менее, за счет распространенности вещества, на Земле хватает минералов, его содержащих.
Наиболее богаты фосфором апатиты и фосфориты. Из них-то и получается фосфорная кислота. Формула соединения позволяет добывать его двухступенчатой и одноступенчатой реакцией.
Последняя дороже, требует громоздкой аппаратуры и дает загрязненную кислоту.
Суть метода в окислении фосфора до фосфорного ангидрида. Его газы охлаждают, гидротируют и фильтруют.
Производство фосфорной кислоты двухступенчатым способом отличается избирательным окислением фосфора.
Окись углерода остается в стороне. Полученный ангидрит фосфора взаимодействует с водой, «рождая» метакислоту. Для этого нужен нагрев до 800-от градусов Цельсия.
Метафосфорная кислота находится в парообразном состоянии. Остается гидрировать ее и получить ортотуман.
Есть ряд промежуточных реакций, которые могут довести до формирования низших окислов, к примеру, фосфораватистой кислоты.
Она не входит в планы промышленников. Поэтому, фосфор сжигают в двухкратном избытке кислорода. Его обилие исключает переход ортофосфорной кислоты в низший окисел.
Двухступенчатая реакция, как видно, основана на извлечении соединения из раствора.
Поэтому, итогом реакций становится экстракционная фосфорная кислота, то есть, обычная, но полученная путем экстракции.
Попутно, образуется чистый фосфор, причем сразу в двух формах. Обе нужны промышленникам и, это еще один плюс двухступенчатой добычи.
Применение фосфорной кислоты
Фосфор нужен не только человеческому организму, но и растениям. Без биогенного элемента у них плохо созревают семена, плоды, в общем, тормозится репродуктивная функция.
Поэтому, 80, а по некоторым данным и 90% фосфорной кислоты применение находят в сельском хозяйстве. Основные поставщики удобрений – Морокко, Россия и США.
От питания растений перейдем к питанию человека. Фосфорная кислота – официально зарегистрированная пищевая добавка.
Ее обозначение – Е338. Примешивается не только к газировкам, но и мармеладу, колбасам, хлебобулочным изделиям, даже к сахару.
Последний продукт реагент осветляет. Желтоватый сахар, как известно, не в почете. Остальные позиции Е338 подкисляет, усиливает вкус.
Все бы ничего, но остаток фосфорной кислоты, перебрасываемый в сферу питания, все увеличивается.
Постоянное употребление Е338 повышает кислотность организма. Нейтрализовать ее удается путем вымывания из костей и зубов кальция.
Его организму требуется единица, а фосфора, как говорилось, на 50% больше. Но, с современными продуктами питания это не 50, а все 150%.
Итог – кариес, проблемы с костями, ранний остеопороз. Поэтому, лучше искать на упаковках отметку об обогащении кальцием.
Фосфора и так с излишком. Веселье и вкус бодрящий – лишь начальный этап. После, приходят проблемы со здоровьем.
Теперь к животным. Они тоже нуждаются в фосфоре, но продуктов с Е338 не покупают.
Поэтому, ортофосфорную кислоту животным дают ветеринары. Они советуют соединение в качестве профилактического средства от камней в почках.
Пригождается ортофосфорная кислота и в деревообрабатывающей промышленности. Соединение используют в качестве пропитки.
После обработки древесина теряет горючесть. К пламени, так же, устойчивы лакокрасочные смеси с фосфорной кислотой. В пенопласт ее тоже добавляют.
Фосфорная кислота способна смягчить воду. Не удивительно, что реагент входит в состав средств от накипи и некоторых моющих составов.
Своеобразному мытью подвергают и зубы, предназначенные под коронки. Протезы садятся на клей, а он лучше держится на поверхности, обработанной фосфорной кислотой.
Героиня статьи легко разъедает ржавчину. Поэтому, в кустарных условиях с помощью реагента снимают окисленные детали, гайки.

Достаточно капнуть на них кислотой и подождать около получаса. Элемент легко подастся.
Капают, обычно, не чистым соединением, а смесями для гидроусилителей, или тормозной жидкостью. В их составе всегда есть фосфорная кислота.
Цена фосфорной кислоты
Купить фосфорную кислоту можно и по 100 рублей за кило, и по 40. Причем, последний ценник выставлен одним из производителей за улучшенный состав марки «И».
Она соответствует ТУ 113-25-65-01-88. Единственный нюанс, под маркой «И» скрывается 72-ух, а не 85-процентная кислота.
Ценник в 100 рублей выставляется за последнюю. По сути, запросы продавцов зависят от их личных амбиций, чистоты реагента, его концентрации и формы поставок.

Оптовикам предлагают скидки в районе 10-20%. Канистры, обычно, вмещают 35 килограммов кислоты. На Российском рынке она либо китайская, либо отечественная.
В малых объемах реагент продается, к примеру, в виде флюса для пайки. 10-миллилитровый бутылек стоит в районе 20-ти рублей.
За 30 миллилитров просят 40 рублей. В небольших емкостях реализуют и пищевую кислоту, то есть Е338. За 200 миллилитров просят 200-300 рублей.
Редкое предложение – бутыли по 1,5-2 килограмма. Такие реализует одна из компаний Новокузнецка. За бутыль просят 350 рублей.
Источник: https://tvoi-uvelirr.ru/fosfornaya-kislota-svojstva-dobycha-primenenie-i-cena-fosfornoj-kisloty/
Оксиды фосфора. Фосфорная кислота

Фосфор образует очень большое число различных оксидов и кислот. Среди них наиболее устойчивыми являются оксид фосфора (V) и соответствующая ему ортофосфорная, или фосфорная, кислота Н3РО4.
Оксид фосфора (V), или фосфорный ангидрид Р2О5 – белый порошок, без запаха. По своему характеру является типичным кислотным оксидом. При растворении в воде гидратируется с образованием следующих кислот:
- P2O5 + H2O = 2HPO3
- P2O5 + 2H2O = H4P2O7
- P2O5 + 3H2O = 2H3PO4
- Как кислотный оксид Р2О5 взаимодействует с основаниями и основными оксидами, например:
- P2O5 + 6NaOH = 2Na3PO4 + 3H2O
- P2O5 + 3BaO = Ba3(PO4)2
- При взаимодействии Р2О5 со щелочами в зависимости от соотношения реагентов могут образовываться не только средние, но и кислые соли:
- P2O5 + 4NaOH = 2Na2HPO4 + H2O
- P2O5 + 2NaOH + H2O = 2NaH2PO4
- Хотя в Р2О5 фосфор имеет высшую степень окисления +5, оксид фосфора (V) не проявляет сколько-нибудь выраженных окислительных свойств, так как эта степень окисления для фосфора очень устойчива.
Оксид фосфора (V) является прекрасным водопоглощающим и водоотнимающим средством. На этом основано его использование в эксикаторах (сосудах для высушивания веществ), при проведении реакций дегидратации и т.д.
Фосфорная кислота
Фосфорная (ортофосфорная) кислота Н3РО4 – бесцветное кристаллическое вещество, плавящееся при температуре 42 оС, очень хорошо растворимое в воде. Фосфорная кислота является трёхосновной кислотой средней силы.
- В лаборатории её получают окислением фосфора разбавленной азотной кислотой.
- В промышленности Н3РО4 получают экстракционным методом, обрабатывая природные фосфаты серной кислотой:
- Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4
- а также термическим методом, восстанавливая природные фосфаты до свободного фосфора, который затем сжигают и образующийся при этом Р2О5 растворяют в воде.
Фосфорная кислота обладает всеми общими свойствами кислот, но она значительно слабее таких кислородсодержащих кислот, как серная и азотная. В отличие от этих кислот фосфорная кислота не обладает даже значительными окислительными свойствами, несмотря на устойчивость степени окисления +5.
Применение фосфорной кислоты
Помимо производства удобрений, фосфорную кислоту используют при изготовлении реактивов, многих органических веществ, для получения катализаторов, для создания защитных покрытий на металлах, в фармацевтической промышленности и т.д.
- Соли фосфорной кислоты
- Как трёхосновная кислота Н3РО4 образует три ряда солей: средние (нормальные) соли – фосфаты; кислые соли – гидрофосфаты и дигидрофосфаты.
- Например, при нейтрализации фосфорной кислоты гидроксидом натрия в зависимости от молярного соотношения кислоты и щёлочи могут идти следующие реакции:
- Н3РО4 + 3NaOH = Na3PO4 + 3H2O
- Н3РО4 + 2NaOH = Na2HPO4 + 2H2O
- Н3РО4 + NaOH = NaH2PO4 + H2O
Большинство средних солей – фосфатов – нерастворимо в воде. Исключением являются лишь фосфаты щелочных металлов и аммония. Многие же кислые соли фосфорной кислоты, хорошо растворяются в воде, причем наиболее растворимыми являются дигидрофосфаты.
Фосфорные удобрения
 Минерал апатит
Минерал апатит
Фосфор, как и азот, является одним из тех элементов, который необходим для питания растений. Поэтому наряду с азотными в сельском хозяйстве широко используются фосфорные удобрения. В качестве удобрения можно использовать только водорастворимые соединения. В связи с этим основная задача при производстве фосфорных удобрений — превращение нерастворимого фосфата кальция (основа фосфоритов и апатитов) в растворимые кислые фосфаты.
- Важнейшее фосфорное минеральное удобрение – суперфосфат (или простой суперфосфат), который получают обработкой природных фосфоритов серной кислотой:
- Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
- Образующаяся смесь содержит дигидрофосфат кальция, который хорошо растворим в воде, и сульфат кальция, который не имеет практического значения.
- Для получения двойного суперфосфата из природного фосфорита выделяют сначала фосфорную кислоту по реакции:
- Ca3(PO4)2 + 3H2SO4 = 2Н3РО4 + 3CaSO4↓
- Затем полученной кислотой обрабатывают новую порцию фосфорита:
- Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
- Иногда фосфорную кислоту нейтрализуют гидроксидом кальция, при этом получается так называемый преципитат, который тоже является хорошим удобрением:
- H3PO4 + Ca(OH)2 = CaHPO4∙2H2O
- СаНРО4 плохо растворяется в воде, но достаточно хорошо растворим при внесении его в кислые почвы.
 Аммофос
Аммофос
- В последнее время широкое распространение получили сложные удобрения, содержащие несколько необходимых растениям элементов.
- Важнейшим из них является аммофос, который содержит азот и фосфор и образуется при взаимодействии аммиака и фосфорной кислоты:
- NH3 + H3PO4 = NH4H2PO4
- 2NH3 + H3PO4 = (NH4)2HPO4
Смесь аммофоса с калийной селитрой KNO3 называется аммофоской. Это удобрение содержит все наиболее необходимые растениям питательные элементы – азот, фосфор и калий.
*на изображении записи минерал апатит
Источник: https://al-himik.ru/oksidy-fosfora-fosfornaja-kislota/
Ортофосфорная кислота
Ортофосфорная кислота (фосфорная кислота) — неорганическая кислота средней силы с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 %-й водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима в этаноле и других растворителях.
Физические свойства
В чистом виде фосфорная кислота представляет собой бесцветное кристаллическое вещество с температурой плавления 42,35 °С. Кристаллы имеют моноклинную сингонию. Твёрдая фосфорная кислота гигроскопична и расплывается на воздухе; она смешивается с водой во всех соотношениях, но коммерчески обычно доступна в трёх концентрациях:
- 75 % H3PO4 (т. пл. –20 °С);
- 80 % H3PO4 (т. пл. 0 °С);
- 85 % H3PO4 (т. пл. 20 °С).
Из 85 %-ой фосфорной кислоты можно получить безводную при испарении воды в вакууме при 80 °С. Из концентрированных растворов она осаждается в виде гемигидрата H3PO4·0,5H2O.
В твёрдом состоянии и концентрированных растворах между молекулами фосфорной кислоты существуют водородные связи. При снижении концентрации до 40-50 % более устойчивой является водородная связь между фосфат-анионами и молекулами воды. Также в растворах фосфорная кислота обменивается атомами кислорода с водой.
Химические свойства
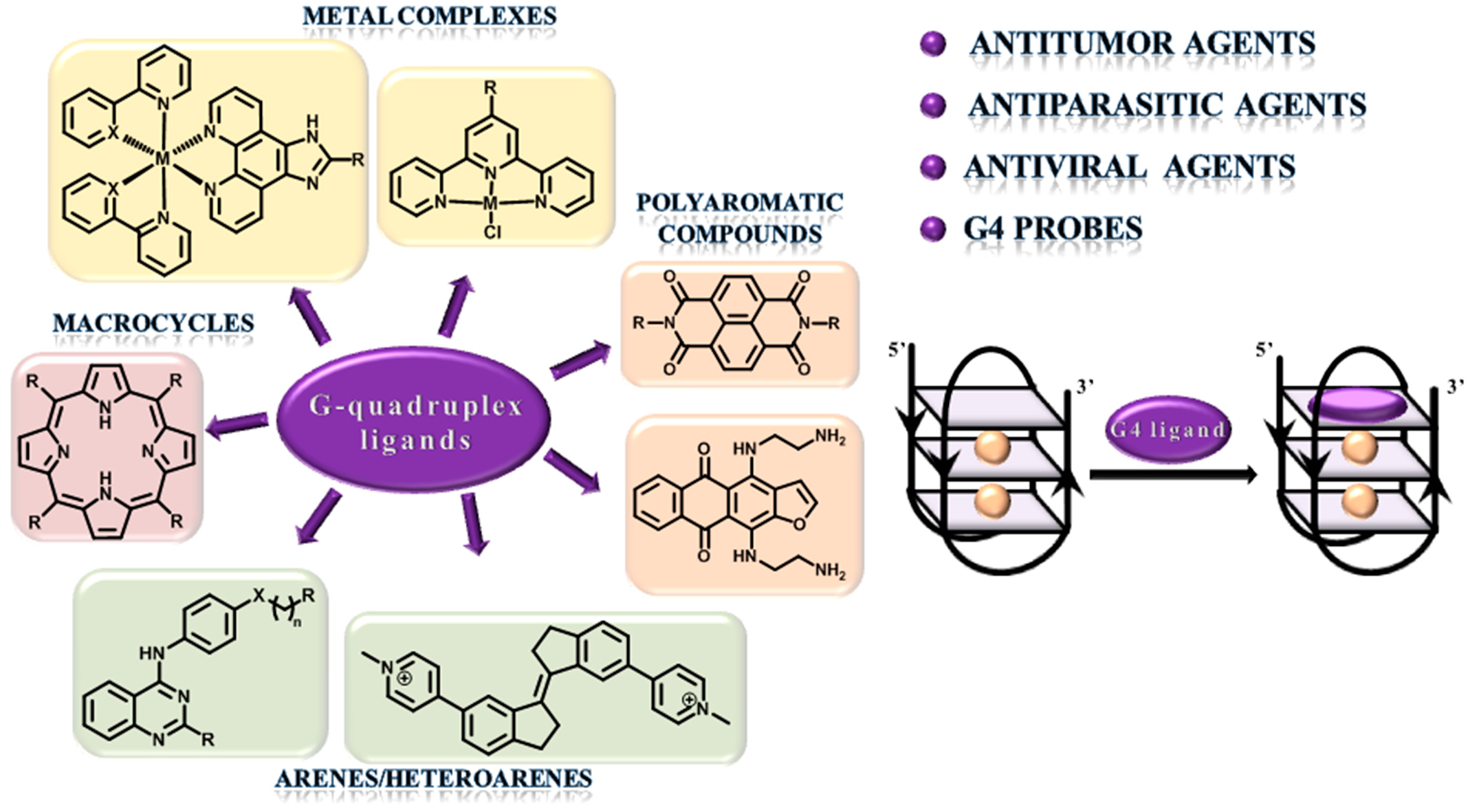 Ионный состав в зависимости от pH раствора.
Ионный состав в зависимости от pH раствора.
Фосфорная кислота — трёхосновная кислота средней силы. В водных растворах она подвергается диссоциации по трём ступеням c константами диссоциации K1 = 7,1⋅10–3 (pKa1 2,12); K2 = 6,2⋅10–8 (pKa2 7,20); K3 = 5,0⋅10–13 (pKa3 12,32). Экзотермична только диссоциация по первой ступени; по второй и третьей ступени она эндотермична.
| H3PO4(aq) + H2O(l) ⇌ H3O(aq)+ + H2PO4(aq)− |
| H2PO4(aq)− + H2O(l) ⇌ H3O(aq)+ + HPO4(aq)2− |
| HPO4(aq)2− + H2O(l) ⇌ H3O(aq)+ + PO4(aq)3− |
Как следствие, фосфорная кислота может образовывать как средние (фосфаты), так и кислые соли (гидрофосфаты и дигидрофосфаты). Однако при нормальных условиях она малоактивна и вступает в реакции только с карбонатами, гидроксидами и некоторыми металлами.
Выше 80 °С фосфорная кислота реагирует также с неактивными оксидами, кремнезёмом и силикатами. Также фосфаты образуются в процессе фосфатирования, при помощи которого чёрные и цветные металлы покрывают защитной плёнкой для улучшения их характеристик.
Нагревание фосфорной кислоты приводит к отщеплению воды с образованием пирофосфорной кислоты и метафосфорной кислоты:
2H3PO4 → H2O + H4P2O7 ; H4P2O7 → H2O + 2HPO3
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра: при этом образуется жёлтый осадок, тогда как другие фосфорные кислоты дают белый осадок:
H3PO4 + 3AgNO3 → Ag3PO4 + 3HNO3
Качественной реакцией на ион H2PO4− является образование ярко-жёлтого осадка молибденофосфата аммония:
H3PO4 + 12[NH4]2MoO4 + 21HNO3 → [NH4]3PMo12O40 ⋅ 6H2O↓ + 21NH4NO3 + 6H2O
Впервые фосфорную кислоту из оксида фосфора(V) получил Роберт Бойль в 1694 году. Лабораторный метод получения заключается в окислении фосфора азотной кислотой:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO
Термический способ
В промышленности используют два основных способа получения фосфорной кислоты: термический и экстракционный. Термический способ заключается в сжигании фосфора до оксида фосфора(V) и реакции последнего с водой:
P4 + 5O2 → P4O10 ; P4O10 + 6H2O → 4H3PO4
Технически этот процесс реализуется по-разному. В так называемом IG-процессе (от названия фирмы IG) обе реакции проводятся в одной реакционной колонне. Сверху в неё сжатым воздухом или паром под давлением 1,5 МПа через сопло подаётся фосфор, который сгорает при температуре >2000 °C.
Полученный оксид фосфора(V) поглощается фосфорной кислотой, которая стекает сверху по стенкам колонны, целиком покрывая их. При этом она одновременно выполняет несколько функций: растворяет оксид фосфора(V), отводит теплоту из реакции сгорания и защищает стенки колонны от пламени.
Полученная фосфорная кислота собирается под колонной, пропускается через теплообменник и подаётся в верхнюю часть колонны, откуда снова стекает по стенкам. Материалом для установки по получению фосфорной кислоты служит нержавеющая сталь с низким содержанием углерода.
До 100 °C она устойчива к концентрированной фосфорной кислоте.
Получаемая этим способом фосфорная кислота практически не содержит примесей соединений фосфора в низших степенях окисления (содержание фосфористой кислоты H3PO3 составляет всего 0,1 %).
Однако её необходимо очистить от примесного мышьяка, который в низких концентрациях содержится даже в очень чистом фосфоре.
Эта очистка осуществляется воздействием сероводорода (для его получения в фосфорную кислоту вводят сульфид натрия) и осаждением сульфида мышьяка с последующим фильтрованием.
На этих реакциях основан также TVA-процесс (от Tennessee Valley Authority), однако сжигание фосфора и поглощение оксида фосфора(V) проводится отдельно.
Фосфор и воздух подаются в стальную камеру сгорания с внешним охлаждением, после чего продукты сгорания через верхнюю часть камеры подпадают в камеру поглощения, где и образуется фосфорная кислота.
В Хёхст-процессе (от названия фирмы Hoechst) сгорание и поглощение проводятся отдельно, однако он отличается тем, что теплота сгорания фосфора там используется для генерирования пара.
Экстракционный способ
Экстракционный способ производства фосфорной кислоты заключается в обработке природных фосфатов неорганическими кислотами (в странах СНГ преимущественно хибинского апатитового концентрата и фосфоритов Каратау). Фосфаты обрабатывали серной кислотой ещё в середине 1880-х гг., однако развитие этой области началось после Второй мировой войны благодаря повышенному спросу на минеральные удобрения.
Разложение сырья происходит по следующей схеме (x от 0,1 до 2,2):
Ca5(PO4)3F + 5H2SO4 + 5xH2O → 5CaSO4 ⋅ xH2O + 3H3PO4 + HF
Побочным продуктом этой реакции является сульфат кальция, который в зависимости от температуры и концентрации фосфорной кислоты может выпадать в виде дигидрата (CaSO4·2H2O) или гемигидрата (CaSO4·0,5H2O).
По этому признаку экстракционные процессы получения фосфорной кислоты делят на дигидратные, гемигидратные и комбинированные (дигидратно-гемигидратный и гемигидратно-дигидратный).
Существует также ангидритный метод (с осаждением безводного сульфата кальция), который, однако, в промышленности не используется, так как он связан с серьёзными коррозионными проблемами.
Дигидратный процесс является классическим методом получения фосфорной кислоты. Его преимущества заключаются в относительно низкой температуре, благодаря чему удаётся избежать коррозии.
Кроме того, можно использовать различное фосфатное сырьё и перерабатывать его в больших количествах. Для начала сырьё измельчают до размера частиц меньше 150 мкм.
Фосфат и серная кислота подаются в реактор по отдельности, чтобы образование слоя сульфата кальция на частицах не затрудняло дальнейшего разложения. Температура процесса составляет 70-80 °С, а концентрация фосфорной кислоты в системе равна 28-31 % в пересчёте на P2O5.
В этих условиях сульфат кальция образуется в виде дигидрата. Недостатком метода является то, что исходное сырьё необходимо перемалывать, а полученную фосфорную кислоту дополнительно концентрировать до 40-55 % и даже до 70 % P2O5.
Гемигидратный процесс был разработан для того, чтобы избежать необходимости концентрирования полученной фосфорной кислоты. Он проводится при более высокой температуре (80-100 °С) — в условиях, когда более устойчивой формой является гемигидрат сульфата кальция.
Фосфорная кислота при этом получается в концентрации 40-48 %. Гемигидратно-дигидратный процесс разработан в Японии в связи с тем, что он позволяет получать практически чистый гипс, залежи которого в этой стране отсутствуют.
Обработка сырья ведётся при высокой температуре, и образуется гемигидрат сульфата кальция, однако затем его перекристаллизовывают в дигидрат.
Концентрирование и очистка
Для концентрирования фосфорной кислоты, полученной дигидратным процессом, используют вакуумное испарение, хотя на старых заводах до сих пор применяют погружное горение. Иногда используют последовательно несколько испарителей, так что пары с одного испарителя используются для нагрева раствора в следующем испарителе.
Кроме того, при испарении воды из фосфорной кислоты также удаляется фтор в виде смеси SiF4 и HF. Так, при повышении концентрации фосфорной кислоты с 30 до 50 % P2O5 из неё удаляется 50-60 % фтора. Поскольку выбросы фтора регулируются законами, эти вещества направляют на производство кремнефтористоводородной кислоты H2SiF6.
Разнообразные неорганические примеси удаляют осаждением и экстракцией. Осаждать необходимо примеси мышьяка (в виде сульфида мышьяка), кадмия (в виде комплекса с эфирами дитиофосфорной кислоты), а также примеси катионных металлов (обработкой гидроксидом натрия).
Экстракция основана на переводе фосфорной кислоты в органическую фазу и промывках водой, разбавленной фосфорной кислотой и растворами фосфатов. При этом удаляются как катионные, так и анионные примеси. Сама фосфорная кислота отделяется от растворителя перегонкой.
В качестве растворителей используют бутанол-1, амиловый спирт, метилизобутилкетон, трибутилфосфат, диизопропиловый эфир и др.
Экономические и экологические аспекты
Мировая потребность в фосфорной кислоте по состоянию на 1989 г. оценивается в 40,6 млн тонн в год в пересчёте на P2O5.
Экстракционный способ производства является преобладающим (95 % от общего количества), поскольку он потребляет меньше энергии. Остальные 5 % производятся термическим способом.
Основным производителем (и потребителем) экстракционной фосфорной кислоты являются США: их доля от общего производства фосфорной кислоты составляет 90 %.
В 1980-е гг. произошло сокращение производства фосфорной кислоты из-за отказа от фосфорсодержащих детергентов и минеральных удобрений. Это было связано с загрязнением фосфатными удобрениями грунтовых вод и эвтрофикацией водоёмов.
Экстракционное производство фосфорной кислоты связано с образованием отвалов сульфата кальция: на 1 т P2O5 производится 4,5-5,5 т загрязнённого сульфата кальция, который необходимо утилизировать. По состоянию на 2008 год существует три варианта:
- затопление в водоёмах (10 %);
- сваливание на суше (около 88 %);
- использование в качестве сырья.
При затоплении в водоёмах сульфат кальция быстро растворяется: его растворимость в морской воде составляет 3,5 г/л, а природное содержание — 1,6 г/л. Примеси оксида кремния и оксида алюминия остаются нерастворёнными. Загрязнение воды тяжёлыми металлами мало по сравнению с существующими концентрациями, однако загрязнение кадмием значительно.
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии.
Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию.
Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Авиационная промышленность
В авиационной промышленности ортофосфорная кислота используется в составе гидрожидкости НГЖ-5У и её иностранных аналогов.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках, например в Кока-Коле. По вкусу подслащённые слабые водные растворы ортофосфорной кислоты напоминают крыжовник.
Сельское хозяйство
В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного pH желудка и мочекаменной болезни.
Также ее применяют в гидропонных системах для регулировки уровня pH питательного раствора.
Стоматология
Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов.
При применении адгезивных материалов 2-го и 3-го поколений требуется протравливание эмали зуба кислотой с последующим промыванием и просушиванием.
Кроме дополнительных временных затрат на проведение, данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесённый адгезив не полностью (не по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удаётся полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность связывания, а также приводят к образованию так называемой «кислотной мины».
С появлением адгезивных материалов 4-го и 5-го поколений стали использовать технику тотального протравливания (дентин — эмаль).
В адгезивных системах 6-го и 7-го поколений отдельный этап протравливания кислотой отсутствует, так как адгезивы являются самопротравливающимися.
Однако некоторые производители всё же рекомендуют для усиления адгезии кратковременно протравливать эмаль даже при использовании самопротравливающих адгезивов.
Фосфорная кислота не оказывает специфического токсического действия. Системная токсичность низкая. Её растворы раздражают глаза, дыхательные пути и слизистые оболочки. При концентрации > 10 % она оказывает раздражающее действие, а выше 25 % — также коррозионное.
При глотании большого количества возникает тошнота, рвота, диарея, кровавая рвота и гиповолемический шок. Концентрированные растворы вызывают ожоги слизистой оболочки рта, пищевода и желудка. При попадании рекомендуется промыть кожу или промыть глаза тёплой водой или физиологическим раствором.
При глотании фосфорной кислоты в качестве первой помощи необходимо поддерживать дыхание и внутривенно восполнять жидкость.
У добровольцев, получавших фосфорную кислоту перорально в количестве 2-4 г/кг в день в течение 10 дней или 3,9 г/кг в день в течение 14 дней, не обнаружено негативных для метаболизма последствий. Допускается использовать 0,5–1 г/л фосфорной кислоты в напитках.
Источник: https://chem.ru/ortofosfornaja-kislota.html
Фосфористая кислота — простейшая фосфоновая кислота

Теоретически, судя по химической формуле, кислота должна быть трехосновной, так как в ней три гидроксильных группы —ОН. Но исследователи на практике убедились, что в химических реакциях замещаются только два атома водорода. Из этого был сделан вывод, что на самом деле молекула реагента содержит лишь две гидрооксигруппы, а третьи атомы водорода и кислорода напрямую связаны с атомом фосфора. Молекула имеет форму тетраэдра с атомом фосфора в центре, к которому присоединены, расположенные в вершинах, два гидроксила, атом кислорода и атом водорода, поэтому часто встречается написание формулы как Н2[НРО3], которое лучше отражает структуру.
Получают вещество химическим синтезом из фосфатов, растворением оксида фосфора P2O3 в воде или гидролизом хлорида фосфора PCl3 или других галогенидов фосфора.
| Фосфористая кислота | Фосфорный ангидрид (фосфорпятиокись) |
Свойства
В нормальных условиях — кристаллы без цвета и запаха, плавятся при температуре уже около +70 °С.
Легко поглощают влагу из воздуха и расплываются; хорошо растворяются в воде, спиртах, многих органических растворителях.
При нагревании реактив разлагается на крайне токсичный фосфин и ортофосфорную кислоту Н3РО4. При нагревании раствора выделяется водород и образуется ортофосфорная кислота.
Вещество относится к неорганическим кислотам средней силы. В химических реакция проявляет себя как сильный восстановитель. Взаимодействует со щелочами с образованием солей, называемых фосфитами. Фосфиты щелочных металлов и кальция водорастворимы. Все остальные — нерастворимы.
Активно вступает в реакции с большинством окислителей, например, с галогенами, галогенидами, окислами азота и активных металлов, кислородом, химически активными металлами, перманганатом калия. В реакции с растворами солей благородных металлов, металлы выделяются в виде осадка.
Образует ангидриды и эфиры.
Реактив следует хранить в многослойных или пластиковых мешках, на сухих складах, оберегая от высоких температур, вдали от нагревательных приборов.
Как и с любой кислотой, с реактивом следует обращаться осторожно. При контакте с кожей или слизистыми концентрированного раствора возможен химический ожог, поэтому работать с фосфористой кислотой следует в спецодежде, химических очках, резиновых перчатках.
В случае случайного проглатывания фосфористой кислоты нужно дать пострадавшему выпить побольше воды и срочно доставить к врачу. Рвоту не вызывать, чтобы не усугубить ожог гортани и пищевода.
Применение
- В лабораторной практике и химическом
 производстве кислота и ее соли используются в восстановительных реакциях.
производстве кислота и ее соли используются в восстановительных реакциях. - Для производства фосфитов, фосфорорганических соединений, включая сложные органические фосфоновые кислоты.
- Для выделения благородных металлов из их солей.
- В химпроме — в производстве каучуков, пестицидов, специализированных реактивов для водоподготовки.
Источник: https://pcgroup.ru/blog/fosforistaya-kislota-prostejshaya-fosfonovaya-kislota/
фосфорная кислота 1химическая формула место в классификации 2физические свойства 3химические — Школьные Знания.com
HPO₃-хим.формулафиз св-ва :бесцв. гигроскопичные кристаллы моноклинной сингониирасплывается на воздухе; В расплавленном состоянии склонна к переохлаждению; при 15 0C образует густую маслянистую жидкость, при -121 0C- стеклообразную массу.
Фосфорная кислота обладает всеми типичными свойствами кислот.
Растворы фосфорной кислоты могут реагировать с металлами, стоящими в ряду напряжений до водорода.
Но так как почти все соли H3PO4 нерастворимы в Н2О, то её реакция с металлами чаще всего идёт только в начальный момент времени, пока осаждающаяся соль не покроет всю поверхность металла и не затруднит доступ кислоты к глубинным слоям металла. После этого реакция (если осадок достаточно плотный) прекращается:
- 3 Mg + 2H3PO4 = Mg3(PO4)2↓ + 3H2↑
- Растворимые соли фосфорной кислоты образованы щелочными металлами, но эти металлы с разбавленными растворами кислоты вероятнее всего реагируют в 2 стадии.
- Вначале металл взаимодействует с H2O:
- 2Na + 2H2O = 2NaOH + H2↑
- А затем образовавшаяся щёлочь реагирует с кислотой:
- 3NaOH + H3PO4 = Na3PO4 + 3H2O
- При этом в зависимости от молярного соотношения щелочи и кислоты в растворе могут получаться как кислые, так и средние соли.
С оксидами многих металлов растворы H3PO4 взаимодействуют также только в начальный момент времени, пока нерастворимая соль плотной плёнкой не покроет всю поверхность оксида металла. Оксиды щелочных и щелочноземельных металлов с разбавленными растворами кислоты, как и сами эти металлы, могут реагировать в 2 стадии.
- Взимодействие H3PO4 с растворами щелочей протекает ступенчато:
- 1. H3PO4 + NaOH = NaH2PO4 + H2O
- 2. NaH2PO4 + NaOH = Na2HPO4 + H2O
- 3. Na2HPO4 + NaOH = Na3PO4 + H2O
- суммарное уравнение 3NaOH + H3PO4 = Na3PO4 + 3H2O
- 1. 2H3PO4 + Ba(OH)2 = Ba(H2PO4)2 + 2H2O
- 2. Ba(H2PO4)2 + Ba(OH)2 = 2BaHPO4 + 2H2O
- 3. 2BaHPO4 +Ba(OH)2 = Ba3(PO4)2 + 2H2O
- суммарное уравнение 2H3PO4 +3Ba(OH)2 = Ba3(PO4)2 + 6H2O
- Если щелочь взять в недостатке, то реакция может прекратиться на любой из стадий, в зависимости от молярного соотношения исходных веществ.
- В несколько стадий протекает и взаимодействие растворов H3PO4 с аммиаком:
- H3PO4 + NH3 = NH4H2PO4
- NH4H2PO4 + NH3 = (NH4)2HPO4
Аммоний-фосфат (NH4)3PO4 в этих условиях получить нельзя, т.к. вследствие гидролиза он тут же полностью превращается в аммоний-гидрофосфат:
- (NH4)3PO4 + HOH → (NH4)2HPO4 + NH3 + H2O
- Фосфорная кислота сильнее, чем угольная, сероводородная, кремниевая, поэтому может вытеснять перечисленные кислоты из водных растворов их солей:
- 2H3PO4 + Na2S = 2NaH2PO4 + H2S↑
- H2O
- 2H3PO4 + Na2CO3 = 2NaH2PO4 + H2CO3
- CO2↑
- 2H3PO4 + Na2SiO3 = 2NaH2PO4 + H2SiO3↓
- К числу специфических свойств фосфорной кислоты можно отнести ее постепенное обезвоживание при сильном нагревании с образованием сначала дифосфорной или пирофосфорной кислоты, а затем – тетраметафосфорной.
- Данный процесс обратен переходу тетраметафосфорной кислоты в H3PO4 при растворении фосфор(V)-оксида в воде.
Качественной реакцией на фосфорную кислоту и ее соли в растворе является взаимодействие с AgNO3. При этом образуется осадок серебро(I)-фосфата желтого цвета.
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
Полифосфорные кислоты и их соли в аналогичной реакции образуют осадок белого цвета.
Источник: https://znanija.com/task/23109481




