| Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона). |
|
| Уравнением состояния называется уравнение, связывающее параметры физической системы и однозначно определяющее ее состояние. В 1834 г. французский физик Б. Клапейрон, работавший дли тельное время в Петербурге, вывел уравнение состояния идеального газа для постоянной массы газа. В 1874 г. Д. И. Менделеев вывел уравнение для произвольного числа молекул. |
|
| В МКТ и термодинамике идеального газа макроскопическими параметрами являются: p, V, T, m. Мы знаем, что |
|
| |
|
| Таким образом, имеем: — уравнение состояния (уравнение Менделеева – Клапейрона). |
|
| Другие формы записи уравнения состояния идеального газа. | |
| 1.Уравнение для 1 моля вещества. Если n=1 моль, то, обозначив объем одного моля Vм, получим: . |
 |
| 2. Запись уравнения через плотность: — плотность зависит от температуры и давления! | |
| 3. Уравнение Клапейрона. |
|
| Эта запись означает, что для данной массы данного газа справедливо равенство: |
|
| Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: . | |
| Газовые законы. | |
| 1. Закон Авогадро. В равных объемах различных газов при одинаковых внешних условиях находится одинаковое число молекул (атомов). Условие: V1=V2=…=Vn; p1=p2=…=pn; T1=T2=…=Tn |
|
 Следовательно, при одинаковых условиях (давление, объем, температура) число молекул не зависит от природы газа и одинаково. Следовательно, при одинаковых условиях (давление, объем, температура) число молекул не зависит от природы газа и одинаково. |
|
| 2. Закон Дальтона. Давление смеси газов равно сумме парциальных (частных) давлений каждого газа. Доказать: p=p1+p2+…+pn  |
|
| 3. Закон Паскаля. Давление, производимое на жидкость или газ, передается во все стороны без изменения. |
Источник: https://www.eduspb.com/node/1742
Инфофиз — мой мир..
Как известно, многие вещества в природе могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
Учение о свойствах вещества в различных агрегатных состояниях основывается на представлениях об атомно-молекулярном строении материального мира. В основе молекулярно-кинетической теории строения вещества (МКТ) лежат три основных положения:
- все вещества состоят из мельчайших частиц (молекул, атомов, элементарных частиц), между которыми есть промежутки;
- частицы находятся в непрерывном тепловом движении;
- между частицами вещества существуют силы взаимодействия (притяжения и отталкивания); природа этих сил электромагнитная.
Значит, агрегатное состояние вещества зависит от взаимного расположения молекул, расстояния между ними, сил взаимодействия между ними и характера их движения.
Сильнее всего проявляется взаимодействие частиц вещества в твердом состоянии. Расстояние между молекулами примерно равно их собственным размерам. Это приводит к достаточно сильному взаимодействию, что практически лишает частицы возможности двигаться: они колеблются около некоторого положения равновесия. Они сохраняют форму и объем.
Свойства жидкостей также объясняются их строением. Частицы вещества в жидкостях взаимодействуют менее интенсивно, чем в твердых телах, и поэтому могут скачками менять свое местоположение – жидкости не сохраняют свою форму – они текучи. Жидкости сохраняют объем.
Газ представляет собой собрание молекул, беспорядочно движущихся по всем направлениям независимо друг от друга. Газы не имеют собственной формы, занимают весь предоставляемый им объем и легко сжимаются.
Существует еще одно состояние вещества – плазма. Плазма — частично или полностью ионизованный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы.
При достаточно сильном нагревании любое вещество испаряется, превращаясь в газ. Если увеличивать температуру и дальше, резко усилится процесс термической ионизации, т. е.
молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы.
Модель идеального газа. Связь между давлением и средней кинетической энергией.
Для выяснения закономерностей, которым подчиняется поведение вещества в газообразном состоянии, рассматривается идеализированная модель реальных газов – идеальный газ. Это такой газ, молекулы которого рассматриваются как материальные точки, не взаимодействующие друг с другом на расстоянии, но взаимодействующие друг с другом и со стенками сосуда при столкновениях.
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ. Не применима, когда газ сильно сжат, когда газ переходит в жидкое состояние. Реальные газы ведут себя как идеальный, когда среднее расстояние между молекулами во много раз больше их размеров, т.е. при достаточно больших разрежениях.
Свойства идеального газа:
- расстояние между молекулами много больше размеров молекул;
- молекулы газа очень малы и представляют собой упругие шары;
- силы притяжения стремятся к нулю;
- взаимодействия между молекулами газа происходят только при соударениях, а соударения считаются абсолютно упругими;
- молекулы этого газа двигаются беспорядочно;
- движение молекул по законам Ньютона.
Состояние некоторой массы газообразного вещества характеризуют зависимыми друг от друга физическими величинами, называемыми параметрами состояния. К ним относятся объем V, давление p и температура T.
Объем газа обозначается V. Объем газа всегда совпадает с объемом того сосуда, который он занимает. Единица объема в СИ м3.
- Давление – физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
- p = F/S Единица давления в СИ паскаль [Па]
- До настоящего времени употребляются внесистемные единицы давления:
- техническая атмосфера 1 ат = 9,81-104 Па;
- физическая атмосфера 1 атм = 1,013-105 Па;
миллиметры ртутного столба 1 мм рт. ст.= 133 Па;
1 атм = = 760 мм рт. ст. = 1013 гПа.
Как возникает давление газа? Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
Давление газа возникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Используя модель идеального газа, можно вычислить давление газа на стенку сосуда.
В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной.

Приборы, измеряющие давление, называют манометрами. Манометры фиксируют среднюю по времени силу давления, приходящуюся на единицу площади его чувствительного элемента (мембраны) или другого приемника давления.

Жидкостные манометры:
- открытый – для измерения небольших давлений выше атмосферного
- закрытый — для измерения небольших давлений ниже атмосферного, т.е. небольшого вакуума


Металлический манометр – для измерения больших давлений.

Основной его частью является изогнутая трубка А, открытый конец которой припаян к трубке В, через которую поступает газ, а закрытый – соединен со стрелкой. Газ поступает через кран и трубку В в трубку А и разгибает её. Свободный конец трубки, перемещаясь, приводит в движение передающий механизм и стрелку. Шкала градуирована в единицах давления.
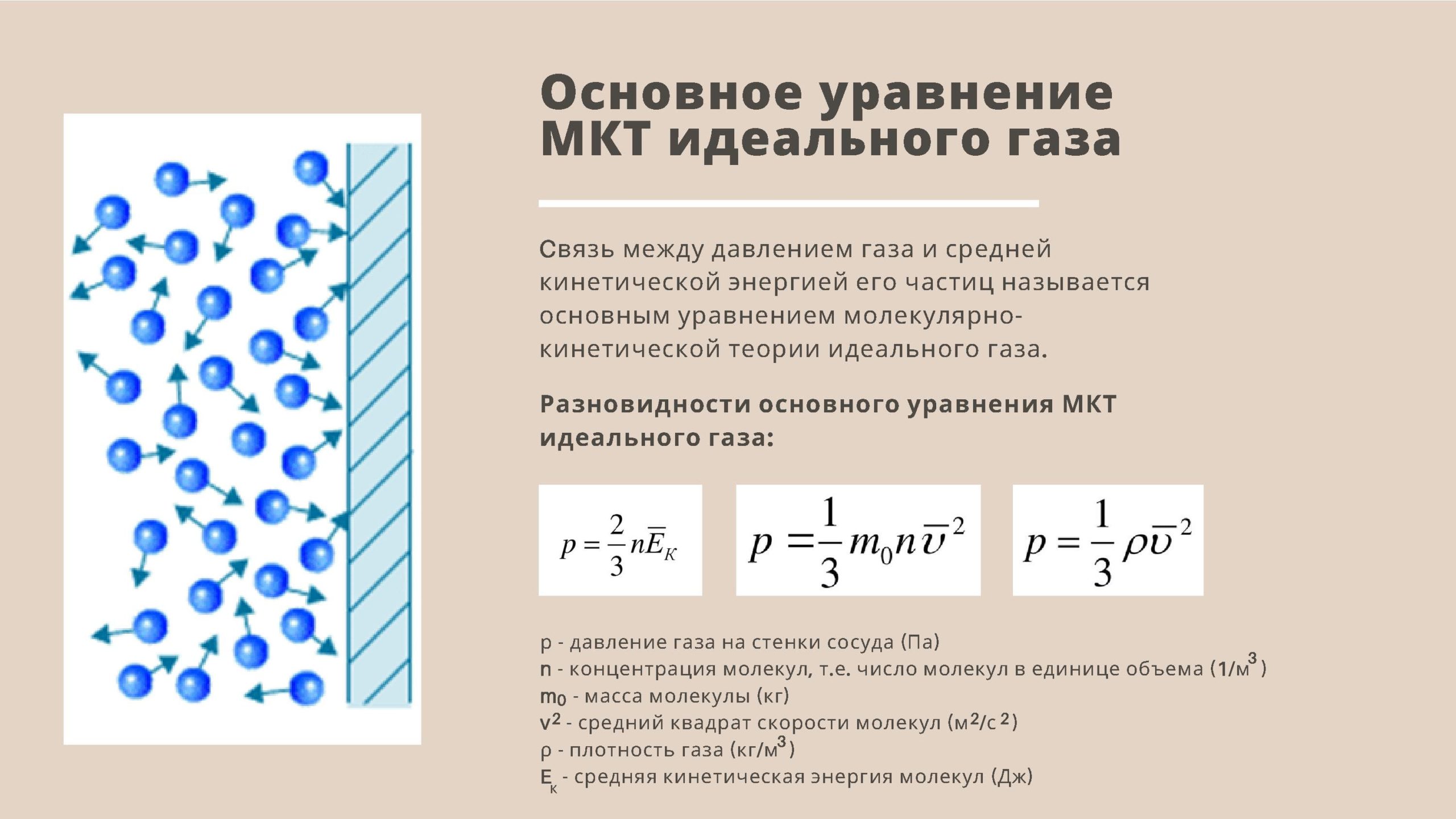

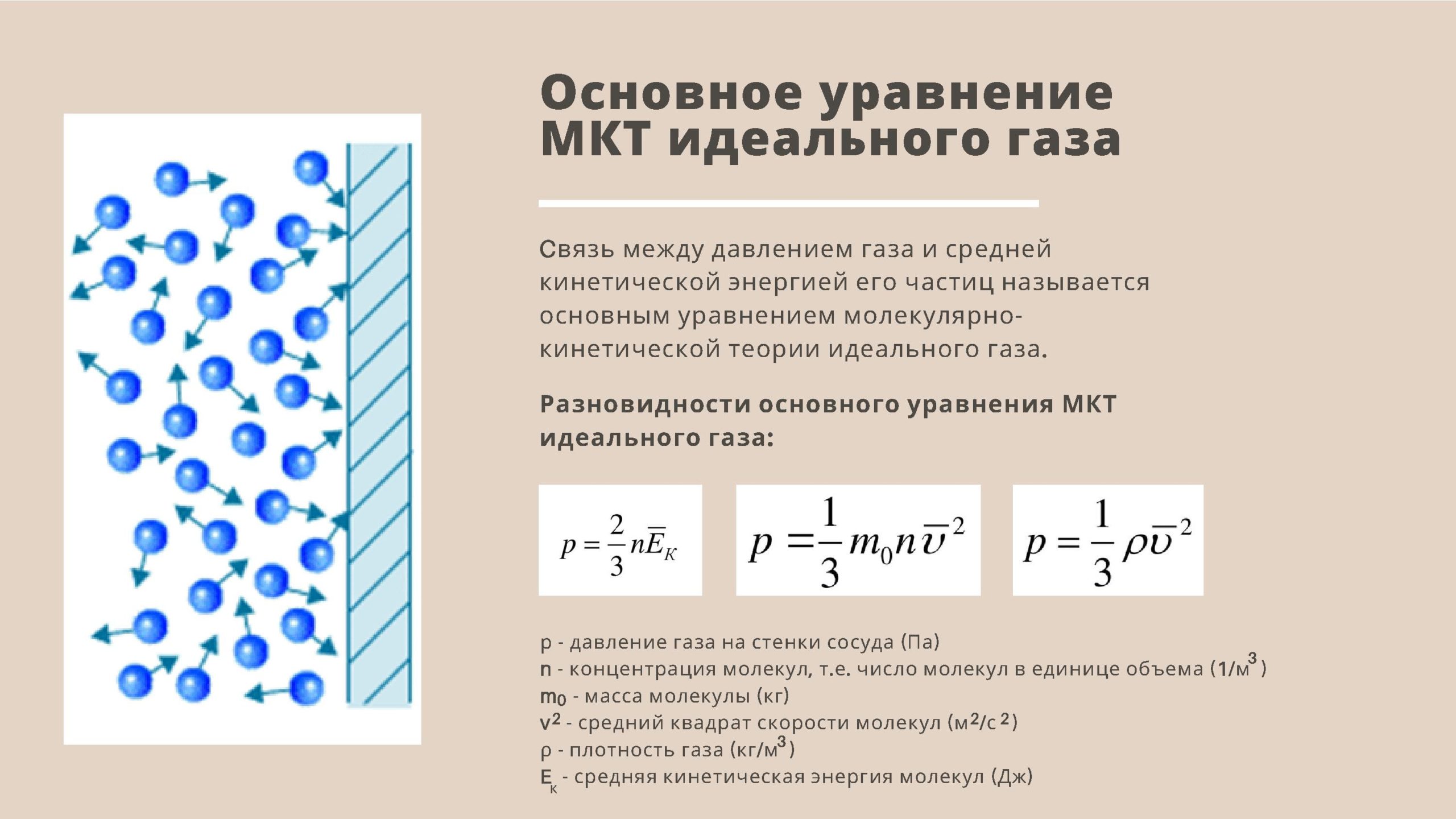
- Основное уравнение молекулярно-кинетической теории идеального газа.
- Основное уравнение МКТ: давление идеального газа пропорционально произведению массы молекулы, концентрации молекул и среднему квадрату скорости движения молекул
- p = 1/3·m0·n·v2
- m0 — масса одной молекулы газа;
- n = N/V – число молекул в единице объема, или концентрация молекул;
- v2 — средняя квадратичная скорость движения молекул.
- Так как средняя кинетическая энергия поступательного движения молекул E = m0*v2/2, то домножив основное уравнение МКТ на 2, получим p = 2/3· n·(m0· v2)/2 = 2/3·E·n
- p = 2/3·E·n
- Давление газа равно 2/3 от средней кинетической энергии поступательного движения молекул, которые содержатся в единичном объеме газа.
- Так как m0·n = m0·N/V = m/V = ρ, где ρ – плотность газа, то имеем p = 1/3· ρ· v2
- Объединенный газовый закон.
- Макроскопические величины, однозначно характеризующие состояние газа, называют термодинамическими параметрами газа.
- Важнейшими термодинамическими параметрами газа являются его объем V, давление р и температура Т.
- Всякое изменение состояния газа называется термодинамическим процессом.
- В любом термодинамическом процессе изменяются параметры газа, определяющие его состояние.
- Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом.
- Газовый закон, выражающий связь между всеми тремя параметрами газа называется объединенным газовым законом.
- p = nkT
Соотношение p = nkT связывающее давление газа с его температурой и концентрацией молекул, получено для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
- где n – концентрация молекул, N – общее число молекул, V – объем газа
- Тогда получим или
- Так как при постоянной массе газа N остается неизменным, то Nk – постоянное число, значит
- При постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном и часто его называют уравнением Клайперона.
- Уравнение Клайперона можно записать в другой форме.
- p = nkT,
- учитывая, что

- Здесь N – число молекул в сосуде, ν – количество вещества, NА – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:

- Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной (молярной) газовой постоянной и обозначается буквой R.
- Ее численное значение в СИ R = 8,31 Дж/моль·К
- Соотношение
![]()
называется уравнением состояния идеального газа.
В полученной нами форме оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.`
Для одного моля любого газа это соотношение принимает вид: pV=RT
Установим физический смысл молярной газовой постоянной. Предположим, что в некотором цилиндре под поршнем при температуре Е находится 1 моль газа, объем которого V. Если нагреть газ изобарно (при постоянном давлении) на 1 К, то поршень поднимется на высоту Δh, а обьем газа увеличится на ΔV.
- Запишем уравнение pV=RT для нагретого газа: p ( V + ΔV ) = R (T + 1)
- и вычтем из этого равенства уравнение pV=RT , соответствующее состоянию газа до нагревания. Получим pΔV = R
- ΔV = SΔh, где S – площадь основания цилиндра. Подставим в полученное уравнение:
- pSΔh = R
- pS = F – сила давления.
- Получим FΔh = R, а произведение силы на перемещение поршня FΔh = А – работа по перемещению поршня, совершаемая этой силой против внешних сил при расширении газа.
- Таким образом, R = A.
- Универсальная (молярная) газовая постоянная численно равна работе, которую совершает 1 моль газа при изобарном нагревании его на 1 К.
Источник: http://infofiz.ru/index.php/mirfiziki/lkf/124-lk18
Основные формулы термодинамики и молекулярной физики, которые вам пригодятся
Основные формулы термодинамики и молекулярной физики, которые вам пригодятся. Еще один отличный день для практических занятий по физике. Сегодня мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Ежедневная рассылка с полезной информацией для студентов всех направлений – на нашем телеграм-канале.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева

Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая постоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)

Массу, в свою очередь, можно вычислить, как произведение плотности и объема.

Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:

Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:

Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ

Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:

Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них.
Кстати! Для всех наших читателей сейчас действует скидка 10% на любой вид работы.
Изотермический процесс протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:

Изохорный процесс протекает при постоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.

Изобарный процесс идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.

Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
Внутренняя энергия одноатомного и двухатомного идеального газа
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
Вот мы и собрали основные формулы термодинамики, которые пригодятся в решении задач. Конечно, это не все все формулы из темы термодинамика, но их знание действительно может сослужить хорошую службу. А если возникнут вопросы – помните о студенческом сервисе, специалисты которого готовы в любой момент прийти на выручку.
Источник: https://Zaochnik-com.ru/blog/osnovnye-formuly-termodinamiki-i-molekulyarnoj-fiziki-kotorye-vam-prigodyatsya/
Идеальный газ. Уравнение идеального газа. Изопроцессы
Подробности Категория: Молекулярно-кинетическая теория Опубликовано 05.11.2014 07:28 Просмотров: 15461

Газ — одно из четырёх агрегатных состояний, в которых может находиться вещество.
Частицы, из которых состоит газ, очень подвижны. Они практически свободно и хаотично движутся, периодически сталкиваясь друг с другом подобно биллиардным шарам. Такое столкновение называют упругим столкновением. Во время столкновения они резко изменяют характер своего движения.
Так как в газообразных веществах расстояние между молекулами, атомами и ионами намного превышает их размеры, то между собой эти частицы взаимодействую очень слабо, и их потенциальная энергия взаимодействия очень мала по сравнению с кинетической.
Связи между молекулами в реальном газе сложные. Поэтому также довольно сложно описывать зависимость его температуры, давления, объёма от свойств самих молекул, их количества, скорости их движения. Но задача значительно упрощается, если вместо реального газа рассматривать его математическую модель — идеальный газ.
Предполагается, что в модели идеального газа между молекулами нет сил притяжения и отталкивания. Все они движутся независимо друг от друга. И к каждой из них можно применить законы классической механики Ньютона. А между собой они взаимодействуют только во время упругих столкновений. Время самого столкновения очень мало по сравнению со временем между столкновениями.
Классический идеальный газ

Попробуем представить молекулы идеального газа маленькими шариками, находящимися в огромном кубе на большом расстоянии друг от друга. Из-за этого расстояния они не могут друг с другом взаимодействовать. Следовательно, их потенциальная энергия равна нулю.
Но эти шарики двигаются с огромной скоростью. А значит, обладают кинетической энергией. Когда они сталкиваются друг с другом и со стенками куба, они ведут себя как мячики, то есть упруго отскакивают. При этом они меняют направление своего движения, но не меняют скорости.
Примерно так выглядит движение молекул в идеальном газе.
Газ можно считать идеальным, если в нём выполняются следующие допущения:
- Потенциальная энергия взаимодействия молекул идеального газа настолько мала, что ею пренебрегают по сравнению с кинетической энергией.
- Молекулы в идеальном газе также имеют настолько маленькие размеры, что их можно считать материальными точками. А это означает, что и их суммарный объём также ничтожно мал по сравнению с объёмом сосуда, в котором находится газ. И этим объёмом также пренебрегают.
- Среднее время между столкновениями молекул намного превышает время их взаимодействия при соударении. Поэтому временем взаимодействия пренебрегают также.
Газ всегда принимает форму сосуда, в котором находится. Движущиеся частицы сталкиваются друг с другом и со стенками сосуда. Во время удара каждая молекула действует на стенку с некоторой силой в течение очень короткого промежутка времени. Так возникает давление. Суммарное давление газа складывается из давлений всех молекул.
Уравнение состояния идеального газа

- Состояние идеального газа характеризуют три параметра: давление, объём и температура. Зависимость между ними описывается уравнением:

- где р — давление,
- VM — молярный объём,
- R — универсальная газовая постоянная,
- T — абсолютная температура (градусы Кельвина).
- Так как VM = V/n, где V — объём, n — количество вещества, а n = m/M, то

где m — масса газа, М — молярная масса. Это уравнение называется уравнением Менделеева-Клайперона.
- При постоянной массе уравнение приобретает вид:

- Это уравнение называют объединённым газовым законом.
- Используя закон Менделеева-Клайперона, можно определить один из параметров газа, если известны два других.
Изопроцессы
С помощью уравнения объединённого газового закона можно исследовать процессы, в которых масса газа и один из важнейших параметров — давление, температура или объём — остаются постоянными. В физике такие процессы называются изопроцессами.
Из объединённого газового закона вытекают другие важнейшие газовые законы: закон Бойля-Мариотта, закон Гей-Люссака, закон Шарля, или второй закон Гей-Люссака.
Изотермический процесс

- Процесс, в котором изменяются давление или объём, но температура остаётся постоянной, называется изотермическим процессом.
- При изотермическом процессе T = const, m = const.
Поведение газа в изотермическом процессе описывает закон Бойля-Мариотта. Этот закон открыли экспериментальным путём английский физик Роберт Бойль в 1662 г. и французский физик Эдм Мариотт в 1679 г. Причём сделали они это независимо друг от друга. Закон Бойля-Мариотта формулируется следующим образом: В идеальном газе при постоянной температуре произведение давления газа на его объём также постоянно.
Уравнение Бойля-Мариотта можно вывести из объединённого газового закона. Подставив в формулу Т = const,получаем
p·V = const
Это и есть закон Бойля-Мариотта. Из формулы видно, что давление газа при постоянной температуре обратно пропорционально его объёму. Чем выше давление, тем меньше объём, и наоборот.
Как объяснить это явление? Почему же при увеличении объёма газа его давление становится меньше?
Так как температура газа не меняется, то не меняется и частота ударов молекул о стенки сосуда. Если увеличивается объём, то концентрация молекул становится меньше.
Следовательно, на единицу площади придётся меньшее количество молекул, которые соударяются со стенками в единицу времени. Давление падает. При уменьшении объёма число соударений, наоборот, возрастает.
Соответственно растёт и давление.
Графически изотермический процесс отображают на плоскости кривой, которую называют изотермой. Она имеет форму гиперболы.

Каждому значению температуры соответствует своя изотерма. Чем выше температура, тем выше расположена соответсвующая ей изотерма.
Изобарный процесс
Процессы изменения температуры и объёма газа при постоянном давлении, называются изобарными. Для этого процесса m = const, P = const.
Зависимость объёма газа от его температуры при неизменяющемся давлении также была установлена экспериментальным путём французским химиком и физиком Жозефом Луи Гей-Люссаком, опубликовавшем его в 1802 г.
Поэтому её называют законом Гей-Люссака: «При постоянном давлении отношение объёма постоянной массы газа к его абсолютной температуре является постоянной величиной».
При Р = const уравнение объединённого газового закона превращается в уравнение Гей-Люссака.
Пример изобарного процесса — газ, находящийся внутри цилиндра, в котором перемещается поршень. При повышении температуры растёт частота ударов молекул о стенки. Увеличивается давление, и поршень приподнимается. В итоге увеличивается объём, занимаемый газом в цилиндре.
- Графически изобарный процесс отображается прямой линией, которая называется изобарой.
- Чем больше давление в газе, тем ниже расположена на графике соответствующая изобара.
Изохорный процесс
- Изохорным, или изохорическим, называют процесс изменения давления и температуры идеального газа при постоянном объёме.
- Для изохорного процесса m = const, V = const.
Представить такой процесс очень просто. Он происходит в сосуде фиксированного объёма.
Например, в цилиндре, поршень в котором не двигается, а жёстко закреплён.
Изохорный процесс описывается законом Шарля: «Для данной массы газа при постоянном объёме его давление пропорционально температуре». Французский изобретатель и учёный Жак Александр Сезар Шарль установил эту зависимость с помощью экспериментов в 1787 г. В 1802 г. её уточнил Гей-Люссак. Поэтому этот закон иногда называют вторым законом Гей-Люссака.
- При V = const из уравнения объединённого газового закона получаем уравнение закона Шарля, или второго закона Гей-Люссака.
- При постоянном объёме давление газа увеличивается, если увеличивается его температура.
- На графиках изохорный процесс отображается линией, которая называется изохорой.
- Чем больше объём занимаемый газом, тем ниже расположена изохора, соответствующая этому объёму.
В реальности ни один параметр газа невозможно поддерживать неизменным. Это возможно сделать лишь в лабораторных условиях.
Конечно, в природе идеального газа не существует. Но в реальных разреженных газах при очень низкой температуре и давлении не выше 200 атмосфер расстояние между молекулами намного превышает их размеры. Поэтому их свойства приближаются к свойствам идеального газа.
Источник: http://ency.info/materiya-i-dvigenie/molekulyarno-kineticheskaya-teoriya/354-idealnyj-gaz-ravnenie
Уравнение состояния идеального газа — Класс!ная физика
«Физика — 10 класс»
В этой главе речь пойдёт о следствиях, которые можно извлечь из понятия температуры и других макроскопических параметров. Основное уравнение молекулярнокинетической теории газов вплотную приблизило нас к установлению связей между этими параметрами.
Как можно рассчитать массу воздуха в кабинете физики? Какие параметры воздуха будут необходимы для определения этой массы?
Мы детально рассмотрели поведение идеального газа с точки зрения молекулярно-кинетической теории. Была определена зависимость давления газа от концентрации его молекул и температуры (см. формулу (9.17)).
На основе этой зависимости можно получить уравнение, связывающее все три макроскопических параметра р, V и Т, характеризующие состояние идеального газа данной массы.
Формулой (9.17) можно пользоваться только до давления порядка 10 атм.
Уравнение, связывающее три макроскопических параметра р, V и Т, называют уравнением состояния идеального газа.
Подставим в уравнение р = nkT выражение для концентрации молекул газа. Учитывая формулу (8.8), концентрацию газа можно записать так:
![]()
где NA — постоянная Авогадро, m — масса газа, М — его молярная масса. После подстановки формулы (10.1) в выражение (9.17) будем иметь
![]()
Произведение постоянной Больцмана k и постоянной Авогадро NA называют универсальной (молярной) газовой постоянной и обозначают буквой R:
R = kNA = 1,38 • 10-23 Дж/К • 6,02 • 1023 1/моль = 8,31 Дж/(моль • К). (10.3)
Подставляя в уравнение (10.2) вместо kNA универсальную газовую постоянную R, получаем уравнение состояния идеального газа произвольной массы
![]()

- Единственная величина в этом уравнении, зависящая от рода газа, — это его молярная масса.
- Из уравнения состояния вытекает связь между давлением, объёмом и температурой идеального газа, который может находиться в двух любых состояниях.
- Если индексом 1 обозначить параметры, относящиеся к первому состоянию, а индексом 2 — параметры, относящиеся ко второму состоянию, то согласно уравнению (10.4) для газа данной массы
![]()
Правые части этих уравнений одинаковы, следовательно, должны быть равны и их левые части:
![]()
Известно, что один моль любого газа при нормальных условиях (р0 = 1 атм = 1,013 • 105 Па, t = 0 °С или Т = 273 К) занимает объём 22,4 л. Для одного моля газа, согласно соотношению (10.5), запишем:
![]()
Мы получили значение универсальной газовой постоянной R.
Таким образом, для одного моля любого газа
Уравнение состояния в форме (10.4) было впервые получено великим русским учёным Д. И. Менделеевым. Его называют уравнением Менделеева—Клапейрона.
Уравнение состояния в форме (10.5) называется уравнением Клапейрона и представляет собой одну из форм записи уравнения состояния.
Б. Клапейрон в течение 10 лет работал в России профессором в институте путей сообщения. Вернувшись во Францию, участвовал в постройке многих железных дорог и составил множество проектов по постройке мостов и дорог.
- Его имя внесено в список величайших учёных Франции, помещённый на первом этаже Эйфелевой башни.
- Уравнение состояния не надо выводить каждый раз, его надо запомнить. Неплохо было бы помнить и значение универсальной газовой постоянной:
- R = 8,31 Дж/(моль • К).
До сих пор мы говорили о давлении идеального газа. Но в природе и в технике мы очень часто имеем дело со смесью нескольких газов, которые при определённых условиях можно считать идеальными.
Самый важный пример смеси газов — воздух, являющийся смесью азота, кислорода, аргона, углекислого газа и других газов. Чему же равно давление смеси газов?
- Для смеси газов справедлив закон Дальтона.
- Закон Дальтона
- Давление смеси химически невзаимодействующих газов равно сумме (ЦЩй их парциальных давлений
p = p1 + p2 + … + pi + … .
где рi — парциальное давление i-й компоненты смеси.
Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Назад в раздел «Физика — 10 класс, учебник Мякишев, Буховцев, Сотский»
Основные положения МКТ. Тепловые явления — Физика, учебник для 10 класса — Класс!ная физика
Почему тепловые явления изучаются в молекулярной физике — Основные положения молекулярно-кинетической теории. Размеры молекул — Примеры решения задач по теме «Основные положения МКТ» — Броуновское движение — Силы взаимодействия молекул. Строение газообразных, жидких и твёрдых тел — Идеальный газ в МКТ.
Среднее значение квадрата скорости молекул — Основное уравнение молекулярно-кинетической теории газов — Примеры решения задач по теме «Основное уравнение молекулярно-кинетической теории» — Температура и тепловое равновесие — Определение температуры. Энергия теплового движения молекул — Абсолютная температура.
Температура — мера средней кинетической энергии молекул — Измерение скоростей молекул газа — Примеры решения задач по теме «Энергия теплового движения молекул» — Уравнение состояния идеального газа — Примеры решения задач по теме «Уравнение состояния идеального газа» — Газовые законы — Примеры решения задач по теме «Газовые законы» — Примеры решения задач по теме «Определение параметров газа по графикам изопроцессов»
Источник: http://class-fizika.ru/10_a196.html
Давление газа.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).Изопроцессы
Давление газа возникает в результате столкновений молекул со стенками сосуда ( и на помещенное в газ тело ), в котором находится беспорядочно движущиеся молекулы газа. Чем чаше удары, тем они сильнее – тем выше давление.
Если масса и объем газа неизменны, то его давление в закрытом сосуде всецело зависит от температуры. Давление зависит и от скорости поступательно движущихся газовых молекул. Единица измерения давления — паскаль p(Па).
Измеряют давление газа манометром (жидкостным, металлическим и электрическим).
Идеальный газ – это модель реального газа. За идеальный газ принимают газ в сосуде, когда молекула, пролетая от стенки до стенки сосуда не испытывает столкновения с другими молекулами. Точнее, Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало ⇒ Eк >> Eр .
Основное уравнение МКТ связывает макроскопические параметры (давление p, объём V, температура T, масса m) газовой системы с микроскопическими параметрами (масса молекулы , средняя скорость их движения):
, где n— концентрация, 1/м3; m — масса молекулы, кг; — средняя квадратичная скорость молекул, м/с.
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, объёмом и абсолютной температурой идеального газа, характеризующее состояние данной системы газа.  — уравнение Менделеева — Клапейрона (для произвольной массы газа). R = 8,31 Дж/моль·К — универсальная газовая постоянная. pV = RT – (для 1 моля).
— уравнение Менделеева — Клапейрона (для произвольной массы газа). R = 8,31 Дж/моль·К — универсальная газовая постоянная. pV = RT – (для 1 моля).
Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества ν=const. Тогда:
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: — уравнение Клапейрона.
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры.
Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным.
Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака. Эти законы называют законами для изопроцессов:
- Изопроцессы – это процессы, которые совершаются при одинаковом параметре или Т-температуре, или V-объеме, или р-давлении.
 Изотермический процесс —
Изотермический процесс —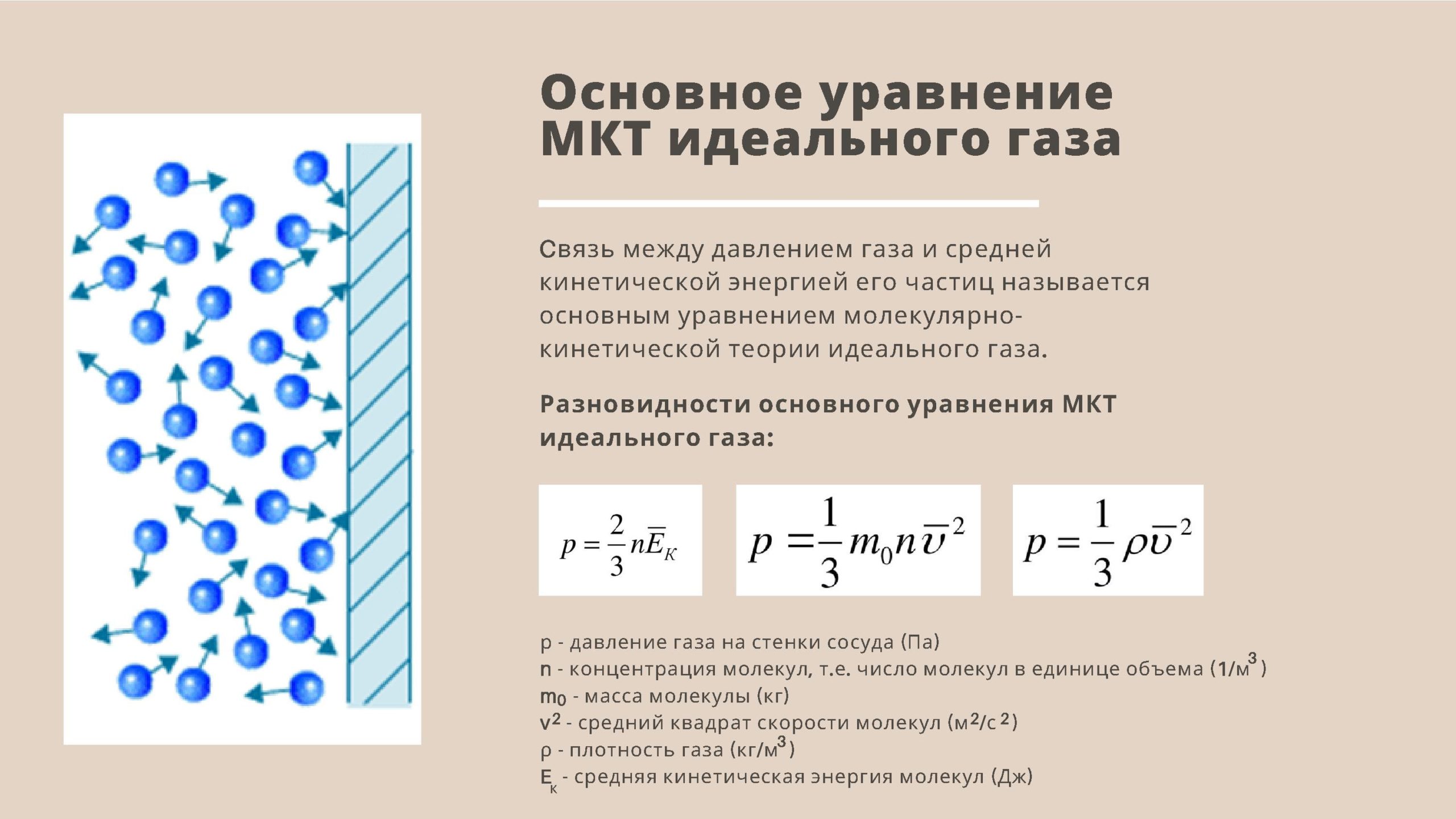 — закон Бойля — Мариотта (при постоянной температуре и данной массы газа произведение давления на объем есть величина постоянная)
— закон Бойля — Мариотта (при постоянной температуре и данной массы газа произведение давления на объем есть величина постоянная) Изобарный процесс —
Изобарный процесс — 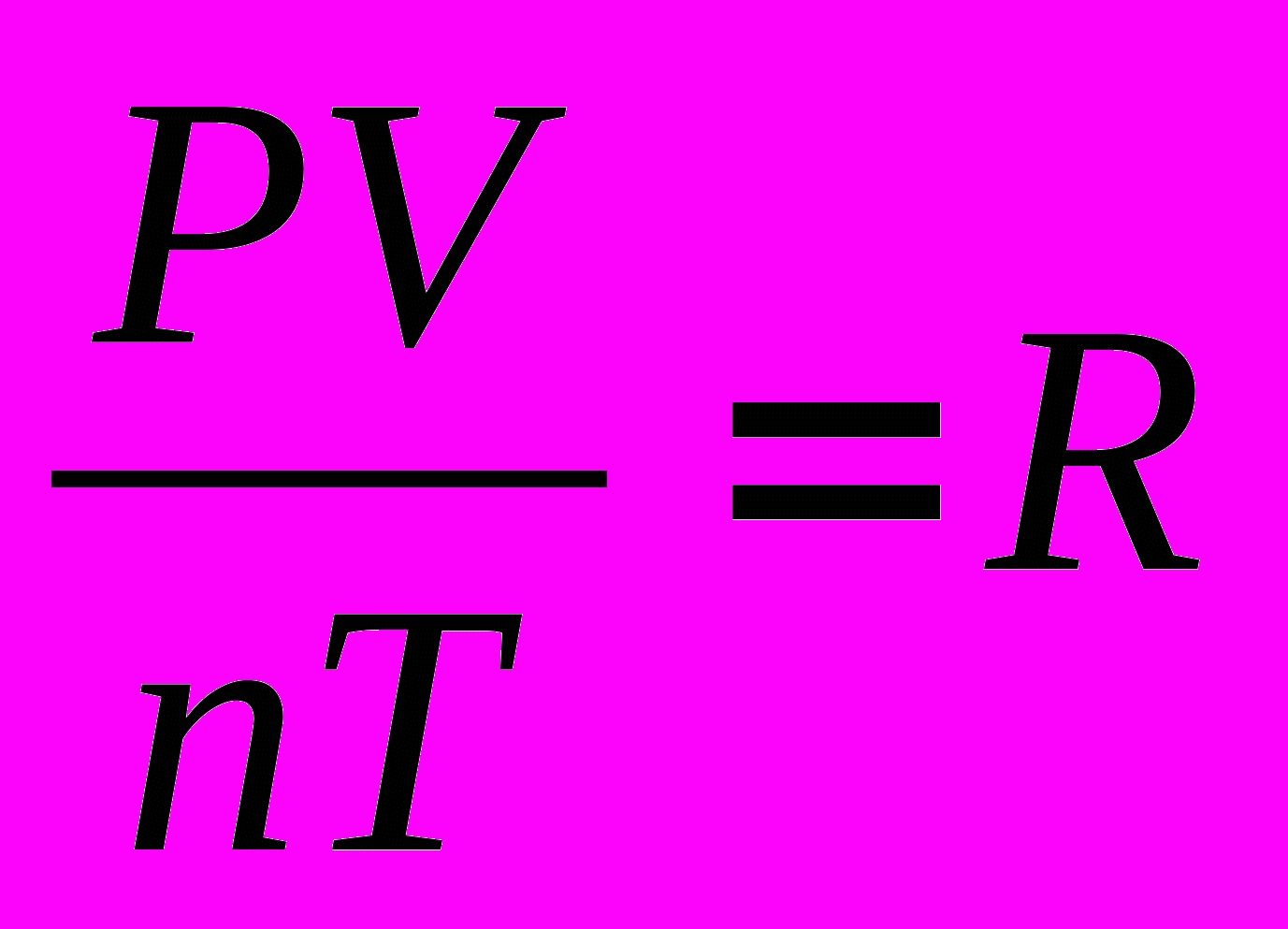 — закон Гей-Люссака (при постоянном давлении для данной массы газа отношение объема к температуре есть величина постоянная)
— закон Гей-Люссака (при постоянном давлении для данной массы газа отношение объема к температуре есть величина постоянная)- Изохорный п
 роцесс —
роцесс — — закон Шарля (при постоянном объеме для данной массы газа отношение давления к температуре есть величина постоянная.
— закон Шарля (при постоянном объеме для данной массы газа отношение давления к температуре есть величина постоянная.
Вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
Источник: http://kaplio.ru/davlenie-gaza-uravnenie-mendeleeva-klapejrona-izoprotsessy/
Молекулярная физика Основные формулы
- m — масса;
- μ — молярная масса вещества;
- N — число молекул;
- NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
- p — давление идеального газа;
- m — масса одной молекулы;
- n = N/V — концентрация молекул;
- V — объем газа;
- N — число молекул;
![]()
1.3 Средняя квадратичная скорость молекул идеального газа
![]()
- k = 1,38·10-23 Дж/К — постоянная Больцмана;
- R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
- T = t+273 — абсолютная температура;
- t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
- n — концентрация молекул;
- k — постоянная Больцмана;
- T — абсолютная температура.
1.6 Закон Бойля-Мариотта
![]()
p — давление;
V — объем газа.
1.7 Закон Шарля
![]()
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
![]()
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
- ν — количество вещества;
- R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
- T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
- при изменении объема на бесконечно малую величину dV
- p — давление газа.
- При изменении объема от V1 до V2
2.3 Первый закон термодинамики
- ΔQ — количество подведенной теплоты;
- ΔA — работа, совершаемая веществом;
- ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
- ΔQ — количество переданной системе теплоты на участке процесса;
- ΔT — изменение температуры на этом участке процесса.
Источник: http://fizikazadachi.ru/molekulyarnaya_fizika/
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением
Калькулятор ниже предназначен для решения задач на использование уравнения Клапейрона-Менделеева, или уравнение состояния идеального газа. Некоторая теория изложена под калькулятором, ну а чтобы было понятно, о чем идет речь — пара примеров задач:
Примеры задач на уравнение Менделеева-Клапейрона
-
В колбе объемом 2,6 литра находится кислород при давлении 2,3 атмосфер и температуре 26 градусов Цельсия .
Вопрос: сколько молей кислорода содержится в колбе? - Некоторое количество гелия при 78 градусах Цельсия и давлении 45,6 атмосфер занимает объем 16,5 литров.
Вопрос: Каков объем этого газа при нормальных условиях? (Напомню, что нормальными условиями для газов считается давление в 1 атмосферу и температура 0 градусов Цельсия)
В калькулятор вводим начальные условия, выбираем, что считать (число моль, новые объем, температуру или давление), заполняем при необходимости оставшиеся условия, и получаем результат.
Единицы измеренияатмосферы
паскали
миллиметры ртутного столба
Единицы измерениялитры
кубические метры
Единицы измеренияградусы Цельсия
градусы Кельвина
Ищемчисло молей
объем
давление
температуру
Единицы измеренияатмосферы
паскали
миллиметры ртутного столба
Единицы измерениялитры
кубические метры
Единицы измеренияградусы Цельсия
градусы Кельвина
Точность вычисления
Знаков после запятой: 2
Теперь немного формул.
Если используется СИ, то газовая постоянная равна 8,314 Дж/K·моль
И эту закономерность опытным путем установили еще до вывода уравнения. Это так называемые газовые законы — законы Бойля-Мариотта, Гей-Люссака, Шарля.
- Так, закон Бойля-Мариотта гласит (это два человека):
Для данной массы газа m при неизменной температуре Т произведение давления на объем есть величина постоянная. - Закон Гей-Люссака (а вот это один человек):
Для данной массы m при постоянном давлении P объем газа линейно зависит от температуры - Закон Шарля:
Для данной массы m при постоянном объеме V давление газа линейно зависит от температуры - Посмотрев на уравнение, нетрудно убедиться в справедливости этих законов.
Уравнение Менделеева-Клапейрона, также как и опытные законы Бойля-Мариотта, Гей-Люссака и Шарля справедливы для широкого интервала давлений, объемов и температур. То есть во многих случаях эти законы удобны для практического применения.
Однако не стоит забывать, что когда давления превышают атмосферное в 300-400 раз, или температуры очень высоки, наблюдаются отклонения от этих законов.
Собственно, идеальный газ потому и называют идеальным, что по определению это и есть газ, для которого не существует отклонений от этих законов.
Источник: https://planetcalc.ru/4265/




