- Учение о химической связи составляет основу всей теоретической химии.
- Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
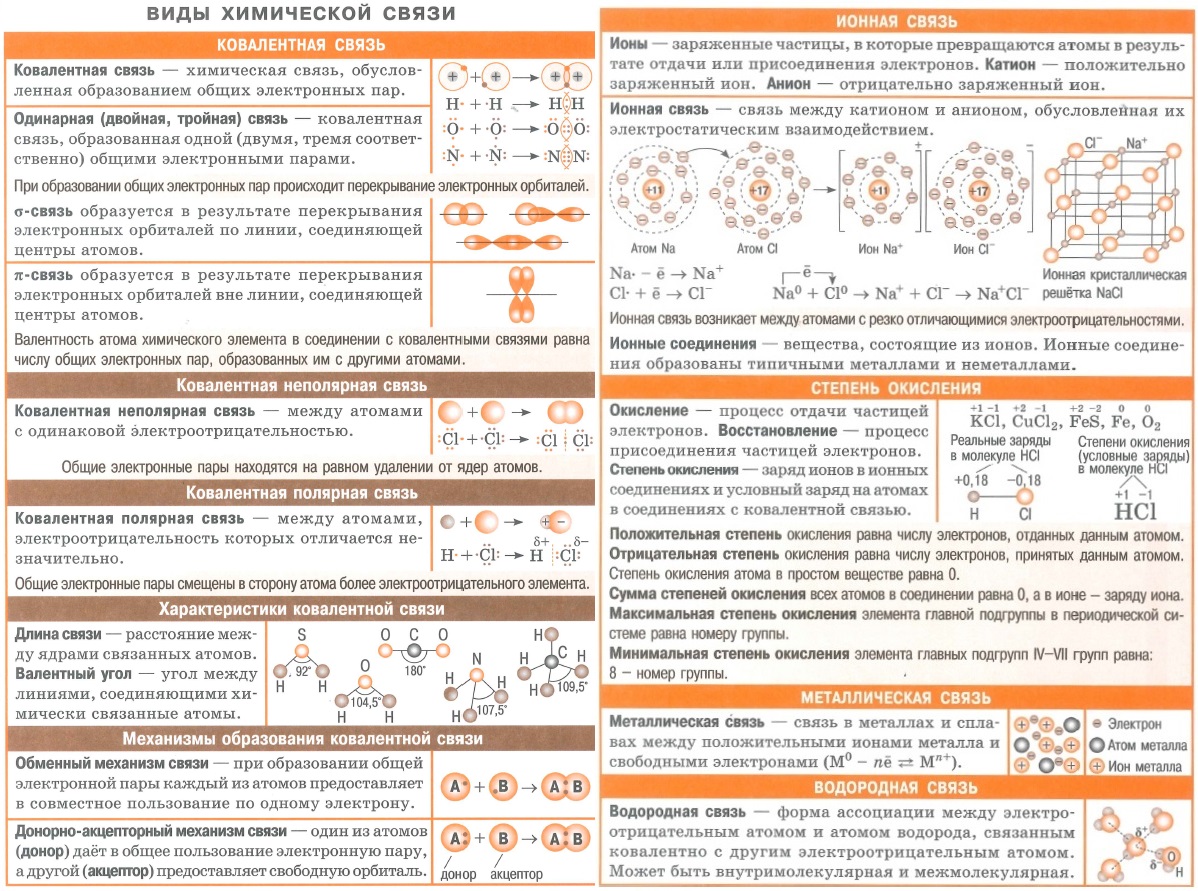
- Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
- Деление химических связей на типы носит условный характер, по скольку все они характеризуются определенным единством.
- Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
- Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
- В веществах часто отсутствуют предельные случаи химической связи (или чистые химические связи).
Например, фторид лития $LiF$ относят к ионным соединениям. Фактически же в нем связь на $80%$ ионная и на $20%$ ковалентная. Правильнее поэтому, очевидно, говорить о степени полярности (ионности) химической связи.
В ряду галогеноводородов $HF—HCl—HBr—HI—HАt$ степень полярности связи уменьшается, ибо уменьшается разность в значениях электроотрицательности атомов галогена и водорода, и в астатоводороде связь становится почти неполярной $(ЭО(Н) = 2.1; ЭО(At) = 2.2)$.
Различные типы связей могут содержаться в одних и тех же веществах, например:
- в основаниях: между атомами кислорода и водорода в гидроксогруппах связь полярная ковалентная, а между металлом и гидроксогруппой — ионная;
- в солях кислородсодержащих кислот: между атомом неметалла и кислородом кислотного остатка — ковалентная полярная, а между металлом и кислотным остатком — ионная;
- в солях аммония, метиламмония и т. д.: между атомами азота и водорода — ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком — ионная;
- в пероксидах металлов (например, $Na_2O_2$) связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом — ионная и т.д.
Различные типы связей могут переходить одна в другую:
— при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь переходит в ионную;
— при испарении металлов металлическая связь превращается в ковалентную неполярную и т.д.
Причиной единства всех типов и видов химических связей служит их одинаковая химическая природа — электронно-ядерное взаимодействие. Образование химической связи в любом случае представляет собой результат электронно-ядерного взаимодействия атомов, сопровождающегося выделением энергии.
Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи
Ковалентная химическая связь — это связь, возникающая между атомами за счет образования общих электронных пар.
Механизм образования такой связи может быть обменным и донорно-акцепторным.
I. Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов.
1) $H_2$ — водород:
![]()
Связь возникает благодаря образованию общей электронной пары $s$-электронами атомов водорода (перекрыванию $s$-орбиталей):

2) $HCl$ — хлороводород:
![]()
Связь возникает за счет образования общей электронной пары из $s-$ и $p-$электронов (перекрывания $s-p-$орбиталей):

3) $Cl_2$: в молекуле хлора ковалентная связь образуется за счет непарных $p-$электронов (перекрывание $p-p-$орбиталей):
4) $N_2$: в молекуле азота между атомами образуются три общие электронные пары:

II. Донорно-акцепторный механизм образования ковалентной связи рассмотрим на примере иона аммония $NH_4^+$.

Донор имеет электронную пару, акцептор — свободную орбиталь, которую эта пара может занять. В ионе аммония все четыре связи с атомами водорода ковалентные: три образовались благодаря созданию общих электронных пар атомом азота и атомами водорода по обменному механизму, одна — по донорно-акцепторному механизму.
Ковалентные связи можно классифицировать по способу перекрывания электронных орбиталей, а также по смещению их к одному из связанных атомов.
Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи, называются $σ$-связями (сигма-связями). Сигма-связь очень прочная.

$p-$Орбитали могут перекрываться в двух областях, образуя ковалентную связь за счет бокового перекрывания:

Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т.е. в двух областях, называются $π$-связями (пи-связями).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной. Электронные пары не смещены ни к одному из атомов, т.к. атомы имеют одинаковую ЭО — свойство оттягивать к себе валентные электроны от других атомов. Например:
![]()
т.е. посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов. Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной.
Длина и энергия ковалентной связи.
Характерные свойства ковалентной связи — ее длина и энергия. Длина связи — это расстояние между ядрами атомов. Химическая связь тем прочнее, чем меньше ее длина.
Однако мерой прочности связи является энергия связи, которая определяется количеством энергии, необходимой для разрыва связи. Обычно она измеряется в кДж/моль. Так, согласно опытным данным, длины связи молекул $H_2, Cl_2$ и $N_2$ соответственно составляют $0.
074, 0.198$ и $0.109$ нм, а энергии связи соответственно равны $436, 242$ и $946$ кДж/моль.
Ионы. Ионная связь
Представим себе, что «встречаются» два атома: атом металла I группы и атом неметалла VII группы. У атома металла на внешнем энергетическом уровне находится единственный электрон, а атому неметалла как раз не хватает именно одного электрона, чтобы его внешний уровень оказался завершенным.
Первый атом легко отдаст второму свой далекий от ядра и слабо связанный с ним электрон, а второй предоставит ему свободное место на своем внешнем электронном уровне.
Тогда атом, лишенный одного своего отрицательного заряда, станет положительно заряженной частицей, а второй превратится в отрицательно заряженную частицу благодаря полученному электрону. Такие частицы называются ионами.
- Химическая связь, возникающая между ионами, называется ионной.
- Рассмотрим образование этой связи на примере хорошо всем знакомого соединения хлорида натрия (поваренная соль):
- Процесс превращения атомов в ионы изображен на схеме:
- Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов.
- Рассмотрим алгоритм (последовательность) рассуждений при записи образования ионной связи, например между атомами кальция и хлора:
- Кальций — это элемент главной подгруппы II группы, металл. Его атому легче отдать два внешних электрона, чем принять недостающие шесть:${Ca^0}↙{атом}-2e↖{-}→Ca^{2+}↙{ион}$.
- Хлор — это элемент главной подгруппы VII группы, неметалл. Его атому легче принять один электрон, которого ему не хватает до завершения внешнего уровня, чем отдать семь электронов с внешнего уровня:${Cl^0}↙{атом}+1e↖{-}→Cl^{-}↙{ион}$.
- Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно $2 (2 · 1)$. Затем определим, сколько атомов кальция нужно взять, чтобы они отдали два электрона, т.е. надо взять один атом $Са$, и сколько атомов хлора надо взять, чтобы они могли принять два электрона, т.е. нужно взять два атома $Cl$.
- Схематично образование ионной связи между атомами кальция и хлора можно записать так:
Цифры, показывающие число атомов или молекул, называются коэффициентами, а цифры, показывающие число атомов или ионов в молекуле, называют индексами.
Металлическая связь
Ознакомимся с тем, как взаимодействуют между собой атомы элементов-металлов. Металлы обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Что удерживает атомы металла в едином объеме?
Атомы большинства металлов на внешнем уровне содержат небольшое число электронов — $1, 2, 3$. Эти электроны легко отрываются, и атомы при этом превращаются в положительные ионы.
Оторвавшиеся электроны перемещаются от одного иона к другому, связывая их в единое целое. Соединяясь с ионами, эти электроны образуют временно атомы, потом снова отрываются и соединяются уже с другим ионом и т.д.
Следовательно, в объеме металла атомы непрерывно превращаются в ионы и наоборот.
- Связь в металлах между ионами посредством обобществленных электронов называется металлической.
- На рисунке схематически изображено строение фрагмента металла натрия.
- При этом небольшое число обобществленных электронов связывает большое число ионов и атомов.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобществлении внеш них электронов.
Однако при ковалентной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы.
Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов — сплавов, находящихся в твердом и жидком состояниях.
Водородная связь
- Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары ($F, O, N$ и реже $S$ и $Cl$), другой молекулы (или ее части) называют водородной.
- Механизм образования водородной связи имеет частично электростатический, частично донорно- акцепторный характер.
- Примеры межмолекулярной водородной связи:
- При наличии такой связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород).
- Вещества с водородной связью имеют молекулярные кристаллические решетки.
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества.
Вещество при заданных условиях может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном.
Свойства вещества зависят также от характера химической связи между образующими его частицами — молекулами, атомами или ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, состоящие из молекул, называются молекулярными веществами.
Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы.
К молекулярным веществам относятся вещества с атомной структурой ($C, Si, Li, Na, K, Cu, Fe, W$), среди них есть металлы и неметаллы.
Рассмотрим физические свойства щелочных металлов. Относительно малая прочность связи между атомами обуславливает низкую механическую прочность: щелочные металлы мягкие, легко режутся ножом.
Большие размеры атомов приводят к малой плотности щелочных металлов: литий, натрий и калий даже легче воды. В группе щелочных металлов температуры кипения и плавления понижаются с увеличением порядкового номера элемента, т.к. размеры атомов увеличиваются, и ослабевают связи.
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли ($NaCl, K_2SO_4$), некоторые гидриды ($LiH$) и оксиды ($CaO, MgO, FeO$), основания ($NaOH, KOH$). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Вещество, как известно, может существовать в трех агрегатных состояниях: газообразном, жидком и твердом.
Твердые вещества: аморфные и кристаллические.
Рассмотрим, как влияют особенности химических связей на свойства твердых веществ. Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
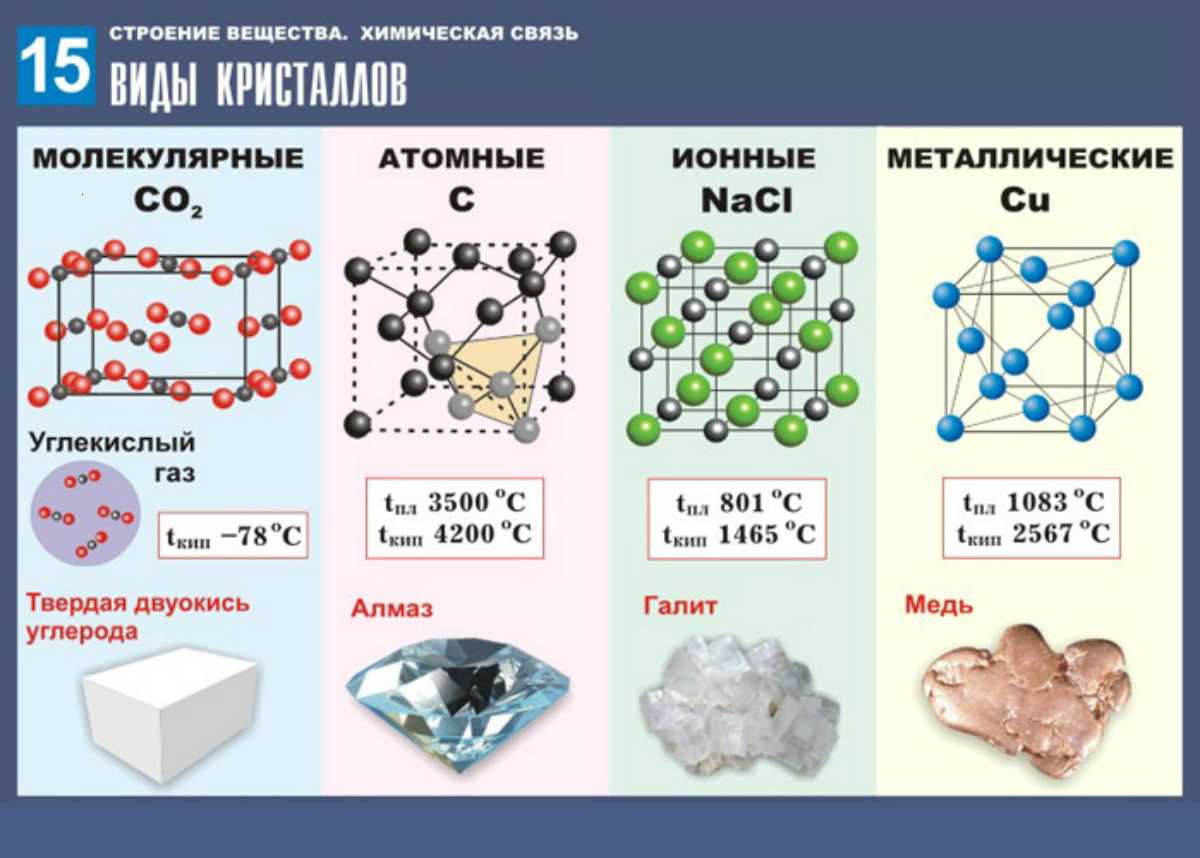
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы $Na^{+}, Cl^{–}$, так и сложные $SO_4^{2−}, ОН^–$.
Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия состоит из чередующихся положительных ионов $Na^+$ и отрицательных $Cl^–$, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы.
Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решетки.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
- Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она выше $3500°С$), они прочны и тверды, практически нерастворимы.
- Молекулярные кристаллические решетки.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными ($HCl, H_2O$), и неполярными ($N_2, O_2$).
Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи.
Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решетки.
Вещества с металлической связью имеют металлические кристаллические решетки.
В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»).
Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Источник: https://examer.ru/ege_po_himii/teoriya/xarakteristiki_ximicheskix_svyazej
Сайт преподавателя химии и биологии Коноваловой Лидии
Химическая связь. Строение вещества.
План
1. Химическая связь: ковалентная (неполярная, полярная; одинарная, двойная, тройная); ионная; металлическая; водородная; силы межмолекулярного взаимодействия.
2. Кристаллические решетки (молекулярная, ионная, атомная, металлическая).
Видео фильмы по данной теме здесь (можно посмотреть онлайн)
Разные вещества имеют различное строение. Из всех известных на сегодняшний день веществ только инертные газы существуют в виде свободных (изолированных) атомов, что обусловлено высокой устойчивостью их электронных структур. Все другие вещества (а их в настоящее время известно более 10 млн) состоят из связанных атомов.
Химическая связь – это силы взаимодействия между атомами или группами атомов, приводящие к образованию молекул, ионов, свободных радикалов, а также ионных, атомных и металлических кристаллических решеток. По своей природе химическая связь – это электростатические силы.
Главную роль при образовании химической связи между атомами играют их валентные электроны, т. е. электроны внешнего уровня, наименее прочно связанные с ядром.
При переходе от атомного состояния к молекулярному происходит выделение энергии, связанное с заполнением электронами свободных орбиталей внешнего электронного уровня до определенного устойчивого состояния.
Существуют различные виды химической связи.
Ковалентная связь – это химическая связь, осуществляемая за счет обобществления электронных пар. Теорию ковалентной связи предложил в 1916 г. американский ученый Гилберт Льюис. За счет ковалентной связи образуется большинство молекул, молекулярных ионов, свободных радикалов и атомных кристаллических решеток.
Ковалентная связь характеризуется длиной (расстояние между атомами), направленностью (определенная пространственная ориентация электронных облаков при образовании химической связи), насыщаемостью (способность атомов образовывать определенное число ковалентных связей), энергией (количество энергии, которое необходимо затратить для разрыва химической связи).
Ковалентная связь может быть неполярной и полярной. Неполярная ковалентная связь возникает между атомами с одинаковой электроотрицательностью (ЭО) (H2, O2, N2 и т. д.). В этом случае центр общей электронной плотности находится на одинаковом расстоянии от ядер обоих атомов. По числу общих электронных пар (т.е.
по кратности) различают одинарные, двойные и тройные ковалентные связи. Если между двумя атомами образуется только одна общая электронная пара, то такая ковалентная связь называется одинарной. Если между двумя атомами возникают две или три общие электронные пары, образуются кратные связи – двойные и тройные. Двойная связь состоит из одной -связи и одной -связи.
Тройная связь состоит из одной -связи и двух -связей.
Ковалентные связи, при образовании которых область перекрывания электронных облаков находится на линии, соединяющей ядра атомов, называются -связями. Ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов, называются —связями.
В образовании -связей могут участвовать s— и s-электроны (Н2), s— и p-электроны (HCl), р— и р-электроны (Cl2). Кроме того, -связи могут образовываться за счет перекрывания «чистых» и гибридных орбиталей. В образовании -связей могут участвовать только р— и d-электроны.
Ниже линиями показаны химические связи в молекулах водорода, кислорода и азота:
![]()
где пары точек (:) – спаренные электроны; «крестики» (х) – неспаренные электроны.
Если ковалентная связь образуется между атомами с различной ЭО, то центр общей электронной плотности смещен в сторону атома с большей ЭО. В этом случае имеет место ковалентная полярная связь.
Двухатомная молекула, связанная ковалентной полярной связью, представляет собой диполь – электронейтральную систему, в которой центры положительного и отрицательного зарядов находятся на определенном расстоянии друг от друга.
Графический вид химических связей в молекулах хлороводорода и воды следующий:
![]()
где стрелками показано смещение общей электронной плотности.
Полярная и неполярная ковалентные связи образованы по обменному механизму. Кроме того, существуют донорно-акцепторные ковалентные связи. Механизм образования их другой.
В этом случае один атом (донор) предоставляет неподеленную пару электронов, которая становится общей электронной парой между ним и другим атомом (акцептором).
Акцептор при образовании такой связи предоставляет свободную электронную орбиталь.
Донорно-акцепторный механизм образования ковалентной связи проиллюстрирован на примере образования иона аммония:

Таким образом, в ионе аммония все четыре связи являются ковалентными. Три из них образованы по обменному механизму, одна – по донорно-акцепторному. Все четыре связи равноценны, что обусловлено sp3-гибридизацией орбиталей атома азота. Валентность азота в ионе аммония равна IV, т.к.
он образует четыре связи. Следовательно, если элемент образует связи и по обменному, и по донорно-акцепторному механизмам, то его валентность больше числа неспаренных электронов и определяется общим числом орбиталей на внешнем электронном слое.
Для азота, в частности, высшая валентность равна четырем.
Ионная связь – химическая связь между ионами, осуществляемая за счет сил электростатического притяжения. Ионная связь образуется между атомами, имеющими большую разность ЭО (> 1,7); другими словами, это связь между типичными металлами и типичными неметаллами. Теория ионной связи была предложена в 1916 г.
немецким ученым Вальтером Косселем. Отдавая свои электроны, атомы металлов превращаются в положительно заряженные ионы – катионы; атомы неметаллов, принимая электроны, превращаются в отрицательно заряженные ионы – анионы.
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Ионная связь характеризуется ненаправленностью и ненасыщаемостью; для ионных соединений понятие «молекула» не имеет смысла.
В кристаллической решетке ионных соединений вокруг каждого иона располагается определенное число ионов с противоположным зарядом. Для соединений NaCl и FeS характерна кубическая кристаллическая решетка.
 |
Ниже показано образование ионной связи на примере хлорида натрия:

Ионная связь является крайним случаем полярной ковалентной связи. Резкой границы между ними не существует, тип связи между атомами определяется по разнице электроотрицательности элементов.
При образовании простых веществ – металлов – атомы достаточно легко отдают электроны внешнего электронного уровня. Таким образом, в кристаллах металлов часть их атомов находится в ионизированном состоянии.
В узлах кристаллической решетки находятся положительно заряженные ионы и атомы металлов, а между ними – электроны, которые могут свободно перемещаться по всей кристаллической решетке. Эти электроны становятся общими для всех атомов и ионов металла и называются «электронным газом».
Связь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов называетсяметаллической связью.
Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электропроводность, теплопроводность, ковкость, пластичность, металлический блеск. Свободные электроны могут переносить теплоту и электричество, поэтому они являются причиной главных физических свойств, отличающих металлы от неметаллов, – высокой электро- и теплопроводности.
Водородная связь возникает между молекулами, в состав которых входит водород и атомы с высокой ЭО (кислород, фтор, азот).
Ковалентные связи H–O, H–F, H–N являются сильно полярными, за счет чего на атоме водорода скапливается избыточный положительный заряд, а на противоположных полюсах – избыточный отрицательный заряд.
Между разноименно заряженными полюсами возникают силы электростатического притяжения – водородные связи. Водородные связи могут быть как межмолекулярными, так и внутримолекулярными.
Энергия водородной связи примерно в десять раз меньше энергии обычной ковалентной связи, но тем не менее водородные связи играют большую роль во многих физико-химических и биологических процессах. В частности, молекулы ДНК представляют собой двойные спирали, в которых две цепи нуклеотидов связаны между собой водородными связями.
Таблица
| Частицы в узлах решетки | Молекулы | Kатионы и анионы | Атомы | Kатионы и атомы металлов |
| Характер связи между частицами | Силы межмолекулярного взаимодействия (в том числе водородные связи) | Ионные связи | Kовалентные связи | Металлическая связь |
| Прочность связи | Слабая | Прочная | Очень прочная | Разной прочности |
| Отличительные физические свойства веществ | Легкоплавкие или возгоняющиеся, небольшой твердости, многие растворимы в воде | Тугоплавкие, твердые, многие растворимы в воде. Растворы и расплавы проводят электрический ток | Очень тугоплавкие, очень твердые, практически нерастворимы в воде | Высокая электро- и теплопроводность, металлический блеск |
| Примеры веществ | Йод, вода, сухой лед | Хлорид натрия, гидроксид калия, нитрат бария | Алмаз, кремний, бор, германий | Медь, калий, цинк, железо |
Межмолекулярные водородные связи между молекулами воды и фтороводорода можно изобразить (точками) следующим образом:

Вещества с водородной связью имеют молекулярные кристаллические решетки. Наличие водородной связи приводит к образованию ассоциатов молекул и, как следствие, к повышению температур плавления и кипения.
Кроме перечисленных основных видов химической связи существуют также универсальные силы взаимодействия между любыми молекулами, которые не приводят к разрыву или образованию новых химических связей. Эти взаимодействия называются вандерваальсовыми силами. Они обусловливают притяжение молекул данного вещества (или различных веществ) друг к другу в жидком и твердом агрегатном состояниях.
Различные виды химической связи обусловливают существование различных типов кристаллических решеток (табл.).
Вещества, состоящие из молекул, имеют молекулярное строение. К таким веществам относятся все газы, жидкости, а также твердые вещества с молекулярной кристаллической решеткой, например йод. Твердые вещества с атомной, ионной или металлической решеткой имеютнемолекулярное строение, в них нет молекул.
 |
Источник: https://lidijavk.ucoz.ru/load/studentam/lekcii/khimicheskaja_svjaz/44-1-0-587
Содержание:
Химическая связь, ее типы, свойства, наряду с химическими реакциями является одним из краеугольных камней интересной науки под названием химия. В этой статье мы разберем все аспекты химических связей, их значение в науке, приведем примеры и многое другое.
Что такое химическая связь
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Типы химических связей
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
- Ковалентная химическая связь (которая в свою очередь может быть полярной и неполярной)
- Ионная связь
- Водородная связь
- Химическая связь металлов
подобных людям.
Что касается ковалентной химической связи, то на нашем сайте ей посвящена отдельная статья, и более детально вы можете почитать по ссылке. Далее же мы разберем более детально все другие основные типы химических связей.
Ионная химическая связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.

Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
Водородная химическая связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.

На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил.
Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд.
А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Химическая связь металлов
Какая химическая связь характерна для металлов? У этих веществ есть свой собственный тип химической связи – атомы всех металлов расположены не абы как, а определенным образом, порядок их расположения называется кристаллической решеткой. Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.

Так выглядит металлическая химическая связь.
В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее.
Как определить вид химической связи
В зависимости от веществ, принимающих в ней участие, если метал и неметалл, то связь ионная, если два метала, то металлическая, если два неметалла то ковалентная.
Свойства химических связей
Чтобы провести сравнение разных химических реакций используются разные количественные характеристики, такие как:
- длина,
- энергия,
- полярность,
- порядок связей.
Разберем их подробнее.
Длина связи – равновесное расстояние между ядрами атомов, которые соединены химической связью. Обычно измеряется экспериментально.
Энергия химической связи определяет ее прочность. В данном случае под энергией подразумевается усилие, необходимое, для того, чтобы разорвать химическую связь и разъединить атомы.
Полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов. Способность атомов смещать к себе электронную плотность или говоря простым языком «тянуть одеяло на себя» в химии называют электроотрицательностью.
Порядок химической связи (другими словами кратность химической связи) – это число электронных пар, вступающих в химическую связь. Порядок может быть, как целым, так и дробным, чем он выше, тем большее число электронов осуществляют химическую связь и тем труднее ее разорвать.
Химическая связь, видео
И в завершение познавательное видео об разных видах химической связи.

При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Bonding: Definition, Types, Properties.
Источник: https://www.poznavayka.org/himiya/himicheskaya-svyaz-opredelenie-tipyi-svoystva/
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон.
Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов.
Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь.
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
- Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
- Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
- E(XY) < E(X) + E(Y)
- По этой причине при образовании химических связей между отдельными атомами выделятся энергия.
- Упрощенно можно считать, что в основе химических связей лежат электростатические силы, обусловленные взаимодействиями положительно заряженных ядер и отрицательно заряженных электронов.
- В образовании химических связей принимают участие электроны внешнего электронного слоя с наименьшей энергией связи с ядром, называемые валентными. Например, у бора таковыми являются электроны 2 энергетического уровня – 2 электрона на 2s-орбитали и 1 на 2p-орбитали:
При образовании химической связи каждый атом стремится получить электронную конфигурацию атомов благородных газов, т.е. чтобы в его внешнем электронном слое было 8 электронов (2 для элементов первого периода). Это явление получило название правила октета.
Достижение атомами электронной конфигурации благородного газа возможно, если изначально одиночные атомы сделают часть своих валентных электронов общими для других атомов. При этом образуются общие электронные пары.
В зависимости от степени обобществления электронов можно выделить ковалентную, ионную и металлическую связи.
Ковалентная связь
Ковалентная связь возникает чаще всего между атомами элементов неметаллов. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной.
Причина такого названия кроется в том, что атомы разных элементов имеют и различную способность притягивать к себе общую электронную пару. Очевидно, что это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд.
В свою очередь, на другом атоме формируется частичный положительный заряд. Например, в молекуле хлороводорода электронная пара смещена от атома водорода к атому хлора:
Примеры веществ с ковалентной полярной связью:
СCl4, H2S, CO2, NH3, SiO2 и т.д.
Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента. Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:
Вышеописанный механизм образования ковалентной связи, когда оба атома предоставляют электроны для образования общих электронных пар, называется обменным.
Также существует и донорно-акцепторный механизм.
При образовании ковалентной связи по донорно-акцепторному механизму общая электронная пара образуется за счет заполненной орбитали одного атома (с двумя электронами) и пустой орбитали другого атома.
Атом, предоставляющий неподеленную электронную пару, называют донором, а атом со свободной орбиталью – акцептором.
В качестве доноров электронных пар выступают атомы, имеющие спаренные электроны, например N, O, P, S.
Например, по донорно-акцепторному механизму происходит образование четвертой ковалентной связи N-H в катионе аммония NH4+:
Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
HI < HBr < HCl < HF
Также энергия связи зависит от ее кратности – чем больше кратность связи, тем больше ее энергия. Под кратностью связи понимается количество общих электронных пар между двумя атомами.
Ионная связь
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
Если в ковалентной-полярной связи общая электронная пара смещена частично к одному из пары атомов, то в ионной она практически полностью «отдана» одному из атомов.
Атом, отдавший электрон(ы), приобретает положительный заряд и становится катионом, а атом, забравший у него электроны, приобретает отрицательный заряд и становится анионом.
- Таким образом, ионная связь — это связь, образованная за счет электростатического притяжения катионов к анионам.
- Образование такого типа связи характерно при взаимодействии атомов типичных металлов и типичных неметаллов.
- Например, фторид калия. Катион калия получается в результате отрыва от нейтрального атома одного электрона, а ион фтора образуется при присоединении к атому фтора одного электрона:

- Между получившимися ионами возникает сила электростатического притяжения, в результате чего образуется ионное соединение.
- При образовании химической связи электроны от атома натрия перешли к атому хлора и образовались противоположно заряженные ионы, которые имеют завершенный внешний энергетический уровень.
- Установлено, что электроны от атома металла не отрываются полностью, а лишь смещаются в сторону атома хлора, как в ковалентной связи.
Большинство бинарных соединений, которые содержат атомы металлов, являются ионными. Например, оксиды, галогениды, сульфиды, нитриды.
Ионная связь возникает также между простыми катионами и простыми анионами (F−, Cl−, S2-), а также между простыми катионами и сложными анионами (NO3−, SO42-, PO43-, OH−). Поэтому к ионным соединениям относят соли и основания (Na2SO4, Cu(NO3)2, (NH4)2SO4), Ca(OH)2, NaOH).
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М0 — ne− = Mn+ , где М0 – нейтральный атом металла, а Mn+ катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом.
Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”.
Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный.
В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой.
Например водородная связь наблюдается для молекул воды:
Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/tipy-himicheskih-svjazej
Основные типы химической связи
.
Вам известно, что атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ.
При этом образуются различного типа химические связи: ионная, ковалентная (неполярная и полярная), металлическая и водородная.
Одно из наиболее существенных свойств атомов элементов, определяющих, какая связь образуется между ними – ионная или ковалентная, — это электроотрицательность, т.е. способность атомов в соединении притягивать к себе электроны.
Условную количественную оценку электроотрицательности дает шкала относительных электроотрицательностей.
В периодах наблюдается общая тенденция роста электроотрица-тельности элементов, а в группах – их падения. Элементы по электроот-рицательностям располагают в ряд, на основании которого можно сравнить электроотрицательности элементов, находящихся в разных периодах.
Тип химической связи зависит от того, насколько велика разность значений электроотрицательностей соединяющихся атомов элементов. Чем больше отличаются по электроотрицательности атомы элементов, образующих связь, тем химическая связь полярнее. Провести резкую границу между типами химических связей нельзя.
В большинстве соединений тип химической связи оказывается промежуточным; например, сильнополярная ковалентная химическая связь близка к ионной связи. В зависимости от того, к какому из предельных случаев ближе по своему характеру химическая связь, ее относят либо к ионной, либо к ковалентной полярной связи.
Ионная связь.
Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий(Na), калий(K), кальций (Ca), стронций(Sr), барий(Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия(NaOH) и сульфате натрия(Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи – ковалентные полярные).
Ковалентная неполярная связь.
При взаимодействии атомов с одинаковой электроотрица-тельностью образуются молекулы с ковалентной неполярной связью. Такая связь существует в молекулах следующих простых веществ: H2, F2, Cl2, O2, N2.
Химические связи в этих газах образованы посредством общих электронных пар, т.е.
при перекрывании соответствующих электронных облаков, обусловленном электронно-ядерным взаимодей-ствием, которые осуществляет при сближении атомов.
Составляя электронные формулы веществ, следует помнить, что каждая общая электронная пара – это условное изображение повышенной электронной плотности, возникающей в результате перекрывания соответствующих электронных облаков.
Ковалентная полярная связь.
При взаимодействии атомов, значение электроотрецательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому. Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония и амония.
Металлическая связь.
Связь, которая образуется в результате взаимодействия относите-льно свободных электронов с ионами металлов, называются металлической связью. Этот тип связи характерен для простых веществ- металлов.
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы.
Относительно свобо-дные электроны, оторвавшиеся от атома, перемещаются между положи-тельными ионами металлов. Между ними возникает металлическая связь, т. е.
Электроны как бы цементируют положительные ионы кристал-лической решетки металлов.
- Водородная связь.
- Связь, которая образуется между атомов водорода одной молекулы и атомом сильно электроотрицательного элемента (O, N, F) другой молекулы, называется водородной связью.
- Может возникнуть вопрос: почему именно водород образует такую специфическую химическую связь?
Это объясняется тем, что атомный радиус водорода очень мал. Кроме того, при смещении или полной отдаче своего единственного электрона водород приобретает сравнительно высокий положительный заряд, за счет которого водород одной молекулы взаимодействует с атомами электроотрицательных элементов, имеющих частичный отрицательный заряд, выходящий в состав других молекул (HF, H2O, NH3).
Рассмотрим некоторые примеры. Обычно мы изображаем состав воды химической формулой H2O. Однако это не совсем точно. Правильнее было бы состав воды обозначать формулой (H2O)n, где n = 2,3,4 и т. д. Это объясняется тем, что отдельные молекулы воды связаны между собой посредством водородных связей.
Водородную связь принято обозначать точками. Она гораздо более слабая, чем ионная или ковалентная связь, но более сильная, чем обычное межмолекулярное взаимодействие.
Наличие водородных связей объясняет увеличения объема воды при понижении температуры. Это связано с тем, что при понижении температуры происходит укрепление молекул и поэтому уменьшается плотность их «упаковки».
При изучении органической химии возникал и такой вопрос: почему температуры кипения спиртов гораздо выше, чем соответствующих углеводородов? Объясняется это тем, что между молекулами спиртов тоже образуются водородные связи.
Повышение температуры кипения спиртов происходит также всле-дствие укрупнения их молекул.
Водородная связь характерна и для многих других органических соединений (фенолов, карбоновых кислот и др.). Из курсов органической химии и общей биологии вам известно, что наличием водородной связи объясняется вторичная структура белков, строение двойной спирали ДНК, т. е. явление комплиментарности.
Источник: https://mirznanii.com/a/324341/osnovnye-tipy-khimicheskoy-svyazi




