Ключевое различие между Ацетиленом и Этиленом состоит в том, что Ацетилен имеет тройную связь между двумя атомами углерода, тогда как Этилен имеет двойную связь между двумя атомами углерода.
Содержание
- Обзор и основные отличия
- Что такое Ацетилен
- Что такое Этилен
- Сходство между Ацетиленом и Этиленом
- В чем разница между Ацетиленом и Этиленом
- Заключение
Что такое Ацетилен?
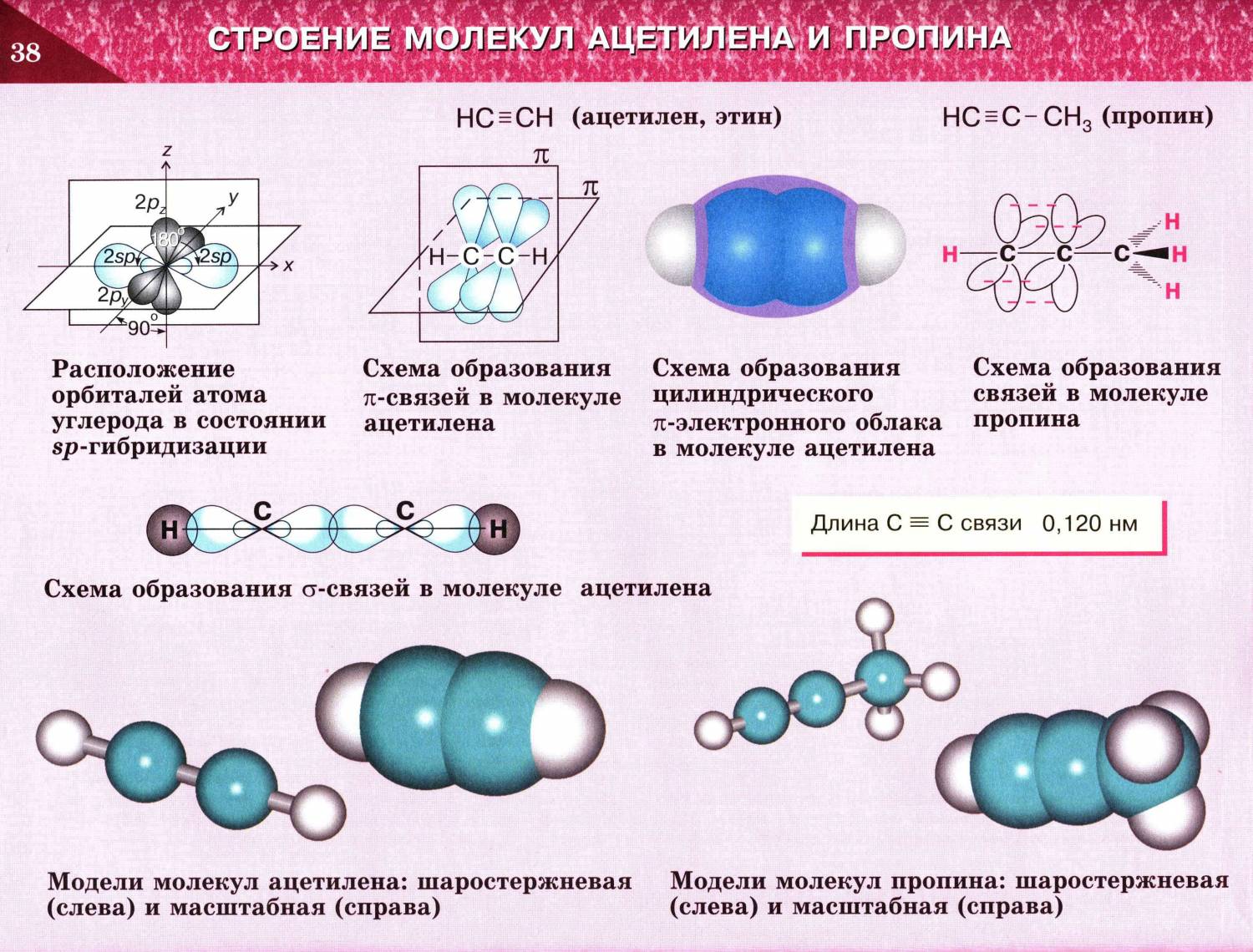
Ацетилен представляет собой органическое соединение, имеющее химическую формулу C2H2. Это самый простой алкин среди углеводородов. Алкин это соединение, имеющее тройную связь между двумя атомами углерода и соответственно ацетилен, также имеет тройную связь между двумя атомами углерода. Между этими атомами углерода есть две пи-связи и одна сигма-связь.
 Химическая и молекулярная структура Ацетилена
Химическая и молекулярная структура Ацетилена
Молекула ацетилена имеет линейную геометрию, так как один атом углерода может образовывать только четыре ковалентные связи (ацетилен имеет тройную связь и одинарную связь СН, что делает молекулу линейной). Следовательно, атомы углерода молекулы ацетилена sp-гибридизованы.
Химические свойства Ацетилена:
- Химическая формула: C2H2
- Молярная масса: 26,04 г/моль
- Физическое состояние при комнатной температуре: бесцветный газ
- Наличие запаха: без запаха
- Температура плавления: -80,8 °С
- Температура кипения: -84 °C
- Растворимость в воде: слаборастворимый
- Химическое название: Этин
Ацетилен не может существовать в виде жидкости при атмосферном давлении. Таким образом, он не имеет фактической температуры плавления. Приведенная выше температура плавления фактически является тройной точкой ацетилена. Поэтому твердая форма ацетилена подвергается сублимации, а не плавлению. при этом твердый ацетилен превращается в пар.
 Резка металла на кислородно-ацетиленовой смеси
Резка металла на кислородно-ацетиленовой смеси
Основное применение ацетилена в резке металла, а также в сварочных процессах. Кислородно-ацетиленовое пламя — это высокотемпературное пламя, которое нагревается до 3150 °С и используется для резки металла и его сварки.
Что такое Этилен?
Этилен является органическим соединением, имеющим химическую формулу C2H4. У этилена два атома углерода, связанные друг с другом через двойную связь (пи-связь и сигма-связь). Следовательно, молекула этилена имеет два sp2-гибридизованных атома углерода. Молекула этилена имеет плоскую структуру.
 Химическая и молекулярная структура Этилена
Химическая и молекулярная структура Этилена
Химические свойства Ацетилена Этилена:
- Химическая формула: C2H4
- Молярная масса: 28,05 г/моль
- Физическое состояние при комнатной температуре: бесцветный, легковоспламеняющийся газ
- Запах: сладковатый запах
- Температура плавления: −169,2 °C
- Точка кипения: −103,7 °C
- Растворимость в воде: слаборастворимый
- Химическое название: Этен
 Получение Этилена Лабораторным путём
Получение Этилена Лабораторным путём
Лабораторным путём Этилен получают при нагревании этилового спирта с серной кислотой (концентрированной)
Основным источником промышленного этилена является сырая нефть и природные газы. Существует три основных способа производства этилена:
- Паровой крекинг этана и пропана
- Паровой крекинг нафты
- Каталитический крекинг газойля
Этилен применяется в качестве мономеров для производства полимеров, таких как полиэтилен, который производится путем аддитивной полимеризации. Полиэтилен является распространенным упаковочным материалом.
Кроме того, в биологических системах этилен выполняет функции растительного гормона. Кроме того он стимулирует процесс созревания плодов, что имеет практическое применение в растениеводстве.
Например при перевозке бананов применяется их газация этиленон для дозревания в процессе доставки и тем самым потребителю они приходят зрелые и в свежем виде.
Каковы сходства между Ацетиленом и Этиленом?
- Оба являются простейшими углеводородами.
- Ацетилен и этилен состоят только из атомов углерода и атомов водорода.
- Оба бесцветные газы.
- И ацетилен, и этилен являются легковоспламеняющимися газами.
- Ацетилен и этилен имеют плоскую структуру.
В чем разница между ацетиленом и этиленом?
| Ацетилен против Этилена |
|
| Ацетилен представляет собой органическое соединение, имеющее химическую формулу C2H2 | Этилен является органическим соединением, имеющим химическую формулу C2H4 |
| Количество атомов водорода |
|
| Ацетилен имеет два атома водорода в одной молекуле ацетилена | Этилен имеет четыре атома водорода в одной молекуле этилена |
| Молярная масса |
|
| Молярная масса ацетилена составляет 26,04 г/моль | Молярная масса этилена составляет 28,05 г/моль |
| Химическая связь |
|
| Ацетилен имеет тройную связь между двумя атомами углерода и двумя одинарными связями СН | Этилен имеет двойную связь между двумя атомами углерода и четырьмя одинарными связями СН |
| Гибридизация атомов углерода |
|
| Атомы углерода молекулы ацетилена sp-гибридизованы | Атомы углерода молекулы этилена sp2-гибридизованы |
Разница между Уксусной кислотой и Этановой кислотой
Ацетилен и Этилен являются углеводородными соединениями с широким спектром применения. Разница между Ацетиленом и Этиленом заключается в том, что Ацетилен имеет тройную связь между двумя атомами углерода, тогда как Этилен имеет двойную связь между двумя атомами углерода.
Источник: https://raznisa.ru/raznica-mezhdu-acetilenom-i-etilenom/
Удельный вес ацетилена. Вес ацетилена в 1м3
Газ ацетилен был открыт еще в 1836 году ученым Эдмундом Дэви вследствие воздействия водой на карбид кальция. С 1855 по 1862 год французский химик Марселен Бертло смог получить ацетилен, или как раньше его назвали «двууглеродистый водород», сразу несколькими способами, он же присвоил ему название «ацетилен».
Яркое, теплого спектра и горячее пламя ацетилена стали использовать в светильниках вместо газовых фонарей не только в домашних условиях, но и для освещения улиц и даже в качестве фонаря для велосипедов и карет.
Свойства ацетилена
Ацетилен в советское время применяли на стройках путем смешивания карбида кальция с водой. Неприятный запах, сопровождавший процесс, был обусловлен примесями аммиака и сероводорода в техническом карбиде. Сам по себе чистый ацетилен:
- газ со слабым эфирным запахом,
- легким сладковатым привкусом,
- легче воздуха,
- слаботоксичный.
В таблице ниже представлены основные значения плотности, молярной массы и веса литра газа ацетилена при нормальных условиях.
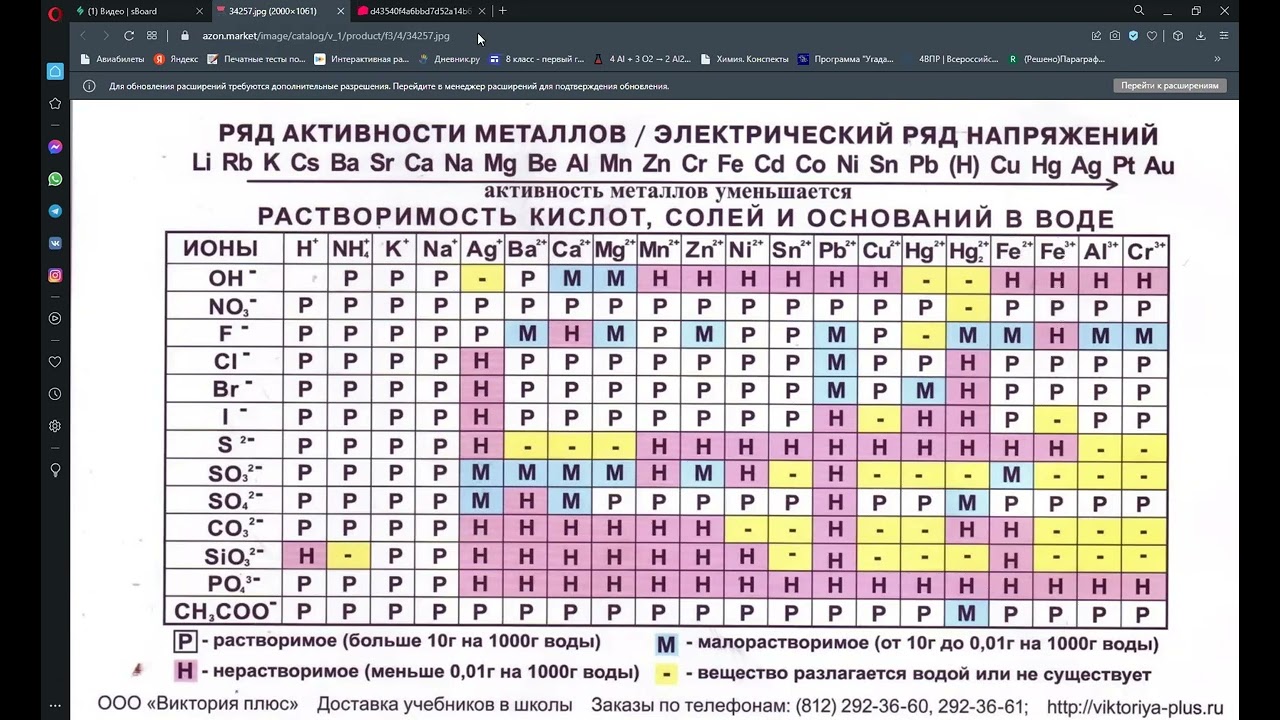
| Вещество | Химическая формула | Удельный вес (кг/м3) | Плотность (г/см3) | Вес 1 литра (г) | Молярная масса (г/моль) |
| Ацетилен | C2H2 | 1,09 | 1,00109 | 1,0896 | 26,038 |
При естественной влажности и нормальной температуре ацетилен бесцветный газ, а при понижении температуры до -85ºС кристаллизуется.
Особой характеристикой, которая в большой степени обусловила области использования ацетилена, стала его повышенная взрывоопасность во множестве сопутствующих условий, например, при резком повышении температуры (даже в результате трения) до 450 – 500ºС.
Смесь воздуха, а тем более кислорода с ацетиленом взрывоопасна в большом диапазоне концентраций (от 2,8% и до 81%). При 335ºС происходит самовоспламенение газа. Соединения ацетилена с медью или серебром взрываются от удара.
При повышении давления на большие объемы газа выше 2 кг/см2 газ становится взрывоопасным и может детонировать даже от искры статического электричества на одежде. Взрыв сопровождается увеличением давления до 10 раз и температуры до 3000 градусов Цельсия.
Для понижения взрывчатости ацетилен хранится и перевозится в баллонах с мелкокапиллярным пористым наполнителем либо растворяется в ацетоне, азоте, метане, пропане.
Применение
Ацетилен – один из наиболее значимых углеводородов, активно вступающих в химические связи. Применение газа довольно широко:
- горючее для газовой резки и сварки металла,
- производство растворителей путем присоединения хлора и хлорпроизводных веществ, отщепление хлороводорода дает высококачественный растворитель, применимый для химчистки тканей,
- производство поливинилхлорида (изоляция проводов, кожзамы, трубы и пр),
- выпуск других полимеров, необходимых для создания пластмассы, различных каучуковых смесей, синтетических волокон,
- создание взрывчатых веществ.
Источник: https://naruservice.com/articles/udelnyj-ves-atsetilena
Ацетилен
Взрывоопасность ацетилена
При использовании ацетилена необходимо учитывать его взрывоопасные свойства. Это единственный широко применяемый в промышленности газ, горение и взрыв которого возможны даже при отсутствии кислорода или других окислителей.
Температура самовоспламенения ацетилена зависит от давления (таблица 5).
Таблица 5 — Зависимость температуры самовоспламенения ацетилена от давления
| Абсолютное давление, кгс/см3 (МПа) | 2 (0,2) | 3 (0,3) | 4 (0,4) | 22 (2,2) |
| Температура самовоспламенения, °С (К) | 630 (903) | 530 (803) | 475 (748) | 350 (623) |
Повышение давления существенно уменьшает температуру самовоспламенения ацетилена.
Частицы других веществ, присутствующие в ацетилене, увеличивают поверхность его контакта и тем самым снижают температуру самовоспламенения при атмосферном давлении до следующих значений, °С (К): железная стружка – 520 (793); латунная стружка – 500–520 (773–793); карбид кальция – 500 (773); оксид алюминия – 490 (763); медная стружка – 460 (733); активированный уголь – 400 (673); гидрат оксида железа (ржавчина) – 280–300 (553–573); оксид железа – 280 (553);
оксид меди – 250 (523).
Если ацетилен медленно нагревать до температуры 700–800 °С (973–1073 К) при атмосферном давлении, то происходит его полимеризация, при которой молекулы уплотняются и образуют более сложные соединения: бензол C6H6, стирол C8H8, нафталин C10H8, толуол C7H8 и др. Полимеризация всегда сопровождается выделением теплоты и при быстром нагреве ацетилена может перейти в его самовоспламенение или взрывчатый распад.
Если при сжатии ацетилена в компрессоре до давления 29 кгс/м3 (2,9 МПа) те5мпература при завершении этого процесса не превышает 275 °С (548 К), то воспламенения не происходит, что позволяет наполнять баллоны ацетоном с целью его длительного хранения и транспортирования. С повышением давления температура, при которой начинается процесс полимеризации, понижается (рис.1).
| Рис.1. Области полимеризации (I) и взрывчатого распада (II) ацетилена |
При практическом использовании ацетилена допустим его нагрев до следующих значений температуры, °С (К): 300 (573) – при давлении 1 кгс/см2 (0,1 МПа); 150–180 (423–453) – при 2,5 кгс/см2 (0,25 МПа);
100 (373) – при более высоких давлениях.
Одним из важных показателей взрывоопасности горючих газов и паров является энергия зажигания. Чем меньше эта величина, тем взрывоопаснее данной вещество. Значения энергии зажигания ацетилена (при нормальных условиях): с воздухом – 19 кДж; в кислородом – 0,3 кДж.
Водяной пар служит флегматизатором для ацетилена, т.е. его присутствие существенно снижает способность ацетилена к самовоспламенению при наличии случайных источников теплоты и взрывчатому распаду. Согласно действующим нормам для ацетиленовых генераторов, в которых ацетилен всегда насыщен парами воды, предельное избыточное давление составляет 150 кПа, а абсолютное – 250 кПа.
При атмосферном давлении смесь ацетилена с воздухом взрывоопасна, если в ней содержатся 2,2 % ацетилена и более, смесь с кислородом – 2,8 % ацетилена и более (верхних пределов концентрации ацетилена для его смесей с воздухом и кислородом не существует, так как при достаточной энергии зажигания способен взрываться и чистый ацетилен).
Источник: http://bst29.ru/info/articles/detail.php?ELEMENT_ID=12
Ацетилен — это… Что такое Ацетилен?
Ацетиле́н (по ИЮПАК — этин) — ненасыщенный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C.
При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах.
Взрывоопасный. Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
Химические свойства
Ацетилено-кислородное пламя(температура «ядра» 2621 °C)
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³.
При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
- Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
- Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
- Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
- CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
- а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
- 2СН4 = С2Н2↑ +3Н2↑
Применение
Ацетиленовая лампа
Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком)[2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры.
Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
Источник: https://dic.academic.ru/dic.nsf/ruwiki/94478
C2H2
Ацетиле́н (по ИЮПАК — этин) — органическое соединение, непредельный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. При нормальных условиях — бесцветный, очень горючий газ.
В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция[3] (Ф. Вёлер, 1862 год)[4]:
C
a
C
2
+
2
H
2
O
→
C
a
(
O
H
)
2
+
C
2
H
2
↑
{displaystyle {mathsf {CaC_{2}+2H_{2}O
ightarrow Ca(OH)_{2}+C_{2}H_{2}uparrow }}}
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2
C
H
4
→
C
2
H
2
+
3
H
2
{displaystyle {mathsf {2CH_{4}
ightarrow C_{2}H_{2}+3H_{2}}}}
В промышленности[ | ]
В промышленности ацетилен получают гидролизом карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом и примесями других углеводородов. Карбидный метод позволяет получать очень чистый ацетилен, но требует высокого расхода электроэнергии.
Пиролиз существенно менее энергозатратен, т.к. для нагрева реактора используется сгорание того же рабочего газа во внешнем контуре, но в газовом потоке продуктов концентрация самого ацетилена низка. Выделение и концентрирование индивидуального ацетилена в таком случае представляет сложную задачу.
Экономические оценки обоих методов многочисленны, но противоречивы[5][:стр. 274].
Получение пиролизом[ | ]
Электрокрекинг[ | ]
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000—3000 °С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600 °С.
Расход электроэнергии составляет около 13000 кВт•ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса.
Выход ацетилена составляет 50 %.
Регенеративный пиролиз[ | ]
Иное название — Вульф-процесс. Сначала разогревают насадку печи путём сжигания метана при 1350—1400 °С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным, как считалось на стадии проектирования.
Окислительный пиролиз[ | ]
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз[ | ]
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы[ | ]
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод[ | ]
Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция (негашёную известь) и кокс в электропечах при 2500—3000 °С:
C
a
O
+
3
C
→
C
a
C
2
+
C
O
↑
{displaystyle {mathsf {CaO+3C
ightarrow CaC_{2}+COuparrow }}}
Негашёную известь получают из карбоната кальция:
C
a
C
O
3
→
C
a
O
+
C
O
2
↑
{displaystyle {mathsf {CaCO_{3}
ightarrow CaO+CO_{2}uparrow }}}
Далее карбид кальция обрабатывают водой:
C
a
C
2
+
2
H
2
O
→
C
2
H
2
+
C
a
(
O
H
)
2
{displaystyle {mathsf {CaC_{2}+2H_{2}O
ightarrow C_{2}H_{2}+Ca(OH)_{2}}}}
Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Физические свойства[ | ]
Рис.1. Пи-связи в молекуле ацетилена
При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом. Технический ацетилен хранится в баллонах с пористым наполнителем, пропитанным ацетоном (т.к. чистый ацетилен при сжатии взрывается), и может содержать другие примеси, которые придают ему резкий запах[6]. Малорастворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C[7]. Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм[8].
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа[4] при комнатной температуре.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном[9].
Ацетилен обнаружен на Уране и Нептуне.
Химические свойства[ | ]
Ацетилено-кислородное пламя (температура «ядра» 2621 °C)
- Для ацетилена (этина) характерны реакции присоединения:
HC
≡
CH
+
Cl
2
⟶
ClCH
=
CHCl
{displaystyle {ce {HC#CH + Cl_2 -> ClCH=CHCl}}}
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³ (50,4 МДж/кг). При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в ~500 °C. В присутствии катализаторов, например, трикарбонил(трифенилфосфин)никеля, температуру реакции циклизации можно снизить до 60—70 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так, ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
- Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
- Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
- Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
- Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов — эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
История[ | ]
Открыт в 1836 году Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 год).
Применение[ | ]
Ацетилен используют:
- для газовой сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях (вместе с аммиаком)[10]
Безопасность[ | ]
Поскольку ацетилен нерастворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3—80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает незначительным токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м³ согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест».
Источник: https://ru-wiki.ru/wiki/C2H2




