Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ?
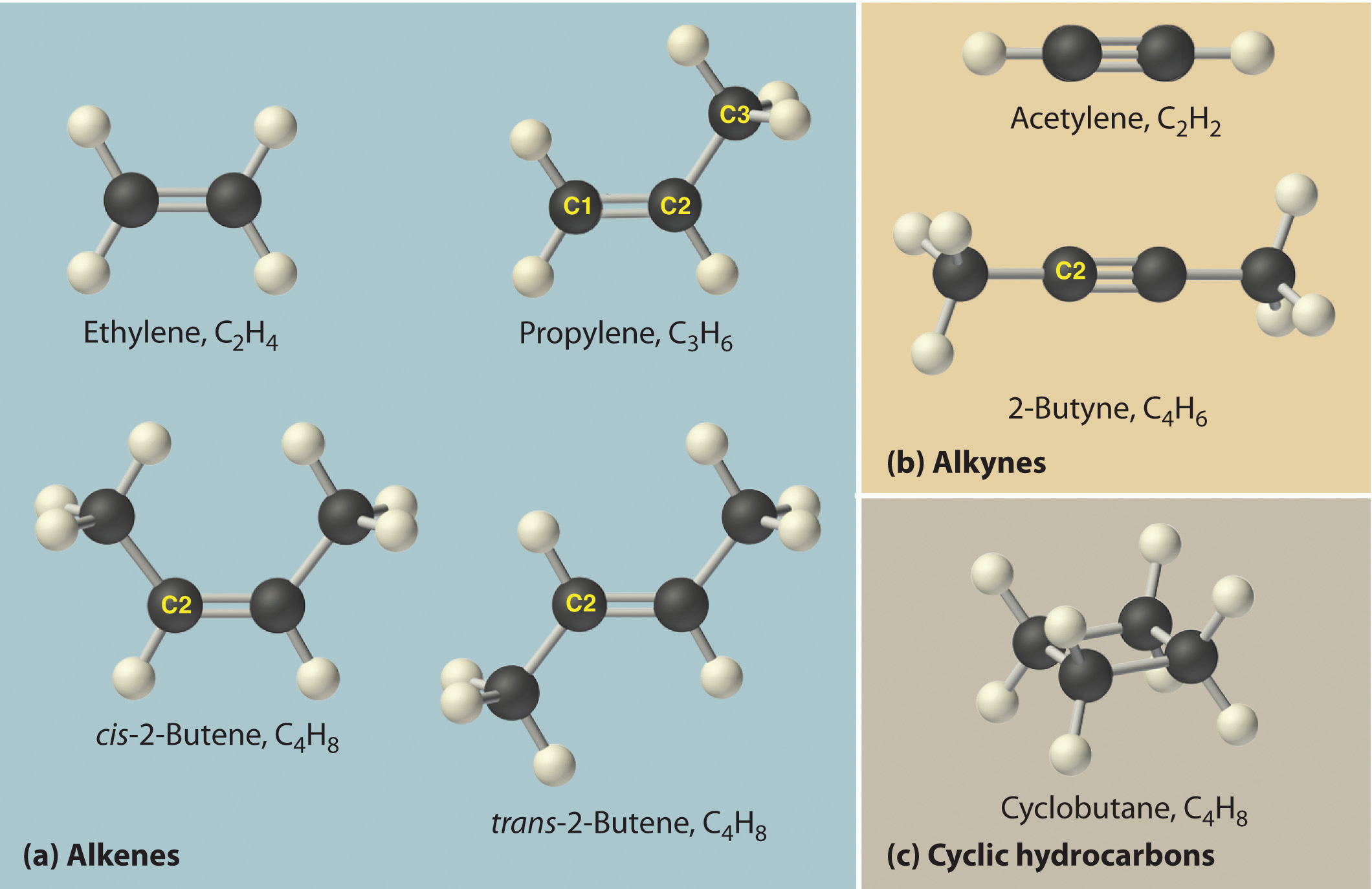
В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда — CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos — соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp3
- Валентный угол (между химическими связями) составляет 109°28'

Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- В ходе крекинга нефти получается один алкан и один алкен.
- C8H18 → C4H8 + C4H10
- C12H26 → C6H12 + C6H14
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан. 
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия. Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3 CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
- С3H8 + O2 → CO2 + H2O
- В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
- CH4 + O2 → CH3-OH (метанол)
- Пиролиз
- CH4 → (t > 1000°С) C + H2
- CH4 → (t = 1500-1600°С) CH≡CH + H2↑
- CH4 → (t = 1200°С, кат., P) CH2=CH2 + H2↑
- C2H6 → (t = 1200°С, кат., P) CH2=CH2 + 2H2↑
- Изомеризация
- Крекинг
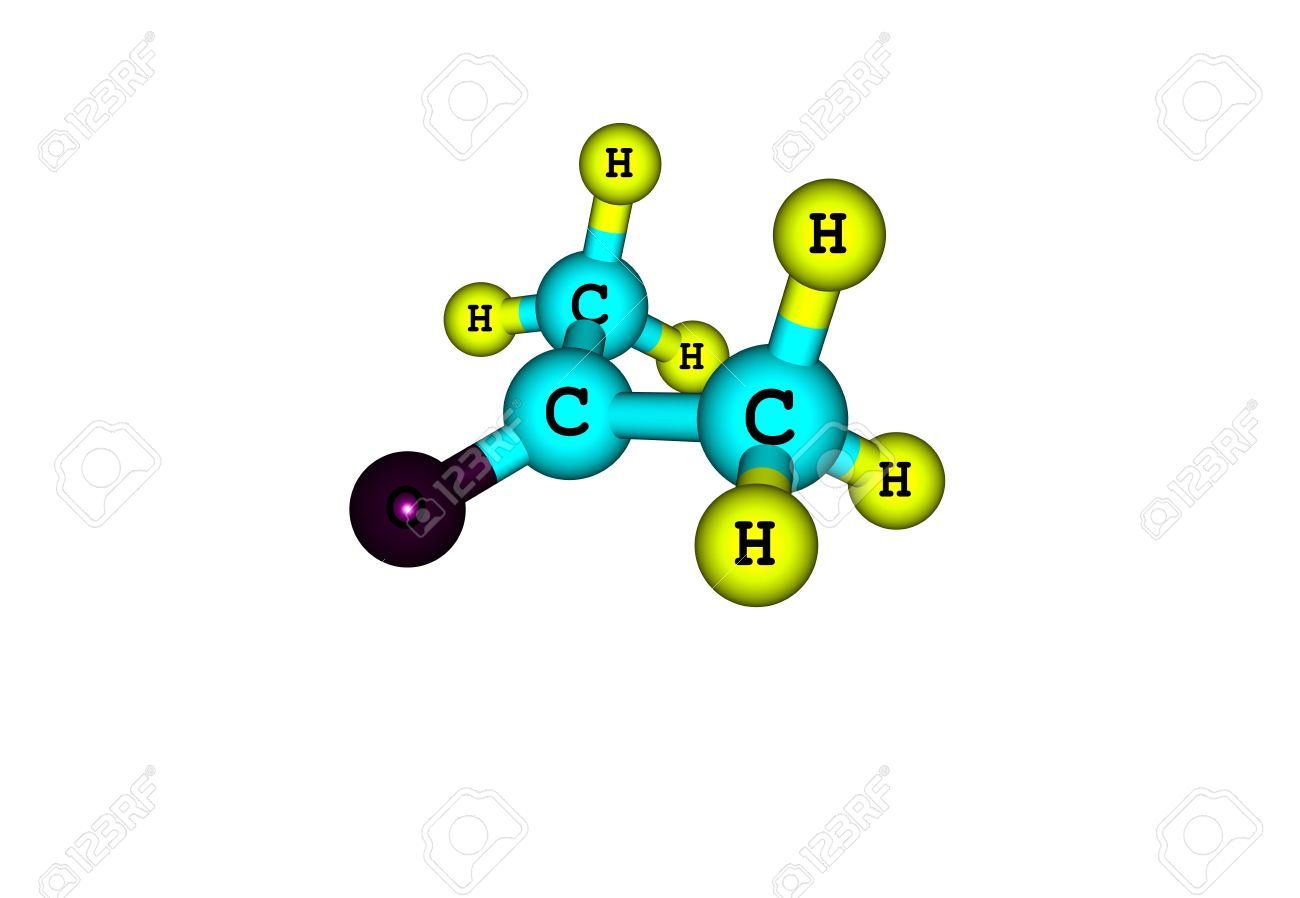
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее — у вторичного и значительно труднее — у первичного. Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму. CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.
Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения — в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
Источник: https://studarium.ru/article/181
Алканы: гомологический ряд, номенклатура и изомерия
Алканы относятся к насыщенным углеводородам, то есть к органическим соединениям, в составе которых содержаться только одинарные С – С связи.
Наиболее часто в природе встречается метан. Он представляет собой бесцветный газ, который легче воздуха, не имеет запаха. Метан образуется в природных условиях при разложении без доступа воздуха остатков растительных и животных организмов.
Метан ещё называют болотным газом из-за того, что в небольшом количестве он выделяется в заболоченных местах. Больше всего метана в природном газе, там его содержание достигает 95 %.
Метан вместе с этаном, пропаном и бутаном содержится в попутных нефтяных газах и в угольных пластах.
Высшие алканы входят в состав пчелиного воска, восковых покрытий листьев, плодов и семян растений, они встречаются также в виде озокерита.
Все насыщенные углеводороды образуют ряд, в котором любой член ряда отличается на одну или несколько групп – СН2 –, которая называется гомологической разностью. Сам ряд углеводородов называется гомологическим рядом, а члены гомологического ряда – гомологами.
Первые представить этого ряда – метан, второй – этан, третий член ряда – пропан, а четвёртый – бутан. Состав гомологического ряда алканов можно выразить общей формулой CnH2n+2. Буква n показывает число атомов углерода, которые содержатся в молекуле конкретного углеводорода.
Например, в молекуле гептана содержится 7 атомов углерода, значит его молекулярная формула С7Н16.
Рассмотрим электронное и пространственное строение алканов. Например, молекулярная формула метана СН4. Связи между атомом углерода и водорода являются равноценными и называются σ-связями. В электронной формуле метана валентные связывающие электроны показаны в виде точек. Каждая химическая связь изображается чёрточкой при записи структурной формулы.

Установлено, что молекула метана имеет тетраэдрическое строение. В центре тетраэдра – атом углерода, а атомы водорода находятся в вершинах тетраэдра. Такое расположение связей обусловлено взаимным отталкиванием электронных облаков связей С – Н.

Пространственное строение других алканов аналогичное. Например, у пропана такое же тетраэдрическое строение, углы между связями 109028´, поэтому атомы углерода находятся не по прямой линии, а зигзагообразно.
Особенностью одинарной связи между атомами углерода является возможность свободного вращения атомов вокруг этой связи, поэтому углеродная цепь алканов может принимать различную форму.
Длина этой углерод-углеродной связи С – С в молекуле алканов равна 0,154 нм.

Алканы могут иметь неразветвлённое и разветвлённое строение.
Названия алканов по Международной номенклатуре образуются добавлением суффинка – ан к греческим названиям чисел, которые показывают число атомов углерода в составе молекулы.
Первые четыре представителя гомологического ряда алканов имеют тривиальные названия: с одним атомом углерода – метан, двумя – этан, тремя – пропан и четырьмя – бутан.
Радикалы, или алкильные группы имеют названия такие же, как названия алканов, только суффикс –ан заменяется на суффикс –ил. Например, радикал – СН3 называется метил, с двумя атомами углерода – этил, с тремя – пропил или изопропил и так далее.
Для того, чтобы назвать алкан нужно выбрать самую длинную цепь, нумерацию начинают с того конца, где ближе заместители. Затем называют заместители в алфавитном порядке.
Назовём следующий углеводород.

Определяем слева или справа начинать отсчёт. Заместители ближе с правой стороны, поэтому отсчёт начинаем справа налево. От третьего атома углерода отходят два одинаковых заместителя. Поэтому название этого углеводорода будет 3,3-диметилгексан.
Приведём ещё один более сложный пример названия алкана.

Первое, что нужно сделать – это найти главную цепь, то есть цепь, имеющую самое большое число атомов углерода. Предположим, начнём отсчёт слева. Главная цепь содержит 10 атомов углерода. Теперь попробуем пронумеровать справа. Главная цепь и в этом случае содержит 10 атомов углерода.
Выбираем за главную цепь ту, которая содержит большее число разветвлений. Обозначим заместители. Их всего 5. У нас есть заместители, которые называются метил, этил и пропил. Слева заместители отходят от третьего атома углерода, справа – от второго. Приоритет отдаётся тому направлению, где ближе первое разветвление.
Значит, нумерацию начинаем справа. Согласно правилам современной номенклатуры, названия радикалам нужно давать в том порядке, в каком они находятся по алфавиту. Получается, что первым мы будим называть метил, потом, пропил, в последнюю очередь – этил.
Так как метил не один, а их три, то название углеводорода будет следующим: 2,6,8-триметил, далее у пятого атома углерода радикал пропил, поэтому 5-пропил, 8-этилдекан.
![]()
Для алканов, как и для других органических соединений, характерно явление изомерии, то есть явление существования различных соединений, имеющих один и тот же качественный и количественный состав, но разное строение.
Для насыщенных углеводородов – алканов изомерия начинается с бутана. Например, у бутана и изобутана одна и та же молекулярная формула – С4Н10, но разное химическое строение.
Так, в бутане с неразветвлённой цепью атомов центральный атом связан с двумя атомами углерода, а в изобутане, где разветвлённая цепь атомов, центральный атом связан с тремя атомами углерода. Поэтому бутан и изобутан являются изомерами.
Кроме того, что у этих веществ различное строение, они ещё имеют и различные свойства.

Различают изомерию структурную и пространственную. Одним из видов структурной изомерии является изомерия углеродного скелета. Так, у пентана есть 3 изомера. Это нормальный пентан, который имеет неразветвлённую цепь атомов углерода, 2-метилбутан, или изопентан, а также 2,2-диметилпропан, или неопентан.

Если посмотреть гомологический ряд алканов, то можно увидеть, что первые четыре члена этого ряда являются газами и имеют температуру кипения ниже комнатной. Алканы с С5 – С15 – жидкости, а алканы, которые имеют 16 и более атомов углерода – твёрдые вещества. С увеличение относительной молекулярной массы температуры плавления и кипения увеличиваются. Алканы практически не растворимы в воде.
Таким образом, общая формула алканов CnH2n+2. Длина С – С связи равна 0,154 нм. Для метана и его гомологов характерно тетраэдрическое строение. Основу названия алканов определяет самая длинная цепь атомов углерода, начиная с того конца, где ближе находится заместитель. Для алканов характерна изомерия углеродного скелета.
Источник: https://videouroki.net/video/09-alkany-gomologicheskij-ryad-nomenklatura-i-izomeriya.html
Строение и физические свойства алканов
Алканы (парафины) – ациклические насыщенные углеводороды, состав которых выражается общей формулой CnH2n+2 (n – число атомов углерода). Рассмотрим химическое и пространственное строение алканов.
Атомы углерода в алканах связаны посредством одинарных связей. Значения электроотрицательностей атомов углерода и водорода равны 2,5 и 2,1 соответственно, т.е.
близки, поэтому С-С связи в алканах ковалентные неполярные, а С-Н связи – слабополярные.
В алканах одна s-орбиталь и три р-орбитали атомов углерода гибридизованы и находятся в состоянии sp3— гибридизации. Подробнее о гибридизации атомных орбиталей описано в разделе Химическая связь и строение молекул.
Четыре sp3-гибридные орбитали атома углерода направлены к вершинам тетраэдра, с углом между ними около 109°28′, и длиной связи С–С равной 1,54 Å – именно в этом случае отталкивание между электронами и энергия системы минимальны.
При перекрывании этих орбиталей друг с другом, и с s-орбиталями атомов водорода образуются σ-связи С–С и С–Н.

- В молекуле метана гибридизованные орбитали атома углерода перекрываются со сферическими орбиталями атомов водорода.

- Важно помнить, что в процессе гибридизации происходит только изменение формы орбиталей одного и того же атома, в то время как перекрывание орбиталей двух разных атомов приводит к возникновению химической связи между ними.
- Образование С-С – связей в молекулах алканов происходит за счет перекрывания гибридных орбиталей двух атомов углерода:

Физические свойства
При комнатной температуре алканы от С1 до С4 являются газами, от С5 до С16-жидкостями, а более высокие алканы — твердые и воскоподобные.
Температура кипения нормальных алканов увеличиваются с ростом углеводородной цепи, однако по мере роста числа атомов углерода в цепи темп ее увеличения замедляется. Кривая температуры плавления не имеет такой же плавной зависимости. Между нечетными и четными алканами наблюдается только небольшое нелинейное повышение температуры плавления, что представлено на рисунке ниже.

Физические свойства разветвленных алканов отличны от свойств н-алканов с таким же числом атомов углерода в цепи. Так, чем больше разветвлений в цепи, тем ниже их температуры кипения и плавления.
Циклоалканы С2-С3 – газы, высшие – жидкости или твердые вещества. Теппературы кипения циклоалканов примерно на 20 К выше, чем температуры кипения соответствующих н-алканов.
Растворимость
Растворимость алканов в воде ничтожна, однако в органических растворителях они хорошо растворяются.
Существует 2 эмпирических правила, которые связывают температуры плавления (или кипения) вещества с его растворимостью.
- Для веществ одинаковой химической природы, лучшую растворимость имеют вещества с более низкой температурой плавления, по сравнению с веществами с более высокой температурой плавления. Это объясняется тем, что силы взаимодействия внутри кристаллической решетки, которые должны преодалеваться при растворении более слабые у веществ с низкой температурой плавления.
- Для веществ одинаковой химической природы, лучшую растворимость имеют вещества с более низкой температурой кипения, по сравнению с веществами с более высокой температурой плавления.
Все растворители можно разделить на:
- Растворители с сильными (например, вода) межмолекулярными. Здесь действуют такие межмолекулярные силы как силы Ван-дер-Ваальса, дипольное притяжение, водородные связи, связывающие отдельные молекулы воды.
- Растворители с слабыми (бензол, гексан) межмолекулярными взаимодействиями. Здесь действуют в основном силы Ван-дер-Ваальса.
Чтобы вещество растворилось в воде необходимо чтобы энергия, выделяющаяся при растворении была достаточной для преодаления как сил сцепления между молекулами растворяемого вещества, так и сильных сил сцепления между молекулами воды. Силы сцепления в бензоле или гексане могут быть легко преодалены, в независимости от энергии, необходимой для разделения самих частиц растворенного вещества.
Значимым параметром при растворении вещества является температура. В основном (хотя и не всегда) увеличение температуры ведет к увеличению растворимости.
Углеводороды и в частности алканы, в которых силы сцепления слабы, будут растворяться в растворителях, межмолекулярные силы сцепления в которых также слабы (неполярные растворители).
В этом влучае, первоначально существующие силы заменяются на равноценные и значительных изменений энергии не происходит. В силу отсутствия сильно электроотрицательных атомов в молекулах углеводородов, они не способны к прочному сцеплению с молекулами воды.
Разрыв межмолекулярных связей молекулы воды энергетически невыгоден и углеводороды в ней нерастворимы.
В растворителях меньшей полярности и с меньшей склонностью к образованию водородных связей углеводороды способны более или менее растворяться.
Также следует помнить, что водородная связь в воде, чем в других ассоциированных растворителях, так что растворимость углеводородов в них будет выше по сравнению с растворимостью в воде.
Кроме этого, с увеличением углеводородного остатка растворителя, его химическая природа приближается к природе растворенного вещества и тенденция к растворимости увеличивается. Например, при комнатной температуре гексан не растворяется в метаноле, но растворяется в этаноле.
Номенклатура и изомерия алканов описаны в разделе Номенклатура и изомерия органических соединений
Источник: http://zadachi-po-khimii.ru/organic-chemistry/stroenie-i-fizicheskie-svojstva-alkanov.html
Алканы ряда метана, их общая формула. Метан, электронное и пространственное строение, химические свойства (горение, реакция замещения)
Алканы (предельные, насыщенные) – это нециклические углеводороды, в молекулах, которых атомы углерода связаны друг с другом только простыми (σ-связями). Алканы имеют общую формулу CnH2n+2 , не присоединяют водород и другие элементы.
- Строение молекулы метана
- Простейшим представителем предельных углеводородов является метан.
- СН4 – молекулярная формула (качественный, количественный состав).
Молекула метана не имеет плоского строения. Молекула метана в действительности имеет формутетраэдра. Тетраэдр – это пирамида, в основании которой лежит равносторонний треугольник. Вцентре тетраэдра находится атом углерода, а атомы водорода – в вершинах тетраэдра.
- Вывод: молекула метана в пространстве имеет тетраэдрическое строение.
- 1) Для метана характерны главным образом реакции замещения атомов водорода на атомы галогенов:
- 2)
- СН4 + Cl2 →CH3Cl + HCl — хлорметан
- СН3Cl + Cl2 →CH2Cl2 + HCl — дихлорметан
- СН2Cl2 + Cl2 →CHCl3 + HCl – трихлорметан (хлороформ)
- СНCl3 + Cl2 →CCl4 + HCl – тетрахлорметан (четыреххлористый углерод)
- Метан с кислородом: реакция горения
Процесс горения метана — это взаимодействие метана с кислородом. В результате реакции образуется вода, двуокись углерода и много энергии. Уравнение реакции горения метана:
- CH₄[газ] + 2O₂[газ] → CO₂[газ] + 2H₂O[пар] + 891кДж
- ВОПРОС №7
- Алкены ряда этена (этилена), их общая формула. Этилен, его химические свойства (горение, реакции присоединения и полимеризации)
- Алкены – нециклические углеводороды с одной двойной связью и общей формулой С n Н2 n
- Двойная связь – сочетание прочной σ–связи и непрочной π –связи.
- Электронное строение молекулы этилена
Атомы углерода в составе молекулы алкена связаны между собой двойной связью. Эти атомы находятся в состоянии sp2-гибридизации. Двойная связь между ними образована из двух пар обобществленных электронов, т.е.
это четырехэлектронная связь. Она сочетанием ковалентных σ-связи и π-связи.
σ-Связь образована за счет осевого перекрывания sp2-гибридных орбиталей, а π-связь – за счет бокового перекрывания негибридизованных p-орбителей двух атомов углерода (рис. 1).

Рис. 1. Строение молекулы этилена.
Пять σ-связей двух sp2-гибридизованных атомов углерода лежат в одной плоскости под углом 120o и составляют σ-скелет молекулы. Над и под этой плоскостью симметрично расположена электронная плотность π-связи, которую можно изобразить также в виде плоскости, перпендикулярной σ-скелету.
При образовании π-связи происходит сближение атомов углерода, потому что межъядерное пространство в двойной связи более насыщено электронами, чем в σ-связи. Это стягивает атомные ядра и поэтому длина двойной связи (0,133 нм) меньше одинарной (0,154 нм).
Рис. 4.3. Молекула этена:
а — боковое перекрывание 2р-орбиталей (p-перекрывание);
б — p-связь состоит из двух электронных облаков, одно из которых лежит над, а другое – под плоскостью молекулы
Таким образом, двойная углерод-углеродная связь построена из более прочной s-связи (347 кДж/моль) и менее прочной p-связи (260 кДж/моль). p-Связь делает невозможным вращение одного атома углерода относительно другого вдоль связи углерод-углерод. С этим связано явление геометрической изомерии.
Двойная углерод-углеродная связь в этене короче, чем простая связь в этане.

- Реакции присоединения.
- а) Взаимодействие с водородом (гидрирование)
- СН2=СН2+Н2→СН3-СН3
- этен этан
- б) Взаимодействие с галогенами (галогенирование)
- СН2=СН2+Br2 → СН2Br-СН2Br (1,2-дибромэтан)
- обесцвечивание бурой окраски раствора брома в воде служит качественной реакцией на наличие двойной связи.
- в) Взаимодействие с галогеноводородами
- СН2=СН2+НСl→СН3-СН2Cl (хлорэтан)
- г) Взаимодействие с водой (гидратация)
- СН2=СН2+Н2O→СН3-СН2OH (этанол)
- Реакции полимеризации.
- Полимеризация – соединение небольших молекул мономера в гигантские молекулы полимера:
- n СН2=СН2 → (-СН2-СН2-)n
- этилен полиэтилен
Дата добавления: 2019-07-15; просмотров: 181;
Источник: https://studopedia.net/14_18119_alkani-ryada-metana-ih-obshchaya-formula-metan-elektronnoe-i-prostranstvennoe-stroenie-himicheskie-svoystva-gorenie-reaktsiya-zameshcheniya.html
Электронное и пространственное строение алканов. Лабораторная работа «Изготовление моделей молекул углеводородов»
- Муниципальное казенное общеобразовательное учреждение
- «Попово-Лежачанская средняя общеобразовательная школа»
- Глушковского района Курской области
- Разработка урока по химии на тему:
- Электронное и пространственное строение алканов.
- Лабораторная работа «Изготовление моделей молекул углеводородов»
- 10 класс
- Подготовила:
- Кондратенко Ольга Васильевна,
- учитель химии и биологии
- МКОУ «Попово-Лежачанская» СОШ
- Глушковского района Курской области
- с.Попово-Лежачи
- 2015
- Дата____________
- Химия, 10 класс
- Урок №___
- Тема: Электронное и пространственное строение алканов. Лабораторная работа «Изготовление моделей молекул углеводородов»
- Цель: научиться изготавливать модели молекул алканов, руководствуясь теорией химического строения органических веществ
- Задачи:
- Образовательная:
- формирование у учащихся представлений о гомологическом ряде, видах изомерии, правилах номенклатуры ИЮПАК на примере алканов;
- изучить электронное и пространственное строение молекул алканов;
- формирование умения изготавливать модели молекул алканов, руководствуясь теорией химического строения органических веществ.
Развивающая:
- создать условия для развития системы умений устанавливать причинно-следственные связи между строением, составом и свойствами;
- развивать умение работать с текстом учебника, с дополнительными источниками информации, анализировать, отбирать и представлять необходимую информацию;
- отрабатывать предметную культуру речи, творческое и логическое мышление.
Воспитательная:
- способствовать развитию навыков коммуникативной культуры и сотрудничества при работе в группах; воспитывать информационную компетентность.
- Урок разработан с использованием элементов технологий ИКТ, проблемно-диалогического обучения, технологии смыслового чтения.
- В соответствии с требованиями ФГОС на уроке идет формирование и развитие УУД:
- Личностные УУД:
- смыслообразование — установление учащимися связи между целью учебной деятельности и ее мотивом.
Познавательные УУД:
- поиск и выделение необходимой информации;
- применение методов информационного поиска;
- смысловое чтение; понимание и адекватная оценка языка средств массовой информации;
- развитие умения работать с текстом учебника, с дополнительными источниками информации, анализировать, отбирать и представлять необходимую информацию;
Коммуникативные УУД:
- развитие навыков коммуникативной культуры и сотрудничества при работе в группах; коллективной работе, воспитание информационной компетентности.
Регулятивные УУД:
- умение определять цели, ставить задачи на каждом этапе урока.
- Тип урока: урок совершенствования знаний, умений и навыков учащихся.
- Вид урока: урок-лабораторная работа.
- Формы работы: работа с учебником и тетрадью, демонстрация, беседа, работа в группах, изготовление моделей углеводородов, фронтальный опрос.
- Оборудование и материалы: компьютер, проектор, презентация, таблицы «Правила техники безопасности», «Основные предупредительные меры во время работы в химическом кабинете, пластилин, деревянные или металлические стержни (можно использовать спички).
Литература для учителя и учащихся: Рудзитис Г.Е. Химия. 10 класс : учебн. Для общеобразоват. Организаций с прил на электрон. Носителе (DVD) : базовый уровень / Г.Е. Рудзитис, Ф. Г. Фельдман. — М. : Просвещение, 2014. — 224с. : ил. — ISBN 978-5-09-028570-4.
Интернет-ресурсы:
http://files.school-collection.edu.ru /
Источник: https://xn--j1ahfl.xn--p1ai/library/elektronnoe_i_prostranstvennoe_stroenie_alkanov_la_230656.html
Определение гомологического ряда алканов Метан Строение алканов Номенклатура алканов Изомерия алканов Получение алканов Физические свойства алканов Химические. — презентация
1
2 Определение гомологического ряда алканов Метан Строение алканов Номенклатура алканов Изомерия алканов Получение алканов Физические свойства алканов Химические свойства алканов Применение алканов. Определение гомологического ряда алканов Метан Строение алканов Номенклатура алканов Изомерия алканов Получение алканов Физические свойства алканов Химические свойства алканов Применение алканов
3 Алканы – алифатические (ациклические) углеводороды, в молекулах которых атомы углерода связаны между собой одинарными σ- связями, а остальные их валентности максимально (предельно) насыщены атомами водорода.
Алканы – название предельных углеводородов по международной номенклатуре. Парафины – исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – имеющий мало сродства, малоактивный).
Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода
4 Родоначальник алканов – метан СН 4. В молекуле метана, как и других алканов атом углерода находится в sp 3 гибридизации. Валентный угол равен 109°28 форма молекулы тетраэдр
5 Алканы — углеводороды, состав которых выражается общей формулой C n H 2n+2, где n 1 0,25 нм 0,109 нм 109 °208' 0,154 нм Алканы — углеводороды, состав которых выражается общей формулой C n H 2n+2, где n 1 0,25 нм 0,109 нм 109 °208' 0,154 нм
6 1. Общая формула алканов C n H 2n+2 2. Гибридизация sp 3 3. Все связи атома углерода направлены к вершинам тетраэдра 4. Все атомы углерода соединены между собой одинарной σ связью 5.
Валентный угол 109°28 6.l(C – C) = нм; 7.E(С-С)=353,6 к Дж/моль 8.l(C – H) = нм; 9.E(С-Н)=417,9 к Дж/моль 10.l(C — — C) = 0.25 нм 11.
Начиная с пропана атомы углерода расположены не по прямой, а зигзагообразно
- 7 Формула НазваниеЧисло изомеров Формула НазваниеЧисло изомеров СН 4 Метан 1С 11 Н 24 Ундекан 159 С2Н6С2Н6 Этан 1С 12 Н 26 Додекан 355 С3Н8С3Н8 Пропан 1С 13 Н 28 Тридекан 802 С 4 Н 10 Бутан 2С 14 Н 30 Тетрадекан 1858 С 5 Н 12 Пентан 3С 15 Н 32 Пентадекан 4347 С 6 Н 14 Гексан 5С 20 Н 42 Эйкозан С 7 Н 16 Гептан 9С 25 Н 52 Пентакозан С 8 Н 18 Октан 18С 30 Н 62 Триаконтан С 9 Н 20 Нонан 35С 40 Н 82 Тетраконтан С 10 Н 22 Декан 75С 100 Н 202 Гектаноколо 5,921·
- 8 1)Найти самую длинную цепь; 2)Пронумеровать цепь с того конца где ближе разветвление; 3)Выделить заместители; 4)Место сколько какой кто 1)Найти самую длинную цепь; 2)Пронумеровать цепь с того конца где ближе разветвление; 3)Выделить заместители; 4)Место сколько какой кто
- 9 СН 3 СН С С СН 3 СН СН 2 СН 3 тетра метил гексан
- 10 1. Изомерия углеродного скелета c C 4 ;
- 11 2. Различные пространственные формы молекулы, переходящие друг в друга путем вращения вокруг σ — связей С–С, называют конформациями или поворотными изомерами (конформерами) c C
- 12 3. Оптическая изомерия Оптическими изомерами называются пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение c C Оптическая изомерия Оптическими изомерами называются пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение c C
13 1. Разложение карбида алюминия: Al 4 C H 2 O = 3CH 4 + 4Al(OH) 3 ; 2. Синтез из простых веществ при Т= °С повышенном давлении и в присутствии катализаторов (Ni, Pt, Pd): С + 2Н 2 СН 4 3.
Термокаталитическое восстановление оксидов углерода (катализаторы Ni, Pt, Pd и температура): СО + 3Н 2 СН 4 + Н 2 О (метод Фишера- Тропша) СО 2 + 4Н 2 СН 4 + 2Н 2 О 1. Разложение карбида алюминия: Al 4 C H 2 O = 3CH 4 + 4Al(OH) 3 ; 2. Синтез из простых веществ при Т= °С повышенном давлении и в присутствии катализаторов (Ni, Pt, Pd): С + 2Н 2 СН 4 3.
Термокаталитическое восстановление оксидов углерода (катализаторы Ni, Pt, Pd и температура): СО + 3Н 2 СН 4 + Н 2 О (метод Фишера- Тропша) СО 2 + 4Н 2 СН 4 + 2Н 2 О
14 1. Промышленные способы: A.Выделение из природного газа, нефти, твердых парафинов; B.Химическая переработка угля; C.Получение на основе «синтез-газа» 2. Лабораторные способы: A.Реакция Вюрца; B.Электролиз солей; C.Гидрирование непредельных D.Декарбоксилирование кислот E.
Получение из производных алканов 1. Промышленные способы: A.Выделение из природного газа, нефти, твердых парафинов; B.Химическая переработка угля; C.Получение на основе «синтез-газа» 2. Лабораторные способы: A.Реакция Вюрца; B.Электролиз солей; C.Гидрирование непредельных D.Декарбоксилирование кислот E.
Получение из производных алканов
15 1. Природные источники углеводородов: нефть, уголь, природный и попутный нефтяной газ. Содержание в нефти отечественного происхождения от 30 до 89%. Метан до 98% в природном газе. Смеси высокоплавких твердых алканов встречаются в виде минерала озокерита
16 2. Получение на основе «синтез-газа» nCO + (2n+1)H 2 t( °) kat C n H 2n+2 «синтез-газ» +nH 2 O (образовавшаяся смесь называется синтином). Например: 6СО + 13Н 2 С 6 Н 14 +6Н 2 О 2. Получение на основе «синтез-газа» nCO + (2n+1)H 2 t( °) kat C n H 2n+2 «синтез-газ» +nH 2 O (образовавшаяся смесь называется синтином). Например: 6СО + 13Н 2 С 6 Н 14 +6Н 2 О
17 1. Реакция Вюрца (1855 г): R ' – I + Na + I – R '' R ' – R '' + 2NaI Если в реакции участвуют два разных галогеналкана, то образуется смесь трех углеводородов.
Например: CH 3 – CH 3 CH 3 I + C 2 H 5 I + 2Na CH 3 – C 2 H 5 + 2NaI C 2 H 5 — C 2 H 5 Кроме Na можно использовать Zn, Mg и др. Если в реакции участвуют два разных галогеналкана, то образуется смесь трех углеводородов.
Например: CH 3 – CH 3 CH 3 I + C 2 H 5 I + 2Na CH 3 – C 2 H 5 + 2NaI C 2 H 5 — C 2 H 5 Кроме Na можно использовать Zn, Mg и др.
18 2. Электролиз солей одноосновный карбоновых кислот.
Реакция Кольбе (Ме — одновалентный) 2R-COONa + H 2 O R – R + 2CO 2 + H 2 + 2NaOH Например: 2СН 3 -COONa + H 2 O СН 3 – СН 3 + 2CO 2 + H 2 + 2NaOH 2. Электролиз солей одноосновный карбоновых кислот.
Реакция Кольбе (Ме — одновалентный) 2R-COONa + H 2 O R – R + 2CO 2 + H 2 + 2NaOH Например: 2СН 3 -COONa + H 2 O СН 3 – СН 3 + 2CO 2 + H 2 + 2NaOH
19 3. Декарбоксилирование солей одноосновный карбоновых кислот реакция Дюма: 3. Декарбоксилирование солей одноосновный карбоновых кислот реакция Дюма: R-COONa + NaOH Na 2 СО 3 + R-Н Например: СН 3 -COONa + NaOH Na 2 СО 3 + СН 4 Например: СН 3 -COONa + NaOH Na 2 СО 3 + СН 4
20 4.
Каталитическое гидрирование (гидрогенизация) непредельных углеводородов (катализаторы Ni, Pt, Pd, t и P) С n H 2n + 2H 2 С n H 2n+2 (из алкенов) С 3 H 6 + 2H 2 С 3 H 8 С n H 2n-2 + 2H 2 С n H 2n+2 (из алкинов) С 4 H 6 + 2H 2 С 4 H Каталитическое гидрирование (гидрогенизация) непредельных углеводородов (катализаторы Ni, Pt, Pd, t и P) С n H 2n + 2H 2 С n H 2n+2 (из алкенов) С 3 H 6 + 2H 2 С 3 H 8 С n H 2n-2 + 2H 2 С n H 2n+2 (из алкинов) С 4 H 6 + 2H 2 С 4 H
21 5. Получение из производных алканов. R-Mg-X + H-OH R – H + Mg(OH)X CH 3 -Mg-Cl + H-OH CH 4 + Mg(OH)Cl 5. Получение из производных алканов.
R-Mg-X + H-OH R – H + Mg(OH)X CH 3 -Mg-Cl + H-OH CH 4 + Mg(OH)Cl R-Mg-X + X-R R – R + MgX 2 CH 3 –Mg-Cl + ClC 2 H 5 CH 3 — C 2 H 5 + MgCl 2 Синтез Гриньяра R-Mg-X + X-R R – R + MgX 2 CH 3 –Mg-Cl + ClC 2 H 5 CH 3 — C 2 H 5 + MgCl 2 Синтез Гриньяра
22 С 1 – С 4 – газы без запаха и цвета; С 5 – С 17 – жидкости без цвета с запахом бензина; С 18 – С – твердые вещества белого цвета, жирные на ощупь без запаха. Алканы нерастворимы в воде, но растворимы друг в друге и неполярных растворителях.
Алканы легче воды поэтому образуют пленки на ее поверхности. С 1 – С 4 – газы без запаха и цвета; С 5 – С 17 – жидкости без цвета с запахом бензина; С 18 – С – твердые вещества белого цвета, жирные на ощупь без запаха. Алканы нерастворимы в воде, но растворимы друг в друге и неполярных растворителях.
Алканы легче воды поэтому образуют пленки на ее поверхности
- 23
- 24
- 25 1)Галогенирование CH 4 + Cl 2 HCl + CH 3 Cl (хлорметан или хлористый метил) CH 3 Cl + Cl 2 HCl + CH 2 Cl 2 (дихлорметан или хлористый метилен) CH 2 Cl 2 + Cl 2 HCl + CHCl 3 (трихлорметан или хлороформ) CHCl 3 + Cl 2 HCl + CCl 4 (тетрахлорметан или четыреххлористый углерод) 1)Галогенирование CH 4 + Cl 2 HCl + CH 3 Cl (хлорметан или хлористый метил) CH 3 Cl + Cl 2 HCl + CH 2 Cl 2 (дихлорметан или хлористый метилен) CH 2 Cl 2 + Cl 2 HCl + CHCl 3 (трихлорметан или хлороформ) CHCl 3 + Cl 2 HCl + CCl 4 (тетрахлорметан или четыреххлористый углерод)
26 Реакционная способность убывает в рядах: F 2 > Cl 2 > Br 2 > I 2 R 3 C – H > (R) 2 CH – H > RCH 2 – H > CH 3 – H Протекает по цепному радикальному механизму (Семенов Н.С.
– Нобелевская премия 1956 г) Идет на свету или при температуре Общее уравнение: C n H 2n+2 + X 2 C n H 2n+1 X + HX Реакционная способность убывает в рядах: F 2 > Cl 2 > Br 2 > I 2 R 3 C – H > (R) 2 CH – H > RCH 2 – H > CH 3 – H Протекает по цепному радикальному механизму (Семенов Н.С.
– Нобелевская премия 1956 г) Идет на свету или при температуре Общее уравнение: C n H 2n+2 + X 2 C n H 2n+1 X + HX
27 1. Инициирование (зарождение цепи) Cl 2 2Cl · 2. Рост (развитие) цепи CH 4 + Cl· ·CH 3 + HCl; · CH 3 +Cl 2 2Cl· + CH 3 Cl 3.
Обрыв цепи · CH 3 + · CH 3 C 2 H 6 · CH 3 + Cl· CH 3 Cl Cl · + Cl · Cl 2 1. Инициирование (зарождение цепи) Cl 2 2Cl · 2. Рост (развитие) цепи CH 4 + Cl· ·CH 3 + HCl; · CH 3 +Cl 2 2Cl· + CH 3 Cl 3.
Обрыв цепи · CH 3 + · CH 3 C 2 H 6 · CH 3 + Cl· CH 3 Cl Cl · + Cl · Cl
28 2. Нитрование (реакция Коновалова), при температуре 140°С, 13% азотной кислотой C n H 2n+2 + HO – NO 2 C n H 2n+1 NO 2 + H 2 О Например: CH 4 + HO – NO 2 CH 3 NO 2 + H 2 O 2. Нитрование (реакция Коновалова), при температуре 140°С, 13% азотной кислотой C n H 2n+2 + HO – NO 2 C n H 2n+1 NO 2 + H 2 О Например: CH 4 + HO – NO 2 CH 3 NO 2 + H 2 O
29
30 1. Горение или полное окисление СН 4 + 2О 2 СО 2 + Н 2 О +880 к Дж Общее уравнение: C n H 2n+2 + (3n+1)/2O 2 nCO 2 +(n+1) Н 2 О 1. Горение или полное окисление СН 4 + 2О 2 СО 2 + Н 2 О +880 к Дж Общее уравнение: C n H 2n+2 + (3n+1)/2O 2 nCO 2 +(n+1) Н 2 О
31 2.
Неполное окисление: А) метана: a)2CH 4 + O 2 2CH 3 OH +3H 2 (kat, t) b) 2CH 4 + 2O 2 2CH 2 O +2H 2 O(kat, t) c) 2CH 4 + 3O 2 2HCOOH +2H 2 O(kat, t) d) 2CH 4 + 3O 2 2CO +4H 2 O(kat, t) e) CH 4 +O 2 2C + 2H 2 O(kat, t) Б) гомологи метана с числом атомов углерода больше двух окисляются в присутствии MnO 2 при °С и давлении до кислот реже спиртов 2СН 3 (СН 2 ) 34 СН 3 + 5О 2 4С 17 Н 35 СООН + 2Н 2 О
32
33 А) Термическое разложение метана при сильном нагревании (выше 1000°С) без доступа воздуха (пиролиз) СН 4 2С + 2Н 2 (t>1000°) 2CH 4 C 2 H 2 + 3H 2 (1500° ° кат.
, Р) 2CH 4 C 2 H 4 + 2H 2 (1200°, кат, Р) Б) этана C 2 H 6 C 2 H 2 + 2H 2 (1200°, кат, Р) А) Термическое разложение метана при сильном нагревании (выше 1000°С) без доступа воздуха (пиролиз) СН 4 2С + 2Н 2 (t>1000°) 2CH 4 C 2 H 2 + 3H 2 (1500° ° кат.
, Р) 2CH 4 C 2 H 4 + 2H 2 (1200°, кат, Р) Б) этана C 2 H 6 C 2 H 2 + 2H 2 (1200°, кат, Р)
34 В) Крекинг разрыв связи С – С С 9 Н 20 С 4 Н 10 + С 5 Н °С С 9 Н 20 С 5 Н 12 + С 4 Н 8 Характер образующихся веществ зависит от строения алкана и термического воздействия, а также от катализатора и давления.
СН 4 + С 3 Н 6 С 4 Н 10 С 2 Н 6 + С 2 Н 4 С 2 Н 6 + СН 4 + С 2С 2 Н 2 + 3Н 2 В) Крекинг разрыв связи С – С С 9 Н 20 С 4 Н 10 + С 5 Н °С С 9 Н 20 С 5 Н 12 + С 4 Н 8 Характер образующихся веществ зависит от строения алкана и термического воздействия, а также от катализатора и давления.
СН 4 + С 3 Н 6 С 4 Н 10 С 2 Н 6 + С 2 Н 4 С 2 Н 6 + СН 4 + С 2С 2 Н 2 + 3Н
35 Г ) Дегидрирование C 2 H 6 C 2 H 4 + H 2 (300°, Cr 2 O 3, Р) Д) Дегидроциклизация (ароматизация) характерна для алканов содержащих 6 и боле атомов углерода. С 6 Н 14 С 6 Н 6 + 4Н 2 (t, Pt) Г ) Дегидрирование C 2 H 6 C 2 H 4 + H 2 (300°, Cr 2 O 3, Р) Д) Дегидроциклизация (ароматизация) характерна для алканов содержащих 6 и боле атомов углерода. С 6 Н 14 С 6 Н 6 + 4Н 2 (t, Pt)
36 Е) изомеризация – превращение алкана нормального строения в разветвленный изомер (t, Al 2 O 3 ) СН 3 – СН 2 – СН 2 – СН 3 СН 3 – СН – СН 3 СН 3 Е) изомеризация – превращение алкана нормального строения в разветвленный изомер (t, Al 2 O 3 ) СН 3 – СН 2 – СН 2 – СН 3 СН 3 – СН – СН 3 СН
37 Процесс конверсии протекает при высокой температуре ( ° ) и в присутствии никелевого катализатора.
В этих условиях метан реагирует с водой и углекислым газом: СН 4 + Н 2 О СО + 3Н 2 ; СН 4 + СО 2 2СО + 2Н 2 Процесс конверсии протекает при высокой температуре ( ° ) и в присутствии никелевого катализатора.
В этих условиях метан реагирует с водой и углекислым газом: СН 4 + Н 2 О СО + 3Н 2 ; СН 4 + СО 2 2СО + 2Н
38
Источник: http://www.myshared.ru/slide/1216421/




