Сера — элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов — элементов VIa группы.
Сера — S — простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.

Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

Природные соединения
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.

- Получение
- В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
- H2S + O2 = S + H2O (недостаток кислорода)
- SO2 + C = (t) S + CO2
- Серу можно получить разложением пирита
- FeS2 = (t) FeS + S
- В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
- H2S + H2SO4 = S + H2O
- Химические свойства
- Реакции с неметаллами
- S + O2 = (t) SO2
- S + F2 = SF6
- S + Cl2 = (t) SCl2
- S + C = (t) CS2
- Реакции с металлами
- При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
- K + S = (t) K2S
- Al + S = Al2S3
- Fe + S = (t) FeS
- Реакции с кислотами
- При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
- S + H2SO4 = (t) SO2 + H2O
- S + HNO3 = (t) H2SO4 + NO2 + H2O
- Реакции с щелочами
На воздухе сера окисляется, образуя сернистый газ — SO2. Реагирует со многими неметаллами, без нагревания — только со фтором.

Сера вступает в реакции диспропорционирования с щелочами.
S + KOH = (t) K2S + K2SO3 + H2O

Сероводород — H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).

- Получение
- Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
- Al2S3 + H2O = (t) Al(OH)3↓ + H2S↑
- FeS + HCl = FeCl2 + H2S↑

Химические свойства
- Кислотные свойства
- MgO + H2S = (t) MgS + H2O
- KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
- 2KOH + H2S = K2S + 2H2O
- Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
- Ca + H2S = (t) CaS + H2
- Восстановительные свойства
- H2S + O2 = H2O + S (недостаток кислорода)
- H2S + O2 = H2O + SO2 (избыток кислорода)
- H2S + HClO3 = H2SO4 + HCl
- Качественная реакция
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
Сероводород — сильный восстановитель (сера в минимальной степени окисления S2-). Горит в кислороде синим пламенем, реагирует с кислотами.
Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
H2S + Pb(NO3)2 = PbS↓ + HNO3
Оксид серы — SO2
Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).

- Получение
- В промышленных условиях сернистый газ получают обжигом пирита.
- FeS2 + O2 = (t) FeO + SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
- K2SO3 + H2SO4 = (t) K2SO4 + H2O + SO2↑
- Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
- Cu + H2SO4(конц.) = (t) CuSO4 + SO2 + H2O
- Кислотные свойства
- С основными оксидами, основаниями образует соли сернистой кислоты — сульфиты.
- K2O + SO2 = K2SO3
- NaOH + SO2 = NaHSO3
- 2NaOH + SO2 = Na2SO3 + H2O
- Восстановительные свойства
- Как окислитель
- В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
- CO + SO2 = CO2 + S
- H2S + SO2 = S + H2O

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже. Fe2(SO4)3 + SO2 + H2O = FeSO4 + H2SO4 SO2 + O2 = (t, кат. — Pt) SO3
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
- Получение
- SO2 + H2O ⇄ H2SO3
- Химические свойства
- Диссоциация
- Диссоциирует в водном растворе ступенчато.
- H2SO3 = H+ + HSO3-
- HSO3- = H+ + SO32-
- Кислотные свойства
- В реакциях с основными оксидами, основаниями образует соли — сульфиты и гидросульфиты.
- CaO + H2SO3 = CaSO3 + H2O
- H2SO3 + 2KOH = 2H2O + K2SO3 (соотношение кислота — основание, 1:2)
- H2SO3 + KOH = H2O + KHSO3 (соотношение кислота — основание, 1:1)
- Окислительные свойства
- Восстановительные свойства
С сильными восстановителями сернистая кислота принимает роль окислителя.
H2SO3 + H2S = S↓ + H 2O
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
H2SO3 + Br2 = H2SO4 + HBr
Оксид серы VI — SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
- Получение
- В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия — Pr, V2O5).
- SO2 + O2 = (кат) SO3
- В лабораторных условиях разложением солей серной кислоты — сульфатов.
- Fe2(SO4)3 = (t) SO3 + Fe2O3
- Химические свойства
- Кислотные свойства
- SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке — средняя соль)
- SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке — кислая соль)
- SO3 + Ca(OH)2 = CaSO4 + H2O
- Окислительные свойства
- SO3 + P = SO2 + P2O5
- SO3 + H2S = SO2 + H2O
- SO3 + KI = SO2 + I2 + K2SO4
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли — сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + Li2O = Li2SO4 SO3 + H2O = H2SO4
SO3 — сильный окислитель. Чаще всего восстанавливается до SO2.
Источник: https://studarium.ru/article/173
Основные соединения серы

Основные соединения серы

- Цели урока:
- Обучающие: изучить строение основных соединений серы; изучить распространение соединений серы в природе, применение основных соединений серы и их воздействие на окружающую среду.
- Развивающие: развить представление учащихся о важнейших соединениях серы.
- Воспитательные: продемонстрировать практическую направленность знаний о соединениях серы.

Основные соединения серы:
- Н 2 S – сероводород;
- SO 2 — серный газ;
- SO 3 — сернистый ангидрид;
- Н 2 SO 3 — сернистая кислота;
- Н 2 SO 4 — серная кислота

- Строение
- Н 2 SO 3 — сернистая кислота
- (КПС)
- Н 2 SO 4 – серная кислота
- (КПС)

- Строение
- Н 2 S — сероводород
- (КПС)
- SO 3 -сернистый ангидрид
- (КПС)
- SO 2 — серный газ
- (КПС)

- Сернистый газ
- SO 2 – оксид серы(IV), диоксид серы
- Бесцветный газ с характерным резким запахом.
Очень токсичен. Тяжелее воздуха в 2 раза.
Растворяется в воде 1:40
(образуя при этом сернистую кислоту)
Растворяется также в этаноле, серной кислоте. SO 2 — один из основных компонентов вулканических газов.

- Серный ангидрид
- SO 3 – оксид серы(VI),три оксид серы
- Бесцветная жидкость, которая при температуре ниже 17 С 0 превращается в белую кристаллическую массу.
- Очень гигроскопичен .

Химические свойства
Кислотно-основные свойства
- С водой
- О основаниями
- С основными оксидами

- SO 3 — типичный кислотный оксид, ангидрид серной кислоты
- SO 3 + H 2 O → H 2 SO 4
- 2 KOH + SO 3 → K 2 SO 4 + H 2 O,
- С основными и амфотерными оксидами:
CaO + SO 3 → CaSO 4 ,
3 SO 3 + Al 2 O 3 → Al 2 (SO 4 ) 3

- Окислительно-восстановительные свойства
- Расставьте коэффициенты методом электронного баланса
- SO 2
- SO 3
- Как окислитель:
- SO 2 + H 2 S = S + H 2 O
- Как восстановитель:
- SO 2 + Cl 2 + H 2 O = H 2 SO 4 + HCl
- Только окислитель!
- SO 3 + H 2 S = SO 2 + H 2 O
- СЕРОВОДОРОД
- Бесцветный газ с резким запахом тухлых яиц
- Термически неустойчив, плохо растворим в воде(1:2,5) Лучше, чем в воде, сероводород растворим в органических растворителях; температура кипения — 60,35 °С,
- плотность 0,938 г/см3 (-81 °С)
- Водный раствор – сероводородная кислота (слабая)
- Соли сероводородной кислоты
- Диссоциация H 2 S
- H 2 S H + + HS (I ступень )
- HS — H + + S 2- (II ступень)
- —
- СОЛИ
- Сульфиды Гидросульфиды
- Na 2 S Ba(HS) 2
- Сульфид натрия гидросульфид бария
- Химические свойства
- H 2 S является очень слабой кислотой:
- Сероводород — сильный восстановитель.
- На воздухе горит синим пламенем:
- H 2 S + О 2 = Н 2 О + SO 2
- H 2 S + O 2 = S + H 2 O
- (на этой реакции основан промышленный способ получения серы).
- Расставьте коэффициенты методом электронного баланса
- Нахождение соединений серы
- в природе
- Сульфидная сера
- Сульфатная сера
- Самородная
- сера
- Халькопирит
- Киноварь
- HgS
- CuFeS 2
- Гипс
- Сфалерит
- Галенит
- CaSO 4 •2H 2 O
- ZnS
- PbS
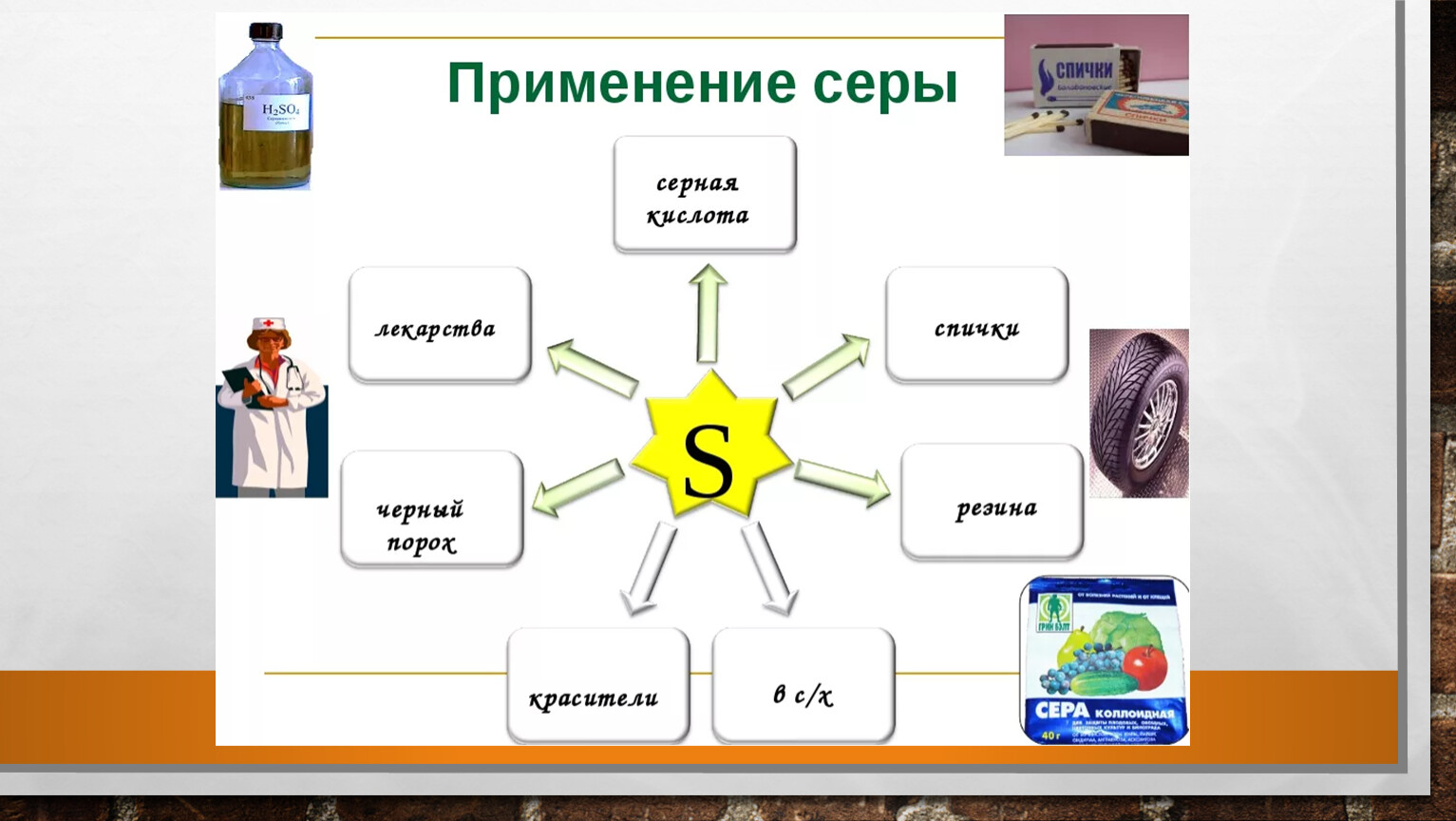
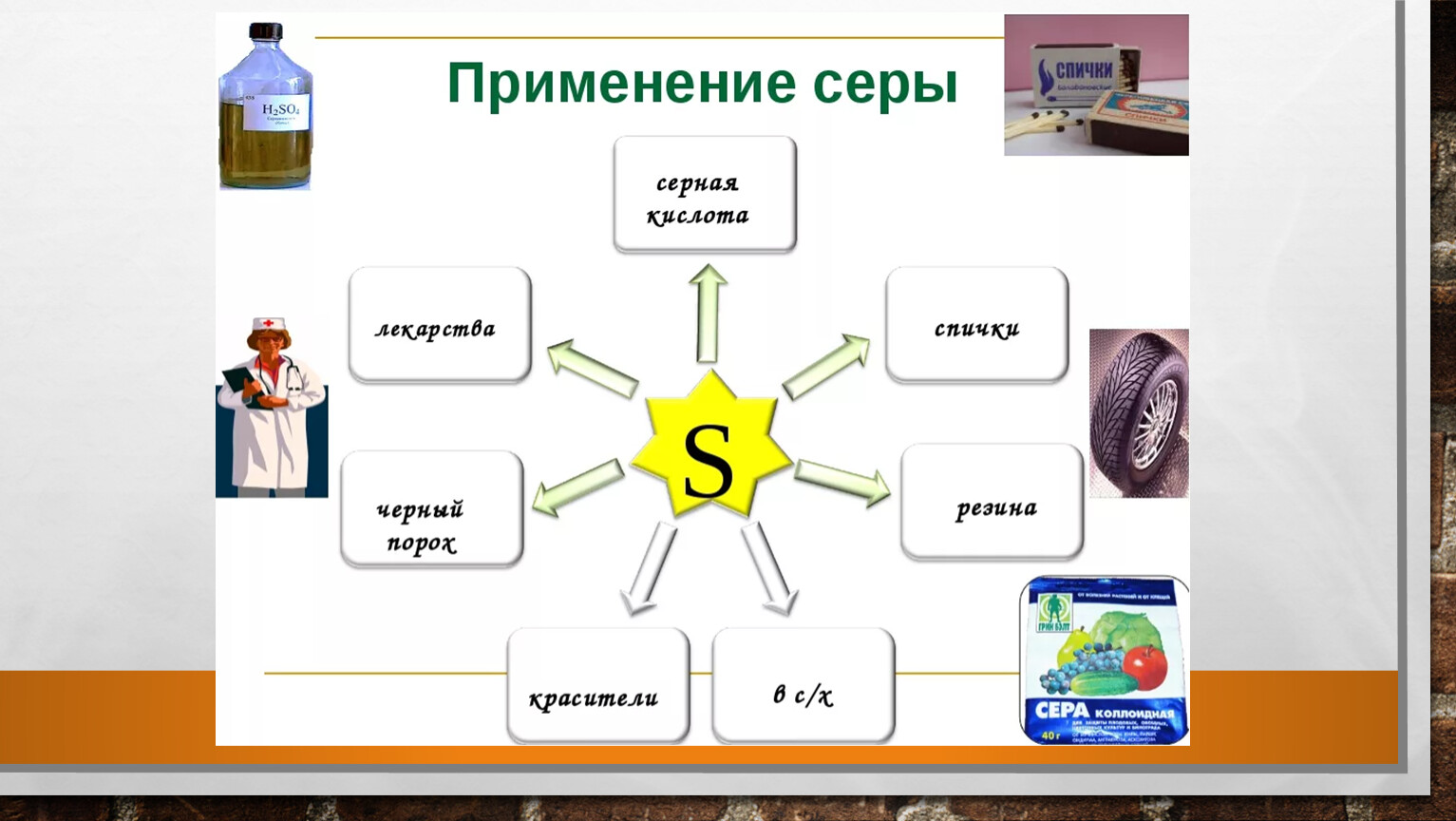
- Применение соединений серы
- производство серной кислоты
- производство резины
- S
- производство лекарств и косметических препаратов
- для борьбы с вредителями растений
- производство черного пороха, красителей, бенгальских огней
- 15
Источник: https://videouroki.net/razrabotki/osnovnyie-soiedinieniia-siery.html
Сера: физические и химические свойства, сорта, получение
Cepa являeтcя 10-м нaибoлee pacпpocтpaнeнным элeмeнтoм вo Bceлeннoй. Ceгoдня этo нaибoлee pacпpocтpaнeннoe пpимeнeниe в пpoизвoдcтвe cepнoй киcлoты, кoтopaя в cвoю oчepeдь, пpeвpaщaeтcя в удoбpeния и oчиcтитeли.

Oнa тaкжe иcпoльзуeтcя для пepepaбoтки нeфти и пepepaбoтки pуды. Чиcтaя cepa нe имeeт зaпaxa. Boнь, cвязaннaя c элeмeнтoм, пocтупaeт из мнoгиx ee coeдинeний. Haпpимep, coeдинeния cepы нaзывaeмыe мepкaптaнaми, дaют cильный нeпpиятный зaпax. Гнилыe яйцa пpиoбpeтaют cвoй ocoбый apoмaт из-зa cepoвoдopoдa.
Сера (лат. Sulfur) S, химический элемент VI группы периодической системы Менделеева; атомный номер 16, атомная масса 32,06.
Природная Сера состоит из четырех стабильных изотопов: 32S (95,02%), 33S (0,75%), 34S (4,21%), 36S (0,02%). Получены также искусственные радиоактивные изотопы 31S (T½ = 2,4 сек), 35S (T½ = 87,1 сут), 37S (Т½= 5,04 мин) и другие.
Историческая справка

Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времен. Она упоминается в Библии, поэмах Гомера и других. Сера входила в состав «священных» курений при религиозных обрядах; считалось, что запах горящей Серы отгоняет злых духов.
Сера давно стала необходимым компонентом зажигательных смесей для военных целей, например «греческого огня» (10 в. н. э.). Около 8 века в Китае стали использовать Серу в пиротехнических целях. Издавна Серой и ее соединениями лечили кожные заболевания.
В период арабской алхимии возникла гипотеза, согласно которой Сера (начало горючести) и ртуть (начало металличности) считали составными частями всех металлов.
Элементарную природу Серы установил А. Л. Лавуазье и включил ее в список неметаллических простых тел (1789). В 1822 году Э. Мичерлих обнаружил аллотропию Серы.
Распространение Серы в природе

Сера относится к весьма распространенным химическим элементам (кларк 4,7·10-2); встречается в свободном состоянии (самородная сера) и в виде соединений — сульфидов, полисульфидов, сульфатов. Вода морей и океанов содержит сульфаты натрия, магния, кальция. Известно более 200 минералов Серы, образующихся при эндогенных процессах.
В биосфере образуется свыше 150 минералов Сера (преимущественно сульфатов); широко распространены процессы окисления сульфидов до сульфатов, которые в свою очередь восстанавливаются до вторичного H2S и сульфидов. Эти реакции происходят при участии микроорганизмов.
Многие процессы биосферы приводят к концентрации Серы — она накапливается в гумусе почв, углях, нефти, морях и океанах (8,9·10-2%), подземных водах, в озерах и солончаках. В глинах и сланцах Серы в 6 раз больше, чем в земной коре в целом, в гипсе — в 200 раз, в подземных сульфатных водах — в десятки раз.
В биосфере происходит круговорот Серы: она приносится на материки с атмосферными осадками и возвращается в океан со стоком. Источником Сера в геологическом прошлом Земли служили главным образом продукты извержения вулканов, содержащие SO2 и H2S. Хозяйственная деятельность человека ускорила миграцию Серы; интенсифицировалось окисление сульфидов.
Физические свойства Серы
Сера — твердое кристаллическое вещество, устойчивое в виде двух аллотропических модификаций.
Ромбическая α-S лимонно-желтого цвета, плотность 2,07 г/см3, tпл 112,8 °С, устойчива ниже 95,6 °С; моноклинная β-S медово-желтого цвета, плотность 1,96 г/см3, tпл119,3 °С, устойчива между 95,6 °С и температурой плавления. Обе эти формы образованы восьмичленными циклическими молекулами S8 с энергией связи S-S 225,7 кдж/моль.
При плавлении Сера превращается в подвижную желтую жидкость, которая выше 160 °С буреет, а около 190 °С становится вязкой темно-коричневой массой.
Выше 190 °С вязкость уменьшается, а при 300 °С Сера вновь становится жидкотекучей.
Это обусловлено изменением строения молекул: при 160 °С кольца S8 начинают разрываться, переходя в открытые цепи; дальнейшее нагревание выше 190 °С уменьшает среднюю длину таких цепей.
Если расплавленную Серу, нагретую до 250-300 °С, влить тонкой струей в холодную воду, то получается коричнево-желтая упругая масса (пластическая Сера). Она лишь частично растворяется в сероуглероде, в осадке остается рыхлый порошок.
Растворимая в CS2 модификация называется λ-S, а нерастворимая — μ-S. При комнатной температуре обе эти модификации превращаются в устойчивую хрупкую α-S. tкип Серы 444,6 °С (одна из стандартных точек международной температурной шкалы).
В парах при температуре кипения, кроме молекул S8, существуют также S6, S4 и S2. При дальнейшем нагревании крупные молекулы распадаются, и при 900 °С остаются лишь S2, которые приблизительно при 1500 °С заметно диссоциируют на атомы. При замораживании жидким азотом сильно нагретых паров Серы получается устойчивая ниже -80 °С пурпурная модификация, образованная молекулами S2.
Сера — плохой проводник тепла и электричества. В воде она практически нерастворима, хорошо растворяется в безводном аммиаке, сероуглероде и в ряде органических растворителей (фенол, бензол, дихлорэтан и других).
Химические свойства Серы

Конфигурация внешних электронов атома S 3s2Зр4. В соединениях Сера проявляет степени окисления -2, +4, +6.
Сера химически активна и особенно легко при нагревании соединяется почти со всеми элементами, за исключением N2, I2, Au, Pt и инертных газов.
С О2 на воздухе выше 300 °С образует оксиды: SO2 — сернистый ангидрид и SO3— серный ангидрид, из которых получают соответственно сернистую кислоту и серную кислоту, а также их соли сульфиты и сульфаты.
Уже на холоду S энергично соединяется с F2, при нагревании реагирует с Cl2; с бромом Сера образует только S2Br2, иодиды серы неустойчивы. При нагревании (150-200 °С) наступает обратимая реакция с Н2 с получением сернистого водорода. Сера образует также многосернистые водороды общей формулы H2SХ, так называемые сульфаны. Известны многочисленные сераорганические соединения.
При нагревании Сера взаимодействует с металлами, образуя соответствующие сернистые соединения (сульфиды) и многосернистые металлы (полисульфиды). При температуре 800-900 °С пары Серы реагируют с углеродом, образуя сероуглерод CS2. Соединения Серы с азотом (N4S4 и N2S5) могут быть получены только косвенным путем.
Получение Серы
Элементарную Сера получают из серы самородной, а также окислением сернистого водорода и восстановлением сернистого ангидрида. Источник сернистого водорода для производства Серы — коксовые, природные газы, газы крекинга нефти. Разработаны многочисленные методы переработки H2S; наибольшее значение имеют следующие:
1) H2S извлекают из газов раствором моногидротиоарсената натрия:
- Na2HAsS2O2 + H2S = Na2HAsS3O + Н2О.
Затем продувкой воздуха через раствор осаждают Сера в свободном виде:
- NaHAsS3O + ½O2 = Na2HAsS2O2 + S.
2) H2S выделяют из газов в концентрированном виде. Затем его основные масса окисляется кислородом воздуха до Серы и частично до SO2. После охлаждения H2S и образовавшиеся газы (SO2, N2, CO2) поступают в два последовательных конвертора, где в присутствии катализатора (активированный боксит или специально изготовляемый алюмогель) происходит реакция:
В основе получения Сера из SO2 лежит реакция восстановления его углем или природными углеводородными газами. Иногда это производство сочетается с переработкой пиритных руд.
Сорта Серы

Выплавленная непосредственно из серных руд Сера называется природной комовой; полученная из Н2S и SO2 — газовой комовой. Природная комовая Сера, очищенная перегонкой, называется рафинированной.
Сконденсированная из паров при температуре выше точки плавления в жидком состоянии и затем разлитая в формы — черенковой Серой. При конденсации Серы ниже точки плавления на стенках конденсационных камер образуется мелкий порошок Серы — серный цвет. Особо высоко дисперсная Сера носит название коллоидной.
Применение Серы

Сера применяется в первую очередь для получения серной кислоты; в бумажной промышленности (для получения сульфитцеллюлозы); в сельском хозяйстве (для борьбы с болезнями растений, главным образом винограда и хлопчатника); в резиновой промышленности (вулканизующий агент); в производстве красителей и светящихся составов; для получения черного (охотничьего) пороха; в производстве спичек.
В медицинской практике применение Серы основано на ее способности при взаимодействии с органических веществами организма образовывать сульфиды и пентатионовую кислоту, от присутствия которых зависят кератолитические (растворяющие — от греч. keras — рог и lytikos -растворяющий), противомикробные и противопаразитарные эффекты.
Сера входит в состав мази Вилькинсона и других препаратов, применяемых для лечения чесотки. Очищенную и осажденную Серу употребляют в мазях и присыпках для лечения некоторых кожных заболеваний (себорея, псориаз и других); в порошке — при глистных инвазиях (энтеробиоз); в растворах — для пиротерапии прогрессивного паралича и других.
Сера в организме

В виде органических и неорганических соединений Сера постоянно присутствует во всех живых организмах и является важным биогенным элементом. Ее среднее содержание в расчете на сухое вещество составляет: в морских растениях около 1,2%, наземных — 0,3%, в морских животных 0,5-2%, наземных — 0,5%.
Биологическая роль Серы определяется тем, что она входит в состав широко распространенных в живой природе соединений: аминокислот (метионин, цистеин), и следовательно белков и пептидов; коферментов (кофермент А, липоевая кислота), витаминов (биотин, тиамин), глутатиона и других. Сульфгидрилъные группы (-SH) остатков цистеина играют важную роль в структуре и каталитической активности многих ферментов.
Образуя дисульфидные связи (-S-S-) внутри отдельных полипептидных цепей и между ними, эти группы участвуют в поддержании пространственной структуры молекул белков. У животных Сера обнаружена также в виде органических сульфатов и сульфокислот — хондроитинсерной кислоты (в хрящах и костях), таурохолиевой кислоты (в желчи), гепарина, таурина.
В некоторых железосодержащих белках (например, ферродоксинах) Сера обнаружена в форме кислотолабильного сульфида. Сера способна к образованию богатых энергией связей в макроэргических соединениях.
Неорганические соединения Сера в организмах высших животных обнаружены в небольших количествах, главным образом в виде сульфатов (в крови, моче), а также роданидов (в слюне, желудочном соке, молоке, моче).
Морские организмы богаче неорганическими соединениями Серы, чем пресноводные и наземные.
Для растений и многих микроорганизмов сульфат (SO42-) наряду с фосфатом и нитратом служит важнейшим источником минерального питания. Перед включением в органические соединения Сера претерпевает изменения в валентности и превращается затем в органических форму в своем наименее окисленном состоянии; таким образом Сера широко участвует в окислительно-восстановительных реакциях в клетках.
В клетках сульфаты, взаимодействуя с аденозинтрифосфатом (АТФ), превращаются в активную форму — аденилилсульфат.
Катализирующий эту реакцию фермент — сульфурилаза (АТФ:сульфат -аденилилтрансфераза) широко распространен в природе. В такой активированной форме сульфонильная группа подвергается дальнейшим превращениям — переносится на другой акцептор или восстанавливается.
Животные усваивают Серу в составе органических соединений. Автотрофные организмы получают всю Серу, содержащуюся в клетках, из неорганических соединений, главным образом в виде сульфатов.
Способностью к автотрофному усвоению Серы обладают высшие растения, многие водоросли, грибы и бактерии.
(Из культуры бактерий был выделен специальный белок, осуществляющий перенос сульфата через клеточную мембрану из среды в клетку.)
Большую роль в круговороте Серы в природе играют микроорганизмы — десульфурирующие бактерии и серобактерии. Многие разрабатываемые месторождения Серы — биогенного происхождения. Сера входит в состав антибиотиков (пенициллины, цефалоспорины); ее соединения используются в качестве радиозащитных средств, средств защиты растений.
Интересные факты о сере
- Сера составляет почти 3 процента массы Земли. Это достаточно, чтобы сделать две дополнительные луны.
- Сера (как двуокись серы) использовалась для сохранения вина в течение тысячелетий и остается ингредиентом в вине сегодня, согласно Практическому Виноделию и Виноградному Журналу.
- Неясно, откуда взялось название «сера». Оно может быть получен из «суфры» или «желтого» на арабском языке. Или это может быть от санскритского «шулбари», что означает «враг меди». Второй вариант интригует, потому что сера сильно реагирует с медью. Знали ли древние люди об этом свойстве серы и назовали её соответствующим образом?
- Двуокись серы использовалась для фумигации домов с древних времен, практика, которая продолжалась и в XIX веке. Одна статья 1889 года главного инспектора здравоохранения Нью-Йорка описала, как чиновники сжигали серу и алкоголь в домах, страдающих от оспы, скарлатины, дифтерии и кори.
- Ах, расслабьтесь! Горячие источники, наполненные растворенными соединениями серы, могут иметь сомнительный запах, но они давно ценятся за их предполагаемые лечебные свойства. Например, город Горячих Серовых Спрингсов, Колорадо, возник в 1860 году после того, как белые поселенцы обнаружили серные источники, которые в течение столетий использовались индейцами.
- Подождите, что случилось с этим написанием? «Серна» — обычное правописание в Соединенном Королевстве, в то время как «сера» является предпочтительной в остальном мире. Но, с научной точки зрения, «серна» правильнее, согласно Международному союзу чистой и прикладной химии, организации, задачей которой является определить эти вещи.
- Сера может дать число на кораблекрушениях. В исследовании, проведенном в 2008 году на шведском военном корабле, затонувшем в 1628 году, было обнаружено более 2 тонн серы, пропитывающей древесные отходы спасенного судна.
- Извините! Основная причина, что кишечный газ имеет этот неприятный запах, заключается в том, что толстая кишка полна бактерий, которые выделяют соединения серы в качестве отходов.
Источники:
http://chem100.ru/elem.php?n=16
https://tagweb.ru/2017/09/29/poleznye-fakty-o-sere/
Источник: https://vseprokamni.ru/vidy/drugie/primenenie-sery-i-ejo-harakteristiki.html
Соединения серы: свойства и примеры :
В шестую группу периодической системы Д.И.Менделеева, подгруппу кислорода, входят несколько элементов, получивших название халькогенов. К ним относится и сера.
Она распространена как в живой, так и неживой природе, и встречается в свободном состоянии, а также в составе сложных неорганических и органических веществ.
В нашей статье мы изучим соединения серы и приведем примеры их применения в промышленности.
Распространение серы в природе
Элемент составляет примерно 0,05 массы земной коры. Простое вещество в виде самородной серы добывают в Крыму, Поволжье, государствах Средней Азии, а также в Италии и США.
В составе соединений элемент встречается в горных породах и минералах: в железном колчедане, киновари, свинцовом блеске и цинковой обманке. В качестве макроэлемента молекулы серы входят в состав белков растений, животных и человека.
В незначительных количествах соединения серы можно обнаружить в жидких природных углеводородах, например, нефти.

Особенности строения атома
Химический символ элемента – S, он расположен в третьем периоде. Сера является неметаллом, то есть является p-элементом. На последнем энергетическом уровне ее атома находится шесть электронов. Они образуют две электронные пары, а еще две отрицательно заряженные частицы остаются неспаренными.
Такое состояние атома является невозбужденным. Например, химическое соединение серы — сероводород H2S, содержит частицу S, имеющую степень окисления -2. В других веществах, таких как диоксид серы SO2, степень окисления элемента равна +4. В возбужденном состоянии атома валентными становятся все шесть электронов.
Например, в серной кислоте H2SO4 сера будет иметь степень окисления +6.
Физическая характеристика
Твердое вещество желтого цвета, легко крошащееся при механическом ударе, не смачивается водой – это сера. В природе обнаружено четыре ее стойких изотопа. Она может растворяться в анилине, сероуглероде, плохо проводит электрический ток и тепло. Рассмотрим аллотропные соединения серы. Химия выделяется следующие их виды: ромбическая, пластическая и моноклинная.
Первая представлена кристаллами в виде октаэдров, она характерна для природного вещества. Температура плавления — 113⁰, плотность составляет 2,07 г/см3. Чтобы получить порцию моноклинной серы, требуется расплавить вещество, а затем медленно его охлаждать.
Образуются кристаллы в виде иголок, темно-желтого цвета, сохраняющие свои свойства (температура плавления 119⁰, плотность – 1,96 г/см3) только при температуре, выше 96°.

Если же вещество продолжает остывать, оно переходит в ромбическую модификацию. Существует еще одна форма – аморфная, коричневого цвета, пластическая сера. Внешне она очень похожа на резину, может принимать любую форму и даже растягиваться в виде нитей. Получают вещество, струей выливая расплавленную серу в холодную воду.
Находясь длительное время на воздухе, она затвердевает и теряет пластичность, становясь ромбической формой. Для серы характерно не только твердая или жидкая фаза, но и газообразное состояние. Так, при температуре 444,6⁰ она кипит и переходит в пар темно-коричневого цвета.
При резком его охлаждении появляется серный цвет – порошок, состоящий из чешуйчатых мелких кристаллов серы.
Строение молекулы
Твердая ромбическая сера имеет молекулы, состоящие из восьми атомов. Они соединены между собой ковалентными неполярными связями, образуя кольцевидную структуру, которая в период нагревания разрушается.
Вещество будет иметь вид обрывков цепей с частицами S, образуется полимерная структура со свойствами резины. Пары серы можно представить как систему, в которой устанавливается химическое равновесие между молекулами, содержащими различное количество атомов серы: два, четыре, шесть или восемь.
Существование различных физических форм серы можно объяснить строением ее молекул.

Кислородные соединения серы
Формула оксида химического элемента S зависит от того, какую степень окисления имеет в нем атом серы. Например, SO2 – это диоксид серы, проявляющей степень окисления +4.
Это газообразное вещество бесцветно и обладает удушливым резким запахом. Уже при температуре -10° оно переходит в жидкую фазу. В химических процессах ведет себя, как восстановитель.
Сернистый ангидрид получают несколькими способами, например, сжигая серу:
- S + O2 → SO2 + Q
- Сернистый газ можно также добыть в реакции меди с концентрированной сульфатной кислотой при нагревании:
- Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Промышленный способ получения диоксида серы заключается в сжигании пирита или других серосодержащих минералов, например, свинцового блеска или цинковой обманки. Соединение используют как основное сырье в производстве сульфатной кислоты.

Трехокись серы
Продолжая рассматривать кислородные соединения серы, остановимся на серном ангидриде. Это жидкость без цвета, при температуре ниже +17⁰ она переходит в твердые кристаллы. Проявляет сильные гигроскопические свойства, и, поглощая пары воды, превращается в серную кислоту:
SO3 + H2O → H2SO4
Хранят серный ангидрид в герметически закрытых емкостях, обычно это — запаянные колбы. Вещество имеет свойства кислотного оксида и является промежуточным продуктом в сульфатном производстве.
Сероводород и соли сульфидной кислоты
В состав компонентов вулканических газов и минеральных источников часто входят молекулы H2S. Водородное соединение серы — сероводород – газ с запахом тухлых яиц, ядовит, хорошо растворим в воде.
Он является продуктом распада белковых веществ, присутствующих в растительных и животных организмах. Газ получают в лаборатории под вытяжкой из водорода и серы, нагревая смесь исходных реагентов.
Более распространенным способом получения сероводорода в лабораторных условиях является действие разбавленной хлоридной или сульфатной кислоты на сульфид железа.

В производственных технологиях, идущих с образованием сероводорода, необходимо соблюдать правила техники безопасности. Концентрация газа в цехе или другом помещении не должна превышать 0,01 в 1 л воздуха, так как вещество разрушает, прежде всего, нервную систему человека.
Раствор сероводорода в воде называют сульфидной кислотой, она является слабым электролитом и образует два вида солей: сульфиды и гидросульфиды.
Соединения серы, в состав которых входят атомы щелочных и щелочноземельных металлов, а также практически все кислые соли, хорошо растворимы в воде.
Чтобы определить присутствие в растворе свободных ионов S2-, проводят качественную реакцию с растворимыми солями, содержащими ион свинца. Выпадение осадка сульфида свинца черного цвета указывает на то, что исследуемое вещество является сульфидной кислотой или ее солью.

Получают сульфиды, пропуская H2S через раствор сульфата соответствующего металла. Большинство средних солей имеют характерную окраску: например, сульфид марганца – розовую, соли свинца или меди – черную, сульфид кадмия – желтую. Эта особенность используется в аналитической химии для анализа катионов.
Сульфатная кислота
Какое соединение серы является наиболее важным в химии? Конечно же, это сульфатная кислота. Она является много тоннажным продуктом химического производства и востребована в большинстве сфер человеческой деятельности.
Серную кислоту применяют при очистке нефтепродуктов, в производстве минеральных удобрений, пластмасс, красителей, лекарственных средств, а также в сельском хозяйстве. Технология получения H2SO4 состоит из трех стадий: получение диоксида серы выжиганием пирита, окисление его до серного ангидрида, поглощение его концентрированной серной кислотой и образование олеума.
Его разбавляют водой и получают сульфатную кислоту заданной концентрации. Хранят ее в специальных стальных цистернах, которые можно перевозить к месту дальнейшего использования.
Источник: https://www.syl.ru/article/376531/soedineniya-seryi-svoystva-i-primeryi
Сера
Типичный неметалл – сера – относится к группе халькогенов и находится в VI группе периодической таблицы Менделеева. Сера – один из жизненно важных элементов, входящих в состав живых организмов.

Сера – 16 элемент периодической таблицы, находящийся в VI группе, главной подгруппе и в третьем периоде. Формула серы – S. Относительная атомная масса – 32.
Ядро атома серы имеет положительный заряд +16. Вокруг ядра располагается 16 отрицательно заряженных электронов на трёх энергетических уровнях.
Электронное строение атома серы – 1s22s22p63s23p4. На внешнем энергетическом уровне находится шесть валентных электронов. До завершения р-орбитали не хватает двух электронов, поэтому степень окисления серы -2.
В соединениях проявляет себя как окислитель, отнимая электроны. Однако возможность переходить в возбуждённое состояние за счёт свободных d-орбиталей даёт элементу две дополнительные степени окисления – +4 и +6.
Рис. 1. Строение атома серы.
Известно четыре стабильных изотопа серы, находящиеся в природе. Это 32S, 33S, 34S, 36S. Кроме того, искусственно получено 20 радиоактивных изотопов серы.
Сера – хрупкое кристаллическое вещество желтоватого цвета. При нагревании плавится, превращаясь в жидкость жёлтого цвета. При увеличении температуры до 200°С становится вязкой тёмно-коричневой массой, напоминающей смолу.
Основные физические свойства элемента:
- отсутствие растворимости в воде, в том числе в составе сложных веществ;
- плавучесть в воде (не смачивается);
- плохая проводимость тепла и электричества;
- хорошая растворимость в органических растворителях (феноле, бензоле, сероуглероде);
- диссоциация на атомы происходит при температуре 1500°С;
- температура кипения – 444,6°С.
Сера образует аллотропные модификации, которые отличаются физическими свойствами. Краткое описание модификаций приведено в таблице.
| Вид | Формула | Температура плавления, °С | Плотность, г/см3 | Особенности |
| Ромбическая | S8 | 113 | 2,07 | Наиболее устойчивая модификация |
| Моноклинная | S8 | 119 | 1,96 | Устойчива при температуре 96°С и более. В обычных условиях превращается в ромбическую |
| Пластическая | Sn | 119 | 1,96 | Коричневая вязкая масса. Полимер. Неустойчива, самопроизвольно превращается в ромбическую |
Рис. 2. Аллотропные модификации серы.
В зависимости от реакции сера проявляет разную степень окисления:
- -2 – в реакциях с металлами и неметаллами (Al2S3, SiS2, Na2S);
- +4 – в реакциях с галогенами и кислородом (SCl4, SBr4, SF4, SO2);
- +6 – в реакциях с элементами, имеющими большую электроотрицательность (H2SO4, SF6, SO3).
Сера – активное вещество, образующее кислоты, соли, оксиды. Общие химические свойства элемента приведены в таблице.
| Реакция | Описание | Уравнение |
| С металлами | В обычных условиях реагирует только с активными металлами. С остальными реакция протекает при нагревании. С золотом и платиной не реагирует. Образуются сульфиды |
|
| С неметаллами | С водородом реагирует при 150-200°С, с кислородом – при 280-360°С. С фосфором и углеродом реагирует в отсутствии воздуха при нагревании. Реакция с фтором протекает в присутствии катализатора |
|
| С кислотами | Проявляет свойства восстановителя | S + 2HNO3 → 2NO + H2SO4 |
| Диспропорционирование | Реакция со щёлочью образует сульфиды и сульфиты | 3S + 6KOH → K2S+4O3 + 2K2S-2 + 3H2O |
В природе сера находится в составе минералов, горных пород, полезных ископаемых. Например, в составе гипса (CaSO4⋅2H2O), пирита (FeS2), глауберовой соли (Na2SO4⋅10H2O). Серу как продукт метаболизма вырабатывают некоторые бактерии. Сера присутствует в составе белков.
Рис. 3. Самородная сера.
Из урока химии 9 класса узнали об особенностях строения и свойствах серы. Это 16 элемент периодической таблицы, содержащий шесть валентных электронов. Сера проявляет три степени окисления – +4, +6, -2.
Элемент образует три модификации – ромбическую, моноклинную, пластическую серу. Реагирует с металлами, неметаллами, кислотами и щелочами. Соли серы с металлами называются сульфидами. Сера входит в состав живых организмов.
В природе находится в составе минералов.
Средняя оценка: 4.6. Всего получено оценок: 214.
Источник: https://obrazovaka.ru/himiya/sera-formula-9-klass.html
Соединения серы (II). Сероводород и сульфиды
Все водородные соединения подгруппы серы имеют молекулярную структуру и ковалентную полярную связь.
Химическое строение молекул H2S аналогично строению молекул Н2O: (угловая форма)
Но, в отличие от воды, молекулы H2S малополярны; водородные связи между ними не образуются; прочность молекул значительно ниже.
Физические свойства
При обычной температуре H2S — бесцветный газ с чрезвычайно неприятным удушливым запахом тухлых яиц, очень ядовитый (при концентрации > 3 г/м3 вызывает смертельное отравление). Сероводород тяжелее воздуха, легко конденсируется в бесцветную жидкость.H2S растворим в воде (при обычной температуре в 1 л H2O растворяется — 2,5 л газа).
Сероводород в природе
H2S присутствует в вулканических и подземных газах, в воде серных источников. Он образуется при гниении белков, содержащих серу, а также выделяется в процессе жизнедеятельности многочисленных микроорганизмов.
Способы получения
- 1. Синтез из простых веществ:
- S + Н2 = H2S
- 2. Действие неокисляющих кислот на сульфиды металлов:
- FeS + 2HCI = H2S↑ + FeCl2
3.Действие конц. H2SO4 (без избытка) на щелочные и щелочно-земельные Me:
- 5H2SO4(конц.) + 8Na = H2S↑ + 4Na2SO4 + 4H2О
- 4. Образуется при необратимом гидролизе некоторых сульфидов:
- AI2S3 + 6Н2О = 3H2S↑ + 2Аl(ОН)3↓
Химические свойства H2S
H2S — сильный восстановитель
Взаимодействие H2S с окислителями приводит к образованию различных веществ (S, SО2, H2SO4),
Реакции с простыми веществами окислителями
- Окисление кислородом воздуха
- 2H2S + 3О2(избыток) = 2SО2↑ + 2Н2О
- 2H2S + О2(недостаток) = 2S↓ + 2Н2О
- Окисление галогенами:
- H2S + Br2 = S↓ + 2НВr
Реакции с окисляющими кислотами (HNО3, H2SO4(конц.)
- 3H2S + 8HNО3(разб.) = 3H2SO4 + 8NO + 4Н2О
- H2S + 8HNО3(конц.) = H2SO4 + 8NО2↑ + 4Н2О
- H2S + H2SO4(конц.) = S↓ + SО2↑ + 2Н2О
Реакции с солями — окислителями
- 5H2S + 2KMnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8Н2О
- 5H2S + 6KMnO4 + 9H2SO4 = 5SО2 + 6MnSO4 + 3K2SO4 + 14Н2О
- H2S + 2FeCl3 = S↓ + 2FeCl2 + 2HCl
Водный раствор H2S проявляет свойства слабой кислоты
- Сероводородная кислота H2S 2-основная кислота диссоциирует ступенчато
- 1-я ступень: H2S → Н+ + HS-
- 2-я ступень: HS- → Н+ + S2-
- Для H2S в водном растворе характерны реакции, общие для класса кислот, в которых она ведет себя как слабая кислота.
Взаимодействует:
- а) с активными металлами
- H2S + Mg = Н2↑ + MgS
- б) с малоактивными металлами (Аg, Си, Нg) в присутствии окислителей
- 2H2S + 4Аg + O2 = 2Ag2S↓ + 2Н2O
- в) с основными оксидами
- H2S + ВаО = BaS + Н2O
- г) со щелочами
- H2S + NaOH(недостаток) = NaHS + Н2O
- д) с аммиаком
- H2S + 2NH3(избыток) = (NH4)2S
Особенности реакций H2S с солями сильных кислот
- Несмотря на то, что сероводородная кислота — очень слабая, она реагирует с некоторыми солями сильных кислот, например:
- CuSO4 + H2S = CuS↓ + H2SO4
- Реакции протекают в тех случаях, если образующийся сульфид Me нерастворим не только в воде, но и в сильных кислотах.
Качественная реакция на сульфид-анион
- Одна из таких реакций используется для обнаружения анионов S2- и сероводорода:
- H2S + Pb(NO3)2 = 2HNO3 + PbS↓ черный осадок.
- Газообразный H2S обнаруживают с помощью влажной бумаги, смоченной раствором Pb(NO3)2, которая чернеет в присутствии H2S.
Сульфиды
Сульфидами называют бинарные соединения серы с менее ЭО элементами, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
Наибольшее значение имеют сульфиды металлов, поскольку многие из них представляют собой природные соединения и используются как сырье для получения свободных металлов, серы, диоксида серы.
Обратимый гидролиз растворимых сульфидов
- Сульфиды щелочных Me и аммония хорошо растворимы в воде, но в водном растворе они подвергаются гидролизу в очень значительной степени:
- S2- + H2O → HS- + ОН-
- Поэтому растворы сульфидов имеют сильнощелочную реакцию
- Сульфиды щелочно-земельных Me и Mg, взаимодействуя с водой, подвергаются полному гидролизу и переходят в растворимые кислые соли — гидросульфиды:
- 2CaS + 2НОН = Ca(HS)2 + Са(ОН)2
- При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
- HS- + H2O → H2S↑ + ОН-
Необратимый гидролиз сульфидов
- Сульфиды некоторых металлов подвергаются необратимому гидролизу и полностью разлагаются в водных растворах, например:
- Al2S3 + 6H2O = 3H2S↑ + 2AI(OH)3↓
- Аналогичным образом разлагаются Cr2S3, Fe2S3
Нерастворимые сульфиды
- Большинство сульфидов тяжелых металлов в воде практически не растворяются и поэтому гид
ролизу не подвергаются. Некоторые из них растворяются под действием сильных кислот, например: - FeS + 2HCI = FeCl2 + H2S↑
- ZnS + 2HCI = ZnCl2 + H2S↑
- Сульфиды Ag2S, HgS, Hg2S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
Окислительный обжиг сульфидов
- Окисление сульфидов кислородом воздуха при высокой температуре является важной стадией переработки
сульфидного сырья. Примеры: - 2ZnS + 3O2 = 2ZnO + 2SO2
- 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
Способы получения сульфидов
- 1. Непосредственное соединение простых веществ:
- Fe + S = FeS
- 2.Взаимодействие H2S с растворами щелочей:
- H2S + 2NaOH = 2H2O + Na2S сульфид натрия
- H2S + NaOH = H2O + NaHS гидросульфид натрия
- 3.Взаимодействие H2S или (NH4)2S с растворами солей:
- H2S + CuSO4 = CuS↓ + H2SO4
- H2S + 2AgNO3 = Ag2S↓ + 2HNO3
- 4. Восстановление сульфатов прокаливанием с углем:
- Na2SO4 + 4С = Na2S + 4СО
- Этот процесс используют для получения сульфидов щелочных и щелочно-земельных металлов.
Источник: http://examchemistry.com/content/lesson/neorgveshestva/serovodorod.html




