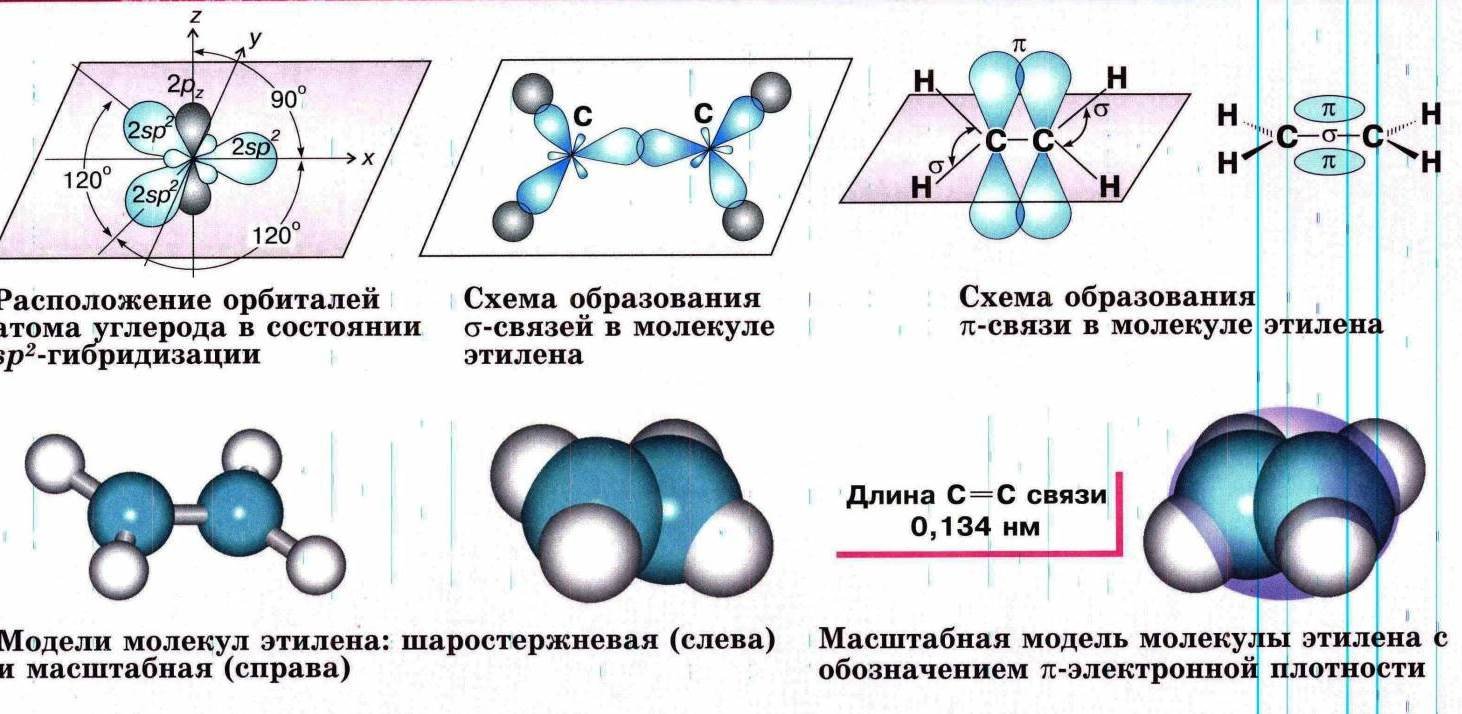
Атомы углерода между которыми имеется двойная связь находятся в состоянии sp2-гибридизации. В гибридизации принимают участие одна σ- и две π-орбитали, а одна π-орбиталь остается негибридизированной. При перекрывании гибридных орбиталей образуется σ-связь, а образование второй π-связи происходит при перекрывании негибридных π-орбиталей соседних атомов.


- Образование двойной связи в молекулах алкенов
По своей природе π-связь резко отличается от σ-связи. π-Связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы. Под действием реагентов π-связь легко разрывается и переходит в две новые σ-связи посредством присоединения по месту двойной связи двух атомов или групп атомов реагирующих веществ.
- Молекула этилена плоская, а электронная плотность π-связи расположена над и под этой плоскостью.
- Электронные орбитали атомов углерода в молекуле этилена
Также π-связывание двух атомов углерода приводит к тому, что уменьшается расстояние между ядрами, т.к. двойная связь является сочетанием σ- и π-связей. Длина двойной связи составляет 0,134 нм.
- Три σ-связи атома углерода направлены к вершинам треугольника с атомом С в центре, угол между связями 120о.
- Строение молекулы этилена C2H4




- Вращение атомов вокруг двойной связи невозможно без ее разрыва.

- Модели молекул этилена
В молекуле пропилена СН2=СН–СН3 в одной плоскости лежат 6 атомов: два sp2-атома углерода и четыре связанные с ними атома (3 атома Н и атом С группы СН3). Вне этой плоскости находятся атомы водорода в метильной группе СН3, имеющей тетраэдрическое строение, т.к. этот атом углерода sp3-гибридизован.

- Аналогичное строение имеют и другие алкены.
- Алкены (непредельные углеводороды)
Источник: https://himija-online.ru/organicheskaya-ximiya/alkeny/stroenie-alkenov.html
Алкены — номенклатура, получение, характерные химические свойства
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены).
Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома).
Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов.
Строение алкенов
Алкены — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n. Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел.

Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр2-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей
соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.

Строение этилена

Образование двойной связи в алкенах
Гомологический ряд этена
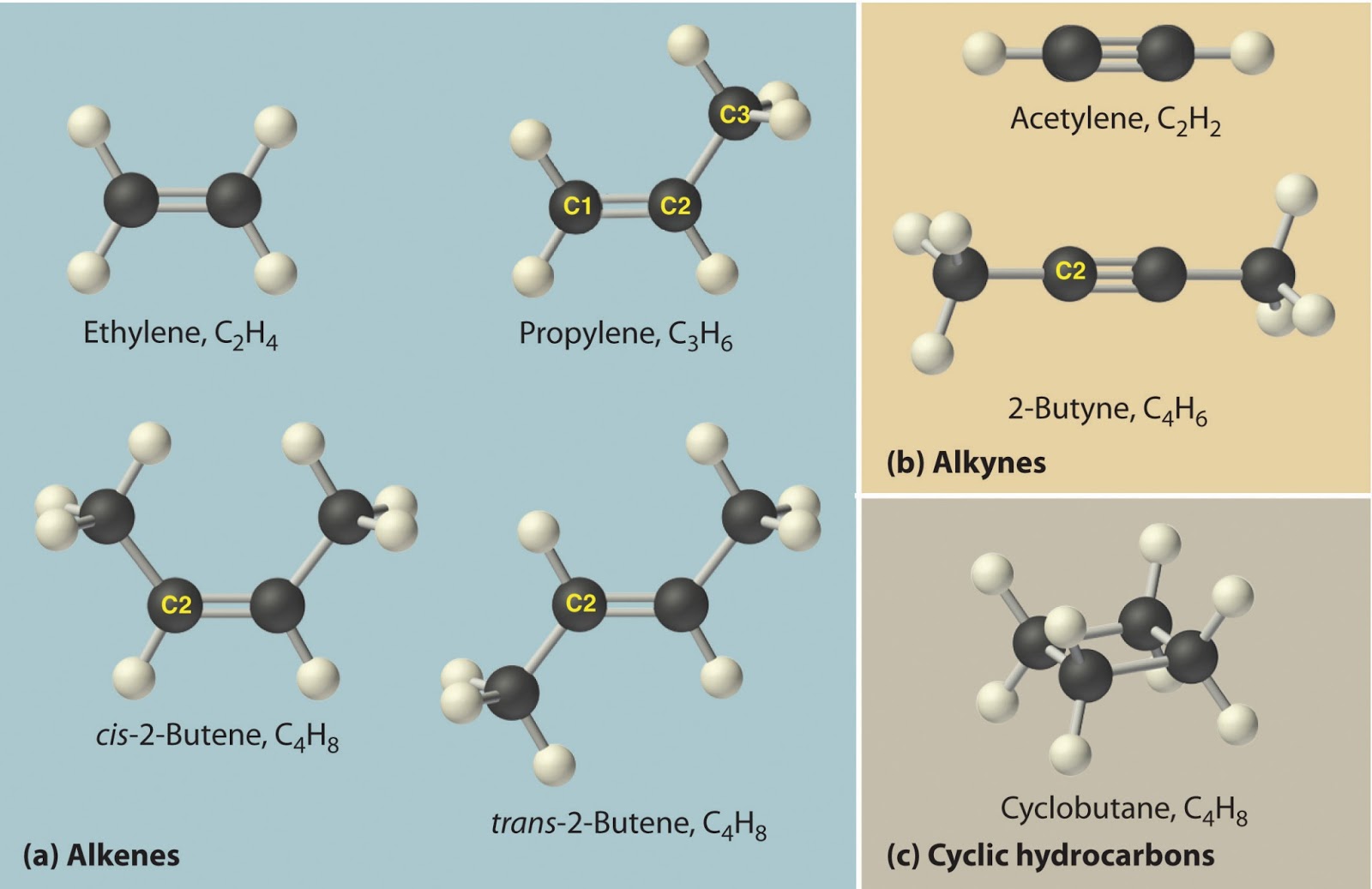
Неразветвленные алкены составляют гомологи- ческий ряд этена (этилена): С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен, С7Н14 — гептен и т.д.
Изомерия алкенов
Для алкенов характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:

Особым видом структурной изомерии является изомерия положения двойной связи:
- Алкены изомерны циклоалканам (межклассовая изомерия), например:

Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис- и транс-изомерии.


Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π -связи, а следовательно, и свойствами.
Номенклатура алкенов
1. Выбор главной цепи. Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Например,правильное название соединения:
![]()
5-метилгексен-2
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.

3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс -ен, обозначающий принадлежность соединения к классу алкенов. Например:
Физические свойства алкенов
Первые три представителя гомологического ряда алкенов — газы; вещества состава С5Н10 — С16Н32 — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства алкенов
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения.
Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов.
Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (СС14) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.
3. Гидрогалогенирование (присоединение галогеноводорода).
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
Эта реакция присоединения протекает по свободнорадикальному механизму.
Реакции окисления.
1. Горение. Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
2. Окисление в растворах. В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Источник: http://himege.ru/alkeny-nomenklatura-poluchenie-xarakternye-ximicheskie-svojstva/
Алкены
Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2. Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.

Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
- Дегидрирование алканов
- Дегидрогалогенирование галогеналканов
- Дегалогенирование дигалогеналканов
- Внутримолекулярная дегидратация спиртов
В результате крекинга нефти образуется один алкан и один алкен. C12H26 → C6H12 + C6H14
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный. CH3-CH3 → (t, кат) CH2=CH2 + H2 
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода. 
В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь. 
При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен. Внутримолекулярная дегидратация спиртов происходит при t > 140 °C. 
Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Гидратация
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь). 
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу. Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы. 
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения. Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода. 
Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа — к наименее гидрированному. 
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном окислении образуются окиси. Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2. В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной связи.
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров. Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
Источник: https://studarium.ru/article/183
План — -конспект урока по химии на тему "Алкены.Состав, строение, номенклатура, получение." (10 класс)
Урок № 13
Дата: 13.10.2015г.
Тема: Алкены. Этилен, его получение.
Цель урока: дать уч-ся представление о непредельных углеводородах, о ненасыщенной (кратной) связи; о строении молекулы этилена – первого представителя ряда алкенов, о физических свойствах веществ этого ряда, их номенклатуре и изомерии.
Задачи урока:
-
дать уч-ся представление о гомологическом ряде алкенов.
-
дать представление о строении молекул алкенов на примере первого представителя этого ряда – этилене, о физических свойствах веществ ряда этилена.
-
дать уч-ся представление о видах изомерии, присущих для алкенов: структурной и пространственной.
-
научить уч-ся составлять формулы изомеров алкенов, используя знания о видах изомерии алкенов.
-
научить уч-ся составлять названия изомеров алкенов.
Оборудование: шаро – стержневые модели молекул алкенов, СД «Кирилли и Мефодий. Химия 10 класс», табл. «Строение молекулы этилена».
Ход урока: I. Анализ контрольной работы.
II. Новый материал.
-
Дать уч-ся понятие ненасыщенной связи, кратной связи. Дать понятие «непредельные углеводороды».
Использовать шаро – стержневые модели молекул этилена и пропилена, табл. № 2. Вспомнить с уч-ся уравнение реакции дегидрирования этана:
СН3 – СН3 CH2 = CH2 + H2 |
Дать определение алкенов (стр. 33 учебника).
Алкены, или олефины (от лат. olefiant — масло — старое название, но широко используемое в химической литературе.Поводом к такому названию послужил хлористый этилен, полученный в XVIII столетии, — жидкое маслянист вещество.) — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь.
Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными.
Этилен.Этен.
- Н2С=СН2 молекула плоская , валентный угол 1200
- II валентное состояние
- 1.SP2— гибридизация

2. π , ϭ –связь3.валентный угол=1200
- 4.Есвязи (С=С)=620 кДж
- Есвязи (С-С)=620-350=270 кДж
- 5.межъядерное расстояние 1,34 А0(или нм)
-
Строение молекул алкенов:
CnH2n – общая формула, где n больше или равно 2.
Задание классу: составить формулы алкенов, если n = 2,3,4,5,6
-
Гомологический ряд этилена и номанклатура алкено:
- Принадлежность углеводорода к классу алкенов отражают родовым суффиксом — ен (или — илен)в его названии.
- С2Н4 СН2=СН2 этен, этилен (-СН2=СН2 винил — радикал)
- С3Н6 СН2=СН-СН3 пропен, пропилен
- С4Н8 СН2=СН-СН2-СН3 бутен, бутилен
- С5Н10 СН2=СН-СН2-СН2-СН 3 пентен, амилен
- Особенности построения названий алкенов состоят в том, что главная цепь атомов углерода должна обязательно включать двойную связь С = С, и её нумерацию проводят с того конца главной цепи, к котрому эта связь ближе. В названии углеводорода, окнчивающегося на — ен, цифрой указывают номер того атома углерода, от которого начинается двойная углерод – углеродная связь:
- 1 2 3 4 1 2 3 4
![]()
4. Изомерия алкенов.
Структурная изомерия
1.изомерия углеродного скелета

2.изомерия положения двойной связи
![]()
3.межклассовая изомерия с циклоалканами

- Пространственная изомерия алкенов
- цис-транс-изомерия
- Причина-неподвижность атома углерода при двойной связи

ВНИМАНИЕ! Цис-транс- изомерия не проявляется, если хотя бы один из атомов С при двойной связи имеет 2 одинаковых заместителя. Например,
бутен-1 СН2=СН–СН2–СН3 не имеет цис- и транс-изомеров, т.к. 1-й атом углерода связан с двумя одинаковыми атомами водорода.
Изомеры цис- и транс- отличаются не только физическими, но и химическими свойствами, т.к.
сближение или удаление частей молекулы друг от друга в пространстве способствует или препятствует химическому взаимодействию. Иногда цис-транс-изомерию не совсем точно называют геометрической изомерией.
Неточность состоит в том, что все пространственные изомеры различаются своей геометрией, а не только цис- и транс-изомеры.
-
Физические свойства алкенов
Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) — газы, начиная с C5H10 (амилен, или пентен-1) — жидкости, а с С18Н36 — твердые вещества.
С увеличением молекулярной массы повышаются температуры плавления и кипения. Алкены нормального строения кипят при более высокой температуре, чем их изомеры, имеющие изостроение.
Температуры кипения цис-изомеров выше, чем транс-изомеров, а температуры плавления — наоборот.
Алкены плохо растворимы в воде (однако лучше, чем соответствующие алканы), но хорошо — в органических растворителях. Этилен и пропилен горят коптящим пламенем.
6. Получение алкенов
1. Крекинг алканов: Основным промышленным источником получения первых четырех членов ряда алкенов (этилена, пропилена, бутиленов и пентиленов) являются газы крекинга и пиролиза нефтепродуктов, а также газы коксования угля (этилен, пропилен).
Газы крекинга и пиролиза нефтепродуктов содержат от 15 до 30% олефинов.
Так, крекинг бутана при 600°С приводит к смеси водорода, метана, этана и олефинов – этилена, пропилена, псевдобутилена (бутена-2) с соотношением олефинов ≈ 3,5 : 5 : 1,5 соответственно.
- CnH2n+2 —t, (400-700) → CnH2n+2 + CnH2n
- алканалкен
- 2. Дегидрирование алканов:
- CnH2n+2 — t, kat-Niили (Cr2O3)→ CnH2n +H2
- 3. Гидрирование алкинов:
- CnH2n-2 + H2 — t, kat-(Pt или Pd, Ni) → CnH2n
- Получение в лаборатории
- 1. Дегидратация* спиртов:
- R-CH2-CH2-OH —t>140°C, H2SO4(конц.)→ R-CH=CH2 + H2O
*Правило А. М. Зайцева:
- Отрыв атома водорода происходит от наименее гидрогенизированного атома углерода.
- 2. Дегидрогенирование* моногалогеналканов (по правилу Зайцева)
- R-CH2-CH2-Г +NaOH —спиртовой раствор, t→R-CH=CH2+NaГ+H2O
- 3. Дегалогенированиедигалогеналканов:
- R-CH(Г)-CH2(Г) + Zn— t, NaOH спирт.раствор → R-CH=CH2 + ZnГ2
- Закрепление:
-
Что такое алкены?
-
Какова общая формула алкенов, чему равна min n в этой формуле?
-
Дать сравнительную характеристику строения молекул алканов и алкенов.
-
Каковы физические свойства алкенов?
-
Какие виды изомерии характерны для алкенов?
-
Как получают этилен в промышленности?
- 2. Индивидуальные задания:
- 1) из списка веществ выбрать алкены: C2H2, C3H6, C2H4, C6H6, C8H16, C5H12, C4H8
- 2) составить молекулярные и свёрнутые структурные формулы гомологов этилена, если n= 3,4,5,6.
- 3) решить задачу: определить молекулярную и составить структурную формулы алкена, если известно, что массовая доля углерода в нём составляет 85,7%, относительная плотность вещества по водороду равна 21. (пропен)
- 4) составить и назвать все возможные изомеры для вещества состава С4Н8.
- Самостоятельная работа по теме.
- 1 Вариант
-
Из предложенного ряда веществ выбрать алкены, назвать их:
C2H2 , C2H6 , C4H10, C6H6, C2H4, C6H12, C3H4, C4H8.
-
гидратации;
-
галогенирования;
-
полимеризации?
-
Составить и назвать алкены, если n = 3; 5; 6; 8; 2.
-
Что такое реакция:
-
гидрирования;
-
гидрогалогенирования;
-
окисления? Какие виды окисления органических веществ вы знаете?
Домашнее задание:
пар. 4 стр. 33 – 35, записи в тетради, стр. 41 вопр. 1,2,3, упр. 4; упражнение в тетради: составить и назвать все возможные изомеры для вещества состава С5Н10.
Источник: https://infourok.ru/plan-konspekt-uroka-po-himii-na-temu-alkenisostav-stroenie-nomenklatura-poluchenie-klass-775072.html
Свойства алкенов | Дистанционные уроки
Когда мы говорили об алканах, упоминалась насыщенная связь. У алкенов эта связь ненасыщенная, двойная связь — этим определяются все свойства алкенов. Эта связь видоизмененных (= гибридизированных) орбиталей:
Sp² — гибридизация

Получается, что по двойной связи молекула имеет плоскость. Радикалы при двойной связи будут располагаться по обе стороны от этой плоскости.
- Общая формула алкенов:
- CnH2n
- n = числу атомов углерода.
- Номенклатура алкенов строится из двух частей.
Первая часть «говорит» о количестве атомов углерода, вторая — о связи -С=С-. У алкенов вторая часть всегда имеет окончание -ен.
По правилам номенклатуры ИЮПАК:
- в качестве основной цепи выбирается та, в которой находится двойная связь, не зависимо от ее размера,
- нумерация идет с того конца, к которому ближе двойная связь
- после окончания -ен ставится номер атома, после которого идет двойная связь.
Соответственно, существует 3 вида изомерии алкенов:
- Структурная
- Пространственная
- Межклассовая
- Структурная изомерия алкенов: ну, во первых, можно по цепи двигать двойную связь — изомерия положения двойной связи:

- во-вторых, изомерия положения радикалов:

- Пространственная изомерия: это положение одинаковых радикалов при двойной связи либо по одну, либо по разные стороны от плоскости двойной связи: цис- транс-изомерия:

- Межклассовая изомерия алкенов: по общей формуле — СnH2n алкены изомерны циклоалканам.

- Химические свойства алкенов:
- Двойная ненасыщенная связь обуславливает такие свойства алкенов, как реакции присоединения — π- связь разрывается и образуется одинарная — алкены превращаются в алканы.
- Реакции присоединения:
- СH2=CH-CH3 + H2 → CH3-CH2-CH3
- CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3 — качественная реакция на алкены — обесцвечивание бромной воды.
- Присоединение по правилу Марковникову:
водород присоединяется к наиболее гидрогенезированному (= к тому, у которого больше водородов) атому углерода при двойной связи:
СH2=CH-CH3 + HCl = CH3-CHCl-CH3
- Окисление алкенов:
- В нейтральной (или слабощелочной среде:
СH2=CH2 → CH2(OH) — CH2(OH) — схематичное уравнение
3СH2=CH2 + 2KMnO4 + 4H2O = 3C2H4(OH)2 + 2MnO2 + 2KOH — полное уравнение - В кислой среде — идет разрыв двойной связи:
R-СH=CH-R → 2R-COOH — схематичное уравнение - полное сгорание: С2H4 + 3O2 = 2CO2 + 2H2O
- В нейтральной (или слабощелочной среде:
- Реакция полимеризации:
n СH2=CH2 → n(-CH2-CH2-)
Получение алкенов:
Алкены получают двумя способами:
- Гидрирование алкинов: C2H2 + H2 = C2H4
- из производных алканов: дегидрирование, дегалогенирование, дегидрогалогенирование и т.д.
- в ЕГЭ это вопрос А13 и А14 — Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Обсуждение: «Свойства алкенов»
(Правила комментирования)
Источник: https://distant-lessons.ru/ximiya/alkeny
Алкены
Алкены – это ненасыщенные органические соединения, которые состоят из углерода и водородных атомов, по крайней мере с одной двойной связью в углеродной цепи. Рассмотрим строение алкенов и особенности образования двойной связи.
Строение алкенов Общая молекулярная формула нециклических алкенов — CnH2n, циклических алкенов — CnH2n-2 где n равняется любому целому числу, больше единицы. Полярность молекулы алкена, за счет наличия двойной связи выше, по сравнению с алканами.
В алкенах одна s-орбиталь и…
Подробнее >>
Способы получения и свойства алкенов имеют существенные отличия по сравнению с алканами. Двойная связь в составе углеродной цепи алкенов очень реакционноспособна, поэтому они охотно вступают в реакции присоединения, в отличие от алканов, для которых характерны реакции замещения.
Далее подробно рассмотрим способы получения, физические и химические свойства алкенов. Физические свойства алкенов Физические свойства алкенов, такие как температура плавления и кипения немного ниже температуры кипения соответствующих алканов.
Первые представители данного класса с C1по…
Подробнее >>
Алкадиены – это ненасыщенные органические соединения, в углеродной цепи которых содержатся две двойные связи. Рассмотрим строение алкадиенов, способы расположения двойных связей.
Общая молекулярная формула нециклических алкадиенов — CnH2n-2, циклических алкенов — CnH2n-4 где n равняется любому целому числу, больше трех.
Расположение двойных связей Двойные связи в алкадиенах могут располагаться несколькими способами: Двойные связи примыкают к одному атому углерода – кумулированные связи: между двумя двойными связями расположена одна одинарная связь —сопряженные связи: двойные…
Подробнее >>
Химические и физические свойства алкадиенов, а также способы их получения аналогичны со свойствами алкенов. Однако для алкадиенов существует ряд отличительных свойств и способов получения.
Химические и физические свойства алкадиенов Физические свойства алкадиенов Низшие члены гомологического ряда представляют собой газообразные вещества с низкими температурами кипения и плавления.
С увеличением молекулярной массы наблюдается тенденция к увеличению этих показателей и переход к жидкому состоянию. Алкадиены нерастворимы в воде, хорошо растворимы в большинстве органических…
Подробнее >>
В наше время почти любая область жизнедеятельности предполагает применение каучука. Это производство шин, кабеля, труб, строительный и отделочный материал, его используют в обувной, медицинской и других областях промышленности.
Но что же такое «каучук», каковы виды каучука и как его получают? Еще в конце 15 века индейцы Северной Америки из сока дерева гевеи научились получать каучук, который использовали при изготовлении обуви и других вещей.
При надрезе коры гевеи происходило выделение капель…
Подробнее >>
В настоящем разделе представлены задания с решениями на изомерию и номенклатуру Алкенов и алкадиенов, способы их получения, а также химические свойства данных классов соединений.
1) Напишите графические формулы следующих алкенов: а) 3-этилгексен-1; б) 3-этил-2-метилоктен-4; в) 3-пропилгептен-1; г) 2-метил-3-пропилгептен-1; д) 5,6-диметил-4-пропилгептен-2; е) 2-метил-6-вторбутил-4-неопентил-2-децен.
Показать решение » 2) Напишите графические формулы следующих алкадиенов: а) 2,3-гексадиен; б) 1,3,5-гексатриен; в) 2,4-диметилпентадиен-1,4; г) 2,3-диметилбутадиен-1,3 д) 5-метилгексадиен-1,3; е) 4-метилоктадиен-1,4. Показать решение » 3) Какие соединения образуются…
Подробнее >>
Источник: http://zadachi-po-khimii.ru/organic-chemistry/alkeny
алкены и 2 "несправедливых" правила
(непредельные углеводороды)
Суффикс -ен является характерным для названия всех алкенов
Каждый атом углерода в молекулах алканов находится в состоянии Sp2-гибридизации. Тип углеродной связи — σ-связи и π-связи (см. Неорганическую химию)
- σ-Связь возникает при осевом
перекрывании sp2-гибридных орбиталей, - π-связь – при боковом
перекрывании р-орбиталей соседних sp2-гибридизованных атомов углерода
σ-Связи, образуемые sp2-гибридными
орбиталями, находятся в одной плоскости под углом 120°. Поэтому молекула
этилена имеет плоское строение:
Общая формула алканов: СnH2n
Гомологический ряд алкенов:
Для простейших алкенов применяются также исторически сложившиеся названия: этилен(этен), пропилен (пропен), бутилен (бутен-1), изобутилен (2-метилпропен) и т.п.
С2Н4 — этен, этиленС3Н6 — пропен, пропиленС4Н8 — бутенС5Н10 — пентенС6Н12 — гексен
Номенклатура алкенов
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на–ен:
2 атома С → этан → этен;
3 атома С → пропан → пропен и т.д.
- Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной).
- Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен. Например:
Названия некоторых одновалентных радикалов алкенов:
Изомерия:
- изомерия углеродного скелета (структурная)
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис-изомере, либо по разные стороны в транс-изомере
по общей формуле СnH2n алкены изомерны циклоалканам
Химические свойства:
- Алкены вступают во всевозможные реакции присоединения:
Присоединение против правила Марковникова отмечается в случаях, когда
заместитель при двойной связи оттягивает электронную плотность на себя,
т.е. проявляет электроноакцепторные свойства .
Трихлорпропен Сl3C-CH=CH2 — в этом соединении аж 3атома Сl оттягивают электронную плотность на ебя! Поэтому при взаимодействии с HХ водород
присоединяется к менее гидрогенизированному атому углерода, а Х – к более
гидрогенизированному.
-
- Мягкое окисление алкенов водным раствором перманганата калия:
Для ЕГЭ надо писать, конечно, полное уравнение ОВР методом полуреакции.Как его писать? обсудим… ?
Обесцвечивание раствора перманганата калия — тоже качественная реакция на алкены!!!- При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
- Ну и полное окисление (горение):
III. Дегидратация спиртов при повышенной температуре (выше 140° C)
в присутствии водоотнимающих реагентов
IV. Дегалогенирование дигалогеналканов, имеющих атомы галогена
у соседних атомов углерода, при действии активных металлов :
V. Дегидрирование алканов при 500°С:
Отщепление атома водорода в реакциях дегидрогалогенирования и
дегидратации происходит преимущественно от наименее
гидрогенизированного атома углерода. P.S.
Интересно, кто-нибудь понял, к чему в начале текста была картинка с цветными мешочками? ?
Источник: http://organichimik.blogspot.com/2012/06/2.html
12. Алкены. Гомологический ряд. Номенклатура. Строение. Sp2 – гибридизация. Изомерия. Физические свойства. Способы получения из алканов. Механизм элиминирования. Правило Зайцева
Алке́ны (олефины, этиленовые
углеводороды) —
ациклические непредельные углеводороды,
содержащие одну двойную
связьмежду
атомами углерода,
образующие гомологический ряд с общей
формулой CnH2n
Гомологический
ряд.
| этен (этилен) | C2H4 |
| пропен | C3H6 |
| бутен | C4H8 |
| пентен | C5H10 |
| гексен | C6H12 |
| гептен | C7H14 |
| октен | C8H16 |
| нонен | C9H18 |
| децен | C10H2 |
Простейшим
алкеном является этилен (C2H4).
По номенклатуре IUPAC
названия алкенов образуются от названий
соответствующих алканов заменой
суффикса «-ан» на «-ен»; положение двойной
связи указывается арабской цифрой.
Углеводородные
радикалы, образованные от алкенов имеют
суффикс «-енил».
Тривиальные
названия: CH2=CH— «винил», CH2=CH—CH2— «аллил».
- Атомы
углерода при двойной связи находятся
в состоянии sp²
гибридизации,
и имеют валентный
угол 120°. - Для
алкенов характерны изомерия углеродного
скелета, положения двойной связи,
межклассовая и пространственная. - Физические
свойства
- Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При нормальных условиях алкены с C2H4 до C4H8 — газы; с пентена C5H10 до гексадецена C17H34 включительно — жидкости, а начиная с октадецена C18H36 — твёрдые вещества. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Дегидрирование алканов
Это
один из промышленных способов получения
алкенов
Гидрирование алкинов
Частичное
гидрирование алкинов требует
специальных условий и наличие катализатора
- Двойная
связь является сочетания сигма- и
пи-связей. Сигма- связь возникает при
осевом перекрывании sp2
– орбиталей, а пи-связь при боковом
перекрывании - Правило
Зайцева: - Отщепление
атома водорода в реакциях элиминирования
происходит преимущественно от наименее
гидрогенизированного атома углерода.
13.
Алкены. Строение. sp2
гибридизация, параметры кратной связи.
Реакции электрофильного присоединения
галогенов, галогеноводородов, ,
хлорноватистой кислоты. Гидратация
алкенов. Правило Морковникова. Механизмы
реакций.
- Алке́ны (олефины, этиленовые
углеводороды) —
ациклические непредельные углеводороды,
содержащие одну двойную
связьмежду
атомами углерода,
образующие гомологический ряд с общей
формулой CnH2n - Одна
s-
и 2 p-орбитали
смешиваются и образуются 2 равноценные
sp2-гибридные
орбитали, расположенные в одной плоскости
под углом 120. - Если
связь образуется более чем одной парой
электронов, то она называется кратной. - Кратная
связь образуется в тех случаях, когда
имеется слишком мало электронов и
связывающихся атомов, чтобы каждая
пригодная для образования связи валентная
орбиталь центрального атома могла
перекрыться с какой-либо орбиталью
окружающего атома.
Реакции электрофильного присоединения
В
данных реакциях атакующей
частицей является электрофил.
Галогенирование:
Гидрогалогенирование
Электрофильное
присоединение галогенводородов
к алкенам происходит по правилу
Марковникова
Марковникова
правило:
при присоединении протонных кислот
или воды к
несимметричным алкенам или алкинаматом водорода
присоединяется к наиболее гидрогенизированному
атому углерода
гидрогенизированный
атом углерода – тот атом, к которому
присоединен водород. Наиболее
гидрогенизированный – там где больше
всего Н
- Присоединение хлорноватистой кислоты с образованием хлоргидринов:
Гидратация
Реакция
присоединения воды к
алкенам протекает в присутствии серной
кислоты[21]:
Карбкатион —
частица, в которой на атоме углерода
сосредоточен положительный заряд, атом
углерода имеет вакантную p-орбиталь.
14.
Этиленовые углеводороды. Химические
свойства: реакции с окислителями.
Каталитическое окисление, реакция с
надкислотами, реакция окисления до
гликолей, с разрывом связи углерод-углерод,
озонирование. Вакер-процесс. Реакции
замещения.
- Алке́ны (олефины, этиленовые
углеводороды) —
ациклические непредельные углеводороды,
содержащие одну двойную
связьмежду
атомами углерода,
образующие гомологический ряд с общей
формулой CnH2n - Окисление
- Окисление
алкенов может происходить в зависимости
от условий и видов окислительных
реагентов как с разрывом двойной связи,
так и с сохранением углеродного скелета. - При
сжигании на воздухе олефины дают
углекислый газ и воду. - H2C=CH2 +
3O2 => 2CO2 +
2H2O - CnH2n+
3n/O2 => nCO2 +
nH2O
– общая формула - Каталитическое
окисление
В
присутствии солей палладия этилен окисляется
до ацетальдегида.
Аналогично
образуется ацетон из пропена.
- При действии на алкены сильных окислителей (KMnO4 или K2Cr2O7 в среде Н2SO4) при нагревании происходит разрыв двойной связи:
(кетон)
При
окислении алкенов разбавленным раствором
марганцовки образуются двухатомные
спирты – гликоли (реакция Е.Е.Вагнера).
Реакция протекает на холоде.
| 3H2C=CH2 + 2KMnO4 + 4H2O ® 3 | CH2−CH2(этиленгликоль) + 2MnO2 + 2KOH I I OH OH |
Ациклические
и циклические алкены при взаимодействии
с надкислотами RCOOOH в неполярной, среде
образуют эпоксиды (оксираны), поэтому
сама реакция носит название реакции
эпоксидирования.
- Озонирование
алкенов. - при
взаимодействии алкенов с озоном
образуются перекисные соединения,
которые называются озо-нидами. Реакция
алкенов с озоном является наиболее
важным методом окислительного расщепления
алкенов по двойной связи - Алкены
не вступают в реакции замещения. - Вакер-процесс —процесс
получения ацетальдегида прямым
окислением этилена. - Вакер-процесс
основан на реакции окисления этилена
дихлоридом палладия: - CH2=CH2 +
PdCl2 +
H2O
= CH3CHO
+ Pd + 2HCl
15.
Алкены: химические свойства. Гидрирование.
Правило Лебедева. Изомеризация и
олигомеризация алкенов. Радикальная и
ионная полимеризация. Понятие полимер,
олигомер, мономер, элементарное звено,
степень полимеризации. Теломеризация
и сополимеризация.
Гидрирование
- Гидрирование алкенов
непосредственно водородом происходит
только в присутствии катализатора.
Катализаторами гидрирования
служат платина,палладий, никель - Гидрирование
можно проводить и в жидкой фазе с
гомогенными катализаторами - Реакции
изомеризации - При
нагревании возможна изомеризация
молекул алкенов, которая - может
привести как к перемещению двойной
связи, так и к изменению скелета - углеводорода.
- CH2=CH-CH2-CH3 CH3-CH=CH-CH3
- Реакции
полимеризации
Это
разновидность реакции присоединения.
Полимеризация — это реакция последовательного
соединения одинаковых молекул в большие
по размеру молекулы, без выделения
какого-либо низкомолекулярного продукта.
При полимеризации атом водорода
присоединяется к наиболее гидрогенизированному
атому углерода, находящемуся у двойной
связи, а к другому атому углерода
присоединяется остальная часть молекулы.
CH2=CH2
+ CH2=CH2 + … -CH2-CH2-CH2-CH2- …
или
n CH2=CH2 (-CH2-CH2-)n (полиэтилен)
Вещество,
молекулы которого вступают в реакцию
полимеризации, называются мономером.
Молекула мономера обязательно должна
иметь хотя бы одну двойную связь.
Образующиеся полимеры состоят из
большого количества повторяющихся
цепочек, имеющих одинаковое строение
(элементарных
звеньев).
Число, показывающее, сколько раз в
полимере повторяется структурное
(элементарное) звено, называется степенью
полимеризации
(n).
В
зависимости от вида промежуточных
частиц, образующихся при полимеризации,
различают 3 механизма полимеризации:
а) радикальный; б)катионный; в) анионный.
По
первому методу получают полиэтилен высокого
давления:
- Катализатором
реакции выступают пероксиды. - Второй
и третий методы предполагает использование
в качестве катализаторов кислот
(катионная полимеризация), металлорганических
соединений. - В
химии олигомер ) —
молекула в виде цепочки изнебольшого числа
одинаковых составных
звеньев. - Теломеризация
Теломеризация
– олигомеризация алкенов в присутствии
веществ – передатчиков цепи (телогенов).
В результате реакции образуется смесь
олигомеров (теломеров), концевые группы
которых представляют собой части
телогена. Например, в реакции CCl4 с
этиленом телогеном является CCl4.
CCl4 +
nCH2=CH2 => Cl(CH2CH2)nCCl3
Инициирование
этих реакций может осуществляться
радикальными инициаторами или g -излучением.
16.
Алкены. Реакции радикального присоединения
галогенов и галогеноводородов (механизм).
Присоединение карбенов к олефинам.
Этилен, пропилен, бутилены. Промышленные
источники и основные пути использования.
- Алкены
легко присоединяют галогены, особенно
хлор и бром (галогенирование). - Типичной
реакцией такого типа является
обесцвечивание бромной воды - CH2=CH2
+ Вr2 → СH2Br-CH2Br (1,2-дибромэтан) - Электрофильное
присоединение галогенводородов
к алкенам происходит по правилу
Марковникова:
- Марковникова
правило:
при присоединении протонных кислот
или воды к
несимметричным алкенам или алкинаматом водорода
присоединяется к наиболее гидрогенизированному
атому углерода - гидрогенизированный
атом углерода – тот атом, к которому
присоединен водород. Наиболее
гидрогенизированный – там где больше
всего Н - Реакции
присоединения карбенов - Карбены CR2: —
высокореакционные короткоживущие
частицы, которые способны легко
присоединяться к двойной связи
алкенов[33].
В результате реакции присоединения
карбена образуются производные циклопропана
Этиле́н — органическое химическое
описываемое
формулой С2H4.
Является простейшималкеном (олефином)соединение.
При нормальных условиях — бесцветный
горючий газ со слабым запахом. Частично
растворим в воде.
Содержит двойную связь
и поэтому относится к ненасыщенным или
непредельным углеводородам.
Играет чрезвычайно важную роль в
промышленности.
Этилен —
самое производимое органическое
соединение в мире: Окись
этилена ;
полиэтилен,
уксусная кислота, этиловый спирт.
Основные
химические свойства
( не учи, просто пусть будут на всякий
случай, вдруг списать получится)
Этилен —
химически активное вещество. Так как в
молекуле между атомами углерода имеется
двойная связь, то одна из них, менее
прочная, легко разрывается, и по месту
разрыва связи происходит присоединение,
окисление, полимеризация молекул.
CH2=CH2 +
Br2 →
CH2Br—CH2Br
Происходит
обесцвечивание бромной воды. Это
качественная реакция на непредельные
соединения.
- CH2=CH2 +
H — H → CH3 —
CH3 (под
действием Ni) - CH2=CH2 +
HBr → CH3 —
CH2Br - CH2=CH2 +
HOH → CH3CH2OH
(под действием катализатора)
Эту
реакцию открыл A.M.
Бутлеров,
и она используется для промышленного
получения этилового спирта.
Этилен
легко окисляется. Если этилен пропускать
через раствор перманганата калия, то
он обесцветится. Эта реакция используется
для отличия предельных и непредельных
соединений. Окись этилена — непрочное
вещество, кислородный мостик разрывается
и присоединяется вода, в результате
образуетсяэтиленгликоль.
Уравнение реакции[6]:
3CH2=CH2 +
2KMnO4 +
4H2O
→ 3HOH2C
— CH2OH
+ 2MnO2 +
2KOH
C2H4 +
3O2 →
2CO2 +
2H2O
- Полимеризация (получение полиэтилена):
- nCH2=CH2 →
(-CH2-CH2-)n - Пропиле́н (пропен)
СН2=СН-СН3 — непредельный
(ненасыщенный) углеводород ряда
этилена, горючий газ. Пропилен
представляет собой газообразное вещество
с низкой температурой кипения tкип=
−47,6 °C - Обычно
пропилен выделяют из газов нефтепереработки
(при крекинге сырой
нефти, пиролизе бензиновых фракций) или
попутных газов, а также из газов коксования
угля.
Источник: https://studfile.net/preview/4521044/page:6/




