

История происхождения
В 1869 году русский химик Д. И. Менделеев заявил, что в природе должно существовать несколько элементов, которые всё ещё не найдены людьми. Его идея была связана с Периодической таблицей, по которой между некоторыми веществами находились пробелы. Один из элементов он назвал экасилиций. Менделеев считал, что по свойствам это вещество похоже на кремний.

В 1886 году в Фрейбергской академии наук открыли новый минерал, который назвали аргиродит. Профессор К. Винклер тщательно изучил его и нашёл в его составе неизвестный элемент. Вскоре он раскрыл его свойства и несколько соединений.
Винклер пришёл к выводу, что это и есть то самое вещество, названное Менделеевым экасилиций.
Сначала химик хотел назвать его нептунием, но это наименование дали другому предполагаемому веществу, поэтому элемент получил название Germanium в честь родины Винклера.
До второй половины XX века германий почти не применялся в промышленности. Только во время Второй мировой войны элемент стали использовать в диодах и других электронных устройствах.
Местонахождение и получение
В чистом виде химический элемент не встречается в природе. Обычно его можно отыскать в качестве примесей в разных полезных ископаемых. Общий объём вещества по массе в земной коре планеты составляет около 1,5⋅10−4%. Редко металл встречается в собственных минералах (сульфосолях):
- германит;
- плюмбогерманит;
- конфильдит;
- рениерит;
- стоттит;
- аргиродит.

В основном германий добывают из горных пород и различных минералов таких, как железные руды, сульфидные руды цветных металлов, базальт, диабаз, магнетит, рутил, хромит, гранит. В больших объёмах вещество содержится в некоторых сфалеритах. Примеси германия присутствуют почти во всех силикатах и некоторых месторождениях каменного угля и нефти.
Химический элемент распространён практически по всей планете. Однако промышленных месторождений этого металла нет ни в одной стране. Небольшое количество элемента, содержащегося в его минералах, не может покрыть потребность современной промышленности в этом редком, но важном веществе.
Германий можно получить несколькими методами. Основной способ заключается в применении сульфида металла, который перерабатывают до получения оксида GeO2 и затем освобождают элемент с добавлением водорода. В промышленной области материал выходит в побочных продуктах после переработки руд цветных металлов или золы от сжигания угля.
Физические особенности

Германий относится к 14-й группе 4 периода в таблице Менделеева. Его порядковый номер — 32, обозначение — Ge. В виде простого вещества германий выглядит как хрупкий полуметалл стального или серебристого оттенка. Материал характеризуется металлическим блеском. Элемент относится к непрямозонным полупроводникам.
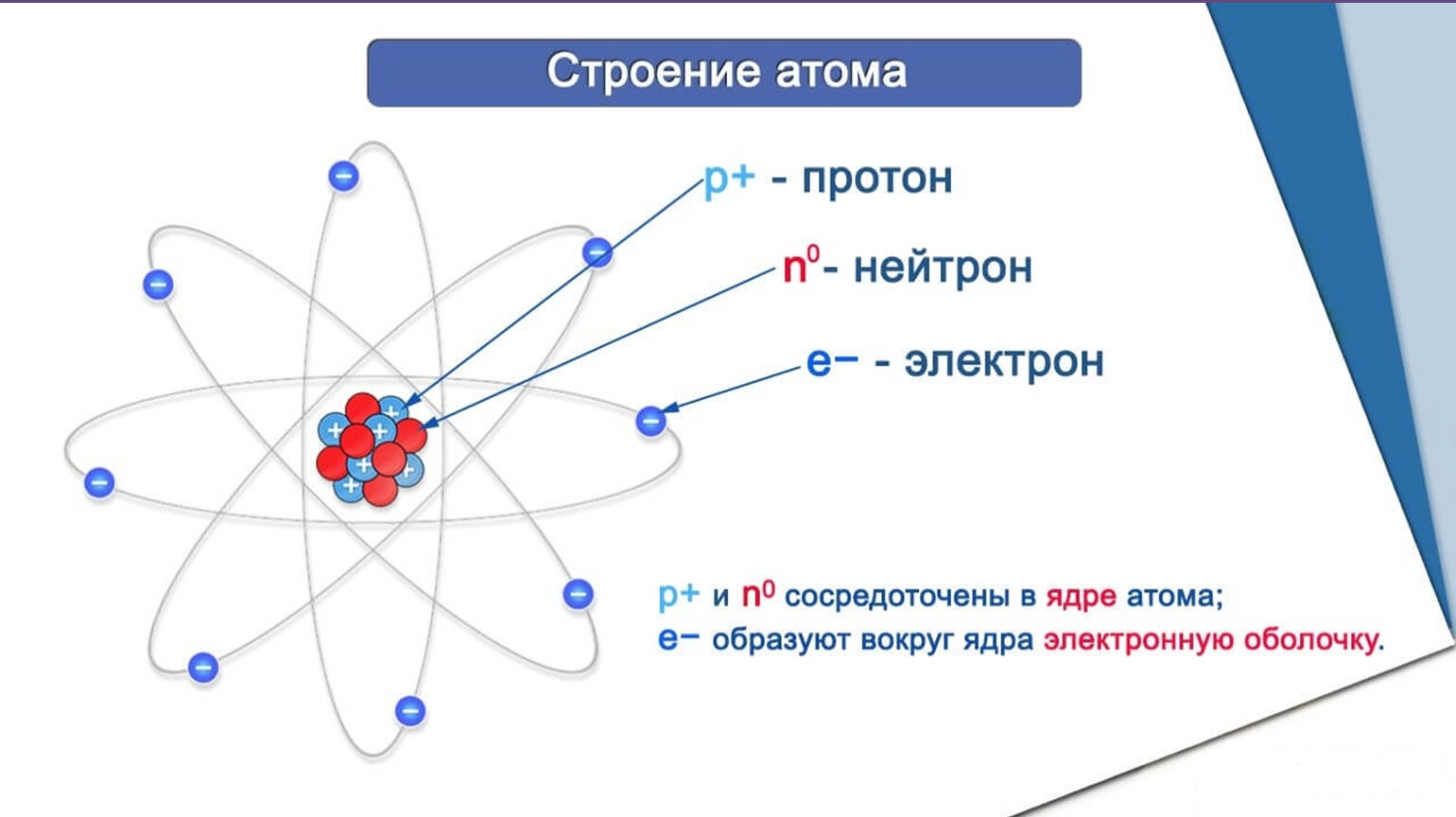
Валентность металла в разных соединениях может быть II или IV; электронная формула германия (конфигурация) — 1s22s22p63s23p63d104s24p2. Следует узнать и о строении атома элемента. Он включает 32 протона и 41 нейтрон. По четырём орбитам движутся 32 электрона.
В нормальном состоянии атом элемента характеризуется двумя s-парными и двумя p-парными отрицательно заряженными частицами, поэтому вещество может образовывать две химические связи.
В возбуждённом состоянии один из s-электронов покидает свою орбиталь и переходит на свободное место на p-подуровне.
Поскольку образуется 4 неспаренных электрона, германий способен образовывать 4 связи по обменному механизму.
Основные физические свойства элемента:
- температура плавления — 938,2 °C;
- температура кипения — 2850 °C;
- плотность — 5,33 г/см³;
- молярный объём — 13,6 см³/моль;
- атомная масса — 72,6 а. е. м.;
- молярная теплоёмкость — 23,32 Дж/К·моль.
При нормальных условиях кристаллическая решётка элемента алмазная, или кубическая. У полуметалла есть необычное физическое свойство: германий считается одним из редких аномальных веществ, у которых при плавлении увеличивается показатель плотности. Кроме того, при повышении температуры возрастает почти в 13 раз удельная проводимость германия, однако при достижении 1100 °C она падает.
Химическая природа
В соединениях металл проявляет степень окисления +4, +2 или -4. Если рассматривать химические свойства германия, вещество напоминает кремний. При нормальных условиях он устойчив к воздействию воздуха, воды, щелочей и кислот. Германий способен растворяться в царской водке и в щелочном растворе пероксида водорода.
На воздухе при 500−700 °C металл окисляется до оксидов. Производные кислоты элемента представлены твёрдыми веществами, которые характеризуются высокими температурами плавления. Их можно получить путём сплавления оксидов германия.

При реакции с галогенами металл образует тетрагалогениды. Легче процесс проходит с фтором и хлором. Тетрахлорид получают при хлорировании германия в твёрдом состоянии или при реакции его оксида (GeO2) с концентрированной соляной кислотой. При гидролизе дигалогенидов элемента получается гидроксид. Монооксид можно получить при нагревании металла с его диоксидом.
Взаимодействуя с серой при температуре 1000 °C, германий образует дисульфид, который представлен твёрдым веществом белого цвета. При нагревании до 1100 °C металл незначительно реагирует с водородом. В результате получается малоустойчивое соединение гермин.
При воздействии на германий аммиака образуется нитрид. С углеродом элемент не взаимодействует.
Также вещество способно образовывать металлорганические (например, тетраэтилгерман) и комплексные соединения с гидроксилсодержащими органическими молекулами (многоосновные кислоты, многоатомные спирты).
Сферы использования

Поскольку германий выступает полупроводником, он широко применяется в электронике и технике при создании микросхем и транзисторов. Сплавы металла необходимы при изготовлении датчиков и детекторов, а его диоксид применяется для производства стёкол, пропускающих инфракрасное излучение. Элемент используют в радарных установках в качестве сопротивления.
Германий используют при создании призм и линз инфракрасной оптики. Без материала не обходятся оптоволоконные системы и полупроводниковые диоды. Элемент применяется при измерении низких температур и обнаружении инфракрасного излучения. Диоды и триоды на основе вещества используются в телевизорах, радиоприёмниках и счётно-решающих средствах.
Влияние на здоровье человека
Германий в незначительном объёме обнаружен в организме человека. Пока учёные не смогли установить, в каком количестве должен присутствовать этот элемент в составе тканей и крови. Металл практически полностью усваивается человеческим организмом. Излишки микроэлемента выводятся через почки. Также не выявлено, какие вещества могут улучшить или ухудшить его поглощаемость.
Специалистам удалось открыть в металле некоторые лечебные свойства. Германий оказывает положительное воздействие на здоровье человека:

- Вещество транспортирует кислород к тканям.
- Элемент замещает свойства пониженного гемоглобина.
- Германий укрепляет иммунную систему, подавляет размножение вредных бактерий и стимулирует выработку противомикробных клеток.
- Металл выступает антиоксидантом, предотвращая образование опухолей.
- Вещество способно подавлять болезненные ощущения.
Но у германия есть не только плюсы. Среди минусов следует отметить, что большие дозировки этого вещества представляют опасность для организма человека и могут вызвать отравление.
Обычно такие последствия вызывает вдыхание паров чистого металла и его оксидов на производственных мероприятиях.
После перорального приёма больших дозировок германия может наблюдаться раздражение кожного покрова или нарушение работы почек и печени.
Очистить организм от избытка элемента необходимо с помощью симптоматического лечения с сорбентами. Из-за недостатка германия возможно развитие остеопороза.
Поддерживать необходимый уровень элемента в организме помогут следующие продукты:

- бобовые;
- молоко;
- грибы;
- лосось;
- чеснок;
- корень женьшеня;
- томатный сок.
В Японии производят добавки с германием для поддержания здоровья. Поскольку это вещество ещё недостаточно изучено, средство пока не получило массового распространения. В начале XXI века в России начали выпускать БАД «Гермавит». Добавку выписывают для укрепления иммунной и костной систем, а также для защиты от кислородного голодания.
Занимательные факты
Любой химический элемент отличается определёнными особенностями и свойствами, которые не характерны для других веществ. О германии имеется немало интересных фактов:
- Хотя элемент относится к группе металлов, по хрупкости его можно сравнить со стеклом. Если его уронить, он может разбиться.
- Германий может быть не только серебристого оттенка. Его цвет зависит от метода обработки. В некоторых случаях металл имеет стальной окрас, а иногда получается практически чёрным.
- Элемент обнаружен на поверхности солнца и в упавших с космоса метеоритах.
- Практически все свойства и характеристики вещества, которые предсказал Менделеев, оказались на удивление точными.
- Около 500 тонн элемента, что составляет половину разведанных запасов металла, скрыто в недрах США. Почти 400 тонн обнаружено в Китае.
- Элемент способен проводить ток не только в стандартном виде, но и в твёрдых растворах.
- Цена слитка германия и золота практически одинаковая.
- Плёнка из германия и ниобия, имеющая толщину несколько тысяч атомов, может сохранять сверхпроводимость даже при температуре 23,2 °К и ниже.
- Ни одно из полученных элементоорганических соединений этого металла не ядовито.
Ежегодно специалисты открывают новые свойства веществ, которые могут повлиять на дальнейшее развитие технологий. Возможно, что в скором будущем германию найдут широкое применение не только в промышленности, но и в области медицины.
Источник: https://nauka.club/khimiya/germaniy.html
Германий
| Атомный номер | 32 |
| Внешний вид простого вещества |  Кристалл германия — светло-серый полупроводник с металлическим блеском Кристалл германия — светло-серый полупроводник с металлическим блеском |
| Атомная масса (молярная масса) | 72,61 а. е. м. (г/моль) |
| Радиус атома | 137 пм |
| Энергия ионизации (первый электрон) | 760,0 (7,88) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s2 4p2 |
| Ковалентный радиус | 122 пм |
| Радиус иона | (+4e) 53 (+2e) 73 пм |
| Электроотрицательность (по Полингу) | 2,01 |
| Электродный потенциал | 0 |
| Степени окисления | 4 |
| Плотность | 5,323 г/см³ |
| Молярная теплоёмкость | 23,32[1] Дж/(K·моль) |
| Теплопроводность | 60,2 Вт/(м·K) |
| Температура плавления | 1210,6 K |
| Теплота плавления | 36,8 кДж/моль |
| Температура кипения | 3103 K |
| Теплота испарения | 328 кДж/моль |
| Молярный объём | 13,6 см³/моль |
| Структура решётки | алмазная |
| Параметры решётки | 5,660 Å |
| Отношение c/a | — |
| Температура Дебая | 360 K |
| Ge | 32 |
| 72,61 | |
| 4s24p2 | |
| Германий |
Германий — химический элемент с атомным номером 32 в периодической системе, обозначается символом Ge (Germanium)
Схема атома германия
Элемент был предсказан Д. И. Менделеевым (как эка-кремний) и открыт в 1885 году немецким химиком Клеменсом Винклером при анализе минерала аргиродита Ag8GeS6. Происхождение названия- назван в честь Германии, родины Винклера.
Общее содержание германия в земной коре 7×10−4% по массе, то есть больше, чем, например, сурьмы, серебра, висмута. Однако собственные минералы германия встречаются исключительно редко. Почти все они представляют собой сульфосоли: германит Cu2(Cu, Fe, Ge, Zn)2 (S, As)4, аргиродит Ag8GeS6, конфильдит Ag8(Sn, Ce) S6 и др.
Основная масса германия рассеяна в земной коре в большом числе горных пород и минералов: в сульфидных рудах цветных металлов, в железных рудах, в некоторых окисных минералах (хромите, магнетите, рутиле и др.), в гранитах, диабазах и базальтах.
Кроме того, германий присутствует почти во всех силикатах, в некоторых месторождениях каменного угля и нефти.
Получение
Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида GeO2, который восстанавливают водородом при 600 °C до простого вещества:
GeO2 + 2H2 = Ge + 2H2O.
Физические свойства
 Кристаллическая структура германия.
Кристаллическая структура германия.
Кристаллическая решетка германия кубическая гранецентрированная типа алмаза, параметр а = 5,660 Å .
Механические свойства
- Модуль упругости E, ГПа — 82
- Скорость звука (t=20÷25°C) в различных направлениях ·1000 м/с.
- L100 : 4,92
- S100 : 3,55
- L110 : 5,41
- S110 : 2,75
- L111 : 5,56
- S111 : 3,04
Электронные свойства
Германий является типичным непрямозонным полупроводником.
- Статическая диэлектрическая проницаемость ε = 16,0
- Ширина запрещённой зоны (300 К) Eg = 0,67 эВ
- Собственная концентрация ni=2,33×1013 см−3
- Эффективная масса
- электронов, продольная: mII=1,58m0, mII=1,64m0
- электронов, поперечная: m┴=0,0815m0 , m┴=0,082m0
- дырок, тяжелых: mhh=0,379m0
- дырок, легких: mhl=0,042m0
- Электронное сродство: χ = 4,0 эВ
Легированный галлием германий в тонкой плёнке можно привести в сверхпроводящее состояние.
Изотопы
В природе встречается пять изотопов: 70Ge (20,55 % масс.), 72Ge (27,37 %), 73Ge (7,67), 74Ge (36,74 %), 76Ge (7,67 %). Первые четыре стабильны, пятый (76Ge) испытывает двойной бета-распад с периодом полураспада 1,58×1021 лет. Кроме этого существует два «долгоживущих» искусственных: 68Ge (время полураспада 270,8 дня) и 71Ge (время полураспада 11,26 дня).
Химические свойства
В химических соединениях германий обычно проявляет валентности 4 или 2. Соединения с валентностью 4 стабильнее. При нормальных условиях устойчив к действию воздуха и воды, щелочей и кислот, растворим в царской водке и в щелочном растворе перекиси водорода. Применение находят сплавы германия и стёкла на основе диоксида германия.
Соединения германия
Неорганические
- Гидриды
- Герман GeH4
- Дигерман Ge2H6
- Тригерман Ge3H8
- Оксиды
- Оксид германия (II) GeO
- Оксид германия (IV) GeO2
- Галогениды
- Бромид германия (IV) GeBr4
- Иодид германия (II) GeI2
- Иодид германия (IV) GeI4
- Фторид германия (IV) GeF4
- Хлорид германия (IV) GeCl4
- Нитрид германия (IV) Ge3N4
- Сульфид германия (II) GeS
- Сульфид германия (IV) GeS2
Органические
Применение
Средние цены на германий в 2007 году /по материалам infogeo.ru/metalls
- Германий металлический $1200/кг
- Германий диоксид (двуокись) $840/кг
- Теллурид германия издавна применяется как стабильный термоэлектрический материал и компонент термоэлектрических сплавов (термо-ЭДС 50 мкВ/К).
- Совершенно исключительное стратегическое значение имеет металлический германий сверхвысокой чистоты в производстве линз, и призм инфракрасной оптики.
- В радиотехнике, германиевые транзисторы и детекторные диоды обладают характеристиками, отличными от кремниевых, ввиду меньшего напряжения отпирания pn-перехода в германии — 0.4В против 0.6В у кремниевых приборов. В своё время германиевые полупроводниковые приборы использовались повсеместно в радиоприёмниках и других конструкциях. Например, схема JOULE (в отечественной радиотехнике известная как блокинг-генератор) позволяет питать трёхвольтовый светодиод от 0,6 В, если в ней применён кремниевый транзистор, и начиная всего с 0,125 В, если германиевый. HI-End усилители на германиевых транзисторах обладают качеством звука, сопоставимым с усилителями на радиолампах, так как германиевые транзисторы мягче переключатся в схемах усилителя класса «AB», имеют более линейную переходную характеристику (чем сопоставимые кремниевые транзисторы тех же лет выпуска), и не пропускают гармоники дальше пятой (тогда как кремниевые — до 11-той — из-за чего звук становится «жестким» на высоких частотах). В классификации радиоэлектроники по советскому ГОСТу кремниевые полупроводниковые элементы обозначались, начиная с буквы К или с цифры 2, а германиевые с буквы Г или цифры 1, например: ГТ313, 1Т308 — германиевые высокочастотные маломощные транзисторы. Существует старая система обозначений, например, П210,213,214,217, и некоторые транзисторы «МПxx» — также германиевые. Ещё более высоким частотным потенциалом (имеется ввиду подвижность носителей заряда в полупроводниках, а не скорость работы готового полупропроводникового прибора) обладает арсенид галлия, применяемый в светодиодах. В настоящее время кремниевые диоды и транзисторы полностью вытеснили германиевые, и они не выпускаются ни в одной стране мира. Найти их можно только в старых радиоаппаратах либо из запасов радиолюбителей тех лет.
- Качер Бровина («генератор Бровина-Теслы») [источник?] лучше работает на германиевых транзисторах.
- Германий широко применяется в ядерной физике в качестве материала для детекторов гамма-излучения.
Биологическая роль
Германий обнаружен в животных и растительных организмах. Малые количества германия не оказывают физиологического действия на растения, но токсичны в больших количествах. Германий нетоксичен для плесневых грибков.
Для животных германий малотоксичен. У соединений германия не обнаружено фармакологическое действие. Допустимая концентрация германия и его оксида в воздухе — 2 мг/м³, то есть такая же, как и для асбестовой пыли.
Соединения двухвалентного германия значительно более токсичны.
Дополнительная информация
Кремний
Источник: http://himsnab-spb.ru/article/ps/ge
ПОИСК
Строение внешней электронной оболочки атома Углерод Кремний Германий Олово Свинец [c.404]
Исходя из строения электронных оболочек атомов, решите, у какого из элементов четвертой группы, у титана или германия, должны сильнее проявляться металлические свойства Почему [c.177]
Германий, олово и свинец относят к главной подгруппе IV группы периодической системы элементов Менделеева. Строение их внешних электронных оболочек аналогично строению электронных обо- [c.184]
Группа 1Уа (С, З , Ое, Зп, РЬ). Алмаз плавится при 4000—4100° под давлением 10—20 кбар, но данных о его строении в жидком состоянии нет, хотя полагают, что он превращается в металл. Экспериментальных данных о структуре жидкого кремния также нет что же касается структуры жидкого германия, то установлено, что он плавится с возрастанием координационного числа с 4 до 8 (см. табл. 41). Единственное возможное объяснение этого, данное нами в 1960 г. [162, 212], заключается в том, что плавление сопровождается разрушением ковалентных связей и переходом всех четырех валентных электронов в зону проводимости, вследствие чего ионы германия приобретают конфигурацию с внешней ортогональной -оболочкой. Экспериментальные значения коэффициента Холла (табл. 40) и оптические свойства жидкого германия соответствуют четырем свободным электронам. Наличие таких ионов у германия, сближенных до перекрытия шести вытянутых -облаков, благодаря высокой концентрации электронного газа (4 эл/атом) приводит к тому, что каждый ион стремится иметь координацию 8, свойственную в твердом состоянии объемноцентрированной кубической структуре. О разрушении ковалентных связей при плавлении германия и переходе его в металлическое состояние свидетельствуют чрезвычайно большой прирост энтропии (см. рис. 108) при плавлении и резкое скачкообразное возрастание электропроводимости. Совершенно идентично изменение свойств германия и кремния, а также тот факт, что оба элемента имеют весьма близкие ионизационные потенциалы и что ион кремния обладает внешней 2р -оболочкой, позволили утверждать [162, 212], что кремний, подобно германию, должен плавиться с изменением координационного числа с 4 до 8 , [c.248]
Главная подгруппа IV группы состоит из углерода, кремния, германия, олова и свинца. По строению электронных оболочек эти элементы делятся на два семейства семейство углерода (углерод и кремний) и семейство германия (германий, олово, свинец). Различие в строении атомов этих элементов сказывается на их химических и каталитических свойствах.
В то время как для соединений углерода наиболее характерны процессы ионного типа, соединения элементов семейства германия довольно часто используются в качестве катализаторов окислительно-восстанови-тельных реакций, хотя для всех этих элементов и их соединений процессы с участием именно молекулярного Нз малохарактерны. [c.
80]
Аналогия между всеми элементами этой группы выражается в том, что максимальная валентность их является одинаковой и равной четырем отличительные особенности заключаются в металлоидном характере углерода и кремния, незаполненной -электронной оболочке у элементов подгруппы титана и постепенном переходе от кремния к металлам — германию, олову и свинцу. Различие между этими элементами также проявляется в изменении характера связи, являющейся ковалентной для углерода, кремния, германия и олова (низкотемпературной модификации) и чисто металлической для аналогов титана и свинца. Металлический характер элементов в подгруппе германия возрастает сверху вниз. Таким образом, получается ряд элементов, где металлические свойства последовательно снижаются РЬ —> Зп Ое 31. Сходство и различие в строении атомов и характере связи обусловливает и различные виды взаимодействия с другими элементами периодической системы и, в частности, с кислородом. Эти элементы по подгруппам отличаются окисляемостью, свойствами кислородных соединений, образованием или отсутствием твердых растворов кислорода в металлах. [c.18]
Особенности электронного строения элементов подгрупп титана и германия проявляются в том, что кислород с элементами переходных групп (титана) образует в значительных концентрациях твердые растворы внедрения и фазы переменного состава, тогда как элементы подгруппы германия с заполненной -электронной оболочкой не способны давать твердые [c.19]
Собственные и примесные полупроводники. Полупроводники, проводимость которых обусловлена ионизацией атомов чистого вещества (германия, кремния и т. д.), называются собственными.
Полупроводники, у которых основную роль играет ионизация атомов легирующих добавок, называются примесными.
В основе электрических характеристик тех и других лежат химические свойства соответствующих элементов, обусловленные их положением в периодической системе— в первою очередь строением электронных оболочек атомов. [c.430]
Многие ковалентные кристаллы (например, германий) плавятся с разрушением направленных связей и переходом в металлическое состояние, соответствующее ОЦК структуре.
Разрушение направленных связей растягивается на определенный интервал температур, и лишь при некотором перегреве достигается чисто металлическое состояние (см. рис. 107).
Наконец, элементы группы кислорода и галогены плавятся без разрушения направленных связей, сохраняя молекулярную структуру в жидком и даже в газообразном состоянии.
Поскольку сохранение жидкостью ближнего порядка вблизи температуры плавления должно быть обусловлено электронным строением внешних оболочек ионов и взаимодействием как этих оболочек, так и валентных электронов при образовании связей, рассмотрим возможность объяснения структур жидких элементов их электронным строением, как это сделано ранее в работах [162, 212]. [c.242]
В главную подгруппу IV группы входят углерод, кремний, германий, олово и свинец. Различие в структуре электронных оболочек позволяет разделить эти элементы на два семейства семейство углерода (С, Si), в котором у атомов под валентными оболочками находятся оболочки соответствующих инертных газов, и семейство германия (Ge, Sn, F b) с JS-элек-тронными подвалеитными оболочками.
Такое различие в строении атомов, резко сказывающееся на свойствах элементов в первых двух группах периодической системы, к III и IV группе сглаживается, что и оправдывает включение элементов этих обоих семейств в главную подгруппу. Все же некоторое различие в ходе изменения химических и каталитических свойств в обоих семействах делает целесообразным рассмотрение их в отдельности. [c.
334]
Особенности строения электронных оболочек атомов элементов IV группы обусловливают способность их проявлять переменную валентность (степень окисления).
Но если углерод и кремний образуют главным образом соединения, где они четырехвалентны, то для германия, олова и свинца в равной мере возможны и двух- и четырехвалентное состояния, причем устойчивость двухвалентного состояния повышается от германия к свинцу.
Это объясняется тем, что у меньших по объему атомов углерода и кремния (и в какой-то мере германия) легко осуществляется 5р -гибридизация, вследствие чего образуется четыре равноценные ковалентные связи.
С ростом радиуса атомов склонность орбиталей к гибридизации уменьшается, а удаление неспареиных электронов с р-орбиталей олова и свинца осуществляется легче, чем спаренных электронов с 5-орбиталей. [c.184]
Исследования элементов при высоких давлениях, кардинальным образом изменяющих строение и степень перекрытия внешних электронных оболочек, привели к обнаружению неизвестных ранее модификаций рубидия, цезия, бария, галлия, индия, таллия, кремния, германия, олова, свинца, сурьмы, висмута, титана, циркония и других элементов. Круг полиморфных металлов расширился настолько, что можно полагать, что в природе вообще не существует элементов, сохраняющих одну и ту же структуру в достаточно широком диапазоне давлений и температур. [c.196]
Вместе с тлеродом, германием, оловом и свинцом кремний составляет гомологический ряд элементов, отличающихся от всех остальных наличием четырех валентных электронов на внешней электронной оболочке.
Поэтому максимальная валентность кремния и его электронных аналогов равна четырем. Строение и физические константы атомов серий (химических типов) элементов четвертой главной группы периодической системы приведены в табл. 2.
[c.9]
Общим для трех исследованных систем является наличие области максимальных значений парамагнетизма Ван-Флека. Для составов с максимальными значениями парамагнитной составляющей получены также экстремальные значения парамет-)0Б электропроводности и других физико-химических величин.
4з анализа полученных экстремальных значений следует, что стекла указанных составов характеризуются статистическим распределением структурных единиц АзЗез/г, АзЗз/г и ОеЗе4/г в полимерных цепях и циклах стеклообразных селена и серы.
Такое распределение приводит к нарушению правильности чередования структурных единиц, нарушению исходного ближнего порядка и вносит тем самым дополнительную асимметрию в строение электронных оболочек атомов. Стекла в системе Аз—Зе с содержанием 9 ат. % мышьяка, в системе Аз—3 с содержанием мышьяка 12 ат.
% и в системе Се—Зе с содержанием 6—7 ат, % германия имеют наименьшую степень [c.73]
Строение внешних электронных оболочек атомов-рассматриваемых элементов Т1 ЗсШз , 2г 4 25 2 , 4 145 20 2 являясь аналогами германия, олова и свинца в состоянии ш =0, Т1, 2г и Н проявляют черты сходства с ними в состоянии йу = 4.
На одном примере это показывает рис. 3.101. Из него также видно, что свойства соединений элементов в ряду С — 81 — Тг— 2г — Н изменяются монотонно (аналогичная закономерность наблюдается в П1 группе элементов, см. рис. 3.98). [c.
504]
В основном состоянии атомы элементов подгруппы германия имеют строение внешних электронных оболочек 4s4p (Ge), 5s p (Sn), 6s 6p (Pb) и двухвалентны. Возбуждение четырехвалентных состояний Ge(4s4p ) и Sn(5s5jB требует затраты [c.131]
Смотреть страницы где упоминается термин Германий строение электронных оболочек: [c.624] [c.110] [c.33] [c.88] [c.114] [c.152] Основы общей химии Том 2 (1967) — [ c.131 ]
- Германий строение
- Оболочка
- Электронная оболочка
- Электронное строение
- электронами электронное строение
© 2019 chem21.info Реклама на сайте
Источник: https://www.chem21.info/info/1179000/
Германий
ГЕРМАНИЙ, Ge (от лат. Germania — Германия * а. germanium; н. Germanium; ф. germanium; и. germanio), — химический элемент IV группы периодической системы Менделеева, атомный номер 32, атомная масса 72,59.
Природный германий состоит из 4 стабильных изотопов 70Ge (20,55%), 72Ge (27,37%), 73Ge (7,67%), 74Ge (36,74%) и одного радиоактивного 76Ge (7,67%) с периодом полураспада 2•106 лет. Открыт в 1886 немецким химиком К.
Винклером в минерале аргиродите; был предсказан в 1871 Д. Н. Менделеевым (экасилиций).
Свойства германия
Германий — хрупкий серебристо-белый металл. Кристаллизуется в кубической решётке типа алмаза с периодом а = 0,56575 нм (5,6575 Е). Плотность 5326 кг/м3 (при 25°С; t плавления 958,5°С, t кипения 2690°С; удельная теплоёмкость (при 0-300°С) 322,14 Дж/кг•К, теплопроводность 58,8 Дж/м•с•К (при 25°С).
Важнейшими являются полупроводниковые свойства германия, самого распространённого природного полупроводникового материала.
Электрические свойства (при 25°С): удельное сопротивление монокристаллического германия 5,6-6,0 кОм/м, концентрация носителей тока 2•1013 см-3, ширина запрещённой зоны 0,665 эВ, подвижность электронов mn 0,39 м2/с, подвижность дырок mr 0,19 m2/с.
Германий химический
Металлический германий устойчив на воздухе при комнатной температуре и быстро окисляется при температуре выше красного каления (600-700°С) с образованием двуокиси, твёрдый германий не реагирует с азотом, водородом; жидкий германий при температуре 1000-1100°С взаимодействует с водородом.
В соединениях степень окисления +2 и +4; устойчивой формой является Ge+4. Моно- и диоксид германия амфотерны, растворяются в щелочной среде с образованием германитов и германатов.
Германий имеет множество соединений с галогенами и серой; сульфиды растворяются в щелочных растворах, образуя сульфогерманаты, соли в водном растворе легко гидролизуются, давая гидратированный диоксид. Радиус иона Ge+4 промежуточный между радиусами ионов Si+4 и Ti+4.
Большинство кислородных соединений германия являются структурными аналогами соединений кремния. Многие из них диморфны; более плотные модификации (например, GeO2) аналогичны по структуре соединениям титана.
Германий в природе
Германий относится к рассеянным элементам. Распространённость германия в земной коре (1-2)•10-4%. В качестве примеси встречается в минералах кремния, в меньшей степени в минералах железа и цинка.
Собственные минералы германия очень редки: сульфосоли — аргиродит, германит, реньерит и некоторые другие; двойной гидратированный оксид германия и железа — штоттит; сульфаты — итоит, флейшерит и некоторые др. Промышленного значения они практически не имеют.
Германий накапливается в гидротермальных и осадочных процессах, где реализуется возможность отделения его от кремния. В повышенных количествах (0,001-0,1%) встречается в сфалерите, магнетите, каменных и бурых углях.
Источниками германия являются полиметаллические руды, ископаемые угли и некоторые типы вулканогенно-осадочных месторождений железных руд. Основное количество германия получают попутно из подсмольных вод при коксовании углей, из золы энергетических углей, сфалеритовых и магнетитовых концентратов.
Германий извлекается кислотным выщелачиванием, возгонкой в восстановительной среде, сплавлением с едким натром и др. Концентраты германия обрабатываются соляной кислотой при нагревании, конденсат очищается и подвергается гидролитическому разложению с образованием диоксида; последний восстанавливается водородом до металлического германия, который очищается методами фракционной и направленной кристаллизации, зонной плавки.
Применение германия
Германий применяют в радиоэлектронике и электротехнике как полупроводниковый материал для изготовления диодов и транзисторов.
Из германия изготовляют линзы для ИК оптики, фотодиоды, фоторезисторы, дозиметры ядерных излучений, анализаторы рентгеновской спектроскопии, преобразователи энергии радиоактивного распада в электрическую и т.д.
Сплавы германия с некоторыми металлами, отличающиеся повышенной стойкостью к кислым агрессивным средам, используют в приборостроении, машиностроении и металлургии. Некоторые сплавы германия с другими химическими элементами — сверхпроводники.
Источник: http://www.mining-enc.ru/g/germanij
Германий
Общие сведения и методы получения
Германий ( Ge ) — элемент серовато-белого цвета в компактном состоянии и серого в диспергированном. Существование и свойства этого элемента предсказаны в 1871 г. Д И. Менделеевым, который назвал его экасилицием. Новый элемент был открыт А. Винклсром в 1886 г.
во Фрайберге (Германия) в минерале аргиродите 4 Ag 2 S — GeS 2 и назван германием в честь роднны ученого. Практический интерес к этому элементу возник в период второй мировой войны в связи с развитием полупроводниковой электроники.
Начало промышленного производства германия относится к 1945—1950 гг.
Содержание германия в земной коре составляет 7*10-4 % (по массе). Основное количество элемента находится в рассеянном состоянии в силикатах, сульфидах н минералах, представляющих собой сульфосоли.
Известно несколько минералов типа сульфосолей с высоким содержанием германия, которые ие имеют промышленного значения: аргнродит— Ag 8 GeS 6 (5—7%), германит Cu 3 ( Fe , Ge , Са, Zn ) ( As , S )4 (6—10%), рениернт ( Cu , Fe )3( Fc , Ge , Zn , Sn ) ( S , As )4 (6,37—7,8%).
Источниками получения германия являются сульфидные руды, а также малометамор-физированные угли и некоторые железные руды (до 0,01 % Ge ).
- В зависимости от состава исходного сырья применяют различные способы его первичной обработки:
- — выщелачивание серной кислотой с последующим выделением германия из растворов;
- — сульфатизирующий обжиг материалов;
- — возгонка сульфида GeS или монооксида GcO в восстановительной среде;
- — сульфатизирующий обжиг материала;
- — восстановительная плавка в присутствии меди или железа;
- — экстракция;
- — ионообменная сорбция.
- Германиевые концентраты могут быть выделен л из растворов следующими способами:
- — осаждение в виде малорастворимых соединений;
- — соосаждение с гидратами железа, цинка, с сульфидами цника, меди и т. д ;
- — осаждение из сернокислых растворов на цинковой пыли (цементация).
С целью получения четыреххлористого германия германиевые концентраты обрабатывают концентрированной соляной кислотой в токе хлора.
Образующийся тетрахлорид германия ( GeCI 4 ) отгоняют от хлоридов металлов, имеющих более высокие температуры кипения В результате гидролиза очищенного четыреххлористого германия получают диоксид германия Qe 02 Элементарный германий получают восстановлением очищенного и просушенного диоксида чистым водородом.
Восстановленный германий подвергают дальнейшей очистке от примесей фракционной кристаллизацией Из высокочистого германия методом зонной плавки или по способу Чохральского выращивают монокристаллы с заданными электрофизическими свойствами. Промышленность выпускает поли- и монокристаллический германий.
Германий марки ГПЗ-1 предназначен для получения монокристаллического иелегированного и легированного германия, а также специальных целей, марки ГПЗ-2 — для получения монокристаллического легированного германия и других целей, марки ГПЗ-3 — для получения сплавов и заготовок для оптических деталей.
Германий поставляется в виде слитков в форме сегмента, каждый из которых упаковывают в полиэтиленовый пакет. Слиток в полиэтиленовой упаковке помещают в картонную или пластмассовую тару и уплотняют мягкой прокладкой, обеспечивающей сохранность его при транспортировке и хранении.
Доставка осуществляется любым видом крытого транспорта.
Физические свойства
Атомные характеристики Атомный номер 32, атомная масса 72,59 а е м , атомный объем 13,64-10^6 м3/моль, атомный радиус 0,139 нм, ионный радиус Qe 2 + 0,065 нм, Ge 4 + 0,044 нм. Электронное строение свободного атома германия 4s2p2 . Потенциалы ионизации / (эВ): 7,88; 15,93; 34,21. Электроотрицательность 2,0.
Кристаллическая решетка германия — кубическая типа алмаза с периодом а = 0,5657 нм. Энергия кристаллической решетки 328,5 мкДж/кмоль. Координационное число 4. Каждый атом германия окружен четырьмя соседними, расположенными на одинаковых расстояниях в вершинах тетраэдра.
Связи между атомами осуществляются спаренными валентными электронами.
Химические свойства
В соединениях германий проявляет степень окисления +2 и +4, реже +1 и +3. Нормальный электродный потенциал реакции Ge —2е«=* *± Ge 2 + ф0=— 0,45 В.
В атмосфере сухого воздуха германий покрывается тонким слоем оксидов толщиной около 2 нм, но не изменяет при этом своего цвета. Во влажном воздухе германий, особенно поликристаллический, постепенно тускнеет. Заметное окисление начинается при 500 °С.
В ряду напряжений германий располагается после водорода — между медью и серебром. Германий не взаимодействует с водой и не раство-стся в разбавленной и концентрированной соляной кислоте. Растворяется в горячей концентрированной серной кислоте с образованием Ge ( S 04) u и выделением SO 2.
При взаимодействии с азотной кислотой образует осадок диоксида германия xGe 02-(/ H 2 0. Хорошо растворяется в царской водке и смеси HF + HNC 4. Лучшим растворителем для германия является щелочной раствор пероксида водорода. Быстро растворяют германий расплавленные едкие щелочи.
При этом образуются гер-маиаты щелочных металлов, гидролизующиеся водой.
Диоксид Ge02 может быть получен прокаливанием германия на воздухе, прокаливанием сульфидов, растворением элементарного германия в 3 %-ном пероксиде водорода в платиновом тигле с последующим выпариванием раствора и прокаливанием остатка.
Ge 02 существует в двух полиморфных модификациях: низкотемпературной а с тетрагональной решеткой (1123°С) и высокотемпературной й с гексагональной решеткой (выше 1123°С). Температура плавления Ge 02 1725°С. При плавлении образуется прозрачный расплав.
Диоксид германия растворяется в воде с образованием германиевой кислоты НгйеОз, легко переводится в раствор щелочами с образованием солей германиевой кислоты — гсрманатов.
При действии пероксида водорода на концентрированные растворы ''ер-манатов получаются соли надгерманиевых кислот, образующие кристаллогидраты, например Na2 Ge 05-4 H2 0.
Имеется несколько соединений германия с водородом. Установлено существование GeH — темного, легко взрывающегося порошка.
Известны также соединения типа германов GenH 2 „+2 (например, Ge 2 H 4 , Ge 2 He ), которые прн малых значениях п являются летучими. Моногерман GeH 4 —бесцветный газ с температурой кипения 88,9 °С.
Днгерман и трн-герман при комнатной температуре и обычном давлении существуют в жидкой фазе. Растворимость водорода в германии при 800 °С не превышает 1,5-10-7 % (эт.).
Углерод практически нерастворим в германии. В жидком германии вблизи температуры плавления растворимость углерода оценивается в 0,23 % (ат.). По данным различных авторов определена концентрация углерода в монокристаллическом германии от 7*10-4 до 5,2*10-3 %.
При нагреве германия до 700—750 °С в азоте или NH 3 образуются Ge 3 N 4 и Ge 3 N 2 . Нитрид германия Ge 3 N 2 представляет собой темно-коричневые кристаллы, легко подвергающиеся гидролизу. Термический распад на элементы начинается при 500 °С. Более стабилен нитрид Ge 2 N 4 , который разлагается выше 1000 °С.
Непосредственное взаимодействие германия с галогенами начинается около 250 °С. Наибольшее практическое значение имеет тетрахлорид GeCl 4 — основной промежуточный продукт при получении полупроводникового германия.
С иодом германий образует иодид Gel 4 — вещество желтого цвета с температурой плавления 146 °С и температурой кипения 375 °С. Gel 4 используется для получения высокочистого германия методом транспортных реакций.
Галогениды неустойчивы к воде.
Из соединений с серой известен дисульфид GeS 2 , который выделяется из сильнокислых растворов солей четырехвалентного германия при пропускании интенсивного тока сероводорода.
Кристаллический GcS 2 представляет собой белые чешуйки с перламутровым блеском, расплав застывает в янтарно-желтую прозрачную массу н обнаруживает полупроводниковые свойства Температура плавления GeS 2 —825 °С. Моносульфид германия GeS существует в аморфном и монокристаллическом состояниях.
Кристаллический GeS темно-серого цвета, плавится при 615 «С. Все халькогеннды германия (сульфиды, селениды и теллуриды) обнаруживают полупроводниковые свойства. С фосфором германий дает соединение GeP .
Технологические свойства
Германий характеризуется сравнительно высокой твердостью, большой хрупкостью и потому не может быть подвергнут холодной обработке давлением. Деформирование возможно при температурах, близких к температуре плавления, и в условиях всестороннего неравномерного сжатия.
С помощью алмазной пилы слиток германия может быть распилен на тонкие пластинки. Поверхность пластин шлифуется тонким корундовым порошком на стекле и полируется на сукне с суспензией из окиси алюминия.
Области применения
Германий играет исключительную роль в радиоэлектронике. Его применяют для изготовления кристаллических выпрямителей (диодов) и кристаллических усилителей (триодов), которые используются в вычислительной технике, телемеханике, радарных установках и т. д.
На основе германия созданы также мощные выпрямители с высоким к. п. д. для выпрямления переменного тока обычной частоты, рассчитанные на силу тока до 10000 А н выше.
- Германиевые триоды широко используются для усиления, генерирования или преобразования электрических колебаний.
- В радиотехнике получили распространение пленочные сопротивления от 1000 Ом до нескольких мегаом.
- Благодаря значительному изменению проводимости под действием излучения германий используется в различных фотодиодах н фотосо-противленнях.
- Германий находит применение для изготовления термистеров (при этом используется сильная температурная зависимость электросопротивления германия).
- В ядерной технике применяются германиевые детекторы уизлУче-ния.
Германиевые линзы, легированные золотом, являются неотъемлемой частью приборов инфракрасной техники. Из диоксида германия изготовляют специальные оптические стекла с большим коэффициентом преломления. Германий вводят также в состав сплавов для высокочувствительных термопар.
- Значительно увеличивается потребление германия в качестве катализатора в производстве искусственного волокна.
- Ряд соединений германия с переходными металлами имеет высокую температуру перехода в сверхпроводящее состояние, в частности материалы на основе соединения Nb 3 Ge ( T „>22 К).
- Предполагают, что некоторые органические соединения германия биологически активны: задерживают развитие злокачественных образований, понижают кровяное давление, оказывают обезболивающее действие.
Источник: https://ibrain.kz/himiya-svoystva-elementov/germaniy
Большая Рнциклопедия Нефти Рё Газа
Cтраница 4
Атомом индия замещен один атом германия. При этом оказываются заполненными электронные связи лишь трех соседних атомов, а связь с одним из четырех атомов германия будет. [46]
В упомянутых выше реакциях атом германия вводится в конец углеродной цепи. [47]
Пусть на один миллион атомов германия приходится всего один атом мышьяка. В таком полупроводнике преобладает электронная проводимость. [48]
При отрыве электронов от атомов германия в последних образуются свободные места, которые могут быть заняты другими электронами. [50]
Пусть на один миллион атомов германия приходится всего один атом мышьяка. В таком полупроводнике преобладает электронная проводимость. [52]
- В обеих модификациях вокруг атома германия тетраэдрически расположены четыре атома азота, и каждый атом азота, по-видимому, окружен тремя атомами герма ия. [53]
- По-видимому, 17 % атомов германия, находящихся в тетраэдрическом окружении, могут быть замещены на фосфор. [54]
- При отрыве от анода атома германия необходимо разорвать две ковалентные связи. [55]
Пусть на один миллион атомов германия приходится всего один атом мышьяка. В таком полупроводнике преобладает электронная проводимость. [57]
Рассматривая структуру электронных оболочек атома германия, следует сделать вывод Рѕ том, что РІ Рђ — оболочке атома германия для ее достройки РґРѕ оболочки криптона недостает четырех электронов. [58]
По-видимому, 17 % атомов германия, находящихся в тетраэдрическом окружении, могут быть замещены на фосфор. [59]
Если же один из атомов германия заменить атомом акцепторной примеси, например трехвалентным индием In ( рис.
211, б), то в силу структуры решетки германия атом индия захватит еще один электрон из заполненной зоны и превратится в отрицательный ион, а в заполненной зоне появится дырка. [60]
Страницы: 1 2 3 4 5
Источник: https://www.ngpedia.ru/id116803p4.html




