ДЕЛЕНИЕ ЯДЕР УРАНА

Делиться могут только ядра некоторых тяжелых элементов, например, урана.

Ядро урана — 235 имеет форму шара. Поглотив нейтрон, ядро возбуждается и начинает деформироваться.
Оно растягивается из стороны в сторону до тех пор, пока кулоновские силы отталкивания между протонами не начнут преобладать над ядерными силами притяжения.
После этого ядро разрывается на две части и осколки разлетаются со скоростью 1/30 скорости света. При делении ядра образуются еще 2 или 3 нейтрона.
Появление нейтронов объясняется тем, что число нейтронов в осколках оказывается больше, чем это допустимо.

- Таким образом, деление ядер урана сопровождается выделением большого количества энергии.
-

- ЦЕПНАЯ ЯДЕРНАЯ РЕАКЦИЯ
- — это процесс, в котором одна проведенная реакция вызывает последующие реакции такого же типа.
- При делении одного ядра урана образовавшиеся нейтроны могут вызвать деления других ядер урана, при этом число нейтронов нарастает лавинообразно.

Отношение числа образовавшихся нейтронов в одном акте деления к числу таких нейтронов в предыдущем акте деления называется коэффициентом размножения нейтронов k. При k меньше 1 реакция затухает, т.к. число поглщенных нейтронов больше числа вновь образовавшихся. При k больше 1 почти мгновенно происходит взрыв. При k равном 1 идет управляемая стационарная цепная реакция.
Цепная реакция сопровождается выделением большого количества энергии.
![]()
В природе изотопы урана-235 составляют всего лишь 0,7% от всего запаса урана, однако именно они пригодны для проведения цепной реакции, т.к. делятся под влиянием медленных нейтронов.
Ядра урана-238 могут делиться лишь под влиянием нейтронов большой энергии (быстрых нейтронов). Такую энергию имеют только 60% нейтронов, появляющихся при делении ядра урана-238. Примерно только 1 из 5 образовавшихся нейтронов вызывает деление ядра.
- Условия протекания цепной реакции в уране-235:
- Критическая масса:
- Для урана-235 критическая масса составляет 50 кг (это, например, шар из урана диаметром 9 см).
— минимальное количество топлива (критическая масса), необходимое для проведения управляемой цепной реакции в атомном реакторе — скорость нейтронов должна вызывать деление ядер урана — отсутствие примесей, поглощающих нейтроны — если масса урана мала, нейтроны будут вылетать за его пределы, не вступая в реакцию — если масса урана велика, возможен взрыв за счет сильного увеличения числа нейтронов — если масса соответствует критической, протекает управляемая цепная реакция ![]() Первая управляемая цепная реакция — США в 1942 г. (Э.Ферми) В СССР — 1946 г. (И.В.Курчатов).
Первая управляемая цепная реакция — США в 1942 г. (Э.Ферми) В СССР — 1946 г. (И.В.Курчатов).
Вспомни тему «Атомная физика» за 9 класс:
Радиоактивность.
Радиоактивные превращения.
Состав атомного ядра. Ядерные силы.
Энергия связи. Дефект масс.
Деление ядер урана.
Ядерная цепная реакция.
Ядерный реактор.
Термоядерная реакция.
Другие страницы по теме «Атомная физика» за 10-11 класс:
Строение атома
Квантовые постулаты Бора Методы регистрации частиц Естественная радиоактивность Радиоактивный распад Закон радиоактаивного распада Ядерные силы Открытие электрона Открытие протона Открытие нейтрона Строение ядра атома Изотопы Энергия связи ядра Ядерные реакции Деление ядер урана. Цепная реакция Ядерный реактор. Атомная бомба Термоядерная реакцияВодородная бомба Топливные ресурсы. Ядерная энергетика 
НЕМНОГО ИЗ ИСТОРИИ
В 1930 году в Кембридже Дж. Кокрофт и Э. Уолсон расщепили атом. Руководитель Кавендишской лаборатории лорд Э. Резерфорд публично высказался по поводу этого эксперимента: «Расщепление атома, это всего лишь наиболее элегантный эксперимент и элегантность его в том и состоит, что он не имеет никакого практического применения». ___
Когда во Франции начались работы по созданию атомного оружия и, соответственно, по очистке изотопов урана, внезапно обнаружилось, что уран из окрестностей западноафриканской деревушки Окло вместо 0.
71% для урана-235, годного для боеприпасов, содержит только 0.68%.
Последовавшее за этим разбирательство привело к открытию уникального, поистине единственного в своем роде объекта – природного ядерного реактора! При этом при работе этого реактора расходовалась часть урана-235.
___
Недавно человечество отметило 50-летие атомных бомбардировок Хиросимы и Нагасаки. Путь к этим трагическим событиям проходил и под главной трибуной Чикагского стадиона, где 2-го декабря 1942 года была проведена первая цепная ядерная реакция.
___
Из анекдота о том, что такое цепная реакция: «Если кто-то разгуливает неподалеку от сидящей на цепи собаки, она начинает лаять, а следом за ней — и другие собаки».
Источник: http://class-fizika.narod.ru/at13.htm
Урок 2. Изотопы элементов – HIMI4KA
Архив уроков › Основные законы химии
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.

Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами.
Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает.
По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).

Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число.
Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона.
Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».

На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3).
Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены.
Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы).
Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.
) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе.
Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg.
Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg.
Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-2-izotopy-jelementov.html
Раздел 9. Уран — Энергетика: история, настоящее и будущее
Совершенно другую разновидность ископаемого топлива представляет собой ядерное сырье – уран, торий. Только в самом конце XIX – начале XX века был открыт ряд явлений, подтверждающих сложность строения атомов (об этом более подробно будет рассказано в третьем томе издания).
Использование ядерной энергии стало возможным после открытия деления ядер атомов тяжелых элементов при захвате ими нейтронов в конце 30-х годов ХХ века немецкими учёными О. Ганом и Ф. Штрассманом.
При этом испускаются новые частицы и освобождается энергия связи ядра атомов, передаваемая осколкам деления (рис. 9.1).
Деление урана вызывается присоединением к ядру его атома нейтрона и образованием составного ядра. Последнее делится на два осколка, освобождая вторичные нейтроны, среднее число которых равно 2–3 на акт деления. Однако в отдельных реакциях деления число вторичных нейтронов может достигать 10. В каждой реакции деления выделяется энергия около 200 МэВ (1 МэВ = 1,6 · 10 -1 3 Дж).
- Для иллюстрации можно привести две из многих возможных схем реакции деления:
- 92 U + 0 n > 57 L a + 35 B r + 2 0 n + Q f ≈ 20 0 МеВ
- або
- 92 U + 0 n > 51 B a + 36 K r + 3 0 n + Q f ≈ 20 0 МеВ.
- Такое количество энергии выделяется при делении ядра атома урана-235 и уносится различными видами излучения.
- Это открытие сделало ХХ век атомным и прибавило к запасам энергетического ископаемого топлива (уголь, нефть, газ) существенный клад ядерного горючего.
Уран (лат. Uranium) – радиоактивный химический элемент III группы периодической системы элементов Менделеева – относится к актиноидам. Атомный номер этого элемента – 92, атомная масса – 238,029, металл.
Природный уран состоит из смеси трёх изотопов: 238 U c периодом полураспада 4,51·10 9 лет (99,274%), 235 U с периодом полураспада 7,13·10 8 лет (0,702%) и 234 U с периодом полураспада 2,48·10 5 лет (0,024%).
Из 11 искусственных радиоактивных изотопов с массовыми числами от 227 до 240 долгоживущим является 23 U с периодом полураспада 1,62·10 5 лет. Его получают при нейтронном облучении тория по реакции

Уран был открыт в 1789 году немецким химиком М.Г. Клапротом (1743–1817).
Уран был назван в честь открытой в 1781 году В. Гершелем планеты Уран. В металлическом состоянии он был получен в 1841 году французским химиком Э Пелиго. Первоначально урану приписывали атомную массу 120 и только в 1871 году Д.И.
Менделеев пришел к выводу, что атомная масса его почти в два раза больше. По цвету уран похож на сталь, легко поддается обработке, имеет удельное электрическое сопротивление при комнатной температуре около 3·10 — 7 Ом·см, слабый парамагнетик.
Механические свойства урана зависят от егочистоты, а также от режимов механической и термической обработки.
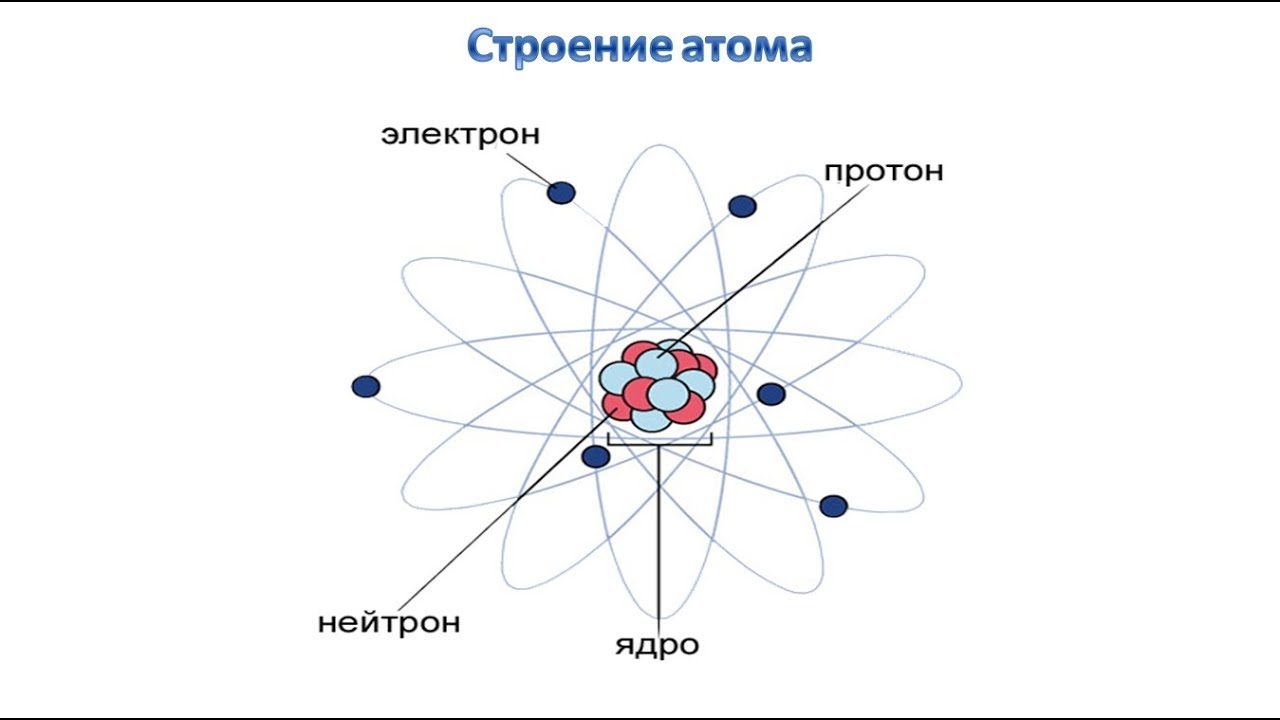 Рис. 9.1. Схема деления ядра
Рис. 9.1. Схема деления ядра
Облучение урана потоком нейтронов (которое имеет место в ядерном реакторе) изменяет его физико-механические свойства: развивается ползучесть и повышается хрупкость, наблюдается деформация изделий, что заставляет использовать уран в ядерных реакторах в виде различных урановых сплавов.
Температура плавления урана 1129–1133°С, теплопроводность его довольно низкая и при изменении температуры от 200 до 850°С изменяется практически линейно от 30 до 50 Вт/м ·°С.
При этом она практически не зависит от технологии изготовления и термообработки, за исключением урана, полученного методом порошковой металлургии.
Уран обладает плохой коррозионной стойкостью в воде и водяном паре. При температуре до 70°С в насыщенной кислородом воде на уране образуется тонкая плотная пленка оксида, оказывающая защитное действие.
С ростом температуры оксидная пленка теряет защитные свойства, коррозия увеличивается и, кроме того, отмечается точечная коррозия.
С насыщенным паром уран реагирует при 150–250°С, образуя диоксид урана UO 2 и гидрид урана UH 3, при температуре 289–300°С образуются в основном оксиды.
В случае его контакта с пароводяным теплоносителем образующийся при окислении водород быстро диффундирует через уран, образуя UH 3, вследствие чего уран распухает. Для повышения коррозионной стойкости уран легируют цирконием, ниобием, молибденом, однако это только задерживает коррозию, но не предотвращает её.
Уран – радиоактивный элемент. Ядра 238 U и 235 U являются родоначальниками двух радиоактивных рядов. Ядра 23 U и 235 U делятся при захвате как медленных (тепловых), так и быстрых нейтронов, а ядра 238 U делятся только при захвате быстрых нейтронов с энергией не менее 1 МэВ.
Все эти ядра могут делиться самопроизвольно (спонтанно), но вероятность такого процесса очень мала. При радиационном захвате нейтронов ядра 238 U превращаются в 239 Pu, ядерные свойства которого близки к свойствам урана-235.
Распад ядер урана 238 U и 235 U завершается образованием стабильных изотопов свинца с атомным номером 82.
Природный, или естественный уран, извлекаемый из урановых руд, часто обогащается по изотопу 235 U до получения необходимого процентного содержания последнего. Такой уран называют обогащенным.
 Рис. 9.2. Энергия деления 25U
Рис. 9.2. Энергия деления 25U
Уран – характерный элемент для граничного слоя и осадочной оболочки земной коры. Среднее содержание урана по массе в земной коре 2,5·10 -4 %, в кислых изверженных породах – 3,5·10 -4 %, в глинах и сланцах – 3,2·10 -4 %, в основных породах – 5·10 -5 %, в ультраосновных породах мантии – 3·10 -7 %.
Он энергично мигрирует в холодных и горячих, нейтральных и щелочных водах в форме простых и комплексных ионов. Соединения урана, как правило, хорошо растворимы в водах с окислительной средой и плохо растворимы в водах с восстановительной средой (например сероводородных).
Известно более 150 минералов урана, промышленное значение из них имеют только 12. В ходе геологической истории содержание урана в земной коре уменьшилось за счёт радиоактивного распада. С этим процессом связано накопление в земной коре атомов свинца.
Радиоактивный распад урана играет важную роль в энергетике земной коры, являясь существенным источником глубинного тепла.
Профессор Берлинского университета Мартин Генрих Клапрот был одним из авторитетнейших химиков своего времени. И это неудивительно.
Клапрот был предельно строг к себе и другим, по точности эксперимента современники могли сравнить с ним только выдающегося французского химика Луи Никола Ваклена.
Клапрот открыл четыре новых элемента: в 1789 году – уран и цирконий, в 1792 году – титан (причем независимо от немного опередившего его англичанина Грегора), а в 1803 году – церий.
Уран и торий распределены в земной коре в породах самого разного возраста.
Хотя общие ресурсы урана в земной коре оцениваются в 10 1 3 т, а тория в 2·10 1 3 т, промышленных ресурсов этих металлов (с приемлемой стоимостью производства) намного меньше.
Уран в природе встречается гораздо чаще, чем золото, серебро, платина, молибден, ртуть, но находится в основном в рассеянном состоянии, что затрудняет поиск и разработку месторождений.
Основным типом руды, из которой добывают в промышленном масштабе торий, является моноцит. Его месторождения имеются во многих странах мира. На втором месте – минерал торит (силикат тория), содержащий 5–10% ThO 2. В течение ближайших 20 лет торий не может быть альтернативой урану в качестве сырья для ядерной энергетики.
Длительное время уран представлял интерес только для узкого круга химиков и находил ограниченное применение для производства красок и цветного стекла.
С открытием явления радиоактивности урана в 1896 году и радия в 1898 году началась промышленная переработка урановых руд с целью извлечения и использования радия в научных исследованиях и медицине.
На ранней стадии производства радия наиболее известными сырьевыми источниками были месторождения уранита в Чехословакии и карнотитовых руд на Колорадском плато в США. В 1923 году появились новые, более крупные и богатые месторождения Шинколобве в Бельгийском Конго (ныне – Заир).
В 1933 году на мировой рынок урана вышла Канада, начав добычу уранита на месторождениях Эльдорадо в Форт-Радиуме в северо-западных районах. Растущие потребности в ванадии и его интенсивные поиски привели в 1936 году к открытию новых крупных залежей урановой руды в районе Колорадского плато в США.
После открытия в 1939 году явления деления ядер урана начиная с 1942 года уран стал основным ядерным топливом.
Это стимулировало развитие в США технологии получения урана из отходов породы, оставшейся после извлечения радия и ванадия.
В начале 1950-х годов добыча и обогащение урана в США получили новый импульс, поскольку правительство предоставило гарантированный рынок сбыта. Начала создаваться урановая промышленность.
Урановая горно-металлургическая промышленность, включающая поиск и разведку урана, разработку урановых месторождений, гидрометаллургический передел уранового сырья, представляет собой крупную отрасль экономики. В период разработки ядерного оружия уран требовался в огромных количествах и это обусловило бурные темпы развития урановой промышленности и ее высокий технический уровень.
Технический уровень урановой промышленности и её производственные возможности на современном этапе соответствуют потребностям развивающейся ядерной энергетики.
Благодаря финансовым льготам, которые предоставлялись правительствами заинтересованных в уране стран, уранодобывающим фирмам в первые годы становления урановой промышленности в довольно сжатые сроки удалось открыть крупные месторождения урана.
Новые открытия были сделаны в Канаде и по мере их разработки в провинциях Саскачеван и Онтарио производство урана увеличилось. В 1952 году в Южной Африке уран стали получать в качестве побочного продукта при добыче золота.
В 1955 году Франция, добившись успехов в разработке важных залежей урана жильного типа на своей территории, расширила исследования и разведку осадочных отложений в ряде районов Африки, что привело к открытию месторождений в Габоне в 1956 году. В 1960 году значительные залежи были обнаружены в Нигерии и Центрально-Африканской Республике. Большая часть сырьевых ресурсов урана сосредоточена в Австралии, главным образом в месторождениях жильного типа и сходных образований.
Уран и его соединения радиационно и химически токсичны. Токсическое действие урана обусловлено его химическими свойствами и зависит от растворимости.
Отравление ураном и его соединениями возможно на предприятиях по добыче и переработке уранового сырья и других промышленных объектах, где он используется в технологическом процессе. При попадании в организм уран действует на все органы и ткани, являясь общеклеточным ядом.
Признаки отравления обусловлены преимущественно поражением почек, поражаются также печень и желудочно-кишечный тракт.
По существу до 1965 года весь производившийся уран предназначался для военных целей, поскольку ядерная энергетика была ещё недостаточно развита. После 1965 года ядерные державы и в первую очередь США сократили объем закупок урана для военных программ и спрос на делящиеся материалы резко снизился.
Уранопроизводящие страны Канада, Австралия и ЮАР оказались без рынков сбыта урана и были вынуждены сокращать производство урановых концентратов, что привело к закрытию значительного числа предприятий по добыче и переработке уранового сырья, а оставшиеся предприятия работали не на полную мощность.
Однако интенсивное развитие ядерной энергетики в конце 60-х годов прошлого столетия способствовало новому подъему урановой промышленности.
Урановую руду в основном добывают открытым, подземным и нетрадиционным (например кучное выщелачивание) способами. Основные применяемые системы разработки: камерно-столбовая в различных вариантах; сплошная система разработки длинными лавами; слоевая выемка с гидрозакладкой; с магазинированием руды.
В последние годы отмечается снижение содержания урана во вновь открываемых месторождениях (за исключением руд месторождений жильного типа). Для обеспечения необходимого прироста запасов урана поисково-разведочные работы во все возрастающем масштабе проводят в нетрадиционных для уранопроизводящих стран геологических средах и породах.
По-видимому, в будущем в эксплуатацию будут вовлекаться бедные руды с содержанием урана 0,03–0,04%, например месторождения в пегманитах, сиенитах и гранитах.
Источником урана также могут служить темные ураноносные сланцы со средним содержанием 0,01–0,04% U 3 O 8 и ураноносные фосфориты, широко распространенные в США, Марокко, Алжире, Египте, Тунисе и некоторых других странах.
В случае крайней необходимости может быть налажено извлечение урана из морской воды. Запасы урана в Мировом океане оцениваются приблизительно в 4 млрд. т при средней его концентрации 3·10 — 3 г/м 3.
Реализация программ развития ядерной энергетики в мире в начале XXI века будет в основном базироваться на водо-водяных реакторах, использующих в качестве топлива обогащенный уран, а это зависит от наличия достаточных производственных мощностей по разделению урана. Поэтому для всех стран, развивающих ядерную энергетику, решение проблемы обогащения урана имеет первостепенное значение.
На первом этапе развития ядерной энергетики производство обогащенного урана во всем мире осуществлялось газодиффузионным методом разделения изотопов.
С 80-х годов ХХ столетия для разделения изотопов урана используют более совершенную центробежную технологию, которая по сравнению с газодиффузионной имеет ряд преимуществ: в 10–13 раз меньше расход электроэнергии, возможна реализация модульной схемы наращивания производственных мощностей, существуют перспективы дальнейшего совершенствования. Использование газодиффузионной и центробежной технологий ввиду их большой технической сложности доступно только странам с высокоразвитой индустрией. В странах с менее развитой промышленностью могут найти применение аэродинамические методы разделения урана. В начале ХХI столетия найдет применение в промышленных масштабах и разработанная лазерная технология разделения изотопов урана.
По оценкам разработчиков, эта технология позволяет осуществлять строительство менее капиталоемких заводов по разделению изотопов урана и обеспечивать извлечение 235 U из продуктов отходов заводов с другими технологиями, что даст возможность полнее использовать природный уран.
В пределах территории Украины находится одна из самых больших в мире ураноносных провинций – центральная часть Украинского кристаллического щита. В пределах этой провинции в период 1964–1989 годов было открыто около 20 месторождений урана.
Сырьевая база урана в Украине представлена месторождениями, руда которых может отрабатываться подземным способом и методом подземного вылуживания поверхности. При этом запасы промышленных категорий разведки урана отвечают потребностям украинских АЭС на период не менее 100 лет.
В случае перехода в будущем к использованию реакторов на быстрых нейтронах этот потенциал мог бы в десятки раз увеличиться. Кроме того, запасы украинского урана находятся на хорошо освоенной территории с развитой инфраструктурой и наличием рабочей силы.
В Украине сформировалась отечественная школа геологов-уранников, внедрялись передовые технологии уранодобычи.
Восточный горнообогатительный комбинат первым в мире освоил технологию подземного вылуживания, основными преимуществами которой являются низкая себестоимость продукции, незначительные капиталовложения, быстрые темпы введения в эксплуатацию и окупаемость инвестиций, а также – соответствие природоохранным требованиям, а благоприятные геологические и природно-климатические условия позволяли создавать на базе разведанных месторождений крупные горнодобывающие предприятия продуктивностью 2–3 млн. т руды в год. Следует также иметь в виду, что потенциал недр Украины по урану еще далеко не исчерпан. Сохраняются перспективы открытия крупных месторождений традиционного для Украины типа, а также месторождений более богатых руд типа канадских и австралийских.
Источник: http://energetika.in.ua/ru/books/book-1/part-2/section-9
Деление ядер урана — Класс!ная физика
«Физика — 11 класс»
Делиться на части могут только ядра некоторых тяжелых элементов. При делении ядер испускаются два-три нейтрона и γ-лучи.
- Одновременно выделяется большая энергия.
- Открытие деления урана
Деление ядер урана было открыто в 1938 г. немецкими учеными О. Ганом и Ф. Штрассманом. Они установили, что при бомбардировке урана нейтронами возникают элементы средней части периодической системы: барий, криптон и др.
Однако правильное истолкование этого факта именно как деления ядра урана, захватившего нейтрон, было дано в начале 1939 г. английским физиком О. Фришем совместно с австрийским физиком Л. Мейтнер.
Захват нейтрона нарушает стабильность ядра. Ядро возбуждается и становится неустойчивым, что приводит к его делению на осколки.
Деление ядра возможно потому, что масса покоя тяжелого ядра больше суммы масс покоя осколков, возникающих при делении.
Поэтому происходит выделение энергии, эквивалентной уменьшению массы покоя, сопровождающему деление. Но полная масса сохраняется, так как масса движущихся с большой скоростью осколков превышает их массу покоя.
Возможность деления тяжелых ядер можно также объяснить с помощью графика зависимости удельной энергии связи от массового числа A.
Удельная энергия связи ядер атомов элементов, занимающих в периодической системе последние места (А ≈ 200), примерно на 1 МэВ меньше удельной энергии связи в ядрах элементов, находящихся в середине периодической системы (А ≈ 100).
Поэтому процесс деления тяжелых ядер на ядра элементов средней части периодической системы является энергетически выгодным. Система после деления переходит в состояние с минимальной внутренней энергией.
Ведь, чем больше энергия связи ядра, тем большая энергия должна выделяться при возникновении ядра и, следовательно, тем меньше внутренняя энергия образовавшейся вновь системы.

При делении ядра энергия связи, приходящаяся на каждый нуклон, увеличивается на 1 МэВ и общая выделяющаяся энергия должна быть огромной — порядка 200 МэВ. Ни при какой другой ядерной реакции (не связанной с делением) столь больших энергий не выделяется.
На рисунке представлены треки осколков делящегося урана в камере Вильсона.
Выделяющаяся при делении ядра энергия имеет электростатическое, а не ядерное происхождение. Большая кинетическая энергия, которую имеют осколки, возникает вследствие их кулоновского отталкивания.
Механизм деления ядра
Процесс деления атомного ядра можно объяснить на основе капельной модели ядра. Согласно этой модели сгусток нуклонов напоминает капельку заряженной жидкости.
Ядерные силы между нуклонами являются короткодействующими, подобно силам, действующим между молекулами жидкости.
Наряду с большими силами электростатического отталкивания между протонами, стремящимися разорвать ядро на части, действуют еще бо́льшие ядерные силы притяжения.
Эти силы удерживают ядро от распада.

Ядро урана-235 имеет форму шара. Поглотив лишний нейтрон, оно возбуждается и начинает деформироваться, приобретая вытянутую форму. Ядро будет растягиваться до тех пор, пока силы отталкивания между половинками вытянутого ядра не начнут преобладать над силами притяжения, действующими в перешейке. После этого оно разрывается на две части.
- Под действием кулоновских сил отталкивания эти осколки разлетаются со скоростью, равной 1/30 скорости света.
- Испускание нейтронов в процессе деления
Фундаментальный факт ядерного деления — испускание в процессе деления двух-трех нейтронов. Именно благодаря этому оказалось возможным практическое использование внутриядерной энергии.
Понять, почему происходит испускание свободных нейтронов, можно исходя из следующих соображений. Известно, что отношение числа нейтронов к числу протонов в стабильных ядрах возрастает с повышением атомного номера.
Поэтому у возникающих при делении осколков относительное число нейтронов оказывается большим, чем это допустимо для ядер атомов, находящихся в середине таблицы Менделеева.
В результате несколько нейтронов освобождается в процессе деления.
Их энергия имеет различные значения — от нескольких миллионов электрон-вольт до совсем малых, близких к нулю.
Деление обычно происходит на осколки, массы которых отличаются примерно в 1,5 раза. Осколки эти сильно радиоактивны, так как содержат избыточное количество нейтронов.
В результате серии последовательных β-распадов в конце концов получаются стабильные изотопы.
Существует также спонтанное деление ядер урана. Оно было открыто советскими физиками Г. Н. Флеровым и К. А. Петржаком в 1940 г.
- Период полураспада для спонтанного деления равен 1016 лет.
- Реакция деления ядер сопровождается выделением энергии.
- Деление атомных ядер тяжелых элементов возможно благодаря тому, что удельная энергия связи этих ядер меньше удельной энергии связи ядер элементов, находящихся в середине периодической системы Менделеева.
- Источник: «Физика — 11 класс», учебник Мякишев, Буховцев, Чаругин
Это в два миллиона раз больше периода полураспада при α-распаде урана. Следующая страница «Цепные ядерные реакции» Назад в раздел «Физика — 11 класс, учебник Мякишев, Буховцев, Чаругин»
Физика атомного ядра. Физика, учебник для 11 класса — Класс!ная физика
Методы наблюдения и регистрации элементарных частиц — Открытие радиоактивности. Альфа-, бета- и гамма-излучения — Радиоактивные превращения — Закон радиоактивного распада. Период полураспада — Открытие нейтрона — Строение атомного ядра. Ядерные силы.
Изотопы — Энергия связи атомных ядер — Ядерные реакции — Деление ядер урана — Цепные ядерные реакции — Ядерный реактор — Термоядерные реакции.
Применение ядерной энергии — Получение радиоактивных изотопов и их применение — Биологическое действие радиоактивных излучений — Краткие итоги главы — Три этапа в развитии физики элементарных частиц — Открытие позитрона. Античастицы
Источник: http://class-fizika.ru/11_80.html
Уран (химический элемент)
Содержание статьи
УРАН, U (uranium), металлический химический элемент семейства актиноидов, которые включают Ac, Th, Pa, U и трансурановые элементы (Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr). Уран приобрел известность благодаря использованию его в ядерном оружии и атомной энергетике. Оксиды урана применяются также для окрашивания стекла и керамики.
Нахождение в природе
Содержание урана в земной коре составляет 0,003%, он встречается в поверхностном слое земли в виде четырех видов отложений. Во-первых, это жилы уранинита, или урановой смолки (диоксид урана UO2), очень богатые ураном, но редко встречающиеся. Им сопутствуют отложения радия, так как радий является прямым продуктом изотопного распада урана.
Такие жилы встречаются в Заире, Канаде (Большое Медвежье озеро), Чехии и Франции. Вторым источником урана являются конгломераты ториевой и урановой руды совместно с рудами других важных минералов. Конгломераты обычно содержат достаточные для извлечения количества золота и серебра, а сопутствующими элементами становятся уран и торий.
Большие месторождения этих руд находятся в Канаде, ЮАР, России и Австралии. Третьим источником урана являются осадочные породы и песчаники, богатые минералом карнотитом (уранил-ванадат калия), который содержит, кроме урана, значительное количество ванадия и других элементов. Такие руды встречаются в западных штатах США.
Железоурановые сланцы и фосфатные руды составляют четвертый источник отложений. Богатые отложения обнаружены в глинистых сланцах Швеции. Некоторые фосфатные руды Марокко и США содержат значительные количества урана, а фосфатные залежи в Анголе и Центральноафриканской Республике еще более богаты ураном. Большинство лигнитов и некоторые угли обычно содержат примеси урана.
Богатые ураном отложения лигнитов обнаружены в Северной и Южной Дакоте (США) и битумных углях Испании и Чехии.
Открытие
Уран был открыт в 1789 немецким химиком М.Клапротом, который присвоил имя элементу в честь открытия за 8 лет перед этим планеты Уран. (Клапрот был ведущим химиком своего времени; он открыл также другие элементы, в том числе Ce, Ti и Zr.
) В действительности вещество, полученное Клапротом, было не элементным ураном, но окисленной формой его, а элементный уран был впервые получен французским химиком Э.Пелиго в 1841. С момента открытия и до 20 в. уран не имел того значения, какое он имеет сейчас, хотя многие его физические свойства, а также атомная масса и плотность были определены.
В 1896 А.Беккерель установил, что соли урана обладают излучением, которое засвечивает фотопластинку в темноте. Это открытие активизировало химиков к исследованиям в области радиоактивности и в 1898 французские физики супруги П.Кюри и М.Склодовская-Кюри выделили соли радиоактивных элементов полония и радия, а Э.Резерфорд, Ф.Содди, К.
Фаянс и другие ученые разработали теорию радиоактивного распада, что заложило основы современной ядерной химии и атомной энергетики.
Первые применения урана
Хотя радиоактивность солей урана была известна, его руды в первой трети нынешнего столетия использовались лишь для получения сопутствующего радия, а уран считался нежелательным побочным продуктом.
Его использование было сосредоточено в основном в технологии керамики и в металлургии; оксиды урана широко применяли для окраски стекла в цвета от бледножелтого до темнозеленого, что способствовало развитию недорогих стекольных производств.
Сегодня изделия этих производств идентифицируют как флуоресцирующие под ультрафиолетовыми лучами. Во время Первой мировой войны и вскоре после нее уран в виде карбида применяли в производстве инструментальных сталей, аналогично Mo и W; 4–8% урана заменяли вольфрам, производство которого в то время было ограничено.
Для получения инструментальных сталей в 1914–1926 ежегодно производили по нескольку тонн ферроурана, содержащего до 30% (масс.) U. Однако такое применение урана продолжалось недолго.
Современное применение урана
Промышленность урана начала складываться в 1939, когда было осуществлено деление изотопа урана 235U, что привело к технической реализации контролируемых цепных реакций деления урана в декабре 1942.
Это было рождение эры атома, когда уран из незначительного элемента превратился в один из наиболее важных элементов в жизни общества. Военное значение урана для производства атомной бомбы и использование в качестве топлива в ядерных реакторах вызвали спрос на уран, который возрос в астрономических размерах.
Интересна хронология роста потребности в уране по истории отложений в Большом Медвежьем озере (Канада). В 1930 в этом озере была обнаружена смоляная обманка – смесь оксидов урана, а в 1932 на этом участке была налажена технология очистки радия.
Из каждой тонны руды (смоляной обманки) получали 1 г радия и около половины тонны побочного продукта – уранового концентрата. Однако радия было мало и его добыча была прекращена. С 1940 по 1942 разработку возобновили и начали отправку урановой руды в США.
В 1949 аналогичная очистка урана с некоторыми усовершенствованиями была применена для производства чистого UO2. Это производство росло, и в настоящее время оно является одним из наиболее крупных производств урана.
| СВОЙСТВА УРАНА | |
| Атомный номер | 92 |
| Атомная масса | 238,03 |
| Изотопы | |
| стабильные | нет |
| нестабильные | 226–242 |
| в т. ч. природные | 234, 235, 236 (следы), 238 |
| Температура плавления, °С | 1132 |
| Температура кипения, °С | 3818 |
| Плотность, г/см3 | 18,7 |
| Твердость (по Моосу) | 4,0 |
| Содержание в земной коре, % (масс.) | 0,003 |
| Степени окисления | +3, +4, +5, +6 |
Свойства
Уран – один из наиболее тяжелых элементов, встречающихся в природе. Чистый металл очень плотный, пластичный, электроположительный с малой электропроводностью и высокореакционноспособный.
Уран имеет три аллотропные модификации: a-уран (орторомбическая кристаллическая решетка), существует в интервале от комнатной температуры до 668° С; b-уран (сложная кристаллическая решетка тетрагонального типа), устойчивый в интервале 668–774° С; g-уран (объемноцентрированная кубическая кристаллическая решетка), устойчивый от 774° С вплоть до температуры плавления (1132° С). Поскольку все изотопы урана нестабильны, все его соединения проявляют радиоактивность.
Изотопы урана
238U, 235U, 234U встречаются в природе в соотношении 99,3:0,7:0,0058, а 236U – в следовых количествах. Все другие изотопы урана от 226U до 242U получают искусственно. Изотоп 235U имеет особо важное значение.
Под действием медленных (тепловых) нейтронов он делится с освобождением огромной энергии. Полное деление 235U приводит к выделению «теплового энергетического эквивалента» 2Ч107 кВтЧч/кг.
Деление 235U можно использовать не только для получения больших количеств энергии, но также для синтеза других важных актиноидных элементов.
Уран природного изотопного состава можно использовать в ядерных реакторах для производства нейтронов, образующихся при делении 235U, в то же время избыточные нейтроны, не востребуемые цепной реакцией, могут захватываться другим природным изотопом, что приводит к получению плутония:

- При бомбардировке 238U быстрыми нейтронами протекают следующие реакции:

- Согласно этой схеме, наиболее распространенный изотоп 238U может превращаться в плутоний-239, который, подобно 235U, также способен делиться под действием медленных нейтронов.
В настоящее время получено большое число искусственных изотопов урана. Среди них 233U особенно примечателен тем, что он также делится при взаимодействии с медленными нейтронами.
Некоторые другие искусственные изотопы урана часто применяются в качестве радиоактивных меток (индикаторов) в химических и физических исследованиях; это прежде всего b-излучатель 237U и a-излучатель 232U.
Соединения
Уран – высокореакционноспособный металл – имеет степени окисления от +3 до +6, близок бериллию в ряду активности, взаимодействует со всеми неметаллами и образует интерметаллические соединения с Al, Be, Bi, Co, Cu, Fe, Hg, Mg, Ni, Pb, Sn и Zn.
Тонкораздробленный уран особенно реакционноспособен и при температурах выше 500° С часто вступает в реакции, характерные для гидрида урана. Кусковой уран или стружка ярко сгорает при 700–1000° С, а пары урана горят уже при 150–250° С, с HF уран реагирует при 200–400° С, образуя UF4 и H2.
Уран медленно растворяется в концентрированной HF или H2SO4 и 85%-ной H3PO4 даже при 90° С, но легко реагирует с конц. HCl и менее активно с HBr или HI. Наиболее активно и быстро протекают реакции урана с разбавленной и концентрированной HNO3 с образованием нитрата уранила (см. ниже).
В присутствии HCl уран быстро растворяется в органических кислотах, образуя органические соли U4+. В зависимости от степени окисления уран образует несколько типов солей (наиболее важные среди них с U4+, одна из них UCl4 – легко окисляемая соль зеленого цвета); соли уранила (радикала UO22+) типа UO2(NO3)2 имеют желтую окраску и флуоресцируют зеленым цветом.
Соли уранила образуются при растворении амфотерного оксида UO3 (желтая окраска) в кислой среде. В щелочной среде UO3 образует уранаты типа Na2UO4 или Na2U2O7. Последнее соединение («желтый уранил») применяют для изготовления фарфоровых глазурей и в производстве флуоресцентных стекол. См. также КЕРАМИКА ПРОМЫШЛЕННАЯ.
Галогениды урана широко изучались в 1940–1950, так как на их основе были разработаны методы разделения изотопов урана для атомной бомбы или ядерного реактора.
Трифторид урана UF3 был получен восстановлением UF4 водородом, а тетрафторид урана UF4 получают разными способами по реакциям HF с оксидами типа UO3 или U3O8 или электролитическим восстановлением соединений уранила.
Гексафторид урана UF6 получают фторированием U или UF4 элементным фтором либо действием кислорода на UF4. Гексафторид образует прозрачные кристаллы с высоким коэффициентом преломления при 64° С (1137 мм рт. ст.); соединение летуче (в условиях нормального давления возгоняется при 56,54° С).
Оксогалогениды урана, например, оксофториды, имеют состав UO2F2 (фторид уранила), UOF2 (оксид-дифторид урана). См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ; РАДИОАКТИВНОСТЬ; УРАНИНИТ; УРАНОВАЯ ПРОМЫШЛЕННОСТЬ.
Источник: https://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/URAN.html
II. Строение атома
Каждое химическое вещество состоит из однородных частиц, называемых молекулами. Если разложить молекулу на более элементарные составные части, мы получим атомы.
Атом принято схематически изображать в виде ядра с вращающимися вокруг него электронами. Ядро состоит из двух видов элементарных частиц (нуклонов): протонов, несущих положительный электрический заряд, и нейтронов, не имеющих никакого электрического заряда. Вокруг ядра вращается целый рой отрицательно заряженных электронов, расположенных в несколько слоев.
1. Атомный номер Z и массовое число А.
Количество протонов, содержащихся в ядре того или иного элемента, равно атомному номеру Z этого элемента. Например, в ядре водорода и его изотопов содержится всего один протон, а в ядре урана — 92 протона. Поэтому водород имеет атомный номер 1, а уран — 92.
Атом электрически нейтрален.
Поскольку величина электрического заряда протона равна величине заряда электрона, который называется элементарным зарядом, можно сделать вывод, что число протонов в ядре равно числу электронов, вращающихся вокруг ядра. Следовательно, атомный номер элемента дает возможность судить как о количестве протонов, так и о количестве электронов, содержащихся в атоме этого элемента.
Массовое число А соответствует количеству нуклонов или общему числу протонов и нейтронов в ядре того или иного элемента.
В ядре легкого водорода содержится всего один протон, вокруг которого вращается один электрон. В ядре дейтерия, кроме протона, имеется 1 нейтрон, что в сумме составляет 2 частицы, а в ядре трития — 2 нейтрона, то есть всего 3 частицы. Поэтому мы обозначаем эти изотопы так: легкий водород — iH1, дейтерий — iH2, тритий — iH3.
Из 11 изотопов урана 3 изотопа (с атомным весом 234, 235 и 238) являются естественными.
Содержание урана 235 в природном уране составляет 1/140, а урана 238 — 139/140. Это означает, что на каждые 140 ядер природного урана приходится всего одно ядро урана 235, а остальную массу его составляет уран 238. Что касается урана 234, то в природном уране можно обнаружить лишь его следы.
В ядре урана 235 насчитывается 235 нуклонов. Поскольку число протонов в ядре урана равно 92, простым вычитанием можно определить количество нейтронов, которое в ядре урана 235 будет равно 143. Уран 238 отличается от урана 235 тем, что в его ядре на 3 нейтрона больше. Эти 3 естественных изотопа урана можно обозначить следующим образом: 92U234, 92U235, 92U238.
Плутоний, который в таблице Менделеева стоит в 94-й клетке, имеет массовое число 239. Это означает, что ядро плутония содержит 94 протона и 145 нейтронов.
Следовательно, количество нейтронов любого элемента равно разности А — Z.
Число нейтронов в ядрах легких элементов, как правило, примерно равно числу протонов. Что касается тяжелых элементов, то в их ядрах нейтронов больше, чем протонов.
2. Размеры атома и ядра.
Радиус атома выражается числом порядка 10-8 см, что соответствует десяти тысячным микрона (микрон равен тысячной доле миллиметра), радиус ядра равен примерно 10-13 см, или одной миллиардной доле микрона. Иными словами, атом в 100 тыс. раз больше его ядра. Из этих цифр можно сделать вывод, что между ядром и электронной оболочкой ничего нет — «вещество заполнено пустотой»[1].
Необходимо сделать еще одно важное замечание: почти вся масса атома сосредоточена в ядре. Чтобы проиллюстрировать необычайную плотность ядра, скажем, что 1 см3 ядер урана весит более 100 млн. т!
Конечно, представить себе такую громадную плотность очень трудно.
3. Сложное строение атома.
Схема атома, которую мы дали выше, очень упрощена. На самом же деле, кроме тех частиц, о которых мы уже говорили, существуют еще положительно заряженные электроны, называемые позитронами, а также отрицательно заряженные протоны, или антипротоны. Сейчас ученые говорят даже об антинейтронах. Действительно, в некоторых случаях протоны передают свой заряд нейтронам.
Следовательно, эти две частицы могут в определенных условиях превращаться из одной в другую. Кроме того, они связаны между собой особыми силами, носящими название ядерных сил, природа которых мало изучена.
Не подлежит сомнению, что все эти понятия со временем будут уточнены и, может быть, ученым удастся обнаружить новые частицы, более элементарные, чем известные нам сегодня.
Все так называемые «классические» свойства элементов (химические, электрические, магнитные) обусловливаются числом электронов и структурой электронной оболочки.
Лишь явления радиоактивности и превращения элементов связаны с изменениями внутри ядра.
Электроны должны рассматриваться одновременно и как материальные частицы, и как волны; эта их двойственная природа легла в основу квантовой механики, принципы которой были сформулированы в 1924 году Луи де Бройлем.
Следующая глава
Источник: https://fis.wikireading.ru/1892




