

Время на чтение: 14 минут 
История обнаружения и происхождение Cr
В 1761 году Иоганн Готтлоб Леманн обнаружил на Урале красно-оранжевый минерал, который он назвал сибирским красным свинцом. Несмотря на то что находка по ошибке была отнесена к соединению свинца с компонентами селена и железа, в действительности это был хромат свинца (PbCrO4).
В 1797 году Николя-Луи Воклен получил образцы крокоитовой руды. Он смог произвести оксид хрома (CrO3), смешав крокоит с HCl. В 1798 году Воклен обнаружил, что он может изолировать металлический Cr, нагревая оксид в печи на угле.

Руда, из которой происходит получение всех соединений хрома, является хромитом, или хромовой железной рудой (FeCr2O4).
Элемент также встречается в небольших количествах во многих других минералах, особенно в крокоите (хромате свинца PbCrO4), в котором этот минерал был впервые обнаружен. Хром добывается в виде хромовой руды (FeCr2O4).
Практически вся хромовая руда перерабатывается путём превращения в дихромат натрия, и практически все соединения и материалы на основе хрома готовятся из этой соли.
Cr получается в промышленности путём нагревания руды в присутствии алюминия или кремния. Около ½ объёма хромовой руды в мире добывается в Южной Африке.
Хотя месторождения самородного элемента редки, был обнаружен некоторый металл самородного хрома. Шахта Удачная в России производит образцы такого металла. Эта шахта представляет собой кимберлитовую трубу, богатую алмазами, а восстановительная среда помогает добывать как элементарный Cr, так и алмаз.
Изобилие Cr в разных средах:

- во Вселенной — 0,0015%;
- на солнце — 0,002%;
- в метеоритах — 0,3%;
- в земной коре — 0,014%;
- в океанах — 6 x 10−8%;
- в организме человека — 3 x 10−6%.
Основные характеристики элемента
Cr не тускнеет на воздухе, при нагревании он образует зелёный оксид. Наиболее распространённые степени окисления хрома составляют +2, +3 и +6, причём наиболее стабильным является +3, +4 и +5 относительно редки.
С увеличением валентности Сг в оксидах и гидроксидах их основный характер ослабевает, а кислотный — усиливается. Точно так же происходит и замена восстановительной активности на окислительную. Соединения Cr с валентностью 6 являются мощными окислителями.
- Символ Элемента: Cr.
- Атомный номер: 24.
- Молярная масса: 51,9961 г/моль.
- Температура плавления: 1857,0°С.
- Температура кипения: 2672,0°C.
- Количество протонов / электронов: 24.
- Количество нейтронов: 28.
- Электронная конфигурация (схема): 1 s2 2 s2 2 p6 3 s2 3 p6 3 d5 4 s1
- Кристаллическая структура: кубический.
- Валентность: +2, +3, +6.
- Плотность: 7,19 г / см3.
- Цвет: стальной, серый.
Классификация и свойства
Элементы могут быть классифицированы на основе их физических состояний (состояний материи), например, газообразный, твёрдый или жидкий. Cr является твёрдым элементом.
Он классифицируется в химии как «переходный металл», который находится в группах 3−12 Периодической таблицы Менделеева.
Элементы, классифицируемые как переходные металлы, обычно описываются как пластичные и способные проводить электричество и тепло.

Химические свойства — это характеристики, которые становятся очевидными, когда материал подвергается химической реакции или химическим изменениям. Фактическая структура материала должна быть изменена, чтобы можно было наблюдать химические свойства.
- Взаимодействие с неметаллами. При нагревании выше 600 °C Cr сгорает в кислороде. С F реакция наступает при 350 °C, с Cl — при 300 °C, с Br — при t красного каления, образуя галогениды хрома (III).С N — при t выше 1000 °C с образованием нитридов.
- Взаимодействие с кислотами. В NCl и HCl в высокой концентрации Cr может растворяться только при сильном нагревании, образуя соли Cr (III) и продукты восстановления кислоты. При взаимодействии солей металла Cr и азотной кислоты образуется нитрат хрома Cr (NO3)3.
Это серо-голубой металл, который можно отполировать, чтобы добиться высокого блеска. Он очень блестящий, и хотя хром относительно твёрдый, он также и очень хрупкий. Это довольно активный металл.
Хотя он не реагирует с водой, но он способен реагировать с большинством кислот, а также с кислородом при комнатной температуре. Одним из наиболее важных свойств Cr является его пассивация.
Несмотря на то что он стабилен на воздухе, он тем не менее окисляется, образуя тонкий слой, который действует как защитное покрытие для предотвращения дальнейшей коррозии.

Cr в элементарной форме проявляет парамагнитные свойства.
Недавно было обнаружено, что этот элемент может проявлять различные магнитные свойства в зависимости от его нагрева и охлаждения, а это, в свою очередь, влияет на ориентацию вращения электронов.
Соединения элемента, такие как диоксид хрома, считаются ферромагнитными. Ферромагнитные свойства этих соединений позволяют использовать их в ленте данных, как способе хранения информации.
Cr можно добавлять к другим соединениям, сохраняя его магнитные свойства. Это зависит от количества других элементов в соединении.
Например, некоторые соединения из нержавеющей стали являются магнитными в зависимости от количества хрома, который они содержат.
Соединения хрома
Cr образует много разных соединений, в том числе оксидов, которые проявляют общее кислотно-основное поведение. Их список выглядит так:
- Оксид хрома (II). Его формула — CrO, и он является основным оксидом. Окись хрома используется в форме нерастворимого чёрного порошка.
- Оксид хрома (III). Cr2O3 является основным оксидом. Он амфотерный и, хотя и нерастворим в воде, способен растворяться в кислоте. Cr2O3 встречается в природе в виде редкого минерала эсколаита. Используется в качестве пигмента, производящего тёмно-зелёный цвет.
- Диоксид хрома или оксид хрома (IV) с формулой CrO2, в своём естественном состоянии выглядит как чёрные кристаллы. Он проявляет ферромагнитные свойства и когда-то широко использовался в качестве синтетического магнита в магнитных лентах данных, таких как аудиокассеты. Он считался одним из самых совершенных магнитных пигментов для записи лент благодаря своим тонким, длинным стеклянным стержням, похожим на кристаллы. Это аморфное твёрдое вещество может быть образовано в результате термического разложения дихроматных комплексов.
- Триоксид хромаТриоксид хрома или оксид хрома (VI), с формулой CrO3 представляет собой кислый оксид или кислотный ангидрид хромовой кислоты. Он будет реагировать с водой с образованием хромовой кислоты и реагировать с основанием с образованием соли хрома. В твёрдой форме это тёмный красно-оранжевый зернистый комплекс. Он используется в хромировании в качестве сильного окислителя, однако, является чрезвычайно токсичным.
- Гидроксид хрома II. Сг (ОН)2 жёлтого цвета, не растворяется в воде, обладает свойствами основания, является восстановителем, получается в результате действия щёлочи на хлорид хрома CrСl2, получаемого при взаимодействии Cr c НСl.
- Гидроксид хрома III. Cr (OH)3 — зелёный полимер. Он не растворим в воде, но способен растворяться в кислотах и в щелочах и вступает в реакции с кислотами с образованием солей Cr (III) и с щелочами, при этом образуются гидроксохромиты — растворы сине-фиолетового цвета.
- Сульфат хрома. Его формула Cr 2 (SO 4) 3. Он является умеренно растворимым в воде и кислоте источником Cr для применений, совместимых с сульфатами. Сульфатные соединения представляют собой соли или сложные эфиры серной кислоты, образующиеся при замене одного или обоих атомов водорода металлом.
- Сульфид хрома (III). Он представляет собой неорганическое соединение с формулой Cr2S3. Это коричнево-чёрное твёрдое вещество. Сульфиды хрома обычно представляют собой нестехиометрические соединения с формулами в диапазоне от CrS до Cr0,67S (что соответствует Cr2S3). Cr2S3 подвергается необратимому гидролизу.
- Хромат и Дихромат. Хромат, CrO42-, является солью хромовой кислоты. Эта соль ассоциируется с жёлтым цветом в обычных условиях, например, в виде хромата калия. Дихромат Cr2O72- представляет собой соль дихромовой кислоты. Эта соль ассоциируется с сильным оранжевым цветом в кислых условиях, например, дихромат калия. Однако соединения хромата или дихромата с тяжёлыми металлами обычно имеют красный цвет. Дихромат является сильным окислителем, но он плохо осаждается. Хромат, с другой стороны, используется в качестве осаждающего агента, но он является плохим окислителем. Химическое равновесие отображается, когда любой анион находится в водном растворе.
В кислотном растворе прямая реакция является предпочтительной. В основном растворе предпочтительной является обратная реакция.
Дихромат калия является мощным окислителем и является предпочтительным соединением для очистки лабораторной посуды от любых возможных органических веществ. Зелёный хром — это зелёный оксид хрома, Cr2O3, используемый для окраски эмали и окрашивания стекла. Хром жёлтый — это блестящий жёлтый пигмент PbCrO4, используемый художниками.
Хромовая кислота имеет гипотетическую структуру H2CrO4. Ни хромовая, ни дихромовая кислота не обнаружены в природе, но их анионы обнаружены в различных соединениях. Триоксид хрома, CrO3, ангидрид хромовой кислоты, продаётся в промышленности как «хромовая кислота».
Cr является важным микроэлементом для человека, потому что он помогает перерабатывать глюкозу. Тем не менее в избытке этот элемент ядовит. Человек принимаем около 1 миллиграмма хрома в день. Такие продукты, как пивные дрожжи, зародыши пшеницы, печень и свёкла, богаты этим элементом.
Трёхвалентный хром является важным микроэлементом и необходим для правильного метаболизма сахара у людей. Дефицит элемента может влиять на эффективность инсулина в регулировании баланса сахара. В отличие от других важных микроэлементов, хром не обнаружен в металлопротеине с биологической активностью. Поэтому функциональная основа для его наличия в рационе остаётся необъяснимой
В металлургии для придания коррозионной стойкости и блестящей отделки, в качестве компонента сплава, например, из нержавеющей стали, в хромировании. В качестве катализатора.
Хромит используется для изготовления форм для обжига кирпича.
Соли Cr делают цвет стекла изумрудно-зелёным. Они используются также при дублении кожи. Около 90% всей кожи подвергается дублению с использованием Cr. Однако жидкие отходы токсичны, поэтому изучаются альтернативные варианты.
- Он позволяет достичь рубиново-красный цвет, и поэтому используется в производстве синтетических рубинов.
- Хроматы и оксиды используются в красителях и красках.
- Диоксид хрома (CrO2) используется для производства магнитной ленты, где его более высокая коэрцитивная сила, чем у лент из оксида железа, даёт лучшие характеристики.
Хромирование может использоваться для придания полированной зеркальной отделке стали. Хромированные части автомобилей и грузовиков, такие как бамперы, когда-то были очень распространены.
Меры предосторожности
Соединения Cr и Cr (III) обычно не считаются опасными для здоровья, но соединения Cr (VI) могут быть токсичными при пероральном использовании.
Смертельная доза ядовитых соединений Cr (VI) составляет около половины чайной ложки материала. Большинство соединений этого типа раздражают глаза, кожу и слизистые оболочки.
Его хроническое воздействие может привести к необратимому повреждению глаз. Cr (VI) является признанным канцерогеном для человека.
В 1958 году Всемирная организация здравоохранения рекомендовала максимально допустимую концентрацию 0,05 мг / литр в питьевой воде для Cr (VI) исходя из соображений здоровья. Эта рекомендация была пересмотрена несколько раз, и за это время это значение не изменилось.
Поскольку соединения Cr используются в красителях и красках, а также для дубления кожи, эти соединения часто обнаруживаются в почве и грунтовых водах на (заброшенных) промышленных объектах, которые в настоящее время нуждаются в очистке и восстановлении окружающей среды.
Источник: https://nauka.club/khimiya/khrom.html
Хром — общая характеристика элемента, химические свойства хрома и его соединений
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром— твёрдый металл голубовато-белого цвета.

Химические свойства хрома
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
- 4Cr + 3O2 –t° →2Cr2O3
- 2Cr + 3Cl2 –t°→ 2CrCl3
- 2Cr + N2 –t°→ 2CrN
- 2Cr + 3S –t°→ Cr2S3
- В раскалённом состоянии реагирует с парами воды:
- 2Cr + 3H2O → Cr2O3 + 3H2
- Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4)
- В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
- Cr + 2HCl → CrCl2 + H2
- 2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
- Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
- Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
- Cr(OH)2 + 2HCl → CrCl2 + 2H2O
- Соединения хрома (II) — сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
- 2CrCl2 + 2HCl → 2CrCl3 + H2
- 4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
- Оксид хрома (III) Cr2O3 – зелёный, нерастворимый в воде порошок.
Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
- 2Cr(OH)3 –t°→ Cr2O3 + 3H2O
- 4K2Cr2O7 –t°→ 2Cr2O3 + 4K2CrO4 + 3O2
- (NH4)2Cr2O7 –t°→ Cr2O3 + N2+ 4H2O (реакция «вулканчик»)
- Амфотерный оксид.
При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
- Cr2O3 + 2NaOH → 2NaCrO2 + H2O
- Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
- При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
- Cr2O3 + 4KOH + KClO3 → 2K2CrO4+ KCl + 2H2O
Гидроксид хрома (III) Сr(ОН)3 . Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид СrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака.
- Обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
- 2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O Сr(ОН)3 + ЗН+ = Сr3+ + 3H2O
- Cr(OH)3 + KOH → K[Cr(OH)4] , Сr(ОН)3 + ЗОН— (конц.) = [Сr(ОН)6]3-
- Cr(OH)3 + KOH → KCrO2+2H2O Сr(ОН)3 + МОН = МСrO2(зел.) + 2Н2O (300—400 °С, М = Li, Na)
- Сr(ОН)3 →(120oC –H2O) СrO(ОН) →(430-10000С –H2O) Cr2O3
2Сr(ОН)3 + 4NаОН(конц.) + ЗН2O2(конц.) =2Na2СrO4 + 8Н20
- Получение: осаждение гидратом аммиака из раствора солей хрома(Ш):
- Сr3+ + 3(NH3 Н2O) = Сr(ОН)3↓ + ЗNН4+
- Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 ↓+ 3Na2SO4 (в избытке щелочи — осадок растворяется)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
- Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
- Zn + 2Cr+3Cl3 → 2Cr+2Cl2 + ZnCl2
- 2Cr+3Cl3 + 16NaOH + 3Br2 → 6NaBr + 6NaCl + 8H2O + 2Na2Cr+6O4
- Соединения шестивалентного хрома
- Оксид хрома (VI) CrO3 — ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и H2SO4(конц.).
- K2CrO4 + H2SO4 → CrO3 + K2SO4 + H2O
- K2Cr2O7 + H2SO4 → 2CrO3 + K2SO4 + H2O
- CrO3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
- CrO3 + 2KOH → K2CrO4 + H2O
- В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
- 2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
- В щелочной среде эта реакция протекает в обратном направлении:
- K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
- Дихромат калия – окислитель в кислой среде:
- К2Сr2O7 + 4H2SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O
- K2Cr2O7 + 4H2SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4H2O
- K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
- K2Cr2O7 + 7H2SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
Хромат калия К2 CrО4. Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде (желтая окраска раствора отвечает иону СrO42-), незначительно гидролизуется по аниону. В кислотной среде переходит в К2Cr2O7. Окислитель (более слабый, чем К2Cr2O7). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO42- — выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
2K2CrO4+H2 SO4(30%)=K2Cr2O7 +K2SO4 +H2O
2K2CrO4(т)+16HCl(конц.,гор.) =2CrCl3+3Cl2↑+8H2O+4KCl
- 2K2CrO4+2H2O+3H2S=2Cr(OH)3↓+3S↓+4KOH
- 2K2CrO4+8H2O+3K2S=2K[Сr(ОН)6]+3S↓+4KOH
- 2K2CrO4+2AgNO3=KNO3+Ag2CrO4(красн.)↓
- Качественная реакция:
- К2СгO4 + ВаСl2 = 2КСl + ВаCrO4↓
- 2ВаСrO4(т)+ 2НСl (разб.) = ВаСr2O7(p)+ ВаС12 + Н2O
- Получение: спекание хромита с поташом на воздухе:
- 4(Сr2Fe‖‖)O4 + 8К2CO3 + 7O2 = 8К2СrO4 + 2Fе2O3 + 8СO2 (1000 °С)
Дихромат калия K2Cr2O7 . Оксосоль. Техническое название хромпик. Оранжево-красный, негигроскопичный.
Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (оранжевая окраска раствора отвечает иону Сr2O72- ). В щелочной среде образует К2CrO4 . Типичный окислитель в растворе и при сплавлении.
Вступает в реакции ионного обмена.
Качественные реакции — синее окрашивание эфирного раствора в присутствии Н2O2 , синее окрашивание водного раствора при действии атомарного водорода.
Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с Н2SO4 (конц.) — для мытья химической посуды.
- Уравнения важнейших реакций:
- 4К2Cr2O7=4K2CrO4+2Cr2O3+3O2 (500-600o C)
- K2Cr2O7(т)+14HCl (конц) =2CrCl3+3Cl2↑+7H2O+2KCl (кипячение)
- K2Cr2O7(т)+2H2SO4(96%) ⇌2KHSO4+2CrO3+H2O (“хромовая смесь”)
- K2Cr2O7+KOH (конц ) =H2O+2K2CrO4
- Cr2O72- +14H+ +6I— =2Cr3+ +3I2↓+7H2O
- Cr2O72- +2H+ +3SO2(г)=2Cr3+ +3SO42- +H2O
- Cr2O72- +H2O +3H2S(г)=3S↓+2OH— +2Cr2(OH)3↓
Cr2O72- (конц )+2Ag+(разб.) =Ag2Cr2O7 (т. красный)↓
- Cr2O72- (разб.) +H2O +Pb2+=2H+ + 2PbCrO4 (красный)↓
- K2Cr2O7(т) +6HCl+8H0(Zn)=2CrCl2(син)+7H2O+2KCl
- Получение: обработка К2СrO4 серной кислотой:
- 2К2СrO4 + Н2SO4 (30%) = К2Cr2O7 + К2SO4 + Н2O

Источник: http://himege.ru/xrom-svojstva/
Хром
Хром (Cr), химический элемент VI группы периодической системы Менделеева. Относится к переходным металлом с атомным номером 24 и атомной массой 51,996. В переводе с греческого, название металла означает «цвет». Такому названию металл обязан разнообразной цветовой гамме, которая присуща его различным соединениям.

Физические характеристики хрома
Металл обладает достаточной твердостью и хрупкостью одновременно. По шкале Мооса твердость хрома оценивается в 5,5. Этот показатель означает, что хром имеет максимальную твердость из всех известных на сегодня металлов, после урана, иридия, вольфрама и бериллия. Для простого вещества хрома характерен голубовато-белый окрас.
| Атомный номер | 24 |
| Атомная масса | 51,996 |
| Плотность, кг/м³ | 7190 |
| Температура плавления, °С | 1856 |
| Теплоемкость, кДж/(кг·°С) | 0,46 |
| Электроотрицательность | 1,6 |
| Ковалентный радиус, Å | 1,18 |
| 1-й ионизац. потенциал, эв | 6,76 |
Металл не относится к редким элементам. Его концентрация в земной коре достигает 0,02% масс. долей. В чистом виде хром не встречается никогда.
Он содержится в минералах и рудах, которые являются главным источником добычи металла. Хромит (хромистый железняк, FeO*Cr2O3) считается основным соединением хрома.
Еще одним достаточно распространенным, однако менее важным минералом, является крокоит PbCrO4.
Металл легко поддается плавке при температуре 19070С (21800К или 34650F). При температуре в 26720С – закипает. Атомная масса металла составляет 51,996 г/моль.
Хром является уникальным металлом благодаря своим магнитным свойствам. В условиях комнатной температуры ему присуще антиферромагнитное упорядочение, в то время, как другие металлы обладают им в условиях исключительно пониженных температур. Однако, если хром нагреть выше 370С, физические свойства хрома изменяются.
Так, существенно меняется электросопротивление и коэффициент линейного расширения, модуль упругости достигает минимального значения, а внутреннее трение значительно увеличивается. Такое явление связано с прохождением точки Нееля, при которой антиферромагнитные свойства материала способны изменяться на парамагнитные.
Это означает, что первый уровень пройден, и вещество резко увеличилось в объеме.
Строение хрома представляет собой объемно-центрированную решетку, благодаря которой металл характеризуется температурой хрупко-вязкого периода.
Однако, в случае с данным металлом, огромное значение имеет степень чистоты, поэтому, величина находится в пределах -500С — +3500С.
Как показывает практика, раскристаллизированный металл не имеет никакой пластичности, но мягкий отжиг и формовка делают его ковким.
Химические свойства хрома
Атом имеет следующую внешнюю конфигурацию: 3d54s1. Как правило, в соединениях хром имеет следующие степени окисления: +2, +3, +6, среди которых наибольшую устойчивость проявляет Сr3+.Кроме этого существуют и другие соединения, в которых хром проявляет совершенно иную степень окисления, а именно: +1, +4, +5.
Металл не отличается особой химической активностью. Во время нахождения хрома в обычных условиях, металл проявляет устойчивость к влаге и кислороду. Однако, данная характеристика не относится к соединению хрома и фтора – CrF3, которое при воздействии температур, превышающих 6000С, взаимодействует с парами воды, образуя в результате реакции Сr2О3, а также азотом, углеродом и серой.
Во время нагревания металлического хрома, он взаимодействует с галогенами, серой, кремнием, бором, углеродом, а также некоторыми другими элементами, в результате чего получаются следующие химические реакции хрома:
- Cr + 2F2 = CrF4 (с примесью CrF5)
- 2Cr + 3Cl2 = 2CrCl3
- 2Cr + 3S = Cr2S3
Хроматы можно получить, если нагреть хром с расплавленной содой на воздухе, нитратами или хлоратами щелочных металлов:
2Cr + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2.

Хром не обладает токсичностью, чего нельзя сказать о некоторых его соединениях. Как известно, пыль данного металла, при попадании в организм, может раздражать легкие, через кожу она не усваивается. Но, поскольку в чистом виде он не встречается, то его попадание в человеческий организм является невозможным.
Трехвалентный хром попадает в окружающую среду во время добычи и переработки хромовой руды. В человеческий организм попадание хрома вероятно в виде пищевой добавки, используемой в программах по похудению.
Хром с валентностью, равной +3, является активным участником синтеза глюкозы.
Ученые установили, что излишнее употребление хрома особого вреда человеческому организму не наносит, поскольку не происходит его всасывание, однако, он способен накапливаться в организме.
Соединения, в котором участвует шестивалентный металл, являются крайне токсичными. Вероятность их попадания в человеческий организм появляется во время производства хроматов, хромирования предметов, во время проведения некоторых сварочных работ.
Попадание такого хрома в организм чревато серьезными последствиями, так как соединения, в которых присутствует шестивалентный элемент, представляют собой сильные окислители. Поэтому, могут вызвать кровотечение в желудке и кишечнике, иногда с прободением кишечника.
При попадании таких соединений на кожу возникают сильные химические реакции в виде ожогов, воспалений, возникновения язв.
В зависимости от качества хрома, которое необходимо получить на выходе, существует несколько способов производства металла: электролизом концентрированных водных растворов оксида хрома, электролизом сульфатов, а также восстановлением оксидом кремния. Однако, последний способ не очень популярен, так как при нем на выходе получается хром с огромным количеством примесей. Кроме того, он также является экономически невыгодным.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
| +2 | CrO (чёрный) | Cr(OH)2 (желтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зеленый) | Амфотерный | Cr3+ (зеленые или лиловые соли)[Cr(OH)4]- (зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | H2CrO4H2Cr2O7 | Кислотный | CrO42- (хроматы, желтые)Cr2O72- (дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Источник: http://mining-prom.ru/rud/hrom/khrom/
Хром и его соединения
Кларк в земной коре 3,5-1% по массе. Основная хромовая руда — FeO • Cr2O3 (хромистый железняк). Был открыт в составе руды РbСrO4(крокоит). Хром в переводе с греч. означает «цвет, краска» (многие природные и синтетические соединения Сr имеют яркую разнообразную окраску).
Чистый хром — очень твердый тугоплавкий металл голубовато-серебристого цвета. Имеет самую большую твердость из всех применяемых в промышленности металлов. Т. пл. 1890°С, плотность 7,19 г/см.
- 24Cr [Ar]3d54s1
- Изотопы:
- 50Cr (4.35 %)
- 52Cr (83,79 %)
- 53Cr (9.50 %)
- 54Cr (2.36 %)
- ЭО 1,6
- E°Cr0/Cr3+ -0,74 В
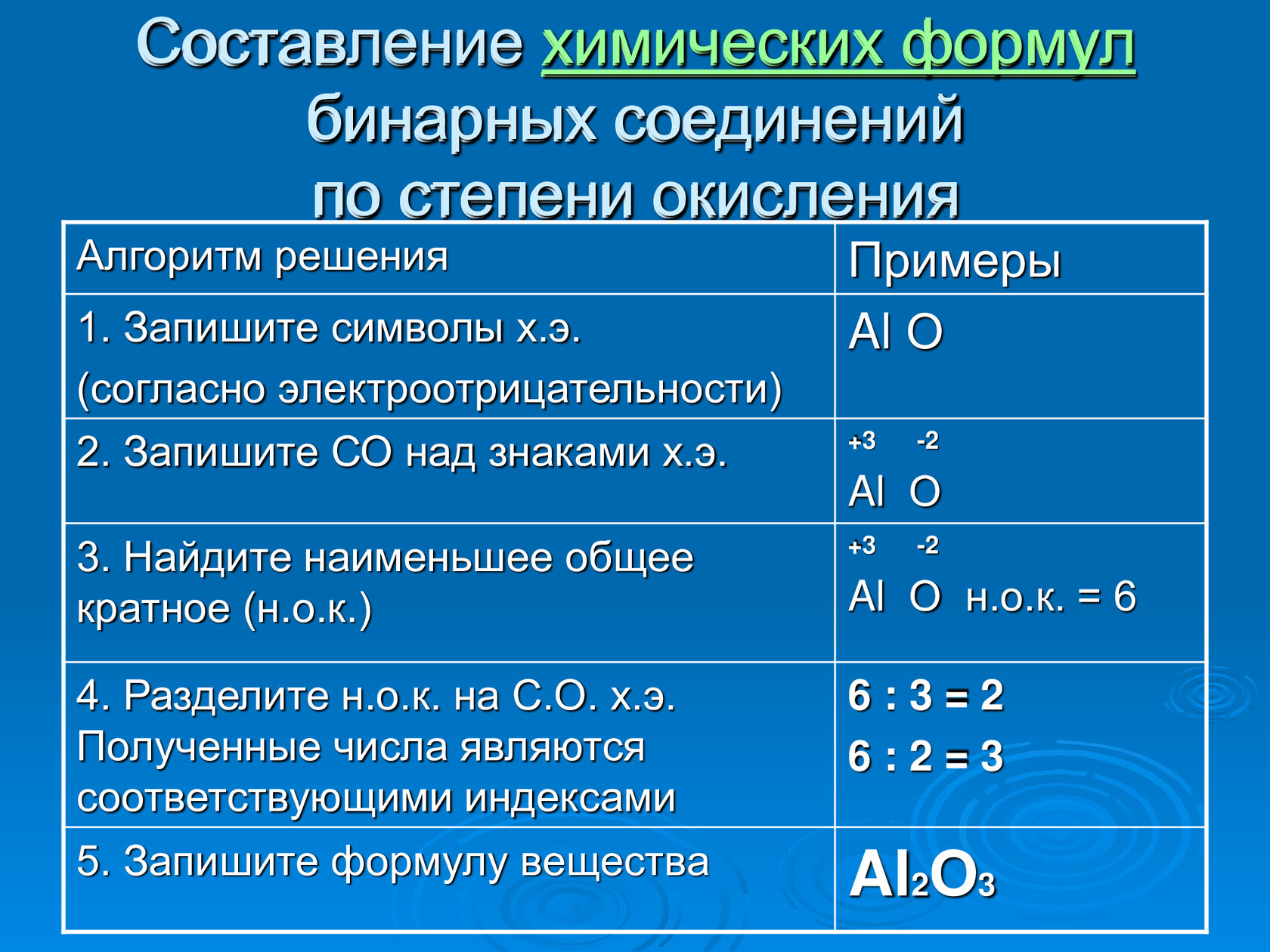
При образовании соединений с другими элементами хром может использовать от 1 до 6 валентных электронов. Наибольшую устойчивость и практическую значимость имеют соединения, в которых атомы Сг находятся в степенях окисления +2, +3, +6.
С повышением степени окисления атомов Сг в оксидах и гидроксидах их основный характер ослабевает,а кислотный — усиливается. В этом же направлении происходит замена восстановительной активности на окислительную.
Некоторые важнейшие соединения хрома
| Cr+2 | Cr+3 | Cr+6 | |||
| Оксиды | CrOосновный | Cr2O3амфотерный | CrO3кислотный | ||
| Гидроксиды | Cr(OH)2слабое основание | Cr(OH)3 ↔ HCrO2 + H2Oамфотерный гидроксид | 2H2CrO4 ↔ H2Cr2O7 + H2O сильные кислоты | ||
| Соли | CrCl2,CrSO4,Cr(NO3)2,CrS | Тип ICrCl3,Cr(SO4)3,Cr(NO3)3 | Тип IIKCrO2,Ca(CrO2)2,Fe(CrO2)2хромиты | хроматыK2CrO4,Na2(CrO4)2,BaCrO4,PbCrO4 | дихроматыK2Cr2O7,Na2Cr2O7,(NH4)2Cr2O7 |
| Окислительно-восстановительная функция | Сильные восстановители | Окислители и восстановители | Сильные окислители |
- 1. Алюминотермический: Сr2O3 + 2Al = Аl2O3 + 2Сr
- 2. Силикотермический: 2Сr2O3 + 3Si = 3SiO2 + 4Cr
- 3. Электролитический: 2CrCl3 = 2Сr + 3Cl2
Химические свойства
Поверхностная оксидная пленка является причиной инертности хрома при обычной температуре, благодаря чему этот металл не подвергается атмосферной коррозии (в отличие от железа).
При нагревании хром проявляет свойства довольно активного металла, что соответствует его положению в электрохимическом ряду напряжений.
1. Взаимодействие с O2
Тонкоизмельченный хром интенсивно горит в токе кислорода. На воздухе реакция с O2 происходит лишь на поверхности металла.
4Сr + 3O2 = 2Сr2O3
При осторожном окислении амальгамированного хрома образуется низший оксид CrO.
2. Взаимодействие с другими неметаллами
- (Сr не взаимодействует с Н2, но поглощает его в больших количествах)
- 2Cr + 3Cl2 = 2CrCl3
- Cr + S = CrS
- CrCl3 и CrS — ионные соединения.
- 2Cr + N2 = 2CrN
- Cr + C → CrxCy
- CrN и rxCy — ковалентные тугоплавкие инертные вещества, по твердости сравнимы с алмазом.
3. Взаимодействие с разбавленными растворами HCl и H2SO4
Сr + 2HCl = СrСl2 + Н2↑
Сr + H2SO4 = CrSO4 + Н2↑
4. Действие концентрированных HNO3, H2SO4 и «царской водки» на хром
Эти кислоты не растворяют хром при обычной температуре, они переводят его в «пассивное» состояние.
Пассивацию можно частично снять сильным нагреванием, после чего хром начинает очень медленно растворяться в кипящих конц. HNO3, H2SO4, «царской водке».
- Сr + 6HNO3 = Cr(NO3)3 + 3NO2↑ + 3H2O
- 2Сr + 6H2SO4 = Cr2(SO4)3 + 3SO2↑ + 6H2O
- Царская водка — смесь концентрированных HNO33 и НСl (1:3), растворяет золото и платиновые металлы (Pd,Os,Ru).
5. Вытеснение малоактивных Me из водных р-ров солей
Сr + CuSO4 = CrSO4 + Сu
Сr + Pb(NO3)2 = Cr(NO3)2 + Pb
6. Взаимодействие с солями, разлагающимися с образованием кислорода
2Сr + KIO3 = Сr2O3 + KCl
2Сr + 3NaNO3 = Сr2O3 + 3NaNO2
Соединения Cr (II)
СrO — оксид хрома (II). Твердое черное вещество, н. р. в Н2O.
Способы получения
- 1) медленное окисление хрома, растворенного в ртути
- 2Сr + O2 = 2СrO
- 2) обезвоживание Сr(ОН)2 в восстановительной атмосфере:
- Сr(ОН)2 = СrO + H2O
Химические свойства
СrO — неустойчивое вещество, легко окисляется при небольшом нагревании до Сr2O3; при более высоких Т диспропорционирует:
3СrО = Сr + Сr2O3
СrO — типичный основный оксид, проявляет характерные для этого класса свойства. Реакции необходимо проводить в восстановительной среде.
Сr(OН)2 — гидроксид хрома (II) твердое желтое вещество, н. р. в Н2O.
Получают обменными реакциями из солей Сr2+:
CrCl2 + 2NaOH = Сr(ОН)2 + 2NaCl
Химические свойства
- Неустойчивое вещество, разлагается при нагревании; на воздухе быстро окисляется с образованием зеленого гидроксида хрома (III);
- 4Сr(ОН)2 + O2 + 2Н2O = 4Сr(ОН)3
- желтый → зеленый
Соли Сr2+
Наиболее важные: CrCl2, CrSO4, (СН3СОО)2Сr. Гидратированный ион Сr2+ имеет бледно-голубую окраску.
Способы получения:
- 1. Сr + неметалл (S, Hal2)
- Сr + 2HCl(r) = CrCl2 + Н2
- 2. Восстановление солей Сr3+:
- 2СrСl3 + Н2 = 2CrCl2 + 2HCl
Химические свойства
- 1. Соли Сr2+ — сильные восстановители, так как очень легко окисляются до солей Сr3+
- 4CrCl2 + 4HCl + O2 = 4СrСl3 + 2Н2О
- 2.
Раствор CrSO4 в разбавленной H2SO4 — превосходный поглотитель кислорода:
- 4CrSO4 + O2 + 2H2SO4 = 2Cr2(SO4)3 + 2Н2О
- 3.
С аммиаком соли Сr2+ образуют комплексные соли — аммиакаты:
- CrCl2 + 6NH3 = [Cr(NH3)6]Cl2
- Для Сr2+ характерно образование двойных сульфатов, например: K2Cr(SO4)2• 6Н2O
Соединения Сr(III)
Сr2О3 — оксид хрома (III), важнейшее природное соединение хрома. Сr2О3, полученный химическими методами, представляет собой темно-зеленый порошок.
Способы получения
- 1. Синтез из простых веществ:
- 4Сr + 3O2 = 2Сr2О3
- 2. Термическое разложение гидроксида хрома (III) или дихромата аммония:
- 2Сr(ОН)3 = Сr2O3 + 3Н2O
- (NH4)2Cr2O7 = Сr2O3 + N2 + 4Н2O
- 3. Восстановление дихроматов углеродом или серой:
- К2Сr2O7 + S = Сr2O3 + K2SO4
- Сr2O3 используется для изготовления краски «хромовая зеленая», обладающей термо- и влагоустойчивостью.
Химические свойства
- Сr2O3 — типичный амфотерный оксид
- В порошкообразном виде реагирует с сильными кислотами и сильными щелочами, в кристаллическом виде — химически инертное вещество.
- К наиболее практически важным реакциям относятся следующие:
- 1.
Восстановление с целью получения металлического хрома:
- Сr2O3 + 2Al = 2Сr + Аl2O3
- 2. Сплавление с оксидами и карбонатами активных металлов:
- Сr2O3 + МgО = Мg(СrO2)2
- Сr2O3 + Na2CO3 = 2NaCrO2 + CO2
- Образующиеся метахромиты являются производными метахромистой кислоты НСrO2.
- 3.
Получение хлорида хрома (III):
- Сr2O3 + ЗС + 3Cl2 = 2СrСl3 + ЗСО
- Сr2O3 + ЗССl4 = 2СrСl3 + ЗСОСl2
Сr(ОН)3 — гидроксид хрома (III)
- Образуется в виде синевато-серого осадка при действии щелочей на соли Сr3+:
- СrСl3 + 3NaOH = Сr(ОН)3 + 3NaCl
- Практически нерастворимый в воде гидроксид может существовать в виде коллоидных растворов.
В твердом состоянии гидроксид хрома (III) имеет переменный состав Сr2O3• nН2O. Теряя молекулу воды, Сr(ОН)3 превращается в метагидроксид СrО(ОН).
Химические свойства
- Сr(ОН)3 — амфотерный гидроксид, способный растворяться как в кислотах, так и в щелочах:
- Cr(OH)3 + 3HCl = СrСl3 + ЗН2O
- Сr(ОН)3 + ЗН+ = Сr3+ + ЗН2O
- Сr(ОН)3 + 3NaOH = Na3(Cr(OH)6]
- Сr(ОН)3 + ЗОН- = [Cr(OH)6]3-гексагидроксохромитанион
- При сплавлении с твердыми щелочами образуются метахромиты:
- Сr(ОН)3 + NaOH = NaCrO2 + 2Н2O
Соли Cr3+
Растворением осадка Сr(ОН)3 в кислотах получают нитрат Cr(NO3)3, хлорид СrСl3, сульфат Cr2(SO4)3 и другие соли. В твердом состоянии чаще всего содержат в составе молекул кристаллизационную воду, от количества которой зависит окраска соли.
- Самой распространенной является двойная соль КСr(SO4)2• 12H2O — хромокалиевые квасцы (сине-фиолетовые кристаллы).
- Хромиты, или хроматы (III) — соли, содержащие Сr3+ в составе аниона. Безводные хромиты получают сплавлением Сr2O3 с оксидами двухвалентных металлов:
- Сr2O3 + МеО = Ме(СrO2)2 метахромиты
- В водных растворах хромиты существуют в виде гидроксокомплексов.
Химические свойства
- К наиболее характерным свойствам солей Cr(III) относятся следующие:
- 1. Осаждение катиона Сг3+ под действием щелочей:
- Сr3+ + ЗОН- = Сr(ОН)3
- Характерный цвет осадка и его способность растворяться в избытке щелочи используется для отличия ионов Сг3+ от других катионов.
- 2.
Легкая гидролизуемость в водных растворах, обусловливающая сильнокислый характер среды:
- Сr3+ + Н2O = СrОН2+ + Н+
- Соли Сr (III) с анионами слабых и летучих кислот в водных растворах не существуют; так как подвергаются необратимому гидролизу, например:
- Cr2S3 + 6Н2O = 2Сr(ОН)3 + 3H2S
- 3.
Окислительно-восстановительная активность:
- а) окислитель: соли Cr(III) → соли(VI)
- см. «Получение солей Cr(VI)»
- б) восстановительь: соли Cr(III) → соли(II)
- см. «Получение солей Cr(II)»
- 4.
Способность к образованию комплексных соединений — аммиакатов и аквакомплексов, например:
- СrСl3 + 6NH3 = [Cr(NH3)6]Cl3
Соединения Cr(VI)
CrO3 — оксид хрома (VII) триоксид хрома, хромовый ангидрид
Кристаллическое вещество темно-красного цвета, очень гигроскопичное, легко растворимое в воде. Основной способ получения:
К2Сr2O7(кр.) + H2SO4 = 2CrO3 + K2SO4 + Н2O
Химические свойства
- СrО3 — кислотный оксид, активно взаимодействует с водой и щелочами, образуя хромовые кислоты и хроматы.
- Хромовый ангидрид — чрезвычайно энергичный окислитель. Например, этанол воспламеняется при соприкосновении с СrO3:
- С2Н6ОН + 4СrO3 = 2CO2 + ЗН2O + 2Сr2O3
- Продуктом восстановления хромового ангидрида, как правило, является Сr2O3.
Хромовые кислоты — Н2СrO4, Н2Сr2O7
Химические свойства
- При растворении CrO3 в воде образуются 2 кислоты:
- CrO3 + Н2O = Н2СrO4 хромовая
- 2CrO3 + Н2O = Н2Сr2O7 дихромовая
- Обе кислоты существуют только в водных растворах.
Между ними устанавливается равновесие:
- 2Н2СrO4 = Н2Сr2O7 + Н2O
- Обе кислоты очень сильные, по первой ступени диссоциированы практически полностью:
- Н2СrO4 = Н+ + НCrO4-
- Н2Сr2O7 = Н+ + НСr2O7-
Хроматы (VI) — соли, содержащие анионы хромовой кислоты CrO42-. Почти все имеют желтую окраску (реже — красную).
В воде хорошо растворяются только хроматы щелочных металлов и аммония. Хроматы тяжелых металлов н. р. в Н2O. Наиболее распространены: Na2CrO4, К2CrO4, РЬCrO4 (желтый крон).
Способы получения
- 1. Сплавление CrO3 с основными оксидами, основаниями:
- CrO3 + 2NaOH = Na2CrO4 + Н2O
- 2. Окисление соединений Cr(III) в присутствии щелочей:
- 2К3[Сr(ОН)6]+ ЗВr2+ 4КОН = 2К2СrO4 + 6КВr + 8Н2O
- 3. Сплавление Сr2O3 со щелочами в присутствии окислителя:
- Сr2О3 + 4КOН + КClO3 = 2К2СrO4 + KCl + 2Н2O
Химические свойства
- Хроматы существуют только в разбавленных щелочных растворах, которые имеют желтую окраску, характерную для анионов СrO42-. При подкислении раствора эти анионы превращаются в оранжевые дихромат-анионы:
- 2СrO42- + 2Н+ = Сr2O72- + Н2O Это равновесие мгновенно сдвигается в ту или иную сторону при изменении рН растворов.
- Хроматы — сильные окислители.
- При нагревании хроматы тяжелых металлов разлагаются; например:
- 4Нg2СrO4 = 2Сr2O3 + 8Нg + 5O2
- Дихроматы (VI) — соли, содержащие анионы дихромовой кислоты Сr2O72-
В отличие от монохроматов имеют оранжево-красную окраску и обладают значительно лучшей растворимостью в воде. Наиболее важные дихроматы — К2Сr2O7, Na2Cr2O7, (NH4)2Cr2O7.
Их получают из соответствующих хроматов под действием кислот, даже очень слабых, например:
2Na2CrO4 + 2СO2 + Н2O → Na2Cr2O7 + 2NaHCO3
Химические свойства
Водные растворы дихроматов имеют кислую среду вследствие устанавливаемого равновесия с хроматанионами (см. выше). Окислительные свойства дихроматов наиболее сильно проявляются в подкисленных растворах:
Сr2O72- + 14Н+ + 6e- = 2Сr3+ + 7Н2O
При добавлении восстановителей к кислым растворам дихроматов окраска резко изменяется от оранжевой до зеленой, характерной для соединений Сг3+.
Примеры ОВР с участием дихроматов в качестве окислителей
- K2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2↑ + 2KCl +7Н2О
- K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S↓ + K2SO4
- K2Cr2O7 + 3SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O
- Эта реакция используется для получения хромокалиееых квасцов KCr(SO4)2 • 12H2O
- K2Cr2O7 + 6HI + 4H2SO4 = Cr2(SO4)3 + 3I2↓ + K2SO4 + 7H2O
- K2Cr2O7 + 6FeSO4 +7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
- K2Cr2O7 + H2O2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3O2↑ + 7H2O
- 2K2Cr2O7 + 3CH3OH + 8H2SO4 = Cr2(SO4)3 + 3HCOOH + 2K2SO4 + 11H2O
- 8K2Cr2O7 + 3C12H22O11 + 32H2SO4 = 8Cr2(SO4)3 + 12CO2↑ + 8K2SO4 + 43H2O
- Сплавление:
- Na2Cr2O7 + 2C = Cr2O3 + Na2CO3 + CO↑
- Очень сильным окислителем является «хромовая смесь» — насыщенный раствор K2Cr2O7 или Na2Cr2O7 в концентрированной H2SO4.
Источник: http://examchemistry.com/content/lesson/neorgveshestva/hrom.html
Хром в окислительно-восстановительных реакциях.. ЕГЭ химия
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде.
Восстанавливаются соединения хрома (VI) до соединений хрома (III).
Соединения хрома Cr+3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3, и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K3[Cr(OH)6].
Источник: ЯндексКартинки
Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As+5 + другие продукты
- Приведем пример:
- K2Cr2O7 + К2SO3 + H2SO4=
- Окислитель создает кислую среду следовательно, дихромат превратится в сульфат хрома (III), сульфит окислится до сульфата, ионы калия свяжутся сульфат-ионами, ионы водорода превратятся в воду.
- K2Cr2O7 + 3К2SO3 + 4H2SO4= 4К2SO4+ Cr2(SO4)3+ 4H2O
- В следующих статьях рассмотрим поведение дихромита калия в реакциях с органическими веществами.
Удачи в подготовке!!!
Источник: https://zen.yandex.ru/media/id/5ca1e061dbb8aa00b4c4ce60/5dc07d0fe6cb9b00b129f8e2
Что такое шестивалентный хром (или хром-6)?
Что такое шестивалентный хром (или хром-6)?
Что такое шестивалентный хром и для чего он используется? Промышленность добавляет хром (Cr) к железу и никелю для изготовления металлических сплавов, особенно характеризующихся высокой устойчивостью к коррозии и окислению. Используемый в небольших количествах, хром затвердевает сталь.
Нержавеющие стали — это сплавы хрома и железа, в которых содержание хрома колеблется от 10 до 26 процентов. Хромовые сплавы используются для производства таких продуктов, как масляная трубка, автомобильная отделка и столовые приборы.
Хромит используется в качестве огнеупорного материала (веществ, который устойчив к нагреванию) и в качестве сырья для производства хрома химических веществ. Наиболее распространенными формами хрома являются состояния окисления +2, +3 и +6.
В очень небольших количествах трехвалентный хром (Cr + 3) полезен для метаболизма животных, помогая регулировать уровень глюкозы и повышать эффективность инсулина в организме.
Эта форма хрома появляется в ряде продуктов, включая брокколи, картофель и чеснок.
Агентство по охране окружающей среды США (EPA) отмечает, что в среднем люди берут менее 0,2-0,4 микрограмма от воздуха, менее 2 микрограмм от воды и менее 60 микрограммов от пищи каждый день.
Хексавалентный хром (Cr + 6), напротив, токсичен.
Химическое вещество используется в ряде промышленных процессов, а также для кожевенного, хромирования, цветного стекла, а также в пигментах и красках для краски, а также для цветных пластиков и тканей и служит в качестве антикоррозийных покрытий. Это опасно при вдохе, проглатывании или прикосновении. Он переносит 50-процентную летальность (LD50) при проглатывании до 50 миллиграммов на литр массы тела.
Согласно Управлению по безопасности и гигиене труда (OSHA), в любой 8-часовой рабочей смене среднее воздействие шестивалентного хрома не должно выходить за пределы концентрации 5 микрограммов на кубический метр. Повторное воздействие шестивалентного хрома может вызвать ряд респираторных состояний, включая астму, бронхит, зуд, физическую травму дыхательных путей и рак легких.
Реальная жизнь Хинкли была почти заброшена, поскольку Эрин Брокович была в театрах. Хотя некоторые исправления и очистка были сделаны, беспокойство о загрязненной воде продолжает парить над городом.
Геологическое исследование Соединенных Штатов (USGS) определило, что даже в 2007 году концентрации шестивалентного хрома в Хинкли составляли в среднем около 1,2 микрограмм на литр (около 1,2 частей на миллиард [ppb]), достигающих максимума в 3,1 микрограмма на литр.
Вслед за событием Хинкли штат Калифорния установил цель общественного здравоохранения в размере 0,02 млрд. Долл. США для питьевой воды в 2011 году, что намного меньше, чем нынешний стандарт EPA в размере 100 ч. / Млрд для всех форм хрома.
Источник: http://Наука
Источник: http://www.winstein.org/publ/1-1-0-2697




