ЕГЭ 2018 по химии › Подготовка к ЕГЭ 2018
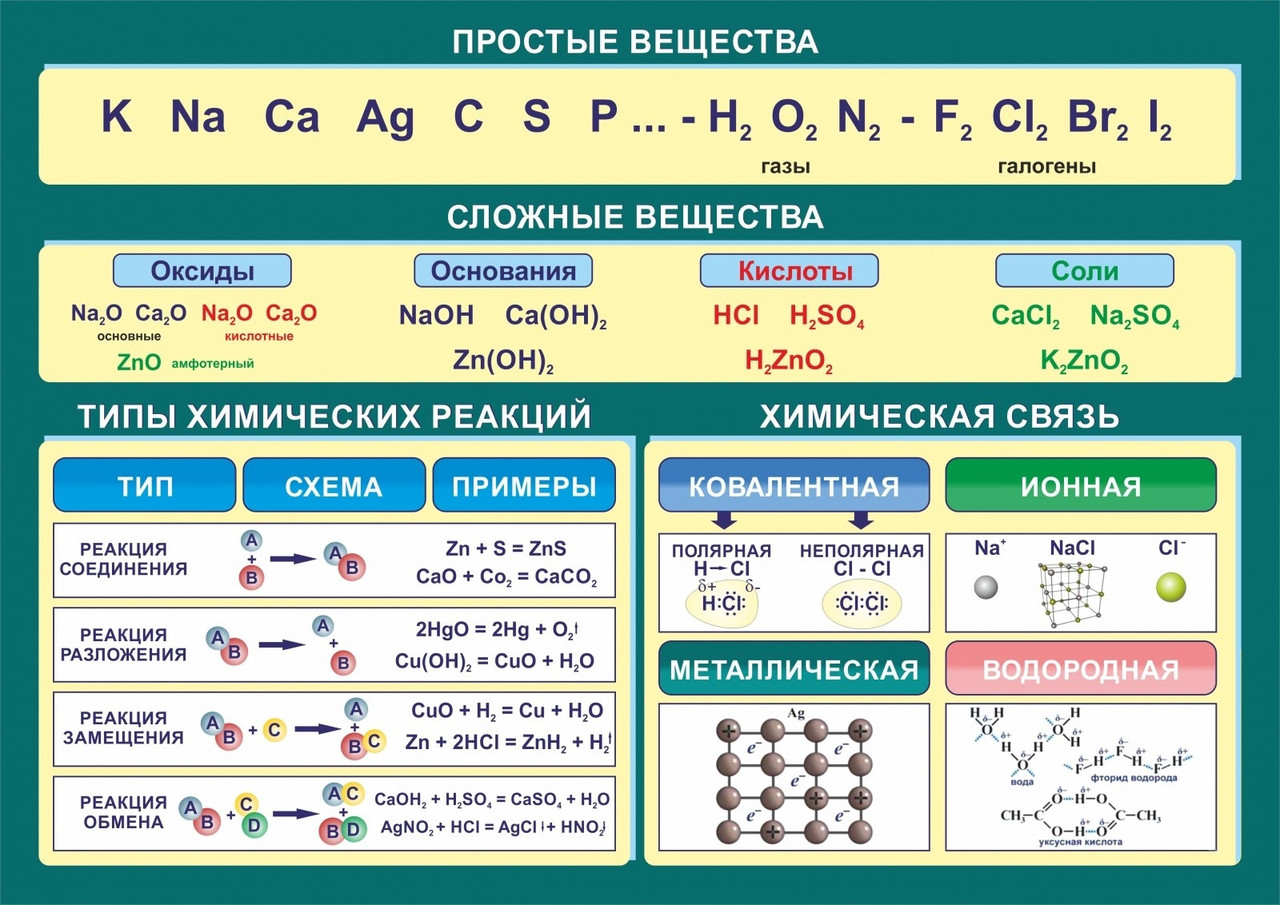
Неорганические вещества классифицируют по различным классифицирующим признакам. По химическому составу их делят на простые и сложные.
- Простыми называют вещества, которые образуют атомы одного и того же химического элемента; сложными — вещества, которые образуют атомы двух и более химических элементов.
- Простые вещества делят на металлы и неметаллы.
- Металлами называют простые вещества, которые обладают характерными металлическими свойствами, а именно высокой электро- и теплопроводностью и металлическим блеском.
- Простые вещества, которые образуют атомы элементов-неметаллов, при нормальных условиях такими свойствами не обладают.
В Периодической таблице Д. И. Менделеева неметаллы расположены в главных подгруппах справа вверху от условной диагонали, проведенной через бор и астат. В главных подгруппах слева от этой диагонали и во всех побочных подгруппах располагаются металлы.
- Оксидами называют класс химических соединений, состоящий из какого-либо элемента и кислорода со степенью окисления –2.
- Оксиды классифицируют так.
- Несолеобразующими, или безразличными, называют оксиды, не проявляющие ни оснОвные, ни кислотные свойства, например N2O, NO, CO.
- Солеобразующими называют группу кислотных, основных и амфотерных оксидов.
Кислотные оксиды образуют неметаллы и некоторые металлы в высших степенях окисления. Примеры кислотных оксидов: CO2, SiO2, N2O3, NO2, N2O5, P2O3, P2O5, SO2, SO3, Cl2O5, Cl2O7, CrO3, Mn2O7.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями с образованием солей и воды или кислых солей, а также с водой в том случае, если образующаяся в ходе такой реакции кислота растворима в воде:
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:

Основные оксиды образуют металлы в низших степенях окисления. Наиболее известные из них: Li2O, Na2O, K2O, MgO, CaO, BaO, HgO, Ag2O.
Их характерные свойства: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:

Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
![]()
Амфотерными называют оксиды, которые проявляют как основные, так и кислотные свойства в зависимости от другого реагента. Наиболее известные амфотерные оксиды Al2O3, Cr2O3, ZnO, BeO, PbO, SnO. Ряд оксидов, например CuО, Fe2O3, проявляет амфотерные свойства с преобладанием основных.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:

- С водой амфотерные оксиды не взаимодействуют.
- Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы.
- Число гидроксильных групп определяет кислотность основания.
- Щелочами называют растворимые в воде основания.
Сильные основания: гидроксиды щелочных и щелочноземельных металлов LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2. Слабые основания: все нерастворимые в воде гидроксиды металлов и гидрат аммиака.
Все основания легко реагируют с кислотами (реакция нейтрализации) и кислотными оксидами с образованием солей и воды:

Основания могут вступать в реакцию с кислыми солями:
![]()
Щелочи при сплавлении с амфотерными оксидами дают соль и воду:
![]()
Щелочи могут вступать в реакции обмена с солями, если в результате этой реакции образуется осадок, например:
![]()
- Нерастворимые в воде основания, а также гидроксид лития при нагревании разлагаются на оксид и воду:
- Кислотами называют класс химических соединений, которые содержат в своем составе один или несколько катионов водорода, способных замещаться на атомы металлов, и анионов кислотных остатков.
- Неорганическими кислотами называют вещества, молекулы которых при электролитической диссоциации в водной среде отщепляют протоны, в результате чего в растворе образуются гидроксоний-катионы Н3О+ и анионы кислотных остатков А–:
- Исключение составляет борная кислота В(ОН)3, которая акцептирует гидроксид-ионы ОН–, в результате чего в водном растворе создается избыток гидроксоний-катионов:
Именно поэтому формулу H3BO3 и соответственно название борная кислота применять не рекомендуется, поскольку все три атома водорода молекулы В(ОН)3 не являются кислотными, т. е. не подвергаются кислотной диссоциации по Аррениусу или кислотному протолизу по Бренстеду.
Основностью кислоты называют число способных замещаться на металл атомов водорода в ее молекуле. По основности кислоты делят на одно-, двух- и трехосновные, например HBr, H2S и H3PO4 соответственно.
- В зависимости от элементного состава кислоты делят на бескислородные и кислородные, например HBr и H2SO3.
- Кислотный остаток — это структурный элемент молекулы кислоты, который выступает как единое целое в ходе химических реакций.
- Все кислоты вступают в реакцию с основаниями с образованием солей и воды (реакция нейтрализации), с основными и амфотерными оксидами с образованием солей и воды, например:
- Водные растворы сильных кислот вступают в реакцию с металлами, которые стоят в ряду напряжений металлов левее водорода, с образованием соли и выделением водорода:
Исключением является азотная кислота в любой концентрации и концентрированная серная кислота. В этих случаях водород не выделяется, а происходит восстановление атомов азота и серы соответственно.
- Сильные кислоты вытесняют более слабые кислоты из их солей. При этом образуется новая кислота и новая соль:
- Сильные кислоты: HI, HBr, HCl, HClO4, H2SO4, HNO3, H2CrO4, H2Cr2O7, HMnO4.
- Кислоты средней силы: H2SO3, H3PO4, HF, HNO2.
- Слабые кислоты: CH3COOH, H2CO3, H2S.
- Кислородсодержащие кислоты и основания объединяют в общий класс гидроксидов.
Амфотерными называют гидроксиды, способные реагировать как с кислотами, так и с основаниями. Амфотерные гидроксиды: Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Be(OH)2, Sn(OH)2 Некоторые гидроксиды (Cu(OH)2, Fe(OH)3) проявляют амфотерные свойства с преобладанием основных. Проиллюстрируем химические свойства амфотерных гидроксидов на примере реакций гидроксида цинка.
- Химические свойства гидроксида:
- Солями называют класс химических соединений, которые представляют собой продукты взаимодействия кислот с основаниями.
- По составу соли классифицируют на средние, кислые и основные.
- Средними называют соли, которые состоят только из катиона металла или иона аммония и аниона кислотного остатка, например: CsBr, MgSO4.
- Кислыми называют соли, которые наряду с катионом металла содержат катионы водорода, способные замещаться на другие катионы в ходе обменных реакций, например: LiHCO3, CaHPO4.
- Основными называют соли, которые наряду с анионом кислотного остатка содержат одну или несколько гидроксильных групп, способных замещаться на анионы в ходе реакций обмена, например: Al(OH)Br2, Cu(OH)I.
- Комплексными называют соли, которые содержат в своем составе комплексные катионы и/или анионы, например: K4[Fe(CN)6], [Ag(NH3)2]Cl.
- Двойными называют соли, формально представляющие собой продукты взаимодействия двух простых солей, например: KAl(SO4)2.
- Смешанными называют соли, являющиеся производными нескольких кислот и/или оснований, например: BaClBr.
- Соли могут реагировать с кислотами с образованием кислых солей; более сильные кислоты могут вытеснять более слабые из их солей:
- Соли взаимодействуют со щелочами:
- Растворимые в воде соли могут вступать друг с другом в реакции обмена, если один из продуктов уходит из сферы реакции в виде осадка, например:
- Растворы или расплавы солей вступают во взаимодействие с металлами, стоящими левее, чем металл, входящий в состав соли, в ряду стандартных электродных потенциалов:
- Кислые соли вступают в реакции со щелочами с образованием средних солей и воды:
- Некоторые кислые соли, например угольной кислоты, разлагаются под действием более сильных кислот:
- ОснОвные соли вступают в реакции с кислотами:
- Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами, например:
- При нагревании комплексные соли теряют воду:
- Классификацию неорганических веществ можно представить следующей самой общей схемой:
Источник: https://himi4ka.ru/egje-2018-po-himii/1-5-klassifikacija-i-obshhie-svojstva-osnovnyh-klassov-neorganicheskih-veshhestv.html
Классификация веществ — урок. Химия, 8–9 класс
Все вещества делятся на простые и сложные.
Простые вещества состоят из атомов одного элемента.
Сложные вещества (химические соединения) состоят из атомов нескольких элементов.
Простые вещества разделяют на металлы и неметаллы. Деление основано на различиях в их свойствах.
Металлы имеют характерный «металлический» блеск, ковкость, высокую теплопроводность и электропроводность. При комнатной температуре все металлы (кроме ртути) твёрдые. Большинство металлов вытесняют из кислот водород.
Серебро
Неметаллы не обладают характерным блеском, ковкостью. Многие неметаллы при обычных условиях газообразны.

Красный фосфор
Сложные вещества делят на органические и неорганические.
Органические вещества — соединения углерода. В их состав могут также входить атомы водорода, кислорода, азота, фосфора, серы.
Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение.
Органических веществ миллионы. Они содержатся во всех живых организмах, входят в состав продуктов питания, топлива, лекарств, красителей, пластмасс.

Изделия из пластмасс
Неорганические вещества — соединения всех остальных элементов. К ним относятся также некоторые вещества, содержащие углерод: сода, мел, угарный и углекислый газы и др. Простые вещества тоже являются неорганическими.
Неорганических веществ около (700) тысяч. Они образуют неживую природу: минералы, горные породы и т. д. Почти все неорганические вещества имеют немолекулярное строение. Большинство из них при обычных условиях представляют собой твёрдые вещества.
Мел
Источник: https://www.yaklass.ru/p/himija/89-klass/klassy-neorganicheskikh-veshchestv-14371/klassifikatciia-veshchestv-194235/re-613caa21-be00-4874-b198-87bbd8045e4c
Классификация веществ в химии
Среднее относительное содержание какого-либо химического элемента в природе называют его распространенностью (кларком) и выражают в массовых или атомных долях, а также в процентах. Химический состав и закономерности распространения и распределения элементов на Земле изучает геохимия.
Характер распространения химических элементов в земной коре сходен с характером их космической распространенности (рис. 1). В состав земной коры входит 88 химических элементов.
Практически отсутствуют технеций, прометий, астат, франций и трансурановые элементы из-за их непродолжительного «времени жизни» (короткоживущие элементы).
Основные элементы земной коры – кислород, кремний, алюминий, натрий, железо, кальций, магний и калий (94,5% (массовых) в сумме).

Рис. 1 Распространение химических элементов в земной коре.
Простые вещества
Один и тот же элемент способен образовывать несколько простых веществ – аллотропных модификаций. Явление аллотропии может быть обусловлено разным составом молекул данного элемента, либо способом размещения молекул или атомов в кристаллах.
Так, атомы фосфора (валентные электроны 3s23p3), имеющие три неспаренных электрона, могут объединяться в полимерные слои Р2 (рис. 2 I) с пирамидальным распределением связей или образовывать четырехатомные молекулы Р4 тетраэдрической формы (рис. 2 II)

Рис. 2. Аллотропные модификации фосфора: I – Р2; II – P4.
В соответствии с характером изменения структуры и типа химической связи изменяются свойства простых веществ (плотность, температура плавления и кипения, электропроводность и т.д.). Так, аргон, хлор и сера в твердом состоянии – диэлектрики, кремний – полупроводник, а алюминий, магний и натрий – проводники.
Химические свойства, а также способы получения простых веществ (металлов и неметаллов) будут рассмотрены позднее.
Двухэлементные (бинарные) соединения
В зависимости от типа химической связи бинарные соединения – ионные, ковалентные, металлические и со смешанным типом химической связи. В соответствии с закономерным развитием электронных структур атомов характер химической связи однотипных соединений в периодах и группах Периодической системы закономерно изменяется.
Рассмотрим это явление на примере бинарных соединений элементов второго периода (рис. 3). Так, при переходе от I к VIII группе в периоде полярность химической связи уменьшается.

Рис. 3 Бинарные соединения элементов второго периода
Так, в ряду фторидов тип химической связи изменяется от ионного (LiF) с последующим уменьшением полярности до ковалентного неполярного (F2).
В соответствии с изменением химической природы элемента закономерно изменяются и химические свойства соединений (кислотно-основная активность). Так, в случае оксидов в ряду от Li2O до N2O5 ослабевают основные свойства и усиливаются кислотные: Li2O – сильно основный оксид, BeO – амфотерный, а B2O3, CO2 и N2O5 – кислотные.
Трехэлементные соединения
- При взаимодействии резко различных по химической природе бинарных соединений образуются новые химические соединения, среди которых наиболее распространены трехэлементные соединения:
- NaF + BF3 = Na[BF4]
- Na2O + CO2 = Na2CO3
- Трехэлементные соединения могут быть ионными, ионно-ковалентными и ковалентными в зависимости от типа химической связи между внутренней и внешней сферами.
- Помимо комплексных соединений среди трехэлементных соединений различают смешанные соединения, твердые растворы и эвтектики.
- Смешанные соединения получают при взаимодействии соединений элементов в равной степени склонных к образованию комплексов:
- CuS + FeS = CuFeS2
- MgO + Al2O3 = MgAl2O4
- Твердые растворы получаются если взаимодействуют электроположительные элементы, способные образовывать близкие по строению и размеру структурные единицы:
- KNO3 + RbNO3 = KNO3 — RbNO3 (твердый раствор)
- MnCl2 + FeCl2 = MnCl2 — FeCl2 (твердый раствор)
- Механическая смесь кристаллов (эвтектика) получается, когда между собой не взаимодействуют соединения элементов, близких по химическим свойствам, но различающихся по строению и размеру атомов или ионов:
- LiCl + KCl = LiCl + KCl (эвтевтика)
Примеры решения задач
Источник: http://ru.solverbook.com/spravochnik/ximiya/11-klass/klassifikaciya-veshhestv/
Классификация неорганических веществ
Классификация неорганических веществ основана на их способности к разложению. Простые вещества, состоящие из атомов только одного химического элемента (O2, H2, Mg), не распадаются.
Легко разлагаются сложные вещества, состоящие из атомов двух и более элементов (CO2, H2SO4, NaOH, KCl).

Классификация классов неорганических веществ включает:
- металлы – элементы, обладающие тепло- и электропроводностью, высокой пластичностью, ковкостью, металлическим блеском;
- неметаллы – более хрупкие, чем металлы, элементы, не обладающие электропроводностью и проявляющие окислительные свойства.
Рис. 1. Схема классификации неорганических веществ.
Металлы расположены в нижнем левом углу периодической таблицы, неметаллы – в правом верхнем углу и включают благородные газы.
Рис. 2. Расположение металлов и неметаллов в таблице Менделеева.
Многие простые химические элементы обладают аллотропией – свойством образовывать несколько простых веществ. Например, при присоединении ещё одного атома к кислороду образуется простое вещество озон (О3), углерод в зависимости от количества атомов образует графит, уголь или алмаз.
Сложные вещества классифицируют на следующие классы:
- оксиды – состоят из двух элементов, один из которых является кислородом;
- кислоты – состоят из атомов водорода и кислотного остатка;
- основания – состоят из металла и одной или нескольких гидроксильных групп;
- соли – состоят из металла и кислотного остатка.
Отдельно выделяют амфотерные гидроксиды, которые проявляют свойства кислот и оснований. Это твёрдые вещества, являющиеся слабыми электролитами. К ним относятся гидроксиды металлов со степенью окисления +3 и +4. Исключениями являются Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2.
Более подробная классификация сложных веществ представлена в таблице с примерами.
| Вид | Номенклатура | Химические свойства | Пример |
| Оксиды – ЕхОу | Оксид элемента (степень окисления) | Выделяют основные оксиды, которые при взаимодействии с кислотами образуют соли, и кислотные оксиды, образующие при взаимодействии с основаниями кислоты. Отдельно выделяют амфотерные оксиды, взаимодействующие с кислотами и основаниями (образуется соль) | Na2O – оксид натрия, Fe2O3 – оксид железа (III), N2O5 – оксид азота (V) |
| Основания – Ме(ОН)х | Гидроксид металла (степень окисления) | В соответствии с растворимостью выделяют щёлочи и нерастворимые в воде основания. Щёлочи взаимодействуют с неметаллами и кислотными оксидами. Нерастворимые основания взаимодействуют с кислотами и способны разлагаться при высоких температурах | Fe(OH)2 – гидроксид железа (II), Cu(OH)2 – гидроксид меди (II), NaOH – гидроксид натрия |
| Кислоты – HnAc | Читается в зависимости от кислотного остатка | Взаимодействуют с металлами, стоящими левее водорода в ряде активности, с оксидами, солями. Способны разлагаться при высоких температурах | H2SO4 – серная кислота, HCl – соляная кислота, HNO3 – азотная кислота |
| Соли – Мех(Ас)у | Кислотный остаток металла (степень окисления) | Реагируют с кислотами, щелочами, металлами и солями | Na2SO4 – сульфат натрия, CaCO3 – карбонат кальция, KCl – хлорид калия |
Рис. 3. Список названий кислот.
Генетические связи между классами основаны на взаимном превращении веществ. При химических реакциях атомы переходят от одного вещества к другому, образуя генетические ряды (ряды превращений).
Металл при присоединении кислорода образует оксид, который при взаимодействии с водой превращается в основание. Из неметалла образуется кислотный оксид, который, взаимодействуя с водой, образует кислоту.
Любой генетический ряд заканчивается солью.
Неорганические вещества включают простые и сложные соединения. Простые вещества состоят из атомов одного и того же элемента. К ним относятся металлы и неметаллы.
Сложные соединения включают вещества, состоящие из нескольких элементов. К ним относятся оксиды, кислоты, основания, соли и амфотерные гидроксиды. Все вещества генетически связаны между собой.
Из простого вещества можно получить более сложное вещество. Наиболее сложными веществами считаются соли.
Средняя оценка: 4.6. Всего получено оценок: 111.
Будь в числе первых на доске почета
Источник: https://obrazovaka.ru/himiya/klassifikaciya-neorganicheskih-veschestv-klassy.html
Классификация и номенклатура неорганических веществ

Оксиды – соединения элементов с кислородом, степень окисления кислорода в оксидах всегда равна -2.
Оснóвные оксиды образуют типичные металлы со С.О. +1,+2 (Li2O, MgO, СаО,CuO и др.).
Кислотные оксиды образуют неметаллы со С.О. более +2 и металлы со С.О. от +5 до +7 (SO2, SeO2, Р2O5, As2O3, СO2,SiO2 , CrO3 и Mn2O7). Исключение: у оксидов NO2 и ClO2 нет соответствующих кислотных гидроксидов, но их считают кислотными.
Амфотерные оксиды образованы амфотерными металлами со С.О. +2,+3,+4 (BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО).
Несолеобразующие оксиды – оксиды неметаллов со С.О.+1,+2 (СО, NO, N2O, SiO).
- Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из иона металла (или иона аммония) и гидроксогруппы (-OH).
- Кислотные гидроксиды (кислоты) — сложные вещества, которые состоят из атомов водорода и кислотного остатка.
- Амфотерные гидроксиды образованы элементами с амфотерными свойствами.
- Соли – сложные вещества, образованные атомами металлов, соединёнными с кислотными остатками.
- Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла.
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Чтобы правильно назвать кислую соль, необходимо к названию нормальной соли прибавить приставку гидро- или дигидро- в зависимости от числа атомов водорода, входящих в состав кислой соли.
Например, KHCO3 – гидрокарбонат калия, КH2PO4 – дигидроортофосфат калия
Нужно помнить, что кислые соли могут образовывать только двух и более основные кислоты.
Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Чтобы назвать основную соль, необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН — групп, входящих в состав соли.
Например, (CuOH)2CO3 — гидроксокарбонат меди (II).
Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Например,KAl(SO4)2, KNaSO4.
Смешанные соли — в их составе присутствует два различных аниона. Например, Ca(OCl)Cl.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4 ·10H2O.
Тривиальные названия часто употребляемых неорганических веществ:
| Формула | Тривиальное название |
| NaCl | галит, каменная соль, поваренная соль |
| Na2SO4*10H2O | глауберова соль |
| NaNO3 | Натриевая, чилийская селитра |
| NaOH | едкий натр, каустик, каустическая сода |
| Na2CO3*10H2O | кристаллическая сода |
| Na2CO3 | Кальцинированная сода |
| NaHCO3 | пищевая (питьевая) сода |
| K2CO3 | поташ |
| КОН | едкое кали |
| KCl | калийная соль, сильвин |
| KClO3 | бертолетова соль |
| KNO3 | Калийная, индийская селитра |
| K3[Fe(CN)6] | красная кровяная соль |
| K4[Fe(CN)6] | желтая кровяная соль |
| KFe3+[Fe2+(CN)6] | берлинская лазурь |
| KFe2+[Fe3+(CN)6] | турнбулева синь |
| NH4Cl | Нашатырь |
| NH3*H2O | нашатырный спирт, аммиачная вода |
| (NH4)2Fe(SO4)2 | соль Мора |
| СаO | негашеная (жженая) известь |
| Са(OH)2 | гашеная известь, известковая вода, известковое молоко, известковое тесто |
| СaSO4*2H2O | Гипс |
| CaCO3 | мрамор, известняк, мел, кальцит |
| СаНРO4×2H2O | Преципитат |
| Са(Н2РO4)2 | двойной суперфосфат |
| Са(Н2РO4)2+2СаSO4 | простой суперфосфат |
| CaOCl2(Ca(OCl)2 + CaCl2) | хлорная известь |
| MgO | жженая магнезия |
| MgSO4*7H2O | английская (горькая) соль |
| Al2O3 | корунд, боксит, глинозем, рубин, сапфир |
| C | алмаз, графит, сажа, уголь, кокс |
| AgNO3 | ляпис |
| (CuОН) 2СO3 | малахит |
| Cu2S | медный блеск, халькозин |
| CuSO4*5H2O | медный купорос |
| FeSO4*7H2O | железный купорос |
| FeS2 | пирит, железный колчедан, серный колчедан |
| FeСО3 | сидерит |
| Fe2О3 | красный железняк, гематит |
| Fe3О4 | магнитный железняк, магнетит |
| FeО × nH2О | бурый железняк, лимонит |
| H2SO4 × nSO3 | олеум раствор SO3 в H2SO4 |
| N2O | веселящий газ |
| NO2 | бурый газ, лисий хвост |
| SO3 | серный газ, серный ангидрид |
| SO2 | сернистый газ, сернистый ангидрид |
| CO | угарный газ |
| CO2 | углекислый газ, сухой лед, углекислота |
| SiO2 | кремнезем, кварц, речной песок |
| CO + H2 | водяной газ, синтез-газ |
| Pb(CH3COO)2 | свинцовый сахар |
| PbS | свинцовый блеск, галенит |
| ZnS | цинковая обманка, сфалерит |
| HgCl2 | сулема |
| HgS | киноварь |
Источник: http://himege.ru/klassifikaciya-neorganicheskix-veshhestv/
Классификация неорганических веществ
- Химические вещества можно разделить на две неравные группы: простые и сложные.
- Простые вещества состоят из атомов одного элемента (О2, P4).
- Сложные вещества состоят из атомов двух и более элементов (CaO, H3PO4).
- Простые вещества можно разделить на металлы и неметаллы.
Металлы – это простые вещества, в которых атомы соединены между собой металлической химической связью.
Металлы стремятся отдавать электроны и характеризуются металлическими свойствами (металлический блеск, высокая электро- и теплопроводность, пластичность и др.).
Неметаллы – это простые вещества, в которых атомы соединены ковалентными (или межмолекулярными) связями. Неметаллы стремятся принимать или притягивать электроны. Неметаллические свойства – это способность принимать или притягивать электроны.
Все элементы в Периодической системе химических элементов (ПСХЭ) расположены либо в главной подгруппе, либо в побочной. В различных формах короткопериодной ПСХЭ главные и побочные подгруппы расположены по-разному.
Есть простой способ, который позволит вам быстро и надежно определять, к акой подгруппе относится элемент. Дело в том, что все элементы второго периода расположены в главной подгруппе.
Те элементы, которые расположены в ячейке точно под элементами второго периода (справа или слева), относятся к главной подгруппе. Остальные — к побочной.
Например, в таблице Менделеева, которая используется на ЕГЭ по химии, элемент номер 32, галлий, расположен в ячейке справа, точно под соответствующим ему элементом второго периода, бором. Следовательно, галлий относится к главной подгруппе. А вот скандий, элемент номер 21, расположен в ячейке слева. Следовательно, скандий относится к побочной подгруппе.
Неметаллы расположены в главных подгруппах, в правом верхнем угле ПСХЭ.
К металлам относятся все элементы побочных подгрупп и элементы главных подгрупп, расположенные в левой нижней части ПСХЭ.
Разделяют металлы и неметаллы обычно, проводя условную линию от бериллия до астата. На рисунке показано точное разделение на металлы и неметаллы. Закрашены цветом неметаллы.
- Основные классы сложных веществ — это оксиды, гидроксиды, соли.
- Оксиды — это сложные вещества, которые состоят из атомов двух элементов, один из которых кислород, имеющий степень окисления -2.
В зависимости от второго элемента оксиды проявляют разные химические свойства. Некоторым оксидам соответствуют гидроксиды (солеобразующие оксиды), а некоторым нет (несолеобразующие).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, которые проявляют характерные основные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +1 и +2. Например, оксид лития Li2O, оксид железа (II) FeO.
Кислотные оксиды — это оксиды, которые проявляют кислотные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов с любой степенью окисления. Например, оксид хлора (I) Cl2O, оксид хрома (VI) CrO3.
Амфотерные оксиды — это оксиды, которые проявляют и основные, и кислотные свойства. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Встречаются и оксиды, похожие на соли, т.е. солеобразные (двойные).
Двойные оксиды — это некоторые оксиды, образованные элементом с разными степенями окисления. Например, магнетит (магнитный железняк) FeO·Fe2O3.
Алгоритм определения типа оксида: сначала определяем, какой элемент образует оксид – металл или неметалл. Если это металл, то определяем степень окисления, затем определяем тип оксида. Если это неметалл, то оксид кислотный (если это не исключение).
Гидроксиды — это сложные вещества, в составе которых есть группа Э-O-H. К гидроксидам относятся основания, амфотерные гидроксиды, и кислородсодержащие кислоты.
- Каждому солеобразующему оксиду соответствует гидроксид:
- основному оксиду соответствует гидроксид основание,
- кислотному оксиду соответствует гидроксид кислота,
- амфотерному оксиду соответствует амфотерный гидроксид.
Например, оксид хрома (II) CrO — основный, ему соответствует гидроксид основание. Формулу гидроксида легко получить, просто добавив к металлу гидроксидную группу OH: Cr(OH)2.
Оксид хрома (VI) — кислотный, ему соответствует гидроксид кислота H2CrO4, и кислотный остаток хромат-ион CrO42-.
Если все индексы кратны 2, то мы делим все индексы на 2.
Например: N2O5 + H2O → H2N2O6, делим на 2, получаем HNO3. Так получаем мета-формулу кислоты. Если мы добавим еще одну молекулу воды, то получим орто-формулу кислоты.
Например: оксид P2O5, мета-форма: HPO3. Добавляем воду, орто-форма: H3PO4. Орто-форма устойчива у фосфора и мышьяка.
- Оксид хрома (III) — Cr2O3 — амфотерный, ему соответствует амфотерный гидроксид, который может выступать и как основание, и как кислота: Cr(OH)3 = HCrO2, кислотный остаток хромит: CrO2—.
- Взаимосвязь оксидов и гидроксидов:
- Основания (основные гидроксиды) — это сложные вещества, которые при диссоциации в водных растворах в качестве анионов (отрицательных ионов) образуют только гидроксид-ионы OH—.
- Основания можно разделить на растворимые в воде (щелочи), нерастворимые в воде, и самопроизвольно разлагающиеся.
- К разлагающимся в воде (неустойчивым) основаниям относят гидроксид аммония, гидроксид серебра (I), гидроксид меди (I). В водном растворе такие соединения практически необратимо распадаются:
- NH4OH → NH3 + H2O
- 2AgOH → Ag2O + H2O
- 2CuOH → Cu2O + H2O
- Основания с одной группой ОН – однокислотные (например, NaOH), с двумя – двухкислотные (Ca(OH)2) и с тремя – трехкислотные (Fe(OH)3).
Кислоты – это сложные вещества, которые при диссоциации в водных растворах образуют в качестве катионов только ионы гидроксония H3O+(H+). Кислоты состоят из водорода H+ и кислотного остатка.
По числу атомов водорода, которые можно заместить на металлы, кислоты разделяют на одноосновные (HNO3), двухосновные (H2SO4), трехосновные (H3PO4) и т.д.
- По содержанию атомов кислорода кислоты делят на бескислородные (например, соляная кислота HCl) и кислородсодержащие (например, серная кислота H2SO4).
- Кислоты также можно разделить на сильные и слабые.
- Сильные кислоты. К ним относятся:
- Бескислородные кислоты: HCl, HBr, HI. Остальные бескислородные кислоты, как правило, слабые.
- Некоторые высшие кислородсодержащие кислоты: H2SO4, HNO3, HClO4 и др.
Слабые кислоты. К ним относятся:
- Слабые и растворимые кислоты: это H3PO4, CH3COOH, HF и др.
- Летучие или неустойчивые кислоты: H2S — газ; H2CO3 — распадается на воду и оксид: H2CO3 → Н2О + СО2↑; H2SO3 — распадается на воду и оксид: H2SO3 → H2O+ SО2↑.
- Нерастворимые в воде кислоты: H2SiO3, H3BO3 и другие.
Определить, сильная кислота перед вами, или слабая, позволяет простой прием. Мы вычитаем из числа атомов O в кислоте число атомов H. Если получаем число 2 или 3, то кислота сильная. Если 1 или 0 — то кислота слабая.
Например: HClO: 1-1 = 0, следовательно, кислота слабая.
Соли – сложные вещества, состоящие из катиона металла (или металлоподобных катионов, например, иона аммония NH4+) и аниона кислотного остатка. Также солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.
- Если рассматривать соли, как продукты взаимодействия кислоты и основания, то соли делят на средние, кислые и основные.
- Средние соли – продукты полного замещения катионов водорода в кислоте на катионы металла (например, Na2CO3, K3PO4).
- Кислые соли – продукты неполного замещения катионов водорода в кислоте на катионы металлов (например, NaHCO3, K2HPO4).
- Основные соли – продукты неполного замещения гидроксогрупп основания на анионы кислотных остатков кислоты (например, малахит (CuOH)2CO3).
- По числу катионов и анионов соли разделяют на:
- Простые соли – состоящие из катиона одного типа и аниона одного типа (например, хлорид кальция CaCl2).
- Двойные соли – это соли, состоящие из двух или более разных катионов и аниона одного типа (например, алюмокалиевые квасцы – KAl(SO4)2).
- Смешанные соли – это соли, состоящие из катиона одного типа и двух или более анионов разного типа (например, хлорид-гипохлорит кальция Ca(OCl)Cl).
- По структурным особенностям выделяют также гидратные соли и комплексные соли.
- Гидратные соли (кристаллогидраты) – это такие соли, в состав которых входят молекулы кристаллизационной воды (например, декагидрат сульфата натрия Na2SO4·10 H2O).
- Комплексные соли – это соли, содержащие комплексный катион или комплексный анион (K3[Fe(CN)6], [Cu(NH3)4](OH)2).
Помимо основных классов неорганических соединений, существует большое количество других. Например, бинарные соединения элементов с водородом.
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водород образует солеобразные гидриды и летучие водородные соединения.
Солеобразные гидриды ЭНх – это соединения металлов IA, IIA групп и алюминия с водородом. Степень окисления водорода равна -1. Например, гидрид натрия NaH.
Летучие водородные соединения НхЭ – это соединения неметаллов с водородом, в которых степень окисления водорода равна +1. Например, аммиак NH3, фосфин PH3.
Источник: https://chemege.ru/materials/classification/
Классификация неорганических веществ
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов).
В химических реакциях разлагаются с образованием нескольких других веществ.
| Неорганические вещества | |
| Простые | Металлы |
| Неметаллы | |
| Сложные | Оксиды |
| Основания | |
| Кислоты | |
| Соли |
Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства. Аллотропия
- Аллотропия — способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.
- 1) различным числом атомов в молекуле, например кислород O2 и озон O3
- ОСНОВАНИЯ
С — алмаз, графит, карбин. O — кислород, озон. S — ромбическая, моноклинная, пластическая. P — белый, красный, чёрный. Явление аллотропии вызывается двумя причинами: 2) образованием различных кристаллических форм, например алмаз и графит. Основания — сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания — сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид — анионы OH-). Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот. Получение 1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O ® 2NaOH + H2
Ca + 2H2O ® Ca(OH)2 + H2 2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O ® Ba(OH)2
3. Электролиз водных растворов солей
2NaCl + 2H2O ® 2NaOH + H2 + Cl2
Химические свойства
| Щёлочи | Нерастворимые основания |
| 1. Действие на индикаторы. | |
| лакмус — синий метилоранж — жёлтый фенолфталеин — малиновый | — |
| 2. Взаимодействие с кислотными оксидами. | |
| 2KOH + CO2 ® K2CO3 + H2O KOH + CO2 ® KHCO3 | — |
| 3. Взаимодействие с кислотами (реакция нейтрализации) | |
| NaOH + HNO3 ® NaNO3 + H2O | Cu(OH)2 + 2HCl ® CuCl2 + 2H2O |
| 4. Обменная реакция с солями | |
| Ba(OH)2 + K2SO4 ® 2KOH + BaSO4¯ 3KOH+Fe(NO3)3 ® Fe(OH)3¯ + 3KNO3 | — |
| 5. Термический распад. | |
| — | Cu(OH)2 -t°® CuO + H2O |
- ОКСИДЫ Классификация
- Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
| ОКСИДЫ | |
| Несолеобразующие | CO, N2O, NO |
| Солеобразующие | Основные -это оксиды металлов, в которых последние проявляют небольшую степень окисления +1, +2Na2O; MgO; CuO |
| Амфотерные (обычно для металлов со степенью окисления +3, +4). В качестве гидратов им соответствуют амфотерные гидроксидыZnO; Al2O3; Cr2O3; SnO2 | |
| Кислотные -это оксиды неметаллов и металлов со степенью окисления от +5 до +7SO2; SO3; P2O5; Mn2O7; CrO3 | |
| Основным оксидам соответствуют основания,кислотным — кислоты,амфотерным — и те и другие |
Получение 1. Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 ® 2MgO
4P + 5O2 ® 2P2O5 S + O2 ® SO2 2CO + O2 ® 2CO2 2CuS + 3O2 ® 2CuO + 2SO2 CH4 + 2O2 ® CO2 + 2H2O 4NH3 + 5O2 -кат.® 4NO + 6H2O 2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2 -t°® CuO + H2O
(CuOH)2CO3 -t°® 2CuO + CO2 + H2O 2Pb(NO3)2 -t°® 2PbO + 4NO2 + O2 2HMnO4 -t°;H2SO4(конц.)® Mn2O7 + H2O
Химические свойства
| Основные оксиды | Кислотные оксиды |
| 1. Взаимодействие с водой | |
| Образуется основание: Na2O + H2O ® 2NaOH CaO + H2O ® Ca(OH)2 | Образуется кислота: SO3 + H2O ® H2SO4 P2O5 + 3H2O ® 2H3PO4 |
| 2. Взаимодействие с кислотой или основанием: | |
| При реакции с кислотой образуется соль и вода MgO + H2SO4 -t°® MgSO4 + H2O CuO + 2HCl -t°® CuCl2 + H2O | При реакции с основанием образуется соль и вода CO2 + Ba(OH)2 ® BaCO3 + H2O SO2 + 2NaOH ® Na2SO3 + H2O |
| Амфотерные оксиды взаимодействуют | |
| с кислотами как основные: ZnO + H2SO4 ® ZnSO4 + H2O | с основаниями как кислотные: ZnO + 2NaOH ® Na2ZnO2 + H2O (ZnO + 2NaOH + H2O ® Na2[Zn(OH)4]) |
| 3. Взаимодействие основных и кислотных оксидов между собой приводит к солям. | |
| Na2O + CO2 ® Na2CO3 | |
| 4. Восстановление до простых веществ: | |
| 3CuO + 2NH3 ® 3Cu + N2 + 3H2O P2O5 + 5C ® 2P + 5CO |
Источник: https://www.examen.ru/add/manual/school-subjects/natural-sciences/chemistry/obshhaya-ximiya/klassifikacziya-neorganicheskix-veshhestv/




