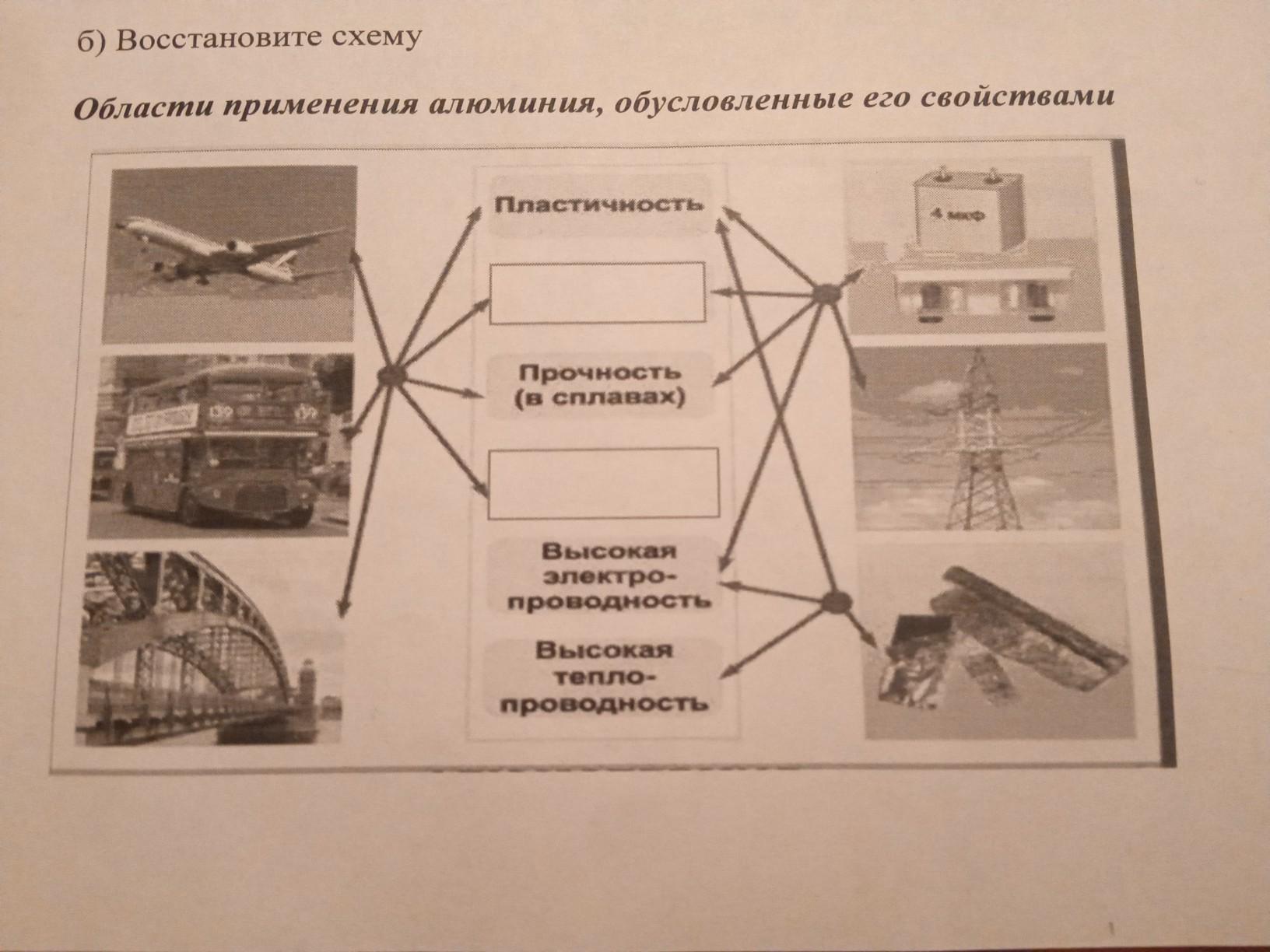
Области применения алюминия
Авиация
На современном этапе развития дозвуковой и сверхзвуковой авиации алюминиевые сплавы являются основными конструкционными материалами в самолетостроении.
В авиации США широко применяются сплавы серии 2ххх, Зххх, 5ххх, 6ххх и 7ххх. Серия 2ххх рекомендована для работы при высоких рабочих температурах и с повышенными значениями коэффициента вязкости разрушения.
Сплавы серии 7ххх — для работы при более низких температурах значительно нагруженных деталей и для деталей с высокой сопротивляемостью к коррозии под напряжением. Для малонагруженных узлов применяются сплавы серии Зххх, 5ххх и 6xxx.
Они же используются в гидро-, масло-и топливных системах.
В России при изготовлении авиационной техники успешно используются упрочняемые термической обработкой высокопрочные алюминиевые сплавы Al-Zn-Mg-Cu и сплавы средней и повышенной прочности Al-Mg-Cu.
Они являются конструкционным материалом для обшивки и внутреннего сплавного набора элементов планера самолета (фюзеляж, крыло, киль и др.). Сплав 1420, принадлежащий системе Al-Zn-Mg, используют при конструировании сварного фюзеляжа пассажирского самолета.
При изготовлении гидросамолетов предусмотрено применение свариваемых коррозионностойких магнолиевых сплавов (AМг5, АМг6) и сплавов Al-Zn-Mg (1915, В92, 1420).

Рисунок 1 – Гражданский самолет
Бесспорное преимущество имеется у свариваемых алюминиевых сплавов при создании объектов космической техники. Высокие значения удельной прочности, удельной жесткости материала позволили обеспечить изготовление баков, межбаковых и носовых частей ракеты с высокой про-дольной устойчивостью.
К достоинствам алюминиевых сплавов (2219 и др.) следует отнести их работоспособность при криогенных температурах в контакте с жидким кислородом, водородом и гелием. У этих сплавов происходит так называемое криогенное упрочнение, т.е.
прочность и пластичность параллельно растут с понижением температуры.
Сплав 1460 принадлежит системе Al-Cu-Li и является более перспективным для проектирования и изготовления баковых конструкций применительно к криогенному типу топлива – сжатому кислороду, водороду или природному газу.
Судостроение
Алюминий и сплавы на его основе находят все более широкое применение в судостроении. Из алюминиевых сплавов изготовляют корпусы судов, палубные надстройки, коммуникацию и различного рода судовое оборудование.
Основное преимущество при внедрении алюминия и его сплавов по сравнению со сталью – снижение массы судов, которая может достигать 50 – 60 %. В результате представляется возможность повысить грузоподъемность судна или улучшить его тактико-технические характеристики (маневренность, скорость и т.д.).
Наиболее широкое применение среди алюминиевых сплавов для изготовления конструкций речного и морского флота находят магналиевые сплавы АМгЗ, АМг5, АМг61, а также сплавы АМц и Д16.
Корпус судна повышенной грузоподъемности изготовляют из стали, тогда как надстройки и другое вспомогательное оборудование из алюминиевых сплавов.
Имеет место изготовление рыболовецких баркасов из сплава АМг5 (обшивка).
Широкое применение в судостроении США находят свариваемые сплавы серии 5ххх и 6ххх. Там, где необходима высокая прочность (500 МПа), используются полуфабрикаты из сплавов серии 2xxx и 7ххх.
Железнодорожный транспорт
Тяжелые условия эксплуатации подвижного состава железной дороги (длительный срок службы и способность выдерживать ударные нагрузки) выдвигают особые требования к конструкционным материалам.

Рисунок 2 – Товарный поезд
Основные характеристики алюминия и его сплавов, раскрывающие целесообразность применения их в железнодорожном транспорте, высокая удельная прочность, небольшая сила инерции, коррозионная стойкость. Внедрение алюминиевых сплавов при изготовлении сварных емкостей повышает их долговечность при перевозке ряда продуктов химической и нефтехимической промышленности.
Алюминий и его сплавы используются при изготовлении кузова и рамы вагона. Для вагона рекомендованы свариваемые сплавы средней прочности марок АМг3, AMr5, Амг6 и 1915. Перспективными сплавами для рефрижераторных вагонов являются алюминиевые сплавы. В зависимости от продуктов химической промышленности выбирается марка свариваемого материала для котлов цистерны.
В США из свариваемых сплавов серии 6ххх, серии 5ххх и сплава 7005 изготавливают подвижной состав с получением оптимальных прочностных характеристик и высокой коррозионной стойкости сварных элементов.
Автомобильный транспорт
Одним из основных требований к материалам, применяемым в автомобильном транспорте, является малая масса и достаточно высокие показатели прочности. Принимаются во внимание также коррозионная стойкость и хорошая декоративная поверхность материала.

Рисунок 3 – Автомобиль
Высокая удельная прочность алюминиевых сплавов увеличивает грузоподъемность и уменьшает эксплуатационные расходы передвижного транспорта. Высокая коррозионная стойкость материала продляет сроки эксплуатации, расширяет ассортимент перевозимых товаров, включая жидкости и газы с высокой агрессивной концентрацией.
При изготовлении элементов каркаса, обшивки кузова полуприцепа автофургона, рефрижератора, скотовоза и т.п. перспективным материалом являются алюминиевые сплавы АД31, 1915 (прессованные профили) и сплавы АМг2, АМг5 (лист).
Находят применение алюминиевые сплавы АМц, АМгЗ и 1915 при изготовлении отдельных узлов легкового автомобиля (навесные детали, бамперы, радиаторы охлаждения, отопители).
В автомобилестроении США широко используются алюминиевые свариваемые сплавы серии Зххх, 5ххх и 6ххх.
Из прессованных полуфабрикатов сплавов 2014 и 6061 изготовляют балки, рамы тяжелых грузовых автомобилей. Панели и отдельные элементы из сплава 5052 поступают на изготовление кабины.
В качестве обшивочного материала кузова грузовика используют лист из сплавов 5052, 6061, 2024, 3003 и 5154. Стойки кузова выполняются из прессованных полуфабрикатов сплавов 6061 и 6063.
Магналиевые сплавы серии 5ххх (5052, 5086, 5154 и 5454) являются основным материалом при изготовлении автоцистерн.
Строительство
Перспективность применения алюминиевых сплавов в строительных конструкциях подтверждается технико-экономическими расчетами и многолетней мировой практикой в области сооружения различных строительных объектов.
Внедрение алюминиевых сплавов в строительстве уменьшает металлоемкость, повышает долговечность и надежность конструкций при эксплуатации их в экстремальных условиях (низкая температура, землетрясение и т.п.). В зависимости от назначения строительных алюминиевых конструкций рекомендуются различные марки сплавов: АД1, АМц, АМг2, АД31, 1915 и др.

Рисунок 4 – Здание со светопрозрачными конструкциями из алюминия
Опыт, накопленный в США, подтверждает целесообразность использования алюминиевых сплавов в строительных конструкциях. На них расходуется больше алюминия, чем в любой другой отрасли промышленности. При этом предпочтение отдается внедрению свариваемых сплавов серии Зххх, 5ххх и 6ххх.
Нефтяная и химическая промышленность
Освоение новых месторождений, увеличение глубины скважин выдвигают определенные требования к материалам, применяемым для изготовления деталей и узлов нефте- и газопромыслового оборудования и аппаратуры для переработки продуктов нефти.

Рисунок 5 – Нефтяная вышка
Высокая удельная прочность алюминиевых сплавов позволяет уменьшить массу бурильного оборудования, облегчить их транспортабельность и обеспечить прохождение глубоких скважин.
Коррозионностойкие алюминиевые сплавы дают возможность повысить эксплуатационную надежность бурильных, насосно-компрессорных и нефтегазопроводных труб. Повышенная сопротивляемость коррозионному растрескиванию позволяет применить алюминиевые сплавы при изготовлении емкостей для хранения нефти и ее продуктов.
Основным конструкционным материалом при изготовлении бурильных труб из алюминиевых сплавов является сплав марки Д16.
Высокую стойкость к сырой нефти и некоторым бензинам показали алюминиевые сплавы АМг2, AMr3, АМг5 и АМг6. Из перечисленных магналиевых сплавов наиболее технологичным сплавом для изготовления аппаратов является сплав АМг2, особенно при изготовлении конденсаторов и холодильников на нефтеперегонных заводах.
В США оборудование для нефтяной промышленности изготовляется из алюминиевых сплавов серии Зххх, 5ххх и 6ххх. В конструкции бурового оборудования применяют трубы из сплава 6063.
Морские платформы собираются из труб 6061, 6063, а также из высокопрочных сплавов марок 2014 и 7075. Из алюминия АДОО, АДО и АД1 изготовляют емкости, колонны, конденсаторы и т.п.
для производства уксусной кислоты, сульфирования жирных спиртов, хлората калия, натриевой и аммиачной селитры, синильной кислоты и т.д.
Химической промышленности рекомендованы алюминиевые сплавы АМц, АМг2, АМгЗ, АМг5 для изготовления сосудов, работающих под давлением при температурах от – 196 до +150 °С.
Из алюминия АДОО, АДО и АД1 изготовляют емкости, колонны, конденсаторы и т.п. для производства уксусной кислоты, сульфирования жирных спиртов, хлората калия, натриевой и аммиачной селитры, синильной кислоты и т.д.
В США в зависимости от условий эксплуатации аппаратуры химической промышленности применяют сплавы серий 1ххх, Зххх, 5ххх. В отдельных случаях для обеспечения наибольшей прочности применяют термически упрочняемые сплавы 2ххх и 7ххх с пониженной коррозионной стойкостью.
Емкости для хранения химических продуктов выполняют из сплавов высокой коррозионной стойкости – 1100 или 3003; сосуды высокого давления – из сплавов 5052 или 6063; тара, цистерны и другие виды оборудования для хранения уксусной кислоты, высокомолекулярных жирных кислот, спиртов и других продуктов – из сплавов 3003, 6061, 6063, 5052; емкости для озоносодержащих растворов удобрений из сплавов 3004; 5052 и 5454; емкости для хранения растворов нитрата аммония из сплавов 1100, 3003, 3004, 5050, 5454, 6061 и 6062 [3].
Электрика
Алюминий и ряд сплавов на его основе находят применение в электротехнике, благодаря хорошей электропроводности, коррозионной стойкости, небольшому удельному весу, и, что немаловажно, меньшей стоимостью, по сравнению с медью и ее проводниковыми сплавами.
В зависимости от величины удельного электросопротивления, алюминиевые сплавы подразделяют на проводниковые и сплавы с повышенным электрическим сопротивлением.
Удельная электрическая проводимость электротехнического алюминия марок А7Е и А5Е составляет порядка 60 % от проводимости отожженной меди по международному стандарту. Технический алюминий АД0 и электротехнический А5Е используют для изготовления проводов, кабелей и шин. Применение в электротехнической промышленности получили низколегированные сплавы алюминия системы Al-Mg-Si АД31, АД31Е.
Сплавы алюминия, повышающие его прочность и улучшающие другие свойства, получают введением в него легирующих добавок, таких, как медь, кремний, магний, цинк, марганец.
Дуралюмин
Дуралюмин (дюраль, дюралюминий, от названия немецкого города, где было начато промышленное производство сплава) – сплав алюминия (основа) с медью (Cu: 2,2 – 5,2%), магнием (Mg: 0,2 – 2,7 %) марганцем(Mn: 0,2 – 1 %). Подвергается закалке и старению, часто плакируется алюминием. Является конструкционным материалом длZ авиационного и транспортного машиностроения.

Рисунок 6 – Дюралюминий листовой
Силумин
Силумин – легкие литейные сплавы алюминия (основа) с кремнием (Si: 4 – 13 %), иногда до 23 % и некоторыми другими элементами: Cu, Mn, Mg, Zn, Ti, Be). Из него изготавливают детали сложной конфигурации, главным образом в авто- и авиастроении.
 |
 |
| Рисунок 7 – Силумин | Рисунок 8 – Магналии |
Магналии
Магналии – сплавы алюминия (основа) с магнием (Mg: 1 – 13 %) и другими элементами, обладающие высокой коррозийной стойкостью, хорошей свариаемостью, высокой пластичностью. Из них изготавливают фасонные отливки (литейные магналии), листы, проволоку, заклепки и т. д. (деформируемые магналии).
По широте применения сплавы алюминия занимают второе место после стали и чугуна [4].
Применение в быту
Исследуя влияние алюминия на различные пищевые продукты, ученые установили, что при контакте пищи с алюминием не разрушаются витамины.
Это открытие послужило причиной широкого применения алюминия в пищевой промышленности, в виде посуды из алюминия, а также в косметике и бытовой химии.
Из алюминия изготавливают разнообразную аппаратуру, предназначенную для переработки пищевых продуктов в сахарной, кондитерской, маслобойной и других отраслях промышленности.

Рисунок 9 – Алюминивая посуда
Алюминиевых изделий изобилие, как на кухне крупного предприятия общественного питания, так и на домашней кухне: мясорубки, вилки, ложки, чашки, тазы, посуда из алюминия и т. д. Алюминиевая фольга — прекрасный упаковочный материал, хорошо сохраняющий различные продукты.
В обертку из алюминиевой фольги упаковываются кулинарный жир, маргарин, мороженое, конфеты и многое другое, поэтому его еще именуют — пищевой алюминий. В алюминиевые тубы традиционно упаковывается зубная паста.
Чтобы было удобно пользоваться, некоторые продукты, такие, например, как плавленый сыр, упаковывают в тубы с отвинчивающейся крышкой. В таких тубах берут с собой в космос продукты питания космонавты.
Все чаще тонкий листовой пищевой алюминий применяется вместо жести при производстве консервных банок, а также все больше посуды из алюминия изготавливают производители [5].
Фармацевтика
Говоря об универсальности алюминия, нельзя обойти вниманием важный факт: металл, из которого делают посуду и самолеты, широко применяется для лечения и предупреждения тяжелых болезней и одобрен для этих целей Всемирной организацией здравоохранения. Конечно, речь идет не об алюминии в чистом виде, а о его соединениях.
В 1926 году было открыто, что осажденный квасцами дифтерийный токсоид (обезвреженный бактериальный токсин) гораздо лучше стимулирует выработку антител, чем он же в чистом виде. С тех пор для усиления действия вакцин чаще всего используют алюминиевые соли, поскольку они считаются безвредными для человека.
Именно на основе алюминия производят наиболее эффективные антациды. Гидроокись алюминия, хорошо нейтрализующая кислоту, нужна для лечения язвенных болезней, диспепсии, раздражения желудка. Для этих же целей подходит фосфат алюминия.
 |
|
| Рисунок 10 — Лекарства | Рисунок 11 — Дезодоранты |
Но даже тем, у кого прекрасное здоровье, пригодится содержащее алюминий средство, которое продается в любое аптеке, да и не только. Речь идет о дезодоранте-антиперспиранте. Еще древние греки и римляне использовали квасцы для подавления секреции.
Обычными квасцами пользовались и наши бабушки. В первые фабричные средства от запаха пота добавляли хлорид алюминия, а основным агентом современных средств является хлоргидрат алюминия.
Кстати, на чем основан эффект их действия, до сих пор точно не известно [6].
Источник: https://MetalSpace.ru/education-career/osnovy-metallurgii/metallurgiya-alyuminiya/680-primenenie-alyuminiya.html
Алюминий

Кусок чистого алюминия
Алюминий — очень редкий минерал семейства меди-купалита подкласса металлов и интерметаллидов класса самородных элементов. Преимущественно в виде микроскопических выделений сплошного мелкозернистого строения.
Может образовывать пластинчатые или чешуйчатые кристаллы до 1 мм., отмечены нитевидные кристаллы длиной до 0,5 мм. при толщине нитей несколько мкм.
Лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
СТРУКТУРА

Кубическая гранецентрированная структура. 4 оранжевых атома
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно.
Элементарная ячейка состоит из четырех атомов размером 4,049596×10-10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10-10 м, а атомный объем 9,999×10-6 м3/г-атом.
Примеси в алюминии незначительно влияют на величину параметра решетки.
Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В.
В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10-5 см), но прочной пленкой оксида алюминия А1203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
СВОЙСТВА

Самородный алюминий. Поле зрения 5 x 4 мм. Азербайджан, Гобустанский район, Каспийское море, Хере-Зиря или остров Булла
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью, парамагнетик. Температура плавления 660°C. К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см3), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость.
Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой — оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления.
Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется.
При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона.
Запасы и добыча

Кусочки алюминия
По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов.
Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
ПРОИСХОЖДЕНИЕ

Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико.
Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов.
Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
ПРИМЕНЕНИЕ

Украшение из алюминия
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость.
Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу.
Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем.
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г.
были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Алюминий (англ. Aluminium) — Al
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.21
Физические свойства
Оптические свойства
Плеохроизмне плеохроирует
Кристаллографические свойства
Источник: http://mineralpro.ru/minerals/aluminium/
Алюминий – общая характеристика элемента, химические свойства
 Алюми́ний — элемент главной подгруппы III группы, третьего периода, с атомным номером 13. Алюминий – р-элемент. На внешнем энергетическом уровне атома алюминия содержится 3 электрона, которые имеют электронную конфигурацию 3s23p1. Алюминий проявляет степень окисления +3.
Алюми́ний — элемент главной подгруппы III группы, третьего периода, с атомным номером 13. Алюминий – р-элемент. На внешнем энергетическом уровне атома алюминия содержится 3 электрона, которые имеют электронную конфигурацию 3s23p1. Алюминий проявляет степень окисления +3.
Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий— лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
 Химические свойства алюминия
Химические свойства алюминия
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. При разрушении оксидной плёнки алюминий выступает как активный металл-восстановитель.
1. Алюминий легко реагирует с простыми веществами-неметаллами:
- 4Al + 3O2 = 2Al2O3
- 2Al + 3Cl2 = 2AlCl3,
- 2Al + 3 Br2 = 2AlBr3
- 2Al + N2 = 2AlN
- 2Al + 3S = Al2S3
- 4Al + 3С = Al4С3
- Сульфид и карбид алюминия полностью гидролизуются:
- Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
- Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
2. Алюминий реагирует с водой
(после удаления защитной оксидной пленки):
2Al + 6H2O = 2Al(OH)3 + 3H2
3. Алюминий вступает в реакцию со щелочами
- 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
- 2(NaOH•H2O) + 2Al = 2NaAlO2 + 3H2
- Сначала растворяется защитная оксидная пленка: Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
- Затем протекают реакции: 2Al + 6H2O = 2Al(OH)3 + 3H2, NaOH + Al(OH)3 = Na[Al(OH)4],
- или суммарно: 2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2,
- и в результате образуются алюминаты: Na[Al(OH)4] — тетрагидроксоалюминат натрия Так как для атома алюминия в этих соединениях характерно координационное число 6, а не 4, то действительная формула тетрагидроксосоединений следующая: Na[Al(OH)4(Н2О)2]
4. Алюминий легко растворяется в соляной и разбавленной серной кислотах:
- 2Al + 6HCl = 2AlCl3 + 3H2
- 2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
- При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
- 8Al + 15H2SO4(конц) = 4Al2(SO4)3 + 3H2S + 12H2O
- Al + 6HNO3(конц) = Al(NO3)3 + 3NO2 + 3H2O
5. Алюминий восстанавливает металлы из их оксидов (алюминотермия):
- 8Al + 3Fe3O4 = 4Al2O3 + 9Fe
- 2Al + Cr2O3 = Al2O3 + 2Cr



Источник: http://himege.ru/alyuminij-xarakteristika-elementa/
Алюминий
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
- Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
- При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
- В природе алюминий встречается в виде минералов:
- Al2O3 — корунд
- 3BeO*Al2O3*6SiO2 — берилл (аквамарин — примесь Fe и изумруд — примесь Cr2O3)
- Al2O3*Cr2O3 — красный рубин
- Al2O3 с примесью Fe+2/Fe+3/Ti
- Al2O3*H2O — боксит
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3AlF6). Галлий, индий и таллий получают схожим образом — методом электролиза их оксидов и солей.
Al2O3 → (t) Al + O2 (в расплаве криолита — Na3AlF6)
- Реакции с неметаллами
- При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
- Al + O2 → Al2O3 (снаружи Al покрыт оксидной пленкой — Al2O3)
- Al + Br2 → AlBr3 (бромид алюминия)
- При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
- Al + F2 → (t) AlF3 (фторид алюминия)
- Al + S → (t) Al2S3 (сульфид алюминия)
- Al + N2 → (t) AlN (нитрид алюминия)
- Al + C → (t) Al4C3 (карбид алюминия)
- Реакции с кислотами и щелочами
- Al + HCl → AlCl3 + H2
- Al + H2SO4(разб.) → Al2(SO4)3 + H2↑
- Al + H2SO4(конц.) → (t) Al2(SO4)3 + SO2↑ + H2O
- Al + HNO3(разб.) → (t) Al(NO3)3 + N 2O + H2O
- Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде — выделяется водород)
- При прокаливании комплексные соли не образуются, так вода испаряется:
- Na[Al(OH)4] → (t) NaAlO2 + H2O
- Реакция с водой
- Алюминотермия
- С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.
- Fe2O3 + Al → (t) Al2O3 + Fe
- Cr2O3 + Al → (t) Al2O3 + Cr
- MnO2 + Al → (t) Al2O3 + Mn
- Al + O2 → Al2O3
- Al(OH)3 → (t) Al2O3 + H2O↑
- Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
- Al2O3 + H2SO4 → Al2(SO4)3 + H2O
- Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
- Al2O3 + NaOH → (t) NaAlO2 + H2O (алюминат натрия)
- Al2O3 + Na2O → (t) NaAlO2
- AlBr3 + LiOH → Al(OH)3↓ + LiBr
- Al(NO3)3 + K2CO3 → KNO3 + Al(OH)3↓ + CO2 (двойной гидролиз: Al(NO3)3 гидролизуется по катиону, K2CO3 — по аниону)
- Al2S3 + H2O → Al(OH)3↓ + H2S↑

Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι — двойственный), вступает в реакции как с кислотами, так и с основаниями.
При комнатной температуре не идет из-за образования оксидной пленки — Al2O3 — на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет.
Al + H2O → (t) Al(OH)3 + H2↑

Алюминотермия (лат. Aluminium + греч. therme — тепло) — способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.

Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом — на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок — гидроксид алюминия.
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание — Li3[Al(OH)6] — гексагидроксоалюминат лития)

Источник: https://studarium.ru/article/165
Алюминий и его характеристики
Алюминий – самый распространенный в земной коре металл. Он входит в состав глин, полевых шпатов, слюд и многих других минералов. Общее содержание алюминия в земной коре составляет 8% (масс.).
Алюминий – серебристо-белый (рис. 1) легкий металл. Он легко вытягивается в проволоку и прокатывается в тонкие листы.
При комнатной температуре алюминий не изменяется на воздухе, но лишь потому, что его поверхность покрыта тонкой пленкой оксида, обладающего очень сильным защитным действием.

Рис. 1. Алюминий. Внешний вид.
Атомная и молекулярная масса алюминия
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии алюминий существует в виде одноатомных молекул Al, значения его атомной и молекулярной масс совпадают. Они равны 26,9815.
Изотопы алюминия
Известно, что в природе алюминий может находиться в виде одного стабильного изотопа 27Al. Массовое число равно 27. Ядро атома изотопа алюминия 27Al содержит тринадцать протонов и четырнадцать нейтронов.
Существуют радиоактивные изотопы алюминия с массовыми числами от 21-го до 42-х, среди которых наиболее долгоживущим является изотоп 26Al, период полураспада которого составляет 720 тысяч лет.
Ионы алюминия
На внешнем энергетическом уровне атома алюминия имеется три электрона, которые являются валентными:
1s22s22p63s23р 1.
В результате химического взаимодействия алюминий отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Al0-3e → Al3+.
Молекула и атом алюминия
В свободном состоянии алюминий существует в виде одноатомных молекул Al. Приведем некоторые свойства, характеризующие атом и молекулу алюминия:
| Энергия ионизации атома, эВ | 5,99 |
| Относительная электроотрицательность | 1,61 |
| Радиус атома, нм | 0,143 |
| Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль | 329,1 |
Сплавы алюминия
Основное применение алюминия – производство сплавов на его основе. Легирующие добавки (например, медь, кремний, магний, цинк, марганец) вводят в алюминий главным образом для повышения его прочности.
Широкое применение имеют дуралюмины, содержащие медь и магний, силумины, в которых основной добавкой служит кремний, магналий (сплав алюминия с 9,5-11,5% магния).
Алюминий – одна из наиболее распространенных добавок в сплавах на основе меди, магния, титана, никеля, цинка и железа.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/ximiya/ximicheskie-elementy/alyuminij-i-ego-xarakteristiki/
Статьи
Свойства алюминия
Алюминий — серебристо-белый легкий металл. Расположен в III группе Периодической системы элементов Д.И.Менделеева под номером 13; атомная масса алюминия — 26,98.
Конфигурация внешней электронной оболочки 3s23р; атомный радиус — 0,143 мм, ионный радиус А1 3+ (в скобках указаны координационные числа) 0,053 нм (4); 0,062 нм (5); 0,067 нм (6); энергия ионизации А1 -» А1 + -> А1 2+ —> А1 3+ — соответственно 5,984; 18,828; 28,44 эВ; сродство к электрону 0,5 эВ; электроотрицательность по Поллингу — 1,5; поперечное сечение захвата тепловых нейтронов — 215*10-25 м2 [3]. Алюминий имеет кубическую гранецентрированную кристаллическую решетку с параметрами: а = 0,40403 нм, z = 4, пространственная группа Fm3m. В природе существует один стабильный изотоп 27А1.
Отличительные особенности алюминия — высокая электропроводимость, теплопроводность, коррозионная стойкость, малая плотность и отличная обрабатываемость давлением в холодном состоянии.
Физические свойства алюминия [2-6]
| Плотность (99,996% А1), г/см3, при температуре: | |
| 20 °С | 2,6989 |
| 1000 °С | 2,289 |
| плавления | 660 |
| кипения | ~2452 |
| плавления | 10,55 |
| испарения | 291,4 |
| Давление пара, Па, при температуре: | |
| 660 °С | 0,266 |
| 1123 °С | 13 3 |
| 1279 °С | 133 |
| Удельная теплоемкость, Дж/(кг*К), при температуре: | |
| 20 °С | 929,46 |
| 100 °С | 931,98 |
| Коэффициент линейного расширения при температуре 20-100 °С, К-1 | 24,58*10-6 |
| Теплопроводность, Вт/( м*К), при температуре: | |
| 20 °С | 217 |
| 190 °С | 343 |
| Электропроводность по отношению к меди при температуре 20 °С | 65,5% |
| Удельное электросопротивление, мк*Ом*м | 0.0265 |
| Температурный коэффициент электросопротивления | 0,042 |
| Динамическая вязкость (99,85% А1), Н*с/м2, при температуре: | |
| 800 °С | 2*10-3 |
| 1123 °С | 1,540-3 |
| 1279 °С | 1,3*10-3 |
| Модуль нормальной упругости Е, МПа, при температуре: | |
| 180 °С | 7,8*104 |
| 20 °С | 7,1*104 |
| 100 °С | 7,0*104 |
| 200 °С | 6,6*104 |
| 400 °С | 5,6*104 |
| 500 °С | 5,0*104 |
| 600 °С | 4,4*104 |
| Модуль сдвига при температуре 20 °С | 2,7*104 МПа |
| Магнитная характеристика алюминия | Слабо парамагнитен |
Механические свойства алюминия [4-6]
| Временное сопротивление разрыву σв,МПА: | |
| в отожженном состоянии | 50 |
| в деформированном (холоднокатаном) состоянии | 115 |
| в отожженном состоянии | 50-80 |
| в деформированном состоянии | 120 |
| Предел усталости (500*10 6 циклов),σ -1: | |
| в отожженном состоянии | 40 |
| в деформированном состоянии | 50 |
| Предел ползучести, при температуре: | |
| 15 °С | 50 |
| 100 °С | 27 |
| 200 °С | 7 |
| Предел прочности при срезе,σ ср: | |
| в отожженном состоянии | 60 |
| в деформированном состоянии | 100 |
| Относительное удлинение,δ: | |
| в отожженном состоянии | 30-40% |
| в деформированном состоянии | 5-10% |
| Относительное сужение, ψ: | |
| в отожженном состоянии | 70-90% |
| в деформированном состоянии | 50-60% |
| Ударная вязкость при температуре 20 °С aм | 140 |
| Твердость по Бринеллю, НВ: | |
| в отожженном состоянии | 25 |
| в литом состоянии | 20 |
| в деформированном состоянии | 30-35 |
При охлаждении алюминия до температуры ниже 120 К его прочностные свойства в отличии от большинства металлов возрастают, а пластичность не изменяется (табл. 1.7).
Таблица 1.7.
Механические свойства алюминия различной чистоты
| Состояние | Содержание Аl, % | Предел прочности при растяжении σв2МПа | Предел текучести при растяжении σ.00,2, МПа | Относительное удлинение δ, % | Твердость по Бринеллю, НВ |
| Литой в землю | 99,996 | 50 | — | 45 | 13-15 |
| Литой в землю | 99,5 | 75 | — | 29 | 20 |
| Литой в землю | 99.0 | 85 | — | 20 | 25 |
| Литой в кокиль | 99,0 | 90 | — | 25 | 25 |
| Деформированный и отожженный | 99.0 | 90 | 30 | 30 | 25 |
| Деформированный | 99,0 | 140 | 100 | 12 | 32 |
| Литой в землю | 98,0 | 90 | 35 | 12,5 | 28 |
Технологические свойства алюминия [6]
| Температура | |
| литья горячей обработки отжига отпуска Линейная усадка, % Допускаемая деформация (холодная и горячая), % Начало рекристаллизации, °СЖидкотекучесть, мм. | 690-710 350-450 370-400 150 2,7 75-90 150 317 |
Коррозионные свойства алюминия [6].
Алюминий и его сплавы характеризуются высокой коррозионной стойкостью в атмосферных условиях как сельской местности, так и городских промышленных районов.
Сернистый газ, сероводород, аммиак и другие газы, находящиеся в воздухе промышленных районов, не оказывают заметного влияния на скорость коррозии алюминия и его сплавов. Алюминий практически не корродирует в дистиллированной и чистой пресной (естественной) воде даже при высоких температурах (до 180 °С). Действие пара на алюминий и его сплавы также незначительно.
Вода, содержащая примеси щелочей, резко повышает скорость коррозии алюминия. При комнатной температуре скорость коррозии алюминия в аэрированной воде содержащей 0,1% едкого натрия — 16 мм/год; 0,1% соляной кислоты — 1 мм/год и 1% соды — 4 мм/год.
Алюминий и его сплавы, не содержащие меди, достаточно стойки в естественной (не загрязненной) морской воде. Сернокислые соли магния, натрия, алюминия, а также гипосульфит практически не действуют на технический алюминий. Скорость коррозии алюминия возрастает в присутствии в воде солей ртути, меди или ионов хлора, разрушающих защитную оксидную пленку на алюминии.
В концентрированной азотной кислоте при комнатной температуре алюминий и его сплавы устойчивы, но быстро разрушаются в разбавленных кислотах.
Слабые растворы серной кислоты, концентрацией до 10%, при комнатной температуре незначительно влияют на технический алюминий, но с повышением концентрации и температуры скорость коррозии резко возрастает. В концентрированной серной кислоте алюминий практически устойчив.
Соляная кислота быстро разрушает алюминий и его сплавы, особенно с повышением температуры. Такое же действие на алюминий оказывают растворы плавиковой и бромистоводородной кислот. Слабые растворы фосфорной (менее 1%), хромовой (до 10%) и борной (при всех концентрациях) кислот на алюминий и его сплавы действуют незначительно.
Органические кислоты — уксусная, масляная, лимонная, винная, а также кислые (незагрязненные) фруктовые соки, вино оказывают слабое действие на алюминий и его сплавы, за исключением щавелевой и муравьиной кислот.
Алюминий и его сплавы быстро разрушаются в растворах едких щелочей, однако в растворах аммиака они довольно стойки, особенно сплавы, содержащие магний. Амины на них действуют также незначительно.
Следует отметить, что алюминий и однофазные сплавы на алюминиевой основе более стойки в коррозионном отношении, чем сплавы двухфазные и многофазные.
Влияние примесей на свойства алюминия. На коррозионные, физические, механические и технологические свойства алюминия оказывают значительное влияние примеси различных элементов. Так, например, большинство примесей снижают электропроводность алюминия (рис. 1.1).
Основные примеси в алюминии — железо и кремний. Железо снижает коррозионную стойкость, электропроводность и пластичность алюминия, но несколько повышает его прочность. Диаграмма состояния системы Al-Fe, приведенная на рис. 1.
2, показывает, что железо незначительно растворяется в алюминии в твердом состоянии. При температуре эвтектики (655°С) растворимость железа достигает 0,052% и с понижением температуры граница твердого раствора а резко сдвигается в сторону алюминия.
Железо в алюминии присутствует в виде самостоятельной фазы Al3Fe.
Железо — вредная примесь не только в алюминии, но и в сплавах алюминия с кремнием и магнием. Однако в жаропрочных алюминиевых сплавах железо (в сочетании с никелм) является полезной примесью.
Обычная примесь в алюминии — кремний. В сплавах на алюминиевой основе кремний наряду с медью, магнием, цинком, а также марганцем, никелем и хромом вводится в качестве основного компонента. Образующиеся при этом соединения CuAl2, Mg2Si, CuMgAl2 и др. являются эффективными упрочнителями алюминиевых сплавов.
Из диаграммы состояния алюминий-кремний (рис. 1.3) видно, что при температуре эвтектики 577°С в алюминии растворяется до 1,65% кремния. С понижением температуры область твердого раствора α резко уменьшается.
Примеси кальция и других элементов, присутствующих в стандартных марках алюминия в незначительном количестве, не имеют практического значения. Небольшие добавки церия, натрия и титана оказывают существенное влияние на структуру и свойства определенных алюминиевых сплавов.
Водород хорошо растворяется в алюминии и оказывает отрицательное влияние на его свойства, вызывая при литье пористость. Азот при высоких температурах вступает в реакцию с алюминием с образованием тугоплавкого соединения.
Токсикологические свойства алюминия [7]. В соответствии с ГОСТом по степени воздействия на организм человека алюминиевую пыль относят к III классу опасности. Предельно-допустимая концентрация (ПДК) в воздухе пыли металлического алюминия и его оксидов составляет 2 мг/м3.
При постоянном вдыхании пыли металлического алюминия и его оксида может возникнуть алюминоз легких. Рабочие, подвергшиеся воздействию пыли, должны проходить периодически флюорографическое обследование. У рабочих, занятых в производстве алюминия, часты катары верхних дыхательных путей (рипиты, фарингиты).
Наибольшую опасность для здоровья представляет процесс электролиза глинозема, протекающий в расплавленном криолите (Na3AlF6) при температуре 950 °С. Электролиз расплавленных солей может сопровождаться выбросами большого количества фторидной пыли, фторсодержащих газов, а также паров и частиц битума-компонента анодной массы.
Рабочим, занятым на этой операции, также грозят ожоги кожи и глаз при попадании на них расплавленного металла. Во избежании несчастных случаев электролизные ванны необходимо надежно изолировать, рабочие должны иметь средства индивидуальной защиты:, противопылевые маски, очки„, перчатки, фартуки, сапоги и т.д.
В электролизных цехах должен регулярно проводиться контроль за содержанием пыли в воздухе.
ПДК алюминия и его оксида по ГОСТу и нормативам США приведены ниже:
| Стандарт | Вещество | Агрегатное состояние | ПДК, мг/м 1 (в пересчете на металл) |
| ГОСТ 12. 1.005 | Алюминий | Пыль | 2 |
| STEL ACGIH* | Алюминий, оксид алюминия | Пыль | 20 |
| TLV ACGIII** | То же | То же | 10 |
| TLV ACGIH | Алюминий | Порошок (от 00,2 до 0,04 мкм) | 5 |
| TLV ACGIH | Алюминий | Пары | 5 |
| * Предел кратковременного влияния, т.е. максимальная концентрация, воздействию которой человек может подвергаться не более 15 минут подряд при условии, что в течении дня допускается не более 4-х таких воздействий с промежутками не менее 60 минут. ** Величина порогового предела концентрации вещества, устанавливаемая американской конференцией государственных гигиенистов и определенная для 8-часового рабочего дня и 40-часовой рабочей недели. |
Источник: https://tdsm.ru/article/view/svojstva-aluminia-2
Алюминий: физические свойства, получение, применение, история
Физические свойства алюминия
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью. Температура плавления 660°C.
По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов.
К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см3), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов.
Алюминий и его сплавы делятся по способу получения на деформируемые, подвергаемые обработке давлением и литейные, используемые в виде фасонного литья; по применению термической обработки — на термически не упрочняемые и термически упрочняемые, а также по системам легирования.
Получение
Впервые алюминий был получен Гансом Эрстедом в 1825 году. Современный метод получения разработали независимо друг от друга американец Чарльз Холл и француз Поль Эру.
Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием графитовых электродов.
Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке.
Применение
Алюминий широко применяется как конструкционный материал.
Основные достоинства алюминия в этом качестве — легкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной пленкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки.
Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий).
Электропроводность алюминия сравнима с медью, при этом алюминий дешевле. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при изготовлении проводников в чипах. Правда, у алюминия как электротехнического материала есть неприятное свойство — из-за прочной оксидной пленки его тяжело паять.
Благодаря комплексу свойств широко распространен в тепловом оборудовании.
Внедрение алюминиевых сплавов в строительстве уменьшает металлоемкость, повышает долговечность и надежность конструкций при эксплуатации их в экстремальных условиях (низкая температура, землетрясение и т.п.).
Алюминий находит широкое применение в различных видах транспорта. На современном этапе развития авиации алюминиевые сплавы являются основными конструкционными материалами в самолетостроении.
Алюминий и сплавы на его основе находят все более широкое применение в судостроении.
Из алюминиевых сплавов изготовляют корпусы судов, палубные надстройки, коммуникацию и различного рода судовое оборудование.
Идут исследования по разработке пенистого алюминия как особо прочного и легкого материала.
Драгоценный алюминий
В настоящее время алюминий является одним из самых популярных и нашедших широкое применение металлов.
С самого момента открытия в середине XIX века его считали одним из ценнейших благодаря удивительным качествам: белый как серебро, легкий по весу и не подверженный воздействию окружающей среды. Стоимость его была выше цен на золото.
Не удивительно, что в первую очередь алюминий нашел свое применение в создании ювелирных изделий и дорогих декоративных элементов.
В 1855 г. на Универсальной выставке в Париже алюминий был самой главной достопримечательностью. Изделия из алюминия располагались в витрине, соседствующей с бриллиантами французской короны. Постепенно зародилась определенная мода на алюминий. Его считали благородным малоизученным металлом, используемым исключительно для создания произведений искусства.
Наиболее часто алюминий использовали ювелиры. При помощи особой обработки поверхности ювелиры добивались наиболее светлого цвета металла, из-за чего его часто приравнивали к серебру. Но в сравнении с серебром, алюминий обладал более мягким блеском, чем обуславливалась еще большая любовь к нему ювелиров.
Так как химические и физические свойства алюминия сначала были слабо изучены, ювелиры сами изобретали новые техники его обработки. Алюминий технически легко обрабатывать, этот мягкий металл позволяет создавать отпечатки любых узоров, наносить рисунки и создавать желаемой формы изделия. Алюминий покрывался золотом, полировался и доводился до матовых оттенков.
Но со временем алюминий стал падать цене. Если в 1854-1856 годах стоимость одного килограмма алюминия составляла 3 тысячи старых франков, то в середине 1860-х годов за килограмм этого металла давали уже около ста старых франков. Впоследствии из-за низкой стоимости алюминий вышел из моды.
В настоящее время самые первые алюминиевые изделия представляют большую редкость. Большинство из них не пережило обесценивания металла и было заменено серебром, золотом и другими драгоценными металлами и сплавами.
В последнее время вновь наблюдается повышенный интерес к алюминию у специалистов. Этот металл стал темой отдельной выставки , организованной в 2000 году Музеем Карнеги в Питсбурге.
Во Франции расположен Институт истории алюминия, который в частности занимается исследованием первых ювелирных изделий из этого металла.
В Советском союзе из алюминия делали общепитовские приборы, чайники и т.д. И не только. Первый советский спутник был выполнен из алюминиевого сплава.
Другой потребитель алюминия — электротехническая промышленность: из него делаются провода высоковольтных линий передач, обмотки моторов и трансформаторов, кабели, цоколи ламп, конденсаторы и многие другие изделия.
Кроме того, порошок алюминия применяют во взрывчатых веществах и твердом топливе для ракет, используя его свойство быстро воспламеняться: если бы алюминий не покрывался тончайшей оксидной пленкой, то мог бы вспыхивать на воздухе.
Последнее изобретение — пеноалюминий, т.н. «металлический поролон», которому предсказывают большое будущее.
Источник: https://TochMeh.ru/info/alum2.php




