-
 • уксусной кислоты CH3COOH и аммония NH4; • уксусной кислоты CH3COOH и карбоната аммония (NH4)2CO3;• CH3COOH и водного раствора аммиака NH3;• ледяной уксусной кислоты и газообразного аммиака;• карбоната аммония и ледяной уксусной кислоты, полученной уксуснокислым брожением этанола (технология для пищепрома);• цианометана (ацетонитрила) CH3CN и воды.
• уксусной кислоты CH3COOH и аммония NH4; • уксусной кислоты CH3COOH и карбоната аммония (NH4)2CO3;• CH3COOH и водного раствора аммиака NH3;• ледяной уксусной кислоты и газообразного аммиака;• карбоната аммония и ледяной уксусной кислоты, полученной уксуснокислым брожением этанола (технология для пищепрома);• цианометана (ацетонитрила) CH3CN и воды.
В лабораториях уксуснокислый аммоний получают воздействием уксусной кислоты на гидроокись аммония NH4OH или гидролизом ацетонитрила.
 |
 |
| Аммоний уксуснокислый | Банка 1 Л (С55) |
Свойства
Ацетат аммония представляет собой порошкообразное вещество с белыми или прозрачными бесцветными кристаллами в виде иголок. Практически не имеет запаха (возможен легкий запах уксуса). Вкус слегка щелочной.
Активно впитывает влагу из воздуха и «расплывается», легко растворяется даже в совсем холодной воде. Растворяется в этаноле. Разлагается при нагревании всего до +112 °С (один из самых низких показателей для солей).
Реактив является солью, образованной слабой кислотой и слабым основанием. Водные растворы имеют нейтральную среду. Вступает в реакции с сильными кислотами и образует уксусную кислоту CH3COOH и соль аммония. Реагирует со щелочами и оксидами щелочных и щелочноземельных металлов с выделением газообразного аммиака.
Меры предосторожности
Аммоний уксуснокислый относится к веществам 3-го класса опасности для человека. Вызывает раздражение слизистых верхних дыхательных путей и глаз. Может вызывать химический ожог при попадании на незащищенную кожу и в глаза. При передозировке оказывает негативное влияние на печень. Может вызывать аллергические реакции при наличии индивидуальной непереносимости.
На предприятиях работники должны использовать средства защиты: респираторы, очки, спецодежду, резиновые перчатки. Рабочее место располагают в помещениях, оборудованных системой вентиляции.
Расфасовывают реагент в герметично заваренные плотные полиэтиленовые мешки, помещенные для прочности во внешние многослойные бумажные или полипропиленовые мешки. Хранят в прохладных вентилируемых складах.
В лабораториях нужно следить, чтобы ацетат аммония хранился вдали от источников тепла и солнечных лучей, в герметичных сосудах, защищающих от влаги воздуха.
Аммониевая соль уксусной кислоты легко доступна, недорогая, поэтому широко применяется в различных областях.
Применение
• Для органического синтеза кетонов и альдегидов в химпроме.• В лабораторной практике — входит в состав ацетатного буферного раствора.
• Добавка Е264 в пищепроме — это консервант, регулятор кислотности, ограниченно разрешенный в некоторых странах, в том числе в РФ (считается относительно безопасным).
Достаточно редко используется для консервирования овощей, в производстве плавленых сыров. Иногда применяется для ускорения созревания недорогих вин.
 • Пестицид для борьбы с плодовой мушкой и другими вредителями в сельском хозяйстве.• В качестве экологичного биоразлагаемого антиобледенителя для автотрасс — в коммунальном хозяйстве • В биохимии водный раствор ацетата аммония является коагулянтом для выделения белков из раствора.• Для окрашивания шерсти в текстильпроме.
• Пестицид для борьбы с плодовой мушкой и другими вредителями в сельском хозяйстве.• В качестве экологичного биоразлагаемого антиобледенителя для автотрасс — в коммунальном хозяйстве • В биохимии водный раствор ацетата аммония является коагулянтом для выделения белков из раствора.• Для окрашивания шерсти в текстильпроме.
Источник: https://pcgroup.ru/blog/ammonij-uksusnokislyj-nedorogoj-i-vostrebovannyj-reaktiv/
Таинственный консервант Е264 (ацетат аммония)
Пищевой консервант Е 264 относится к пищевым добавкам, статус которых до сих пор не определен. Санитарно–эпидемиологические нормы РФ позволяют использовать его в производстве ограниченного числа продуктов питания. ГОСТ предпочел исключить сомнительное вещество из списка добавок.
Чем не угодила ученой комиссии одна из солей уксусной кислоты? Попробуем разобраться.
Название продукта
Пищевая добавка с европейским кодом E 264 (другое написание Е–264) носит название — Ацетат аммония. Международный синоним — Ammonium acetate.
Химическое наименование — Аммоний уксуснокислый (Ammoniumsaltofaceticacid).
Синонимы в других языках:
- Ammoniumacetat или Ammonium salzder Essigsaure (немецкий);
- Acetate de ammonium или Sel de ammonium de l’acide acetique (французский).
Тип вещества
Неорганическое вещество является аммонийной солью уксусной кислоты.
Получают пищевую добавку E 264 путем химической реакции нейтрализации ледяной уксусной кислоты (результат уксуснокислого брожения этилового спирта) аммониевой солью угольной кислоты.
При нагревании разлагается на воду, слабую уксусную кислоту, этанамид и аммиак.
Свойства
| Показатель | Стандартные значения |
| Цвет | беловатый |
| Состав | аммонийная соль; эмпирическая формула C2H7NO2 |
| Внешний вид | кристаллы |
| Запах | отсутствует или слабый уксусной кислоты |
| Растворимость | хорошо в воде |
| Содержание основного вещества | 98% |
| Вкус | Слабый щелочной |
| Плотность | 1,073 (20°C г/см3) |
| Другие | гигроскопичен |
Расфасовывают пищевую добавку Е 264 в стандартные многослойные бумажные или полипропиленовые мешки с дополнительным вкладышем из плотного полиэтилена.
Применение
Ацетат аммония разрешен для производства продуктов питания в России, Белоруссии, Казахстана, Армении.
В странах Европейского Союза добавка запрещена.

- В пищевой отрасли ацетат аммония используют при консервировании овощей (в качестве регулятора кислотного баланса) и в производстве плавленых сыров. Обычно в композиции с диацетатом натрия или другими консервантами.
- Фармацевтические предприятия вводят раствор ацетата аммония в состав мочегонных препаратов, редко — антибиотиков.
- В сельском хозяйстве в качестве пестицида для борьбы с плодовой мушкой и другими вредителями.
- Консервант Е 264 иногда добавляют в дешевые сорта вин для ускорения созревания и стабилизации вкуса.
- Широко применяют ацетат аммония для технических нужд (окрашивание тканей, экологически безопасный антиобледенитель и другие), в аналитической химии в качестве реактива, в органическом синтезе.
Польза и вред

- Вред добавки Е 264 связывают с возможными аллергическими реакциями, нарушением работы печени и индивидуальной непереносимостью.
- Как любая кислота, попадая на кожу, может вызвать ожог.
- Лабораторные опыты показали, что высокая доза уксуснокислого аммония может привести к летальному исходу (для крыс критической было количество 632 мг на 1 кг массы).
- Технологические инструкции по производству продуктов питания не предполагают использование высокой концентрации вещества.
Соблюдать осторожность необходимо при покупке алкоголя. Дешевая добавка популярна у поставщиков фальсифицированных крепленых напитков. Количество ацетата аммония в составе никто не контролирует. Сохранить здоровье можно, отказавшись от покупки алкогольной продукции в сомнительных местах.
Основные производители
- специализированный завод химикатов Тунъюань Ляньюньган (Китай, провинция Цзянсу);
- компания HEMAGmbH & Co (Германия);
- предприятие Норд Плас, входящее в группу компаний NORD (Санкт-Петербург);
- компания «Химреактив» (Нижний Новгород).
Лабораторные испытания ацетат аммония продолжаются до сих пор.
- Институт питания РАМН не признал добавку Е 264 безопасной и в выдаче сертификата отказал.
- Роспотребнадзор, специалисты центра «Кедр» и Министерство здравоохранения дали консерванту расплывчатое определение «относительно безопасный».
- Потребитель может успокоить себя тем, что доля применения добавки Е 264 в пищевой отрасли невелика.
Источник: https://vkusologia.ru/dobavki/konservanty/e264.html
Что такое ацетат аммония?

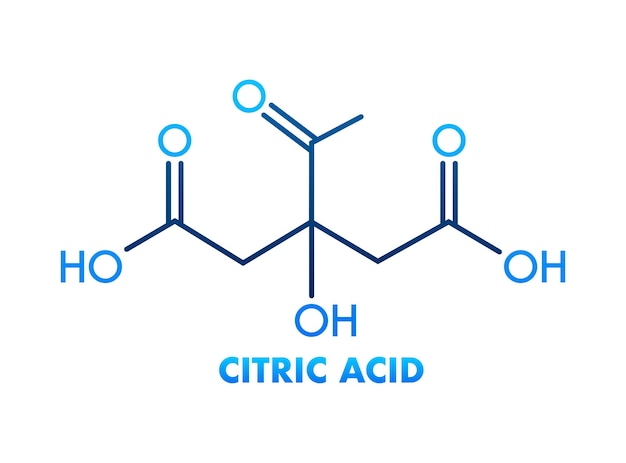
Ацетат аммония (аммоний уксуснокислый) – это аммониевая соль CH3COOH (соль слабых кислоты и основания). Выглядит как твердая масса, сформированная не имеющими цвета кристаллическими образованиями с ромбической решеткой. Обладает гигроскопичностью. Вкус – едва выраженный щелочной. Растворение в H2O – хорошее (148 г/100 мл), также хорошо поддается растворению в этаноле, этерах; в диметилкетоне (ацетоне) растворяется слабо. Разлагается легко при небольшой температуре с образованием амида уксусной кислоты и воды.
Молярная масса – 77,0825 г/моль, плотность – 1,07 г/см³, t разложения – 112 °C. Формула: C2H7NO2.
Синтез
Чтобы создать данное вещество, необходимо соединить карбонат аммония и абсолютную этановую кислоту. В кислоту, охлаждаемую водой и активно помешиваемую, вливают 10 %-ный NH4OH.
Когда появляется сильный запах аммиака, массу фильтруют, при необходимости осуществляют выпаривание на водяной бане до того момента, пока не образуется кристаллическая пленка.
Далее следует отстаивание выпавших кристаллов на воронке Бюхнера и беспромедлительное перемещение в плотно закрывающуюся емкость.
Применение
Ацетат аммония – это материал, важный для многих пром. отраслей, в каждой из которых ему отведена особая роль.
В пищепроме он используется как добавка к пище E264 из группы консервантов, благодаря которой можно достичь сохранности пищевых продуктов путем остановки и прекращения репродуцирования бактерий и грибков, провоцирующих болезни человека. Одна из наиболее частых задач, для выполнения которых задействуется – регулировка созревания вин. К тому же, может выступать солью-плавителем, благодаря способности смягчать кислый вкус CH3COOH в пище.
- В медицине применяется как лекарство с мочегонными характеристиками.
- При окрашивании шерсти выступает протравой.
- В состав средств, предотвращающих локальное обледенение, входит как биологически разлагаемый реактив.
Вместе с уксусной кислотой является компонентом буферных растворов. Особенность его в этой роли – разложение при малой температуре без формирования ионов.
В орган. синтезе этот реагент находит применение в реакции Кневенагеля.
В аналитической химии служит коагулянтом. Если растворить данное вещество в очищенной водной среде, можно осаждать белки из растворов.
Такая широта использования объясняется доступностью этого соединения и его невысокой стоимостью.
Ацетат аммония и безопасность
Продукт в полной мере усваивается организмом, но кислота, освобождающаяся в ходе реакции, может незначительно и неспецифически раздражать. Разрешенная к употреблению суточная доза не установлена.
Применение этой соли в технических целях требует обязательного соблюдения правил безопасности. Как и множество иных хим. веществ, данное может провоцировать аллергии и обжигать кожу. Поэтому важно избегать прямого контакта с телом. Если этого не удалось достичь (уксуснокислый аммоний попал на кожу, в глаза или дыхательные пути), промойте пораженный участок водой и обратитесь к доктору.
Теперь вы знаете, что такое ацетат аммония и как с ним следует обращаться. Остались вопросы по поводу применения? Обращайтесь!
Источник: https://www.systopt.com.ua/ru/chto-takoe-atsetat-ammonyya/
Ацетат аммония
Случайный факт:
За последние 50 лет средний рост женщин увеличился на 1 см.
— Обновить
- Разрешающие применение — 2
- Упоминаний о добавке— 4
- Россия — разрешена
- Украина — нет данных
- Беларусь — разрешена
- Евросоюз — нет данных
- США — разрешена
- Канада — нет данных
Ацетат аммония представляет собой химическое соединение в виде белых гигроскопических кристаллов, с слабовыраженным щелочным вкусом. Хорошо растворим в эфирах и воде, но плохо растворим в ацетоне. Ацетат аммония получают путем взаимодействия карбоната аммония с уксусной кислотой, либо воздействием аммиака на уксусную кислоту. Химическая формула CH3COONH4.
E-264 Ацетат аммония является дешевым в производстве и легкодоступным пищевым консервантом.
Консервант Е-264 способен смягчать кислый вкус некоторых ингредиентов, изменяя вкус готовых продуктов питания.
Применение:
В пищевой промышленности Е-264 используются для сохранения качества продукции, останавливая размножение бактерий и грибков, как консервант, в виноделии — регулятор созревания вин, нейтрализует слишком кислый вкус уксусной кислоты. Его используют в качестве биоразлагаемого реагента или антиобледенителя, а так же в органическом синтезе.
Пищевой консервант E-264 Ацетат аммония используют не только в пищевой промышленности, но и в фармакологии как компонент большинства мочегонных лекарственных средств, а так же химической промышленности как протрава при окрашивании шерсти.
При растворении в дистилированной воде Ацетат аммония выступает как коагулянт, осаждающий белки из раствора.
Воздействие на организм человека:
Ацетат аммония полностью усваивается организмом человека и способен вызывать стойкие аллергические реакции, тошноту у людей, страдающих индивидуальной непереносимостью пищевых добавок.
При попадании любого количества ацетата аммония на слизистые или кожные покровы человека возникает жжение и неприятные ощущения, может вызвать ожог.
В такой ситуации нужно сразу же промыть место ожога водой и обратиться за медицинской помощью, во избежание тяжелых последствий, которые могут возникнуть в результате негативного воздействия ацетата аммония на человеческий организм.
Передозировка ацетатом аммония может вызвать фатальные негативные последствия для здоровья и жизни человеческого организма.
Ацетат аммония Е-264 не имеет на настоящее время положительного заключения Института питания Академии медицинских наук РФ и не имеют разрешения Госкомсанэпиднадзора РФ на использование в пищевой промышленности.
Источник: https://prodobavki.com/dobavki/E264.html
E264 Ацетат аммония
Ацетат аммония (Ammonium acetate, E264) — белые или прозрачные кристаллы, которые могут быть получены при реакции уксусной кислоты с аммонием. Он легко доступен, относительно дёшев и широко применяется.
- Химическая формула NH4C2H3O2.
- В пищевой промышленности используется как консервант.
- Растворенный в дистилированной воде используется как коагулянт, осаждающий белки из раствора.
Примечательно то, что вред пищевого консерванта E264 Ацетат аммония до настоящего времени изучается.
На основе результатов предварительных исследований и тестирования пищевому консерванту E264 Ацетат аммония был присвоен статус «относительно безопасной» пищевой добавки для здоровья человека.
Однако, использование в современной пищевой промышленности пищевого консерванта E264 Ацетат аммония запрещено или ограничено в большинстве стран мира.
В Российской Федерации пищевой консервант E264 Ацетат аммония не смог пройти сертификацию и получить одобрение Института питания Академии медицинских наук РФ. Ацетат аммония представляет собой химическое соединение в виде кристаллического вещества, которое получают в результате воздействия аммиаком на уксусную кислоту.
Пищевой консервант E264 Ацетат аммония считается легкодоступной и дешевой в производстве пищевой добавкой.
Биологически активное химическое соединение ацетат аммония, содержащиеся в составе консерванта Е264, используют в качестве биоразлагаемого реагента или антиобледенителя, а так же в органическом синтезе и, так называемой, «конденсации Кневенагеля».
По своим химическим свойствам пищевой консервант E264 Ацетат аммония не особо отличается от других пищевых добавок, которые обладают сходными антибактериальным свойствами.
Химический состав пищевого консерванта E264 Ацетат аммония определяет отличительные свойства соединения.
Е264 Ацетат аммония способен изменять вкус готовых продуктов питания и смягчать от природы ярко выраженные кислые вкусы некоторых исходных ингредиентов.
Пищевой консервант E264 Ацетат аммония используют не только в пищевой, но и в фармакологической, а так же химической промышленности. К примеру, ацетатом аммония протравливают шерстяную ткань при окраске. Кроме того ацетат аммония входит в состав большинства мочегонных лекарственных средств.
Вред пищевого консерванта E264 Ацетат аммония
Основной вред пищевого консерванта E264 Ацетат аммония заключается в способности вызывать стойкие аллергические реакции у людей, страдающих индивидуальной непереносимостью пищевых добавок.
Правда, такие тяжелые последствия пищевой консервант E264 Ацетат аммония вызывают у небольшого круга испытуемых.
Однако, некоторые исследователи полагают, что передозировка ацетатом аммония может вызвать фатальные негативные последствия для здоровья и жизни человеческого организма.
возможный вред пищевого консерванта E264 Ацетат аммония санитарно-эпидемиологические службы Российской Федерации запрещают использовать не до конца изученное вещество в процессе производства товаров продовольственной группы.
Правда, некоторые недобросовестные производители продолжают применять ацетат аммония в процессе производства некачественной подпольной алкогольной продукции. К примеру, пищевой консервант Е264 Ацетат аммония применяют в качестве регулятора созревания плодово-ягодных вин.
Стоит отметить, что пищевой консервант E264 Ацетат аммония нашел широкое применение в химической промышленности.
Для работы с ацетатом аммония разработана специальная техника безопасности, которая предусматривает обязательное наличие средств индивидуальной защиты и специальной одежды.
При попадании любого количества ацетата аммония на слизистые или кожные покровы человека возникает жжение и неприятные ощущения.
При возникновении такой ситуации нужно сразу же обратиться за медицинской помощью, во избежание тяжелых последствий, которые могут возникнуть в результате негативного воздействия ацетата аммония на человеческий организма.
Источник: http://ruslekar.info/E264-Atsetat-ammoniya-953.html
ПОИСК
АММОНИИ УКСУСНОКИСЛЫЙ (АММОНИЙ АЦЕТАТ) [c.
47]
Водные растворы каких из нижеперечисленных веществ будут вызывать изменения окраски индикатора бромид натрия, цианид натрия, нитрат цезия, фосфат калия, перхлорат калия, дигидрофосфат натрия, бромид железа (III), ацетат натрия, бромид аммония, ацетат алюминия Напишите сокращенные ионные уравнения процессов, протекающих при взаимодействии указанных солей с водой. [c.117]
По указанию преподавателя измеряется pH одного из растворов солей хлорида аммония, ацетата натрия и нитрата аммония. Полученные данные используют для расчета степени и константы гидролиза, а также термодинамических характеристик в экспериментах второй части работы. [c.104]
Какую реакцию должны показывать водные растворы нитрата аммония, нитрата калия, цианида калия, цианида аммония, ацетата аммония [c.78]
Аммония ацетата насыщенный раствор. Растворяют достаточное количество аммония уксуснокислого в воде до получения раствора, содержащего не менее 61,5 % аммония уксуснокислого. [c.104]
Аммоний уксуснокислый Аммоний ацетат Уксусной кислоты аммонийная [c.43]
Акролеин. … Ализарин. … Ализариновый красный С Аллоксан. … Алюминон. … Аммония ацетат Аммония бензоат Аммония оксалат. Аммония стеарат. . [c.3]
АММОНИЯ АЦЕТАТ И ФОРМИАТ. Мол. вес 77,09 и 63,06 соответственно. [c.68]
Можно ли оттитровать в водном растворе прямым способом борную кислоту, соли аммония, ацетат-ион [c.117]
Пример 6. Вычислить эквивалентную электропроводность ацетата аммония при бесконечном разведении, если значения этой, величины для хлорида аммония, ацетата натрия и хлорида натрия прн 25° С равны соответственно 129,9-10 91,01-10 и 108,9-10 СмХ Хм -моль . [c.21]
Примечание Аммония ацетата раствор (40 г/л) ИР должен быть свежеприготовленным. [c.386]
Определение тяжелых металлов. 5 мл настойки выпаривают досуха, прибавляют I мл концентрированной серной кислоты, осторожно сжигают и прокаливают.
Полученный остаток обрабатывают при нагревании 5 мл насышенного раствора аммония ацетата, фильтруют через беззольный фильтр, промывают 5 мл воды и доводят фильтрат водой до объема 100 мл 10 мл полученного раствора должны выдерживать испытание на тяжелые металлы (не более 0,001 %) (ГФ XI, вып. 1, с. 165). [c.149]
Роданиды применялись для обнаружения кобальта в солях никеля [302], в сталях электрографическим методом с использованием реактивной бумаги, пропитанной растворами роданида аммония, ацетата аммония и винной кислоты [875], в минералах и горных породах [194, 239] и др. [c.48]
Алюминия сульфат Алюмокалиевые квасцы Аммония нитрат Аммония роданид Аммония сульфат Аммошзя карбонат Аммония ацетат Аммония фторид Аммония гидрофосфат Аммония хлорид Аммония бихромат Аммония персульфат Бария нитрат Бария vльфaт Бария карбонат Бария ацетат Бария хлорид Висмута нитрат Висмута сульфат Железа (II) сульфат Железа (II) хлорид Кадмия оксид Кадмия сульфат Кадмия хлорид Калия боргидрид Калия нитрат Калня бихромат Калия гсксациапо-(II) феррат [c.20]
Одноосновные соединения, титрующиеся с тимоловым синим уксусная, бензойная, никотиновая, салициловая кислоты, нитрат аммония, ацетат аммония, п-нитрофенол, о-нитрофенол, 2,4-динитрофенол, 2-меркаптобензотиазол. [c.51]
Крашение белковых и полиамидных волокон чаще всего проводят в две стадии.
На первой стадии в кислой среде (добавка уксусной кислоты, сульфата аммония, ацетата аммония) волокно приобретает положительный заряд и анионы активных красителей подобно анионам кислотных красителей сорбируются ионизированными аминогруппами с образованием ионных связей (уравнение 10).
Краситель, перешедший на волокнистый материал, в дальнейшем образует с ним ковалентную связь. Эта реакция легче идет в нейтральной или слабощелочной среде, поэтому на второй стадии крашения в красильный раствор вводят щелочные реагенты. [c.107]
- Вольфрамат натрия, парамолибдат аммония, ацетат свинца (коэффициент комбинированного действия (Ккд) равен 1,6) [c.1098]
- Вольфрамат натрия, мышьяковистый ангидрид, парамолибдат аммония, ацетат свинца (Ккд равен 2,0) Вольфрамат натрия, германия диоксид, мышьяковистый ангидрид, парамолибдат аммония, ацетат свинца (Ккд равен 2,5) [c.1098]
- Этанонлат аммония (ацетат аммония, уксуснокислый аммоний) [c.413]
Для уменьшения (элиминирования) диффузионного потенциала между различными растворами электролитов помещают трубки, заполненные насыщенным раствором такого электролита, у которого подвижности и скорости диффузии аниона и катиона близки друг к другу.
Используют водные растворы хлоридов калия и аммония, нитратов калия и аммония, ацетата лития и неводные растворы K NS в С2Н5ОН, Nal в СН3ОН и др. Заполненные трубки называют электролитическими (солевыми) мостами.
На схемах знаком показывают включение электролитического моста, что означает Ед- О, а знак указывает, что на границе фаз д=т =0. [c.122]
Аммония ацетат Hз OONH4 4 300 г соли растворить в воде и разбавить до 1 л. [c.377]
А. Проводят испытание, как описано в разделе Тонкослойная хроматография (т. 1, с. 92), используя в качестве сорбента силикагель РЗ, а в качестве подвижной фазы — свежеприготовленный раствор аммония ацетата (40 г/л) ИР.
Наносят на пластинку отдельно по 1 мкл каждого из 2 растворов, содержащих (А) 20 мг испытуемого вещества в 1 мл и (Б) 20 мг стандартного образца неомицина В сульфата СО в 1 мл.
После извлечения пластинки из хроматографической камеры дают ей высохнуть на воздухе в течение 10 мин, нагревают 1 ч при 105 С, опрыскивают раствором трикетогидриндена в бутаноле ИР. Снова нагревают 5 мин при 105 С и оценивают хроматограмму при дневном свете.
Основное пятно, которое дает раствор А, соответствует по положению и внешнему виду пятну, которое дает раствор Б. [c.240]
АММОНИЯ АЦЕТАТ H3 OONH4, пл 114 С, разл> >114 С гигр. легко раств. в воде (148 г в 100 г при 4 °С), раств. в сн., плохо — в ацетоне. Получ. взаимод. ледяной уксусной к-ты с (NH4)2 03. Протрава при крашении шерсти, диуретич. лек. ср-во, компонент буферных р-ров. АММОНИЯ БЕНЗОАТ СеНХООКМ.,, крист. [c.42]
Аммония ацетат. H3 OONH4. 4 и. Растворяют 300 г соли и разбавляют водой до 1 л. [c.378]
Аммония ацетата раствор (80 г/л) ИР. Раствор ацетата аммония Р, содержащий 2H7NO2 около 77 г/л (приблизительно 1 моль/л). [c.191]
Аммония ацетата раствор (100 г/л) ИР. Раствор аммония ацетата Р, содержащий 100 г 2H7NO2 в 1 л. [c.386]
Аммония ацетата раствор (40 г/л) ИР. Раствор аммония ацетата Р, содержащий около 38,5 г 2H7NO2 в I л (приблизительно 0,5 моль/л). [c.386]
Аммония ацетат МН С2НР2 1 230 г соли растворить в литре воды [c.164]
Аммоний уксуснокислый. Аммония ацетат. H3 OONH4. М. м. 77,08. Бесцветные гигроскопичные кристаллы. ГОСТ 3117-78. [c.104]
Различная растворимость гидроокисей металлов позволяет осуществить гидролитическое отделение кобальта ог высоковалентных легкогидролизующихся ионов 1П аналитической группы, а именно, от ниобия, тантала, циркония, титана, железа, алюминия, галлия, индия, таллия, хрома, урана, бериллия, редкозе.мельных элементов. Применяется осаждение гидроокисью аммония, ацетатом, сукцинатом или бензоатом аммо- [c.60]
Осадители. В качестве осадителей для разделения н выделения отдельных компонентов анализируемых смесей применяют разнообразные химические соединения. Главнейшими из них являются сероводород, осаждающий в виде сульфидов ионы V, IV и частично III аналитических групп (см. Книга I, Качественный анализ, гл.
VI—VIII), а также разлагающий при опред еленных значениях pH анионы АзОз , АзО , VOз, М0О4 , 04 и др. (см. Книга I, Качественный анализ, гл. XII) водный раствор аммиака, осаждающий катионы бериллия, железа (III), алюминия, таллия, галлия, индия, ниобия, тантала, урана, редкоземельных металлов и др.
фосфаты щелочных металлов и аммония ацетат натрия едкие щелочи сульфид аммония и т. д. [c.354]
Источник: https://www.chem21.info/info/76030/




