Оксид углерода((II)), или угарный газ
Оксид углерода((II)) CO образуется при неполном сгорании топлива. Это бесцветный газ без запаха. Он плохо растворяется в воде ((2,3) см³ в (100) см³ при (20) °С). Оксид углерода((II)) очень ядовит. При вдыхании его молекулы связываются с гемоглобином крови и препятствуют переносу кислорода.
Оксид углерода((II)) относится к несолеобразующим оксидам. При обычных условиях он не реагирует с водой, кислотами и основаниями.
Является сильным восстановителем. Восстановительные свойства проявляет в реакциях с оксидами металлов и кислородом. Оксид углерода((II)) отнимает кислород от оксидов металлов. В результате реакции образуются металл и углекислый газ:
- Cu+2O+C+2O=tCu0+C+4O2.
- Оксид углерода((II)) горит на воздухе голубым пламенем:
- 2C+2O+O02=t2C+4O−22.
- В реакции выделяется большое количество тепла.
Оксид углерода((IV)), или углекислый газ
Оксид углерода((IV)) CO2 — бесцветный газ без запаха. Он примерно в (1,5) раза тяжелее воздуха.
Малорастворим в воде (при комнатной температуре в (1) объёме воды растворяется (0,88) объёма CO2).
При охлаждении и повышенном давлении углекислый газ превращается в твёрдое вещество — «сухой лёд», который способен возгоняться, т. е. из твёрдого состояния переходить сразу в газообразное.

Сухой лёд
Оксид углерода((IV)) — типичный кислотный оксид. Он взаимодействует с водой, основными оксидами и щелочами. В реакции с водой образуется неустойчивая угольная кислота:
- CO2+H2O⇄H2CO3.
- В реакциях с основными оксидами и щелочами образуются карбонаты:
- CO2+CaO=CaCO3,
- CO2+2NaOH=Na2CO3+H2O.
- При взаимодействии щёлочи с избытком углекислого газа образуются гидрокарбонаты:
- CO2+NaOH=NaHCO3.
- В углекислом газе степень окисления углерода максимальная, поэтому он может проявлять окислительные свойства. Так, магний горит в атмосфере углекислого газа:
- C+4O2+2Mg0=t2Mg+2O+C0.
- Получение:
- в лаборатории углекислый газ получают действием кислот на карбонаты:
CaCO3+2HCl=CaCl2+H2O+CO2↑.
- В промышленности для его получения используют обжиг известняка:
- CaCO3=tCaO+CO2↑.
- В природе углекислый газ образуется при дыхании и сгорании топлива, при гниении и тлении органических веществ, а поглощается растениями в процессе фотосинтеза.
- Угарный газ используется:
- в качестве топлива;
- как восстановитель в производстве чугуна;
- для получения метанола.
Углекислый газ применяется:
- в производстве газированных напитков;
- для тушения пожаров;
- для охлаждения пищевых продуктов («сухой лёд»).
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/uglerod-i-ego-soedineniia-163475/re-52f9e0f4-9ed8-407d-997b-52c7405cc5f9
Окисление углерода
 Самой распространенной полезной примесью в стали является углерод. Обычно он составляет не более 1,2 % от всей массы стали. Свойства углерода в твердом железе: он начинает образование пересыщенного раствора, а также занимает часть узлов кристаллической решетки железа, тем самым вызывая её деформацию. Благодаря этому железо приобретает повышенную прочность и твердость.
Самой распространенной полезной примесью в стали является углерод. Обычно он составляет не более 1,2 % от всей массы стали. Свойства углерода в твердом железе: он начинает образование пересыщенного раствора, а также занимает часть узлов кристаллической решетки железа, тем самым вызывая её деформацию. Благодаря этому железо приобретает повышенную прочность и твердость.
Влияет углерод и на окислительное рафинирование металлов (особенно четко это влияние прослеживается на примере чугуна). Все эти свойства углерода непосредственно связаны с его окислением:
1. В результате окисления углерода происходит выделение газообразных оксидов углерода (СО и СО2). Эти оксиды способствуют активному перемешиванию смеси металла и шлака, без которого не сможет пойти ни один сталеплавильный процесс. Также пузыри оксида углерода удаляют из жидкого металла газы и неметаллические включения;
2. В результате окислительного процесса (с использованием газообразного кислорода) выделяется огромное количество тепла, которое будет использовано для подогрева ванны; 3. Окислительно-восстановительная реакция углерода с оксидом железа ([C]+(FeO)=(CO)+[Fe]) будет способствовать дополнительной защите железа от окисления, что уменьшит потерю продукта при окислительном рафинировании; 4. Качество готового продукта (стали) напрямую зависит от уровня всевозможных неметаллических добавок (в том числе и оксидов). А данный уровень, в свою очередь, зависит от количества углерода и активности его окислительных процессов в металле.
Углерод в реакциях
В большинстве процессов плавления стали углерод (до 90 %) будет окисляться лишь до оксида углерода. Реакция окисления углерода до диоксида считается второстепенной (менее 15 % от всего объема оксидов).
Виды реакций окисления углерода, присутствующие в металлах:
1. [С] + 1/2О2 = {СО} – тепло выделяется; ΔG° = -152570 — 33,8 Т
2. [С] + (FeO) = [Fe] + {СО} – тепло поглощается; ΔG° = +85 373 — 83,8 Т 3. [С] + [О] = {СО} – тепло выделяется. ΔG° = -35 630 — 31 Т При составлении графика, показывающего взаимосвязь изменения ΔG° при изменении температуры, можно сделать вывод, что при увеличении температуры, ΔG° будет понижаться. То есть, рост температуры способствует окислению углерода. Вычислить константу равновесия третьей реакции можно по выражению:
Кр = Pco/(a[С]∙a[О]). Если концентрация углерода менее 1 %, а кислорода менее 0,08 %, то коэффициент активности каждого вещества можно принять за единицу. Тогда выражение примет следующий вид: Кр=Рсо/([С] ∙ [О]).
Значением теплового эффекта можно пренебрегать из-за сравнительно малой величины. Поэтому при любой температуре Рсо/([C] ∙ [О]) = const.
При окончании процесса плавления стали температура приблизительно равна 1600 °С для открытого агрегата (Рсо = 1000 г/см²), Кр можно принять равным 402, поэтому [C]∙[О]=Рсо/Кр=Рсо/402 = 0,0025*Рсо=0,0025.
Это будет означать, что, при данном типе условий, количество оставшегося углерода в металле будет зависеть лишь от уровня кислорода. Причем, чем выше будет уровень кислорода, тем меньше будет остаток углерода.
Исходя из теоретических данных, наивысшее содержание кислорода для температур при окончании процессов плавления стали составит около 0,19 – 0,26 %. Взяв среднюю величину [О] = 0,23 %, подставим её в получившееся равенство, получая Cmin = 0,01 %. То есть, тем самым доказывая невозможность получения 50 % оксида железа.
Именно из-за этого наивысшее содержание кислорода в металлах составляет порядка 0,13 %, а степень остаточного углерода не опускается ниже 0,02 %.
Однако и этот уровень углерода является недопустимым, поскольку он обеспечивает слишком сильное окисление железа (тем самым снижая выход продукта) и увеличение износа оборудования, что также плохо сказывается на производительности.
В настоящее время развивается изготовление стали с уровнем остаточного углерода 0,026 – 0,041 % (для открытых агрегатов, что позволяет предотвратить увеличение износа оборудования). Чтобы снизить этот процент до необходимых 0,02 % применяется обработка еще не застывшей стали с помощью вакуума и нейтрального газа. Для получения требуемой концентрации углерода в продукте применяются следующие идеи:
1. На протяжении всего процесса окислительного очищения поддерживается беспрерывный процесс окисления;
2. Для получения необходимого уровня углерода в продукте обязательно иметь требуемый объем углерода в начальной смеси (начальный объем превышает итоговый объем), использовать объем в период проведения процесса следует аккуратно; 3. Процесс плавки должен производиться с учетом того, чтобы начальный объем углерода расходовался лишь во временной промежуток, необходимый для проведения иных работ: нагрев, дефосфорация, десульфурация, удаление прочих побочных веществ.
- Как синхронизировать процесс нагревания и удаления углерода в металле?
- Δt[c] = Qt/(100∙C[м]+g[шл]∙C[шл]), где Qt соответствует тепловому эффекту окислительной реакции при заданных параметрах, кДж/кг; g[шл] — количество шлакового материала, кг/100кг металла; С — удельная теплоемкость металла и шлака, Дж/(кг К).
- Исходя из того, что C[м] = 0,84 кДж/(кг К) и С[шл]= 2,09 кДж/(кг К), а процент содержания шлаков не превышает 15 %, то формула принимает следующий вид:
- Δt[c] = 0,009∙Qt
- • холодного (кислородного, либо воздушного) дутья;
В процессе плавление особую значимость имеет не только процесс окисления углерода и получение его в требуемой концентрации, но и синхронизации этих процессов с процессом нагрева ванны. Если рассматривать идеальные условия (ванны не вступают в процессы теплообмена с окружающей средой, а единственный идущий процесс – окисление углерода), то сдвиг температуры ванн в процессе окисления углерода (Δt[c])будет определяться по следующему уравнению: Из этого можно сделать вывод: синхронизировать вышеупомянутые процессы возможно только путем изменения теплового эффекта окислительной реакции. Изменить величину и знак этого эффекта можно изменением источников кислорода. В основном на производстве используется кислород, получаемый из: • оксидов железа (твердые окислители: железная руда, агломерат, окатыши или окалина); • горячих печных газов. Первый и третий способы являются примером экзотермических процессов (тепло выделяется). Причем, с повышением температуры происходит увеличение теплового эффекта. Второй способ является примером эндотермического процесса (тепло поглощается).
В действительности Δt[c] может быть отлична от теоретически рассчитанных величин из-за ряда причин: теплообмена между ванной и окружающей средой (нагревается футеровка и окружающий воздух), протекания в ванне побочных процессов (они могут быть как экзотермическими, так и эндотермическими).
Источник: https://metallplace.ru/about/stati-o-chernoy-metalurgii/okislenie-ugleroda/
Углерод и его соединения
Углерод встречается в природе, как в свободном виде, так и в соединениях. В свободном виде встречается в виде аллотропных видоизменений – алмаз, графит, карбин, фуллерен.
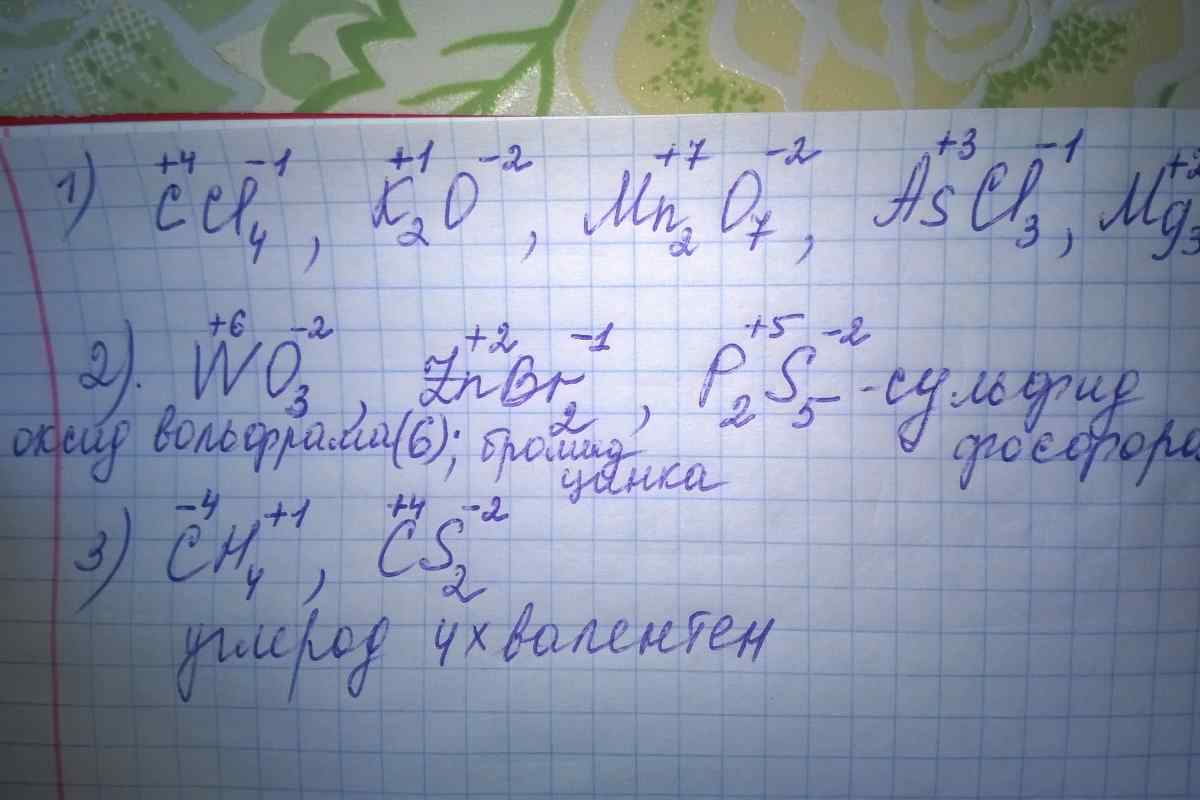
Алмаз
Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, ρ = 3,5 г/см3; t°пл. = 3730°C; t°кип. = 4830°C.
Можно получить из графита при p > 50 тыс. атм; t° = 1200°C.
- Применение:
- Шлифовальный порошок, буры, стеклорезы, после огранки — бриллианты.
- Графит
- Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток; ρ = 2,5 г/см3.
- Применение:
- Электроды, карандашные грифели, замедлитель нейтронов в ядерных реакторах, входит в состав некоторых смазочных материалов.
- Карбин
- Чёрный порошок; ρ = 2 г/см3; полупроводник.
- Состоит из линейных цепочек –C≡C–C≡C– и =С=С=С=С=.
- При нагревании переходит в графит.
В конце 80-х годов XX века было обнаружено ещё одно аллотропное видоизменение – фуллерит. Он, в отличие от алмаза и графита, имеет не атомную, а молекулярную кристаллическую решётку.
Атомы углерода могут образовывать также полые трубки – так называемые нанотрубки. В настоящее время фуллерены и нанотрубки рассматриваются в качестве основы для технологий будущего.
Соединения углерода весьма распространены: все живые организмы, каменный уголь, торф, нефть и др. содержат углерод. Углерод входит в состав многих неорганических веществ (известняк, мел, мрамор и др).
ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА
Углерод — малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
| С – восстановитель С0 – 4 е—→ С+4 или С0 – 2 е—→ С+2 |
С – окислитель С0 + 4 е—→ С-4 |
1) с кислородом
|
1) с некоторыми металлами образует карбиды
|
Оксид углерода(II) – СО
(угарный газ, окись углерода, монооксид углерода)
Физические свойства: бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
Источник: http://www.yoursystemeducation.com/uglerod-i-ego-soedineniya/
Степень окисления
Мы уже говорили, что термин валентность допустимо применять только к атомам, которые связаны с другими атомами ковалентными химическими связями. Так как по определению, валентность — это количество ковалентных связей конкретного атома.
Во многих школьных учебниках и пособиях учат составлять формулы по валентностям, даже для соединений с ионными связями. Для упрощения процедуры составления формул это, на наш взгляд, допустимо. Но нужно понимать, что это не совсем корректно ввиду вышеизложенной причины.
Более универсальным понятием является понятие о степени окисления. По значениям степеней окисления атомов так же как и по значениям валентности можно составлять химические формулы и записывать формульные единицы.
Отметим, что степень окисления и формальный заряд — совершенно разные понятия. Обстоятельно о формальном заряде и методах его рассчёта мы поговорим чуть позже, в последующих главах, а пока же можете поинтересоваться этим вопросом в литературных источниках.
Степень окисления — это условный заряд атома в частице (молекуле, ионе, радикале), вычисленный в приближении того, что все связи в частице являются ионными.
Прежде чем определять степени окисления, необходимо сравнить электроотрицательности связуемых атомов. Атом с большим значением электроотрицательности имеет отрицательную степень окисления, а с меньшим положительную.
Для определения значений электроотрицательностей можно пользоваться шкалой Полинга, но мы не рекомендуем это делать по ряду причин. Например, по шкале Полинга электроотрицательность хлора выше чем электроотрицательность азота.
Если бы это было так, то реакция гидролиза NCl3 протекала бы с образованием HNO2 и HCl (гидролиз — не окислительно восстановительный процесс). Известно, что при гидролизе NCl3 образуется NH3 и HClO (допустимо в качестве продукта указывать NH4ClO).
Из этого следует, что электроотрицательность азота выше, нежели чем электроотрицательность хлора.
С целью объективного сравнения значений электроотрицательности атомов при расчёте степеней окисления, в 2013 году IUPAC дал рекомендацию использовать шкалу Аллена.
- Так, например, по шкале Аллена электроотрицательность азота 3,066, а хлора 2,869.
Шкала значений электроотрицательности Аллена
Проиллюстрируем данное выше определение на примерах. Составим структурную формулу молекулы воды.
Ковалентные полярные связи O-H обозначены синим цветом.
Представим, что обе связи являются не ковалентными, а ионными. Если бы они были ионными, то с каждого атома водорода на более электроотрицательный атом кислорода перешло бы по одному электрону. Обозначим эти переходы синими стрелками.
*В этом примере, стрелка служит для наглядной иллюстрации полного перехода электронов, а не для иллюстрации индуктивного эффекта.
Легко заметить, что число стрелок показывает количество перешедших электронов, а их направление — направление перехода электронов.
На атом кислорода направлено две стрелки, это значит, что к атому кислорода переходит два электрона: 0 + (-2) = -2. На атоме кислорода образуется заряд равный -2. Это и есть степень окисления кислорода в молекуле воды.
С каждого атома водорода уходит по одному электрону: 0 — (-1) = +1. Значит, атомы водорода имеют степень окисления равную +1.
Сумма степеней окисления всегда равняется общему заряду частицы.
Например, сумма степеней окисления в молекуле воды равна: +1(2) + (-2) = 0. Молекула — электронейтральная частица.
Если мы вычисляем степени окисления в ионе, то сумма степеней окисления, соответственно, равна его заряду.
Значение степени окисления принято указывать в верхнем правом углу от символа элемента. Причём, знак пишут впереди числа. Если знак стоит после числа — то это заряд иона.
Теперь рассмотрим случай, когда соединение имеет смешанные связи: Na2SO4. Связь между сульфат-анионом и катионами натрия — ионная, связи между атомом серы и атомами кислорода в сульфат-ионе — ковалентные полярные. Запишем графическую формулу сульфата натрия, а стрелками укажем направление перехода электронов.
Структурная формула отображает порядок ковалентных связей в частице (молекуле, ионе, радикале). Структурные формулы применяют только для частиц с ковалентными связями. Для частиц с ионными связями понятие структурной формулы не имеет смысла. Если в частице имеются ионные связи, то применяют графическую формулу.
- Видим, что от центрального атома серы уходит шесть электронов, значит степень окисления серы 0 — (-6) = +6.
- Концевые атомы кислорода принимают по два электрона, значит их степени окисления 0 + (-2) = -2
- Мостиковые атомы кислорода принимают по два электрона, их степень окисления равна -2.
- В этой формуле мостиковые атомы кислорода уже имеют единичные отрицательные заряды и к ним дополнительно приходит по электрону от атома серы -1 + (-1) = -2, значит их степени окисления равны -2.
Определим степени окисления элементов в надпероксиде (супероксиде) калия. Для этого составим графическую формулу супероксида калия, стрелочкой покажем перераспределение электронов. Связь O-O является ковалентной неполярной, поэтому в ней перераспределение электронов не указывается.
Надпероксид-анион является ион-радикалом. Формальный заряд одного атома кислорода равен -1, а другого, с неспаренным электроном, 0.
Видим, что степень окисления калия равна +1. Степень окисления атома кислорода, записанного в формуле напротив калия, равна -1. Степень окисления второго атома кислорода равна 0.
Точно также можно определить степени окисления и по структурно-графической формуле.
В кружочках указаны формальные заряды иона калия и одного из атомов кислорода. При этом значения формальных зарядов совпадают со значениями степеней окисления.
- Так как оба атома кислорода в надпероксид-анионе имеют разные значения степени окисления, то можно вычислить средне-арифметическую степень окисления кислорода.
- Она будет равна [0 + (-1)] / 2 = — 1/2 = -0,5.
- Значения среднеарифметических степеней окисления обычно указывают в брутто-формулах или формульных единицах, чтобы показать что сумма степеней окисления равна общему заряду системы.
- Для случая с надпероксидом: +1 + 2(-0,5) = 0
Легко определить степени окисления используя электронно-точечные формулы, в которых указывают точками неподеленные электронные пары и электроны ковалентных связей.
Кислород — элемент VIА — группы, следовательно в его атоме 6 валентных электронов. Представим, что в молекуле воды связи ионные, в этом случае атом кислорода получил бы октет электронов.
Степень окисления кислорода соответственно равна: 6 — 8 = -2.
А атомов водорода: 1 — 0 = +1
Умение определять степени окисления по графическим формулам бесценно для понимания сущности этого понятия, так же это умение потребуется в курсе органической химии. Если же мы имеем дело с неорганическими веществами, то необходимо уметь определять степени окисления по молекулярным формулам и формульным единицам.
Для этого прежде всего нужно понять, что степени окисления бывают постоянными и переменными. Элементы, проявляющие постоянную степень окисления необходимо запомнить.
Любой химический элемент характеризуется высшей и низшей степенями окисления.
Низшая степень окисления — это заряд, который приобретает атом в результате приёма максимального количества электронов на внешний электронный слой.
Ввиду этого, низшая степень окисления имеет отрицательное значение.
Даже атомы металлов могут проявлять отрицательные значения ЭО, например железо в Na2[Fe(CO)4]. Связано это с тем, что степень окисления — условная величина.
Большинство неметаллов главных подгрупп старается заполнить свой внешний электронный слой до восьми электронов, после этого атом приобретает устойчивую конфигурацию (правило октета). Поэтому, чтобы определить низшую степень окисления, необходимо понять сколько атому не хватает валентных электронов до октета.
Например, азот — элемент VА группы, это значит, что в атоме азота пять валентных электронов. До октета атому азота не хватает трёх электронов. Значит низшая степень окисления азота равна: 0 + (-3) = -3
Высшая степень окисления — это заряд, который приобретает атом в результате отдачи максимального количества валентных электронов.
- По этой причине высшая степень окисления имеет положительное значение, за исключением фтора, атом которого электроны никогда и никому из атомов простых веществ не отдаёт, фтор — самый электроотрицательный элемент.
- Высшая степень окисления фтора равна 0.
- Чтобы определить высшую степень окисления, необходимо понять какое максимальное количество валентных электронов может отдать атом другим атомам.
- Например, в атоме азота пять валентных электронов, если все пять электронов атом азота отдаст другому, более электроотрицательному атому 0 — (-5), то он приобретет степень окисления равную +5.
Атом кислорода не может отдать все шесть валентных электронов, так как у кислорода высокое значение электроотрицательности. Кислород максимум может отдать два валентные электрона и то только атому фтора. По этой причине высшая степень окисления кислорода равна +2 в соединении OF 2 — фторид кислорода.
- Значение степени окисления часто не совпадает с валентностью.
- Формальный заряд при этом тоже может отличаться (он указывается в кружочках).
- Рекомендуем запомнить некоторые примеры, иллюстрирующие этот факт.
- В катионе аммония валентность азота равна IV, а степень окисления -3.
- В молекуле угарного газа (CO) валентность углерода и кислорода равна III, а степени окисления +2 и -2 (не удивляйтесь этому, даже если Вас учили, что кислород всегда двухвалентен, так как в современном понимании валентность — всего лишь число ковалентных связей атома).
- В катионе гидроксония атом кислорода трёхвалентен, а его степень окисления равна -2.
В молекуле азотной кислоты атом азота четырёхвалентен, а его степень окисления равна +5. При этом один из атомов кислорода I-валентен, но его степень окисления равна -2.
*Попробуйте для примера определить валентности и степени окисления атомов кислорода в молекуле озона, а также в синглетном и триплетном состояниях молекулы кислорода.
Источник: https://zen.yandex.ru/media/id/5d72342f394b2a00afea90b6/5d72355b3f548700ae6b38cd




