Аммиак – это летучее водородное соединение (нитрид водорода), которое играет ведущую роль в современной промышленности.
Хоть его и открыли лишь в восемнадцатом веке, но он был известен человеку с незапамятных времен. Водный раствор аммиака – это нашатырный спирт. Данное вещество содержится в продуктах разложения живых организмов и моче. Поэтому при распаде органики (останков растений, животных) выделяется аммиак, и от этого появляется резкий запах гниения (нашатыря).
История аммиака
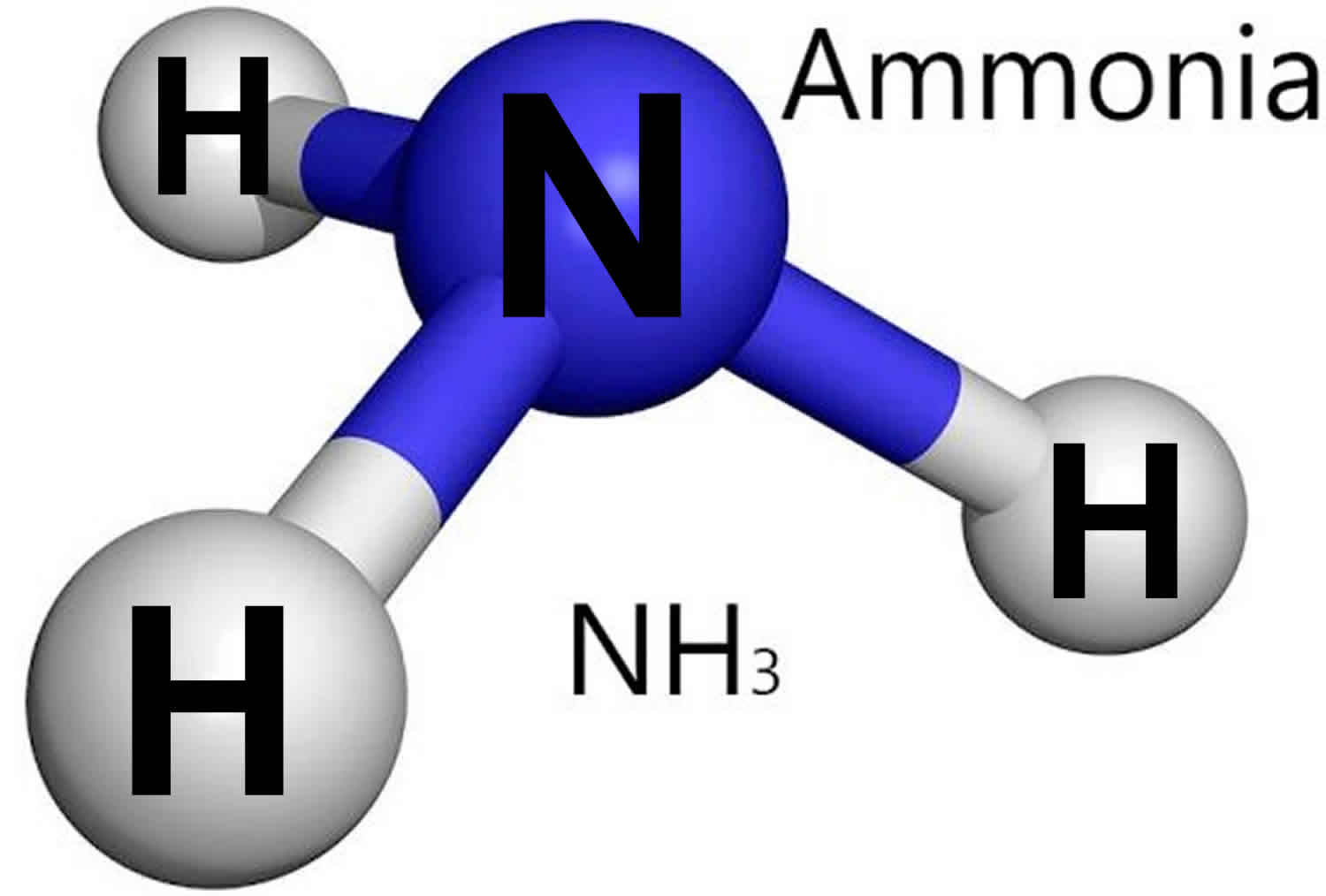
- Аммиак был открыт в конце восемнадцатого века британским химиком Джозефом Пристли – одним из основоположников современной химии, который совершил также множество важных открытий в других сферах науки (физике, биологии, оптике).
- Например, в списках его изобретений есть: газированная вода, за которую он получил медаль Лондонского Королевского общества, и всем известный ластик (раньше для стирания графита все пользовались хлебом).
- Нельзя отрицать того, что Джозеф Пристли сделал огромный вклад в химию, особенно в области газов, однако многие свои достижения он совершил случайно.
- Джозеф Пристли получил аммиак методом нагревания хлорида аммония (нашатырь) с гидроксидом кальция (гашеная известь) и затем собрал выделившийся газ в ртутной ванной.
Ртутная ванная – это специальный прибор, созданный Пристли для концентрирования газов. При комнатной температуре ртуть является жидкостью с высокой плотностью, что не позволяет ей абсорбировать газы. Их ученый легко выделял из веществ, нагревая над поверхностью ртути.
- Уравнение аммиака:
- 2NH4Cl + Ca(OH)2 = NH3 + CaCl2.
- После открытия Джозефом Пристли аммиака, его изучение не стояло на месте.
- В 1784 был установлен состав этого вещества химиком Луи Бертолле, который разложил его на исходные элементы электрическим разрядом.
- Именование «нашатырь» он получил уже в 1787 году от латинского названия нашатырной щелочи, а само наименование «аммиак», которым мы привыкли пользоваться, ввел Яков Дмитриевич Захаров в 1801 году.
Но вот что интересно. За сто лет до Джозефа Пристли и его открытия аммиака, ученый Роберт Бойль наблюдал некое явление, при котором палочка, предварительно смоченная в соляной кислоте, начинала дымить, когда ее подносили к газу, выделяющемуся при сжигании навоза.
Это объясняется тем, что кислота и аммиак вступали в реакцию, и в ее продуктах содержался хлорид аммония, частицы которого и создавали дым. Получается, что экспериментальными методами аммиак был выявлен давно, но его нахождение в мире было доказано намного позже.
Состав молекулы
Молекула аммиака (NH3) имеет форму тетраэдра с атомом азота в вершине. В ней находятся четыре электронных облака, которые перекрываются вдоль линии связи, следовательно, в молекуле содержатся исключительно сигма-связи.
По сравнению с водородом азот имеет большую электроотрицательность, поэтому общие электронные пары в молекуле смещены в его сторону.
И так как в аммиаке везде одинарные связи, то тип гибридизации – sp3, а угол между электронными облаками равен 109 градусам.
Способы получения
В мире ежегодно производится около 100 миллионов тонн аммиака, поэтому этот процесс можно по праву считать одним из важнейших в мире. Выпускают его в жидком виде или как двадцати пяти процентный раствор.
Существуют следующие способы его получения:
1. В промышленности аммиак добывают посредством синтеза азота и водорода, что сопровождается выделением тепла. Причем данная реакция может проходить лишь при высокой температуре, давлении и в присутствии катализатора, который, ускоряя слабую реакцию, сам в нее не вступает.
Уравнение реакции аммиака:
N2 + 3H2 ⇄ 2NH3 + Q
2. Можно получить аммиак во время коксования каменного угля.
На самом деле в угле нет никакого аммиака, но в нем присутствует много органических соединений, в составе которых содержатся азот и водород. А при сильном нагревании угля (пиролизе) эти составляющие и образуют аммиак, который выходит как побочный продукт.
- 3. В лаборатории аммиак добывают нагреванием хлорида аммония и гидроксида кальция:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
- 4. Или нагреванием хлорида аммония с концентрированной щелочью:
- NH4Cl + NaOH = NaCl + NH3↑ + H2O
Применение

Аммиак – это незаменимое и действительно нужное вещество, без которого мировая промышленность замедлила бы свое движение. Область его применения широка: он задействован во всех производственных процессах человека, начиная от заводов и лабораторий, заканчивая медициной. Его преимущества в том, что он экологически чист и является довольно дешевым продуктом.
Области применения аммиака:
- Химическая промышленность. Его используют в производстве удобрений, полимеров, азотной кислоты, взрывчатых веществ, в качестве растворителя (жидкий аммиак).
- Холодильные установки. Аммиак испаряется с поглощением большого количества тепла из окружающей среды, так как обладает определенными термодинамическими свойствами. Холодильные системы, основанные на его применении более чем эффективны, поэтому он является главным хладагентом в промышленности.
- Медицина. Нашатырный спирт или 10 % раствор аммиака используют при выведении из обморочного состояния (раздражение рецепторов слизистой оболочки носа способствует стимуляции дыхания), обработке рук хирурга, возбуждении рвоты и так далее.
- Текстильная промышленность. С его помощью получают синтетические волокна. Также аммиак используют при очистке или окрашивании различных тканей.
Физические свойства
Вот какие физические свойства присущи аммиаку:
- При нормальных условиях является газом.
- Бесцветный.
- Имеет резкий запах.
- Ядовит и очень токсичен.
- Очень хорошо растворим в воде (один объем воды на семьсот объемов аммиака) и ряде органических веществ.
- Температура плавления составляет -80 °С.
- Температура кипения – около -36 °С.
- Является взрывоопасным и горючим веществом.
- Примерно вдвое легче воздуха.
- Имеет молекулярную кристаллическую решетку, соответственно, он легкоплавкий и непрочный.
- Молярная масса аммиака равна 17 грамм/моль.
- При нагревании в кислородной среде разлагается на воду и азот.
Химические свойства аммиака

Аммиак является сильным восстановителем, так как степень окисления азота в молекуле минимальная. Он способен также к окислительным свойствам, что случается намного реже.
Реакции с аммиаком:
- С кислотами аммиак образует соли аммония, разлагающиеся при нагревании. С соляной кислотой аммиак составляет хлорид аммония, а с серной — сульфат аммония.
NH3 + HCL = NH4CL
NH3 + H2SO4 = (NH4)2SO4
- С кислородом при нагревании образуется азот, а при участии катализатора (Pt) получается оксид азота.
4NH3 + 5O2 = 4NO + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
- С водой образуется неустойчивый гидрат аммиака.
NH3 + H2O = NH3 × H2O
Аммиак способен проявлять щелочные свойства, поэтому при взаимодействии с водой он образует слабое основание – NH4OH. Но на самом деле такого соединения не существует, поэтому формулу следует записывать так: NH3 × H2O.
- 2NH3 + 3CuO = 3Cu + N2 + 3H2O
- 8NH3 + 3Cl2 =N2 + 6NH4Cl
- 3NH3 + ЗН2О + AlCl3 = Al(OH)3↓ + 3NH4Cl
Соединения аммиака
Есть несколько типов сложных веществ, образующихся при взаимодействии с аммиаком:
- Соли аммония. Они образуются в результате реакций аммиака с кислотами и разлагаются при нагревании.
- Амиды. Это соли, которые получают, действуя на щелочные металлы аммиаком.
- Гидразин. Это вещество, которое получают в результате окисления аммиака гипохлоритом натрия в присутствии желатина.
- Амины. Аммиак взаимодействует с галогеноалканами в качестве реакции присоединения, образуя соли.
- Аммиакаты. С серебром и солями меди аммиак образует комплексные соли.
Биологическая роль
Аммиак — вещество, образующееся в организмах живых существ при метаболизме, являющееся в них продуктом азотистого обмена. В физиологии животных для него отведена важная роль, однако он имеет высокую токсичность для организмов и почти не содержится в них в чистом виде. Большая его часть перерабатывается печенью в безвредное вещество – мочевину или как ее еще называют карбамид.
Также он способствует нейтрализации кислот поступающих в организм с пищей, поддерживая кислотно-щелочной баланс крови.
Аммиак – это важный источник азота для растений. Главным образом они поглощают его из почвы, но это очень трудоемкий и неэффективный процесс. Некоторые растения способны накапливать азот, который содержится в атмосфере, с помощью специальных ферментов – нитрогеназов. После чего они перерабатывают азот в полезные им соединения, например, белки и аминокислоты.
Агрегатные состояния

Аммиак может находиться в разных агрегатных состояниях:
- Он присутствует в виде бесцветного газа с неприятным резким запахом в нормальных условиях.
- Также он очень хорошо может растворяться в воде, поэтому его можно хранить в виде водного раствора с определенной концентрацией. Он сжижается и становится жидкостью в результате давления и сильного охлаждения.
- Аммиак имеет твердое состояние, в котором он предстает бесцветными кубическими кристаллами.
Отравление аммиаком

Как уже выше упоминалось, аммиак – это крайне токсичное и ядовитое вещество. Его относят к четвертому классу опасности.
Отравление этим газом сопровождается нарушением многих процессов организма:
- Сначала поражается нервная система и снижается усвоение кислорода нервными клетками.
- При проникновении в глотку, затем трахею и бронхи аммиак оседает на слизистых покровах, растворяется, образуя щелочь, которая начинает пагубно действовать на организм, вызывая внутренние ожоги, разрушая ткани и клетки.
- Это вещество также оказывает разрушающее воздействие на жировые компоненты, которые в том или ином виде входят в состав всех органов человека.
- Попадают под влияние сердечно-сосудистая и эндокринная система, нарушается их работа.
После контакта с аммиаком страдает почти весь организм человека, его внутренние ткани и органы, ухудшается процесс жизнедеятельности.
Чаще всего случаи отравления этим газом происходят на химических производствах в результате его утечки, но также можно им отравиться и в домашних условиях, например, если емкость, в которой содержится нашатырный спирт, неплотно закрыта, и его пары накапливаются в помещении.
Отравление может произойти, даже когда при обморочном состоянии человеку подносят к носу тампон, смоченный в нашатыре. Если пострадавшему дать понюхать его более пяти секунд, то высок риск интоксикации, так что с нашатырным спиртом всегда следует обращаться предельно осторожно.
Симптомы отравления
Ниже перечислен ряд признаков отравления аммиаком:
- Сильный кашель, затруднение дыхания.
- Жжение в глазах, слезоточивость, болевая реакция на яркий свет.
- Жжение в полости рта и носоглотке.
- Головокружение, головная боль.
- Боли в животе, рвота.
- Снижение слухового порога.
- При более серьезном отравлении возможны: потеря сознания, судороги, остановка дыхания, острая сердечная недостаточность. Совокупность нарушений может привести пострадавшего в коматозное состояние.
Профилактика при отравлении
Первая помощь в данном случае состоит из нескольких простых действий. Сначала необходимо вынести пострадавшего на свежий воздух, промыть ему лицо и глаза проточной водой. Даже те, кто был не очень хорош в химии, со школы знают: щелочь нейтрализуется кислотой, поэтому ротовую полость и нос нужно обязательно промыть водой с добавлением лимонного сока или уксуса.
Если отравившийся потерял сознание, следует уложить его на бок на случай рвоты, а при остановке пульса и дыхания сделать массаж сердца и искусственное дыхание.
Последствия отравления

После интоксикации аммиаком человека могут ждать очень серьезные необратимые последствия. В первую очередь страдает центральная нервная система, что влечет за собой целый ряд осложнений:
- Мозг перестает полностью выполнять свои функции и начинает давать сбои, из-за этого снижается интеллект, появляются психические заболевания, амнезия, нервные тики.
- Понижается чувствительность некоторых частей тела.
- Нарушается работа вестибулярного аппарата. Из-за этого человек ощущает постоянное головокружение.
- Органы слуха начинают терять свою работоспособность, что приводит к глухоте.
- При поражении глазных покровов снижается зрение и его острота, в худшем случае пострадавшего ждет слепота.
- Наступление летального исхода. Это зависит от того, насколько концентрация газа в воздухе была высокой и сколько паров аммиака попало в организм.
Знать и соблюдать предписанные меры безопасности — значит оградить себя от риска угрозы собственной жизни или худшей участи — инвалидности, потери слуха или зрения.
Источник: https://www.syl.ru/article/430916/ammiak—eto-nashatyirnyiy-spirt-formula-svoystva-i-primenenie-ammiaka
Аммиак, получение, свойства, химические реакции
![]()
![]()
![]()
![]()
- Аммиак, NH3 – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
- Аммиак, формула, газ, характеристики
- Аммиак, жидкость, твердое тело, характеристики
- Физические свойства аммиака
- Химические свойства аммиака
- Получение аммиака в промышленности и лаборатории
- Химические реакции – уравнения получения аммиака
- Применение и использование аммиака
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:

Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота.
Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,59. Таким образом, аммиак практически вдвое (в 1,7 раза) легче воздуха. Его можно собирать в перевернутые вверх дном сосуды.
Аммиак – это горючий газ. Пожаро- и взрывоопасен. В чистом кислороде аммиак сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Аммиак горит при наличии постоянного источника огня. Наличие масел и другого горючего увеличивает пожаровзрывоопасность этого вещества.
Аммиак образует с воздухом взрывоопасную смесь. Концентрационные пределы распространения пламени – 15,0-33,6 объемные доли, %; либо 107-240 г/м3. Наиболее легковоспламеняемая концентрация 24,5% (180 г/м3).
Хорошо растворим в воде как в газообразном, та и в жидком состоянии. Растворимость NH3 в воде чрезвычайно велика – около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. При растворении аммиака в воде выделяется значительное количество тепла.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/ammiak-poluchenie-svoystva-himicheskie-reaktsii/
Химические свойства аммиака | Дистанционные уроки
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков.

Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи
В больших количествах токсичен для человека.
Интересными химическими свойствами молекула аммиака обязана атому азота — p-элемент элемент 2-го периода V группы периодической системы имеет на внешнем энергетическом уровне 5 электронов.

На 3 ковалентных связи с водородом расходуются 3 электрона. 2 остаются. Эти 2 неспаренных электрона образуют неподеленную электронную пару.
Именно эта свободная неподеленная пара электронов определяет многие химические свойства аммиака.
- Образование иона аммония:
NH3 + H+ → NH4+ —
— у аммиака есть неподеленная электронная пара, а у иона водорода есть абсолютно свободная орбиталь;
- молекула аммиака полярна — отрицательный заряд двух электронов и положительный — от трех водородов, поэтому вещество хорошо растворимо в воде, более того, водный раствор аммиака — широко известный «нашатырный спирт» — жидкость с очень характерным запахом
Формулу такого раствора часто записывают вот в таком виде:
NH3 + H2O → NH3•H2O или NH4OH
NH4OH — гидроксид аммония. Т.к. азот притягивает к себе водород из воды, то по химическим свойствам аммиак — слабое основание, т.е. очень слабо диссоциирует на NH4+ (ион аммония) и OH— — гидроксид-ион.
- соответственно, водород «любит» все, что содержит водород, например, кислоты:
NH3 + HСl → NH4Cl — хлорид аммония
- к химическим свойствам аммиака относится и вытеснение металлов из водных растворов солей:
2NH3 + CuSO4 = (NH4)2SO4 + Cu
- к химическим свойствам аммиака относятся и реакции окисления:
2NH3 + 6KMnO4+ 6KOH → 6K2MnO4+N2 + 6H2O
(аммиак окисляется до азота)
В чистом кислороде он сгорает бледно-желтым пламенем:

- аммиак не восстанавливается, т.к. атом азота находится в низшей (№ группы-8) степени окисления;
Качественные реакции на аммиак:
- изменение окраски индикатора в водном растворе аммиака (щелочная среда):
- лакмус — становится синим,
фенолфталеин — малиновым, - метиловый-оранжевый — желтым;
- если к пробирке с раствором NH3 (NH3•H2O или NH4OH) поднести палочку, смоченную в концентрированной соляной кислоте HCl – будет выделяться видимый белый дым – образуется хлорид аммония (NH4Cl);

Свойства солей аммония:
- ионная кристаллическая решетка;
- в растворе диссоциируют:
NH4X → NH4+ + X—
- подвергаются гидролизу с образованием кислой среды:
гидролиз по катиону:
- NH4Сl + H2O → NH3 ↑+ H2O + HCl (кислая среда)
- гидролиз по катиону и аниону:
- (NH4)2СO3 + H2O → 2NH3 ↑+ 2H2O + СO2 ↑ (нейтральная среда)
- свойства солей аммония соответствуют свойствам всех других солей — взаимодействие с основаниями, другими солями и кислотами. Главные условия протекания таких реакций до конца — образование газа, осадка или малодиссоциирующего вещества;
- важное химическое свойство солей аммония — разложение при нагревании:

Последняя реакция — разложение бихромата аммония часто используется в заданиях С3 ЕГЭ по химии (химический эксперимент), так что стоит ее выучить.
Химические свойства аммиака обусловлены строением молекулы, т.е. электронной конфигурацией атома азота. Т.к. в заданиях ГИА и ЕГЭ уделяется много внимания как самому аммиаку, так и его соединениям, то эту тему надо знать хорошо.
Обсуждение: «Химические свойства аммиака»
(Правила комментирования)
Источник: https://distant-lessons.ru/ximicheskie-svojstva-ammiaka.html
Аммиак — урок. Химия, 8–9 класс
Формула аммиака — NH3. Степень окисления азота равна (–3). В молекуле три ковалентные полярные связи. У атома азота одна электронная пара остаётся неподелённой и играет важную роль в способности аммиака вступать в химические реакции.

Молекула аммиака имеет форму пирамиды, в вершине которой расположен атом азота, а в основании — три атома водорода.

Общие электронные пары в молекуле смещены к более электроотрицательному атому азота. Он заряжен отрицательно, а атомы водорода — положительно. Поэтому молекула полярна и представляет собой диполь. Благодаря высокой полярности молекулы аммиака способны образовывать водородные связи между собой и с молекулами воды. Образование водородных связей влияет на физические свойства вещества.
При обычных условиях аммиак представляет собой бесцветный газ с резким неприятным запахом. Он легче воздуха. Ядовит.
Аммиак очень хорошо растворяется в воде — при (20) °С в одном объёме воды может раствориться до (700) объёмов аммиака. Раствор с содержанием газа (25) % называется аммиачной водой, а (10)%-ный раствор используется в медицине как нашатырный спирт.

Аммиак легко сжижается при пониженной температуре или при повышенном давления. При испарении жидкого аммиака поглощается много тепла, что позволяет использовать его в холодильных установках.
1. Восстановительные свойства.
Степень окисления азота в аммиаке — (–3), поэтому в окислительно-восстановительных реакциях он выступает в роли сильного восстановителя.
Аммиак окисляется кислородом с образованием азота или оксида азота((II)). Результат реакции зависит от условий её протекания.
- При горении аммиака в чистом кислороде образуется азот:
- 4N−3H3+3O20=2N20+6H2O−2.
- Если реакция проводится с катализатором, то образуется оксид азота((II)):
- 4N−3H3+5O20=k4NO+2+6H2O−2.
2. Основные свойства.
Если в водный раствор аммиака добавить несколько капель фенолфталеина, то его окраска станет малиновой. Значит, раствор содержит гидроксид-ионы. Образование этих ионов происходит в результате реакции между водой и молекулами аммиака:
NH3+H2O⇄NH3⋅H2O⇄NH4++OH−.
Образующийся в реакции неустойчивый гидрат аммония частично диссоциирует на ионы аммония и гидроксид-ионы.
Аммиак реагирует с кислотами. При этом образуются соли аммония. Так, с соляной кислотой образуется хлорид аммония, а с серной — сульфат аммония:
- NH3+HCl=NH4Cl,
- 2NH3+H2SO4=(NH4)2SO4.
- В промышленности аммиак синтезируют из азота и водорода:
- N2+3H2⇄t,p,k2NH3.

- Производство аммиака
- Лабораторный способ получения — реакция между солью аммония и гидроксидом кальция:
- 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O.
В больших количествах аммиак применяется для производства азотной кислоты и минеральных удобрений, а также красителей и взрывчатых веществ. Используется в холодильных установках. Нашатырный спирт находит применение в медицине и в быту.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/azot-i-ego-soedineniia-161796/re-38361faf-ef50-48c1-81b8-a678e93fd08f
Физические и химические свойства аммиака
ОПРЕДЕЛЕНИЕ
Аммиак — нитрид водорода.
Формула ( mathrm{NH} 3 ). Молярная масса — 17 г / моль.
Физические свойства аммиака
Аммиак (( mathrm{NH} 3 )) представляет собой бесцветный газ с сильным запахом (запах «аммиака»), более легкий, чем воздух, растворимый в воде (один объем воды растворяется до 700 объемов аммиака). Концентрированный раствор аммиака содержит 25% (масса) аммиака и имеет плотность 0,91 г / см3.
Связи между атомами в молекуле аммиака являются ковалентными. Общий вид молекулы ( mathrm{AB3} ). Все валентные орбитали атома азота входят в гибридизацию, поэтому тип гибридизации молекулы аммиака равен ( mathrm{sp} 3 ). Аммиак имеет геометрическую структуру типа ( mathrm{AB3E} ) — тригональную пирамиду (рис.1).
Химические свойства аммиака
Химически аммиак довольно активен: он реагирует со многими веществами. Степень окисления азота в аммиаке «-3» минимальна, поэтому аммиак обладает только снижающими свойствами.
- Когда аммиак нагревается с галогенами, оксидами тяжелых металлов и кислородом, образуется азот:
- ( 2 mathrm{NH} 3+3 mathrm{Br} 2=mathrm{N} 2+6 mathrm{HBr} )
- ( 2 mathrm{NH} 3+3 mathrm{CuO}=3 mathrm{Cu}+mathrm{N} 2+3 mathrm{H} 2 mathrm{O} )
- ( 4 mathrm{NH} 3+3 mathrm{O} 2=2 mathrm{N} 2+6 mathrm{H} 2 mathrm{O} )
- В присутствии катализатора аммиак может быть окислен до оксида азота (II):
- ( 4 mathrm{NH} 3+5 mathrm{O} 2=4 mathrm{NO}+6 mathrm{H} 2 mathrm{O} )(катализатор представляет собой платину)
В отличие от водородных соединений неметаллов групп VI и VII аммиак не проявляет кислотных свойств. Однако атомы водорода в молекуле все еще могут быть замещены атомами металла. При полной замене водорода металлом происходит образование соединений, называемых нитридами, которые также могут быть получены прямым взаимодействием азота с металлом при высокой температуре.
- Основные свойства аммиака обусловлены наличием одиночной пары электронов у атома азота. Раствор аммиака в воде имеет щелочную среду:
- ( mathrm{NH} 3+mathrm{H} 2 mathrm{O} mapsto mathrm{NH} 4 mathrm{OH} leftrightarrow mathrm{NH} 4++mathrm{OH}- )
- Когда аммиак взаимодействует с кислотами, образуются соли аммония, которые разлагаются при нагревании:
- ( mathrm{NH} mathbf{Z}+mathrm{HCl}=mathrm{NH} 4 mathrm{Cl} )
- ( mathrm{NH} 4 mathrm{Cl}=mathrm{NH} 3+mathrm{HCl} )(при нагревании)
- Производство аммиака
- Выделяют промышленные и лабораторные методы производства аммиака. В лаборатории аммиак получается при действии щелочей на растворы солей аммония при нагревании:
- ( mathrm{NH} 4 mathrm{Cl}+mathrm{KOH}=mathrm{NHZ} uparrow+mathrm{KCl}+mathrm{H} 2 mathrm{O} )
- ( mathrm{NH} 4++mathrm{OH}-=mathrm{NH} 3 uparrow+mathrm{H} 2 mathrm{O} )
- Эта реакция является качественной на ионах аммония.
- Применение аммиака
Производство аммиака является одним из важнейших технологических процессов в мире. Ежегодно в мире производится около 100 миллионов тонн аммиака. Выделение аммиака осуществляется в жидкой форме или в виде 25% -ного водного раствора аммиачной воды.
Основными направлениями использования аммиака являются производство азотной кислоты (производство азотсодержащих минеральных удобрений), соли аммония, мочевина, гексамин, синтетические волокна (нейлон и нейлон).
Аммиак используется в качестве хладагента в промышленном холодильном оборудовании, как отбеливатель при чистке и окрашивании хлопка, шерсти и шелка.
- Примеры решения проблем
- ПРИМЕР 1
Какова масса и объем аммиака, который потребуется для производства 5 тонн нитрата аммония?
- Запишем уравнение для реакции получения нитрата аммония из аммиака и азотной кислоты:
- ( mathrm{NH} 3+mathrm{HNO} 3=mathrm{NH} 4 mathrm{NO} 3 )
- Согласно уравнению реакции количество вещества нитрата аммония составляет 1 моль-в (( mathrm{NH} 4 mathrm{NO} 3 )) = 1 моль. Затем масса нитрата аммония, рассчитанная по уравнению реакции:
- ( mathrm{m}(mathrm{NH} 4 mathrm{NO} 3)=mathrm{v}(mathrm{NH} 4 mathrm{NO} 3) imes mathrm{M}(mathrm{NH} 4 mathrm{NO} 3) );
- ( M(mathrm{NH} 4 mathrm{NO} 3)=1 imes 80=80 mathrm{T} )
- Согласно уравнению реакции, количество аммиака также составляет 1 моль-в (NH3) = 1 моль. Затем масса аммиака, рассчитанная по уравнению:
- ( (mathrm{NH} 3)=mathrm{v}(mathrm{NH} 3) imes mathrm{M}(mathrm{NH} 3) );
- ( (mathrm{NH} 3)=1 imes 17=17 )т
- Составьте пропорцию и найдите массу аммиака (практический):
- ( mathrm{x} ext { g } mathrm{NH} 3-,5 ,mathrm{t,} mathrm{NH} 4 mathrm{NO} 3 )
- ( 17 ext { T } mathrm{NH} 3-80; mathrm{T} ext { NH4NO } 3 )
- ( x=17 imes 5 / 80=1,06 )
- ( (mathrm{NH} 3)=1,06 mathrm{Т} )
- Аналогичная пропорция будет способствовать обнаружению объема аммиака:
- ( 1,06; mathrm{г}; mathrm{NH} 3-mathrm{x} 1 mathrm{NH} 3 )
- ( 17 ; ext { T } mathrm{NH} 3-22,4 imes 103; mathrm{m3}; mathrm{NH} 3 )
- ( x=22,4 imes 103 imes 1,06 / 17=1,4 imes 103 )
- ( V;(N H 3)=1,4 imes 103; m; 3 )
- Аммиачная масса — 1,06 т, объем аммиака — 1,4 × 103 м3
- ПРИМЕР 2
- Промышленный метод получения аммиака соответствует реакции:
- A) ( mathrm{NH} 40 mathrm{H}=mathrm{NH} 3 quad uparrow+mathrm{H} 20 )
- Б) ( mathrm{NH} 4 mathrm{Cl}=mathrm{NH} 3 uparrow+mathrm{HCl} uparrow )
- B) ( mathrm{N} 2;+3; mathrm{H} 2 ext { & bull; } 2 mathrm{NH} 3 )
- Г)( mathrm{NH}_{4} mathrm{Cl}+mathrm{NaOH}=mathrm{NH}_{3} uparrow+mathrm{H}_{2} mathrm{O}+mathrm{NaCl} )
Реакция «в» соответствует промышленному методу получения аммиака
Источник: https://sciterm.ru/spravochnik/fizicheskie-i-himicheskie-svojstva-ammiaka/
Аммиак
Продажа
Производство
Доставкатехнический марка Атехнический марка Ак
Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит.
Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине.
Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуяион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость.
Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами.
Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Твёрдый аммиак — бесцветные кубические кристаллы.
Химические свойства
- Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как нуклеофил или комплексообразователь. Так, он присоединяет протон, образуя ион аммония:
NH3 + H+ → NH4+
- Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
NH3 + H2O → NH4+ + OH−; Ko=1,8×10−5
- Взаимодействуя с кислотами даёт соответствующие соли аммония:
NH3 + HNO3 → NH4NO3
- Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
2NH3 + 2К = 2KNH2 + Н2
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН− и NH2−, а также молекулы Н2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
NaNH2 + H2O → NaOH + NH3CaNH + 2H2O → Ca(OH)2 + NH3↑Zn3N2 + 6H2O → 3Zn(OH)2 + 2NH3↑
и в спиртах:
KNH2 + C2H5OH → C2H5OK + NH3
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
MNH2 → M+ + NH2−
Фенолфталеин в этих растворах окрашивается в красный цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
- При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
4NH3 + 3O2 → 2N2 + 6H204NH3 + 5O2 → 4NO + 6H2O
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
3CuO + 2NH4Cl → 3Cu + 3H2O +2HCl + N2
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
2NH3 + NaClO → N2H4 + NaCl + H2O
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
NH3 + CH3Cl → CH3NH3Cl (гидрохлорид метиламмония)
- С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов(восстановительное аминирование).
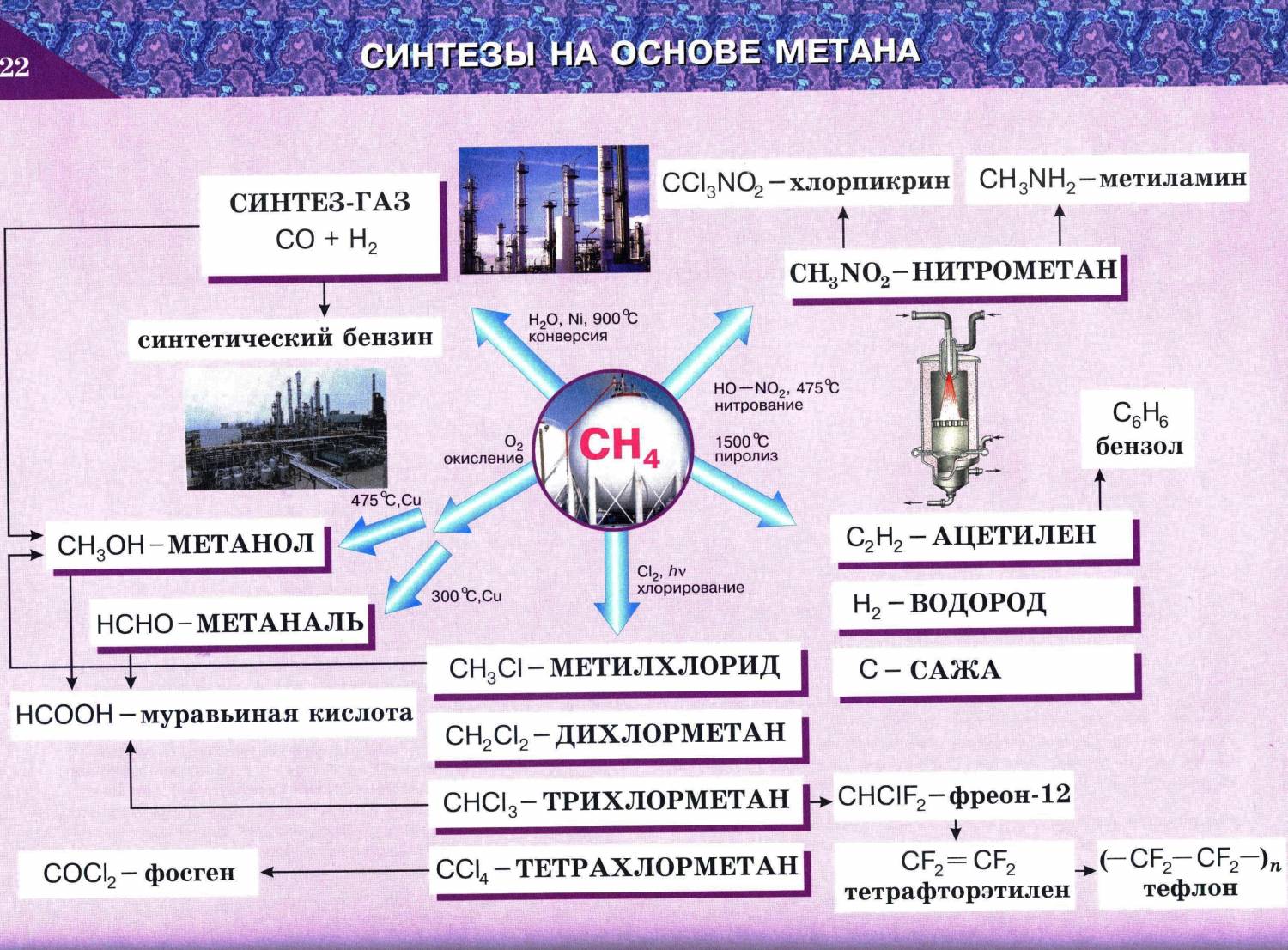
- При 1000 °C аммиак реагирует с углём, образуя HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
CH4 + NH3 + 1,5O2 → HCN + 3H2O
История названия
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей.
В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского словаамониан.
Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы, в чём проявлется его сходство с водой:
2NH3 → NH4+ + NH2−
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворенный в NH3 металл постепенно реагирует с образованием амида:
2Na + 2NH3 → 2NaNH2 + H2
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам, молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металловприводит к образованию их аминокомплексов:
CuSO4 + 4NH3 → [Cu(NH3)4]SO4Ni(NO3)2 + 6NH3 → [Ni(NH2)6](NO3)2
Комплексообразование обычно сопровождается изменением окраски раствора, так в первой реакции голубой цвет (CuSO4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений.
Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину).
Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название «восстановительное аминирование». Таким образом из щавелевоуксусной кислоты получается аспарагиновая, из α-кетоглутаровой — глутаминовая и т. д.
Физиологическое действие
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени.
Запах аммиака ощущается при концентрации 37 мг/м³.
Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения составляет 20 мг/м³. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно.
Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м³ — эритематозный, 21 г/м³ и более — буллёзныйдерматит.
Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов.
Предельно допустимая концентрация аммиака в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м³; максимальная разовая 0,2 мг/м³.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области .
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн.
В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717)
В медицине 10% раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусы насекомых, обработка рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5–1 с).
Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку является слабым основанием при взаимодействии нейтрализует кислоты.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Получение
- Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
- N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
- Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо.
Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит и больших капиталовложений.
Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %.
В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза.
Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
- Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
- NH4Cl + NaOH = NH3↑ + NaCl + H2O.
- Обычно лабораторным способом получают получают слабым нагреванием смеси хлорида аммония с гашеной известью. 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
- Для осушения аммиака его пропускают через смесь извести с едким натром.
Очень сухой аммиак можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. Система должна выдерживать высокое давление(при комнатной температуре давление насыщенных паров аммиака около 10 атмосфер)[2]. В промышленности аммиак осушают в абсорбционных колоннах.
Аммиак в медицине
При укусах насекомых аммиак применяют наружно в виде примочек. Возможны побочные действия: при продолжительной экспозиции (ингаляционное применение) аммиак может вызвать рефлекторную остановку дыхания.
Местное применение противопоказано при дерматитах, экземах, других кожных заболеваниях, а также при открытых травматических повреждениях кожных покровов. При ингаляционном применении — рефлекторная остановка дыхания, при местном применении — раздражения, дерматиты, экземы в месте аппликации. Местное применение возможно только на неповрежденную кожу.
При случайном поражении слизистой оболочки глаза промыть водой (по 15 мин через каждые 10 мин) или 5 % раствором борной кислоты. Масла и мази не применяют. При поражении носа и глотки — 0,5 % раствор лимонной кислоты или натуральные соки.
В случае приема внутрь пить воду, фруктовый сок, молоко, лучше — 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка. Взаимодействие с другими лекарственными средствами неизвестно. (Инструкция по применению)
Источник: https://tgko.ru/spravka/gaz/ammiak
Физические и химические свойства аммиака
Билет № 24
1. Аммиак: состав молекулы, химическая связь в молекуле. Физические и химические свойства аммиака
Молекулярная формула аммиака NH3. Три атома водорода соединены с азотом ковалентными полярными связями (азот более электроотрицателен). В образовании связей принимают участие три неспаренных электрона азота и по одному электрону водорода. Структурная формула:
H – N – H
|
H
Молекула аммиака имеет форму треугольной пирамиды, в вершинах которой находятся атомы азота и водорода.Угол между связями N–H около 107°
Аммиак — бесцветный газ с характерным резким запахом. Легче воздуха, его можно собирать в перевернутые вверх дном сосуды.
Аммиак хорошо растворяется в воде (в 1 литре воды при комнатной температуре растворяется около 700 литров аммиака). При повышенном давлении аммиак легко переходит в жидкое состояние.
При последующем испарении поглощается много тепла, поэтому его используют в качестве хладагента в холодильных установках.
Аммиак химически активен.
Наличие у атома азота неподелённой электронной пары, не участвующей в образовании связей, делает возможным присоединение протона и образования еще одной, донорно-акцепторной связи, обозначаемой стрелкой:
H
l
[H – N → H ]+
l
H
- Ион аммония образуется, например, при растворении аммиака в воде:
- NH3 + H2O NH4+ + OH−
- Поэтому раствор аммиака обладает щелочными свойствами и окрашивает индикатор фенолфталеин в малиновый цвет.
- Аммиак взаимодействует с кислотами. Если близко поднести стеклянные палочки, смоченные концентрированным раствором аммиака и концентрированной соляной кислотой, образуется «дым» из кристалликов хлорида аммония:
- NH3 + HCl = NH4Cl
- Аммиак горит в кислороде с образованием молекулярного азота:
- 4NH3 + 3O2 = 2N2 + 6H2O
- В присутствии платины в качестве катализатора, азот аммиака окисляется до оксида азота (II):
- 4NH3 + 5O2 = 4NO + 6H2O
Эта реакция используется в производстве азотной кислоты и азотных удобрений. 10%-ный раствор аммиака в воде используется в медицине под названием «нашатырный спирт».
При нагревании аммиак разлагается (реакция обратная синтезу):
2NH3 N2 + 3H2
2. Опыт. Распознавание раствора соли серной кислоты среди трех предложенных растворов солей
- Для распознавания соли серной кислоты капаем в каждую пробирку раствор хлорида бария.
Там, где находится сульфат, выпадет белый кристаллический осадок, нерастворимый в концентрированной азотной кислоте:
- Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
- или в ионном виде:
- Ba2+ + SO42−= BaSO4↓
- Если среди растворов будет карбонат (тоже выпадает в осадок с Ba2+):
- Делим каждый раствор на две порции и капаем в первую тройку соляную кислоту. В пробирке с карбонатом выделится газ.
- Оставшиеся два раствора испытываем на сульфат.
автор: Владимир Соколов
Источник: https://staminaon.com/ru/chemistry/chemistry_9-24.htm




