![]()
![]()
![]()
![]()
Ar 18 Аргон
39,948(1) 1s2 2s2 2p6 3s2 3p6
Аргон — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 18. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), третьем периоде периодической системы.
Атом и молекула аргона. Формула аргона. Строение аргона
- Изотопы и модификации аргона
- Свойства аргона (таблица): температура, плотность, давление и пр.
- Физические свойства аргона
Химические свойства аргона. Взаимодействие аргона. Реакции с аргоном
Получение аргона
Применение аргона
Таблица химических элементов Д.И. Менделеева
Атом и молекула аргона. Формула аргона. Строение аргона:
Аргон (лат. Argon, от др.-греч. ἀργός – «ленивый, медленный, неактивный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ar и атомным номером 18. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), третьем периоде периодической системы.
Аргон самый лёгкий элемент периодической таблицы химических элементов Д. И. Менделеева из группы пниктогенов.
Аргон – химически инертный неметалл. Химически малоактивен.
- Как простое вещество аргон (химическая формула Ar) при нормальных условиях представляет собой одноатомный газ без цвета, вкуса и запаха.
- Молекула аргона одноатомна.
- Химическая формула аргона Ar.
Электронная конфигурация атома аргона 1s2 2s2 2p6 3s2 3p6. Потенциал ионизации атома аргона равен 15,76 эВ (1519,6 кДж/моль).
Строение атома аргона. Атом аргона состоит из положительно заряженного ядра (+18), вокруг которого по трем атомным оболочкам движутся 18 электронов. При этом 10 электронов находятся на внутреннем уровне, а 8 электронов – на внешнем. Поскольку аргон расположен в третьем периоде, оболочки всего три.
Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. Внешний энергетический уровень атома аргона полностью завершен – 8 спаренных электронов. Поэтому аргон химически малоактивен.
В свою очередь ядро атома аргона состоит из 18 протонов и 22 нейтронов.
Радиус атома аргона составляет 71 пм.
Атомная масса атома аргона составляет 39,948(1) а. е. м.
Аргон – третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объёму и 1,288 % по массе. Аргон – самый распространённый инертный газ в земной атмосфере.
Изотопы и модификации аргона:
Свойства аргона (таблица): температура, плотность, давление и пр
| Общие сведения | |
| Название | Аргон/ Argon |
| Символ | Ar |
| Номер в таблице | 18 |
| Тип | Неметалл |
| Открыт | Уильям Рамзай, Джон Уильям Стретт (лорд Рэлей), Англия, 1894 г. |
| Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха. |
| Содержание в земной коре | 0,00015 % |
| Содержание в океане | 0,000045 % |
| Свойства атома | |
| Атомная масса (молярная масса) | 39,948(1) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 |
| Радиус атома | 71 пм |
| Химические свойства | |
| Степени окисления | |
| Валентность | |
| Ковалентный радиус | 106 пм |
| Радиус Ван-дер-Ваальса | |
| Радиус иона | 154 пм |
| Электроотрицательность | 4,3 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 1519,6 кДж/моль (15,76 эВ) |
| Электродный потенциал | |
| Физические свойства | |
| Плотность (при +20 °C и нормальных условиях, состояние вещества – газ) | 0,0017839 г/см3 |
| Плотность (при -185,7 °C и нормальных условиях, состояние вещества – жидкость) | 0,402 г/см3 |
| Плотность (при -233 °C и нормальных условиях, состояние вещества – твердое тело) | 1,65 г/см3 |
| Температура плавления | -189,35 °C (83,8 К) |
| Температура кипения | -185,85 °C (87,3 К) |
| Уд. теплота плавления | 7,05 кДж/моль |
| Уд. теплота испарения | 6,45 кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Молярный объём | 24,2 см³/моль |
| Критическая температура | -122,5 °C |
| Критическое давление | 4,86 МПа |
| Критическая плотность | 0,531 г/см3 |
| Давление паров | 1 мм.рт.ст. (при -219,5°C), 10 мм.рт.ст. (при -211,3°C), 100 мм.рт.ст. (при -200,1°C) |
| Стандартная энтальпия образования ΔH (при 298 К, для состояния вещества – газ) | 0 кДж/моль |
| Стандартная энергия Гиббса образования ΔG (при 298 К, для состояния вещества – газ) | 0 кДж/моль |
| Стандартная энтропия вещества S (при 298 К, для состояния вещества – газ) | 154,7 Дж/(моль·K) |
| Теплопроводность (при 300 K) | 0,0164 Вт/(м·К) |
| Диэлектрическая проницаемость | 1,000504 (при 25°C), 1,3247 (при -133,2°C) |
| Электропроводность в твердой фазе | |
| Сверхпроводимость при температуре | |
| Твёрдость | |
| Структура решётки | кубическая гранецентрированная |
| Параметры решётки | 5,260 Å |
| Температура Дебая | 85 К |
Физические свойства аргона:
Химические свойства аргона. Взаимодействие аргона. Реакции с аргоном:
Получение аргона:
Применение аргона:
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com
-




- карта сайта
- аргон атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле аргона
сколько электронов в атоме свойства металлические неметаллические термодинамические
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/argon-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Газ аргон – химические свойства и сфера применения
В переводе с греческого «argon» означает «медленный» или «неактивный». Такое определение газ аргон получил благодаря своим инертным свойствам, позволяющим широко его использовать во многих промышленных и бытовых целях.
Химический элемент Ar
Ar – 18-й элемент периодической таблицы Менделеева, относящийся к благородным инертным газам. Данное вещество является третьим после N (азота) и O (кислорода) по содержанию в атмосфере Земли. В обычных условиях – бесцветен, не горюч, не ядовит, без вкуса и запаха.
Другие свойства газа аргона:
- атомная масса: 39,95;
- содержание в воздухе: 0,9% объема и 1,3% массы;
- плотность в нормальных условиях: 1,78 кг/м³;
- температура кипения: -186°С.

На рисунке название химического элемента и его свойства
Данный элемент был открыт Джоном Стреттом и Уильямом Рамзаем при исследовании состава воздуха. Несовпадение плотности при различных химических испытаниях натолкнуло ученых на мысль, что в атмосфере помимо азота и кислорода присутствует инертный тяжелый газ. В итоге в 1894 г. было сделано заявление об открытии химического элемента, доля которого в каждом кубометре воздуха составляет 15 г.
Как добывают аргон
Ar не поддается изменениям в процессе его использования и всегда возвращается в атмосферу. Поэтому ученые считают данный источник неисчерпаемым. Он добывается как сопутствующий продукт при разделении воздуха на кислород и азот посредством низкотемпературной ректификации.
Для реализации этого метода применяются специальные воздухоразделительные аппараты, состоящие из колонн высокого, низкого давления и конденсатора-испарителя.
В результате процесса ректификации (разделения) получается аргон с небольшими примесями (3-10%) азота и кислорода. Чтобы произвести очистку, примеси убираются с помощью дополнительных химических реакций.
Современные технологии позволяют достичь 99,99% чистоты данного продукта.

Представлены установки по производству данного химического элемента
Хранится и транспортируется газ аргон в стальных баллонах (ГОСТ 949-73), которые имеют серый окрас с полосой и соответствующей надписью зеленого цвета.
При этом процесс наполнения емкости должен полностью соответствовать технологическим нормам и правилам безопасности.
Детальную информацию о специфике заполнения газовых баллонов можно прочитать в статье: баллоны со сварочной смесью – технические особенности и правила эксплуатации.
Где применяется газ аргон
Данный элемент имеет достаточно большую сферу применения. Ниже приведены основные области его использования:
- заполнение внутренней полости ламп накаливания и стеклопакетов;
- вытеснение влаги и кислорода для долгого хранения пищевых продуктов;
- огнетушащее вещество в некоторых системах тушения пожара;
- защитная среда при сварочном процессе;
- плазмообразующий газ для плазменной сварки и резки.
В сварочном производстве он применяется как защитная среда в процессе сварки редких металлов (ниобия, титана, циркония) и их сплавов, легированный сталей разных марок, а также алюминиевых, магниевых и хромоникелевых сплавов. Для черных металлов, как правило, применяют смесь Ar с другими газами – гелием, кислородом, углекислотой и водородом.

Вид защитной среды при сварочном процессе, которую создает аргон
Являясь тяжелее воздуха, аргоновая струя надежно защищает металл во время сварки. Инертный газ на протяжении длительного времени является защитой для расплавленной и нагретой металлической поверхности. Больше о сварочном процессе с применением аргоновой защитной среды читайте в статье: сварка аргоном – технология и режимы работы оборудования.
Меры предосторожности при эксплуатации
Данный химический элемент не представляет абсолютно никакой опасности для окружающей среды, но при большой концентрации оказывает удушающее воздействие на человека.
Он нередко скапливается в районе пола в недостаточно проветриваемых помещениях, а при значительном уменьшении содержание кислорода может привести к потере сознания и даже смертельному исходу.
Поэтому важно следить за концентрацией кислорода в закрытом помещении, которая не должна падать ниже 19%.
Еще мы советуем посмотреть третью часть обучения сварке в защитной среде аргона:
Жидкий Ar способен вызвать обморожение участков кожи и повредить слизистую оболочку глаз, поэтому в процессе работы важно использовать спецодежду и защитные очки. При работе в атмосфере этого газа с целью предотвращения удушения необходимо применять изолирующий кислородный прибор или шланговый противогаз.
Заправить баллоны аргоном можно в компании «Промтехгаз», где соблюдается правильная технология заправки и предоставляется качественное обслуживание.
Если вы интересуетесь другими техническими газами, информацию можете найти здесь.
Источник: http://xn--80affkvlgiu5a.xn--p1ai/gaz-argon-himicheskie-svojstva/
Аргон Ar
Аргон в таблице менделеева занимает 18 место, в 3 периоде.
| Символ | Ar |
| Номер | 18 |
| Атомный вес | 39.9480000 |
| Латинское название | Argon |
| Русское название | Аргон |
Как самостоятельно построить электронную конфигурацию? Ответ здесь Ar: 1s2 2s2 2p6 3s2 3p6 Короткая запись:
Ar: [Ar]
- Одинаковую электронную конфигурацию имеют атом аргона и Si-4, P-3, S-2, Cl-1, K+1, Ca+2, Sc+3, Ti+4, V+5, Mn+7
- Порядок заполнения оболочек атома аргона (Ar) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
- На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
- Аргон имеет 18 электронов, заполним электронные оболочки в описанном выше порядке:
- 2 электрона на 1s-подуровне
- 2 электрона на 2s-подуровне
- 6 электронов на 2p-подуровне
- 2 электрона на 3s-подуровне
- 6 электронов на 3p-подуровне
Степень окисления аргона
Атомы аргона в соединениях имеют степени окисления 0.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы аргона
Валентность Ar
Атомы аргона в соединениях проявляют валентность .
Валентность аргона характеризует способность атома Ar к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ar
Квантовые числа определяются последним электроном в конфигурации, для атома Ar эти числа имеют значение N = 3, L = 1, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif): 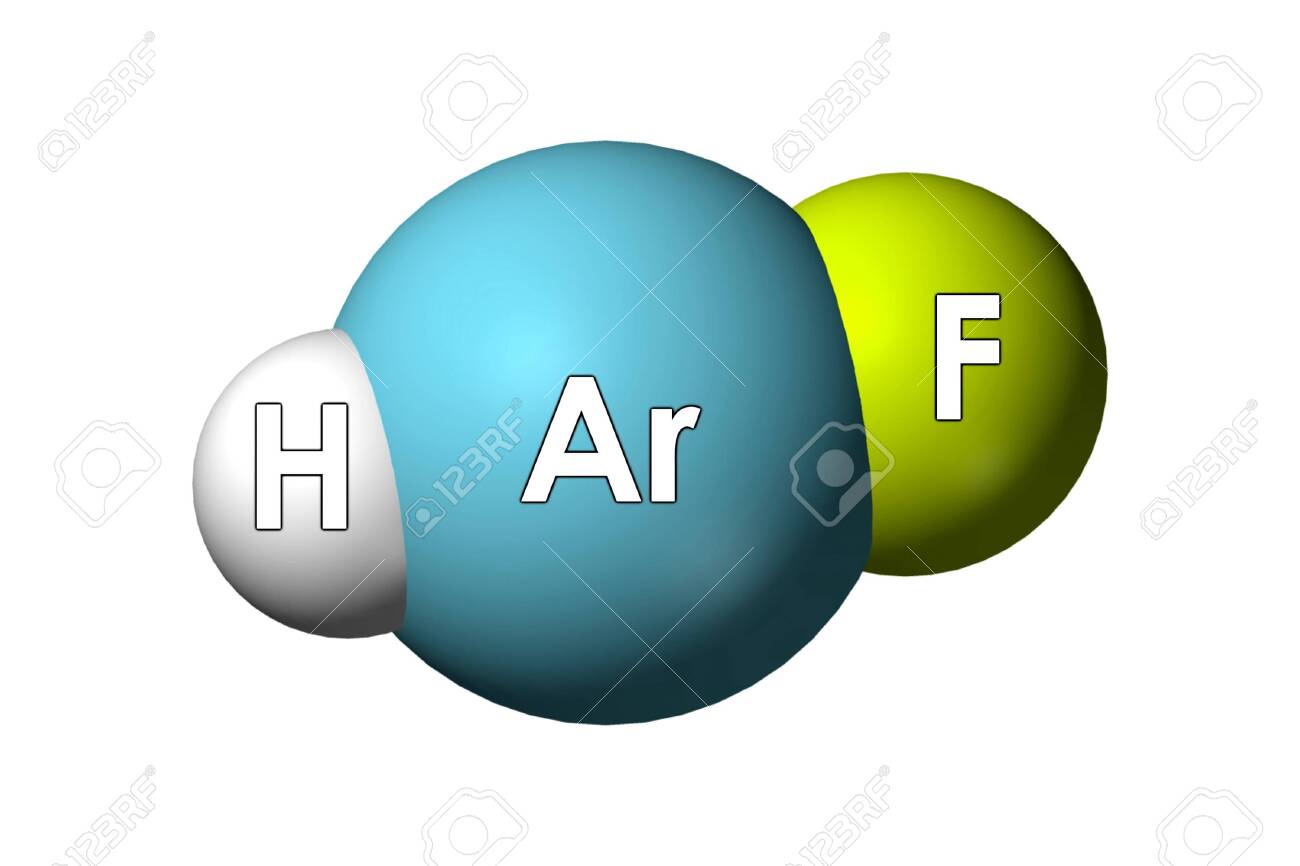

Источник: https://k-tree.ru/tools/chemistry/periodic.php?element=Ar
Технические характеристики и применение аргона
Инертные газы практически не вступают в реакцию с другими веществами, поэтому их нельзя использовать, например, для отопления жилища или производства химических соединений. Несмотря на свой «асоциальный характер» такие элементы получили очень большое распространение в промышленности, благодаря наличию очень интересных физических свойств. Газ аргон относится именно к таким элементам.
Об основных качествах аргона, а также о сферах его применения будет подробно рассказано в этой статье.
Аргон: технические характеристики
Аргон представляет собой бесцветный газ, который не оказывает никакого действия на органы вкуса и обоняния. Этот одноатомный элемент является одним из самых распространённых инертных газообразных веществ на земле.
Аргон был открыт в конце XIX века британским учёным Джоном Стреттом. Исследователь проводил опыты по выделению азота из воздуха.
В результате экспериментов было выяснено, что азот полученный таким образом имеет немного большую плотность, чем в случае, когда для получения этого газа использовались органические вещества.
Учёный предположил, что азот из атмосферы содержит примесь неизвестного на тот момент газообразного вещества. Впоследствии, эти догадки были подтверждены, и аргон был получен в чистом виде и тщательно исследован.

Несмотря на отсутствие соединений аргон, как и другие вещества, обладает физическими свойствами. К наиболее важным характеристикам газа относятся:
- Плотность: 1,784 кг/м3.
- Температура кипения: -185,8 ˚С.
- Тройная точка: -189,8˚С.
- Содержание в воздухе: 0,9% объёма.
Аргон практически не растворяется в воде, а также абсолютно безопасен в плане пожарной активности. Этот газ не ядовит, поэтому при работе с ним не требуется использовать каких-либо средств защиты.
Где применяется аргон
Аргон получил большое распространение в промышленности. Инертные свойства этого газа особенно востребованы в различных производственных процессах, где необходимо вытеснить один из самых активных элементов – кислород.
Использование аргона очень дёшево, в сравнении с другими инертными летучими веществами, поэтому газ незаменим в том случае, когда требуется защитная среда при сваривании металлов, а также вытеснение влаги и кислорода в ёмкостях, где хранятся пищевые продукты.
Наполнение колб ламп накаливания инертным газом, позволяет значительно увеличить ресурс работы осветительного прибора. Кроме повышенного срока использования такие элементы обладают большей яркостью. Используется инертный газ и при производстве люминесцентных ламп. Применение аргона позволяет облегчить запуск разряда электрической дуги, а также значительно увеличить ресурс электродов.
При изготовлении стеклопакетов, инертным газом заполняются полости между стёклами, что позволяет значительно улучшить теплоизоляционные свойства. Учитывая тот факт, что аргон является абсолютно прозрачным, использование его никак не ограниченно даже при изготовлении многослойных конструкций.

Благодаря возможности образовывать плазму при относительно невысоком напряжении, этот благородный газ используется в медицине для проведения аргоновой коагуляции. Такой метод успешно используется для удаления новообразований, а также для остановки кровотечений.
Аргон применяется и в химической промышленности. Благодаря отсутствию взаимодействия с другими элементами этот газ используется для получения сверхчистых веществ, а также для их анализа.
В металлургической промышленности благородный газ позволяет обрабатывать такие металлы, как: титан, тантал, ниобий, бериллий, цирконий и др.
Кроме этого, газ используется для перемешивания расплавленных веществ и снижения окисления хрома при производстве хромированной стали.
Способы получения аргона
Аргон является третьим по распространённости газом в земной атмосфере, поэтому наиболее логичным способом является добывание его из воздуха. Для этой цели используются специальные низкотемпературные ректификационные аппараты.
Процесс отделения инертного вещества осуществляется в такой последовательности:
- Воздух очищается от пыли и подвергается сжатию до жидкого состояния.
- Жидкий воздух, состоящий преимущественно из кислорода, азота и аргона подвергается ректификации.
- После отделения азота, из получившейся при сжатии жидкости, осуществляется доочистка кислородно-аргоновой смеси.
Температура кипения аргона в ректификационной установке составляет минус 185,3˚С. При этом, кислород кипит при температуре на 3 градуса выше, а азот – на 13˚С ниже этого показателя.
По причине небольшого отличия в переходе из одного агрегатного состояния в другое, на первом этапе отделения аргона смесь содержит большое количество жидкого кислорода. На заключительной стадии получения аргона производится отделение благородного газа из кислородно-аргоновой смеси.
Процесс доочистки, как правило, осуществляется с помощью электролитического водорода. В результате реакции в контактном аппарате с кислородом образуется водяной пар, который затем утилизируется через влагоотделитель.
Аргон может быть получен не только из атмосферного воздуха. При некоторых производственных процессах этот газ может являться сопутствующим продуктом. Например, при производстве аммиака, аргон является примесью азота и является совершенно ненужным элементом, поэтому полученный таким образом газ имеет очень низкую себестоимость, в сравнении с криогенным аргоном.
Правила хранения и транспортировки
Хранение и перевозка газа осуществляется в специальных металлических баллонах.
Несмотря на то, что аргон является инертным газом, к ёмкостям всё равно предъявляются определённые технические требования, нарушение которых приведёт к невозможности использовать сосуд в дальнейшем.
Кроме этого, утечка благородного газа в закрытом помещении может вызвать тошноту и потерю сознания у людей, ведь этот газ тяжелее воздуха и способен вытеснить необходимый для дыхания кислород.
Баллоны, используемые для хранения и транспортировки аргона, представляют собой цилиндрические ёмкости, которые могут быть разделены на следующие категории:
- Малого объёма: 0,4 – 12 л.
- Среднего объёма: 20 – 50 л.
- Большого объёма: более 50 л.
Стандартное давление в аргоновом баллоне составляет 150 атм, но в ёмкостях объёмом 40 литров разрешается хранить газ давлением до 200 атм. На ёмкости для хранения аргона наносится информация о дате изготовления и аттестации, а также такие параметры, как вес и объём.
Аргоновые баллоны имеют в верхней части горловины вентиль, с помощью которого можно надёжно перекрыть подачу газа, а также колпак, который защищает запорное устройство от механических повреждений. Все баллоны, вне зависимости от объёма, окрашиваются в серый цвет и маркируются надписью «Аргон» зелёного цвета.
Транспортировка аргона должна осуществляться по правилам. Автомобили должны маркироваться специальным знаком, которые указывает на перевозку нетоксичных и невзрывоопасных веществ. Все документы оформляются в строгом соответствии с правилами ДОПОГ.
Кроме этого, при перевозке аргона необходимо:
- Надёжно закрепить баллоны.
- Размещение ёмкостей осуществляется в горизонтальной плоскости.
- Возможно вертикальное размещение только при наличии специальных приспособлений, повышающих устойчивость баллонов.
- Заправленные аргоном баллоны разрешается перевозить только при отсутствии утечек из ёмкости.
При перевозке аргона в количестве до 18 баллонов (объём 40 л) груз не является опасным, поэтому специальное разрешение не требуется. Тем не менее, даже при перемещении небольших партий следует придерживаться вышеописанных правил транспортировки ёмкостей с этим газом.
Источник: https://ballonis.ru/stati/gaz-argon-tehnicheskie-harakteristiki-i-primenenie
Аргон: применение, получение, история
 Аналитические линии плазмообразующего газа (аргона) на фрагменте спектра образца углеродистой низколегированной стали
Аналитические линии плазмообразующего газа (аргона) на фрагменте спектра образца углеродистой низколегированной стали
Аргон – элемент с атомной массой 39,944 и порядковым номером 18. Принадлежит к 8-ой группе главной подгруппы таблицы Менделеева, относится к благородным инертным одноатомным газам. Не обладает ни запахом, ни цветом, ни вкусом. Негорючий и невзрывоопасный.
История открытия Аргона
Впервые неизвестный до этого газ, при химических и физических экспериментах, обнаружил в 1785 году Генри Кавендиш — английский физик и химик. Но он не смог разгадать загадку и прекратил исследования. Позднее на записи Кавендиша обратил внимание Джеймс Максвелл.
И лишь спустя более ста лет, в 1894 году, химик Уильям Рамзай и физик Джон Уильям Стретт (Лорд Рэлей) сделали доклад об открытии нового элемента, который, за свою химическую неактивность, назвали аргоном.
Это случилось в Оксфорде на собрании Британской ассоциации естествоиспытателей, физиков и химиков. Название нового газа произошло от греческого слова ἀργός, что в переводе означает — неактивный, медленный.
Спустя еще 10 лет, эти ученые получили Нобелевские премии за исследования газов, открытие аргона и других инертных газов в атмосфере.
Получение Аргона
Аргон — наиболее распространенный в воздухе инертный газ. В 1 м3 содержится примерно 0,09 см3 ксенона, 1,1 см3 криптона, 5,2 см3 гелия, 18,2 см3 неона, 9000 см3 аргона.
В атмосфере Земли аргон занимает третье место. На первом – азот, на втором — кислород. В процентном отношении это примерно 0,93% по объёму или 1.3% по массе. По этой причине он является самым легкодоступным и недорогим инертным газом.
Получение и промышленное производство этого газа происходит как выделение сопутствующего газа при добыче азота и кислорода из атмосферного воздуха. Наиболее простой метод — это глубокое охлаждение и ректификация с последующей доочисткой от примесей.
Кроме того, аргон получают при производстве аммиака. Доочистку аргона осуществляют по технологии гидрирования с платиновым катализатором или адсорбционным методом с использованием молекулярных сит или активного угля.
Применение Аргона
Основными потребителями аргона являются:
Металлургия. Применение аргона в современных технологических процессах выплавки стали — продувка расплава в ковше.
Эта операция выполняет несколько функций: охлаждение металла, ускорение плавления вводимых в ковш лигатур и раскислителей, гомогенизация металла по химическому составу и температуре, очищение от неметаллических включений, образующихся от раскисляющих и легирующих добавок, углеродное раскисление металла и его обезуглероживание, удаление водорода и азота, ускорение десульфурации (удаление серы из расплава), вдувание раскисляющих и легирующих порошкообразных добавок.
В металлургии высококачественных сплавов аргон используется для защиты расплава от контакта с воздухом во время выплавки и разливки. Высокотемпературная обработка титана и его сплавов требует защитной аргоновой атмосферы. Незаменим аргон и в технологиях обработки таких редких металлов как цирконий, вольфрам, тантал, ниобий, бериллий, гафний и др.
Металлообрабатывающая промышленность. Основное использование аргона — создание защитной завесы при электродуговой (АРДЭС), контактной и лазерной сварке, термообработке. Аргон — плазмообразующий газ в установках сварки и резки активных, редких металлов, сплавов на их основе, например, алюминиевых и магниевых, нержавеющих, хромоникелевых, жаропрочных сплавов и легированных сталей.
Радиоэлектронная промышленность. Здесь аргон незаменим для создания инертной среды в установках плазменного напыления, заполнение колб электрических и люминесцентных ламп, электровакуумных приборов, газосветной рекламы. Например, сине-голубое свечение получается при заполнении трубок аргоном с парами ртути.
Пищевая промышленность. Благодаря своей химической нейтральности, аргон широко используют как пропеллтен («выталкивающий» газ) в аэрозольных упаковках, антифламинг (вещество снижающее образование пены) и «упаковочный» газ в пищевой промышленности.
Спектральный анализ и метрология. В данной сфере аргон наиболее часто используется как газ-носитель, инертная среда и плазмообразующий газ в контрольно-измерительных приборах, а также при производстве поверочных газовых смесей (ПГС) для различных газоанализаторов.
В данной сфере применения чистота аргона имеет ключевое значение.
Даже при минимальных отклонениях качества аргона от соответствующих ГОСТов и ТУ, регламентированных для использования в конкретных приборах, изменяются условия работы и анализа, что приводит к серьезным искажениям результатов измерений, нарушению работоспособности оборудования, снижению качества продукции, снижению ресурса фильтров и, как следствие, серьезным экономическим убыткам.
Для предотвращения вышеописанного, могут использоваться специализированные фильтры, а также установки доочистки аргона (инертных газов) лабораторного или промышленного назначения.
Так как наша компания занимается разработкой и производством спектрометров, применение аргона в этих приборах мы решили рассмотреть более подробно. Ниже в статье этому будет посвящена отдельная глава.
Прочие сферы применения. Огнетушительные установки, заполнение стеклопакетов и поддув сухих гидрокостюмов водолазов для лучшей теплоизоляции, в медицине — очистка разрезов при хирургическом вмешательстве, в химической промышленности — инертная среда для нестабильных на воздухе соединений, а так же в прочих областях промышленности.
Продолжение >
Источник: https://www.iskroline.ru/articles/argon/
Свойства аргона
Молярная масса любого вещества показывает отношение веса этой субстанции относительно количества молей. Иными словами, зная молярную массу можно знать, сколько будет весить один моль вещества. Каждый элемент и соединение нескольких элементов может отличаться по данному параметру. Эта характеристика необходима в тех случаях, когда нужно смешивать несколько веществ.
Аргон в таблице Менделеева
Аргон относится к одному из самых востребованных газов для современной сварки. Он выполняет защитную функцию, так как создает изоляционный слой для сварочной ванны. Когда используется сварочная проволока, то на ней зачастую не бывает обмазки.
Чтобы кислород и другие элементы из атмосферы не влияли на сваривающийся металл, следует оградить их от всех негативных факторов. Свойства аргона обеспечивают лучшую защиту, на которую не способен ни один другой газ из этой области.
Несмотря на относительно высокую стоимость, которой обладает материал, его применение оказывается вполне оправданным.
Молярная масса аргона составляет 40 грамм на 1 моль вещества. Это может пригодиться для вычисления количества закачки газа в пустой баллон. Ведь практически все емкости могут использоваться многократно. Чтобы узнать количество заправленного вещества, сначала взвешивают пустую емкость, а затем взвешивают ее уже после заполнения.
Область применения
Применение аргона в сварочной сфере за последние годы существенно расширилось. В основном, его используют для сложных и ответственных работ.
Если для стандартных процедур соединения с обыкновенными металлами подходят и другие, менее дорогостоящие газы, то для сложно свариваемых изделий необходим только аргон.
С его помощью можно сваривать алюминий, нержавеющую сталь различных марок, никель и прочие цветные металлы.
В строительной сфере, где нужно получить соединение максимально высокого качества, аргонная сварка является основной. Свою популярность газ получил благодаря минимальному количеству брака, который получается во время сваривания.
Тонкие трубопроводы, химическая и пищевая промышленность, машиностроение и прочие места, в которых находит применение сварка аргоном. В частной сфере используется все достаточно редко, так как себестоимость процесса оказывается довольно высокой и зачастую неоправданно.
Если в быту возникает необходимость в применении аргона, то чаще всего люди обращаются за услугами специалистов.
Ацетилен газообразный технический
Виды аргона
Существует три основные разновидности этого вещества, которые можно найти на современном рынке. В основном они отличаются по чистоте. Среди них выделяют следующие разновидности:
- Высший сорт. В данной разновидности содержание чистого газа составляет 99,99%. Он пригоден для сварки металлов, обладающих высокой химической активностью, к примеру, титановых сплавов, нержавейки. Им сваривают несущие конструкции на стройках.
- Первый сорт от высшего по чистоте имеет небольшое отклонение на 0,01%. Газом 99,98% можно сваривать алюминиевые сплавы с различными металлами. Это распространенный вариант для промышленности. Им можно работать со многими цветными металлами.
- Второй сорт. Этот газ содержит 99,95% чистого аргона. Основная сфера применения – сварка жаропрочных сталей, алюминия и других металлов. Чистый аргон здесь редко применяется, так как это может привести к образованию пор. Чтобы этого не допустить, применяются дополнительные газы, такие как углекислый и кислород. Дополнительные элементы делают защиту более активной. В чистом виде аргон не дает полной защиты от влаги, включений и других загрязнений. Добавки вступают в реакции со всеми примесями и выжигают их или выталкивают на поверхность сварочной ванны.
Физические и химические свойства
Физические свойства аргона определяют его как одноатомный газ. Температура кипения составляет -185,9 градусов Цельсия при нормальном давлении. Она выше, чем у азота, но ниже, чем у кислорода. В 100 мл воды может раствориться до 3,3 мл газа. Плотность аргона при нормальных условиях 1,78 кг/м3. Молярная теплоемкость аргона составляет 20,79 Дж/(К*моль).
На данный момент известно только два химических соединения, в которых участвует газ. Первым является CU(Ar)O, а вторым – гидрофторид аргона. Оба варианта существуют только при низких температурах. Помимо этого, аргон способен образовывать эксимерные молекулы.
У них неустойчивы нормальные состояния и устойчивые возбуждение состояния. Ученые считают, что очень нестойкое соединение с этим элементом Hg – Ar, которое получается в результате электрического разряда, это и есть валентное соединение.
Предполагается, что можно получить также валентные соединения с кислородом и фтором. Они также будут отличаться неустойчивостью.
Расход аргона при сварке
Электроотрицательность составляет 4,3 пункта по шкале Полинга. Степень окисления равняется нулю, также, как и электродный потенциал. Радиус иона достигает 154 пм, а ковалентный радиус – 106 пм. Энергия ионизации – 1519 кДж/моль
Обозначение
Формула аргона – Ar. В промышленности применяется аргон по ГОСТ 10157-79. Данный стандарт предназначается для жидкого и газообразного аргона, который получается из остаточных газов на аммиачных производствах и воздуха.
Используется он в качестве защитной среды вовремя разки, сварки, плавке и прочих процедур с металлами. Стандарт выдвигает требования по изготовлению аргона для данной сферы.
В итоге, полученное вещество должно соответствовать физико-химическим характеристикам, приведенным в самом ГОСТе.
Техника безопасности при работе с аргоном
Как и любой другой газ, аргон может оказаться очень опасным для здоровья человека, если не применять соответствующие меры безопасности. Чтобы минимизировать вероятность появления несчастных случаев, следует придерживаться следующих пунктов:
- Во время работы с самим аргоном, следует применять шланговые противогазы или специальные изолирующие кислородные приборы, такие как баллоны;

Аргон в баллонах разной емкости
- Контакт с аргоном в жидком состоянии может привести к обморожению слизистых оболочек и кожи, так что для личной безопасности нужно применять спецодежду и защитные приспособления.
«Важно!
Во время работы с газом он может замещать кислород из атмосферы, что приводит к удушью, поэтому, нужно контролировать содержание кислорода дистанционными методами и не допускать его падение ниже 19%.»
Заключение
Несмотря на все преимущества использования газа, на практике он оказывается достаточно сложным в использовании. Основная проблема заключается в его вредности для здоровья человека.
При постоянном контакте с ним возникают различные профессиональные болезни, которые проявляются более остро и активно, чем с другими газами.
Таким образом, к проблемам безопасности связанными с хранением, добавляются еще и те, которые связаны с использованием.
Вторая сложность заключается в наличии соответствующей техники и умения работать. Ведь в каждом отдельном случае нужны свои навыки. Тем не менее, аргон остается наиболее востребованным веществом для обеспечения защиты во время соединения сложно свариваемых металлов и их сплавов.
Источник: https://svarkaipayka.ru/material/zashhitnyie-gazyi/molyarnaya-massa-argona.html
Аргон – самый ленивый газ
Аргон химический элемент периодической системы Д. И. Менделеева, инертный газ, атомный номер 18, атомная масса 39,948. Объемная концентрация аргона в воздухе 0,9325% об. или 1,2862% вес. Аргон тяжелее воздуха, плотность 1,78 кг/м3 при нулевой температуре и нормальном давлении. Температура кипения -185,85°C. Обладает низким потенциалом ионизации 15,7 В.
С большинством элементов аргон не образует химических соединений, кроме некоторых гидридов. В металлах аргон, как в жидком, так и в твердом состоянии нерастворим. При обычных условиях — бесцветный, негорючий, неядовитый газ, без запаха и вкуса. Химическая формула — Ar.
Аргон добывают как побочный продукт, при получении кислорода и азота из воздуха методом низкотемпературной ректификации (см. Способы получения аргона)
Аргон был открыт Джоном Уильямом Стреттом (John Strutt) и Сэром Уильямом Рамзаем (Sir William Ramsay) при исследовании азота, полученного из воздуха химическим путем.
Несовпадение плотности этого газа при различных способах получения натолкнуло этих ученых на идею о присутствии в воздухе какого-то тяжелого инертного газа, который и был выделен ими в 1894 г.
и назван аргоном, что с греческого переводится как «ленивый», «медлительный», «неактивный».
Наиболее часто аргон применяют:
- как защитный газ при сварке;
- как плазмообразующий газ при плазменной сварке и резке;
- для вытеснения кислорода и влаги из упаковки при хранении пищевых продуктов, что увеличивает срок их хранения (пищевая добавка Е938);
- как газ для тушения огня в некоторых системах пожаротушения.
В сварочном производстве газообразный аргон применяют в качестве защитной среды при сварке активных и редких металлов (титана, циркония и ниобия) и сплавов на их основе, алюминиевых и магниевых сплавов, а также хромоникелевых коррозионностойких жаропрочных сплавов, легированных сталей различных марок.
Для сварки черных металлов аргон обычно используются в смеси с другими газами — кислородом, гелием, двуокисью углерода или водородом.
Аргон, являясь более тяжелым, чем воздух, своей струей лучше защищает металл при сварке в нижнем положении. Растекаясь по поверхности свариваемого изделия, он защищает достаточно длительно довольно широкую и протяженную зону как расплавленного, так и нагретого при сварке металла.
Низкий ионизационный потенциал аргона помогает получить превосходный профиль сварочного шва и сохранять хорошую и устойчивую дугу от начала до конца. В тоже время, низкий потенциал ионизации является причиной и низкого напряжения на дуге, что снижает тепловую мощность дуги (см. статью Свойства сварочной дуги в инертных газах — аргоне и гелии).
Применение аргона позволяет повысить температуру сварочной дуги, что улучшает проплавление сварного шва, увеличивая производительность сварки в целом.
При этом проплавление приобретает «кинжальную» форму, что дает возможность выполнять однопроходную сварку в щелевую разделку металла больших толщин.
При сварке в среде аргона (как и иных инертных газов) минимизируется выгорание активных легирующих элементов, что позволяет использовать более дешевые сварочные проволоки.
При TIG-сварке аргон служит защитой не только для сварочной ванны от вредного воздействия воздуха, а также инертной защитой конца электрода.
Хотя для дуговой сварки в целом аргон применяется гораздо чаще, чем гелий, однако при сварке листового алюминия толщиной менее 6 мм аргон рекомендуют смешивать с гелием, чтобы обеспечить нужную теплопроводность.
В некоторых случаях аргонно-гелиевые смеси используют для зажигания дуги, после чего сварка происходит в присутствии гелия. Этот метод применяется для сварки толстолистового алюминия вольфрамовым электродом при постоянном токе.
Аргон не оказывает опасного воздействия на окружающую среду, но относится к асфиксантам (удушающий газ). Поскольку газообразный аргон тяжелее воздуха он может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается содержание кислорода в воздухе, что вызывает кислородную недостаточность и удушье.
Жидкий аргон – низкокипящая жидкость, которая может вызвать обморожение кожи и поражение слизистой оболочки глаз.
Газообразный и жидкий аргон поставляется по ГОСТ 10157. Газообразный аргон хранят и транспортируют в стальных баллонах по ГОСТ 949 под давлением 15МПа.
Стальные баллоны должны соответствовать ГОСТ 949. Баллон окрашивается в серый цвет с зеленой полосой и зеленой надписью «АРГОН ЧИСТЫЙ».
Возможна также транспортировка аргона в жидком виде в специальных цистернах или сосудах Дьюара с последующей его газификацией.
Коэффициенты перевода объема и массы аргона при Т=15°С и Р=0,1 МПа
| 1,669 | 1 | 1,197 |
| 1,394 | 0,835 | 1 |
| 1 | 0,599 | 0,717 |
Коэффициенты перевода объема и массы аргона при Т=0°С и Р=0,1 МПа
| 1,784 | 1 | 1,279 |
| 1,394 | 0,782 | 1 |
| 1 | 0,561 | 0,717 |
Газ в баллоне
| Аргон | 40 | 10,85 | 6,5 |
Давление аргона в баллоне при различной температуре окружающей среды
| -40 | 10,5 |
| -30 | 11,3 |
| -20 | 12,2 |
| -10 | 12,9 |
| 13,7 | |
| +10 | 14,6 |
| +20 | 15,3 |
| +30 | 16,0 |
Источник: https://weldering.com/argon-samyy-lenivyy-gaz
в„–18 РђСЂРіРѕРЅ
Первый вклад в открытие аргона внес английский физик и химик Генри Кавендиш.
�зучая в 1785 году окисление атмосферного азота кислородом под действием электрического разряда, он обнаружил, что остается небольшой объем газа, не подвергающегося окислению.
Однако он не нашел объяснения этому факту. В 1892 году английский физик Дж.
Рэлей обнаружил небольшое (всего на 0,13%) превышение плотности азота, выделяемого из воздуха, над плотностью азота, получаемого химическим путем. Английский физик У.
Рамзаем предположил, что причиной этого может быть примесь еще неизвестного более тяжелого газа и предложил выделить его. Ему и Дж.
Рэлею РІ 1894 РіРѕРґСѓ удалось выделить этот газ Рё спектральным анализом доказать, что это новый химический элемент. Дальнейшие исследования показали полную химическую инертность этого вещества. Благодаря своей химической инертности (Р° это был первый РёР· открытых инертных газов), новый элемент Рё получил СЃРІРѕРµ название РђСЂРіРѕРЅ (греч. Р°rgos — неактивный, ленивый).
Нахождение в природе и получение:
В атмосферном воздухе содержится 0,93% аргона по объему (9,34 л в 1м3), его запасы в атмосфере оцениваются в 4·1014 т.
Среди РґСЂСѓРіРёС… изотопов преобладает aСЂРіРѕРЅ-40, постоянно образующийся РІ С…РѕРґРµ ядерной реакции («СЌР»РµРєС‚ронный захват») РёР· РїСЂРёСЂРѕРґРЅРѕРіРѕ изотопа калия: 40K + e = 40Ar + ne
Р’ промышленности аргон получают как побочный РїСЂРѕРґСѓРєС‚ РїСЂРё крупномасштабном разделении РІРѕР·РґСѓС…Р° РЅР° кислород Рё азот. РџСЂРё температуре -185,9В°C аргон конденсируется, РїСЂРё -189,4°С — кристаллизуется.
Физические свойства:
Бесцветный, без запаха газ. Температура кипения аргона (при нормальном давлении) -185,9°C, температура плавления -189,4°C. Плотность при нормальных условиях 1,784 кг/м3. В 100 мл воды при 20°C растворяется около 3,3 мл аргона.
в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде. При пропускании электрического разряда через стеклянную трубку, заполненную аргоном, наблюдается сине-голубое свечение.
Химические свойства:
Аргон химически инертен, при обычных условиях химических соединений не образует.
Однако СЃРѕ РјРЅРѕРіРёРјРё веществами, между молекулами которых действуют водородные СЃРІСЏР·Рё (РІРѕРґРѕР№, фенолом, РіРёРґСЂРѕС…РёРЅРѕРЅРѕРј Рё РґСЂСѓРіРёРјРё), образует соединения включения (клатраты), РіРґРµ атом аргона, как своего СЂРѕРґР° «РіРѕСЃС‚СЊ», находится РІ полости, образованной РІ кристаллической решетке молекулами вещества-С…РѕР·СЏРёРЅР°. РџСЂРё сверхнизких температурах спектральными методами зафиксировано образование некоторых чрезвычайно неустойчивых молекул, содержащих аргон.
Установлено существование так называемых эксимерных молекул, содержащих аргон. На переходах этих молекул из метастабильного состояния в несвязанное генерируется лазерное излучение.
Важнейшие соединения:
Клатрат Ar*6H2O — соединение включения, температура разложения РђrВ·6Рќ2Рћ РїСЂРё 101325 РџР° 42,0°С.
Гидрофторид аргона HArF — первое открытое, Рё РїРѕРєР° единственное известное РЅР° 2013 Рі.
химическое соединение аргона с электронейтральной молекулой. Получен при УФ-облучении смеси аргона и фтороводорода при 8K.
Нестоек и распадается уже при 17 К на фтороводород и аргон.
CU(Ar)O — образование такого соединение РїСЂРё 3 Рљ предполагается РЅР° основании спектральных данных. Р’ этой молекуле уран должен быть связан СЃ тремя РґСЂСѓРіРёРјРё атомами — углеродом, аргоном Рё кислородом.
Применение:
РђСЂРіРѕРЅ широко используют для создания инертной Рё защитной атмосферы, прежде всего РїСЂРё термической обработке легко окисляющихся металлов (аргоновая плавка, аргоновая сварка Рё РґСЂСѓРіРёРµ). Р’ атмосфере аргона получают кристаллы полупроводников Рё РјРЅРѕРіРёРµ РґСЂСѓРіРёРµ сверхчистые материалы. РђСЂРіРѕРЅРѕРј часто заполняют электрические лампочки (для замедления испарения вольфрама СЃРѕ спирали). Рто же его свойство используется РІ аргоновой сварке, которая позволяет соединять алюминиевые Рё дюралевые детали.
Аргон (в смеси с неоном, парами ртути) применяют для наполнения газоразрядных трубок (сине-голубое свечение), что используется в светящейся рекламе. Также аргон используется в аргоновых лазерах.
В геохронологии по определению соотношения изотопов 40Ar/40К устанавливают возраст минералов.
Мавлянова Н.Х., Жудин С.М.
ТюмГУ, 501 группа, 2013 г.
Источник: http://www.kontren.narod.ru/x_el/info18.htm




