

Цинк является химическим элементом таблицы Д. И. Менделеева. В обычной среде цинк имеет голубоватый окрас и внешне походит на простой металл, который покрывается небольшим слоем оксида цинка.
История открытия Zn
Еще в Древней Греции был открыт такой элемент, как латунь. Это сплав цинка и меди. Из латуни в те времена делали очень многие изделия. Чистый цинк люди не могли выделить длительное время из-за сложностей в его окислении на воздухе.

Андреас Сигизмунд Маргграф
В XVII веке в Англии наконец сумели изобрести способ добычи цинк в чистом виде с помощью метода дистилляции. В следующем веке начали получать его уже в промышленных масштабах. В городе Бристоле даже создали специальный цинковый завод, который успешно работал длительное время.
Несколько позже цинк научились добывать другим методом — с помощью прокаливания оксида цинка и угля, при этом обязательным условием было отсутствие доступа кислорода. Такую смесь требовалось хранить в специальных условиях и поддерживать температурный режим.
Немецкий химик Анреас Маргграф в 1746 г. впервые изобрел такой способ получения цинка. Именно этот человек и считается первооткрывателем чистого цинка. Он также определил и строение атома этого элемента.
С помощью так называемой прокатки уже в XVIII в. ученые Чарльз Сильвестр и его тезка Гобсон запатентовали получение такого металла при определенной температуре.
В нашей стране первые заводы по добыче этого металла начали свою работу уже веком позднее.
Происхождение названия
Само название, которое мы привыкли видеть в периодической системе Менделеева, впервые люди обнаружили в трудах, описанных швейцарским алхимиком Парацельсом. Именно он в те времена именовал этот металл zinken.
В последующем название было адаптировано для других языков. В переводе данное слово означает «зубец». Такое название Парацельс дал цинку именно потому, что металл напоминает кристаллы с иглами или с некими зубцами на поверхности.
Нахождение в природе
Всего ученые насчитывают около 66 минералов цинка или его производных. Этот металл научились смешивать с другими элементами, тем самым получая разнообразные смеси и различные цвета.
Первичным минералом считается так называемая цинковая обманка, которая была обнаружена еще в Древней Греции. В природе она встречается в виде смеси с бурым шпатом.
В земной коре содержится около 10% цинка. Также его можно найти в извергаемых земных породах. В кислых содержится значительно меньше. Также в природе встречается и гидроксид цинка. Всего насчитывается 5 его модификаций.
Цинк имеет свойство мигрировать в термальных водах. Кроме того, его можно обнаружить и в подземных и поверхностных водах, где он также успешно мигрирует.
Ученые выяснили, что и в живых организмах находится относительно большое количество цинка. Он необходим им для успешной жизнедеятельности.
Получение цинка
Самостоятельно как металл в природе невозможно встретить данный элемент. Люди добывают его из руд, а затем обогащают и получают его концентраты. После получения производят обжиг в специальных печах, далее доводя его до необходимого состояния.

Основным способом получения этого металла считается электролитический способ. Концентраты, полученные при обжигании в печи, обрабатывают специальным раствором, после чего тщательно очищают от различных примесей и подвергают электролизу.
Физические свойства
Внешне цинк напоминает обычный бело-серебристый металл, у которого на поверхности много мелких иголочек. При комнатной температуре этот элемент является очень хрупким и его легко согнуть или повредить. Пластичность его возникает при температуре плавления около 100 и более градусов.

Степень окисления или валентность цинка +2. Молярная масса — 65,38 г/моль. Плотность — 7,1333 г/см3. Химическая формула — Zn. Электронная конфигурация содержит около 40 атомов ядер. Вокруг по орбитам движутся 30 электронов.
Химические свойства
В обычной среде обитания или при комнатной температуре этот элемент покрывается оксидом. Когда его нагревают, то происходит сгорание и образуется белый оксид цинка. Его можно соединять с различными соединениями кислот, щелочами, и взаимодействиями растворами.

С некоторыми элементами периодической системы цинк никак не реагирует. Это азот, водород и другие элементы.
Применение
Цинк применяется не как самостоятельный металл. Он полезен людям для того, чтобы добывать с помощью выщелачивания золото и серебро.

Также цинк полезен тем, что используется как антикоррозийное покрытие для металлических предметов или емкостей.
Очень эффективен металл для использования в качестве материала в химических источниках тока. Часто окись его применяют в батарейках или аккумуляторах разной направленности.
Цинк применяется и в полиграфии в качестве пластин для печатей. Как противовоспалительное средство люди научились применять оксид цинка. Также люди используют и нитрат цинка ввиду его специфических свойств. Например, в авиастроении для защиты металлических частей от коррозии.
Производство цинка в мире
В мире очень широко применяется данный материал. Этот элемент является четвертым по частоте использования во всем мире.

Наиболее массово производят цинк в Китае, Австралии, Перу, США и Канаде. В России производят около 190000 тонн цинка в год.
Биологическая роль цинка
У взрослого человека в организме содержится определенное количество цинка, а именно около 2 г. В человеческом организме он содержится в качестве органических соединений, которые находятся в мышечной ткани, поджелудочной железе и печени.
Цинк очень полезен для человека, а его недостаток обычно определяет появление различных заболеваний и патологий. Множество ферментов в человеческом организме содержат данный элемент.
Биологически цинк нужен организму для:
- выработки мужских половых гормонов, в частности, спермы;
- правильной деятельности простаты;
- метаболизма витаминов и питательных веществ;
- синтеза гормонов;
- расщепления клеток алкоголя и ускорения выведения токсинов.
Польза данного элемента очень важна как для взрослых, так и для детей. Для аллергиков и людям с некоторыми заболеваниями хорошо подходят витамины в жидком виде, так как они хорошо усваиваются и для их производства не применяются консерванты. Существуют цинкосодержащие препараты как для взрослых, так и для детей.
Важно помнить, что переизбыток цинка так же вреден, как и недостаток. Поэтому крайне важно следить за правильными пропорциями.
Содержание в продуктах питания
В день взрослому здоровому человеку рекомендуется употреблять около 8 — 10 мг данного элемента. Суточная норма потребления варьируется в зависимости от возраста, пола и индивидуальных особенностей человека.
- Очень много цинка содержится в морепродуктах, семенах тыквы и подсолнечника, некоторых крупах.
- Есть в природе минеральные воды, которые также богаты наличием цинка в составе.
Отражение недостатка цинка на здоровье человека
Недостаток данного микроэлемента в организме обуславливается появлением некоторых возникающих симптомов. А именно могут появиться: аллергия, головокружение, высыпания на теле, ухудшение зрения и слуха, повышенная утомляемость.
Многие люди замечают появление у себя подобных симптомов, но редко связывают это с переизбытком или недостатком каких-либо микроэлементов. Хотя зачастую при регулировании их нормального потребления все патологические процессы самостоятельно исчезают.
Для того, чтобы регулировать нормальное содержание витаминов и минералов, врачи нередко назначают цинксодержащие препараты. Они положительно влияют не только на внутреннее состояние здоровья человека, но и благотворно влияют на его внешний вид.
Очень часто назначается пиколинат цинка. По сути это смесь цинка с пиколиновой кислотой. Такое сочетание усиливает благоприятное воздействие на здоровье человека.
Усваиваемость данного микроэлемента разная у каждого человека. Поэтому врачи должны учитывать данный факт. В некоторых случаях назначается глюконат цинка. В других — ацетат. Для лечения назначается и сульфат цинка, но его содержание должно строго регулироваться лечащим врачом.
Токсичность цинка
Переизбыток данного микроэлемента очень вреден для здоровья человека, так же как и его недостаток. Переизбыток цинка вызывает интоксикацию организма.
В особенности при длительном чрезмерном насыщении организма данным веществом, соли и сульфаты цинка отравляют человека своей токсичностью.
Сульфаты цинка образуются при неправильном хранении продуктов питания. Особенно вредно хранить продукты в закрытых емкостях из оцинкованной посуды.
Токсичность цинка вызывает даже бесплодие, импотенцию и другие проблемы со здоровьем. Можно отравиться им, вдыхая его пары. Проявляться такое отравление будет в виде головокружения, потери сознания, учащении пульса и появлении неприятного привкуса в ротовой полости.
Источник: https://nauka.club/khimiya/tsink.html
Презентация по химии «Цинк»
Слайд 2

2Строение атома цинкаа) Формула состава атома цинка Согласно планетарной модели, предложенной ан —
глийским физиком Резерфордом, атом состоит из
положительно заряжен —
ного ядра и окружаю — щей электронной обо —
лочки, заряженной от —
рицательно.
Слайд 3

Ядро атома в свою очередь состоит из элементар –
ных частиц двух видов: протонов и нейтронов. Протон
имеет заряд (+1) и массу 1 ( р+). Нейтрон, как и протон,
имеет массу 1, но заряда не имеет (n0).
Слайд 4
4Электрон ( е -) имеет заряд (-1) и очень маленькую
массу (1/1840). Следовательно, масса атома (А) со –
средоточена в ядре и численно равна сумме числа
протонов (Z) и нейтронов (N), или А=Z+N. Так как атом – электронейтральная частица, об –
щее число электронов в его электронной оболочке
равно числу протонов в ядре атома. Таким образом, формула состава атома цинка имеет вид:
Слайд 5

5 б) Электронная формула атома цинка Электроны в атоме обладают неодинаковой энерги —
ей и в соответствии со своей энергией располагаются
на различном расстоянии от ядра, образуя электронные
слои или энергетические уровни.
Максимальное число
электронов на энергетическом уровне можно опреде –
лить как , где n – номер энергетического уровня.
Тогда электронная оболочка атома цинка состоит из 4-х энергетических уровней со следующим разме –
щением на них 30 электронов:
Слайд 6

6Такая запись схемы распределения электронов явля —
ется упрощенной, т.к. она не отражает состояние
электрона в атоме и характер его движения.
Обладая различной энергией, электроны в пределах
одного и того же энергетического уровня размещаются
на различных подуровнях, называемых s, p, d, f — под —
уровнями или s, p, d, f – орбиталями, а электроны на
этих орбиталях – s, p, d, f – электронами. С учетом состояния электрона полную электрон –
ную формулу атома цинка можно представить так:
Слайд 7

Положение цинка в переодической таблице Д.И.Менделеева
Слайд 8

8- Порядковый номер выражающий заряд ядра атома Zn, т.е. число протонов или число электронов в атоме, – 30.
— Номер периода, показывающий число энергетиче – ских уровней, – 4.
— Группа, выражающая число электронов на внешнем энергетическом уровне ( валентных электронов ) побочная группа II – группы ( II Б – группа).
— Относительная атомная масса ( А) – 65,37.
Слайд 9

9Физические свойства цинкаМеталлический цинк обладает характерным голубоватым блеском на свежей поверхности, который он быстро теряет во влажном воздухе.
Температура плавления 419,58° С, температура кипения 906,2° С, плотность 7,133 г/см3.
При комнатной температуре цинк хрупок, при 100–150° С становится пластичным и легко прокатывается в тонкие листы и проволоку, а при 200–250° С вновь становится очень хрупким и его можно быть истолочь в порошок
Слайд 10

10Химические свойства цинка Цинк – химически активный металл. Он проявляет
только восстановительные свойства.
Обладая на внеш-
нем энергетическом уровне двумя валентными элек –
тронами, во всех своих соединениях цинк имеет сте –
пень окисления (+ 2).
По химической активности цинк уступает щелоч –
ным и щелочноземельным металлам. Так, с простыми
веществами-неметаллами он реагирует только при на –
гревании:
Слайд 11

11 2 Zn + O2 = 2 ZnO Zn + Cl2 = ZnCl2 Zn + S = ZnS, а с водой – только в раскаленном виде: Zn + H2O = ZnO + H2 При обычных условиях эти реакции не идут, т.к. по –
верхность цинка на воздухе покрывается тонкой за –
щитной пленкой оксида. Цинк вступает в реакции со сложными веществами:
с кислотами и основаниями.
Слайд 12
12 а) При взаимодействии цинка с кислотой ход реакции зависит от концентрации кислоты. Например, из раз –бавленной серной кислоты цинк, стоящий в ряду ак – тивности металлов до водорода, легко вытесняет его в ходе реакции. Окислителями в этих условиях явля – ются ионы водорода: Zn + H2SO4 = ZnSO4 + H2 Zn0 + 2H+ + SO42- = Zn2++ SO42- + H2 Zn0 + 2H+ = Zn2+ + H2
Слайд 13
13 При взаимодействии цинка с концентрированной
серной кислотой окислителем является сера со сте –
пенью окисления (+6). Реакция идет только при на –
гревании: б) В отличие от типичных металлов I- и II-групп
переодической таблицы цинк может взаимодейство –
вать с основаниями в твердом виде ( при нагревании)
или в водном растворе, образуя соль или комплексное
соединение:
Слайд 14
14 Zn0 + 2Na+1OH = Na2ZnO2 + H2↑ Zn0 + 2NaOH + 2H2+1O = Na2[ Zn(OH4)] + H2↑ В приведенных реакциях цинка с кислотами и основа —
ниями выражена двойственная природа цинка как
элемента побочной подгруппы переодической системы,
способного образовать амфотерные оксид и гидроксид.
Слайд 15
15Амфотерные соединения цинка Гидроксид цинка Zn(OH)2 представляет собой не —
растворимое в воде кристаллическое или аморфное
вещество белого цвета.
Он обычно выпадает в осадок
при взаимодействии соли цинка с щелочью: ZnSO4 + 2NaOH = Zn(OH)2↓+ Na2SO4.
Однако осадок легко растворяется в растворе щелочи
или кислоты, проявляя характерные для гидроксида
цинка амфотерные свойства: реагировать с кислотой
.
Слайд 16
16Реагировать с кислотой как основание, а с основанием
как кислота, т.е. формулу гидроксида цинка можно
представить двояко: Zn(OH)2 = H2ZnO2 Тогда уравнения реакций гидроксида цинка с кис —
лотой и с щелочью можно записать так: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Слайд 17
17 H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O В обоих случаях образуются растворимые соли:
хлорид цинка и цинкат натрия.
Оксид цинка ZnO – это белые шелковистые блестя –
щие иглы или призмы, которые можно получить, на –
пример, окислением цинка на воздухе при нагревании,
как было показано ранее.
Аналогично гидроксиду оксид цинка также прояв –
ляет амфотерный характер – образует растворимые в
Воде соли при взаимодействии как с кислотами, про –
Слайд 18
18являя себя в роли основного оксида: ZnO + 2HCl = ZnCl2 + H2O Так и с основаниями, выступая в качестве кислотного
Оксида: ZnO + 2KOH = K2ZnO2 +H2O.
Слайд 19
19Нахождение цинка в природе и его получение Цинк в природе встречается только в составе соеди —
нений цинковых руд, например,цинковая обманка ZnS,
цинковый шпат ZnCO3, цинкит ZnO. Массовая доля
цинка в земной коре составляет 0,005%. Для получения цинка его руды подвергают обжигу: 2ZnS + 3O2 = 2ZnO + 2SO2↑ ZnCO3 = ZnO + CO2↑
Слайд 20
20Далее оксид цинка при нагревании восстанавливают
Углем: ZnO + C = Zn + CO↑
Слайд 21
21Применение цинка и его соединений Ввиду того, что на цинк при обычных условиях не
действует ни кислород воздуха, ни вода, большая часть
цинка расходуется на защитные от коррозии покрытия
железных листов, стальных и чугунных изделий, а также для получения специальных сплавов с повы –
шенной антикоррозионной активностью, для произ –
водства цинково-угольных
гальванических элементов
в батареях разного назна –
чения. Оксид цинка применяют в производстве красок
Слайд 22
22(цинковых белил) и как полупроводниковый материал, а в медицине и косметике – как мазь, шампунь. Сульфат цинка применяют в качестве электролита
при получении цинковых покрытий и как микроудо –
брение в сельском хозяйстве.
Источник: https://topslide.ru/himija/tsink
Цинк: производство и применение
Цинк – это металл, стоящий в таблице Менделеева, под номером 30 и имеет обозначение Zn. Плавится при температуре 419 °С градусов, если же температура кипения 913 °С – начинает превращаться в пар. При температурном обычном режиме, состояние хрупкое, а при ста градусах начинает гнуться.
Цвет цинка сине-белый. При воздействии кислорода появляется окисление, а также покрытие карбоната, предохраняющего металл от дальнейшей реакции окисления. Появление на цинке гидроокиси обозначает то, что вода на химический элемент не действует.
Цинк — химический элемент, имеет свои отличительные свойства, преимущества и недостатки. Он широко применяется в повседневной жизни человека, в фармацевтике и металлургии.
Цинк
Особенности цинка
Металл является необходимым и широко применяемым практически во всех отраслях повседневной жизни человека.
Добыча в основном, производится в Иране, Казахстане, Австралии, Боливии. В России изготовителем является ОАО «ГМК Дальполиметалл».
Это переходной металл, имеет степень окисления +2, радиоактивный изотоп, период полураспада 244 дня.

Водный арсенат кадмия, цинка и меди
В чистом виде элемент не добывается. Содержится в рудах и минералах: клейофане, марматите, вюртците, цинките. Обязательно присутствует в сплаве с алюминием, медью, оловом, никелем.
Химические, физические свойства и характеристики цинка
Цинк – металл, обладает рядом свойств и характеристик, отличающих его от иных элементов периодической таблицы.
К физическим свойствам цинка относится его состояние. Основным фактором выступает температурный режим.
Если при комнатной температуре это хрупкий материал, плотность цинка 7130 кг/м3 (˃ плотности стали), который практически не гнётся, то при повышении он легко изгибается и прокатывается в листах на заводах.
Если взять более высокий температурный режим – материал приобретает жидкое состояние, а если еще поднять температуру на 400-450 °С градусов, тогда он просто испарится. В этом уникальность – менять своё состояние. Если же подействовать кислотами и щелочами, он может рассыпаться, взорваться, расплавиться.

Цинк в жидком состоянии
Формула цинка Zn – zincum. Атомная масса цинка 65.382 а.е.м.
Электронная формула: ядро атома металла содержит 30 протон, 35 нейтрон. В атоме 4 энергетических уровня – 30 электронов. (рис. строение атома цинка)1s22s22p63s23p63d104s2.
Кристаллическая решётка цинка – шестиугольная кристаллическая система с плотно прижатыми атомами. Данные решётки: A=2.66У, С=4.94.
Добытый и не переработанный материал имеет изотопы 64, 66, 67, электроны 2-8-18-2.
По применению среди всех элементов периодической таблицы металл стоит на 23 месте. В природе элемент выступает в виде сульфида с примесями свинца Pb, кадмия Cd, железа Fe, меди Cu, серебра Ag.

Сульфид цинка
В зависимости от того, какое количество примесей, металл имеет маркировку.
Производство цинка
Как было сказано выше, чистого вида данного элемента в природе нет. Он добывается из иных пород, таких как руда – кадмий, галлий, минералы – сфалерит.
Металл получают на заводе. Каждый завод имеет свои отличительные особенности производства, поэтому оборудование для получения чистого материала различно. Оно может быть таким:
- Роторы, расположенные вертикально, электролитные.
- Специальные печи с достаточно высокой температурой для обжига, а также специальные электропечи.
- Транспортёры и ванны для электролиза.
В зависимости от принимаемого метода добычи металла, задействовано соответствующее оборудование.
Получение чистого цинка
Как упоминалось выше – в природе чистого вида нет. В основном добыча производится из руд, в которых он идет с различными элементами.
Для получения чистого материала задействован специальный флотационный процесс с избирательностью (селективностью). После проведения процесса руда распадается на элементы: цинк, свинец, медь и так далее.
Добытый таким методом чистый металл обжигается в специальной печи. Там при определенных температурах сульфидное состояние материала переходит в оксидное. При обжиге выделяется газ с содержанием серы, направляемый для получения серной кислоты.

Чистый цинк
Есть 2 способа получения металла:
- Пирометаллургический – идет процесс обжигания, после — полученная масса восстанавливается с помощью чёрного угля и кокса. Конечным процессом является отстаивание.
- Электролитический – добытая масса обрабатывается серной кислотой. Полученный раствор подвергают электролизу, при этом металл оседает, его плавят в печах.
Выплавка цинка в печи
Температура плавления цинка в печи 419-480 °С градусов. Если же температурный режим превышен, тогда материал начинает испаряться. При данной температуре допускается примесь железа 0.05%.
При процентной ставке 0.2 железа, лист невозможно будет прокатать.
Применяются различные способы выплавки чистого металла, вплоть до получения цинковых паров, которые направляются в специальные резервуары и там вещество опадает вниз.
Применение металла
Свойства цинка позволяют его применение во многих сферах. В процентном соотношении:
- Цинкование – до 60%.
- Медицина – 10%.
- Различные сплавы, содержащие данный металл 10%.
- Выпуск шин 10%.
- Производство красок – 10%.

Медно-цинковый сплав
А также применение цинка необходимо для восстановления таких металлов, как золото, серебро, платина.
Цинк в металлургии
Металлургическая промышленность задействует данный элемент периодической таблицы как основной для достижения определенных целей. Выплавка чугуна, стали является главной во всей металлургии страны. Но, данные металлы подвержены негативному влиянию окружающей среды. Без определенной обработки идет быстрое окисление металлов, что приводит к их порче. Наилучшей защитой служит оцинкование.
Нанесение защитной плёнки на чугун и сталь является лучшим средством от коррозии. На оцинкование уходит около 40% всего производства чистого материала.
Способы оцинкования
Металлургические заводы отличительны не только своим оборудованием, но и применяемыми методами производства. Это зависит от ценовой политики, и месторасположения (природных ресурсов, используемых для металлургической промышленности). Есть несколько методов оцинкования, которые рассматриваются ниже.
Горячий способ оцинкования
Данный способ заключается в обмакивании металлической детали в жидком растворе. Происходит это так:
- Деталь или изделие обезжиривается, очищается, промывается и сушится.
- Далее, цинк расплавляется до жидкого состояния при температуре до 480 °С.
- В жидкий раствор опускается подготовленное изделие. При этом оно хорошо смачивается в растворе и образуется покрытие толщиной до 450 мкм. Это является 100% защитой от воздействия внешних факторов на изделие (влага, прямые солнечные лучи, вода с химическими примесями).

Горячее цинкование металлоконструкций
Но, данный метод имеет ряд недостатков:
- Цинковая пленка на изделии получается неравномерного слоя.
- Нельзя использовать данный метод для деталей, отвечающих точным стандартам по ГОСТу. Где каждый миллиметр считается браком.
- После горячего оцинкования, не каждая деталь останется прочной и износостойкой, поскольку после прохождения высокой температуры появляется хрупкость.
А также данный метод не подходит для изделий, покрытых лакокрасочными материалами.
Холодное оцинкование
Этот метод носит 2 названия: гальванический и электролитический. Методика покрытия изделия защитой от коррозии такова:
- Металлическая деталь, изделие подготавливается (обезжиривается, очищается).
- После этого проводится «метод окрашивания» — применяется специальный состав, имеющий главный компонент – цинк.
- Деталь покрывается данным составом методом распыления.

Холодное цинкование
Благодаря этому методу защитой покрываются детали с точным допуском, изделия, покрытые лакокрасочными материалами. Повышается стойкость к внешним факторам, приводящим к коррозии.
Недостатки данного метода: тонкий защитный слой – до 35 мкм. Это приводит к меньшей защите и небольшим срокам защиты.
Термодиффузионный способ
Данный метод делает покрытие, которое является электродом с положительной полярностью, в то время как металл изделия (сталь) становится отрицательной полярности. Появляется электрохимический защитный слой.
Метод применим только в случае, если детали произведены из углеродистой стали, чугуна, стали с примесями. Цинк используется таким образом:
- При температуре от 290 °С до 450 °С в порошковой среде, поверхность детали насыщается Zn. Здесь маркировка стали, а также тип изделия имеют значение – выбирается соответствующая температура.
- Толщина защитного слоя достигает 110 мкм.
- В закрытый резервуар помещается изделие из стали, чугуна.
- Добавляется туда специальная смесь.
- Последним шагом является специальная обработка изделия от появления белых высолов от солёной воды.
Термодиффузионное цинкование
В основном данным методом пользуются в случае, если требуется покрыть детали, имеющие сложную форму: резьбу, мелкие штрихи. Образование равномерного защитного слоя является важным, поскольку данные детали претерпевают множественное воздействие внешней агрессивной среды (постоянная влага).
Данный метод дает самый большой процент защиты изделия от коррозии. Оцинкованное напыление является износостойким и практически нестираемым, что очень важно для деталей, которые время о времени крутятся и разбираются.
Иные сферы применения цинка
Помимо оцинкования, металл применяется и в других сферах промышленности.
- Цинковые листы. Для производства листа выполняется прокатка, в которой важна пластичность. Это зависит от температурного режима. Температура в 25 °С дает пластичность только в одной плоскости, что создает определенные свойства металла. Тут главное для чего изготавливается лист. Чем выше температура, тем тоньше получается металл. В зависимости от этого идет маркировка изделия Ц1, Ц2, Ц3. После этого из листов создаются различные изделия для автомобилей, профиля для строительства и ремонта, для полиграфии и так далее.
- Цинковые сплавы. Для улучшенных свойств металлических изделий, добавляется цинк. Данные сплавы создаются при высоких температурах в специальных печах. Чаще всего производятся сплавы из меди, алюминия. Данные сплавы применяются для производства подшипников, различных втулок, которые применимы в машиностроении, судостроении и авиации.
В домашнем обиходе оцинкованное ведро, корыто, листы на крыше – это норма. Применяется цинк, а не хром или никель. И дело не только в том, что оцинкование дешевле, чем покрытие другими материалами. Это наиболее надёжный и продолжительный по службе эксплуатации защитный материал нежели, хром или другие применяемые материалы.
В итоге – цинк наиболее распространенный металл, применяемый широко в металлургии.
В машиностроении, строительстве, медицине – материал применим не только как защита от коррозии, но и для увеличения прочности, продолжительного срока эксплуатации.
В частных домах оцинкованные листы защищают крышу от осадков, в зданиях выравниваются стены и потолки гипсокартонными листами на основе оцинкованных профилей.
Практически у каждой хозяйки в доме есть оцинкованное ведро, корыто, которым она пользуется длительное время.
Источник: https://stankiexpert.ru/spravochnik/materialovedenie/proizvodstvo-i-primenenie-cinka.html
Цинк, свойства атома, химические и физические свойства
![]()
![]()
![]()
![]()
Zn 30 Цинк
65,38(2) 1s2 2s2 2p6 3s2 3p6 3d10 4s2
Цинк — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 30. Расположен в 12-й группе (по старой классификации — побочной подгруппе второй группы), четвертом периоде периодической системы.
Атом и молекула цинка. Формула цинка. Строение атома цинка
- Изотопы и модификации цинка
- Свойства цинка (таблица): температура, плотность, давление и пр.
- Физические свойства цинка
Химические свойства цинка. Взаимодействие цинка. Химические реакции с цинком
Получение цинка
Применение цинка
Таблица химических элементов Д.И. Менделеева
Атом и молекула цинка. Формула цинка. Строение атома цинка:
Цинк (лат. Zincum, от нем. Zinke – «зубец») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Zn и атомным номером 30. Расположен в 12-й группе (по старой классификации – побочной подгруппе второй группы), четвертом периоде периодической системы.
Цинк – амфотерный металл. Относится к группе переходных металлов. Относится к цветным металлам.
- Как простое вещество цинк при нормальных условиях представляет собой хрупкий металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
- Молекула цинка одноатомна.
- Химическая формула цинка Zn.
Электронная конфигурация атома цинка 1s2 2s2 2p6 3s2 3p6 3d10 4s2. Потенциал ионизации атома цинка равен 9,39 эВ (905,8 кДж/моль).
Строение атома цинка. Атом цинка состоит из положительно заряженного ядра (+30), вокруг которого по четырем оболочкам движутся 30 электронов. При этом 28 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку цинк расположен в четвертом периоде, оболочек всего четыре.
Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома цинка – на s-орбитали находится два спаренных электрона.
В свою очередь ядро атома цинка состоит из 30 протонов и 35 нейтронов.
Радиус атома цинка составляет 138 пм.
Атомная масса атома цинка составляет 65,38(2) а. е. м.
Цинк с давних пор широко используется человеком.
Изотопы и модификации цинка:
Свойства цинка (таблица): температура, плотность, давление и пр.:
| Общие сведения | |
| Название | Цинк/ Zincum |
| Символ | Zn |
| Номер в таблице | 30 |
| Тип | Металл |
| Открыт | Известен с глубокой древности. Уильям Чемпион, Англия, 1738 г. (получен в чистом виде) |
| Внешний вид и пр. | Хрупкий металл голубовато-белого цвета |
| Содержание в земной коре | 0,0078 % |
| Содержание в океане | 5,0×10-7 % |
| Свойства атома | |
| Атомная масса (молярная масса) | 65,38(2) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 |
| Радиус атома | 138 пм |
| Химические свойства | |
| Степени окисления | +2, 0 |
| Валентность | +2 |
| Ковалентный радиус | 125 пм |
| Радиус иона | (+2e) 74 пм |
| Электроотрицательность | 1,65 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 905,8 кДж/моль (9,39 эВ) |
| Электродный потенциал | -0,76 В |
| Физические свойства | |
| Плотность (при нормальных условиях) | 7,133 г/см3 |
| Температура плавления | 419,53 °C (692,68 K) |
| Температура кипения | 907 °C (1180 K) |
| Уд. теплота плавления | 7,28 кДж/моль |
| Уд. теплота испарения | 114,8 кДж/моль |
| Молярная теплоёмкость | 25,4 Дж/(K·моль) |
| Молярный объём | 9,2 см³/моль |
| Теплопроводность (при 300 K) | 116 Вт/(м·К) |
| Электропроводность в твердой фазе | 17х106 См/м |
| Сверхпроводимость при температуре | |
| Твёрдость | 2,5 по шкале Мооса |
| Структура решётки | гексагональная |
| Параметры решётки | a = 2,6648 Å, c = 4,9468 Å |
| Отношение c/a | 1,856 |
| Температура Дебая | 234 К |
Физические свойства цинка:
Химические свойства цинка. Взаимодействие цинка. Химические реакции с цинком:
Получение цинка:
Применение цинка:
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com
-




- карта сайта
- цинк атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле цинка
сколько электронов в атоме свойства металлические неметаллические термодинамические
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/tsink-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Цинк — общая характеристика элемента, химические свойства цинка и его соединений
 Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
В четвертом периоде цинк является последним d-элементом, его валентные электроны 3d104s2. В образовании химических связей участвуют только электроны внешнего энергетического уровня, поскольку конфигурация d10 является очень устойчивой. В соединениях для цинка характерна степень окисления +2.
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
- Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка: - 2Zn + O2 → 2ZnO.
- При поджигании энергично реагирует с серой:
Zn + S → ZnS. - С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
Zn + Cl2 → ZnCl2. - При действии паров фосфора на цинк образуются фосфиды:
Zn + 2P → ZnP2 или 3Zn + 2P → Zn3P2. - С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
- Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода: - Zn + H2O → ZnO + H2.
- Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот: - Zn + 2HCl → ZnCl2 + H2;
Zn + H2SO4 → ZnSO4 + H2.
- Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O. - Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O;
Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O - Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов: - Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
- при сплавлении образует цинкаты:
Zn + 2KOH → K2ZnO2 + H2. - Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка: - 3Zn + 2NH3 → Zn3N2 + 3H2;
- Zn + 4NH3 + 2H2O → [Zn(NH3)4](OH)2 + H2.
- Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов: - Zn + CuSO4 → Cu + ZnSO4;
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn + CuO → Cu + ZnO.
Оксид цинка (II) ZnO – белые кристаллы, при нагревании приобретают желтую окраску. Плотность 5,7 г/см3, температура возгонки 1800°С. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO + C → Zn + CO;
ZnO + CO → Zn + CO2;
ZnO + H2 → Zn + H2O.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl → ZnCl2 + H2O;
ZnO + 2NaOH + H2O → Na2[Zn(OH)4].
При сплавлении с оксидами металлов образует цинкаты:
ZnO + CoO → CoZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 → Zn2SiO4,
ZnO + B2O3 → Zn(BO2)2.
Гидроксид цинка (II) Zn(OH)2 – бесцветное кристаллическое или аморфное вещество. Плотность 3,05 г/см3, при температуре выше 125°С разлагается:
Zn(OH)2 → ZnO + H2O.
- Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]; - также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2. - Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl.
Источник: http://himege.ru/cink-obshhaya-xarakteristika-elementa-ximicheskie-svojstva-cinka-i-ego-soedinenij/
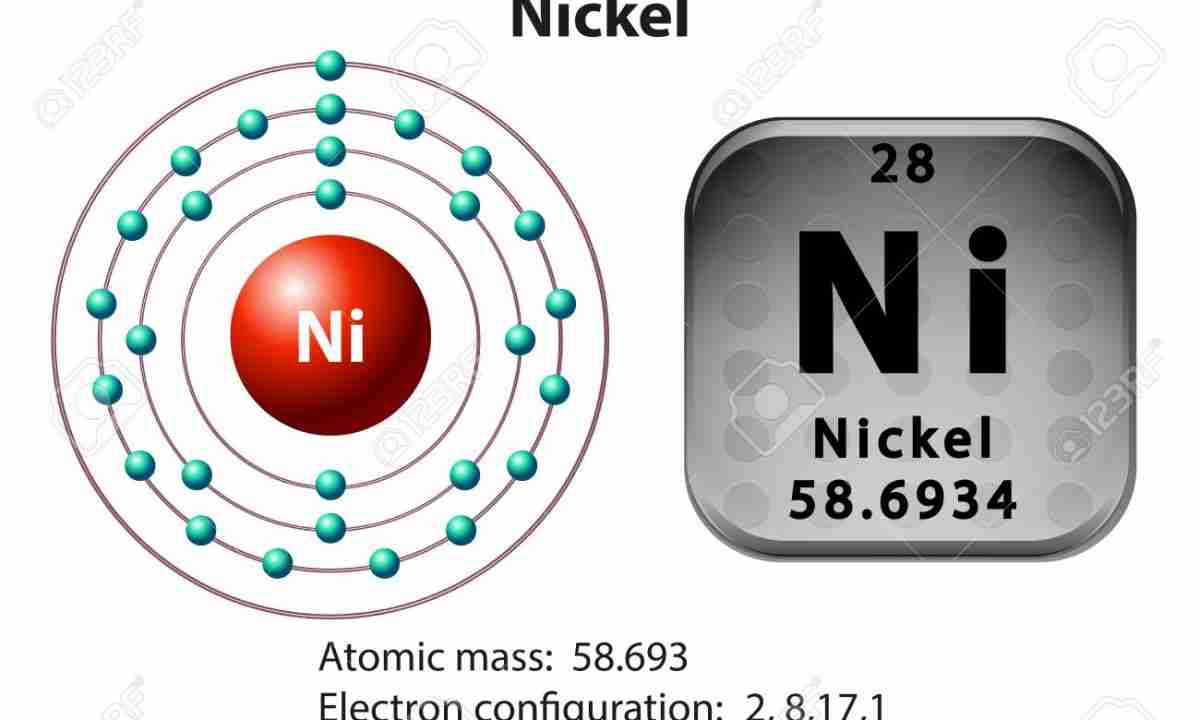
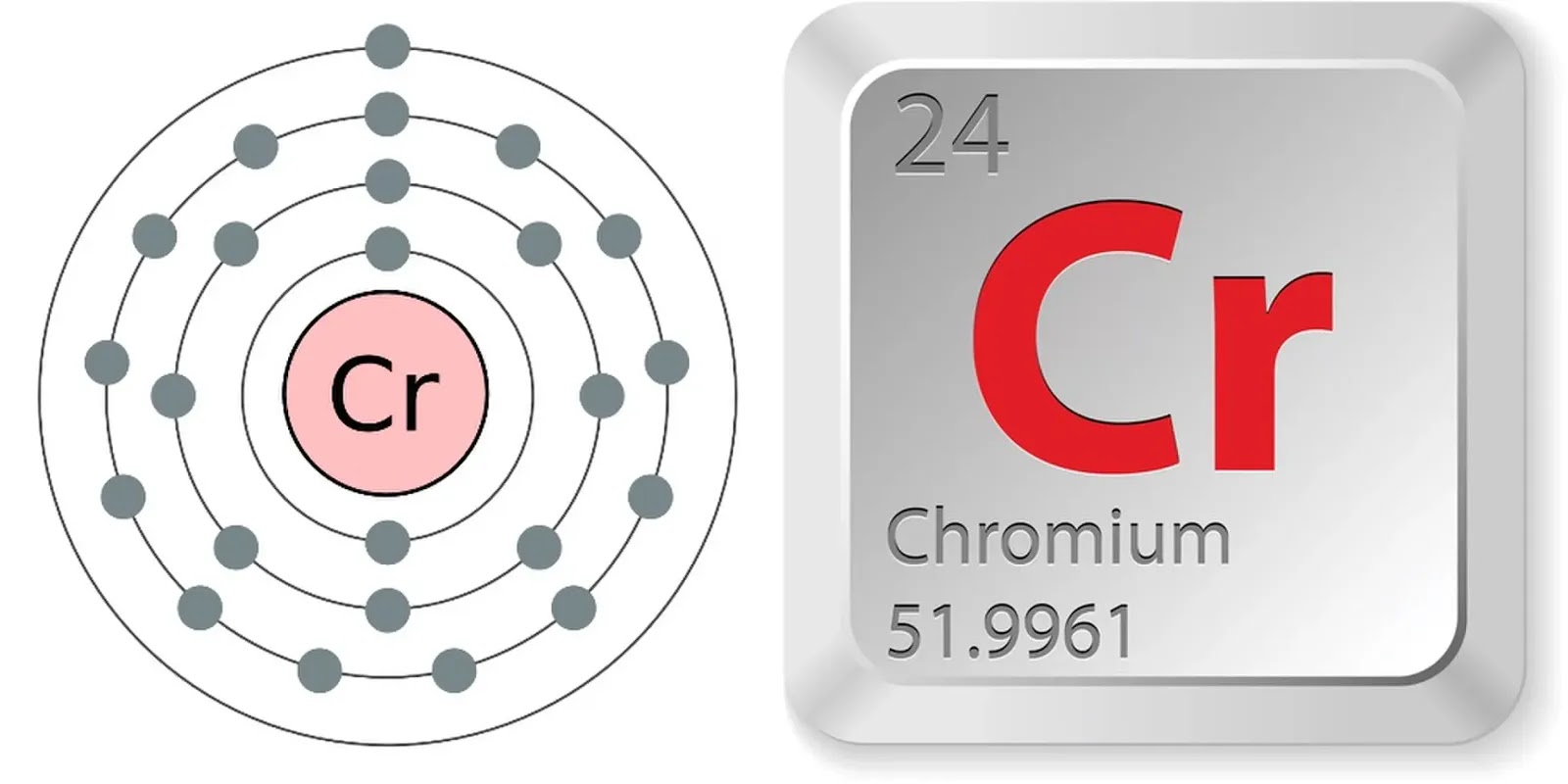
Общая характеристика меди, цинка, хрома, железа
Кодификатор ЕГЭ. Раздел 1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
У атомов переходных элементов (меди, цинка, хрома и железа) происходит заполнение энергетического d-подуровня.
Рассмотрим строение электронной оболочки этих элементов. У атомов цинка и железа заполнение электронной оболочки происходит согласно энергетическому ряду орбиталей (подуровней), который рассмотрен в статье Строение атома. Электронная конфигурация атома железа:
- +26Fe [Ar]3d64s2 [Ar] 4s 3d
- У атома цинка на происходит полное заполнение 3d-подуровня:
- +30Zn [Ar]3d104s2 [Ar] 4s 3d
У атомов хрома и меди наблюдается «проскок» или «провал» электрона, когда один электрон переходит с более энергетически выгодного 4s-подуровня на менее выгодный 3d-подуровень.
Этот переход обусловлен тем, что в результате образуются более устойчивые электронные конфигурации (3d5 у атома хрома и 3d10 у атома меди).
Дело в том, что энергетически более выгодно, когда d-орбиталь заполнена наполовину или полностью.
| Элемент | Электронная конфигурация валентной зоны | |
| Теоретическая | Реальная | |
| Медь +29Cu | [Ar]3d94s2 | [Ar]3d104s1 [Ar] 4s 3d |
| Хром +24Cr | [Ar]3d44s2 | [Ar]3d54s1 [Ar] 4s 3d |
Мы используем, конечно же, реальную электронную конфигурацию меди и хрома, теоретическая будет неверной.
Обратите внимание! У всех 3d-элементов внешним энергетическим уровнем считается четвертый уровень и 4s-подуровень. При образовании катионов атомы металлов отдают электроны с внешнего энергетического уровня.
| Атом | Электронная конфигурация | Характерные валентности | Число электронов на внешнем энергетическом уровне | Характерные степени окисления |
| Хром | [Ar]3d54s1 | II, III. VI | 1 | +2, +3, +6 |
| Железо | [Ar]3d64s2 | II, III. VI | 2 | +2, +3, +6 |
| Медь | [Ar]3d104s1 | I, II | 1 | +1, +2 |
| Цинк | [Ar]3d104s2 | II | 2 | +2 |
Рассмотрим характеристики хрома, железа, меди и цинка:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность,г/см3 |
| Хром | 51,996 | +24 | 1,66 | 0,130 | 652,4 | 1856,9 | 7,19 |
| Железо | 55.845 | +26 | 1.83 | 0,126 | 759,1 | 1538,85 | 7,874 |
| Медь | 63,546 | +29 | 1,90 | 0,128 | 745,0 | 1083,4 | 8,92 |
| Цинк | 65,38 | +30 | 1,65 | 0,138 | 905,8 | 419,6 | 7,133 |
Свойства соединений железа, меди, цинка и хрома.
Для хрома характерны степени окисления +2, +3 и +6. Оксид и гидроксид хрома (II) (CrO и Cr(OH)2) проявляют основные свойства. Степени окисления +3 соответствуют амфотерные оксид и гидроксид: Cr2O3 и Cr(OH)3 соответственно.
Соединения хрома +6 проявляют сильные кислотные свойства: оксид CrO3 и сразу две сильных кислоты: хромовая H2CrO4 и дихромовая H2Cr2O7.
Соединения хрома (II) проявляют сильные восстановительные свойства, соединения хрома (VI) проявляют только сильные окислительные свойства.
Характерные степени окисления железа: +2 и +3. Оксид и гидроксид железа (II) — основные (FeO и Fe(OH)2), а соединения железа (III) проявляют амфотерные свойства (Cr2O3 и Cr(OH)3 соответственно) с преобладанием основных. Соединения железа (II) проявляют также восстановительные свойства.
Для меди характерны степени окисления +1 и +2. Оксид меди (I) CuO и гидроксид меди (I) CuOH — основные. Оксид и гидроксид меди (II) проявляют амфотерные свойства с преобладанием основных: CuO и Cu(OH)2.
Характерная степень окисления цинка +2. Соединения цинка (II) проявляют амфотерные свойства: ZnO и Zn(OH)2.
| Элемент | Степень окисления | Тип и формула оксида | Тип и формула гидроксида | Окислительно-восстановительные свойства |
| Хром | +2 | CrO, основный | Cr(OH)2, основание | восстановитель, слабый окислитель |
| +3 | Cr2O3, амфотерный | Cr(OH)3, амфотерный гидроксид | окислитель и восстановитель | |
| +6 | CrO3, кислотный | H2CrO4 и H2Cr2O7, кислоты | окислитель | |
| Железо | +2 | FeO, основный | Fe(OH)2, основание | восстановитель и слабый окислитель |
| +3 | Fe2O3, амфотерный | Fe(OH)3, амфотерный гидроксид | окислитель, очень слабый восстановитель | |
| Медь | +1 | Cu2O, основный | CuOH, основание | восстановитель и слабый окислитель |
| +2 | CuO, основный | Cu(OH)2, основание | окислитель | |
| Цинк | +2 | ZnO, амфотерный | Zn(OH)2, амфотерный гидроксид | слабый окислитель |
Источник: https://chemege.ru/cu-zn-cr-fe/




