- ВАРИАНТ 1
- Часть А. Тестовые задания с выбором одного правильного ответа
- А1. В порядке усиления металлических свойств химические элементы расположены в ряду
- 1) Na — К — Сu — Rb .
- 2) Mg — Са — Sr — Rb
- 3) Аl — Mg — Na — Li .
- 4) Ca — К — Rb — Sr
- A2. Наиболее активному металлу соответствует электронная конфигурация его атомов
- 1) 1s22s22p63s1 .
- 2) 1s22s22p63s2 .
- 3) 1s22s22p63s23p1
- 4) 1s22s22p6Ss2Sp64s1
- А3. Восстановительные свойства металлов уменьшаются в ряду
- 1) Сu — К — Na .
- 2) Al — Mg — Be
- 3) Mg — Са — Sr .
- 4) К — Са — Mg
- A4. Макро- и микроэлементами соответственно являются металлы
- 1) натрий и цинк .
- 2) железо и медь
- 3) магний и кальций .
- 4) кобальт и молибден
- А5. К числу наиболее пластичных относятся оба металла
- 1) медь и цинк .
- 2) золото и хром
- 3) кальций и ртут.
- 4) калий и магний
- А6. С кислородом непосредственно не взаимодействует
- 1) никель
- 2) серебро
- 3) ртуть
- 4) цинк
- А7. С разбавленной серной кислотой взаимодействует каждый из трёх металлов
- 1) цинк, магний, медь
- 2) алюминий, марганец, никель
- 3) алюминий, ртуть, хром
- 4) магний, серебро, висмут
- А8. Цинк вытесняет металл из растворов обеих солей
![]()
А9. Какие из утверждений о металлах и их свойствах верны?
А. В природе все металлы встречаются в самородном состоянии.
Б. Металлы характеризуются низкими значениями электроотрицательности.
- 1) верно только .
- 2) верно только .
- 3) верны оба суждения
- 4) неверны оба суждения
А10. Натрий массой 0,92 г полностью прореагировал с водой. Объём (н. у.) газа, выделившегося в результате реакции, составил
- 1) 0,224 л
- 2) 0,448 л
- 3) 0,672 л
- 4) 0,896 л
- Часть В. Тестовые задания с выбором трёх правильных ответов (В1) и на соответствие (В2 и В3)
- В1. Водород выделяется в результате взаимодействия между
- 1) магнием и хлороводородной кислотой
- 2) цинком и раствором гидроксида калия
- 3) алюминием и разбавленной серной кислотой
- 4) медью и разбавленной азотной кислотой
- 5) серебром и концентрированной серной кислотой
- 6) железом и концентрированной азотной кислотой
В2. Установите соответствие между реагирующими веществами и газообразным продуктом, который преимущественно выделяется в результате их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА  |
ГАЗООБРАЗНЫЙ ПРОДУКТ |
В3. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
СХЕМА РЕАКЦИИ 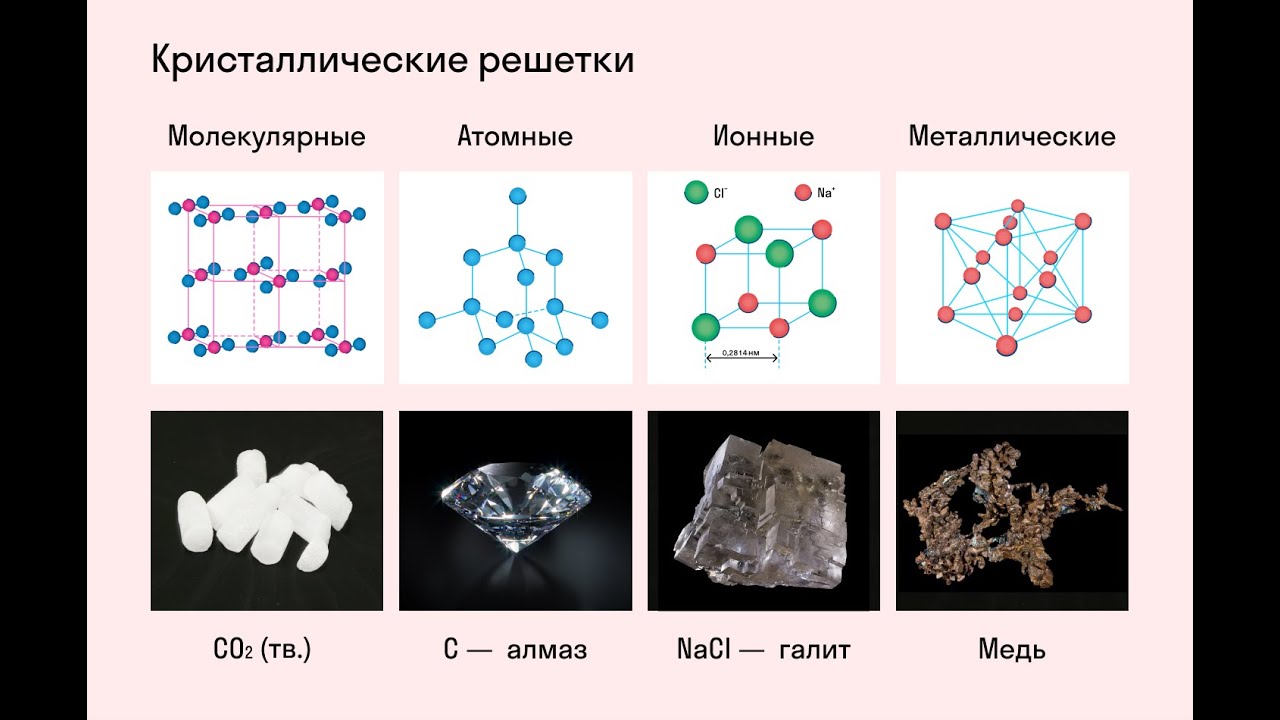 |
ФОРМУЛА НЕДОСТАЮЩЕГО ВЕЩЕСТВА |
Часть С. Задания с развёрнутым ответом
С1. Составьте уравнения реакций в соответствии со схемой: ![]() А, Б и В — сложные вещества, содержащие медь в степени окисления +2. А и Г хорошо растворяются в воде, Б и В в воде не растворяются.
А, Б и В — сложные вещества, содержащие медь в степени окисления +2. А и Г хорошо растворяются в воде, Б и В в воде не растворяются.
С2. Железную пластинку массой 20 г поместили в 16%-й раствор сульфата меди (II) объёмом 200 мл с плотностью 1,18 г/мл. Через некоторое время пластинку вынули из раствора, просушили и взвесили. Масса пластинки оказалась равной 21,6 г. Определите массовые доли солей в полученном растворе.
- ВАРИАНТ 2
- Часть А. Тестовые задания с выбором одного правильного ответа
- А1. Только металлы расположены в ряду
- 1) Р, As, Sb, Bi .
- 2) Ti, Mn, Co, Po
- 3) Se, Cr, S, О .
- 4) Sn, Ge, S, C
- A2. Наименее активному металлу соответствует электронная конфигурация его атомов
- 1) 1s22s22p63s1 .
- 2) 1s22s22p63s2 .
- 3) 1s22s22p63s23p1
- 4) 1s22s22p63s23p64s1
- А3. Восстановительные свойства металлов увеличиваются в ряду
- 1) Mg — Са — Zn .
- 2) Аl — Mg — Be
- 3) Са — К — Rb .
- 4) Li — Na — Mg
- A4. Макро- и микроэлементами соответственно являются металлы
- 1) кобальт и магний
- 2) цинк и хром
- 3) кальций и мед.
- 4) молибден и железо
- А5. Наибольшей электропроводностью обладают оба металла группы
- 1) марганец и цинк
- 2) золото и ртуть
- 3) свинец и алюмини.
- 4) медь и серебро
- А6. С серой при комнатной температуре взаимодействует
- 1) железо
- 2) цинк
- 3) ртуть
- 4) магний
- А7. И медь, и цинк способны вступать во взаимодействие с
- 1) разбавленной соляной кислотой
- 2) концентрированной серной кислотой
- 3) раствором гидроксида натрия
- 4) раствором хлорида железа (II)
- А8. Железо вытесняет металл из растворов обеих солей, содержащихся в группе
- 1) хлорида цинка и сульфата хрома (II)
- 2) сульфата меди (II) и бромида магния
- 3) сульфата олова (II) и нитрата серебра
- 4) нитрата свинца (II) и хлорида марганца (II)
А9. Какие из утверждений о металлах и их свойствах верны?
А. Атомы всех металлов содержат на внешнем электронном слое 1—3 электрона.
Б. Все металлы взаимодействуют с кислородом при комнатной температуре.
- 1) верно только .
- 2) верно только .
- 3) верны оба суждения
- 4) неверны оба суждения
А10. Смесь алюминиевой и медной стружки массой 20 г обработали избытком раствора щёлочи. В результате реакции выделилось 6,72 л (н. у.) газа. Массовая доля меди в смеси равна
- 1) 73%
- 2) 27%
- 3) 40,5% .
- 4) 59,5%
- Часть В. Тестовые задания с выбором трёх правильных ответов (В1) и на соответствие (В2 и В3)
- В1. Водород не выделяется в результате взаимодействия между
- 1) железом и разбавленной азотной кислотой
- 2) марганцем и разбавленной серной кислотой
- 3) алюминием и раствором гидроксида калия
- 4) медью и концентрированной азотной кислотой
- 5) цинком и водой
- 6) магнием и концентрированной серной кислотой
В2. Установите соответствие между реагирующими веществами и газообразным продуктом, который преимущественно выделяется в результате их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА  |
ГАЗООБРАЗНЫЙ ПРОДУКТ |
В3. Установите соответствие между формулой оксида металла и его типом.
| ФОРМУЛА ОКСИДА |
|
Часть С. Задания с развёрнутым ответом
С1. Составьте уравнения реакций в соответствии со схемой: ![]() А, Б и В — сложные вещества, содержащие цинк. Б хорошо растворяется в воде, А и В в воде не растворяются.
А, Б и В — сложные вещества, содержащие цинк. Б хорошо растворяется в воде, А и В в воде не растворяются.
С2. Медную пластинку массой 10 г поместили в 15%-й раствор нитрата серебра объёмом 49,75 мл с плотностью 1,139 г/мл. Через некоторое время пластинку вынули из раствора, просушили и взвесили. Масса пластинки оказалась равной 10,76 г. Определите массовые доли солей в полученном растворе и массу выделившегося серебра.
Источник: https://compendium.su/chemistry/11control/11.html
Общая характеристика металлов побочных подгрупп (d -металлов)
Все элементы побочных подгрупп ПСЭ относятся к электронному семейству d-элементови являются металлами.
Находясь только в больших периодах (IV, V, VI), d-элементы образуют «вставные декады» (по 10 элементов) между s- и р- элементами, поэтому имеют общее название — переходные элементы.
Кроме этих 30 d-элементов, имеющих стабильные изотопы, искусственно синтезированы несколько радиоактивных d- элементов, занимающих свои места внезавершенном VII периоде.
В атомах d-элементов содержится от 1 до 10 электронов на d-подуровне предвнешнего электронного слоя и 2 (или 1 в случае проскока е-) электрона на s-подуровне внешнего электронного слоя. Общая формула электронной конфигурации валентных подуровней в атомах d -элементов.

Сравнение d -металлов с щел. Me и щел.-зем. Me
В каждом большом периоде d-элементы располагаются после двух s-элементов, которые являются щелочным и щелочноземельным металлами:
| Щелочные металлы | Щелочно-земельные металлы | d-металлы |
| Радиусы атомов уменьшаются | ||
| Заряды ядер атомов увеличиваются |
Поэтому d-металлы являются менее активными, чем щелочные и щелочноземельные металлы.
Возможные валентности и степени окисления
Вотличие от щелочных и щелочноземельных Me, большинство d-металлов имеют переменную валентность и переменную степень окисления. Это объясняется тем, что валентными в атомах d-элементовявляются не только s-электроны внешнего слоя, но и все или некоторые d -электроны предвнешнего слоя.
Положение в ПСЭ. Электронное строение атомов
Для d-металлов III — VII групп высшая Ви высшая С.О. равны номеру группы, т. е. суммарному числу е- на (n -1)d и ns-подуровнях; например у d -элементов четвертого периода:
| № группы | III | IV | V | VI | VII |
| Элемент | Sc | Ti | V | Cr | Mn |
| Электронная конфигурация | 3d14s2 | 3d24s2 | 3d34s2 | 3d54s2 | 3d54s2 |
| Высшая валентность | III | IV | V | VI | VII |
| Высшая степень окисления | +3 | +4 | +5 | +6 | +7 |
Для d-металлов VIII группы высшая В и высшая с о., как правило, меньше суммарного числа е- на (n — 1)d и ns -подуровнях;
например:
| № группы | VIII | ||
| Элемент | Fe | Co | Ni |
| Электронная конфигурация | 3d64s2 | 3d74s2 | 3d84s2 |
| Высшая валентность | VI | III | III |
| Высшая степень окисления | +6 | +3 | +3 |
d-Металлы II группы, атомы которых имеют завершенную структуру d-подуровня (n -1)d10, проявляют в своих соединениях постоянную В = II и постоянную с.о. = +2.
Наиболее характерными валентностями и степенями окисления для d-металлов I группы являются: Сu — II и +2; Ag — I и +1; Au — III и +3.
Способность к комплексообразованию
Важной особенностью атомов d-металлов является наличие свободных орбиталей (на (n — 1)d -, ns — образованию и nр-подуровнях), что позволяет им образовывать донорно-акцепторные (координационные) связи с различными донорами неподеленных электронных пар (молекулы NH3, Н2O, ионы ОН-, CN- и др.).
- Вследствие этого d-металлы образуют многочисленные и разнообразные комплексные соединения; например:
- [Co(NH3)6]CI3, K4[Fe(CN)6],
- Na2[Zn(OH)4), [Cr(H2O)6](NО3)3
В свободном состоянии d -металлы (как и вообще все металлы) являются восстановителями.
Восстановительная активность различных d — металлов изменяется в широких пределах: среди них есть металлы средней активности, находящиеся в ряду напряжений до водорода (Fe, Cr , Zn , Mn и др.
); малоактивные металлы (Сu, Нg и др.) и благородные металлы (Au , Pt и др.), располагающиеся в ряду напряжений после водорода.
Окислительно-восстановительные свойства d-металлов и их соединений
- Соединения d-элементов могут выполнять как восстановительные, так и окислительные функции. Соединения с невысокими степенями окисления являются восстановителями, а соединения с высокими степенями окисления — окислителями;
- например:
- MnSO4, FeCl2 , CrCl2 — восстановители
- КMnO4, K2FeO4, K2Cr2O7 — сильные окислители
Кислотно-основные свойства оксидов и гидроксидов d-металлов
При увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается:
| Me+12O | Me+2O | Me+32O3 | Me+4O2 | Me+52O5 | Me+6O3 | Me+72O7 |
| MeOH | Me(OH)2 | Me(OH)3H3MeO3(HMeO2) | Me(OH)4H4MeO4(H2MeO3) |
|
|
HMeO4 |
| основные свойства | амфотерные свойства | кислотные свойства |
Источник: http://examchemistry.com/content/lesson/neorgveshestva/dme.html
Тема 7.Свойства металлов и их соединений
7.1. Физические и химические свойства металлов. Получение металлов. Металлические сплавы и композиты
Из 107
известных к настоящему времени элементов
85 являются
металлами. Они составляют
I,
II,
III
группы
и побочные подгруппы
всех групп.
Кроме того, металлами
являются наиболее тяжелые элементы IV,
V,
VI,
VII
групп.
Следует отметить, что многие металлы
обладают амфотерными
свойствами
и могут вести себя как неметаллы.
Особенностью
строения атомов металлов является
небольшое число электронов во внешнем
электронном слое, не превышающее трех.
Атомы
металлов имеют, как правило, большие
атомные радиусы. В периодах наибольшие
атомные радиусы у щелочных металлов.
Они наиболее химически активны,
т.е. атомы металлов легко отдают электроны
и являются хорошими восстановителями,
лучшие восстановители — металлы I
и II
групп главных подгрупп.
Физические
свойства. Все металлы,
за исключением ртути, — твердые! вещества
с кристаллической структурой, поэтому
температура плавления их выше
нуля, только температура плавления
ртути -39°С. Наиболее тугоплавким металлом
является вольфрам, температура плавления
которого 3370°С.
Наиболее твердым
металлом является хром. Мягкие металлы
— натрий, калий — легко режутся ножом.
Металлы
более или менее пластичны (обладают
ковкостью).
Пластичность
металлов используется при их прокате;
при волочении, когда из
них вытягивают проволоку; при прессовании,
штамповке и т.д.
Все
металлы обладают более или менее ярко
выраженным блеском, который
принято называть металлическим.
Цвет
металлов довольно однообразен: он либо
серебристо-белый (алюминий,
серебро, никель), либо серебристо-серый
(железо, свинец). Только золото
желтого цвета, а медь — красного.
По
цвету металлы условно делят на черные
и цветные. К черным металлам относятся
железо и его сплавы, все остальные
металлы называются цветными.
Металлы характеризуются
высокой электро- и теплопроводностью.
Хорошая
электрическая проводимость металлов
объясняется присутствием
в них свободных электронов, которые под
влиянием даже небольшой
разности потенциалов приобретают
направленное движение от отрицательного
полюса к положительному.
Металлы
проявляют
магнитные своиcтва.
Хорошо намагничиваются железо,
кобальт, никель и их сплавы. Такие металлы
и сплавы называют ферромагнитными.
Все
металлы нерастворимы в воде, но зато
растворимы друг в друге в расплавах.
По
плотности металлы разделяются на тяжелые
и легкие. Тяжелыми считают
те, плотность которых больше 3 г/см3.
Самым тяжелом металлом является осмий.
Наиболее легкие металлы — литий, натрий,
калий — имеют плотность
меньше единицы. Широкое применение в
промышленности получили легкие
металлы — магний и алюминий.
Химические
свойства металлов
Атомы
металлов сравнительно легко отдают
валентные электроны и переходят в
положительно заряженные ионы. Поэтому
металлы являются восстановителями.
В
этом и состоит их главное и наиболее
общее химическое
свойство.
Металлы
как восстановители вступают в реакции
с различными окислителями
— кислотами, солями менее активных
металлов и некоторыми другими
соединениями.
Соединения
металлов с галогенами называются
галогенидами, с серой — сульфидами, с
азотом — нитридами, с фосфором — фосфидами,
с углеродом — карбидами, с кремнием —
силицидами, с бором — боридами, с водородом
— гидридами
и т.д.
Многие из этих соединений нашли
важное применение в новой
технике. Например, бориды металлов
используют в радиоэлектронике, а
также в ядерной технике в качестве
материалов для регулирования нейтронного
излучения и защиты от него.
Взаимодействие
металлов с кислотами является
окислительно-восстановительным
процессом. Окислителем является ион
водорода, который принимает
электрон от металла:
- Взаимодействие
металлов с водными растворами солей
менее активных металлов
можно иллюстрировать примером: - 0 +2 +2 0
- Zn
+ CuSO4
= ZnSO4
+ Сu - В
этом случае происходит отрыв электронов
от атомов более активного металла
(Zn)
и присоединение их ионами менее активного
(Сu2+). - Активные
металлы взаимодействуют с водой, которая
выступает в ролиокислителя.
Например: Na
– e-
=
Na+ 2 - 2H2O
+ 2e-
=
H2
+ 2OH- 1 - 2Na
+ 2H2O
= 2Na+
2OH-
+ H2↑ - Металлы,
гидроксиды которых амфотерны, как
правило, взаимодействуют с
растворами и кислот, и щелочей. Например:
Таким
образом, отношение металлов к неметаллам,
кислотам, растворам солей менее активных
металлов, к воде и щелочам подтверждает
их главное химическое
свойство — восстановительную способность.
Металлы
могут образовывать химические соединения
между собой. Они имеют
общее название — интерметаллические
соединения, или
интерметалл
иды. Примером
могут служить соединения некоторых
металлов с сурьмой:
Na2Sb,
Ca3Sb2,
NiSb,
Ni4Sb,
FeSbx
(x
= 0,72 … 0,92). В них чаще всего
не соблюдаются степени окисления,
характерные в соединениях с неметаллами.
Химическая
связь в интерметаллидах преимущественно
металлическая. По внешнему виду они
похожи на металлы. Твердость интерметаллидов,
как правило,
выше, а пластичность намного ниже, чем
у образующих их металлов. Многие
интерметаплиды нашли практическое
применение. Например, сурьма-алюминий
AlSb;
сурьма-индий InSb
и другие широко используют как
полупроводники.
Металлы
встречаются в природе как в свободном
состоянии (самородные металлы),
так и в виде химических соединений.
В
виде самородных металлов находятся
наименее активные металлы. Типичными
их представителями являются золото и
платина. Серебро, медь, ртуть, олово
могут находиться в природе как в
самородном состоянии, так и в виде
соединений, все остальные металлы
(стоящие в ряду стандартных электродных
потенциалов до олова) — только в виде
соединений с другими элементами.
Минералы
и горные породы, содержащие металлы или
их соединения и пригодные
для промышленного получения металлов,
называются рудами.
Важнейшими
рудами металлов являются их оксиды и
соли (сульфиды, сульфаты,
карбонаты и др.). Если руды содержат
соединения двух или нескольких металлов,
то они называются полиметаллическими
(например, медно-цинковые, свинцово-серебряные
и др.).
Современная
металлургия получает более 75 металлов
и многочисленные сплавы
на их основе. В зависимости от способов
получения металлов различают
пиро-, гидро- и электрометаллургию.
Пирометаллургия
занимает
ведущее место в металлургии. Она
охватывает
способы получения металлов из руд с
помощью реакций восстановления,
проводимых при высоких температурах.
В качестве восстановителей
применяют уголь, активные металлы, оксид
углерода (II),
водород, метан. Так, например, уголь и
оксид углерода (II)
восстанавливают медь из красной медной
руды (куприта) Си2О:
- Cu2O
+ С = 2Cu
+ СО - Cu2O
+ СО = 2Cu
+ СО2 - Если
руда является сульфидом металла, ее
предварительно переводят в
оксид путем окислительного обжига
(обжиг с доступом воздуха), например - 2ZnS
+ ЗО2
= 2ZnO
+ 2SO2 - Затем оксид металла
восстанавливают углем: - ZnO
+ С = Zn
+ CO - Восстановление
углем (коксом) проводят обычно в тех
случаях, когда получаемые
металлы совсем не образуют карбидов
или образуют непрочные карбиды
(соединения с углеродом); таковы железо
и многие цветные металлы
— медь, цинк, кадмий, германий, олово,
свинец и др.
Восстановление
металлов из их соединений другими
металлами, химически
более активными, называются металлотермией.
Эти
процессы протекают
тоже при высоких температурах. В качестве
восстановителей используют
алюминий, магний, кальций, натрий, а
также кремний. Если восстановителем
является алюминий, то процесс называется
алюминотермией, если магний
— мапнийтермией. Например:
Cr2O3+2AI
= 2Cr
+ AI2O3
TiCI4
+2Mg
= Ti
+ 2MgCI2
Металлотермией
обычно получают те металлы (и их сплавы),
которые при
восстановлении их оксидов углем образуют
карбиды. Это — марганец, хром,
титан, молибден, вольфрам и др.
- Иногда
металлы восстанавливают из оксидов
водородом (водоро-дотермия).
Например: - МоО3+ЗН2
= Мо + ЗН2О - WO3
+ ЗН2
= W
+ ЗН2О - При этом получают
металлы большой чистоты.
Гидрометаллургия
охватывает
способы получения металлов из растворов
их солей. При этом металл, входящий в
состав руды, сначала переводят
в раствор с помощью водных растворов
подходящих реагентов, а затем
извлекают из этого раствора. Так,
например, при обработке разбавленной
серной кислотой медной руды, содержащей
оксид меди (II)
СиО, медь переходит
в раствор в виде сульфата;
- CuO
+ H2SO4
= CuSO4
+ Н2О - Затем
медь извлекают из раствора либо
электролизом, либо вытеснением с
помощью порошка железа: - CuSO4
+ Fe
= Сu
+ FeSO4
В
настоящее время гидрометаллургическим
методом получают до 25% всей добываемой
меди. Он имеет большое будущее, так как
позволяет получать металлы,
не извлекая руду на поверхность.
Этим
же методом добывают золото* серебро,
цинк, кадмий, молибден,
уран
и др. Руду, содержащую самородное золото,
после измельчения
обрабатывают
раствором цианида калия KCN.
Всё золото переходит в раствор.
Из
раствора его извлекают электролизом
или вытеснением металлическим
цинком.
Электрометаллургия
охватывает
способы получения металлов с помощью
электролиза. Этими способами получают
главным образом легкие металлы
— алюминий, натрий и др. — из их расплавленных
оксидов или хлоридов.
Электролиз
используют также для очистки некоторых
металлов.
Сплавы
Для
металлов характерна способность
образовывать сплавы. Само название
сплав означает, что чаще всего сплавы
получают смешиванием металлов
в расплавленном состоянии. Сплав может
состоять из двух компонентов
и более, в том числе и»неметаллов. Металлы
в сплавах могут растворяться
друг в друге, вступать друг с другом в
соединения и образовывать обычные
механические смеси.
В
настоящее время некоторые сплавы готовят
методом порошковой
металлургии.
Берется
смесь металлов в виде порошков, прессуется
под большим
давлением и спекается при высокой
температуре в восстановительной
среде. Таким путем получают сверхтвердые
сплавы.
В
состав некоторых сплавов входят
неметаллы, например углерод, кремний,
бор и др.
В технике применяется
более 5000 сплавов.
Сталь
— это сплав железа с
небольшим содержанием углерода (до
1,7%) и с металлургическими примесями
(Мn,
Si,
S,
Р).Специальные стали содержат до 10
различных элементов. По сравнению с
чистым железом они обладают большой
твердостью.
Чугун
— сплав железа с
углеродом (более 2%), кремнием, марганцем,
фосфором
и серой. По сравнению с чистым железом
он очень тверд и хрупок.
В
технике сплавы на основе железа, т. е.
сталь, чугун, а также само железо,
называются черными
металлами, а все
остальные металлы —цветными.
Отсюда
и деление металлургии, получающей
металлы из руд, на черную
и цветную.
Бронза
— сплав меди с другими
элементами, в основном с металлами. В
зависимости от состава различают:
оловянную бронзу (состоит из меди и
олова), алюминиевую
бронзу (содержит до 5… 11% алюминия),
свинцовую (до 33% свинца), кремниевую (до
4% кремния) и др. Применяют для изготовления
частей машин и для художественных
отливок.
Латунь
— сплав меди с цинком
(до 30…35% цинка). Обладает высокой
пластичностью.
Используют для изготовления приборов,
деталей машин, предметов
домашнего обихода.
Баббиты
— сплавы, уменьшающие
трение, изготовляются на основе олова
или
свинца с добавками сурьмы, меди и других
металлов. Применяют для заливки
подшипников.
Нихром
— сплав никеля (67,5%),
хрома (15%), железа (16%) и марганца (1,5%)
обладает большим электрическим
сопротивлением и жаропрочностью, поэтому
применяется для изготовления электрических
нагревательных приборов.
Дуралюмин
— сплав алюминия (95%),
магния, меди и марганца. Очень легкий и
прочный сплав. По прочности он равен
стали, но в 3 раза легче ее. Применяется
в самолетостроении. Легкие сплавы на
основе титана сохраняют прочность
и коррозионную устойчивость при
повышенных температуре и давлении.
Из
них изготовляют
отдельные части реактивных двигателей.
Источник: https://studfile.net/preview/5582830/page:20/
ЕГЭ. Химические свойства металлов
- 1) Реагируют с кислородом (подробнее)
- Все Щ металлы, кроме Li, образуют не оксиды, а пероксиды:
- 2Li + O2 → 2Li2O
- 2Na + O2 → Na2O2
- Оксиды получают взаимодействием пероксидов с металлом:
- Na2O2 + 2Na → 2Na2O
- 2) Реагируют с водородом (подробнее)
- 3) Реагируют с водой (подробнее)
- 4) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
- 3Mg + 2P → Mg3P2 (t)
- 2Na + Cl2 → 2NaCl
- Ca + 2C → CaC2 (t)
- 5) Реагируют с некоторыми кислотными оксидами:
- CO2 + 2Mg → 2MgO + C
- SiO2 + 2Mg → 2MgO + Si SiO2 + 2Ca → 2CaO + Si SiO2 + 2Ba → 2BaO + Si
- 6) Магний как восстановитель используется в производстве кремния и некоторых металлов:
- 2Mg + TiCl4 → 2MgCl2 + Ti (t)
- 7) Реакции Щ и ЩЗ металлов с растворами солей или кислот не рассматриваются, так как эти металлы очень бурно взаимодействуют с водой, и суммарная реакция изменится.
2. Алюминий
- 1) Реагирует с кислородом: 4Al + 3O2 → 2Al2O3
- 2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
- 3) Реагирует с водой, если удалить оксидную пленку:
- 2Al + 6H2O → 2Al(OH)3 + 3H2
- 4) Реагирует с щелочами с выделением водорода (также Be и Zn):
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
- 5) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
- 2Al + 3Cl2 → 2AlCl3
- 4Al + 3C → Al4C3
- 2Al + N2 → 2AlN (t)
- 6) Используется для восстановления менее активных металлов (алюмотермия):
- 3FeO + 2Al → 3Fe + Al2O3 Cr2O3 + 2Al → 2Cr + Al2O3
- 7) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
- Al + H2SO4 (р) → Al2(SO4)3 + H2
- 8) Вытесняет менее активные металлы из их солей:
- 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
9) На холоде пассивируется концентрированными растворами серной и азотной кислот. При нагревании реагирует без выделения водорода.
3. Железо
- 1) Реагирует с кислородом:
- 3Fe + 2O2 → Fe3O4 (железная окалина)
- В присутствии воды образуется ржавчина: 4Fe + 3O2 + 6H2O → 4Fe(OH)3
- 2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
- Fe + H2 → реакция не идет
- 3) Реагирует с парами воды с образованием оксида:
- 3Fe + 4H2O → Fe3O4 + 4H2 (t)
- 4) Не реагирует с щелочами
- Fe + NaOH → реакция не идет
- 5) Реагирует с кислородом, серой, галогенами при нагревании:
- 2Fe + 3F2 → 2FeF3 (образуется соль Fe+3)
- 2Fe + 3Cl2 → 2FeCl3 (образуется соль Fe+3)
- 2Fe + 3Br2 → 2FeBr3 (образуется соль Fe+3)
- Fe + I2 → FeI2 (образуется соль Fe+2)
- Fe + S → FeS
- 6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
- Fe + H2SO4 (р) → FeSO4 + H2 (образуется соль Fe+2)
- Fe + 2HCl → FeCl2 + H2
- 7) Вытесняет менее активные металлы из их солей:
- Fe + CuSO4 → FeSO4 + Cu (образуется соль Fe+2)
8) На холодe пассивируется концентрированными растворами серной и азотной кислот (т.е. реакция не протекает). При нагревании реагирует без выделения водорода:
- Fe + 6HNO3(к) → Fe(NO3)3 + 3NO2 + 3H2O (образуется соль Fe+3)
- 2Fe + 6H2SO4(к) → Fe2(SO4)3 + 3SO2 + 6H2O (образуется соль Fe+3)
- 9) Соединения Fe+3 реагируют с железом, медью, восстанавливаясь до Fe+2:
- 2FeCl3 + Fe → 3FeCl2
- Fe3O4 + Fe → 4FeO
- Fe2O3 + Fe → 3FeO
4. Хром
- 1) Реагирует с кислородом:
- 4Cr + 3O2 → 2Cr2O3
- 2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
- Cr + H2 → реакция не идет
- 3) Реагирует с парами воды с образованием оксида:
- 2Cr + 3H2O → Cr2O3 + 3H2 (t)
- 4) Не реагирует с щелочами
- Cr + NaOH → реакция не идет
- 5) Реагирует с кислородом, серой, галогенами при нагревании:
- 2Cr + 3Cl2 → 2CrCl3 (образуется соль Fe+3)
- 2Cr + 3Br2 → 2CrBr3 (образуется соль Fe+3)
- Cr + S → Cr2S3 (образуется соль Fe+3)
- 6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
- Cr + H2SO4 (р) → CrSO4 + H2 (образуется соль Cr+2)
- Cr + 2HCl → CrCl2 + H2 (образуется соль Cr+2)
7) Пассивируется концентрированным и разбавленным растворами азотной кислоты (т.е. реакция не протекает).
5. Медь
- 1) Реагирует с кислородом:
- 2Cu + O2 → 2CuO
- 2) Реагирует с соединениями Cu+2 с образованием промежуточной степени окисления +1:
- CuO + Cu → Cu2O
- CuCl2 + Cu → 2CuCl
- 3) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
- Cu + H2 → реакция не идет
- 4) Не реагирует с парами воды (так как находится в ряду напряжений после водорода):
- Cu + H2O → реакция не идет
- 5) Не реагирует с щелочами
- Cu + NaOH → реакция не идет
- 6) Реагирует с кислородом, серой, галогенами при нагревании:
- Cu + Cl2 → CuCl2 (образуется соль Cu+2)
- Cu + Br2 → CuBr2 (образуется соль Cu+2)
- 2Cu + I2 → 2CuI (образуется соль Cu+1)
- Cu + S → CuS (образуется соль Cu+2)
- 7) Не реагирует с N2, C, Si.
- 8) Не реагирует с кислотами-неокислителями, так как находится правее водорода в ряду напряжений:
- Cu + H2SO4(р) → реакция не идет.
- 9) Реагирует с кислотами-окислителями как слабый восстановитель:
- Cu + 4HNO3(к) → Cu(NO3)2 + 2NO2 + 2H2O
- 3Cu + 8HNO3(р) → 3Cu(NO3)2 + 2NO + 4H2O
- Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
7. Цинк
1) Реагирует с кислородом: 2Zn + O2 → 2ZnO
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с парами воды, т.е. при сильном нагревании, с образованием оксида:
- Zn + H2O → ZnO + H2
- 4) Реагирует с твердыми щелочами и растворами щелочей с выделением водорода (также Be и Al):
- Zn + 2NaOH(тв.) → Na2ZnO2 + H2 (t)
- Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
- 5) Реагируют с галогенами, серой при нагревании:
- Zn + Cl2 → ZnCl2
- Zn + S → ZnS
- 6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
- Zn + H2SO4 (р) → ZnSO4 + H2
- 8) Реагирует с кислотами-окислителями:
- 4Zn + 5H2SO4(к) → 4ZnSO4 + H2S + 4H2O
- Так как Zn находится примерно в центре ряда напряжений, то в реакциях с азотной кислотой могут образовываться разные продукты:
- Zn+4HNO3(к) → Zn(NO3)2 + 2NO2 + 2H2O
- 4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Источник: https://chemrise.ru/theory/lessons11/metals_11




