Вода — это необыкновенная субстанция, которая не перестает
нас удивлять. Она основной компонент планеты, вода необходима для жизни всего
живого. Люди могут выдержать без воды только несколько дней. Если не
восстановить вовремя ее потери в организме, это верная смерть. Поэтому важно
научиться разумно, тратить ее и знать, что же такое вода.
Химические названия
Почему же воду назвали водой? Слово «вода» происходит от
древнегерманского «мокрый, текучий». В химии могут встречаться разные названия
этого соединения. Самые распространенные – гидроксид водорода и окись водорода.
Также в химической литературе ее называют:
- монооксид дигидрофосфата;
- гидроксильная кислота;
- дигидромонооксид
- оксидан
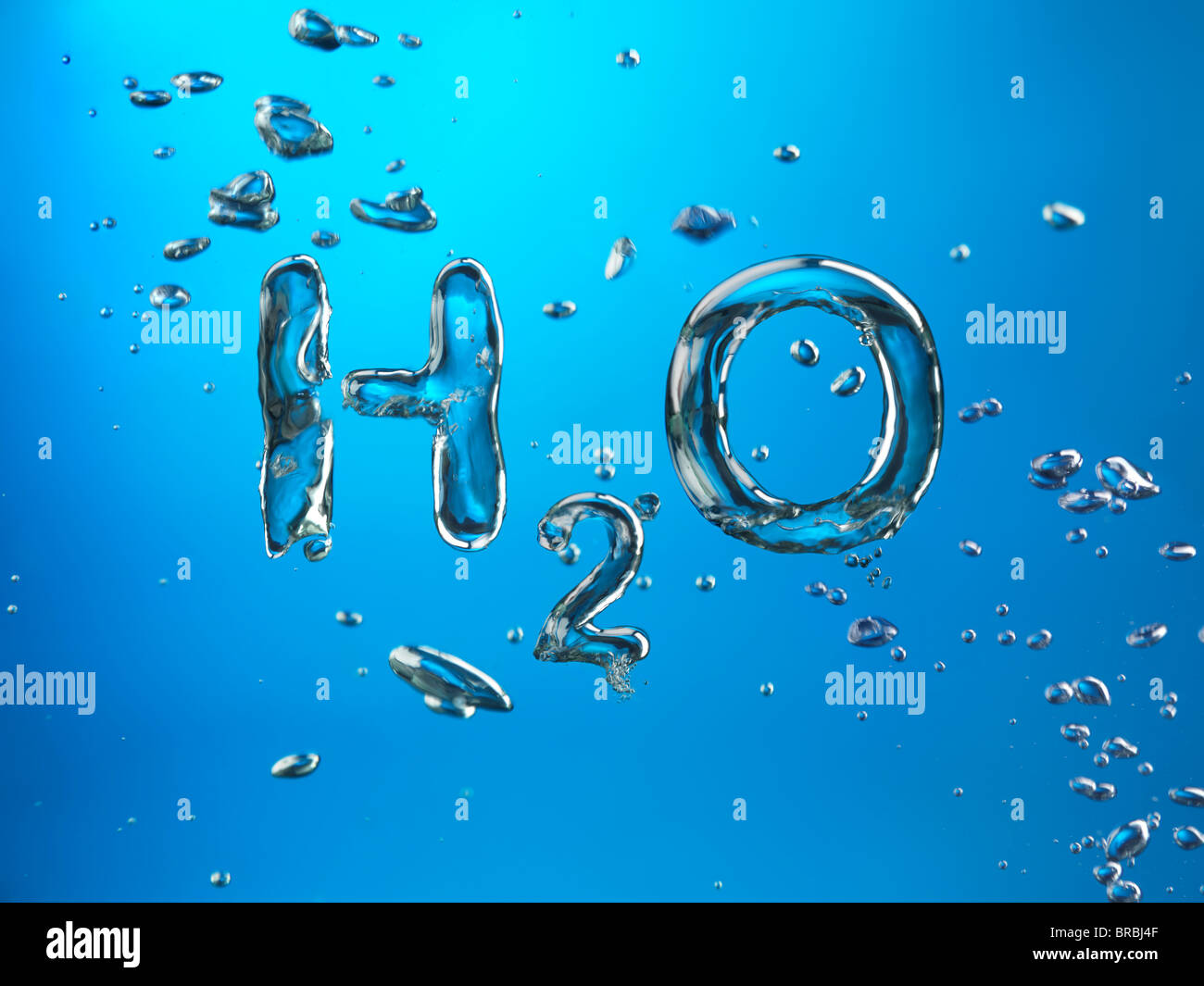
Образование воды
Многих интересует, какая вода находится в реках, морях, под
землей. Образовавшаяся миллиарды лет назад вода сконцентрировалась в океанах.
Из океанов она испаряется и поднимается, где образуются облака.
После долгого
путешествия она возвращается на землю в виде осадков. Вода собирается и
возвращается через реки обратно в море. Часть просачивается в почву и попадает
в грунтовые воды.
Там формируются новые источники, которые текут в море.
В более холодном климате вода остается на ледниках, которые
очень медленно, стекают к более низким высотам, где и тают. В полярных регионах
этот механизм скольжения настолько медленный, что в ледниках можно найти воду,
попавшую на поверхность Земли десятки тысяч лет назад. Вот откуда берется в
природе вода.
Свойства
Влияние воды на жизнь на земле огромное. Это среда обитания
для многих организмов. Она является хорошим растворителем не только для солей,
но и для многих других веществ. Например, питательные соли присутствуют в почве
в виде ионов, то есть в растворенном виде. Только в таком виде растения могут
поглощать их через корни. Поэтому не случайно вода— это источник жизни на
земле.
Вода является важным источником химических и биохимических
реакций, например, для фотосинтеза. Это заметно, когда растение увядает из-за
потери воды, а листья и цветы опадают. Не зря говорят, что вода—это главный
источник жизни.

Физические свойства
Что мы все знаем о воде? То, что она состоит из одного атома
кислорода и двух атомов водорода, знают все, а вот о том что они притягиваются,
друг к другу водородной мостиковой связью знают не все. Эта связь объясняет ее
основные свойства.
- Н2О имеет высокое поверхностное натяжение, то есть
тенденцию принимать сферический объем. - Другим свойством является капиллярность. Молекула H2O
способна перемещаться в очень узких пространствах. - Удельная теплоемкость у нее примерно в 4 раза больше,
чем у воздуха. Это определяет устойчивость к изменениям температуры. - Плотность воды увеличивается с понижением температуры,
примерно до 4 С. Ниже этого порога плотность уменьшается. - Она обладает минимальной вязкостью при высоких
давлениях. Поэтому, чем больше давление, тем легче ей проникать.
Агрегатные состояния
В нормальных условиях вода, является жидкостью. Это
единственное известное вещество, которое существует в природе во всех трех
классических состояниях материи: жидком, твердом, газообразном.
Кстати, термин вода используется для жидкого агрегатного
состояния. В твердом, то есть в замороженном состоянии, она называется льдом, в
газообразном состоянии— водяным паром или просто паром. Существует порог, где
при определенных температурах и равновесного давления три состояния могут
сосуществовать одновременно.

Оптические свойства
Когда свет пересекает границу раздела вода-воздух, полное
отражение происходит под углом 49 град. Это означает, что световые лучи,
попадающие на граничную поверхность, не излучаются из воды, а отражаются.
Преломление света приводит к оптическим иллюзиям. Поэтому
под водой объекты видятся не в том месте, где они находятся на самом деле. То
же самое происходит если смотреть через воду на воздух.
Светопропускная
ценность воды обеспечивает присутствие в ней водорослей и растений, которым
необходим свет для жизни.
Длинноволновый (красный) свет поглощается сильнее,
чем коротковолновый (синий) свет.
Изотопные модификации
Молекулы воды состоят из разных изотопов кислорода и
водорода, каждый из которых встречается в разных концентрациях. В определенных
процессах, таких как образование осадков и фазовые переходы, происходит
фракционирование изотопов, то есть Н2О меняет свой изотопный состав.
В
зависимости от условий окружающей среды и исходного состава это приводит к
определенным изотопным сигналам, которые могут выступать в качестве своего рода
отпечатка пальца для различных процессов и областей происхождения.
Эта
методология используется в гидрогеологии и палеоклиматологии.
Химические свойства
Вода амфотерна, в зависимости от окружающей среды, может
действовать как кислота и основание. В водных растворах сильные кислоты и
сильные основания полностью диссоциируют на ионы H 3 O + и O H.
Это называется
выравнивающим эффектом воды. Чтобы иметь возможность различать очень сильные
кислоты по кислотности, константы равновесия определяют в неводных растворах, и
переносят в растворитель воду.

Многих интересует, вода является органическим веществом или
неорганическим. С точки зрения химии, она относится к неорганическим веществам.
Поскольку, в органики должен присутствовать углерод, а в воде его нет.
Волновая функция основного состояния воды
Под водой скорость звука в 4,4 раза выше, чем у поверхности,
и составляет 1483 м /с при температуре 20 С. Поэтому пространственное
восприятие звука под водой сильно затруднено, мозг просто не успевает
обработать информацию.
Важно знать, что звук под водой не только проходит
быстрее, но также в большей степени чем в воздухе зависит от частоты.
Поэтому
глубокие частоты, такие как звуки больших морских двигателей, часто могут быть
услышаны драйверами на расстоянии нескольких километров.
В природе
Вода в природе везде. Реки и океаны, облака на небе, к этому
добавляются грунтовые воды и те, которые постоянно хранятся в почве и
обеспечивает основу для ее плодородия. Вода в природе — это жизнь, без воды все
ничто. Она— основа плодородия, без нее не было бы ни растений, ни пищи.
Атмосферные осадки
Вода в природе находится в круговороте. Испаряясь, она
поднимается как водяной пар в атмосферу. За тем крошечные капельки собираются и
образуют облака. Когда облака попадают в холодный воздух, маленькие капли воды
конденсируются и образуют дождь, снег или град.

Вода за пределами земли
Вода за пределами Земли на одних небесных телах находится в
твердом состоянии (лед), а на других как водяной пар.
В виде льда, она была
обнаружена в кометах («грязные снежки»), на Марсе и на некоторых других внешних
планетах. Только кольца Сатурна содержат примерно в 20-30 раз больше воды, чем
Земля.
Доказательства присутствия льда в метеоритных кратерах вблизи полюсов
можно найти даже на Меркурии, планете, ближайшей к Солнцу.
Биологическая роль
Вода является источником здоровой жизни и очень важна для
организма. Как часть крови, она снабжает нас кислородом и питательными
веществами.
В то же время токсины транспортируются через кровоток в почки,
удаляются из организма. Вода регулирует температуру тела. Если температура
воздуха высокая, человек потеет, и тело охлаждается.
Однако, если пот не
выделяется, то поднимается температура и самочувствие ухудшается.
Многие витамины, молекулы сахара могут использоваться
организмом только через воду. Органические вещества расщепляются в воде и
транспортируются к нужным органам. Кроме того, она является важным компонентом
клеток и тканей. Например, мозг на 90 % состоит из жидкости.
Применение
Вода используется во всех сферах жизни. Люди пьют ее,
готовят пищу, поливают растения. На гидроэлектростанциях вода используется, как
источник энергии.
Она также необходима на фабриках, например, для производства
и переработки бумаги. Кстати, для производства одного листа бумаги требуется 10
литров воды! При тушении пожаров без нее не обойтись.
Сельское хозяйство было
бы невозможно без Н2О.

Многие используют ее в качестве лекарства от разных
болезней. Особенно много целебных свойств, приписывают органической воде.
Исследования
Вода существует миллиарды лет, и, казалось бы, что о ней
знают все, но она все равно остается тайной. Создаются целые институты, которые
пытаются узнать, как сделать аналог воды, откуда она появилась на Земле и в
космосе. Они изучают ее влияние на жизнь, ландшафт, природу.
Происхождение воды на планете
Многих интересует, откуда все-таки взялась вода. Она
родилась четыре с половиной миллиарда лет назад в глубинах вселенной. Земля,
еще не полностью сформированная, состояла в основном из вулканов. Газы, богатые
водяным паром, выделялись в атмосферу, там образовывались облака.
За
тысячелетия земля остыла, и пары, сгущаясь, падали обратно на земную кору в
виде дождя. Также формированию этого очень важного источника жизни,
способствовали падающие кометы, состоящие в основном изо льда и фрагментов
породы.
Это явление способствовало образованию рек, озер и океанов, где
миллионы лет спустя появились бы первые формы жизни.
Гидрология
Понять, как вода взаимодействует с атмосферой, как влияет на
жизнедеятельность, помогает наука гидрология. Она изучает, какая вода находится
в водной оболочке Земли. Гидрология помогает понять, как рационально управлять
водными объектами. Она составляет прогнозы состояния водных ресурсов, и дает им
оценку.
Гидрогеология
Наука, которая изучает подземные воды, гидрогеохимию
называется гидрогеология. Гидрогеологи занимаются поиском новых подземных
водных источников, изучают, как сделать воду из подземных источников полезной
для мелиорации, водоснабжения, природного ландшафта. Данные полученные учеными
помогают снизить негативные влияния деятельности людей, на подземные водные
источники.
Теперь вы знаете всю правду о воде, и понимаете, насколько
важно бережно к ней относится. Ведь если пропадет вода, то не станет и нас.
Источник: https://VodaVoMne.ru/svojstva-vody/voda
ВОДА
АБВГДЕЖЗИКЛМНОПРСТУФХЦЧШЩЭЮЯ
ВОДА (оксид водорода) Н2О, мол. м. 18,016, простейшее устойчивое соед. водорода с кислородом. Жидкость без запаха, вкуса и цвета.
Распространение в природе. Вода — одно из самых распространенных на Земле соединений. Молекулы воды обнаружены в межзвездном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
Кол-во воды на пов-сти Земли оценивается в 1,39*1018 т, большая часть ее содержится в морях и океанах. Кол-во доступных для использования пресных вод в реках, озерах, болотах и водохранилищах составляет 2*104 т.
Масса ледников Антарктики, Антарктиды и высокогорных районов 2,4*1016т, примерно столько же имеется подземных вод, причем только небольшая их часть — пресные. В глубинных слоях Земли содержится значительно больше (повидимому, не менее, чем на порядок) воды, чем на пов-сти. В атмосфере находится ок.
1,3*1013 т воды. Вода входит в состав мн. минералов и горных пород (глины, гипс и др.), присутствует в почве, является обязат. компонентом всех живых организмов.
Изотопный состав. Существует 9 устойчивых изотопных разновидностей воды. Содержание их в пресной воде в среднем следующее (мол. %): 1Н216О — 99,13; 1Н218О — 0,2; 1Н2170-0,04; 1Н2О16О-0,03; остальные пять изотопных разновидностей присутствуют в воде в ничтожных кол-вах.
Кроме стабильных изотопных разновидностей, в воде содержится небольшое кол-во радиоактивного 3Н2 (или Т2О). Изотопный состав природной воды разного происхождения неск. варьирует. Особенно непостоянно отношение 1Н/2Н: в пресных водах — в среднем 6900, в морской воде -5500, во льдах — 5500-9000. По физ.
свойствам D2O заметно отличается от обычной воде (см. Тяжелая вода). Вода, содержащая 18О, по св-вам ближе к воде с 16О.
Строение молекулы и физические свойства.
Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О—Н 0,0957 нм; валентный угол Н—О—Н 104,5°; дипольный момент 6,17*10-30 Кл*м; поляризуемость молекулы 1,45*10-3 нм3; средний квадрупольный момент — 1,87*10-41 Кл*м2, энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. При взаимод. молекулы воды с др. атомами, молекулами и ионами, в т.ч. с другими молекулами воды в конденсир. фазах, эти параметры изменяются.
Нек-рые параметры, характеризующие св-ва воды в разных агрегатных состояниях при атм. давлении, приведены ниже (см. также табл. 1 и рис. 1, на к-ром указаны области существования разл. модификаций льда): 
Физ. свойства воды аномальны. Плавление льда при атм. давлении сопровождается уменьшением объема на 9%. Температурный коэф. объемного расширения льда и жидкой воды отрицателен при т-pax соотв. ниже -210°С и 3,98 °С.
Теплоемкость С° при плавлении возрастает почти вдвое и в интервале 0-100°С почти не зависит от т-ры (имеется минимум при 35 °С). Минимум изо-термич. сжимаемости (44,9*10-11 Па-1), наблюдаемый при 46°С, выражен довольно четко. При низких давлениях и т-рах до 30 °С вязкость воды с ростом давления падает.
Высокие диэлектрич. проницаемость и диполъный момент воды определяют ее хорошую растворяющую способность по отношению к полярным и ионогенным в-вам. Благодаря высоким значениям С°, и вода-важный регулятор климатич. условий на земле, стабилизирующий т-ру на ее пов-сти. Кроме того, близость угла Н—О—Н к тетраэдрическому (109° 28') обусловливает рыхлость структур льда и жидкой воды и, как следствие, аномальную зависимость плотности от т-ры. Поэтому не промерзают до дна крупные водоемы, что делает возможным существование в них жизни.
Табл. 1 — СВОЙСТВА ВОДЫ И ВОДЯНОГО ПАРА, НАХОДЯЩИХСЯ В РАВНОВЕСИИ 

Рис. 1. Фазовая диаграмма воды.
Взаимодействие между молекулами воды. Структура конденсированных фаз. Молекулы воды, обладая значит. ди-польным моментом, сильно взаимод. друг с другом и полярными молекулами др. в-в. При этом атомы водорода могут образовывать водородные связи с атомами О, N, F, Cl, S и др.
В водяном паре при невысоких т-рах и умеренных давлениях присутствует небольшое кол-во (ок. 1% при т-ре кипения и атм. давлении) димеров воды (для них ~ 15 кДж/моль), расстояние между атомами кислорода ~ 0,3 нм. В конденсиров. фазах каждая молекула воды образует четыре водородные связи: две — как донор протонов и две — как акцептор протонов. Средняя длина этих связей в кристаллич. модификациях льда и кристаллогидратах ок. 0,28 нм. Угол О—Н…О стремится к 180°. Четыре водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра (рис. 2).
Структура модификаций льда представляет собой трехмерную сетку. В плотных модификациях VI-VIII, устойчивых при высоких давлениях, можно даже выделить две такие сетки, «вставленные» одна в другую.
В модификациях, существующих при низких давлениях (льды Ih и Iс), связи Н—О—Н почти прямолинейны и направлены к вершинам практически правильного тетраэдра.
В модификациях II-VI связи искривлены и углы между ними отличаются от тетраэдрического, что обусловливает увеличение плотности по сравнению с плотностью обычного льда. 
Рис. 2. Схема тетраэдрической координации молекулы воды; сплошные линии — ковалентные связи; пунктирные линии — водородные связи.
Но плотность модификаций II-VI значительно ниже той, к-рой мог бы обладать лёд при плотной упаковке молекул. Только в модификациях VII и VIII достигается достаточно высокая плотность упаковки: в их структуре две правильные сетки, построенные из тетраэдров (аналогичные существующим в кубич.
низкотемпературном льде Iс, изоструктурном алмазу), вставлены одна в другую; при этом сохраняется система прямолинейных водородных связей, а координац. число по кислороду удваивается и достигает 8. Расположение атомов кислорода во льдах VII и VIII подобно расположению атомов вжелезе и многих др. металлах. В обычном (Ih) и кубическом (Iс) льдах, а также во льдах HI, V-VII ориентация молекул не определена: оба ближайших к атому О протона образуют с ним ковалентные связи, к-рые м. б. направлены к любым двум из четырех соседних атомов кислорода в вершинах тетраэдра. Диэлектрич. проницаемость этих модификаций высока (выше, чем у жидкой воды). Модификации II, VIII и IX ориентационно упорядочены; их диэлектрич. проницаемость низка (ок. 3). Лед VIII представляет собой упорядоченный по размещению протонов вариант льда VII, а лед IX — льда III. Плотности ориентационно упорядоченных модификаций (VIII, IX) близки к плотностям соответствующих неупорядоченных (VII, III).
Трехмерная сетка водородных связей, построенная из тетраэдров, существует и в жидкой воде во всем интервале от т-ры плавления до критической. Увеличение плотности при плавлении, как и в случае плотных модификаций льда, объясняется искривлением водородных связей и отклонением углов между ними от тетраэдрических.
Искривление связей увеличивается с ростом т-ры и давления, что приводит к возрастанию плотности. С др. стороны, при нагр. средняя длина водородных связей становится больше, в результате чего плотность уменьшается. Совместное действие двух факторов объясняет наличие максимума плотности воды при 3,98 °С.
Химические свойства. Лишь незначит. доля молекул (при 25°С — примерно 1 на 5*109) подвергается электролитич. диссоциации по схеме: Н2ОН+ + ОН-. Протон Н + в водной среде, взаимодействуя с молекулами воды, образует Н3О+ , объединяющийся с 1 молекулой Н2О в H5O2+. Расстояние О…О в таких комплексах заметно короче длины нормальной водородной связи между нейтральными молекулами. Но поскольку протон, по-видимому, находится не точно посредине этой укороченной связи, а ближе к одному из атомов О, можно считать, что в воде существует гидратированный ион оксония Н3О+ . Это явление играет большую роль в хим. процессах, происходящих в разл. системах, в т. ч. биологических. В частности, диссоциация воды — причина гидролиза солей слабых к-т и (или) оснований. Концентрация ионов Н+ и связанная с ней концентрация ионов ОН- -важные характеристики водных р-ров (см. Водородный показатель). Степень электролитич. диссоциации воды заметно возрастает при повышении т-ры.
Образование воды из элементов по р-ции Н2 + 1/2O2Н2O (Hoобр -242 кДж/моль для пара и -286 кДж/моль для жидкой воде) при низких т-рах в отсутствие катализаторов происходит крайне медленно, но скорость р-ции резко возрастает при повышении т-ры, и при 550 °С она происходит со взрывом. При снижении давления и возрастании т-ры равновесие сдвигается влево. Степень термич. диссоциации воды (%) при 100 кПа: 0,034 (1015°С), 0,74 (1711 °С), 8,6 (2215°С) и 11,1 (2483°С). Под действием УФ-излучения происходит фотодиссоциация воды на ионы Н+ и ОН-. Ионизирующее излучение вызывает радиолиз воды с образованием Н2, Н2О2 и своб. радикалов ; радиац. выход — примерно 4 распавшиеся молекулы на каждые 1,6*10-17 Дж поглощенной энергии излучения.
Вода — реакционноспособное соединение. Она окисляется атомарным кислородом: Н2О + О -> Н2О2. При взаимод. воды с F2 образуются HF, а также О, О2, О3, Н2О2, F2O и др. соединения. С остальными галогенами при низких т-рах вода реагирует с образованием смеси к-т HHal и ННаlO. При обычных условиях с водой взаимод. до половины растворенного в ней С12 и значительно меньшие кол-ва Вr2 и 12.
При повыш. т-рах хлор и бром разлагают воду с образованием HHal и О2. При пропускании паров воды через раскаленный уголь она разлагается и образуется т. наз. водяной газ: Н2О + С СО + Н2. При повыш. т-ре в присут. катализатора вода реагирует с СО, СН4 и др. углеводородами, напр.: Н2О + СО СО2 + Н2 (кат. Fe); Н2О + СН4 СО + ЗН2 (кат. Ni или Со). Эти р-ции используют для пром. получения Н2.
Перспективны для его произ-ва также термохим. способы разложения воды (см. Водород, Водородная энергетика). Фосфор при нагр. с водой под давлением в присут. катализатора окисляется в метафосфорную к-ту: 6Н2О + ЗР -> 2НРО3 + 5Н2. Вода взаимод. со мн. металлами с образованием Н2 и соответствующего гидроксида. Со щелочными и щел.-зем.
металлами (кроме Mg) эта р-ция протекает уже при комнатной т-ре. Менее активные металлы разлагают воду при повыш. т-ре, напр. Mg и Zn-выше 100°С, Fe — выше 600°С (2Fe + ЗН2О -> Fe2O3 + 3H2). При взаимод. с воды многих оксидов образуются к-ты или основания. Вода может служить катализатором, напр. щелочные металлы и водород реагируют с хлором только в присут.
следов воды Иногда вода — каталитич. яд, напр. для железного катализатора при синтезе NH3.
Способность молекул воды образовывать трехмерные сетки водородных связей позволяет ей давать с инертными газами, углеводородами, СО2, С12, (СН2)2О, СНС13 и многими др. в-вами т. наз. газовые гидраты.
Вода как растворитель. Вода хорошо растворяет мн. полярные и диссоциирующие на ионы в-ва. Обычно р-римость возрастает с увеличением т-ры, но иногда температурная зависимость имеет более сложный характер. Так, р-римость мн.
сульфатов, карбонатов и фосфатов при повышении т-ры уменьшается или сначала повышается, а затем проходит через максимум. Р-римость малополярных в-в (в т. ч. газов, входящих в состав атмосферы) в воде низкая и при повышении т-ры обычно сначала снижается, а затем проходит через минимум.
С ростом давления р-римость газов возрастает, проходя при высоких давлениях через максимум. Многие в-ва, растворяясь в воде, реагируют с ней. Напр., в р-рах NH3 могут присутствовать ионы NH4 (см. также Гидролиз). Между растворенными в воде ионами, атомами, молекулами, не вступающими с ней в хим.
р-ции, и молекулами воды существуют не разрушающие их ион-дипольные и межмол. взаимодействия (см. Гидратация).
Природная вода. Представляет собой сложную многокомпонентную систему, в состав к-рой входят минер. в-ва, газы, а также коллоидные и крупнодисперсные частицы, в т. ч. микроорганизмы. По величине минерализации (г/л) различают след.
природные воды: ультрапресные — до 0,2, пресные — 0,2-0,5, слабоминерализованные — 0,5-1,0, солоноватые — 1-3, соленые — 3-10, с повыш. соленостью — 10-35, переходные к рассолам — 35-50, рассолы — более 50. Макрокомпонентами природной воды обычно являются Са, Mg, Na, К, Fe (катионогенные воды), Si, С, S, C1 (анионогенные воды).
К микрокомпонентам природной воды относятся редкие и рудные элементы, напр. В, Li, Rb, Cu, Zn, Bi, Be, W, U, Br, I и др.
Осн. газы, содержащиеся в прир. воде, — СО2, N2 (характерны как для поверхностных, так и для глубинных условий), СН4, СО, Н2 (более типичны для подземных водах и для воды вулканич. активных областей). Растворенные в воде компоненты находятся в равновесии, образуя комплексы разл. состава. Данные о составе нек-рых природной воды приведены в табл. 2.
Табл. 2-СОСТАВ ПРИРОДНЫХ ВОД
Питьевая вода. Общее число микроорганизмов в 1 мл питьевой воды должно быть не выше 100, число бактерий группы кишечных палочек (коли-индекс) — не более 3. Концентрация хим. в-в, к-рые встречаются в природной воде или добавляются к воде при ее обработке (см. Водоподготовка), не должна превышать (мг/л):
Содержание примесей, к-рые влияют на органолептические св-ва воды и встречаются в природной воде или добавляются к воде при ее обработке, не должно превышать (мг/л):
Общая жесткость питьевой воды должна быть не выше 7,0 ммоль/л, сухой остаток — 1000 мг/л, рН — от 6,0 до 9,0. Для питьевой воды, подаваемой без спец. обработки, по согласованию с органами санитарно-эпидемиологич. службы допускаются след. показатели: сухой остаток — до 1500 мг/л, общая жесткость — до 10 ммоль/л, содержание железа и марганца — соотв. до 1 и до 0,5 мг/л.
Техническая вода. Воду, расходуемую пром. предприятиями, принято наз. технической. Ее применяют гл. обр. в кач-ве охлаждающего агента, транспортирующей среды для сыпучих материалов (напр., гидротранспорт золы на тепловых электростанциях), р-рителя и др.
В целом по всем отраслям пром-сти 70-75% от общего расхода воды применяют как хладагент по циркуляц. схеме. В этом случае вода лишь нагревается и практически не загрязняется. Главные источники загрязнения охлаждающей воды систем циркуляц. водоснабжения — вода, добавляемая в системы для восполнения неизбежных потерь, и атм.
воздух, из к-poro вымываются в охладителях воды взвешенные в-ва и газы, р-римые в воде.
Осн. ионами, к-рые могут приводить к отложениям минер, солей в системах циркуляц. водоснабжения, являются анионы НСО3-, CO32-, ОН-, SOl42-, PO43-, SiO32-, а также катионы Са2+, Mg2+ , Fe2+,3+ , A13+ , Zn2+ . Наиб.
часто встречающийся компонент солевых отложений — СаСО3 (см. Жесткость воды).
Предотвратить отложение карбонатов можно подкислением воды H2SO4 или НС1, ее рекарбонизацией (обычно обработка топочными газами, содержащими СО2), действием полифосфатов (NaPO3)6 и Na5P3O10, орг. фосфатов и др.
Для предотвращения (уменьшения) коррозии труб и теплообменного оборудования в воде добавляют ингибиторы коррозии: полифосфаты, ингибиторы на основе хромато-цинковых смесей и др. Для предупреждения обрастания оборудования бактериями воды в основном хлорируют (содержание С12 до 5 мг/л), а иногда озонируют.
Лечебные воды. В кач-ве лечебных применяют природной воде, содержащие значит. кол-во минер, солей, газы, нек-рые элементы и др. (подробнее см. Минеральные воды).
===
Исп. литература для статьи «ВОДА»: Хорн Р., Морская химия, пер. с англ., М., 1972; Эйзенберг Д., Кауцман В., Структура и свойства воды, пер. с англ., Л., 1975; Самойлов О. Я., Структура водных растворов электролитов и гидратация ионов, М., 1957 Алекин О.
А., Основы гидрохимии, Л., 1970; Синюков В. В., Структура одноатомных жидкостей, воды и водных растворов электролитов, М., 1976; Унифицированные методы исследования качества вод, ч. 1, кн. 2-3. Методы химического анализа вод, М., 1977; Кульский Л.А., Даль В.В.
, Чистая вода и перспективы ее сохранения, К., 1978; Возная Н. Ф., Химия воды и микробиология, 2 изд., М., 1979; Перельман А.И., Геохимия природных вод, М., 1982; Маленков Г. Г., в кн.: Физическая химия. [Ежегодник], М., 1984, с. 41-76. Г. Г. Маленков. С. В. Яковлев, В. А.
Гладков.
Страница «ВОДА» подготовлена по материалам химической энциклопедии.
АБВГДЕЖЗИКЛМНОПРСТУФХЦЧШЩЭЮЯ
Еще по теме:
- Вода — справочник по веществам
Источник: http://www.xumuk.ru/encyklopedia/786.html
Тайна двух океанов или формула воды
?
Categories:
По материалам книги Позднякова Э.А. http://predmet.ru/zagadki-nauki.pdf
ПОДСКАЗКИ ПРИРОДЫО чем хотят нам сказать эти растительные узоры? И эта геометрия?


Какова же химическая формула воды, если не H2O?
Лавуазье установил, что воздух состоит из смеси двух газов: азота и кислорода.
Источником кислорода и азота в огромном воздушном океане не могут быть растения и бактерии, но может быть только такой же огромный водный океан и состоять он должен из тех же компонентов, т.е. из кислорода и азота. С кислородом проблем нет, а вот с азотом… Водород в воде есть, а азот?
Но азот – это CH2. В итоге:ФОРМУЛА ВОДЫ: CH2OФормула CH2O устраняет аномалии воды:— МОЛЕКУЛЯРНЫЙ ВЕС, рассчитанный по формуле CH2O (12+2+16=30), приходит в соответствие с молекулярным весом, установленным опытным путем;- ТЕМПЕРАТУРА кипения воды (+100 град. по Цельсию при норм. атмосферном давлении), исходя из формулы CH2O, близка температурам кипения органических веществ, наиболее близких по своему химическому составу:- муравьиная кислота (СН2O2) +100,8;- уксусная кислота (С2Н4O2) +118,5;- метиловый спирт (СНЗOН) +64,7;- этиловый спирт (С2Н5OН) +78,3;- азотная кислота (HNO3) +86,0;- АКТИВНОСТЬ: быстро проникает в живые клетки, как и другие вещества, в состав которых входит углеводородная группа.- ЭЛЕКТРОЛИЗ: то, что в процессе электролиза, помимо выделения кислорода и водорода, появляется азотная кислота у анода и аммиак у катода, объясняется наличием в формуле воды азота (органического вещества CH2, названного азотом). Второй закон термодинамики не нарушается.Вывод, к которому пришел Поздняков Э.А.: вода, как и азот, является веществом органическим и формула CH2O в гораздо большей мере отвечает действительности, нежели существующая.Из формул воды и азота следует, что:- химический состав воды и химический состав воздуха ТОЖДЕСТВЕННЫ тот и другой состоят из углеводородной группы СН2 и кислорода, но только в разных СТРУКТУРНЫХ модификациях;- единство жизни, единство всех трех сфер — гидросферы, атмосферы и биосферы — связываются в систему взаимозависимости явлений органического мира, опирающуюся, как на фундамент, на общее для всех трех сфер вещество — СН2.
ФОРМУЛА CH2O ВОДЫ И ВОЗДУХА :
— находит источник кислорода и азота воздуха;- находит источник углерода растений;- находит недостающее первое звено в пищевой цепи;- объясняет параллельное развитие животного и растительного мира в едином русле эволюции;- объясняет единство жизненных процессов водных и земных животных и растений, обитающих как в воде, так и на суше;- объясняет самозарождение жизни.
МЕХАНИЗМ ПЕРЕХОДА ВОДЫ В ДРУГОЕ ФАЗОВОЕ СОСТОЯНИЕ
Солнечная энергия преобразует воду в газообразное состояние (в воздух) путем ее испарения. Испарение — процесс эндотермический, идущий при поглощении водой энергии извне. В результате притока солнечной энергии, структура молекулы жидкой воды преобразуется в структуру молекулы воды-газа и затем — воздуха. Наоборот, отток энергии превращает структуру молекулы жидкой воды в структуру твердой воды — в лед. Таким образом, энергетические изменения в структурном состоянии одного и того же вещества — воды, дают в итоге три различные модификации одного и того же вещества СН2O — жидкость, газ (в виде пара и воздуха) и лед. При одинаковом химическом составе они имеют разные физические свойства.Вследствие этого постоянно идущего процесса, время от времени происходит то, что можно назвать перенасыщенностью атмосферы. При определенных условиях среды избытки испаряющейся воды конденсируют и возвращаются на землю в виде осадков. Этот процесс носит уже экзотермический характер (с отдачей тепла): конденсируясь, воздух (или пар) высвобождает полученную им ранее энергию и одновременно благодаря этому преобразуется в иное агрегатное состояние, то есть в воду или в лед (снег).
КРУГОВОРОТ ВОДЫ В ПРИРОДЕ
Солнце нагревает воду, вода испаряется, превращаясь в газ-воздух, и заполняет им пространство атмосферы до тех пределов, которые определяются силой земного притяжения, а также силой сцепления молекул воздуха, все более растягивающегося вверх, подобно пружине, по мере ослабления земного притяжения. В результате, создается насыщенная газом-воздухом среда. Избыточное количество испарившейся воды, конденсируется вновь в воду и виде дождя или снега возвращается на землю.
ВОДА — ЭТО ЖИЗНЬ (не метафора)Всемирный океан, включающий все водные резервуары и источники на земле есть та единственная кладовая, которая постоянно снабжает атмосферу в неизменном отношении и объеме двумя ее составными частями — азотом (или что то же самое — углеводородной группой СН2) и кислородом.
Водный океан, таким образом, дает жизнь океану воздушному. Вода есть единственный источник существования атмосферы и его необходимое условие.
Именно этим важнейшим обстоятельством определяется постоянство состава атмосферы в любой точке земного шара, независимо от климатических условий, времени года, богатства или бедности растительного мира и прочих эмпирических причин.Но тот же океан питает и третью рассматриваемую сферу — биосферу.
Только благодаря тому обстоятельству, что вода является веществом органическим, что она есть источник атмосферы, возможна жизнь на Земле вообще, возможно существование органического мира.
Жизнь не может зависеть от случайных и непостоянных величин и обстоятельств. В ее основе должны лежать устойчивые и неизменные элементы и условия. На Земле таким элементом является вода, дающая воздух, представляющая ту субстанцию, без которой немыслима жизнь, которая создает, творит жизнь, создает и творит ее не только как среда, но и как вещество, из которого строятся в конечном счете все элементы живого организма, начиная от простейшей клетки и кончая высокоорганизованными существами.Но коли это так, то тем самым окончательно решается вопрос об углеродном питании растений. Углерод поступает в растения в виде уже готового органического соединения, каковым является вода. При участии различных минеральных солей она синтезируется в корневой системе растений в сложные органические соединения и затем вместе с пасокой поступает во все их части. То же относится и к азоту (или группе СН2), имеющей также своим главным источником воду.В науке существует так называемый принцип простоты. Теория или гипотеза, при всех прочих равных условиях, считается тем достовернее, чем меньшее количество независимых допущений она использует для объяснения одного и того же круга явлений по сравнению с другими теориями. Если применить этот принцип к предлагаемой гипотезе, то она вполне ему соответствует, ибо прибегает только к одному независимому постулату — химическому составу воды, который связывает все рассматриваемые элементы в единую органическую систему, из которого выводится все остальное. При существующих же ныне взглядах, каждый элемент системы, напротив, требует отдельного и особого объяснения его существования и функционирования вне органической связи с другими. (Поздняков Э.А.)
http://hajoh.livejournal.com/890.html — аномалии воды
Источник: https://hajoh.livejournal.com/2524.html
Химический состав воды????
Вода, согласно ее формуле — H2O, должна состоять лишь из смеси двух газов – водорода и кислорода, однако это лишь не более чем лабораторный стандарт. На самом же деле она представляет собой смесь самых различных веществ, находящихся в самых разных физических и химических состояниях. Химический состав природной воды весьма и весьма разнообразен.
Факторы, влияющие на формирование химического состава

Произведенный в лаборатории химический анализ воды позволяет определить состав всех примесей органического и минерального происхождения, которые находятся в жидкости в форме молекул, ионов, суспензий, коллоидов и эмульсий. На химический состав как поверхностных, так и подземных вод существенно оказывают влияние географическое расположение, геологическое строение и климатические условия местности, в которой они находятся.
????Кратко рассмотрим химический состав природной воды, представляющей собой довольно сложную дисперсионную систему, где вода – дисперсная среда, а органические, минеральные вещества, газы и живые микроорганизмы – дисперсная фаза.
Около 90 — 95 процентов компонентов, содержащихся в растворенном виде в воде, составляют соли, которые существуют там в виде ионов. В природной воде всегда присутствует «набор» из трех анионов и четырех катионов (HCO3-, SO42 -, Cl-, Ca2+, Mg2+, Na+ , K+), которые принято называть главными ионами.
Одни из них безвкусны, другие же придают жидкости горький и солёный вкус. Поступают они в воду, главным образом, из почвы, горных пород и минералов. Часть из этих ионов имеет происхождение от производственной деятельности человека. Содержатся эти макрокомпоненты в воде в самых различных концентрациях.

Природная вода, кроме главных ионов, содержит в своем составе еще и различные газы, разумеется, в растворенном виде. Одним из важнейших является кислород, который придает жидкости свежий вкус.
Этого газа в воде может содержаться разное количество, все зависит от природных условий. Помимо кислорода, в воде содержатся такие газы, как азот и метан, не имеющие ни вкуса, ни запаха, а так же токсичный сероводород, который придает жидкости крайне неприятный запах.
Концентрация этих газов в воде определяется главным образом ее температурой.
Помимо этого, в воде содержатся биогенные вещества, которые составляют большую часть всех существующих живых организмов. К ним в основном относятся соединения фосфора и азота. Что касается азота, то он в природной воде может содержаться как в органической форме, так и неорганической.
Концентрация биогенных веществ в такой жидкости может быть в самых различный пределах – от всего лишь следов до 10-ти миллиграммов на литр.
Основные источники этих веществ – атмосферные осадки, поступления с поверхностными стоками, а так же сельскохозяйственными, промышленными и бытовыми сточными водами.
Неотъемлемыми составляющими воды являются и микроэлементы, которых содержится в жидкости менее одного миллиграмма на литр. К ним относятся, практически, все известные металлы, за исключением железа и главных ионов и некоторые из неметаллов. Очень важными из них являются фтор и йод, обеспечивающие организму человека нормальное функционирование.
Помимо прочего, в воде присутствуют и растворенные органические вещества. Это, по сути, органические формы упомянутых выше биогенных веществ. К ним относятся: углеводы, органические кислоты, фенолы, альдегиды, спирты, ароматические соединения, эфиры и так далее.
В химический состав воды, помимо перечисленных, входят еще и токсичные соединения и вещества – нефтепродукты, тяжелые металлы, СПАВ, хлорорганические пестициды, фенолы и так далее.
Природная вода ввиду присутствия в ней большого числа пузырьков газа и различных взвешенных частиц, считается негомогенной средой.
Источник: https://CentrGeologiya.ru/analiz-vody/216-himicheskii-sostav-vodi.html
Виды воды — Перечень видов, классификация и фразеологизмы
Виды воды (ВВ) — какие они бывают и чем обусловлено их многообразие?
Вода одно из самых распространенных веществ в природе. Она является базовым элементом жизнеобеспечения на нашей планете.
Многообразие ВВ в первую очередь обусловлено ее химическими и физическими качествами, с которыми, более подробно, вы можете ознакомится в статье ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ В ЖИДКОМ СОСТОЯНИИ ( читать → ).
Виды и типы воды определяются и классифицируются исходя из самых разнообразных факторов и признаков.
Классификация по изотопам водорода в молекуле воды
- Лёгкая вода – это обычная природная вода, очищенная от тяжелой, стандартная питьевая вода на 99,7% состоит из легкой.
- Тяжёлая вода, она же дейтериевая – химическая формула тяжелой воды по своей сути такая же, как и у обычной, за исключением того, что в ее состав вместо молекул водорода входят молекулы дейтерия (2 тяжелых изотопа водорода). Химическая формула тяжелой воды — 2Н2О или D2О.
- Полутяжелая вода — формула полутяжелой воды HDO, присутствует практически во всех водах, в чистом виде существовать не может.
- Сверхтяжёлая вода, она же тритиевая – также как и в тяжелой воде молекулы водорода замещены тритием, химическая формула — Т2O или 3H2O.
- Тяжёлокислородные изотопные модификации воды.
Виды воды исходя из количества солей
- Мягкая вода и жёсткая вода – жесткость воды, а соответственно и совокупность ее химических и физических свойств, определяется количеством растворенных в ней солей щелочноземельных металлов, в первую очередь магния и кальция.
- Пресная вода – вода с минимальным содержанием солей, ее соленость не превышает 0,1% .
- Морская вода – это соленая вода морей и океанов, средняя соленость которой составляет 34,72%.
- Минеральная вода – природные, как правило подземные воды с повышенным содержанием биологически активных минералов и микроэлементов, наличие которых и определяет их лечебные свойства:
- Слабоминерализованная вода;
- Маломинерализованная вода;
- Среднеминерализованная вода;
- Высокоминерализованная вода;
- Рассольная минеральная вода;
- Крепкая рассольная минеральная вода.
- Солоноватая вода (en:Brackish water) – это вода содержание солей в которой больше чем в пресной, но меньше чем в морской.
- Дистиллированная вода – вода очищенная от солей и других примесей с помощью процесса дистилляции.
- Деионизированная вода – вода с фактическим очень низким (стремится к нулю) содержанием ионов примесей.
Виды воды полученные в результате взаимодействия с другими веществами
- Шунгитовая вода – вода полученная в результате взаимодействия чистой пресной воды с природным минералом – Шунгитом.
- Кремниевая вода — вода полученная в результате взаимодействия чистой пресной воды с природным минералом – Кремнием.
- Насыщенная кислородом вода – вода обогащенная кислородом.
- Серебряная вода.
- Золотая вода.
- Медная вода.
Классификация в зависимости от месторасположения в гидросфере
- Подземные воды – это вся вода в любых состояниях, находящаяся в горных породах верхней части земной коры.
- Субмаринные (подводные) воды — «вода под водой», воды находящиеся под океанами, морями и крупными озерами.
- Артезианская вода (воды) — подземные воды залегающие между водоупорными пластами, часто находятся под гидростатическим давлением.
- Грунтовая вода – это самые верхние подземные воды, воды первого водоносного горизонта.
- Поверхностные воды – все воды находящиеся в силу тех или иных причин в тех или иных формах на поверхности Земли.
- Атмосферные воды — воды находящиеся в атмосфере нашей планеты.
Естественные природные виды вод
- Родниковая вода.
- Дождевая вода – это пресная вода которая в виде дождя выпадает на землю из дождевых облаков.
- Питьевая вода – это вода которая может употребляться человеком и другими живыми организмами в соответствии с их потребностями, без каких либо ограничений и без угрозы для их здоровья и жизни.
Виды воды появившиеся вследствие бытовой и хозяйственной деятельности человека
- Водопроводная вода – вода из водопроводных систем.
- Канализационные воды — воды попадающие в канализационные системы.
- Сточные воды – загрязненные воды надлежащие удалению с мест проживания людей, промышленных предприятий … .
- Кипяченая вода.
Классификация по каким либо другим качествам и признакам
- Магнитная вода – вода определенным образом обработанная магнитным полем.
- Щелочная вода — вода у которой pH > 7,1 .
- Апирогенная вода – вода которая при введении в организм не вызывает каких либо негативных реакций, повышения температуры и т. д.
- Поливода – гипотетическая полимеризированная форма воды с уникальными физическими свойствами, образующаяся за счет поверхностных явлений.
- Структурированная вода – этот термин не относится к академической науке и обозначает воду с определенной структурой, которая придает ей некие уникальные свойства и качества.
- Талая вода – вода полученная в результате таяния льда.
- Фильтрованная вода – пресная питьевая вода прошедшая через тот или иной фильтр с целью ее очистки и повышения качеств.
- Мёртвая вода и Живая вода – термины которые широко используются в народных сказках и притчах. Эти воды обладают уникальными сказочными свойствами – оживления и умерщвления людей соответственно.
- Святая вода – вода прошедшая христианский обряд водоосвящения.
- Крещенская вода — вода таинство благословения которой проводят в праздник Крещения Господня.
Фразеологические выражения
Такое разнообразие ВВ в первую очередь обусловлено уникальным сочетанием ее химических, физических и метафизических свойств.
Виды воды
ДАТА СОЗДАНИЯ ПУБЛИКАЦИИ: Июл 5, 2014 22:35 02.05.2015
Источник: https://vodamama.com/vidy-vody.html
Физические и химические свойства, формула воды: строение и какова критическая температура
Основное вещество, которое позволяет существовать жизни на планете – это вода. Она необходима в любом состоянии. Изучение свойств жидкости привело к образованию целой науки – гидрологии.
Предмет изучения большинства ученых – это физические и химические свойства воды.
Они понимают под этими свойствами: критические температуры, кристаллическую решетку, примеси и другие индивидуальные особенности химического соединения.
Изучение
Формула воды известна каждому школьнику. Это три простых знака, но содержатся они в 75% от общей массы всего на планете.
Н2О – это два атома водорода и один — кислорода. Структура молекулы имеет эмпирическую форму, поэтому свойства жидкости такие многообразные, несмотря на простой состав. Каждая из молекул находится в окружении соседей. Они связаны одной кристаллической решеткой.
Простота строения позволяет жидкости существовать в нескольких агрегатных состояниях. Ни одно вещество на планете не может этим похвастаться. Н2О очень подвижна, она уступает в этом свойстве лишь воздуху.
Каждый осведомлен о круговороте воды, о том, что после испарения ее с поверхности земли, где-то далеко проходит дождь или снег.
Климат регулируется именно благодаря свойствам жидкости, которая может отдавать тепло, а сама при этом практически не изменяет свою температуру.
Физические свойства
Н2О и ее свойства зависят от многих ключевых факторов. Основные из них:
- Кристаллическая решетка. Строение воды, а точнее ее кристаллической решетки, обусловлено агрегатным состоянием. Она имеет рыхлое, но очень прочное строение. Снежинки показывают решетку в твердом состоянии, а вот в привычном – жидком, у воды нет четкости в строении кристаллов, они подвижны и изменчивы.
- Строение молекулы – шар. Но влияние земного притяжения заставляет воду принимать форму сосуда, в котором находится. В космосе она будет геометрически правильной формы.
- Реагирует вода с другими веществами, в том числе с теми, кто обладает неразделенными электронными парами, среди них спирт и аммиак.
- Обладает высокой теплоемкостью и теплопроводностью, быстро нагревается и долго не остывает.
- Еще со школы известно, что температура кипения — 100 градусов Цельсия. В жидкости появляются кристаллы при понижении до +4 градусов, а вот лед образуется при еще большем снижении. Температура кипения зависит от давления, в которое поместить Н2О. Есть эксперимент, при котором температура химического соединения достигает 300 градусов, при этом жидкость не кипит, а плавит свинец.
- Еще одним важным свойством является поверхностное натяжение. Формула воды позволяет ему быть очень прочным. Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
Интересно! Н2О, очищенная от примесей (дистиллированная), не может проводить ток. Это свойство оксида водорода появляется лишь при наличии растворенных в нем солей.
Другие особенности
Лед – это уникальное состояние, которое свойственно оксиду водорода. Он образует рыхлые связи, которые легко деформируются. Кроме того, расстояние между частицами значительно увеличивается, делая плотность льда намного ниже жидкости. Это позволяет водоемам не промерзать полностью в зимний период, сохраняя жизнь под слоем льда. Ледники – большой запас пресной воды.
Интересно! У Н2О есть уникальное состояние, которое называется явлением тройной точки. Это когда она находится сразу в трех своих состояниях. Возможно это условие, лишь при температуре 0,01 градус и давлении 610 Па.
Химические свойства
Основные химические свойства:
- Разделяют воду по жесткости, от мягкой и средней — до жесткой. Этот показатель зависит от содержания солей магния и калия в растворе. Есть также такие металлы, которые находятся в жидкости постоянно, а от некоторых можно избавиться кипячением.
- Окисление и восстановление. Н2О влияет на процессы, изучаемые в химии, происходящие с другими веществами: одни она растворяет, с другими вступает в реакцию. Исход любого эксперимента зависит от правильного выбора условий, при которых он проходит.
- Влияние на биохимические процессы. Вода основная часть любой клетки, в ней как в среде, происходят все реакции в организме.
- В жидком состоянии впитывает в себя газы, которые неактивны. Их молекулы располагаются между молекулами Н2О внутри полостей. Так образуются клатраты.
- При помощи оксида водорода образуются новые вещества, которые не связаны с окислительно-восстановительным процессом. Речь идет о щелочах, кислотах и основаниях.
- Еще одна характеристика воды — это способность образовывать кристаллогидраты. Оксид водорода при этом остается в неизменном виде. Среди обычных гидратов можно выделить медный купорос.
- Если через соединение пропустить электрический ток, то можно разложить молекулу на газы.
Важность для человека
Очень давно люди поняли неоценимое значение жидкости для всего живого и планеты в целом. Без нее человек не может прожить и недели. Какого же полезное действие от этого самого распространенного на Земле вещества?
- Самое главное применение — это наличие в организме, в клетках, где проходят все важнейшие реакции.
- Образование водородных связей благоприятно сказывается на живых существах, ведь при изменении температуры жидкость в теле не замерзает.
- Человек давно применяет Н2О в бытовых нуждах, кроме приготовления пищи, это: стирка, уборка, купание.
- Ни один промышленный завод не может работать без жидкости.
- Н2О – источник жизни и здоровья, она является лекарством.
- Растения используют ее на всех этапах своего развития и жизни. С ее помощью они производят кислород, такой необходимый для жизни живых существ, газ.
Кроме самых очевидных полезных свойств, их имеется еще очень много.
Важность воды для человека
Критическая температура
У Н2О, как и у всех веществ, есть температура, которая называется критической. Критическая температура воды определяется методом ее нагрева.
До 374 градусов по Цельсию жидкость называют паром, она еще может превратиться обратно в привычное жидкое состояние, при определенном давлении.
Когда температура вышей этой критической отметки, то вода как химический элемент, превращается в газ безвозвратно.
Применение в химии
Большой интерес у химиков Н2О вызывает благодаря основному своему свойству – умению растворять. Часто ученые ею очищают вещества, чем создают благоприятные условия для проведения экспериментов.
Во многих случаях она является средой, в которой можно провести опытные испытания. Кроме того, Н2О сама участвует в химических процессах, влияя на тот или иной химический эксперимент.
Она соединяется с неметаллическими и металлическими веществами.
Три состояния
Вода предстает перед людьми в трех состояниях, называемых агрегатными. Это жидкость, лед и газ. Вещество одно и то же по составу, но разное по свойствам. У
мение перевоплощаться – очень важная характеристика воды для всей планеты, таким образом, происходит ее круговорот.
Сравнивая все три состояния, человек чаще видит химическое соединение все же в жидком виде. Вода не имеет вкуса и запаха, а то, что ощущается в ней, это из-за наличия примесей, растворенных в ней веществ.
Основные свойства воды в жидком состоянии — это: огромная сила, позволяющая точить камни и рушить скалы, а также возможность принимать любую форму.
Мелкие частицы при замерзании сокращают скорость своего движения и увеличивают дистанцию, поэтому структура льда пористая и по плотности ниже жидкости. Лед применяется в холодильных установках, для различных бытовых и промышленных целей. В природе лед несет лишь разрушения, выпадая в виде града или лавины.
Газ – еще одно состояние, который образуется, когда не достигается критическая температура воды. Обычно при температуре больше 100 градусов, или испаряясь с поверхности. В природе это облака, туманы и испарения. Большую роль искусственное газообразование сыграло в техническом прогрессе в 19 веке, когда были изобретены паровые двигатели.
Количество вещества в природе
75% — такая цифра покажется огромной, но это вся вода на планете, даже та, которая находится в разных агрегатных состояниях, в живых существах и органических соединениях. Если же учесть лишь жидкое, то есть воду, находящуюся в морях и океанах, а также в твердую – в ледниках, то процент становится 70,8%.
Распределение процентного содержания примерно такое:
- моря и океаны – 74,8%
- Н2О пресных источников, распределенная неравномерно по планете, в ледниках составляет — 3,4%, а в озерах, болотах и реках лишь 1,1%.
- На подземные источники приходится примерно 20,7% от всего количества.
Характеристика тяжелой воды
Природное вещество – водород встречается в виде трех изотопов, в таком же количестве форм есть и кислород. Это позволяет выделять кроме обычной питьевой воды еще дейтериевую и тритиевую.
Дейтериевая имеет самую устойчивую форму, она встречается во всех природных источниках, но в очень малом количестве. Жидкость с такой формулой обладает рядом отличий от простой и легкой.
Так, образование кристаллов в ней начинается уже при температуре 3,82 градуса. А вот температура кипения немного выше — 101,42 градуса Цельсия. У нее больше плотность и способность к растворению веществ значительно снижена.
Кроме того, ее обозначают другой формулой (D2O).
Живые системы реагируют на такое химическое соединение плохо. Лишь некоторые виды бактерий смогли в нем приспособиться к жизни. Рыбы и вовсе не выдержали такого эксперимента. В организме человека, дейтерий может находиться несколько недель, а после выводится, не причиняя вреда.
Важно! Пить дейтериевую воду – нельзя!
Уникальные свойства воды. Химия – просто.
Химические свойства воды
Вывод
Широкое применение тяжелая вода нашла в ядерной и атомной промышленности, а обычная — в повсеместном.
Источник: https://uchim.guru/himiya/fizicheskie-i-himicheskie-svojstva-vody.html




