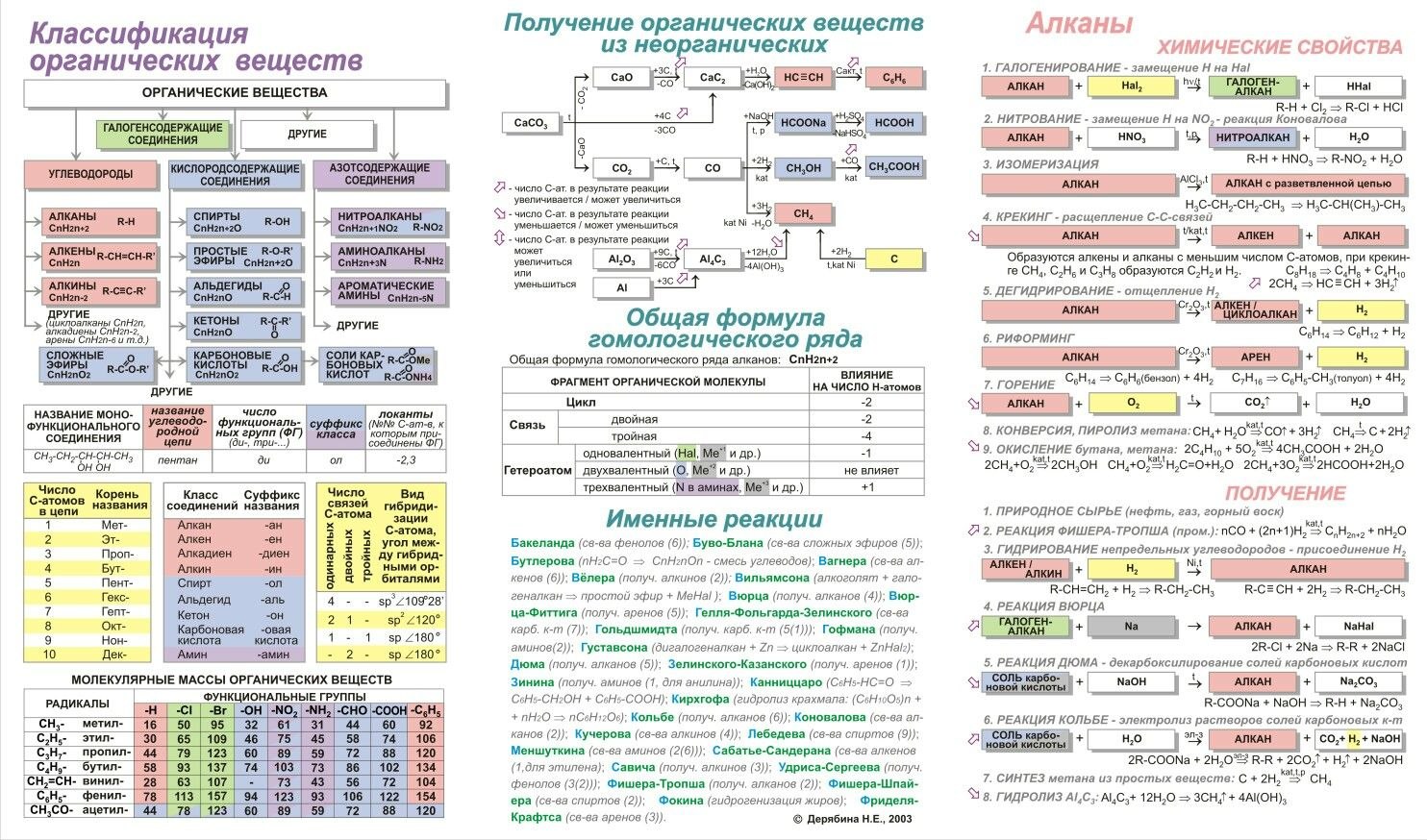
Галогены (греч. hals — соль + genes — рождающий) — химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np5:
- F — 2s22p5
- Cl — 3s23p5
- Br — 4s24p5
- I — 5s25p5
- At — 6s26p5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.

Природные соединения
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CaF2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит

Простые вещества — F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
- NaCl + H2O → (электролиз) NaOH + H2↑ + Cl2↑
- Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF — был впервые получен фтор.
- HF → F2 + H2
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
Cl2 + KBr → Br2 + KCl
Cl2 + KI → I2 + KCl

- В лабораторных условиях галогены могут быть получены следующими реакциями.
- HCl + MnO2 → MnCl2 + Cl2 + H2O
- HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
- Химические свойства
- Реакции с металлами
- Al + F2 → AlF3
- Cu + Cl2 → CuCl2
- Na + Br2 → NaBr
- Реакции с неметаллами
- F2 + H2 → HF (в темноте со взрывом)
- Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность ?
- Br2 + F2 → BrF (фтор более электроотрицателен, чем бром — F-)
- Br2 + I2 → BrI3 (бром более электроотрицателен, чем йод — I-)
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
- KCl + F2 → KF + Cl2
- KBr + Cl2 → KCl + Br2
- KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl2 + Si → SiCl4
Cl2 + H2 → HCl (на свету)

Реакция фтора с водой протекает очень энергично, носит взрывной характер.
H2O + F2 → HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + NaOH → (t) NaCl + NaClO3 + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
- Получение
- В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
- H2 + Cl2 → HCl
- В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
- NaCl + H2SO4 → NaHSO4 + HCl↑
- CaF2 + H2SO4 → CaSO4 + HF
- PBr3 + H2O → HBr↑ + H3PO3
- H2S + I2 → S + HI
- Химические свойства
- Кислотные свойства
- Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
- Na2O + HCl → NaCl + H2O
- ZnO + HI → ZnI2 + H2O
- KOH + HCl → KCl + H2O (реакция нейтрализации)
- С солями
- Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
- AgNO3 + HCl → AgCl + HNO3
- Li2CO3 + HBr → LiBr + H2CO3
- Восстановительные свойства
- В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
- HI + MnO2 → I2 + MnI2 + H2O
- HI + H2SO4 → I2 + H2S + H2O
- HI + O2 → H2O + I2
- HI + Br2 → HBr + I2
- HCl + H2SO4 → Cl2 + SO2 + H2O
- Реакция с оксидом кремния
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты. Mg + HBr → MgBr2 + H2↑ Zn + HCl → ZnCl2 + H2↑ 

Cr(OH)3 + HCl → CrCl3 + H2O

В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
SiO2 + HF → SiF4 + H2O
Источник: https://studarium.ru/article/175
Физические свойства галогенов
Во всех агрегатных состояниях галогены сохраняют молекулярное строение, а уменьшение летучести объясняется усилением межмолекулярного Ван-дер-ваальсова взаимодействия из-за большого числа электронов.
Фтор
Молекула фтора имеет относительно не большую массу и достаточно подвижна, поэтому фтор при обычных условиях – газ с резким и очень неприятным запахом, растворимый в жидком HF. Твердый фтор (температура ниже -228 °C) имеет моноклинную структуру, а выше этой температуры – кубическую молекулярную решетку.
Хлор
Обладает резким раздражающим запахом. Под давлением около 0,6 МПа уже при комнатной температуре превращается в жидкость. Сжиженный хлор обычно хранят и транспортируют в стальных баллонах или цистернах, т.к. сухой хлор с железом не взаимодействует. Жидкий хлор имеет желтую окраску.
Бром
Красно-бурая тяжелая жидкость с плотностью 3,10 г/см3. Пары брома имеют красную окраску (желто-бурый цвет). Обладает высокой упругостью паров.
Йод
При комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым металлическим блеском, с ромбической молекулярной решеткой. Плотность йода 4,94 г/см3. Пары йода имеют фиолетовую окраску.
Скорость испарения йода при комнатной и тем более, повышенной температуре настолько велика, что если небольшое количество йода нагревать в достаточно большом сосуде, он успевает полностью испариться, прежде чем расплавится.
Это явление известно как возгонка или сублимация. Но если парциальное давление паров йода превысит 80 мм. рт. ст.
, что происходит при нагревании его в сосуде небольшого объема, то подобно большинству обычных веществ, он сначала плавится, а закипает лишь при дальнейшем нагревании.
При охлаждении пары йода кристаллизуются, минуя жидкую фазу. Этим пользуются на практике для очистки йода от нелетучих примесей.
Астат
Твердое вещество металлического вида.
Основные характеристики простых веществ галогенов:
| Агрегатное состояние при о.у. (в скобках указан тип кристаллической решетки) | Желтоватый газ. | Желто-зеленый газ. | Красно-бурая жидкость. | Черно-фиолетовые кристаллы (молекулярная ромбическая). | Черно-синие кристаллы (молекулярная). |
| Плотность, г/см3 (293 °К) | 1,696 | 3,214 | 3,1226 | 4,93 | — |
| Т°пл., °C | -219,5 | -101,0 | -7,25 | 113,7 | 244 |
| Т°кип., °C | -188,1 | -34,1 | 59,2 | 185,5 | 317 |
| Длина связи Hal-Hal, нм | 0,141 | 0,199 | 0,228 | 0,267 | — |
| ΔHдис. Hal2, кДж/моль (25 °C) | 155 | 239,2 | 190,1 | 148,8 | 109 |
| Стандартная энтальпия атомизации элементов ΔH°298, кДж/моль | 79,55 | 121,21 | 111,91 | 106,69 | 90,85 |
| ΔH°пл., кДж/моль | 0,51 | 6,41 | 10,60 | 15,56 | — |
| ΔH°кип., кДж/моль | 6,55 | 20,42 | 30,31 | 41,81 | — |
| ΔH°гидр. Hal—, кДж/моль | -535,9 | -405,7 | -386,0 | -301,7 | — |
| pKдис. Hal2 | 2,4 | 6,8 | 4,5 | 2,6 | — |
| Степень термической диссоциации молекул Hal2 при 1000 °K и при 2000 °K | 0,043 и 0,99 | 0,00035 и 0,37 | 0,0023 и 0,72 | 0,28 и 0,89 | — |
| Удельное электрическое сопротивление (298 °K), мкОм·м | — | 1014 | 1,3·1017 | 1,3·1019 | — |
| Относительная электропроводность (Hg = 1, 298 °K) | — | 9,66·10-15 | 7,43·10-18 | 7,43·10-20 | — |
| Стандартная энтропия S°298, Дж/моль·К | 202,85 | 223,1 | 151,77 | 116,81 | 121,42 |
| Растворимость в воде (25 °C), моль/л | Разлагает воду | 0,091 | 0,21 | 0,0013 | — |
| Растворимость в воде (25 °C), г/л | Разлагает воду | 6,5 | 34,6 | 0,3 | — |
| Степень гидролиза в насыщенном растворе, % | — | 33 | 0,55 | 0,49 | — |
Все галогены образуют двухатомные молекулы, имеющие однотипное электронное строение. Строение молекул различных галогенов отличается в основном количественно. Кратность связи у них равна единице.
Энергетическая диаграмма молекулы галогена:
 Энергетическая диаграмма молекулы галогена
Энергетическая диаграмма молекулы галогена
Прочность молекулы фтора, несмотря на наименьшее межъядерное расстояние относительно других галогенов намного меньше по сравнению с молекулами хлора и брома. Во внешней электронной оболочке атома фтора отсутствует d-подоболочка, которая есть у остальных галогенов.
За счет d-подоболочки имеет место дополнительное донорно-акцепторное взаимодействие, упрочняющее связь за счет p-электронов и d атомной орбитали. По величинам энтальпии и константы диссоциации молекула фтора сравнима с молекулой йода. В то же время силовая константа связи в молекуле фтора в 2 с лишним раза превосходит таковую у молекулы хлора.
Другими словами, химическая связь в молекуле фтора менее прочная, но более жесткая.
Схема образования химической связи в молекулах фтора и хлора:
 Схема образования химической связи в молекуле фтора
Схема образования химической связи в молекуле фтора  Схема образования химической связи в молекуле хлора
Схема образования химической связи в молекуле хлора
При образовании молекулы фтора понижение энергии электронов достигается за счет взаимодействия 2p атомных орбиталей с неспаренными электронами атомов фтора (система 1 + 1). Остальные p-АО неподеленных электронных пар можно считать не учавствующими в образовании химической связи.
Химическая связь в молекуле хлора, кроме аналогичного взаимодействия валентных 3p-АО атомов хлора, также образуется за счет взаимодействия 3p-АО неподеленной электронной пары одного атома хлора с вакантной 3d-АО другого (система 2 + 0).
В результате порядок связи в молекуле хлора (1,12) больше, чем в молекуле фтора, а химическая связь прочнее.
Сродство к электрону у атома фтора также меньше, чем у хлора. Фтор является менее электрофильным элементом по сравнению с хлором. Это объясняется кайносимметричностью 2p-электронов атома фтора и связанным с ней эффектом обратного экранирования.
Дело в том, что 2p-АО в атоме фтора сильнее притянуты к ядру и лежат глубже полностью заполненной электронами некайносимметричной 2s-АО. Последняя, будучи полностью заселенной, отталкивает присоединяемый атомом фтора электрон, уменьшая электронное сродство и повышая ионизационные потенциалы.
С повышением в ряду F-At радиуса атомов возрастает и поляризуемость молекул.
В результате усиливается межмолекулярное дисперсионное взаимодействие, что обуславливает повышение температур плавления и кипения галогенов.
В ряду Cl2-Br2-I2 прочность связи между атомами в молекуле постепенно снижается, что находит отражение в уменьшении энтальпии диссоциации молекул галогенов на атомы. Причины этого заключаются в следующем.
С увеличением размеров внешних электронных облаков взаимодействующих атомов степень их перекрывания понижается, а область перекрывания располагается все дальше от атомных ядер. Поэтому при переходе от хлора к брому и йоду притяжение ядер атомов к области перекрывания электронных облаков уменьшается.
Кроме того, в ряду Cl-Br-I возрастает число промежуточных электронных слоев, экранирующих ядро, что также ослабляет взаимодействие атомных ядер с областью перекрывания.
Цвет простых веществ, образуемых галогенами, определяется главным образом поглощением света, связанным с переходом электрона с одной из занятых π*-орбиталей на свободную σ*-орбиталь.
У фтора этот переход соответствует границе ультрафиолетовой и фиолетовой областей спектра, из-за чего цвет вещества оказывается бледно-желтым; у хлора – в фиолетовый, что влечет появление желто-зеленой окраски; красно-коричневый цвет брома связан с поглощением в сине-фиолетовой области, а фиолетовый цвет йода, хорошо видимый в парообразном состоянии, вызван дальнейшим смещением поглощения в зеленую область спектра.
Биологическая роль галогенов
Все галогены обладают очень резким запахом. Вдыхание паров фтора, хлора и брома даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек, а больших – удушение и тяжелое отравление. Жидкий бром, попадая на кожу, вызывает сильные ожоги и долго не заживающие язвы. В то же время, галогены необходимы для жизни.
Фтор важен для млекопитающих, в т.ч. и человека. Его соединения содержатся в костях и эмали зубов (0,01%). Колебания в содержании фтора в питьевой воде приводят к различным заболеваниям зубов. В то же время фтор и его соединения сильноядовиты, исключение составляют CF4, SF6 и некоторые другие химически инертные вещества.
Хлор существенно важен для многих форм жизни, включая человека. Ионы хлора в организме активируют некоторые ферменты, служат источником для образования соляной кислоты, создающей благоприятную среду для действия ферментов желудочного сока, влияют на электропроводность клеточных мембран и т.д. Соединения хлора содержатся в плазме крови и желудочном соке.
Необходим для поддержания жизни и хлорид натрия. Солевой обмен связан с водным балансом организма. Повышенное содержание хлорида натрия в организме удерживает воду в тканях.
Йод также важен для многих живых существ, в т.ч. и для человека. Соединения йода необходимы для нормальной работы щитовидной железы. Йод содержится не только в щитовидной железе, но и в надпочечниках. Гормон щитовидной железы тироксин (соединение йода) определяет общий темп процессов жизнедеятельности. Пары йода ядовиты.
Недостаток всех вышеперечисленных элементов приводит к серьезным заболеваниям.
Биологическая роль брома и астата не установлена. В небольших количествах соединения брома оказывают успокаивающее действие на центральную нервную систему. Бром очень токсичен, соединения брома, содержание анионы брома малотоксичны. Астат токсичен в силу своей радиоактивности.
Растворимость галогенов
Молекулы галогенов неполярны и, как обычно для неполярных веществ, умеренно растворимы в воде (за исключением фтора, который энергично взаимодействует с водой), причем растворимость брома максимальна. Один объем воды растворяет при комнатной температуре около 2,5 объемов хлора.
Этот раствор называется хлорной водой (для брома и йода – бромная и йодная вода соответственно). При пропускании хлора в охлажденную до 0 °C воду из раствора выделяются зеленовато-желтые кристаллы клатратных соединений Cl2·8H2O и Cl2·6H2O. Это вещество плавится инконгруэнтно при 9,6 °C.
Значительно лучше неполярные галогены растворяются в неполярных органических растворителях (за исключением хлора и фтора, которые интенсивно реагируют практически со всеми органическими растворителями). CS2, C2H5OH, C2H5OC2H5, CHCl3, CCl4, C6H6, бензине – «подобное растворяется в подобном». Для растворения хлора можно использовать CCl4.
Йод также хорошо растворим в растворах иодидов металлов за счет образования комплексного иона I3-. Это свойство позволяет легко экстрагировать галогены из водных растворов.
Если, например, взболтать водный раствор йода с небольшим количеством CS2 (не смешивающегося с водой), то почти весь йод перейдет из воды в CS2, окрашивая его в фиолетовый цвет.
Особенностью галогенов является то, что растворение в воде процесс не только физический, но и химический:
H2O + Hal2 ↔ Hhal + HhalO, Hal = Cl, Br
В водном растворе галогены диспропорционируют – подробнее см. химические свойства галогенов.
Источник: https://himgdz.ru/galogeni/fizicheskie-svoistva-galogenov/
Подгруппа VII a. Галогены
 Галогены (от греч. halos — соль и genes — образующий) — элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
Галогены (от греч. halos — соль и genes — образующий) — элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
- Общая электронная конфигурация внешнего энергетического уровня — nS2nP5.
- С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства);
- Галогены — сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
| Символ элемента | F | Cl | Br | I | At |
| Порядковый номер | 9 | 17 | 35 | 53 | 85 |
| Строение внешнего электронного слоя | 2s22p5 | 3s23p5 | 4s24p5 | 5s25p5 | 6s26p5 |
| Энергия ионизации, эв | 17,42 | 12,97 | 11,84 | 10,45 | ~9,2 |
| Относительная электроотрицательность (ЭО) | 4,0 | 3,0 | 2,8 | 2,5 | ~2,2 |
| Радиус атома, нм | 0,064 | 0,099 | 0,114 | 0,133 | – |
| Степени окисления | -1 | -1, +1, +3, +5, +7 |
-1, +1, +3 +5, +7 |
-1, +1, +3, +5, +7 |
– |
- Молекулы галогенов состоят из двух атомов.
- С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
- Получение
- Фтор получают электролизом расплава гидрофторида калия KHF2 (разлагается лишь HF):
- 2HF → H2 + F2
- Анод: 2F— — 2ē → F2
- В промышленности хлор в основном получают электролизом водного раствора хлорида натрия:
- 2NaCl + 2Н2О → Н2↑ + 2NaОН + Сl2↑
- В лаборатории хлор получают действием различных окислителей на соляную кислоту:
- МnО2 + 4НСl → МnСl2 + Сl2↑ + 2Н2О
- 2KMnO4 + 16HCl →2MnCl2 + 5Cl2 + 2KCl + 8H2O
- K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
- Аналогично получают бром и иод, окисляя НВr, НI или их соли:
- 6КВr + К2Сr2О7 +7Н2SО4 → ЗВr2 + Сr2(SО4)3 + 4К2SО4 + 7Н2О.
- Химические свойства F2
- Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду.
- Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты:
- 2Аl + 3F2 → 2АlF3
- 2Fе + 3F2 → 2FеF3
- Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические:
- Н2 + F2 → 2НF (со взрывом)
- Si + 2F2 → SiF4(г)
- При нагревании фтор окисляет все другие галогены (их степень окисления +1):
- Cl2 + F2 → 2ClF
- При облучении фтор реагирует даже с инертными (благородными) газами:
- Хе + F2 → ХеF2
- Взаимодействие фтора со сложными веществами также протекает очень энергично:
- 3F2 + ЗН2О → F2О↑ + 4НF + Н2О2 (со взрывом)
- Химические свойства Сl2
- Свободный хлор реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов:
- 2Аl + ЗСl2 → 2АlСl3(кр)
- 2Fе + ЗСl2 → 2FeСl3(кр)
- Si + 2Сl2 → SiCl4(ж)
- Н2 + Сl2 → 2НСl(г)
- Реакция замещения и присоединения с углеводородами:
- СН3-СН3 + Сl2 → СН3-СН2Сl + НСl,
- СН2=СН2 + Сl2 → СН2Cl — СН2Сl.
- Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
- Сl2 + 2НВr → 2НСl + Вr2,
- Сl2 + 2НI → 2НСl + I2,
- Сl2 + 2КВr → 2КСl + Вr2
- Обратимо реагирует с водой:
- Сl2 + Н2О↔ НСl + НСlO (хлорная вода)
- С щелочами:
- Сl2 + 2NаОН → NаСl + NаСlO + Н2О (на холоде),
- ЗСl2 + 6КОН → 5КСl + КClO3 + ЗН2О (при нагревании).
- Химические свойства Br2
- По химической активности бром занимает промежуточное положение между хлором и иодом. Взаимодействует со многими простыми веществами:
- 2Аl + ЗВr2 → 2АlВr3(кр)
- Si +2Вr2 → SiBr4(ж)
- Н2 + Вr2 → 2НВr(г)
- Бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду»:
- Br2 + H2O = HBr + HBrO
- При растворении в растворах щелочей на холоду происходит образование бромида и гипобромита
- 2NaOH + Br2 =NaBr + NaBrO + H2O
- При повышенных температурах (около 100°С) — бромида и бромата:
- 6NaOH + 3Br2 = 5NaBr + NaBrO3 + 3H2O.
- При реакции брома с растворами иодидов выделяется свободный иод:
Br2+ 2KI = I2+ 2KBr.
С органическими веществами, имеющими двойную или тройную связь. Обесцвечивание бромной воды – качественная реакция на непредельное соединение:
C2H4 + Br2 = C2H4Br2.
Химические свойства I2
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании.
- Взаимодействие же йода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
- Н2 + I2 ↔2НI
- Йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды».
- Но йод способен растворяться в растворах иодидов с образованием комплексных анионов:
- I2 + I− → I−3.
- Образующийся раствор называется раствором Люголя.
- Сероводород H2S, тиосульфат натрия Na2S2O3 и другие восстановители восстанавливают его до I— :
- I2 + H2S = S + 2HI
- Хлор и другие сильные окислители в водных растворах переводят его в IO3— :
- 5Cl2 + I2 + 6H2O = 2HIO3 + 10НСl
- Адсорбируясь на крахмале, йод окрашивает его в темно-синий цвет- качественная реакция на йод.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к йоду. Каждый галоген в ряду F — I может вытеснять последующий из его соединений с водородом или металлами, т.е. каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов.

Источник: http://himege.ru/podgruppa-vii-a-galogeny/
2.3.1. Химические свойства водорода и галогенов
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов.
Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов.
Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:

С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
- Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
- Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
- При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
- В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген.
Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике.
Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ.
Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены.
К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
- При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
- Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
- Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
- Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5).
При этом происходит образование пентафторида фосфора:
- При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
- При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
- Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
- Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
- Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
- Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
- Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
- Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
- а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-vodoroda-i-galogenov
Химические свойства галогенов — урок. Химия, 8–9 класс
Галогены относятся к химически активным веществам. В реакциях с металлами и большинством неметаллов, а также со сложными веществами галогены проявляют сильные окислительные свойства. Наиболее активен в химических реакциях фтор. С увеличением молекулярной массы активность галогенов снижается.
Взаимодействие с металлами
- При взаимодействии галогенов с металлами образуются соли: фториды, хлориды, бромиды, иодиды.
- Фтор реагирует со всеми металлами (даже с золотом и платиной), с большинством — при обычных условиях:
- Ca+F2=CaF2,
- 2Au+3F2=t2AuF3.
- Остальные галогены реагируют с металлами при нагревании:
- 2Fe+3Cl2=t2FeCl3,
- Cu+Br2=tCuBr2,
- 2Al+3I2=t2AlI3.
Взаимодействие с водородом
- В реакциях галогенов с водородом образуются газообразные галогеноводороды.
- Фтор взаимодействует с водородом со взрывом с образованием фтороводорода:
- H2+F2=2HF.
- Смесь хлора с водородом взрывается только при поджигании или освещении. В результате реакции образуется хлороводород:
- H2+Cl2=t2HCl.
- Бром начинает реагировать с водородом только при нагревании, и реакция происходит без взрыва. Продукт реакции — бромоводород:
- H2+Br2=t2HBr.
- Реакция иода с водородом идёт медленно даже при нагревании. Иод с водородом образуют газ иодоводород:
- H2+I2=t2HI.
- На примере этих реакций прослеживается снижение химической активности веществ в ряду: фтор — хлор — бром — иод.
- Все галогеноводороды хорошо растворяются в воде. Их растворы представляют собой кислоты:
- HF — плавиковая, HCl — соляная, HBr — бромоводородная, HI — иодоводородная.
Сила кислот в этом ряду увеличивается. Самая слабая из них — плавиковая кислота, самая сильная — иодоводородная.
Вытеснение галогенов друг другом из солей
- В реакциях галогенов с галогенидами проявляется следующая закономерность: более активный галоген вытесняет менее активный из его солей. Так, хлор взаимодействует с водными растворами бромидов и иодидов, выступая в этих реакциях окислителем:
- 2KBr−1+Cl02=Br02+2KCl−1,
- 2NaI−1+Cl02=I02+2NaCl−1.
- Бром способен вытеснить иод из иодидов, а с хлоридами не реагирует:
- 2KI−1+Br02=I02+2KBr−1.
- У иода способность вытеснять другие галогены отсутствует, так как его окислительные свойства в ряду галогенов самые слабые.
- Реакции фтора с водными растворами солей невозможны по причине его взаимодействия с водой.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/galogeny-khlor-i-ego-soedineniia-161110/re-008d3808-92b9-4fa4-b4dd-6e76c74e5975
Галоген — химические и физические свойства газа
Элементы 17 группы таблицы Д.И. Менделеева – галогены. Классические неметаллы, в чистом виде в природе не встречающиеся. Галоген – это активный окислитель, он находится только в качестве соединений. За исключением отдельных неметаллов, с галогенами реагируют все обычные вещества.
Некоторые характеристики хлора
О галогенах
Из галогенов лишь йод способен обладать признаками свойств, характеризующих металлы. Другие вещества (бром, хлор, астат и фтор) лишены даже косвенных признаков металлов. Когда в 1811 году И.
Швейггер, немецкий химик, предложил так называть новое выделенное вещество – хлор, название не прижилось. С 1841 года галогенами стали называть всю группу «солеродов».
Так переводится с греческого языка слово галогены.
Можно лучше понять, что такое галоген, если охарактеризовать каждый из элементов, входящих в этот ряд:
- Фтор (F) – содержится в солях горных пород. Преимущественно им насыщены криолит, шпат плавиковый и минералы флюорита;
- Хлор (Cl) – популярный из галогенов, в мире имеется в хлориде натрия, являющегося главным сырьём для хлористых соединений;
- Бром (Br) – элемент, встречающийся в морских водах и солёных водоёмах в качестве соли калия и натрия в сочетании с сульфатами хлора;
- Йод (I) – встречается повсеместно, больше всего йода в морской капусте и водорослях;
- Астат (At) – искусственное вещество в природе не встречается, получают в результате оседания частиц при облучении висмута или тория.
К сведению. Хлорид натрия (NaCl) – один из источников хлора. В быту называется поваренной солью. Присутствует в водной жидкости моря, в естественном состоянии находится как серый минерал – галит.
Строение атомов и степени окисления
Основные химические источники электроэнергии
Электронная формула наружной орбиты атомов солеродов – ns2np5. При расположении по порядку:
- F — 2s22p5;
- Cl — 3s23p5;
- Br — 4s24p5;
- I — 5s25p5;
- At — 6s26p5.
Атомы галогенов успешно добавляют к 7 своим электронам, имеющимся на крайней оболочке, один чужой недостающий. Потому при взаимодействии обнаруживают степень (-1) окисления. В союзах, где присутствуют элементы, имеющие электроотрицательность выше, только фтор не меняет степени (-1).
Остальные изменяют её на положительную степень: Cl (+1), Br (+3), I (+5), At (+7).
Графическая картинка электронного строения атома бора Br
Распространённость элементов и получение простых веществ
Чем больше величина атомного радиуса, тем меньше наличие солеродов в теле планеты. Величина r – радиуса атома фтора, по сравнению с радиусом атома иода, говорит о том, что фтор более распространён, нежели йод. Астата в коре планеты всего лишь граммы.
Промышленность производит галоиды (устаревшее название) в больших объёмах. При этом по количеству изготовленной продукции лидирует хлор.
Простые вещества получают при помощи галогенидов, окисляя их. Для этого используется электролитическое окисление. Причём из-за того, что положительные потенциалы у фтора и хлора достаточно высокие, приходится применять сильные окислители.
Важно! Электролиз фтора осложнён невозможностью использования водных растворов. Его потенциал окисления выше, и он может вступать в реакцию с водой, поэтому используют плавиковую кислоту.
Электролиз NaCl с применением анодов из графита позволяет добывать хлор. Катоды при этом могут быть:
- железные;
- жидкие ртутные;
- стальные.
Уравнение, описывающее эту реакцию, имеет вид:
2Cl- —› Cl2 (г.) + 2е-.
Выполняя химическое окисление бромида-иона из морской воды, получают бром.
Так же добывают и йод, используя насыщенные им рассолы. Оба процесса проводят, применяя хлор в виде окислителя. Воздушным потоком, проходящим через раствор, удаляются I2 и Br2.
Производство галогенов, формулы окисления
Физические свойства галогенов
Это характеристики, описывающие цвет, запах, температуры изменения свойств, а также агрегатное пребывание в нормальных условиях.
Физические свойства простых двухатомных веществ
Внимание! Такие токсичные вещества, как галогены, образовывают взаимные соединения: BrCl, ICl, IBr и иные. Три состояния (твёрдое, жидкое и газообразное) присущи солеродам при комнатной температуре.
Химические свойства галогенов
Способность вступать в реакцию с разными веществами под воздействием сторонних факторов индивидуальна для каждого из рассматриваемых элементов.
Химические особенности солеродов
При вступлении галогенов в связь с медью (малоактивный металл) получаются галогениды с формулой:
CuHal2, где Hal2 – солероды Br, Cl, F.
Когда галогениды вступают в реакцию с галогенами, то тот солерод, который активнее, вытесняет малоактивный из его же раствора. Хлор, являясь окислителем, вступает во взаимодействие в смесях солей йода и брома. Бром не реагирует на хлориды, но может из иодидов выдавить йод.
При воздействии на органические соединения при хлорировании воды или йодировании соли происходит галогенирование. При этом атом галогена вводится в соединение. Галогенирование может осуществляться замещением, расщеплением или присоединением атома солерода к атомной структуре органических соединений.
Интересно. Йод, имея низкие окислительные способности, не выдавливает из солей галогены. С фтором реакции водных сульфитов вообще не получаются, он вступает в содействие с Н2О.
Особенности добычи и использования галогенов
Приём электролизного окисления с участием окислителей применяется при добывании галогенов, исходя из того, что в натуральных условиях они – анионы. Например, гидролиз смеси поваренной соли необходим для выработки хлора. В основном, сначала добываются галогениды, из них электрохимическим путём изымаются солероды.
Применение галогенов и их соединений
Использование солеродов находит широкое применение в жизни человека. Быт, медицина, химическая промышленность, военное производство – далеко не все области использования солеродов.
По каждому элементу можно рассмотреть следующие моменты:
- F – значимая часть состава фторополимеров, имеющих высокую химическую, коррозионную и термическую стойкости. Фторсодержащие хлорфторуглероды раньше использовались в хладагентах и в аэрозолях.
- Cl – в натуральном виде газ жёлто-зелёного цвета. Хлор употребляется для обеззараживания скважин, воды для питья и искусственных водоёмов. Наиболее частое применение хлора в быту – отбеливание вещей и очищение загрязнённых поверхностей сантехники. Соляная (муриевая) кислота также содержит хлор.
- Br – негорючее вещество, применяется для тушения огня в огнетушителях. Применим бром и в медицине, в качестве успокоительных препаратов и мегалитических средств. В военных целях входит в состав химии отравляющих веществ.
- I – применяется в виде антисептика, является необходимым элементом в организме человека для работы щитовидной железы.
- At – применения не находит ввиду своей сильной радиоактивности.
Спектр применения галогенов
Добавленный в баллон лампы накаливания газ галоген позволяет повысить температуру встраиваемой нити и качество отдачи света. Пары брома или йода, закачанные в колбу, послужили созданию галогенных ламп и светильников.
Важно! У таких источников света реже сгорают спирали, лампы имеют компактные размеры и могут питаться как переменным, так и постоянным напряжением.
Галогеновый свет используется в лампах автомобильных фар, причём конструкция позволяет выполнять установку, как галогенных ламп накаливания в фару, так и обычных. В соревнованиях светодиодного источника в фаре или галогенового пока лидирует последний.
Галогенные соединения и их роль в организме человека
В человеческом организме в разных процентных содержаниях присутствуют соединения солеродов. Превышение концентраций, как и их уменьшение, существенно влияет на состояние организма.
Биологическая миссия галогенов
Токсичность галогенов
Галогены в опасной концентрации и соединениях действуют на человека следующим образом:
- Хлор имеет 2 класс опасности. Концентрация в атмосфере от 1*10-4% уже вызывает раздражение слизистой, доза 0,01% приводит к острому отравлению и остановке дыхания. Это сильный канцероген, вызывающий туберкулёз и способствующий образованию злокачественных опухолей;
- Фтор в соединении фторида натрия – приводит к смерти, попадая внутрь через органы дыхания или пищеварения. Смертельная концентрация – 4-9 г. Первичные симптомы – слюнотечение, рвотные позывы. Вторичные признаки отравления – поражения нервной и сердечно-сосудистой систем.
- Бром вызывает спазмы и удушье при дыхании уже при концентрации 1*10-3 в объёме воздуха. Токсичная доза – 3 г., смертельная – от 34 г., при попадании внутрь человека.
- Йод, при случайном попадании в организм в количестве 3 г. и более, поражает почки и сердечно-сосудистую систему, блокирует рецепторы щитовидной железы.
Применение галогенов и галогенидов в промышленности и в быту приносит больше пользы, чем вреда. Знание допустимых значений концентрации и правил пользования продуктами, в которых применяются солероды, позволяет пользоваться только их положительными качествами.
Видео
Источник: https://amperof.ru/teoriya/galogen-ximicheskie-i-fizicheskie-svojstva-gaza.html




